PENDAHULUAN
Latar Belakang
Perkembangan biosensor kolesterol sangat penting di tengah-tengah berkembangnya penyakit kardiovaskular yang mengancam kesehatan utama manusia di seluruh dunia. Amperometrik kolesterol biosensor menggunakan kolesterol oksidase telah menjadi fokus dari riset biosensor [1].
Kolesterol LDL merupakan bahan yang tidak seharusnya beredar dalam sirkulasi darah melebihi kadar 160 mg/dl. Kolesterol masuk ke dalam tubuh sebagian besar masuk ke dalam tubuh melalui makanan. Kolesterol banyak ditemukan dalam daging, telur dan makanan berlemak. Jika mengkonsumsi makanan tersebut secara berlebihan maka kadar kolesterol dalam darah akan meningkat drastis. Akhir-akhir ini mulai banyak yang sadar akan pentingnya menjaga kadar kolesterol dalam darah. Hal ini sangat penting untuk menurunkan angka kematian akibat penyakit jantung dan pembuluh darah. Penyakit jantung sudah menjadi penyakit yang umum saat ini. Penyakit ini bisa menyerang siapa saja terutama bagi mereka yang telah berusia di atas 50 tahun. Pada usia ini jantung bekerja lebih berat akibat peningkatan tekanan pembuluh darah tepi. Peningkatan tekanan darah tepi paling sering disebabkan oleh penumpuikan plak kolesterol pada dinidng pembuluh darah [2].
Kadar kolesterol dalam tubuh dapat diketahui melalui tes pemeriksaan kadar kolesterol darah. Pemeriksaan ini biasanya dilakukan dalam laboratorium. Pemeriksaan akan menghasilkan data perkiraan kadar kolesterol yang beredar dalam sirkulasi darah. Hasil tes rutin yang dilakukan di laboratorium akan membutuhkan waktu yang lama untuk mengetahui hasilnya dan tentu biaya juga tidak sedikit. Selain itu pemeriksaaan tidak hanya memeriksa kadar kolesterol dalam darah tapi juga kadar protein dan kreatin.
Metode analisis telah
dikembangkan oleh manusia agar menjadi lebih fleksibel dan target analisis akurat untuk berbagai senyawa kimia dan biokimia. Karakteristik seperti spesivitas, sensitifitas dan biaya merupakan hal perlu dipertimbangkan dalam mengembangkan metode analisis yang turut mempengaruhi keberhasilan atau kegagalan dari teknologi pengukuran baru [1].
Berdasarkan latar belakang di atas maka dikembangkanlah biosensor kolesterol yang dapat khusus mengukur kadar kolesterol dalam darah secara langsung. Biosensor kolesterol ini diharapkan memiliki kemampuan deteksi kadar kolestrol dengan selektifitas yang tinggi, akurat, stabil dan murah. Oleh karena itu dikembangkanlah transduser biosensor kolesterol dengan imobilisasi enzim sehingga lebih selektif lagi dalam pendeteksian kadar kolesterol dalam darah.
Pada penelitian ini akan dilakukan perancangan desain elektroda, pembuatan elektroda dengan metode screen printing, imobilisasi enzim kolesterol oksidase dengan mediator 1,1’-Dimethylferrocene, karakterisasi elektroda dengan metode EIS (Electrochemical Impedance Spectroscopy) dan SEM (Scanning Electron Microscope) serta melakukan pengujian kinerja biosensor kolesterol yang dikembangkan dengan tes CV (CyclicVoltametry ).
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengembangkan biosensor berbasis enzim untuk deteksi kadar kolesterol dengan biaya yang murah. Tujuan khusus dari penelitian ini adalah menentukan konduktifitas, impedansi, sensitifitas, stabilitas dan akurabilitas dari biosensor kolesterol.
TINJAUAN PUSTAKA Biosensor
Biosensor menurut definisi
klasiknya merupakan suatu
perangkat/instrumen analitik yang menggunakan biomolekul (enzim, antibodi, jaringan, sel dan mikroba) untuk melakukan pengenalan/deteksi/rekognisi (recognition) akan suatu zat (bio) kimia tertentu. Perubahan sifat fisika-kimia pada biomolekul yang mempresentasikan informasi ditransduksikan dengan transduser fisis menjadi besaran listrik [3].
Biosensor terdiri atas dua komponen utama yaitu bioreseptor dan transduser. Bioreseptor adalah molekul yang akan mengenali analit target, dapat berupa enzim khusus, atau protein terikat seperti antibodi. Bioreseptor diimobilisasi di atas permukaan transduser. Interaksi spesifik antara analit target dan tempat pengenalan analit pada bioreseptor akan menghasilkan
perubahan kimia-fisika yang kemudian akan dideteksi dan diukur oleh transduser [4].
Transduser yang banyak digunakan dalam suatu biosensor adalah transduser elektrokimia, optoelektronik, kristal piezoelektronik, field effect transistor, dan termistor. Proses yang terjadi dalam transduser dapat berupa kalorimetrik biosensor, potensiometrik biosensor, amperometrik biosensor, optikal biosensor, maupun piezo-elektrik biosensor. Sinyal yang keluar dari transduser kemudian diproses dalam suatu sistem elektronik misalnya recorder atau komputer [5].
Skema operasi dari biosensor kimia diilustrasikan dalam Gambar 1. Dalam bentuk skema umumnya biosensor terdiri dari selector, transducer, dan detector yang terhubung dalam jalur yang tepat. Selector memberi selektifitas pada sensor dan umumnya diikuti oleh filter pada sisi rekognisi. Jika sisi rekognisi ini dari biomolekul (seperti enzim, reseptor, antibodi atau DNA) maka alat ini disebut biosensor. Sisi rekognisi penting untuk menghasilkan sinyal kimia (perubahan dalam ikatan kimia) pada ikatannya dengan analit dan fungsi dari transduser adalah mengkonversi proses tersebut ke dalam pengukuran sinyal fisik (elektrik,termal, mekanik, optik dan magnetik) dan melewatkan sinyal ke detektor yang akan menghasilkan output elektrik [6].
Generasi pertama biosensor dikemukakan oleh Clark dan Lyons (1962) yang diimplementasikan oleh Updike dan Hicks. Generasi ini menggunakan elektroda oksigen dan mengukur penurunan arus yang disebabkan konsumsi oksigen akibat reaksi enzimatik. Generasi kedua mengukur arus yang dihasilkan dari reaksi elektro enzimatik pada sebuah molekul redoks yang berperan sebagai mediator transfer elektron antara enzim dan elektroda. Enzim sebagai reseptor terikat secara kovalen dengan permukaan transduser. Prinsip ini telah dikomersilkan dalam pengukuran kadar gula darah menggunakan glukosa meter. Generasi ketiga biosensor berdasarkan transfer elektron secara langsung dari sebuah enzim pada permukaan elektroda. Enzim terikat pada sebuah peralatan elektronik yang akan mentransduksikan dan memperkuat sinyal yang dihasilkan [7,8].
Gambar 1 Komponen utama biosensor [6]
Metode Elektrokimia
Metode elektrokimia dapat mendeteksi pertukaran elektron yang terjadi pada reaksi redoks enzim. Sehingga didapatkan hubungan dengan konsentrasi zat yang terkait dalam reaksi redoks tersebut [3].
Reaksi (bio) elektrokimia dapat dianalisis dari pengukuran arus (amperometric), pengukuran potensial (potentiometric), dan pengukuran konduktifitas bahan (conductomeric) di antara elektroda. Selain itu teknik
impedimetric juga dapat digunakan dalam
analisis reaksi elektrokimia. Impedimetric pengukurannya berdasakan impedansi (resistansi dan reaktansi) dan efek luas permukaan, yang menggunakan teknologi transistor untuk mengukur arus sebagai hasil pengaruh potensiometrik pada elektroda [9].
Metode elektrokimia yang biasa dipakai yaitu : Voltammetry (dengan mengukur tegangan terhadap arus yang tetap), Amperometry (tegangan tetap, arus terukur), Cyclic Voltamemetry (arus yang diukur terhadap suatu tegangan yang berubah dengan fungsi segitiga terhadap waktu [3].
Reaksi elektrokimia merupakan suatu reaksi kimia yang diakibatkan oleh adanya perbedaan potensial atau ketika suatu beda potensial dihasilkan akibat adanya reakasi kimia. Proses elektrokimia pada dasarnya adalah suatu reaksi redoks dimana energi dihasilkan oleh reaksi yang spontan untuk menghasilkan arus listrik atau ketika adanya arus listrik dapat menstimulasi
terjadinya reaksi kimia. Dalam reaksi redoks terjadi suatu perubahan bilangan oksidasi dari atom atau ion akibat terjadinya transfer elektron [10].
Teknik Voltametri siklik telah digunakan secara efektif untuk menentukan kadar kolesterol dalam sistem. Biosensor amperometrik mengukur perubahan arus pada elektroda indikator melalui oksidasi elektrokimia atau reduksi dari produk dalam reaksi biokima. Dalam amperometrik biosensor potensial elektroda dijaga konstan ketika arus diukur [11].
Sensor elektrokimia terdiri dari elektroda pembanding (reference electrode), elektroda pendukung (counter electrode or
auxillary electrode) dan elektroda kerja
(working electrode), yang juga dikenal sebagai elektroda redoks. Elektroda pembanding, umumnya dibentuk dari Ag/AgCl, jaraknya dijaga dari tempat reaksi bertujuan untuk menjaga potensial awal dan potensial stabil. Elektroda pembanding memiliki nilai potensial yang telah diketahui konstan serta tidak sensitif terhadap komposisi larutan yang dianalisis. Elektroda kerja berperan sebagai elemen transduksi dalam reaksi biokimia [9]. Elektroda kerja merupakan tempat terjadinya reaksi yang akan merespon analit target. Elektroda pendukung membentuk hubungan dengan larutan elektrolit sehingga arus mengalir ke elektroda kerja. Elektroda pendukung diperlukan untuk memperkecil kesalahan dari tahanan sel dalam mengontrol potensial elektroda kerja [1].
Konfigurasi tiga elektroda digunakan untuk meminimalkan kesalahan yang diakibatkan oleh adanya lapisan produk reaksi yang ada pada elektroda. Lapisan ini akan mengakibatkan adanya hambatan tambahan pada sel elektrokimia. Elektroda pembanding dan elektroda kerja dibuat sedekat mungkin agar diperoleh hasil pengukuran dengan hambatan sel yang minimal. Jarak elektroda pemdanding dan kerja yang terlalu dekat dapat mengakibatkan adanya ganguan karena spesi produk yang menempel pada elektroda. Elektroda pendukung dapat mengatasi permasalahan jarak elektroda pembanding dan kerja. Elektroda pendukung akan memberikan jalur alternatif aliran elektron dalam sel elektrokimia, dengan demikian pada elektroda pembanding tidak akan terbentukl lapisan produk reaksi. Hal ini akan membuat pengukuran dapat dilakukan dengan hambatan sel yang minimal [10].
Gambar 2 Konfigurasi elektroda dalam sel elektrokimia [12] Metode Voltametri
Metode analisis voltametri didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik yang diterapkan pada sel elektrolisis. Sel elektrolisis terdiri dari elektroda kerja (working electrode), elektroda pembanding (reference electrode), dan elektroda pendukung (auxillary electrode) [13] .
Mekanisme transfer elektron melalui ion-ion dalam elektrolit menuju permukaan elektroda dapat melalui tiga cara yaitu cara konveksi, migrasi, dan difusi. Pergerakan akibat konveksi dapat disebabkan oleh pengadukan larutan secara mekanik atau akibat perbedaan panas pada setipa bagian larutan. Pergerakan akibat migrasi disebabkan oleh tarik menarik elektrostatik anali-analit dalam larutan atau analit-elektroda. Perpindahan ion akibat difusi disebabkan oleh adanya perbedaan konsentrasi (gradien konsentrasi) pada setiap bagian larutan. Pada voltametri diusahakan hanya pengaruh difusi yang terlibat, sehingga dalam larutan ditambah elektrolit pendukung (supporting electrolyte) untuk menghilangkan pengaruh migrasi ion dan larutan uji tidak diaduk untuk menghilangkan pengaruk konveksi [13]. I
V
Gambar 3 Kuva voltametri penyapuan- linear [14]
Jenis keluaran dari metode voltametri ini ada dua yaitu voltametri penyapuan linear dan voltametri siklus. Gambar 3 menunjukkan keluaran dari voltametri penyapuan linear, pada awalnya potensial rendah dan arus katoda disebabkan oleh migrsi ion dalam larutan. Akan tetapi saat potensial mendekati potensial reduksi dari zat terlarut tereduksikan, arus katodanya bertambah besar. Segera setelah potensial melebihi potensi reduksi, arus berkurang disebabkan polarisasi konsentrasi elektroda karena sekarang terdapatkekuranagn zat terlarut tereduksikan di dekat elektroda ini [15].
Aplikasi metode voltametri tidak sebatas pada penggunaan untuk kepentingan analitik tetapi juga nonanalitik, seperti penelitian mengenai proses dan mekanisme oksidasi-reduksi pada berbagai media, proses adsorpsi, dan mekanisme transfer elektron pada permukaan elektroda yang dimodifikasi. Metode voltametri hanya melibatkan analit-analit pada daerah permukaan elektroda kerja. Fenomena pada permukaan elektroda yang berpengaruh terhadap pengukuran secara voltametri meliputi reaksi oksidasi/reduksi analit, arus yang timbul, dan lapisan difusi yang terbentuk [1].
Voltametri Siklik
Voltametri siklik termasuk dalam metode pengukuran potensiodinamik elektrokimia. Eksperimen voltametri siklik memiliki proses yang lebih panjang dari Voltametri penyapuan-linear. Voltametri siklik dikarakterisasi dari peningkatan potensial elektroda kerja dari potensial awal ke potensial berikutnya dan kembali lagi. Hal ini menunjukkan bahwa potensial awal dan potensial penyapuan adalah parameter yang dapat disesuaikan begitu juga bahan-bahan elektrolit terutama konsentrasi dan temperaturnya dapat juga mempengaruhi [16].
Voltametri siklik mengukur nilai listrik sebagai fungsi aluran potensial dengan rentang potensial awal sama dengan potensial akhir. Perpindahan elektron pada bagian antar muka elektroda-elektrolit terjadi pada saat potensial diubah secara linear dengan laju tertentu sampai suatu potensial tertentu yang memungkinkan senyawa elektroaktif dalam sel mengalami reaksi redoks. Perpindahan elektron ini menyebabkan kenaikan arus mencapai suatu nilai tertentu yang kemudian akan turun
kembali. Pada turun kembali, potensial dialurkan ke arah sebaliknya sehingga senyawa yang terbentuk mengalami reaksi reduksi bila sebelumnya mengalami oksidasi atau sebaliknya [17].
Gambar 4 Kurva arus sebagai fungsi potensial pada metode voltametri
siklik [18]
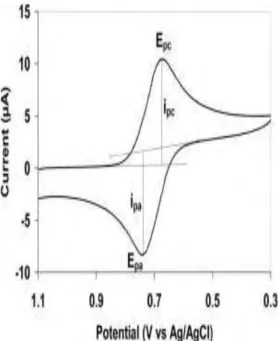
Voltamogram siklus yang khas terlihat dalam Gambar 4. Bentuk kurvanya pada awalnya menyerupai kurva eksperimen penyapuan linear, tetapi setelah potensial mulai turun, terdapat perubahan arus yang cepat disebabkan konsentrasi spesies teroksidasikan tinggi di dekat elektroda. Ketika potensialnya mendekati potensial yang diperlukan untuk mengoksidasikan spesies tereduksi, terdapat arus anoda yang besar sampai oksidasinya sempurna dan arus kembali nol. Bentuk keseluruhan kurva itu memberikan perincian kinetika proses elektroda [15].
Sistem respons ini disebut juga polarisasi kurva atau bergantung dari aliran arus yang melewati potensial elektroda. Kurva ini juga menentukan spektrum elektrokimia dari sistem. Sebuah arus puncak pada kurva polarisasi berhubungan dengan setiap reaksi pada elektroda. Jika potensial ekuilibrium dari reaksi ini saling berdekatan satu sama lain maka puncak yang berhubungan dengan reaksi akan overlap. Setiap puncak dikarakterisasi oleh beberapa data awal (Gambar 3), yaitu: potensial (Ep)
dan arus (Ip) puncak, potensial setengah gelombang (E1/2 ketika I=Id/2) dan potensial saat setengah puncak (Ep/2 ketika I=Ip/2). Cara membaca densitas arus dari puncak ditunjukkan dalam Gambar 4. Asumsikan reaksi reversibel elektroda dari konsentrasi spesi elektroaktif di setiap titik kurva polarisasi kurva harus berhubungan dengan Persamaan Nernst [16] : t r o C C nF RT E E , , , ln (1)
Potensial elektroda yang bergantung waktu dalam kasus metoda potensiodinamik dinyatakan dalam persamaan :
E v
E i (2) Dengan mensubsitusikan E dalam Persamaan 1 dengan hubungan Persamaan 2 dan menyusun hubungan perbandingan konsentrasi permukaan dari oksidasi dan reduksi spesi bergantung waktu dan potensial penyapuan dinyatakan dalam Persamaan 3 : exp .( ,) , ,
E v E RT nF C C i r o (3) Persamaan – persamaan di atas merupakan dasar untuk menurunkan deskripsi matematis dari bentuk umum kurva polarisasi potensiodinamik.Nilai arus puncak maksimum dapat dihitung dari Persamaan 4 yang diturunkan dari deskripsi persamaan di atas :
2 1 2 1 2 1 4463 . 0 o o p D RT nF nFc i
(4) Nilai dari potensial setengah puncak dan perbedaan antara potensial puncak dan setengah puncak dinyakan dalam Persamaan 5 dan Persamaan 6 : nF RT E Ep/2,c 1/2 1,09 (5) mV n nF RT E E p c c p 6 , 56 . 2 , 2 , 2 / , (6)Dapat disimpulkan bahwa potensial puncak dan karakteristik potensial lainnya adalah potensial rata-rata penyapuan yang berdiri sendiri dan densitas arus puncak sebanding dengan v1/2, ketika reaksi reversibel.
Persamaan di atas dapat digunakan untuk menentukan jumlah perubahan elektron dalam reaksi di elektroda atau untuk menentukan koefisien difusi dari spesi elektroaktif [16].
Keterangan :
Do = koefisien difusi oksidasi (cm2..s-1) υ = sweep rate (V/s)
Ep,c = potensial puncak katodik (V) T = 298 K
Ep/2 = potensial puncak setengah (V) Ip,c = arus puncak katodik (A) Ei = potensial inisial (V)
F = konstanta faraday 9,6485×104 C.mol-1
R = konstanta gas (8,31451 JK-1mol-1) Co,τ = konsentrasi oksidasi (mol.cm-3) Cr,τ = konsentrasi reduksi (mol.cm-3) Eө, = potensial formal
Ferosen
Mediator adalah suatu molekul yang dapat menggerakkan bolak-balik elektron antara pusat redoks enzim dengan elektrode. Mediator digunakan sebagai perantara elektron antara elemen pengenal dengan elektroda. Cara ini dapat efektif menghilangkan senyawa penggangu tergantung sampel yang digunakan, yaitu sampel tersebut dapat dihasilkan pada potensial dimana reaksi oksidasi/reduksi senyawa pengganggu tidak terjadi. Mediator yang dapat digunakan pada biosensor yaitu ferosen, ferosianida, kuinon, kompleks rutheum [20]. Mediator yang digunakan harus dapat mentransfer elektron lebih cepat. Syarat-syarat yang harus dipenuhi oleh mediator yakni memilki kelarutan yang sesuai dalam larutan encer atau pelarut organik, bersifat reversibel, stabil dalam bentuk tereduksi dan teroksidasinya, memilki potensial redoks yang lebih rendah dari potensial oksidasi zat-zat pengganggu atau analit, tidak adanya reaksi langsung dengan substrat enzim, serta kurang sensitif terhadap pH dan efek kekuatan ion pada media [1].
Ferosen adalah kompleks logam organik dengan rumus molekul Fe(C5H5)2 [21]. Ferosen merupakan senyawa besi berwarna oranye yang sangat stabil. Ferosen menunjukkan kestabilan termal yang tinggi walaupun ada anggapan umum ikatan logam transisi karbon akan sangat tidak stabil. Namun dengan jelas ditunjukkan bahwa senyawa ini memiliki struktur berlapis
dengan lima atom karbon gugus siklopentadienil terikat secara simultan pada atom besi [22]. Titik leleh ferosen berkisar 172-1740C, titik didih 2490C, memiliki kelarutan dalam pelarut organik seperti benzena, dietileter, metanol, etil alkohol, dan kerosin. Ferosin juga bersifat stabil, tidak beracun, tidak bereaksi dengan asam, basa dan ultra violet [1].
Ferosen mengoksidasi sebuah elektron pada potensial rendah, sekitar 0.5 V Vs saturated calomel electrode (SCE). Oksidasi ferosen menghasilkan sebuah kation stabil yang disebut ferrocenium. Ferrocenium kadang-kadang digunakan sebagai bahan pengoksidasi karena produk reaksi ferosen segera terpisah dari produk ion [23].
Gambar 5 Struktur molekul ferosen [21] Kolesterol
Kolesterol merupakan sterol utama dalam tubuh manusia. Kolesterol merupakan komponen struktural membran sel dan lipoprotein plasma, dan juga merupakan bahan awal pembentukan asam empedu serta hormon steroid. Sterol dan derivatnya sukar larut dalam larutan berair tetapi larut dalam pelarut organik terutama alkohol. Sehingga senyawa ini dimasukkan dalam golongan lipid [24].
Gambar 6 Struktur kolesterol [25]
Kolesterol mempunyai 2 gugus metil yang terikat pada C-13 dan C-10 dengan 5 ikatan rangkap. Rantai cabang hidrokarbon terikat pada atom C-17, sedangkan gugus hidroksil pada C-3. Kolesterol disimpan di dalam sel sebagai
ester asam lemak yang dihasilkan dari reaksi esterifikasi oleh enzim asil KoA : kolesterol asiltransferase (ACAT) di sitoplasma [ 26]. Kolesterol dibuat di dalam tubuh dan juga diperoleh melalui makanan. Hati membentuk sebagian besar kolesterol di dalam tubuh yang membantu mengangkut lemak ke berbagai bagian tubuh yang membutuhkan lemak untuk energi dan perbaikan jaringan tubuh yang rusak [27].
Lipoprotein merupakan senyawa pembawa yang berfungsi sebagai penggerak dalam pembuluh darah [24]. Senyawa ini dibentuk dari ikatan lipid dengan protein. Lipoprotein di dalam plasma darah mengangkut molekul-molekul lipid seperti triasil gliserol, fosfolipid, dan kolesterol melalui aliran darah dari satu organ ke organ lainnya. Lipoprotein juga mengandung anti oksidan yang larut dalam lemak. Pembagian lipoprotein dilakukan berdasarkan densitasnya yaitu : kilomikron, lipoprotein densitas sangat renda (Very Low Density
Lipoprotein, VLDL, 0.95-1.006 g/cm3),
lipoprotein densitas rendah (Low Density
Lipoprotein, LDL, 1.006-1.063 g/cm3 ), dan lipoperotein densitas tinggi (High Density
Lipoprotein, HDL, 1.063-1.210 g/
cm3 ) [26].
Gambar 7 Molekul lipoprotein [25]
Partikel LDL mengangkut kolesterol dari hati ke seluruh bagian tubuh. Jika kolesterol yang tersedia lebih dari yang dibutuhkan, LDL akan beredar dalam aliran darah dan akhirnya tertimbun pada bagian dalam diniding pembuluh darah. LDL disebut ”kolesterol jahat” karena dapat menyebabkan penyumbatan dan berkurangnya pasokan darah [27]. Partikel HDL memindahkan ester kolesteril ke hati sebagai organ yang dapat mengeluarkan
kelebuhan kolesterol atau sebagian besar diubah menjadi asam empedu. [26]. HDL juga dikenal sebagi ”kolesterol baik” karena berjalan mengikuti aliran darah dari area-area tepi (perifer) tubuh sambil membawa kolesterol ke hati untuk dihancurkan [ 27].
Kadar LDL yang tinggi (>160 mg/dl) akan meningkatkan resiko penyakit hati, arteri koroner dan stroke. Sebaliknya, kadar HDL yang dibutuhkan untuk mengurangi resikio penyakit hati, arteri koroner dan stroke lebih dari 40 mg/dl (pria) dan 50 mg/dl (wanita). Kadar kolesterol dalam darah adalah kurang dari 200 mg/dl (resiko rendah), 200-239mg/dl (normal, dan lebih dari 240 mg/dl(resiko tinggi) [27,28]. Enzim
Enzim merupakan suatu protein yang dapat mengkatalisis suatu reaksi kimia dalam makhluk hidup. Protein ini memiliki ukuran yang berada pada kisaran 62 residu asam amino hingga lebih dari 2500 residu asam amino. Sama seperti protein, enzim tersusun dari rantai lurus asam amino yang kemudian mengalami proses pelipatan membentuk suatu struktur tiga dimensi. Setiap urutan asam amino yang berbeda akan menghasilkan struktur unik dan akan memiliki sifat yang berbeda pula [29].
Beberapa enzim membutuhkan kofaktor dan koenzim untuk sebagaimana mestinya. Kofaktor dapat berupa logam anorganik sedangkan koenzim berupa senyawa organik seperti vitamin. Semua enzim adalah protein kecuali sebagian kecil dari molekul RNA katalitik. Enzim akan kehilangan aktivitasnya akibat panas, asam atau basa (perubahan pH), pelarut organik, atau apa saja yang bisa menyebabkan denaturasi protein. Enzim mempunyai sifat khas yaitu bekerja pada substrat dan reaksi tertentu.. Enzim sebagai katalis dapat menurunkan energi aktivasi suatu reaksi. Akibatnya hanya dibutuhkan energi yang kecil untuk mengubah reaktan menjadi produk. Reaksi yang dikatalis oleh enzim lebih cepat dibanding dengan reaksi tanpa katalis [26].
Pengaruh suhu terhadap enzim telah diamati karena struktur protein menentukan aktifitas enzim maka jika struktur ini terganggu aktifitas akan berubah. Proses denaturasi protein berlaku juga untuk protein-protein enzim. Enzim sering memperlihatkan kerapuhan akibat suhu, jika dipanaskan sehingga kurang lebih di atas 500C kebanyakan tetapi tidak semua enzim
akan terdenaturasi. Denaturasi akibat suhu tinggi biasanya ireversibel karena gaya-gaya ikatan lemah yang penting rusak akibat meningkatnya getaran termal komponen atom-atomnya. Pada kondisi yang tidak menyebabkan denaturasi kebanyakan enzim menunjukkan adanya suhu optimum [30].
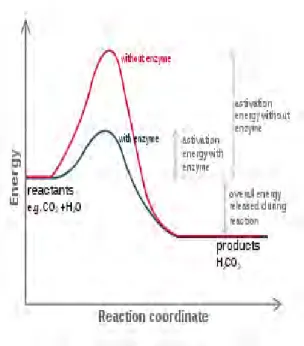
Suatu reaksi kimia dapat berlangsung karena molekul-molekul reaktan A pada suatu waktu tertentu mengalami keadaan aktif, yaitu apabila energi molekul tersebut dalam keadaan energi pengaktifan. Dalam keadaan demikian ikatan kimia dalam molekul dapat pecah sehingga memungkinkan terbentuknya produk P. Keadaan transisi terjadi ketika molekul A ada dalam keadaan aktif dan energi pengaktifan diartikan sebagai jumlah energi yang dibutuhkan oleh satu mol zat pada temperatur tertentu untuk membawa semua molekul ke-keadaan aktifnya [31].
Gambar 8 Kurva energi aktifasi tanpa katalis Enzim dan terkatalisis
Enzim [ 32]
Kinetika enzim merupakan gambaran kuantitatif dari aktifitas enzim. Kinetika ini mengukur rata-rata reaksi dan afinitas terhadap substrat dan inhibitor. Kinetika dapat menggambarkan mekanisme reaksi enzim. Leonor Michaelis dan Mud Menten menyatakan bahwa ketika substrat mengikat sisi aktif dari suatu enzim kemudian membentuk kompleks enzim substrat selama fase transisi substrat diubah menjadi produk [26].
Tahap katalisis
E+S ES ES*→EP→E+P
Ikatan substrat
Gambar 9 Mekanisme reaksi enzim E mewakili enzim bebas, S substrat, ES kompleks antara enzim dan substrat, ES* keadaan aktif atau transisi dari kompleks tersebut, EP kompleks antara enzim dan produk, dan P produk bebas. Dalam formulasi yang tidak begitu rinci ES* dihilangkan guna penyederhanaan. Umumnya substrat lebih banyak terdapat dari pada enzim sehingga hanya sebagian dari S yang terikutkan dalam ES pada suatu waktu tertentu. Bagian S yang membentuk ES mempunyai kandungan energi yang lebih tinggi dari pada S bebas, karena pengaruh penstabilan ES maka kondisi yang secara statistik tidak mungkin ini tetap berlangsung sepanjang waktu yang diperlukan untuk katalisis. Ketika ES diubah menjadi EP terdapat penurunan stabilitas sehingga EP berdisosiasi menghasilkan produk bebas plus enzim. Siklus ini dapat berulang ratusan atau ribuan kali tiap menit [30].
Gambar 10 Kurva hubungan antara laju reaksi, konsentrasi enzim dan konsentrasi substrat [33]
Gambar11 Enzim dalam keadaan jenuh [34]
Dengan meningkatnya konsentrasi substrat, aktifitas enzim akan bertambah karena kemungkinan terbentuknya kompleks enzim-substrat menjadi semakin besar. Kenaikan ini akan terus terjadi seiring dengan bertambahnya konsentrasi substrat sampai pada suatu keadaan jenuh dimana jumlah enzim menjadi faktor pembatas. Pada keadaan ini penambahan konsentrasi substrat tidak memiliki pengaruh lagi terhadap laju reaksi. Proses ini diilustrasikan dalam Gambar 10 dan Gambar 11 [10 ].
Jika laju reaksi awal didefenisikan sebagai laju teramati untuk sejumlah enzim bila konsentrasi produk yang terbentuk mendekati nol, digambarkan sebagai fungsi konsenstrasi substrat maka hasilnya akan nampak seperti pada Gambar 10. Kurva yang menghubungkan titik–titik yang diamati akan berupa hiperbola dan akan mendekati nilai maksimum secara asimtotis seperti diperlihatkan oleh Vmaks. Ini merupakan kecepatan awal maksimum yang dapat dicapai tanpa penambahan jumlah enzim [ 30].
Salah satu enzim yang diaplikasikan dalam berbagai bidang seperti kedokteran dan industri adalah enzim kolesterol oksidase ( 3β-hidroksisteroid oksidase). Kolesterol oksidase termasuk enzim oksido reduktase, yakni enzim yang berperan dalam reaksi redoks. Beberapa mikroba yang mampu menghasilkan enzim ini adalah Nokardia sp., Streptomyces
hygroscopicus., dan Brevibacterium
sterolicum [1].
Imobilisasi Enzim
Imobilisasi biomolekul dilakukan agar dapat dipakai berulang kali untuk proses sensing dan tentu saja agar reaksi yang terjadi pada biomolekul memberi pengaruh langsung secara fisik pada transduser [3].
Proses imobilisasi enzim biasanya mengalami reduksi dalam aktifitas reaksinya. Imobilisasi enzim memilki beberapa keuntungan pada enzim terlarut yaitu jumlah total enzim yang dibutuhkan lebih sedikit dan imobilisasi enzim dapat digunakan lagi, proses dapat dioperasikan secara terus menerus dan dapat dikontrol, produk mudah dipisahkan, kegagalan dalam reaksi materi diperkecil, dan dalam beberapa bahan, aktifitas, dan stabilitas enzim dapat secara mudah diubah dengan imobilisasi. Setiap metode imobilisasi memiliki keterbatasan dan penting untuk
menemukan prosedur yang tepat bagi partikel enzim dan aplikasi yang mudah, tidak terlalu mahal dan mempermudah imobilisasi enzim dengan aktifitas dan stabilitas yang baik [19].
Dalam imobilisasi enzim pada permukaan penting untuk memilih metode perlakuan imobilisasi yang akan mencegah kehilangan aktifitas enzim dengan tidak mengubah sifat kimia atau kelompok reaktif dalam ikatan enzim [35].
Ada beberapa metode untuk imobilisasi enzim yaitu carrier binding, metode ini terdiri dari adsorpsi fisik, ikatan ionik, dan ikatan kovalen. Metode adsorpsi fisik memanfaatkan gaya van der waals, ikatan ionik, dan gaya hidropobik antar materi [3,35]. Metode ini berdasarkan adsorpsi fisik protein pada permukaan matriks dan prosesnya sederhana. Keuntungan utama yang berhubungan dengan adsorpsi langsung pada permukaan benda adalah prosesnya sederhana dan dapat digunakan pada kondisi tertentu [11]. Metode adsorpsi membutuhkan preparasi yang minimal dan tergantung substrat. Kelemahan metode ini adalah ketergantungan terhadap suhu, pH pelarut, kekuatan ionik, serta memilki stabilitas yang cepat [3].
Metode ikatan ionik berdasarkan ikatan ionik dari enzim protein dengan pembawa zat terlarut sehingga terjadi pertukaran ion. Keuntungan dari metode ini adalah ikatan antara enzim dengan carrier mudah terlepas. Oleh karena itu metode ikatan ionik menyebabkan sedikit perubahan dalam bentuk dan sisi aktif dari enzim. Kebocoran enzim dari carrier dapat terjadi di larutan substarat yang kekuatan ioniknya tinggi atau berdasar variasi pH. Hal ini menyebabkan gaya ikatan antara enzim dan
carrier lebih lemah dari ikatan kovalen [35].
Metode ikatan kovalen digunakan untuk mendapatkan imobilisasi yang bertahan lama. Misalnya adalah pada reversibilitas. Reversibilitas dapat diperoleh dengan memanfaatkan teknik tertentu seperti
Metal-cheating [3]. Metode ini berdasarkan
ikatan enzim dan zat terlarut yaitu ikatan kovalen. Kondisi untuk imobilisasi dengan ikatan kovalen lebih rumit dari pada kasus adsorpsi fisik dan ikatan ionik. Oleh karena itu ikatan kovalen dapat merubah struktur dan pusat aktif enzim, kehilangan aktifitas dan perubahan dari substrat. Metode kovalen relatif lebih mahal. Gaya ikatan antara enzim dan carrier sangat kuat sehingga kebocoran enzim tidak terjadi [35].
Metode berikutnya adalah cross
linking. Metode ini berdasarkan ikatan
kovalen antara molekul enzim, dengan menggunakan reagen multifungsional sehingga mempermudah terbentuknya tiga dimensi kumpulan cross link. Metode cross
link digunakan untuk menjaga stabilitas
adsorbsi enzim dan juga mencegah kebocoran. Metode ini dapat menyebabkan perubahan signifikan sisi aktif enzim yang membuat kehilangan aktifitas enzim selama proses preparasi. Metode entrapping
berdasarkan lokalisasi enzim dalam kisi-kisi matriks polimer atau membran. Metode ini berbeda dari ikatan kovalen dan cross
lingking yaitu enzim tidak terikat ke gel
matriks atau membran [35]. Matrix-Entrapment yaitu proses imobilisasi suatu
biomolekul dibarengi dengan elektropolimerisasi sehingga biomolekul akan dikungkung oleh elektropolimer yang terbentuk. Membran-entrapment yaitu dengan menyelubungi biomolekul dengan membran yang misalnya hanya bisa melewatkan analit tapi tidak melewatkan biomolekul [3].
Resistansi dan Konduktivitas Listrik Resistansi suatu material bergantung pada panjang, luas penampang lintang, tipe material dan temperatur. Pada material ohmik resistansinya tidak bergantung pada arus dan. Hubungan empiris ini disebut dengan hukum Ohm dinyatakan oleh Persamaan 7 [36] :
tan
;
R
kons
IR
V
(7) Untuk material nonohmik, arus tidak sebanding dengan tegangan. Resistansinya bergantung pada arus, didefinisikan secara matematis oleh Persamaan :I V R
(8) Kurva hubungan arus dan tegangan pada material Ohmik adalah linear sedangkan material nonohmik kurva hubungannya tidak linear.
Resistansi suatu kawat penghantar sebanding dengan panjang kawat dan berbanding terbalik dengan luas penampang lintang [36]:
A L R
(9) Di mana disebut resistivitas material penghantar. Satuan resistivitas adalah ohm meter (Ωm). Kebalikan dari resistivitas disebut konduktivitas σ :
1
(10) Konduktivitas listrik adalah kemampuan suatu bahan untuk menghantarkan arus listrik . Persamaan 12 merupakan hubungan konduktivitas listrik dan resistansi :
A L R (11) RA L (12) EIS (Electrochemical Impedance Spectroscopy )
Publikasi pertama mengenai
Electrochemical Impedance Spectroscopy
terjadi di tahun 1975 melalui aplikasi secara sinusoidal dengan variasi potensial U, salah satunya mengukur hasil respon arus I. Melalui variasi eksitasi frekuensi f dari aplikasi potensial di atas range frekuensi dapat menghitung kompleks impedansi, jumlah dari riil dan imaginer komponen impedansi dari sistem fungsi frekuensi (contohnya frekuensi angular ω). Oleh karena itu, EIS mengkombinasikan analisis dari riil dan imaginer komponen impedansi yaitu resiatansi dan reaktansi elektrik seperti dalam Persamaan 13 [9] : ) ( ) ( ) ( ) ( ) (
Z jZi j I j U j Z r (3)f
2
(14)EIS memilki kemampuan untuk mempelajari bahan intrinsik material atau proses spesifik yang dapat mempengaruhi konduktifitas/resistifitas atau kapasitas dari sistem elektrokimia. EIS merupakan alat yang sangat berguna dalam pengembangan dan analisis material untuk transduksi biosensor. Teknik impedansi untuk sensor elektrokimia sangat dibutuhkan dalam mengamati perubahan bahan elektrikyang muncul dari peristiwa biorekognisi pada permukaan elektroda termodifikasi. Contohnya perubahan konduktansi dari elektroda dapat diukur hasil reaksi imobilisasi protein dan antibodi-antigen di atas permukaan elektroda [9].
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Teknologi Farmasi dan Medik TIAB BPPT PUSPIPTEK Serpong dan Laboratorium Departemen Fisika IPB dari bulan Agustus 2008 sampai bulan Februari 2009.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah neraca analitik, alat sablon atau screen-printing dengan ketebalan screen 180 mesh, PVC sheet, alat gelas, tisu, Ulano 23, mikropipet, HIOKI 3532-50 LCR Hi Tester dan Potentiostat- Galvanostat Model PG 580 yang dihubungkan ke komputer.
Bahan yang digunakan dalam penelitian ini adalah carbon conductive ink Elektrodag PF-407 ( Acheson Colloids, USA), silver chloride (AgCl) Elektrodag 6037SS (Acheson Colloids, USA), silver (Ag) conductive ink Elektrodag 427SS (Acheson Colloids, USA), insulator ink Elektrodag 452SS (Acheson Colloids, USA), 1,1’-Dimethylferrocene 97% (Sigma), kolesterol standar, kolesterol oksidase dari
Streptomyces sp 39 unit/mg, triton X-100,
KCl, bufer fosfat 0,2 M pH 7.5 ( KH2PO4 + Na2HPO4) dan aquades.
Pembuatan Elektroda Desain Layout Elektroda
Desain layout elektroda dibentuk dengan software Corel Draw 12. Tahap pertama adalah menentukan bentuk elektroda yang terdiri dari elektroda kerja,
![Gambar 1 Komponen utama biosensor [6]](https://thumb-ap.123doks.com/thumbv2/123dok/4175563.3088303/2.893.496.772.133.410/gambar-komponen-utama-biosensor.webp)
![Gambar 2 Konfigurasi elektroda dalam sel elektrokimia [12]](https://thumb-ap.123doks.com/thumbv2/123dok/4175563.3088303/3.893.516.763.136.283/gambar-konfigurasi-elektroda-dalam-sel-elektrokimia.webp)