KERAGAMAN GENETIKNYA
HERMAWATY ABUBAKAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Bakteri yang Berasosiasi dengan Spons Jaspis sp.: Analisis Penghasil Senyawa Antimikrob dan Keragaman Genetiknya adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2009
Hermawaty Abubakar G351070021
HERMAWATY ABUBAKAR. Spons (Jaspis sp.) – Associated Bacteria: Antimicrobial Production and Genetic Diversity Analyses. Under Direction of Aris Tri Wahyudi and Munti Yuhana.
ABSTRACT
Living benthic marine organisms such as sponges are frequently assosiated with bacteria which may produce useful antimicrobial compounds. Genetic diversity of bacteria isolated from marine sponge Jaspis sp. which has capability in producing antibacterial subtances was investigated. As many as 32 isolates (45,71%) and 20 (29,41%) isolates originating from mesohyl and sponge surface respectively, showed the antibacterial activity against Staphylococcus aureus, Vibrio harveyi, Escherichia
coli, Pseudomonas aeruginosa, Enterophatogenic Escherichia coli (EPEC K-11), Candida albicans, and C. tropicalis. Thirty most potential isolates were further
studied by amplified ribosomal DNA restriction analysis (ARDRA) to asses their genetic diversity. Restriction analysis using enzymes RsaI, HaeIII, and HinfI of the 16S rRNA genes resulted seven phylotipes. The 16S rRNA gene sequence of choosen isolates i.e. SAB E-8, SAB E-33, SAB E-35, SAB E-38, SAB E-40 and SAB S-43 that showed inhibition of the growth for all microorganism target were identified. The use of a few phenotypic tests for those isolate can be applied to differentiate them. Gram staining technique was used to distinguish Gram negative from Gram positive ones. Isolates designed as SAB E-8, SAB E-35, and SAB E-40 were identified as Gram negative, whereas SAB E-33, SAB E-38, and SAB S-43 were Gram positive. For Gram positive isolates, further test were performed including spora staining and catalase test for Bacillus identification. Based on their 16S rRNA gene sequences, there were 3 isolates closely related to Pseudomonas sp. while the remaining 3 isolates were members of Bacillus group.
Keywords: Sponge – Associated Bacteria, ARDRA, 16S rRNA, antimicrobial compounds, genetic diversity
RINGKASAN
HERMAWATY ABUBAKAR. Bakteri yang Berasosiasi dengan Spons Jaspis sp.: Analisis Penghasil Senyawa Antimikrob dan Keragaman Genetiknya. Dibimbing oleh Aris Tri Wahyudi dan Munti Yuhana.
Spons merupakan salah satu komponen biota penyusun terumbu karang yang mempunyai potensi bioaktif yang belum banyak dimanfaatkan. Hewan laut ini mengandung senyawa aktif yang persentase keaktifannya lebih besar dibandingkan dengan senyawa-senyawa yang dihasilkan oleh tumbuhan darat. Spons umumnya dapat bertahan hidup di perairan laut yang miskin nutrisi karena adanya assosiasi dengan organisme lain khususnya bakteri.
Bakteri banyak ditemukan secara komensal di permukaan dan bagian mesohyl spons. Pola makan spons yang khas yaitu filter feeder (menghisap dan menyaring) dapat memanfaatkan jasad renik disekitarnya sebagai sumber nutrien, diantaranya bakteri yang hidup pada perairan tersebut. Namun seringkali bakteri juga dijumpai hidup dan berkolonisasi dengan memanfaatkan nutrien yang terdapat pada spons tersebut.
Produk alami laut sebagai hasil metabolik sekunder kemungkinan dihasilkan oleh kehadiran mikroorganisme pada jaringan spons sebagai simbion, baik simbion intraselluler ataupun ekstraselluler. Senyawa-senyawa organik tersebut dapat ditransport karena adanya kerjasama antara simbion dan inangnya. Kehadiran kedua pasangan simbion ini juga menjadi syarat untuk menghasilkan metabolik sekunder seperti senyawa bioaktif yang bersifat antimikrob. Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi bakteri (endosimbion dan ektosimbion) penghasil senyawa antimikrob dan menganalisis keragaman genetiknya berdasarkan amplified
ribosomal DNA restriction analysis (ARDRA) dan sekuensing gen 16S rRNA.
Metode untuk mengisolasi bakteri simbion yang diduga memiliki potensi antimikrob dibagi atas dua metode yaitu untuk mengisolasi bakteri dari permukaan dan bagian mesohyl Jaspis sp. Total jumlah bakteri hasil isolasi dari permukaan dan mesohyl diuji kemampuan antimikrobnya dengan menggunakan bakteri target
Escherichia coli, EPEC K-11, Vibrio harveyi, Pseudomonas aeruginosa, Staphylococcus aureus dan dua jenis khamir yaitu Candida albicans dan C. tropicalis. Bakteri yang memiliki aktivitas antimikrob dianalisis keragaman
genetiknya dengan Amplified ribosomal DNA restriction analysis (ARDRA) serta didentifikasi dengan pewarnaan Gram, uji parsial dan sekuensing gen 16S rRNA.
Hasil isolasi diperoleh 138 isolat bakteri masing-masing 70 isolat endofit dan 68 isolat surfaces, yang ditandai dengan warna dan bentuk koloni yang berbeda-beda. Berdasarkan hasil pengujian antimikrob, 32 isolat bakteri (45,71%) dari total isolat bakteri endofit mempunyai aktivitas antimikrob. Pada bakteri permukaan, 20 isolat bakteri (29,41%) dari total isolat bakteri permukaan juga memiliki aktivitas antimikrob, yaitu mampu menghambat pertumbuhan bakteri uji namun tidak satupun isolat surfaces mampu menghambat C. albicans dan C. tropicalis. Isolat bakteri yang berada pada bagian mesohyl dan memiliki aktivitas antimikroba yang baik diduga adalah bakteri yang memiliki bentuk assosiasi dengan spons Jaspis sp. yang
Meskipun jumlah isolat bakteri yang berasal dari permukaan hampir sama dengan isolat endofit, namun aktivitas antimikrob isolat permukaan lebih rendah dibandingkan isolat endofit. Berdasarkan jumlah isolat yang mempunyai aktivitas antimikrob dan jumlah mikrob target yang dapat dihambat pertumbuhannya, isolat yang berasal dari bagian endofit spons Jaspis sp. lebih banyak dibandingkan isolat yang diisolasi dari permukaan. Bakteri simbion yang berasal dari bagian endofit yaitu mesohyl umumnya memiliki populasi yang berlimpah dan merupakan mikroba spesifik dari spons inangnya. Bakteri simbion yang berasal dari permukaan spons merupakan bakteri yang tidak spesifik dengan inangnya dan memiliki kemiripan dengan komunitas mikrob yang berada di lingkungan perairan dimana spons tersebut berada.
Hasil skrening terhadap semua isolat bakteri yang berasal dari endofit dan permukaan menunjukkan ada enam isolat bakteri yang mampu menghambat pertumbuhan semua mikrob target. Enam isolat tersebut terdiri dari lima isolat endofit yaitu SAB E-8, SAB E-33, SAB E-35, SAB E-38, dan SAB E-40 serta satu isolat permukaan yaitu SAB S-43. Berdasarkan hasil uji antagonis terhadap C. albicans dan
C. tropicalis, hanya isolat SAB E-33, SAB E-38 dan SAB E-40 yang memperlihatkan
aktivitas antagonis yang baik. Kemampuan isolat bakteri yang berasosiasi dengan spons Jaspis sp. dalam menghambat pertumbuhan mikroba target, merupakan bentuk aktivitas antagonis yang diduga dilakukan dengan menghasilkan kandungan senyawa yang bersifat antimikrobial. Biosintesis senyawa antimikrobial berperan penting dalam proses pelekatan, kolonisasi target hingga kompetisi dalam mendapatkan ruang dan nutrisi dengan mikroba lainnya.
Keragaman genetik dilakukan pada 30 isolat yang memiliki aktivitas antimikrob dilakukan dengan ARDRA. Amplifikasi gen 16S rRNA terhadap 30 isolat yang memiliki aktivitas antimikrob dilakukan dengan menggunakan primer spesifik yaitu 63f dan 1387r. Hasil elektroforesis amplifikasi gen 16S rRNA menampakkan pita yang berukuran sekitar 1300 pb. Primer 63f dan 1387r yang digunakan merupakan primer untuk gen yang menyandikan gen 16S rRNA yang telah didesain untuk seluruh domain bakteri. Primer ini dapat digunakan pada kultur murni bakteri maupun sampel alami dimana gen 16S rRNAnya sulit untuk diamplifikasi. Hasil pemotongan gen 16S rRNA memperlihatkan pola pita gen 16S rRNA yang beragam dengan jumlah 2-4 pita.
Profil pita gen 16S rRNA yang beragam dihasilkan setelah dipotong dengan tiga enzim restriksi yaitu RsaI, HaeII dan HinfI. Ketiga enzim restriksi tersebut memiliki situs dan sifat pemotongan yang berbeda-beda. Enzim HinfI merupakan enzim yang memotong secara sticky end, dengan situs pemotongan 5’…G↓ANTC…3’ dan 3’…CTNA↑G…5’. Enzim restriksi RsaI dan HaeIII ialah enzim restriksi yang memotong secara blunt end. Situs pemotongan pada RsaI yaitu 5’…GT↓AC…3’ dan 3’…CA↑TG…5’, sedangkan HaeIII yaitu 5’…GG↓CC…3’ dan 3’…CC↑GG…5’. Konstruksi pohon filogenetik berdasarkan data Amplified ribosomal DNA restriction
antimikrob menjadi tujuh filotipe. Pengelompokan ini berdasarkan adanya kesamaan situs pemotongan tiap isolat setelah direstriksi oleh tiga enzim restriksi yang berbeda.
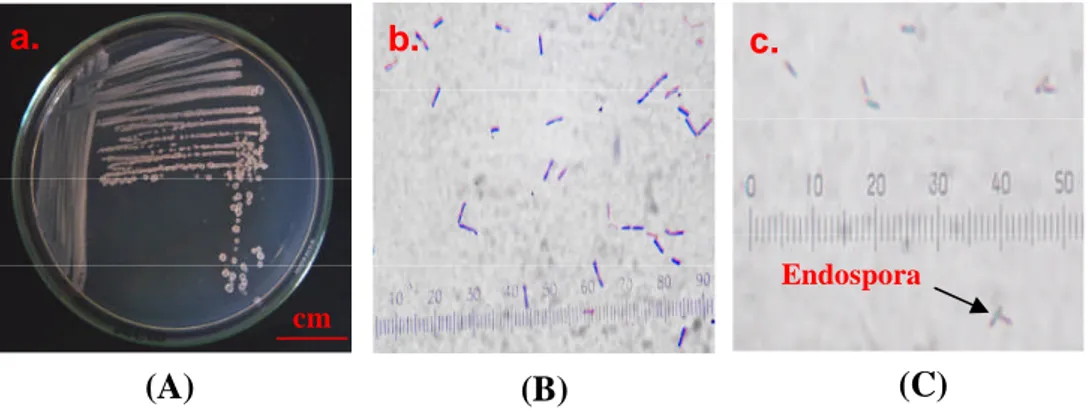
Pengujian fisiologis dilakukan dalam dua metode berdasarkan hasil pewarnaan Gram dari ke enam isolat terbaik. Isolat SAB 8, SAB 35 dan SAB E-40 dari hasil pewarnaan Gram merupakan bakteri Gram negatif. Bakteri Gram positif yaitu isolat SAB E-33, SAB E-38 dan SAB S-43. Uji fisiologis tambahan untuk bakteri Gram positif diarahkan ke kelompok Bacillus dengan melakukan uji parsial yang meliputi pewarnaan Gram, endospora dan katalase. Hasil uji parsial menunjukkan bahwa ketiga isolat tersebut adalah kelompok Bacillus, dicirikan oleh sel yang berbentuk batang, pewarnaan Gram positif, terdapat endospora yang terletak pada bagian sentral dan uji katalase positif.
BlastN sekuen gen 16S rRNA enam isolat dengan aktivitas mikrob terbaik, terbagi menjadi dua kelompok filogenetik yang berbeda yaitu genus Pseudomonas (50%) dan Bacillus (50%). Isolat SAB E-8, SAB E-35, dan SAB E-40 termasuk dalam kelompok Pseudomonas karena ketiga isolat tersebut masing-masing homolog dengan Pseudomonas sp. HN-07, Pseudomonas sp. LPK2 dan Pseudomonas sp.LD116, dengan tingkat identitas maksimum 97% - 98. Tingkat identitas maksimum 98% - 99% diperoleh dari tingkat homologi isolat SAB E-33, SAB E-38, dan SAB S-43 dengan isolat yang terdapat dalam Gen Bank, yaitu masing-masing
Bacillus sp. strain K3, Bacillus pumilus strain 210-50, dan Bacillus sp.E287.
Pohon filogenetik yang menggunakan data sekuen parsial gen 16S rRNA isolat dengan aktivitas antimikrob terbaik dan beberapa galur acuan (reference
strains) menunjukkan adanya kedekatan hubungan kekerabatan. Pohon filogenetik
menunjukkan SAB-35 berdekatan secara evolusi dengan Pseudomonas sp. J451 dengan nilai boostrap 56%. Pohon filogenetik menunjukkan SABS-43 dan SABE-33 memiliki kedekatan kekerabatan dengan Bacillus sp. EGU72 sedangkan SAB E-38 dengan Bacillus sp. D203.
Kata kunci : Spons – Asosiasi Bakteri, ARDRA, 16S rRNA, senyawa antimikrob, keragaman genetik
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
BAKTERI YANG BERASOSIASI DENGAN SPONS Jaspis sp. :
PENGHASIL SENYAWA ANTIMIKROB DAN ANALISIS
KERAGAMAN GENETIKNYA
HERMAWATY ABUBAKAR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama Mahasiswa : Hermawaty Abubakar
NRP : G351070021
Disetujui, Komisi Pembimbing
Dr. Aris Tri Wahyudi, MSi Dr. Munti Yuhana, MSi
Ketua Anggota
Diketahui,
Koordinator Mayor Mikrobiologi An. Dekan Sekolah Pascasarjana Sekretaris Program S2
Dr.Ir. Gayuh Rahayu Dr.Ir. Naresworo Nugroho, M.Sc.
PRAKATA
Puji syukur penulis panjatkan ke Hadirat Allah SWT karena atas segala rahmat dan karuniahNya sehingga karya ilmiah ini berhasil diselesaikan. Topik yang dipilih adalah Bakteri yang Berasosiasi dengan Spons Jaspis sp.: Analisis Penghasil
Senyawa Antimikrob dan Keragaman Genetiknya, yang dilaksanakan sejak bulan
Oktober 2008 sampai Mei 2009.
Penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya terutama kepada pembimbing, yaitu Dr. Aris Tri Wahyudi, Msi. dan Dr. Munti Yuhana, Msi. yang telah banyak memberikan bimbingan dan saran selama penulis menempuh S2. Terimakasih juga penulis sampaikan kepada Dr. Dinamella Wahjuningrum, MSi. selaku Penguji Luar Komisi yang telah memberikan koreksi dan arahan untuk perbaikan tesis.
Ungkapan terima kasih juga disampaikan kepada kedua orang tua, Ayahanda H. Abubakar Makkarumpa dan Ibunda Hj. Bunga Matahari, Suami dan kedua Anakku atas keikhlasan, doa dan kasih sayangnya. Tidak lupa kepada saudara dan sahabat khususnya Ari Susilowati, MSi., Rika I. Astuti, MSi., dan Syamsul Bahri, SSi, penulis mengucapkan banyak terima kasih atas bantuan saran, kritik dan kebersamaanya.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, sehingga kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi pembaca.
Bogor, Juli 2009
Penulis dilahirkan di Pinrang propinsi Sulawesi Selatan pada tanggal 5 Agustus 1978 dari pasangan H. Abubakar Makkarumpa dan Hj. Bunga Matahari. Penulis merupakan anak ke empat dari enam bersaudara.
Tahun 1996 penulis lulus dari SMU Muhammadiyah Pinrang dan pada tahun 1997 lulus seleksi masuk Universitas Hasanuddin Makasar pada jurusan Biologi melalui jalur UMPTN dan lulus tahun 2002. Kesempatan untuk melanjutkan ke program Magister Sains pada mayor Mikrobiologi FMIPA-IPB diperoleh pada tahun 2007. Beasiswa diperoleh dari BPPS Departemen Pendidikan Nasional.
Penulis bekerja sebagai tenaga pengajar di Universitas Negeri Papua sejak tahun 2003 sampai sekarang. Pada tahun 2006, penulis menikah dengan Lutfi Amin Mathar dan dikaruniai dua orang putra kembar yang bernama Moch. Rifat Badrani Mathar (Mori) dan Moch. Razan Badrani Mathar (Mora).
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA ... 4
Tinjauan Umum Spons ... 4
Asosiasi Spons dengan Bakteri ... 5
Potensi Senyawa Bioaktif dari Assosiasi Bakteri dengan Spons ... 7
Senyawa Antimikrob ... 9
Amplified Ribosomal DNA Restriction Analysis (ARDRA) ... 10
MATERI DAN METODE ... 12
Waktu dan Tempat ... 12
Bahan ... 12
Metode Penelitian ... 12
a. Pengambilan Sampel ... 14
b. Isolasi Bakteri dari Sampel Spons ... 14
c. Penapisan Bakteri Penghasil Senyawa Bioaktif ... 15
d. Pewarnaan Gram dan Uji Parsial ... 16
e. Analisis Molekuler Gen 16S rRNA ... 16
HASIL DAN PEMBAHASAN ... 19
Hasil ... 19
a. Isolasi Bakteri dari Sampel Spons ... 19
b. Penapisan Bakteri Penghasil senyawa Bioaktif ... 19
c. Pewarnaan Gram dan Uji Parsial ... 24
d. Amplified Ribosomal DNA Restriction Analysis (ARDRA) ... 26
e. Analisis Sekuens Gen 16S rRNA ... 34
Pembahasan ... 37
a. Isolasi dan Bentuk Asosiasi Spons dengan Bakteri ... 37
b. Isolat Penghasil Senyawa Bioaktif ... 38
c. Amplified Ribosomal DNA Restriction Analysis (ARDRA) ... 41
d. Analisis Sekuens Gen 16S rRNA ... 43
KESIMPULAN ... 46
Kesimpulan ... 46
DAFTAR PUSTAKA ... 47
Halaman
1 Aktivitas antibakteri dan antikhamir isolat-isolat bakteri endofit asal spons Jaspis sp. ... 21 2 Aktivitas antibakteri dan antikhamir isolat-isolat bakteri permukaan
asal spons Jaspis sp. ... 23 3 Ukuran fragmen DNA gen 16S rRNA yang dipotong dengan beberapa
enzim restriksi ………... 32
4 Identitas 6 isolat penghasil senyawa antimikrob terbaik yang berasosiasi dengan spons Jaspis sp. berdasarkan sekuens gen 16S rRNA . ………... 35
DAFTAR GAMBAR
Halaman
1 Tahapan-tahapan yang dilakukan dalam penelitian ini ... 13 2 Penampilan spons Jaspis sp., asal perairan sebelah barat Pulau
Waigeo, Raja Ampat Papua Barat ... 14 3 Penampilan koloni bakteri ektosimbion hasil isolasi dari spons Jaspis
sp pada Medium SWC, setelah diinkubasi selama 24 jam pada suhu 27oC ...
20
4 Penampilan koloni bakteri endosimbion hasil isolasi dari spons Jaspis sp pada Medium SWC, setelah diinkubasi selama 24 jam pada suhu 27oC ...
20
5 Senyawa Antibakteri yang dihasilkan (terlihat dari zona bening yang terbentuk) dari beberapa isolat bakteri endofit asal spons Jaspis sp. terhadap pertumbuhan bakteri a. S. aureus, b. V. harveyii, c. E. coli, d. EPEC-K11, e. P. aeruginosa dan f. S. aureus ……….
22
6 Senyawa Antikhamir yang dihasilkan (terlihat dari zona bening yang terbentuk) dari isolat bakteri endofit asal spons Jaspis sp. SAB E-35 dan SAB E-38 terhadap pertumbuhan khamir a. C. albicans dan b. C.
tropicalis ..……….
22
7 Senyawa Antibakteri yang dihasilkan (terlihat dari zona bening yang terbentuk) dari beberapa bakteri permukaan asal spons Jaspis sp. terhadap pertumbuhan a. S. aureus, b. V. harveyii dan c. P.
Aeruginosa ...
25
8 Profil koloni pada media SWC dan hasil pewarnaan bakteri Gram negatif isolat SAB E-35 …………...
25 9 Uji parsial genus Bacillus untuk isolat bakteri gram positif (SAB
S-43); Profil koloni pada media SWC; Pewarnaan Gram; Pewarnaan Spora ...………...
25
10 Amplifikasi gen 16S rRNA dari beberapa isolat yang memiliki aktivitas antimikrob terbaik, M: standar ukuran molekul DNA 1kb ladder ………...……….
27
11 Elektroforesis gel agarose gen 16S rRNA dari beberapa isolat bakteri asal spons Jaspis sp. yang mempunyai aktivitas antimikroba terbaik yang dipotong dengan Enzim RsaI (A), HaeIII (B) dan HinfI (C). M: standar ukuran molekul DNA (1kb ladder) ...………
28
12 Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan spons Jaspis sp. yang dipotong dengan enzim restriksi RsaI ………
29
13 Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan spons Jaspis sp. yang dipotong dengan enzim restriksi HaeIII ………
30 14 Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan
spons Jaspis sp. yang dipotong dengan enzim restriksi HinfI ………
dikonstruksi berdasarkan metode Neighbor-Joining. Angka 10% pada bagian atas pohon menunjukkan skala persentase perbedaan (distance
scale) antar profil isolat bakteri. Angka pada nodus adalah nilai
bootstrap dengan 100 ulangan ... 16 Pohon filogenetik berdasarkan hasil sekuensing gen 16S rRNA enam
isolat bakteri dengan aktivitas antimikrob terbaik asal spons Jaspis sp. 36
DAFTAR LAMPIRAN
Halaman
1 Komposisi media SWC (Sea Water Complete) ... 51
2 Profil koloni isolat bakteri endofit ... 52
3 Profil koloni isolat bakteri surfaces ... 54
4 Sekuen gen 16S RNA enam isolat terbaik ... 56
Latar Belakang
Mikroorganisme laut merupakan sumber senyawa bioaktif baru yang banyak menjadi perhatian sekarang ini. Bakteri penghuni perairan laut yang miskin nutrisi banyak dijumpai hidup dengan cara berasosiasi dengan berbagai organisme laut bentik, seperti spons dan karang.
Spons merupakan biota laut yang tersebar pada daerah perairan pantai yang dangkal hingga kedalaman 5,5 km. Tubuh hewan ini terdiri dari jaringan rangka yang disebut spikula. Spikula tersebut mengandung senyawa kimia yaitu kalsium karbonat, silika, serat kolagen dan serat spongin yang lentur (Castro & Huber 2005). Spons adalah hewan berpori yang termasuk filter feeder yaitu hewan yang mengumpulkan nutriennya dengan cara menyaring air laut melalui pori-pori (ostium). Makanan porifera berupa sisa organisme yang telah mati atau mikroorganisme yang berada di kolom air. Menurut Taylor et al. (2007), selain dijadikan sumber protein sel tunggal, mikroorganisme juga sebagai simbion dari spons karena mikroorganisme mengkolonisasi tubuh sponge yang berpori-pori sebagai tempat hidup dan berlindung. Hal ini dapat dijumpai sebagai asosiasi antara spons dengan bakteri. Bakteri dapat memberikan kontribusi untuk pertahanan inangnya dengan eksresi antibiotik dan substansi bioaktif lainnya. Secara khusus organisme laut yang sesil seperti spons diperkirakan sangat bergantung pada mekanisme pertahanan simbionnya, yaitu dengan menghasilkan senyawa bioaktif untuk mempertahankan diri terhadap hewan-hewan predator dan dari kolonisasi dari mikroorganisme patogenik.
Banyak senyawa bioaktif yang diproduksi oleh spons sebagai hasil metabolit sekunder. Produk alami laut sebagai hasil metabolik sekunder kemungkinan dihasilkan oleh kehadiran mikroorganisme pada jaringan spons sebagai simbion, baik simbion intraselluler ataupun ekstraselluler. Senyawa-senyawa organik tersebut dapat ditransport oleh adanya kerjasama antara simbion dan inangnya. Kehadiran pasangan simbion ini menjadi syarat untuk menghasilkan metabolik sekunder. Hubungan ini dapat dilihat dari asosiasi spons dan Eubacteria (Barnes 1994).
2
Jenis senyawa metabolit sekunder yang berhasil diisolasi dari bakteri yang bersimbiosis dengan spons memperlihatkan kuantitas yang lebih banyak dari mikroorganisme laut lainnya. Hal ini terutama dikarenakan kemudahan dalam kultur massalnya. Jenis senyawa metabolit sekunder dari bakteri yang bersimbiosis dengan spons sangat bervariasi yaitu dari golongan terpenoid, alkaloid, polyketida, peptida siklik, derivat dari asam lemak dengan berat molekul kecil, heterosklik, hingga
brominated pyrroles, (Tayloret al.2007).
Vibrio spp. yang berasosiasi dengan spons Dysidea sp menunjukkan adanya
sintesis cytotoksik dan antibakteri tetrabromodiphenyl eter demikian pula pada asosiasi antara Micrococcus dengan Tedania ignis ditemukan adanya aktifitas antimikroba (Kanagasabhapathy et al. 2005). Hasil penelitian Kim et al. (2006); Montalvo et.al 2005; Zhang et al. (2006), Actinomyetes yang bersimbiosis dengan spons Pseudoceratina clavalata, Xestospongia spp., Hymeniacidon perlevis dan
Craniella australiensis juga menunjukkan adanya aktifitas antimikrobial.
Penemuan spons sebagai penghasil senyawa bioaktif juga telah banyak dipublikasikan tetapi penggunaan produk alami laut yang bersifat antibiotik dan antifungi sebagai hasil metabolit sekunder dari bakteri yang bersimbiosis dengan spons, lebih menguntungkan dibandingkan dengan mengisolasi dari inangnya. Pertumbuhan spons yang relatif lamban, selanjutnya membawa implikasi pada keterbatasan pasokan biomassa untuk mengekstraksi senyawa metabolit sekundernya. Penggunaan bakteri yang hidupnya berasosiasi dengan spons dalam bentuk simbion lebih baik karena dapat dimurnikan dan dikultur dalam skala laboratorium sehingga tidak perlu mengoleksinya dari alam, dapat diperbanyak dalam waktu yang lebih cepat dan relatif lebih mudah dimanipulasi dengan menggunakan teknologi molekuler. Penggunaan teknik molekuler untuk mengidentifikasi bakteri telah umum dilakukan, salah satunya dengan analisis gen 16S rRNA untuk mengetahui filogeni, penyebaran dan karakteristik bakteri yang bersimbiosis dengan spons. Analisis gen 16S rRNA juga dapat dilanjutkan dengan metode Amplified ribosomal DNA
menganalisis komunitas bakteri pada berbagai lingkungan, termasuk spons sebagai simbion dari berbagai bakteri laut.
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi dan mengkarakterisasi bakteri yang berasosiasi dengan spons Jaspis sp. (endosimbion dan ektosimbion) penghasil senyawa antimikrob dan menganalisis keragaman genetiknya berdasarkan amplified
TINJAUAN PUSTAKA
Tinjauan Umum Spons
Spons (filum Porifera) adalah hewan multisellular (Metazoa) yang paling tua dan mempunyai struktur yang sangat sederhana. Susunan pada struktur spons tidak sama dengan filum yang lainnya, morfologi spons sangat mempengaruhi aspek biologi spons itu sendiri termasuk interaksinya dengan mikroorganisme (Simpson 1984).
Susunan sel-sel spons berbeda pada setiap lapisan strukturnya. Pada permukaan paling luar, atau yang biasa disebut dengan pinacoderm, dibentuk oleh sel-sel epitel yang disebut sebagai pinacocyte. Pori-pori (ostia) pada permukaan luar merupakan saluran yang menembus sampai pada bagian kanal interior. Bagian dalam spons, terdapat sebuah sel-sel berflagella (choanocyte) yang berasal dari sebuah ruang yang disusun oleh choanoderm dimana makanan disimpan. Flagel dari choanocyte akan bergerak untuk memompa air yang akan masuk melalui ostia, choanosyte juga akan menyaring keluar partikel-partikel makanan (termasuk bakteri dan mikroalga) dari air dan akan ditransfer ke mesohyl yang merupakan perluasan lapisan yang berhubungan dengan jaringan. Di dalam mesohyl partikel makanan akan dicerna dengan phagositosis oleh sel-sel spons lainnya yang disebut archaeosyte. Sel-sel totipotensi yang dapat berdiferensiasi menjadi tipe sel spons yang baru juga berada pada mesohyl yang padat dengan komunitas mikroorganisme. Setiapkali choanocyte menyaring air yang masuk, maka air juga akan dikeluarkan dari spons melalui osculum, diperkirakan lebih dari 24.000 liter air yang dipompakan oleh 1 kg spons perhari (Castro & Huber 2005).
Pertumbuhan spons juga memiliki tipe yang bermacam-macam dengan warna-warna yang menarik, seperti tipe encrusting, bercabang, cup dan massive dengan ukuran yang hanya beberapa millimeter hingga yang memiliki diameter lebih dari satu meter. Konstruksi struktur spons dibentuk oleh silika dan spikula kalkareus, komponen ini seringkali dibuat sebagai bahan dalam penyusunan taksonominya. Selain spikula dan silika, jaringan kolagen seperti spongin juga
memengang peranan dalam menyokong struktur pada spons (Castro & Huber 2005).
Spons yang berwarna orange cerah yaitu Jaspis johnstoni adalah spons dengan struktur yang rapuh, lembut dan padat. Spons ini dapat dijumpai pada permukaan karang sehingga dengan mudah dapat dikonsumsi oleh predator. Spons ini mempunyai kandungan senyawa bioaktif yang dapat membunuh predator, hasil penelitian Vanderloos (1997) mengidentifikasi senyawa tersebut adalah Jasplakinolide yang dapat menghambat pertumbuhan sel-sel kanker.
Asosiasi Spons dengan Bakteri
Interaksi antara spons dan bakteri terjadi dalam banyak bentuk. Untuk spons, mikroba yang berbeda dapat diartikan sebagai sumber makanan, patogen/parasit atau sebagai simbion mutualisme. Bakteri yang berasosiasi dengan spons dapat mencapai 40% dari jaringan spons dengan kepadatan 109sel bakteri per ml jaringan spons (Hofman et al. 2005). Berdasarkan sekuen 16S rRNA dan Denaturing Gradient Gel Electrophoresis (DGGE) hasil sensus oleh Taylor et al. (2007), bakteri yang berassosiasi dengan spons antara lain adalah Acidobacteria, Actinobacteria, Bacteroides, Chloroflexi, Cyanobacteria, Deinococcus-Thermus, Firmicutes, Gemmatimonadetes, Nitrospira, Planctomycetes, Poribacteria, Proteobacteria, Sphirochaetes dan Verrucomicrobia.
Sangat jelas keuntungan yang diperoleh spons dari sistem metabolisme simbionnya yaitu bakteri dan mikroba lainnya. Fotosintesis dan fiksasi nitrogen yang dilakukan oleh cyanobakteri kiranya merupakan faktor kunci mengapa spons dapat bertahan dalam kondisi lingkungan peraiaran yang miskin nutrisi (Ariilo et al. 1993). Seperti yang diungkapkan oleh Hoffman et al. (2006), yang menjelaskan bahwa bakteri anaerobik dapat mentransfer asam karboksilat pada spons Geodia baretti. Bakteri metanotropik dapat mensuplemen nutrisi pada spons tanpa proses filter feeding dalam habitat laut yang kaya akan metan (Facelet et al. 1995). Namun, mikroba simbion dapat pula dikonsumsi oleh spons, ini dilaporkan pertamakali pada awal 1970-an, bahwa simbion cyanobakteri ditemukan pada bagian intra dan ekstraseluler dari spons Synecoccus spp. (kelompok Cyanobakteria) juga dijumpai pada sel mesohyl dan bagian sel-sel
6
tertentu dari spons Ircinia virabilis asal Mediterania, yang merupakan sebuah sumber fotosintesis dan pemfiksasi karbon bagi spons (Yahel et al. 2006).
Bentuk asosiasi mikroba juga memberikan kontribusi dalam siklus nutrisi bagi kebutuhan spons inangnya. Sumber nutrisi spons berupa mikroalga dan zooplankton terdiri atas berbagai komponen makrokolekul. Mikroalga yang kaya akan karbon dan nitrogen serta zooplankton yang sebagian struktur tubuhnya terdiri atas kitin dapat dengan mudah dipecah oleh bakteri-bakteri pengahsil enzim protease dan kitinase sehingga menjadi molekul yang lebih kecil (Reiswig 1975). Keuntungan lain yang diperoleh oleh spons dari simbionnya yaitu bakteri adalah penambahan struktur yang lebih kaku akibat produksi mukus yang dihasilkan oleh mikroba. Dalam beberapa kasus senyawa-senyawa yang dihasilkan oleh mikroba simbion potensial digunakan sebagai prekusor untuk metabolisme biosintesis pertahanan spons dari patogen dan predator lainnya.
Penelitian tentang interaksi antara spons dan mikroorganisme, menunjukkan bahwa suatu mikroorganisme akan berasosiasi pada spesies spons tertentu. Hal ini telah dibuktikan melalui pengamatan dengan mikroskop maupun analisa genetik dan studi kultur yang bertujuan untuk isolasi antibiotik dari bakteri yang berasosiasi dengan spons yang berbeda-beda. Suberitas domuncula, misalnya menunjukkan hanya sedikit bakteri yang tampak pada bagian permukaan dalamnya, sementara spons Halichondria panicea dan Ircinia fascikulata menunjukkan bakteri yang berlimpah dengan variasi yang bermacam-macam. Ini dapat dilihat dengan mikroskop elektron yang juga menggambarkan tingginya keanekaragaman isolat bakteri dari spons-spons ini (Imhoff & Stohr 2003).
Spesies spons yang berasosiasi dengan bakteri spesifik dapat ditunjukkan dengan membandingkan komunitas bakteri yang berasosiasi dengan sampel yang berbeda dari spons Mediteranian yaitu Chondrilla nucula dari laut Adriatic dan laut Liguria. Sekuen DNA klon yang identik ditemukan dalam sampel spons dari lokasi yang berbeda. Menariknya, spons Thetya aurantium menunjukkan dua komunitas bakteri yang diperlihatkan dengan bentuk morfologi yang berbeda dari bagian eksterior dan interior sel, yang dapat dilihat dengan mikroskopik dan diperjelas dengan DGGE dan percobaan cloning gen 16S rRNA. Penemuan ini mendukung asumsi bahwa setidaknya bakteri yang ditemukan pada spons tertentu
adalah spesies khusus yang berasosiasi dengan kelompok porifera tersebut serta mempunyai bentuk adaptasi sepanjang proses evolusi pada lingkungan dimana spons berada (Imhoff & Stohr 2003).
Kesuksesan usaha dalam mengisolasi mikroorganisme penghasil senyawa bioaktif yang bersimbiosis dengan spons tergantung oleh beberapa faktor. Faktor yang paling signifikan yaitu bahwa mikroba dapat melakukan sistem metabolisme yang berbeda-beda tergantung kondisi lingkungannya. Banyak penelitian yang berhasil mengkultur bakteri yang berasal dari spons pada medium-medium yang sebelumnya dicampur dengan ekstrak dari jaringan spons. Meskipun demikian, bakteri yang dapat menghasilkan senyawa bioaktif yang diisolasi jumlahnya cukup rendah yaitu berkisar 0,06; 0,1; 0,15 dan 0,7 % dari total bakteri yang dapat dikultur dari spons Candidaspongia flabellata, Rhopaloides odorabile, Aplysinaaerophoba (Burja et al. 1999; Thoms et al. 2003)
Kebutuhan nutrisi mikroba yang bersimbiosis dengan spons sangat susah untuk dipenuhi bila dikultur dalam laboratorium. Bagaimanapun, ada beberapa bakteri yang dapat diisolasi tetapi sudah tidak dapat memproduksi senyawa-senyawa bioaktif lagi, kemungkinan bakteri-bakteri tersebut mengharuskan adanya perantara sistem metabolisme dari spons sebagai inangnya. Adapula beberapa isolat bakteri yang belum diketahui alasannya berhenti menghasilkan produk-produk senyawa bioaktif setelah dikulturkan beberapa waktu pada media buatan. Ini diduga karena adanya keterlibatan faktor genetik, dimana gen yang menyandikan senyawa bioaktif tersebut hilang karena akibat mutasi atau kehilangan penggerak elemen-elemen genetik yang mensintesis gen-gen tersebut (Proksch et al. 2002).
Potensi Senyawa Bioaktif dari Assosiasi Bakteri dengan Spons
Spons dianggap sebagai organisme yang potensial karena lebih dari 200 senyawa metabolit baru yang ditemukan setiap tahun, dibandingkan dengan organisme laut lainnya. Spons dianggap sebagai salah sumber substansi natural yang paling penting seperti antibiotik, antitumor, aktivitas antiviral, antiplasmodial, dan anti-inflammatory. Ini membuat spons sebagai sumber potensial dari produk baru dunia kedokteran. Bagaimanapun, dalam banyak kasus
8
hal ini tidak bisa membuktikan apakah sel-sel spons atau bakteri yang berasosiasi memproduksi substansi senyawa bioaktif (Blunt et al. 2006).
Meskipun awalnya penemuan senyawa bioaktif banyak ditemukan sebagai hasil ekstraksi dari jaringan spons tetapi arah penelitian sekarang ini lebih banyak dieksplorasi pada mikroorganisme yang bersimbiosis dengan spons. Hal tersebut lebih menguntungkan dibandingkan dengan mengisolasi dari inangnya (spons). Menurut West et al. (2002), senyawa makrosiklik lactone yaitu Peluruside A yang diisolasi dari demosphongia Mycale hentscheli di perairan New Zaeland menunjukkan potensi sebagai antikanker dan untuk mendapatkan 2 gram Peluruside A murni dibutuhkan 200 kg ekstrak spons, hal ini tentu saja dapat menghabiskan kekayaan laut bumi ini.
Kenyataanya, banyak kasus yang dapat menunjukkan bahwa bakteri yang berasosiasi yang memproduksi kandungan senyawa bioaktif dan bukan inangnya. Chondramide D yang dihasilkan oleh deltaproteobacterium Chondromyces crocatus memperlihatkan rumus struktur yang sama dengan senyawa Jaspamide yang berasal dari ekstrak spons Jaspis sp. (Taylor et al. 2007).
Spons yang bersimbiosis dengan Actinomycetes dari genus Micromonospora menghasilkan Manzamine yaitu alkaloid yang berpotensi sebagai antimalaria. Manzamine pertama diisolasi dari mikroba yang berasal dari spons yang tidak hanya berbeda spesies, tetapi juga secara geografis berbeda. Namun perkembangan sekarang, manzamine yang dihasilkan tidak selalu bergantung pada komunitas atau jenis mikrobanya. Manzamine yang diisolasi di Indonesia dihasilkan oleh bakteri yang bersimbiosis dengan spons 01IND 35 dan 01IND 52 (Naglaa et al. 2004).
Spons Hyatella sp. yang bersimbiosis dengan Vibrio sp. menghasilkan senyawa peptida yang bersifat antibakterial, sementara itu glycoglycerolipid dihasilkan oleh Halichondria panicea yang bersimbiosis dengan Microbacterium sp. yang berpotensi sebagai anti tumor (Miyashiro & Ikegami 1994; Wicke et al. 2000). Menurut Mitova et al. (2003), sebuah senyawa baru yaitu Cyclotetrapeptida dan dihasilkan oleh bakteri Pseudomonas sp. (IM1) yang diisolasi dari sebuah spesimen spons Ircinia muscarum dari teluk Naples (Italia). Hasil penelitianKim et. al., 2006,analisis filogenetik dari sekuen gen ketosynthase
(KS) strain Salinispora sp. (actinobacteria) diindikasikan memiliki sekuen gen polyketide synthase (PKS) yang sama dengan Amycolatopsis mediterranei penghasil Rifamycin B. Strains Salinispora diisolasi dari spons laut Pseudoceratina clavata. Pada penelitian lainnya, beberapa golongan Quinolon memiliki aktivitas antimikrobial dan cytotoksin dari Pseudomonas asosiasi dengan Homophinia sp. yang berasal dari lautan pasifik (Burja et al. 1999). Asosiasi antara spons Aplysina aerophoba dan A. cavernicola yang berada di laut Mediterania dengan 27 isolat bakteri yang belum teridentifikasi, menunjukkan bahwa beberapa isolat tersebut berpotensi untuk menghambat pertumbuhan bakteri-bakteri klinikal yang multiresisten seperti, Staphylococcus aureus dan S. epidermidis (Hentschel et al. 2001).
Arah penelitian yang semakin dikembangkan yaitu berfokus pada produksi substansi antibiotik dari bakteri yang bersimbiosis dengan spons. Bagaimanapun penambahan bakteri resisten menyebabkan beberapa masalah dalam dunia kedokteran dan menguatkan penelitian-penelitian baru untuk mencari kandungan senyawa aktif melawan patogen multiresisten.
Senyawa Antimikrob
Senyawa antimikroba adalah senyawa yang dihasilkan oleh fungi dan bakteri yang dapat menghambat atau membunuh mikroorganisme lain. Kebanyakan senyawa antimikroba yang telah dipergunakan secara luas dikenal dengan nama antibiotik. Target penting dari antibiotik bakteri adalah ribosom (translasi), dinding sel, membran sitoplasma, proses repilikasi DNA dan transkripsi (Madigan et al. 2006).
Antibiotik yang menghambat sintesis protein pada tahap inisiasi adalah streptomycin sedangkan puromycin, chloramphenicol, cyckloheximide dan tetracyclin pada tahap elongasi. Antibiotik yang berperan pada transkripsi antara lain rifampin dan streptovaricin yang menghambat sintesis RNA yaitu dengan berikatan dengan sub unit β dari RNA polimerase, sedangkan aktinomycin menghambat sintesis RNA dengan menghentikan proses elongasi RNA. Antibiotik β-lactam seperti penicillin dan cephalosporin berpotensi untuk menghambat sintesis dinding sel salah satunya dengan menghasilkan penicillin binding protein (PBPs), (Madigan et al. 2006).
10
Amplified Ribosomal DNA Restriction Analysis (ARDRA)
Salah satu alternatif untuk mengetahui komposisi komunitas suatu lingkungan yaitu dengan mengembangkan teknik biologi molekular. Teknik ini mencakup penentuan variasi pola pita gen 16S rRNA setelah dipotong dengan beberapa enzim restriksi yang dapat dianalisis pada komunitas prokariot yang dijumpai pada habitat tertentu. Gen 16S rRNA adalah bagian dari DNA prokariot yang dapat ditemukan pada bakteri dan archaea. Gen ini mengkodekan rRNA, dimana rRNA merupakan bagian pembentuk dari ribosom. Huruf ”r” pada rRNA merujuk pada kata ribosomal, sedangkan struktur ribosom terdiri dari dua unit yaitu large subunit (LSU) dan small subunit (SSU). Pada bakteri SSU dikodekan oleh gen 16S rRNA sedangakn LSU dikodekan oleh gen gen 5S rRNA dan 23S rRNA (Snyder & Wendy 2002).
Gen 16S rRNA merupakan gen yang sangat stabil, karena susah temutasi meskipun dalam jangka waktu yang lama. Gen 16S RNA mengandung informasi yang dapat dijadikan sebagai biomarker terhadap suatu bakteri. Gen 16S rRNA terdiri dari daerah konservatif yang dapat dijumpai pada semua organisme dan daerah hypervariabel yang unik pada setiap organisme atau organisme yang memiliki hubungan kekerabatan yang dekat yang dapat digunakan untuk identifikasi (Moyer et al. 1994).
Analisis filogeni dari komunitas mikroba yang menggunakan Amplified Ribosomal DNA Restriction Analysis (ARDRA) merupakan sebuah metode sederhana yang didasarkan pada adanya polimorfisme panjang fragmen gen 16S rRNA setelah dipotong dengan enzim restriksi. Istilah polimorfisme adalah hasil pemotongan gen 16S rRNA dari bakteri asal yang berbeda akan memberikan pola fragmen yang berbeda. Panjang fragmen ditentukan melalui proses elektroforesis gel agarose dengan penanda ukuran DNA (DNA marker) sebagai pembanding (Yogiara 2004). Sama halnya hibridisasi dan pelacakan DNA, ARDRA digunakan untuk menganalisis komunitas bakteri pada berbagai lingkungan. Meskipun ARDRA hanya memberikan sedikit atau sama sekali tidak ada informasi mengenai tipe mikroorganisme yang terdapat dalam suatu sampel, namun hasilnya dapat digunakan untuk mengetahui genotip secara cepat atau untuk
membandingkan suatu komunitas mikroorganisme pada kondisi lingkungan yang berbeda.
Pada penelitian Moyer et al. (1994) analisis 16S rRNA menggunakan kombinasi enzim restriksi tetramerik (situs pengenalan 4 basa DNA) untuk menghasilkan suatu pola pita DNA yang emadai sebagai satuan operasional taksonomi (operational taxonomic unit/OTU). Masing-masing OTU akan menjadi ciri dari kelompok 16S rRNA asal bakteri yang hidup dalam komunitas tertentu. Penggunaan enzim restriksi HhaI (isochizomer dengan Hinp1 I), RsaI dan BstUI sebagai enzim yang digunakan dalam studi keragaman mikrob menggunakan ARDRA, karena enzim tersebut dapat menghasilkan pola pita DNA yang relatif lebih beragam.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA-Institut Pertanian Bogor, yang dimulai bulan Oktober 2008 sampai bulan Mei 2009.
Bahan
Bahan yang digunakan dalam penelitian ini adalah sampel spons Jaspis sp yang diambil dari perairan sebelah barat pulau Waigeo, Kabupaten Raja Ampat, Papua Barat. Bakteri uji yang digunakan untuk uji produksi senyawa antibakteri terdiri dari bakteri Gram negatif yaitu Escherichia coli (koleksi laboratorium Mikrobiologi, departemen Biologi IPB), EPEC (Enteropathogenic Escherichia coli) K-11 (koleksi Dr.dr. Sri Budiarti – Departemen Biologi IPB), Vibrio harveyi patogen udang (koleksi Dr. Widanarni – Departemen Budidaya Perikanan IPB), Pseudomonas aeruginosa patogen manusia (koleksi laboratorium Bioteknologi PAU) serta bakteri Gram positif yaitu Staphylococcus aureus patogen manusia (koleksi laboratorium Bioteknologi PAU), Bacillus subtilis dan Staphylococcus aureus (koleksi laboratorium Mikrobiologi, Departemen Biologi IPB). Pengujian antikhamir menggunakan Candida albicans dan C. tropicalis patogen manusia (koleksi Laboratorium Mikrobiologi dan Parasitologi, Fakultas Kedokteran Universitas Indonesia)
Metode Penelitian
Metode ini meliputi pengambilan sampel, lalu dilanjutkan dengan isolasi bakteri yang berpotensi menghasilkan senyawa antimikrob yang berasal dari permukaan dan mesohyl spons Jaspis sp. Penapisan isolat bakteri yang menghasilkan senyawa antimikrob, yang dilakukan terhadap organisme prokariot (bakteri) dan Eukariotik (khamir). Untuk keragaman genetik isolat bakteri yang memiliki aktivitas antimikrob dilakukan dengan Amplified ribosomal DNA restriction analysis (ARDRA) dan dilanjutkan dengan uji fisiologis (pewarnaan Gram dan uji parsial) serta sekuensing gen 16S rRNA untuk identifikasi isolat terbaik. Alur lengkap tahapan dalam penelitian ini dapat dilihat pada Gambar 1.
Gambar 1. Tahapan-tahapan yang dilakukan dalam penelitian ini.
Pengambilan Sampel spons Jaspis sp.
Isolasi Bakteri dari Sampel Spons
Penapisan Isolat Bakteri Penghasil Senyawa Bioaktif
Pengujian Aktivitas Antibakteri
Pengujian Aktivitas Antikamir
Uji fisiologis (Pewarnaan Gram dan Uji Parsial)
Amplified rDNA Restriction Analysis (ARDRA)
14
Pengambilan Sampel
Sampel spons diambil dari perairan sebelah barat pulau Waigeo, Kabupaten Raja Ampat, Papua Barat, pada kedalaman +10 meter dengan menggunakan alat bantu snorkel dan masker. Pengambilan sampel ini dilakukan secara acak, yaitu dengan menyusuri dasar laut. Sampel spons Jaspis sp. yang digunakan dalam penelitian ini dapat dilihat pada Gambar 2. Sampel kemudian dimasukkan ke dalam plastik sampel (Whirl-Pak, Nasco, USA) yang telah diisi dengan oksigen murni, selanjutnya ditempatkan dalam cool box untuk dianalisis secara mikrobiologis di laboratorium.
Gambar 2. Penampilan spons Jaspis sp., asal perairan sebelah barat Pulau Waigeo, Raja Ampat Papua Barat.
Isolasi Bakteri dari Sampel Spons
Permukaan sampel spons dibilas dengan air laut steril, sehingga hanya bakteri dengan daya simbiosis yang kuat saja yang akan tersampling (Amstrong et al. 2001). Untuk isolasi bakteri pada bagian dalam jaringan spons diambil dengan cara memisahkan bagian pinacoderm dengan bagian mesohyl. Bagian mesohyl diambil dengan ukuran + 1 x 1 cm, digerus dan diencerkan dengan Phosphate Buffer Saline (PBS) steril dengan perbandingan 1 : 1 (Kim et al 2006). Selanjutnya dibuat suspensi dari pengenceran 10-1sampai 10-7. Pada pengenceran 10-5,10-6, dan 10-7dipipet 0,1 ml secara aseptik dan disebar ke dalam cawan petri yang telah berisi media Sea Water Complete (SWC), kemudian diinkubasi pada suhu 26oC selama 24 - 36 jam dan diamati pertumbuhan koloni bakteri yang
tumbuh pada media tersebut. Untuk mengisolasi bakteri dari permukaan luar menggunakan swab steril (Wahl et al. 1994). Swab steril diusapkan pada permukaan luar spons, kemudian dicelupkan ke dalam botol pengenceran yang berisi PBS steril dengan perbandingan 1 : 1. Selanjutnya, dari suspensi tersebut dibuat pengenceran 10-1 sampai 10-7. Pada pengenceran 10-5, 10-6, dan 10-7dipipet 0,1 ml secara aseptik dan dimasukkan ke dalam cawan petri yang telah berisi media SWC, kemudian diinkubasi pada suhu 26oC selama 24 - 36 jam dan diamati pertumbuhan koloni bakterinya. Setiap koloni bakteri yang tumbuh dipisahkan berdasarkan warna dan bentuk koloni, serta dimurnikan dengan menggunakan media yang sama.
Penapisan Bakteri Penghasil Senyawa Bioaktif (Antibakteri dan Antikhamir) Pengujian Aktivitas Antibakteri. Metode ini dilakukan dengan teknik
bilayer yaitu, kultur cair bakteri uji yang telah diinkubasi selama 18 jam, diambil sebanyak 1ml lalu dimasukkan ke dalam 100 ml media SWC steril. Campuran antara kultur bakteri dan media SWC sebagai lapisan kedua dituangkan ke dalam cawan petri yang telah berisi dengan media SWC yang telah padat (lapisan pertama). Setelah padat, isolat bakteri yang telah murni digoreskan pada permukaan media yang telah mengandung kultur bakteri uji, kemudian diinkubasi selama 24 jam pada suhu 37oC. Senyawa bioaktif antibakteri yang dihasilkan diindikasikan dengan terbentuknya zona jernih disekitar koloni isolat murni.
Pengujian Aktivitas Antikhamir. Metode yang dilakukan sama dengan
pengujian antibakteri yaitu dengan teknik bilayer. Kultur cair Candida yang telah diinkubasi selama 24 jam, diambil sebanyak 1ml lalu dimasukkan ke dalam 100 ml media PDA (Potato Dextrose Agar) steril. Campuran antara kultur khamir dan media PDA sebagai lapisan kedua dituangkan ke dalam cawan petri yang telah berisi dengan media PDA yang telah padat (lapisan pertama). Setelah padat, isolat yang telah murni digoreskan pada permukaan media yang telah mengandung kultur khamir, lalu diinkubasi selama 24 jam pada suhu 37oC. Senyawa bioaktif antibakteri yang dihasilkan diindikasikan dengan terbentuknya zona jernih disekitar koloni isolat yang digoreskan murni maka dapat menghambat pertumbuhan khamir uji.
16
Pewarnaan Gram dan Uji Parsial
Karakterisasi tambahan yang dilakukan pada isolat bakteri yang menghasilkan senyawa bioaktif yaitu dengan pewarnaan Gram. Isolat yang menghasilkan Gram positif dilanjutkan dengan identifikasi parsial yang merujuk ke kelompok Bacillus yaitu dengan pewarnaan spora dan uji katalase.
Analisis Molekuler Gen 16S rRNA
Isolasi Genom. 30 Isolat bakteri yang menunjukkan kemampuan antibakteri
dan antikhamir masing-masing ditumbuhkan pada media SWC dan diinkubasi shaker selama 24 jam, dengan komposisi media 5 gr/l bacto pepton, 1 gr/l yeast extract dan 3 ml/l glycerol. Isolat bakteri yang telah ditumbuhkan pada media SWC diambil sebanyak 1,5 ml dan disentrifugasi (18.000xg) selama 10 menit untuk mendapatkan pelet bakteri. Pelet ini digunakan untuk mengekstraksi DNA genom dengan metode standar (Sambrook & Russel 2001). Setelah disentrifugasi supernatannya dibuang dan ditambahkan ke dalamnya buffer Tris-EDTA (TE) sebanyak 250 μl, lalu disentrifugasi 8000 rpm selama 10 menit. Supernatannya dibuang dan dilakukan resuspensi dengan TE sebanyak 2 kali. Ditambahkan dengan 250 μl TE dan 5 μl lisozym, lalu tabung eppedorf dibolakbalik dan diinkubasi selama 30 menit pada suhu 37oC. Larutan TE dan lisozym dibuang, kemudian diganti 500 μl SDS 10% dan 10 μl proteinase K lalu tabung dibolakbalik dan diinkubasi selama 37oC selama 60 menit. Larutan SDS dan proteinase K diganti dengan 80 μl NaCl dan 100 μl CTAB 10% lalu diinkubasi selama 20 menit pada suhu 65oC. Setelah inkubasi larutan sebelumnya diganti dengan 650 μl PCl lalu dikocok kuat dan disentrifugasi 14000 rpm selama 10 menit. Bagian atas atau fase aquosenya dipindahkan ke tabung ependorf baru lalu ditambahkan 650 μl CI dan disentrifugasi 14000 rpm selama 10 menit. Larutan sebelumnya diganti dengan etanol absolut 2X vol; Na asetat 3 M 0,1 vol lalu diinkubasi frezeer selama semalam. Setelah diinkubasi semalam etanol 2X vol; Na asetat 3 M 0,1 vol diganti dengan etanol 70% dingin sebanyak 1 ml lalu disentrifuges 14000 rpm selama 15 menit. Supernatannya dibuang lalu pelet dikering udarakan selama semalam. Setelah dikering udarakan selama semalam pelet ditambahkan dengan ddH2O sebanyak 20 μl.
Amplifikasi Gen 16S rRNA dengan PCR. Amplfikasi gen 16S rRNA
digunakan (PCR Perkin Elmer 2400), dengan menggunakan primer 63f
(5’-CAGGCCTAACACATGCAAGTC-3’) dan 1387r
(5’-GGGCGGWGTGTACAAGGC-3’) (Marchesi et al 1998) yang akan memperbanyak fragmen pada target sekitar 1300 pb. Total volume reaksi yang digunakan adalah 25 μl, terdiri atas 12,5 μl 2x GC Buffer,4 μl dNTPs, masing-masing 1 μl primer 63f dan 1387r, 0,25 Taq polimerase, 4 μl DNA template dan 2,25 μl aquabidest steril. Kondisi PCR pada pra denaturasi pada suhu 95oC selama 5 menit; untuk siklus 30, denaturasi pada suhu 95oC selama 30 detik, anneling pada suhu 54oC selama 30 detik, polimerisasi pada suhu 72oC selama 30 detik dan post PCR pada suhu 72oC selama 7 menit. Produk PCR dapat diketahui dengan elektroforesis pada gel agarose 10% (wt/vol) selama 45 menit pada 70V/cm dengan TAE buffer 1X. Produk PCR selanjutnya dipurifikasi dengan menggunakan kit purifikasi (Promega, USA) sesuai dengan instruksi pemakaian.
Amplified Ribosomal DNA Restriction Analysis (ARDRA). Setiap hasil
purifikasi produk PCR gen 16S rRNA dipotong dengan menggunakan empat enzim restriksi yaitu RsaI, HaeIII, dan HinfI (Fermentas, Life Science). Volume reaksi tiap-tiap enzim restriksi terdiri atas 5 μl amplicon (1.5 μg), 2 μl buffer Tango 10X, 2 U/μl enzim restriksi, dan ddH2O hingga volume 20 μl, kemudian diinkubasi selama 3 – 4 jam pada suhu 37oC. Inaktivasi enzim dilakukan dengan menginkubasi pada suhu 65oC selama 20 menit. Produk restriksi selanjutnya dielektroforesis dengan menggunakan gel agarose 1% (wt/vol) selama 45 menit pada 70V/cm dalam buffer TAE 1X. fragmen-fragmen dari hasil pemotongan pita gen 16S rRNA tiap-tiap isolat dibuat data biner dan dianalisis menggunakan software Treecon pada windows ver1.3b (Van de Peer dan De Watcher 1994).
Sekuensing Gen 16S rRNA dan Analisis Filogenetik. Sekuensing gen 16S
rRNA dilakukan di PT Charoen Phokpand Indonesia, terhadap enam isolat terpilih (SAB E-8, SAB E-33, SAB E-35, SAB E-38, SAB E-40 dan SAB S-43) dengan menggunakan metode dideoksi Sanger. Analisis sekuen gen 16S rRNA dilakukan dengan program BlastN yang terdapat di NCBI (www.ncbi.nlm.nih.gov/BLAST/).
18
Sekuen gen 16S rRNA disejajarkan dengan menggunakan program clustalW (www.ebi.ac.uk/clustalw/). Konstruksi pohon filogenetik dilakukan dengan program Treecon 1,3b (Van de Peer dan De Watcher 1994).
Hasil
Isolasi Bakteri dari Sampel Spons
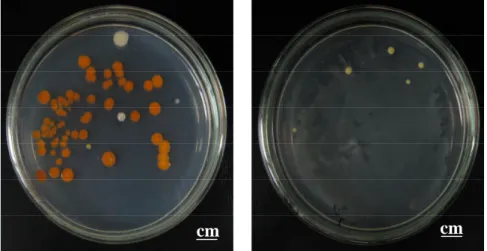
Hasil isolasi diperoleh 138 isolat bakteri masing-masing 70 isolat bakteri endofit dan 68 isolat bakteri permukaan, yang ditandai dengan warna dan bentuk koloni yang berbeda-beda (Gambar 3 dan 4). Seluruh isolat tersebut dikumpulkan lalu diamati warna dan morfologi koloninya. Profil koloni isolat endosimbion dan ektosimbion dapat dilihat pada Lampiran 1 dan 2. Pemberian nama isolat berdasarkan asal sampel dimana bakteri-bakteri tersebut diisolasi, SAB E-1 yang berarti Sponge – Assosiated Bacteria Endofit-1 (nomor urut isolat) yaitu bakteri yang diisolasi dari bagian endofit spons, serta SAB S-1 yang berarti Sponge – Assosiated Bacteria Surfaces-1 (nomor urut isolat) yaitu bakteri yang diisolasi dari bagian surfaces (permukaan) spons. Isolat-isolat bakteri endofit dan surface hasil isolasi diduga memiliki aktivitas antimikrob, yang selanjutnya dilakukan uji lanjut untuk mengetahui sifat antimikrobnya.
Penapisan Isolat Penghasil Senyawa Bioaktif (Antibakteri dan Antikhamir)
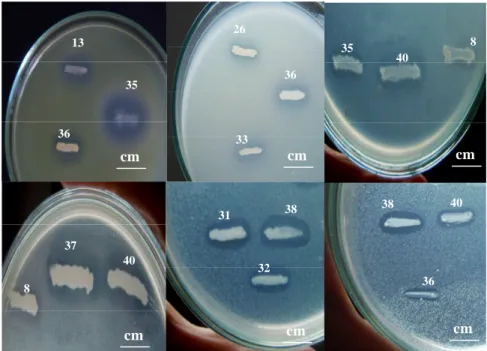
Penapisan ini dilakukan secara kualitatif dengan menggunakan dua kelompok mikroorganisme unicelluler target yaitu bakteri (prokariotik) dan khamir (eukariotik). Hasil penapisan menunjukkan beberapa isolat bakteri endofit dapat menghambat pertumbuhan bakteri target dan khamir target sekaligus, meskipun dengan kemampuan yang berbeda-beda. Isolat-isolat tersebut antara lain isolat SAB 8, SAB 31, SAB 32, SAB 33, SAB 35, SAB 36, SAB E-37, SAB E-38, SAB E-40, dan SAB E-41 (Tabel 1). Hasil uji aktivitas antibakteri isolat-isolat tersebut baik terhadap pertumbuhan bakteri uji maupun pertumbuhan khamir uji berupa zona bening yang terbentuk, masing-masing dapat dilihat pada Gambar 5 dan 6.
Pengujian aktivitas antibakteri dan antikhamir yang dilakukan pada isolat bakteri permukaan juga merupakan penapisan awal. Adanya aktivitas antibakteri dan antikhamir ditandai dengan terbentuknya zona bening disekitar goresan isolat bakteri permukaan. Hasil pengujian isolat bakteri permukaan dapat dilihat pada Tabel 2.
20
Gambar 3. Penampilan koloni bakteri ektosimbion hasil isolasi dari spons Jaspis sp pada Medium SWC, setelah diinkubasi selama 24 jam pada suhu 27oC.
Gambar 4. Penampilan koloni bakteri endosimbion hasil isolasi dari spons Jaspis sp pada Medium SWC, setelah diinkubasi selama 24 jam pada suhu 27oC.
cm cm
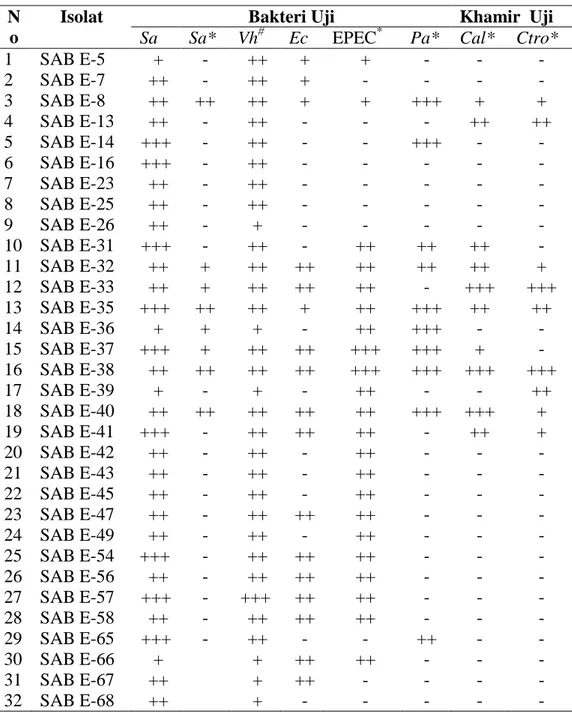
Tabel 1. Aktivitas antibakteri dan antikhamir isolat-isolat bakteri endofit asal spons Jaspis sp.
Bakteri Uji Khamir Uji N
o
Isolat
Sa Sa* Vh# Ec EPEC* Pa* Cal* Ctro*
1 SAB E-5 + - ++ + + - - -2 SAB E-7 ++ - ++ + - - - -3 SAB E-8 ++ ++ ++ + + +++ + + 4 SAB E-13 ++ - ++ - - - ++ ++ 5 SAB E-14 +++ - ++ - - +++ - -6 SAB E-16 +++ - ++ - - - - -7 SAB E-23 ++ - ++ - - - - -8 SAB E-25 ++ - ++ - - - - -9 SAB E-26 ++ - + - - - - -10 SAB E-31 +++ - ++ - ++ ++ ++ -11 SAB E-32 ++ + ++ ++ ++ ++ ++ + 12 SAB E-33 ++ + ++ ++ ++ - +++ +++ 13 SAB E-35 +++ ++ ++ + ++ +++ ++ ++ 14 SAB E-36 + + + - ++ +++ - -15 SAB E-37 +++ + ++ ++ +++ +++ + -16 SAB E-38 ++ ++ ++ ++ +++ +++ +++ +++ 17 SAB E-39 + - + - ++ - - ++ 18 SAB E-40 ++ ++ ++ ++ ++ +++ +++ + 19 SAB E-41 +++ - ++ ++ ++ - ++ + 20 SAB E-42 ++ - ++ - ++ - - -21 SAB E-43 ++ - ++ - ++ - - -22 SAB E-45 ++ - ++ - ++ - - -23 SAB E-47 ++ - ++ ++ ++ - - -24 SAB E-49 ++ - ++ - ++ - - -25 SAB E-54 +++ - ++ ++ ++ - - -26 SAB E-56 ++ - ++ ++ ++ - - -27 SAB E-57 +++ - +++ ++ ++ - - -28 SAB E-58 ++ - ++ ++ ++ - - -29 SAB E-65 +++ - ++ - - ++ - -30 SAB E-66 + + ++ ++ - - -31 SAB E-67 ++ + ++ - - - -32 SAB E-68 ++ + - - - -
-Sa :Staphylococcus aureus; -Sa* :Staphylococcus aureus; Vh#: Vibrio harveyii; Ec :Escherichia
coli; EPEC* K-11 :Escherichia coli; Pa* :Pseudomonas aeruginosa; Cal* :Candida albicans ; Ctro* :Candida tropicalis; *): Patogen manusia;#): Patogen udang: + :1 – 5 mm; ++ :6 – 10 mm ; +++ :11 – 15 mm; - : Tidak dihasilkan senyawa antimikrob.
22
Gambar 5. Senyawa antibakteri yang dihasilkan (terlihat dari zona bening yang terbentuk) dari beberapa isolat bakteri endofit asal spons Jaspis sp. terhadap pertumbuhan bakteri a. S. aureus, b. V. harveyii, c. E. coli, d. EPEC-K11, e. P. aeruginosa dan f. S. aureus.
Gambar 6. Senyawa antikhamir yang dihasilkan (terlihat dari zona bening yang terbentuk) dari isolat bakteri endofit asal spons Jaspis sp. SAB E-35 dan SAB E-38 terhadap pertumbuhan khamir a. C. albicans dan b. C. tropicalis. a b c d e f 35 13 36 36 38 40 33 26 36 35 40 8 37 8 40 38 31 32 cm cm cm cm cm cm a b cm cm 38 35 38 35
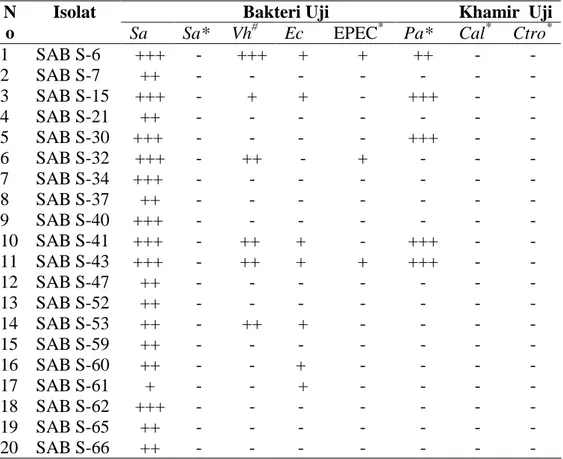
Tabel 2. Aktivitas antibakteri dan antikhamir isolat-isolat bakteri permukaan asal spons Jaspis sp.
Bakteri Uji Khamir Uji N
o
Isolat
Sa Sa* Vh# Ec EPEC* Pa* Cal* Ctro*
1 SAB S-6 +++ - +++ + + ++ - -2 SAB S-7 ++ - - - -3 SAB S-15 +++ - + + - +++ - -4 SAB S-21 ++ - - - -5 SAB S-30 +++ - - - - +++ - -6 SAB S-32 +++ - ++ - + - - -7 SAB S-34 +++ - - - -8 SAB S-37 ++ - - - -9 SAB S-40 +++ - - - -10 SAB S-41 +++ - ++ + - +++ - -11 SAB S-43 +++ - ++ + + +++ - -12 SAB S-47 ++ - - - -13 SAB S-52 ++ - - - -14 SAB S-53 ++ - ++ + - - - -15 SAB S-59 ++ - - - -16 SAB S-60 ++ - - + - - - -17 SAB S-61 + - - + - - - -18 SAB S-62 +++ - - - -19 SAB S-65 ++ - - - -20 SAB S-66 ++ - - -
-Sa :Staphylococcus aureus; -Sa* :Staphylococcus aureus; Vh#: Vibrio harveyii; Ec :Escherichia
coli; EPEC* K-11 :Escherichia coli; Pa* :Pseudomonas aeruginosa; Cal* :Candida albicans ; Ctro* :Candida tropicalis; *): Patogen manusia;#): Patogen udang: + :1 – 5 mm; ++ :6 – 10 mm ; +++ :11 – 15 mm; - : Tidak dihasilkan senyawa antimikrob
24
Beberapa isolat bakteri permukaan mampu menghambat beberapa pertumbuhan bakteri uji namun tidak satupun isolat bakteri permukaan mampu menghambat C. albicans dan C. tropicalis (Tabel 4). Isolat-isolat tersebut adalah SAB S-6, SAB S-15, SAB S-30, SAB S-32, SAB S-41 dan SAB S-43, dimana terdapat zona bening disekitar pertumbuhan isolat-isolat tersebut (Gambar 7). Pada Tabel 2 dan 3 menunjukkan semua isolat bakteri endofit dan permukaan tidak memperlihatkan adanya aktivitas dalam menghambat pertumbuhan terhadap bakteri B. subtillis.
Aktivitas antibakteri dari semua isolat bakteri endofit dan permukaan terhadap pertumbuhan bakteri E. coli dan EPEC*-K11, hampir semuanya membutuhkan waktu yang lama hingga terbentuk zona bening. Waktu inkubasi yang dibutuhkan hingga terbentuk zona bening rata-rata adalah 5 x 24 jam.
Pewarnaan Gram dan Uji parsial
Pewarnaan Gram dan uji parsial dilakukan hanya pada beberapa isolat yang memiliki aktivitas yang baik dalam menghambat pertumbuhan bakteri dan khamir target. Isolat-isolat tersebut adalah SAB E-8, SAB E-33, SAB E-35, SAB E-38, SAB E-40 dan SAB S-43 karena mampu menghambat minimal lima mikroba uji dengan kemampuan penghambatan yang baik. Pewarnaan Gram menunjukkan isolat SAB E-8, SAB E-35, dan SAB E-40 adalah bakteri kelompok Gram negatif (Gambar 8). Hasil pewarnaan Gram positif pada isolat SAB E-33, SAB E-38, dan SAB S-43 dilanjutkan dengan uji parsial.
Gambar 7. Senyawa antibakteri yang dihasilkan (terlihat dari zona bening yang terbentuk) dari beberapa bakteri permukaan asal spons Jaspis sp. terhadap pertumbuhan a. S. aureus, b. V. harveyii dan c. P. aeruginosa.
Gambar 8. A. Profil koloni pada media SWC dan B. Hasil pewarnaan bakteri Gram negatif isolat SAB E-35.
Identifikasi parsial yang mengarahkan isolat yang memiliki gram positif adalah dari kelompok Bacillus meliputi pewarnaan Gram, pewarnaan spora dan uji katalase (Gambar 9).
Gambar 9. Uji parsial genus Bacillus untuk isolat bakteri gram positif (SAB S-43); A. Profil koloni pada media SWC; B. Pewarnaan Gram; C. Pewarnaan Spora. a b c cm cm cm 6 43 41 41 43 15 41 6 43 a. b. cm (A) (B) a. b. c. Endospora cm (A) (B) (C)
26
Amplified Ribosomal DNA Restriction Analysis (ARDRA)
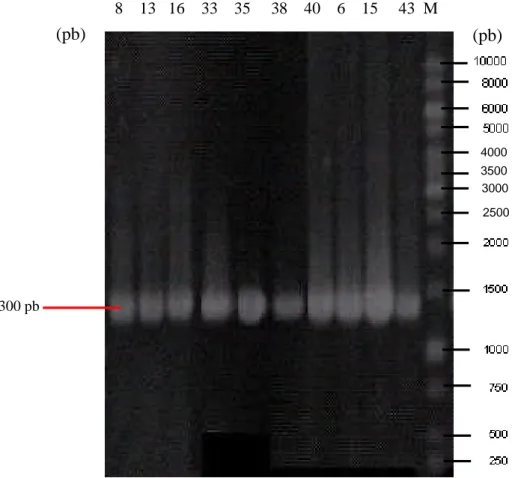
Berdasarkan hasil uji antimikroba, diperoleh 30 isolat yang memiliki aktivitas antimikroba yang terdiri dari 24 isolat bakteri endofit dan 6 isolat bakteri yang berasal dari permukaan. Isolat yang terpilih akan digunakan untuk mengetahui hubungan kekerabatan antar bakteri dengan metode ARDRA. Ekstraksi genom seluruh isolat dilanjutkan dengan amplifikasi gen 16S rRNA dengan PCR yang menunjukkan produk PCR gen 16S rRNA sekitar 1300pb (Gambar 10)
Gen 16S rRNA hasil amplifikasi PCR didigesti dengan tiga enzim restriksi yaitu RsaI, HaeIII dan HinfI. Hasil restriksi memperlihatkan pola pita gen 16S rRNA (profil) yang beragam dengan jumlah 2 – 4 pita. Hasil restriksi gen 16S rRNA dari beberapa isolat yang dipotong dengan RsaI, HaeIII dan HinfI dapat dilihat pada Gambar 11, sedangkan hasil interpretasi profil pola pemotongan untuk ke 30 isolat dengan ARDRA memperlihatkan lebih banyak variasi pola dan jumlah pita berdasarkan enzim restriksi yang digunakan, yaitu RsaI (Gambar 12), HaeIII (Gambar 13) dan HinfI (Gambar 14).
Berdasarkan profil gen 16S rRNA tersebut, dibuat pohon filogenetik untuk melihat kelompok filotipe dari seluruh isolat terbaik. Hasil restriksi gen 16S rRNA dengan tiga enzim restriksi dipadukan dan ditransfer menjadi sebuah hitungan biner (nilai 1 dan 0) berdasarkan keberadaan pita potongan DNA pada ukuran panjang tertentu (Tabel 3). Data biner ini mempermudah dalam pembuatan pohon filogenetik. Konstruksi pohon filogenetik dilakukan dengan menggunakan program Treecon versi 1.3b (Gambar 15.)
Gambar 10. Amplifikasi gen 16S rRNA dari beberapa isolat yang memiliki aktivitas antimikrob terbaik, M: standar ukuran molekul DNA 1kb ladder. 8 13 16 33 35 38 40 6 15 43 M 1300 pb 4000 3500 3000 2500 (pb) (pb)
28
Gambar 11. Elektroforesis gel agarose gen 16S rRNA dari beberapa isolat bakteri asal spons Jaspis sp. yang mempunyai aktivitas antimikroba terbaik yang dipotong dengan Enzim RsaI (A), HaeIII (B) dan HinfI (C). M: standar ukuran molekul DNA (1kb ladder).
(A) (B) (C) M 8 13 16 31 37 47 56 58 59 65 66 6’ 15’ M RsaI 1500 1000 750 500 250 (pb) 1500 1000 750 500 250 (pb) M 8 13 16 31 37 47 56 58 59 65 66 6’ 15’ M HaeIII 1500 1000 750 500 250 (pb) 1500 1000 750 500 250 (pb) M 8 13 16 31 37 47 56 58 59 65 66 6’ 15’ M HinfI 1500 1000 750 500 250 (pb) 1500 1000 750 500 250 (pb)
Gambar 12. Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan spons Jaspis sp. yang dipotong dengan enzim restriksi RsaI . SAB E-8 SAB E-13 SAB E-14 SAB E-16 SAB E-23 SAB E-25 SAB E-26 SAB E-31 SAB E-32 SAB E-33 SAB E-35 SAB E-36 SAB E-37 SAB E-38 SAB E-40 SAB E-41 SAB E-47 SAB E-54 SAB E-56 SAB E-58 SAB E-59 SAB E-65 SAB E-66 SAB E-67 SAB S-6 SAB S-15 SAB S-30 SAB S-32 SAB S-41 SAB S-43
30
Gambar 13. Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan spons Jaspis sp. yang dipotong dengan enzim restriksi HaeIII. SAB E-8 SAB E-13 SAB E-14 SAB E-16 SAB E-23 SAB E-25 SAB E-26 SAB E-31 SAB E-32 SAB E-33 SAB E-35 SAB E-36 SAB E-37 SAB E-38 SAB E-40 SAB E-41 SAB E-47 SAB E-54 SAB E-56 SAB E-58 SAB E-59 SAB E-65 SAB E-66 SAB E-67 SAB S-6 SAB S-15 SAB S-30 SAB S-32 SAB S-41 SAB S-43
Gambar 14. Profil gen 16S rRNA dari 30 isolat bakteri yang berasosiasi dengan spons Jaspis sp. yang dipotong dengan enzim restriksi HinfI. SAB E-8 SAB E-13 SAB E-14 SAB E-16 SAB E-23 SAB E-25 SAB E-26 SAB E-31 SAB E-32 SAB E-33 SAB E-35 SAB E-36 SAB E-37 SAB E-38 SAB E-40 SAB E-41 SAB E-47 SAB E-54 SAB E-56 SAB E-58 SAB E-59 SAB E-65 SAB E-66 SAB E-67 SAB S-6 SAB S-15 SAB S-30 SAB S-32 SAB S-41 SAB S-43
32
Tabel 3. Ukuran fragmen DNA gen 16S rRNA yang dipotong dengan beberapa enzim restriksi
Ukuran fragmen DNA (pb) yang dipotong dengan enzim restriksi
Isolat
RsaI HaeIII HinfI
SAB E-8 520;420;420 630;460;260 600;380;290 SAB E-13 520;440;410 640;470;270 600;380;290 SAB E-14 600;350;350 640;500;300 950;500 SAB E-16 520;440;410 640;470;280 610;390;300 SAB E-23 600;350;350 650;500;300 940;500 SAB E-25 600;350;350 750;330;200 1020;530 SAB E-26 600;350;350 650;500;300 1000;500 SAB E-31 540;440;540 650;490;320 610;400;310 SAB E-32 540;440;540 650;500;300 950;500 SAB E-33 600;350;350 490;350;320;150 600;500;340 SAB E-35 550;500;300 550;400;200 800;490 SAB E-36 550;500;300 640;490;290 800;490 SAB E-37 540;440;540 650;490;320 620;400;310 SAB E-38 510;460;460 610;510;330 600;410;350 SAB E-40 510;480;430 550;350;250;150 600;400;340 SAB E-41 510;480;430 550;350;250;150 600;400;340 SAB E-47 540;460;420 650;490;280 620;390;300 SAB E-54 510;480;450 550;360;250;150 600;400;350 SAB E-56 530;460;410 550;370;320;150 650;500;300 SAB E-58 530;450;410 550;370;200;150 650;400;290 SAB E-59 530;450;410 550;370;200;150 650;400;290 SAB E-65 530;430;430 650;490;320 610;380;290 SAB E-66 520;420;420 640;470;280 590;370;270 SAB E-67 510;480;430 550;360;250;150 600;400;350 SAB S-6 520;420;420 640;470;280 590;370;280 SAB S-15 520;420;420 640;470;270 590;370;280 SAB S-30 510;460;460 610;500;320 600;400;350 SAB S-32 510;460;460 610;500;320 600;400;350 SAB S-41 510;450;450 600;500;320 590;400;350 SAB S-43 510;450;450 600;500;320 590;400;350
Gambar 15. Pohon filogenetik (internode rooted) hubungan kekerabatan antar isolat bakteri yang berasosiasi dengan spons Jaspis sp. dengan aktivitas antimikrob terbaik yang dianalisis dengan ARDRA dan dikonstruksi berdasarkan metode Neighbor-Joining. Angka 10% pada bagian atas pohon menunjukkan skala persentase perbedaan (distance scale) antar profil isolat bakteri. Angka pada nodus adalah nilai bootstrap dengan 100 ulangan.
Filotipe VII Filotipe VI Filotipe V Filotipe IV Filotipe III Filotipe I Filotipe II
34
Hasil konstruksi pohon filogenetik berdasarkan ARDRA menghasilkan tujuh filotipe. Pengelompokan tersebut berdasarkan adanya kesamaan situs pemotongan tiap isolat setelah dipotong dengan tiga enzim restriksi yang berbeda. Filotipe V adalah kelompok yang paling besar yaitu terdiri dari 9 isolat sedangkan filotipe VII hanya terdiri dari satu isolat saja, yaitu isolat SAB E-8.
Analisis Sekuens Gen 16S rRNA
Analisis ini dilakukan terhadap enam isolat yang memiliki aktivitas antimikrob terbaik, yaitu SAB E-8, SAB E-33, SAB E-35, SAB E-38, SAB E-40 dan SAB S-43. Hasil BlasN menunjukkan tidak ada dominasi spesies dengan identitas maksimum untuk semua isolat berada diatas 97% dan nilai E yang dihasilkan semua isolat pada hasil BlastN bernilai 0 (Tabel 4). Sekuensing gen 16S rRNA menunjukkan keenam isolat terbaik terbagi menjadi dua genus yaitu Pseudomonas (isolat SAB E-8, SAB E-35, SAB E-40 ) dan Bacillus (isolat SAB E-33, SAB E-38, dan SAB S-43). Hasil pohon filogenetik menggunakan data sekuen gen penyandi 16S rRNA isolat dengan aktivitas antimikrob terbaik dan beberapa galur acuan (reference strains) menunjukkan adanya kemiripan. SAB-35 berdekatan secara evolusi dengan Pseudomonas sp. J451, dengan nilai boostrap 56% dan tidak berada dalam satu kelompok dengan isolat lainnya. Lima isolat lainnya berada dalam satu kelompok yang sama, serta memiliki kedekatan dengan beberapa galur acuan yaitu SABS-43 dan SABE-33 dengan Bacillus sp. EGU72 sedangkan SAB E-38 dengan Bacillus sp. D203 (Gambar 16).
35
Kode Isolat Kemiripan Identitas maksimum No Akses
SAB E-8 Pseudomonas sp. HN-07 98% FJ919375.1
SAB E-33 Bacillus sp. strain K3 98% EU266581.1
SAB E-35 Pseudomonas sp. LPK2 97% GQ217532.1
SAB E-38 Bacillus pumilus strain 210-50 99% GQ199752.1
SAB E-40 Pseudomonas sp.LD116 98% AM913904.1
36 Gambar 16. Pohon filogenetik berdasarkan hasil sekuensing gen 16S rRNA enam isolat bakteri dengan aktivitas antimikrob terbaik asal
spons Jaspis sp. yang dikonstruksi berdasarkan metode Neighbor-Joining. Angka 10% pada bagian atas pohon menunjukkan skala persentase perbedaan (distance scale) antar profil isolat bakteri. Angka pada nodus adalah nilai bootstrap dengan 100 replikasi.
SAB E-08
SAB E-40
Bacillus pumilus GSP61AY505512 Bacillus pumilus BBT84 Bacillus subtilis D203 SAB E-33 SAB E-38 SAB S-43 Bacillus sp. EGU724 Bacillus sp. T050418-863 Pseudomonas sp. D116 Bacillus subtilis W102 Bacillus subtilis W51 Bacillus subtilis 13-2 P. tunicata U11 P. phenolica Vibrio sp. F-6 Pseudomonas sp. 79 SAB E-35 Pseudomonas sp. J451 Amylocopsis arifamicina DSM4695
Pembahasan
Isolasi dan Bentuk Asosiasi Bakteri dan Spons
Spons adalah organisme sesil yang menghasilkan senyawa metabolik untuk mengendalikan predator, kompetitor, organisme fouling, dan mikroba. Namun menariknya, pada beberapa penelitian diketahui bahwa sejumlah senyawa metabolik tersebut dihasilkan oleh mikroorganisme yang berasosiasi dengan spons inangnya. Penelitian ini merupakan salah satu upaya untuk mengetahui keberadaan dan potensi bakteri yang diisolasi dari spons Jaspis sp. dalam menghambat pertumbuhan beberapa bakteri dan khamir patogen. Penelitian sebelumnya Rachid et al. (2006) berhasil mengisolasi deltaproteobakteri yaitu Chondromyces crocatus yang memiliki struktur kimia yang sama dengan Jaspamide yang dihasilkan oleh spons Jaspis sp. (Zampella et al. 1999).
Pada penelitian ini diperoleh 138 isolat bakteri hasil isolasi yang memiliki potensi penghasil senyawa antimikrob yang berasosiasi dengan spons Jaspis sp., yaitu 70 isolat yang diisolasi pada bagian endofit dan 68 isolat pada bagian permukaan. Bakteri yang berasosiasi dengan spons tersebut dapat berasal dari lingkungan perairan dimana spons berada atau merupakan mikrobial simbion spons pada saat masih tahap larva. Bakteri sebagai simbion dari spons dapat berperan sebagai sumber makanan, patogen atau parasit dan sebagai simbion mutualistik. Salah satu bentuk simbion mutualisme antara bakteri dan spons ditunjukkan dengan adanya produksi senyawa golongan Quinolon yang memiliki aktivitas antimikrobial dan cytotoksin oleh bakteri
Pseudomonas sp. yang berasosiasi dengan spons Homophinia sp. yang berasal dari
lautan pasifik (Burja et al. 1999).
Isolat bakteri dengan aktivitas antimikroba yang berada pada bagian permukaan dan mesohyl (endofit) diduga adalah bakteri yang memiliki bentuk asosiasi dengan spons Jaspis sp. Bentuk asosiasi antara spons dan bakteri dapat terjadi dengan dua cara yaitu transmisi secara horizontal dan vertikal. Transmisi horizontal merupakan bentuk asosiasi spons dengan bakteri yang berada disekitar habitat spons akibat proses filteer feeding. Transmisi vertikal adalah bentuk asosiasi antara bakteri dan spons saat spons berada pada tahap larva. Mekanisme vertikal