SKRIPSI
SINTESIS
N
-(3-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA DAN
N
-(4-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA
DENGAN METODA YAMAGUCHI
FIRST AMBAR WATI NRP. 1412 100 087
Dosen Pembimbing
Prof. Mardi Santoso, Ph.D.
JURUSAN KIMIA
Fakultas Matematika Dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Surabaya 2016
FINAL PROJECT
SYNTHESIS OF
N
-(3-BROMOPHENYL)PIRAZINE-2-CARBOXAMIDE AND
N
-(4-BROMOPHENYL)PIRAZINE-2-CARBOXAMIDE
USING YAMAGUCHI METHOD
FIRST AMBAR WATI NRP. 1412 100 087
Supervisor
Prof. Mardi Santoso, Ph.D.
CHEMISTRY DEPARTMENT
Faculty of Mathematics and Natural Sciences Sepuluh Nopember Institute of Technology Surabaya
2016
iii
SINTESIS
N
-(3-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA DAN
N
-(4-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA
DENGAN METODA YAMAGUCHI
SKRIPSI
Disusun sebagai Syarat untuk Memperoleh Gelar Sarjana pada Program Studi S-1 Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Surabaya
Oleh :
First Ambar Wati
NRP. 1412 100 087
Surabaya, 12 Februari 2016
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER
viii
KATA PENGANTAR
Alhamdulillah, puji syukur ke hadirat ALLAH SWT yang telah memberikan taufik, serta hidayahNya sehingga Tugas Akhir yang berjudul “SINTESIS N
-(3-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA DAN N
-(4-BROMOFENIL)PIRAZINA-2-KARBOKSAMIDA DENGAN
METODA YAMAGUCHI” dapat diselesaikan. Penulis
mengucapkan terima kasih kepada:
1. Prof. Mardi Santoso, Ph.D, selaku dosen pembimbing atas waktu, bimbingan, motivasi, nasehat, dan semua ilmu yang bermanfaat selama penyusunan Tugas Akhir. 2. Prof. Dr. Taslim Ersam, selaku Kepala Laboratorium
Kimia Bahan Alam dan Sintesis Jurusan Kimia FMIPA ITS atas bantuan, arahan, motivasi, dan nasehat selama Tugas Akhir.
3. Prof. Dr. Didik Prasetyoko, M.Sc selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam ITS.
4. Dr.Ir. Endah Mutiara Marhaeni Putri, M.Si selaku dosen wali yang telah memberikan bantuan, arahan, dan semangatnya selama masa perkuliahan di Jurusan Kimia FMIPA ITS.
5. Lidya Tumewu, M.Farm, Apt. dari Institute of Tropical Disease (ITD) Universitas Airlangga atas bantuan analisa dengan Spektrofotometer NMR.
6. Kaliawan, S.T., dari Jurusan Teknik Kimia Politeknik Negeri Malang atas bantuan analisa Spektrometer Massa (ESI).
7. Ibu, Kakek, Nenek, Adik dan keluarga atas dukungan,
do’a serta semangat yang tiada henti.
ix
menyayangi saya yang tidak dapat saya sebutkan satu per satu. Terima kasih atas segala bentuk perhatian, do’a, bantuan dan semangatnya dalam membantu penulis selama penyusunan naskah Skripsi.
9. Teman-teman yang telah berjuang bersama sejak masuk kuliah, SPECTRA, terima kasih karena tetap bersama, selalu menyemangati, saling mendoakan dan sebagainya. 10. Berbagai pihak yang membantu pelaksanaan dan
penyusunan Tugas Akhir ini.
Penulis menyadari Tugas Akhir ini jauh dari kesempurnaan. Penulis sangat mengharapkan saran dan kritik yang bersifat membangun. Harapan penulis, semoga Tugas Akhir ini mampu memberikan konstribusi bagi perkembangan ilmu pengetahuan serta memberi inspirasi bagi pembaca untuk pengembangan lebih lanjut.
Surabaya, 12 Februari 2016
x
DAFTAR ISI
HALAMAN JUDUL i
HALAMAN PENGESAHAN
iv
ABSTRAK vi
ABSTRACT vii
KATA PENGANTAR
viii
DAFTAR ISI x
DAFTAR GAMBAR xii
DAFTAR TABEL
xiv
DAFTAR LAMPIRAN
xv
BAB I. PENDAHULUAN 1
1.1 Latar belakang 1
1.2 Perumusan masalah 5
1.3 Tujuan penelitian 6
BAB II. TINJAUAN PUSTAKA 7
2.1 Asam pirazina-2-karboksilat (15) 7 2.2 2,4,6-Triklorobenzoil klorida (13) 7
2.3 4-Dimetilaminopiridin (14) 8
2.4 Trietilamina (21) 8
2.5 3-Bromoanilina (16) 9
2.6 4-Bromoanilina (17) 9
2.7 Tetrahidrofuran 9
2.8 Pirazina-2-karboksamida (3) 9
2.9 Pemisahan dan pemurnian hasil sintesis 10 2.10 Identifikasi struktur hasil sintesis 12
2.10.1 Spektroskopi Inframerah 12
xi
BAB III. METODOLOGI 19
3.1 Alat dan bahan 19
3.1.1 Alat 19
3.1.2 Bahan 19
3.2 Prosedur penelitian 20
3.2.1 Sintesis N-(3-bromofenil)pirazina-2-
karboksamida (18)
20 3.2.2 Sintesis N-(4-bromofenil)pirazina-2-
karboksamida (19)
21BAB IV. PEMBAHASAN 23
4.1 Sintesis N-(3-bromofenil)pirazina-2-karboksamida
(18) 23
4.2 Sintesis N-(4-bromofenil)pirazina-2-karboksamida
(19) 33
BAB V. KESIMPULAN DAN SARAN 43
5.1 Kesimpulan 43
5.2 Saran 43
DAFTAR PUSTAKA 45
LAMPIRAN 51
xii
DAFTAR GAMBAR
Gambar 1.1 Sintesis turunan pirazina-5-kloro-2-karboksamida (10-12)
4 Gambar 2.1 Sintesis 2,4,6-triklorobenzoil klorida (13) 8 Gambar 2.2 Sintesis 5-kloro-N-(klorofenil)pirazina-2-
karboksamida (22)
10 Gambar 2.3 Skema alat spektrometer NMR 16 Gambar 2.4 Diagram penyemprotan larutan pada MS
(ESI) 17
Gambar 4.1 Hasil pemantauan dengan KLT sintesis N-(3- bromofenil)pirazina-2-karboksamida (18)
23 Gambar 4.2 Hasil pemantauan dengan KLT sintesis N-(3-
bromofenil)pirazina-2-karboksamida (18), setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP
(14) dan 2,3,4-trikklorobenzoil klorida (13)
yang pertama.
24
Gambar 4.3 Hasil pemantauan KLT sintesis N-(3-
bromofenil)pirazina-2-karboksamida (18)
setelah setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP
(14) dan 2,3,4-trikklorobenzoil klorida (13)
yang kedua.
25
Gambar 4.4 Hasil uji KLT hasil pemurnian N-(3-
bromofenil)pirazina-2-karboksamida (18)
dengan kromatografi kolom gravitasi
26
Gambar 4.5 Hasil uji kemurniann N-(3-bromofenil)pirazina-2-karboksamida (18)
hasil sintesis
26
Gambar 4.6 Spektra 1H NMR N-(3-bromofenil)pirazina-2-karboksamida (18) hasil sintesis
menggunakan katalis asam sulfat
28
Gambar 4.7 Spektra 13C NMR N-(4-bromofenil)pirazina-2-karboksamida (18) hasil sintesis
xiii
karboksamida (18) hasil sintesis
Gambar 4.9 Spektra massa N-(3-bromofenil)pirazina-2- karboksamida (18) hasil sintesis
31 Gambar 4.10 Mekanisme reaksi pembentukan
N-fenilpirazina-2-karboksamida (18-19)
32 Gambar 4.11 Hasil pemantauan dengan KLT sintesis N-(4-
bromofenil)pirazina-2-karboksamida (19)
33 Gambar 4.12 Hasil pemantauan dengan KLT sintesis N-(4-
bromofenil)pirazina-2-karboksamida (19), setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP
(14) dan 2,3,4-trikklorobenzoil klorida (13)
yang pertama
34
Gambar 4.13 Hasil pemantauan dengan KLT sintesis N-(4- bromofenil)pirazina-2-karboksamida (19), setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP
(14) dan 2,3,4-trikklorobenzoil klorida (13)
yang kedua
Gambar 4.15 Spektra 1H NMR N-(4-bromofenil)pirazina-2-karboksamida (19) hasil sintesis
37 Gambar 4.16 Spektra 13C NMR
N-(4-bromofenil)pirazina-2-karboksamida (19) hasil sintesis
38 Gambar 4.17 Spektra IR N-(4-bromofenil)pirazina-2-
karboksamida (19) hasil sintesis
40 Gambar 4.18 Spektra massa
N-(4-bromofenil)pirazina-2-karboksamida (19) hasil sintesis
xiv
DAFTAR TABEL
Tabel 1.1
Nilai MIC (µg/mL) (µmol/L) senyawa
(11) dan (12) terhadap Mycobaceterium
tuberculosis H37RV
4
Tabel 2.1 Data Serapan IR 13
Tabel 2.2 Data Pergeseran Kimia pada 1H-NMR 15 Tabel 2.3 Data Pergeseran Kimia pada 13C-NMR 15 Tabel 4.1
Perbandingan data
1H-NMR senyawa
hasil sintesis (18-19)
39 Tabel 4.2
Perbandingan data
13C-NMR senyawa
hasil sintesis (18-19)
39
xv
DAFTAR LAMPIRAN
A.Skema kerja 51
1.
Sintesis
N-(3-bromofenil)pirazina-2-karboksamida (18)
512.
Sintesis
N-(4-bromofenil)pirazina-2-karboksamida (19)
53B. Perhitungan 55
1.
Sintesis
N-(3-bromofenil)pirazina-2-karboksamida (18)
552.
Sintesis
N-(4-bromofenil)pirazina-2-karboksamida (19)
561
BAB I PENDAHULUAN 1.1 Latar Belakang
Tuberkulosis (TB) adalah penyakit menular yang disebabkan oleh Mycobacterium tuberculosis dan merupakan salah satu ancaman global (Kratky dkk, 2013). Bakteri ini dapat menyerang beberapa organ, terutama paru-paru (Kementerian Kesehatan Republik Indonesia, 2015). Organisasi Kesehatan Dunia (WHO) (2014) menyatakan bahwa diperkirakan ada 9 juta penderita tuberkulosis, 1,5 juta meninggal dan 360 ribu di antaranya adalah penderita HIV. Kasus tuberkulosis terbesar ditemukan di Asia yakni sekitar 56%. Indonesia menduduki peringkat ke lima didunia dengan jumlah penderita tuberkulosis sebesar 410.000-520.000 dan jumlah kematian sebesar 36.000 pada tahun 2013. Menteri Kesehatan RI menyatakan bahwa Indonesia memiliki kemajuan luar biasa dalam pengelolaan program pengendalian TB yang efektif, yakni sejak strategi penggunaan DOTS (Directly Observed Treatment Short-course) atau strategi pengobatan jangka pendek dengan tingkat keberhasilan pengobatan TB lebih dari 90% dan tingkat deteksi kasus TB baru di atas 70% yang secara konsisten telah tercapai (Departemen Kesehatan, 2013). Strategi DOTS berisi lima komponen yang dua diantaranya menunjukkan pengobatan dengan menggunakan Obat Anti Tubekulosis (OAT) (PMK RI, 2013)
3
bekerja dalam lingkungan asam dan memiliki sinergi yang baik dengan rifampicin (1) (Dolezal dkk, 2011).
Servusova dkk (2013) berhasil mensintesis senyawa-senyawa anti TBC dengan bahan dasar asam 5-hidroksipirazina-2-karboksilat (7) sebagaimana dapat dilihat pada Gambar 1.1. Reaksi asam 5-hidroksipirazina-2-karboksilat (7) dengan tionil klorida diperoleh asil klorida (8), yang direaksikan dengan nukleofil amina (9-10) dan trietilamina dalam aseton sehingga diperoleh pirazina-5-kloro-2-karboksamida (11-12). Reaksi berjalan dalam dua tahap. Hasil menunjukkan bahwa N
-fenilpirazina-2-karboksamida (11) memiliki aktifitas antimikobakterial yang lebih tinggi bila dibandingkan dengan N
-benzilpirazina-2-karboksamida (12). N- (4-bromofenil)-5-kloropirazina-2-karboksamida (11f) memiliki MIC 3,13 µg/mL sedangkan N-(4-bromobenzil)-5-kloropirazina-2-karboksamida
(12f) memiliki MIC 12,5 µg/mL. Selain itu, adanya subtituen bromo pada N-(4-bromofenil)-5-kloropirazina-2-karboksamida
(11f) dan N-(4-bromobenzil)-5-kloropirazina-2-karboksamida
N
Gambar 1.1 Sintesis turunan pirazina-5-kloro-2-karboksamida (11-12)
Tabel 1.1 Nilai MIC (µg/mL) (µmol/L) senyawa (11) dan (12) terhadap Mycobaceterium tuberculosis H37RV Senyawa MIC (µg/mL)
5
reaksi antara asam karboksilat, tiol, trietilamina, pereaksi Yamaguchi (13) dan DMAP (14).
Sebagai kesinambungan dari percobaan sebelumnya untuk pengembangan senyawa-senyawa anti tuberkulosis, dilakukan pengembangan sintesis senyawa-senyawa berdasarkan modifikasi struktur PZA (3). Pada penelitian ini, asam pirazina-2-karboksilat (15) diubah menjadi anhidrida menggunakan 2,4,6-triklorobenzoil klorida (pereaksi Yamaguchi) (13) karena harganya yang lebih murah dibandingkan tionil klorida yang cukup mahal. Pereaksi ini tetap efektif dalam pembentukan anhidrida yang kereaktifannya hampir sama dengan asil klorida
(8). Anhidrida kemudian direaksikan dengan senyawa turunan anilina, yakni 3-bromoanilina (16), 4-bromoanilina (17) dengan katalis 4-dimetilaminopiridina (14). Produk yang dihasilkan merupakan senyawa N-(3-bromofenil)pirazina-2-karboksamida
(18) dan N-(4-bromofenil)pirazina-2-karboksamida (19) dan yang dapat digunakan sebagai obat anti tuberkulosis.
Cl
Berdasarkan uraian di atas maka permasalahan yang diangkat dalam penelitian adalah apakah pirazina-2-karboksamida
asam pirazina-2-karboksilat (15) dengan menerapkan metode Yamaguchi?
1.3 Tujuan Penelitian
7
BAB II
TINJAUAN PUSTAKA
2.1 Asam pirazina-2-karboksilat (15)
Asam pirazina-2-karboksilat (15) berbentuk serbuk padat putih tidak berbau, memiliki rumus molekul C5H4N2O2. Senyawa ini juga dikenal dengan nama asam pirazinoat. Asam pirazina-2-karboksilat (15) memiliki massa molekul 124,1 g/mol dan titik leleh 222-225ºC (Fishersci, 2015).
Asam pirazina-2-karboksilat (15) berperan sebagai senyawa antimikrobia intraselular aktif (Zimic dkk, 2012). Zhang dkk (2003) melaporkan bahwa asam pirazina-2-karboksilat (15)
merupakan asam lemah (pKa 2,9) yang bertindak sebagai senyawa yang menghancurkan membran bakteri (Lu dkk, 2011; Fernandes dkk, 2014).
2.2 2,4,6-Triklorobenzoil klorida (13)
2,4,6-Triklorobenzoil klorida (13) berbentuk cairan berwarna kuning dengan massa molekul relatif 243,89 g/mol, titik didih 107-108ºC, dan massa jenis 1,561 g/cm3. Senyawa ini larut dalam hampir semua pelarut organik (Ewin dan Pertusati, 2013). 2,4,6-Triklorobenzoil klorida (13) digunakan pertama kali oleh Yamaguchi dkk (1979) untuk mensintesis laktona cincin besar sehingga senyawa ini dikenal dengan pereaksi Yamaguchi. Kawanami dkk (1981) mensintesis S-ester tiokarboksilat yang melibatkan pereaksi Yamaguchi, asam karboksilat, tiol, trietilamina dan DMAP (14). Dhimitruka dan Santalucia Jr. (2005) selanjutnya melaporkan pemanfaatan reaksi Yamaguchi untuk sintesis inhibitor asam aspartat Lux-S.
Seebach dan Sutter (1983) melaporkan bahwa pereaksi Yamaguchi (13) dapat disintesis dari 1,3,5-triklorobenzena (20)
Cl
Gambar 2.1 Sintesis 2,4,6-triklorobenzoil klorida (13) 2.3 4-Dimetilaminopiridin (14)
4-Dimetilaminopiridin atau DMAP (14) berbentuk padatan kristal putih dengan massa molekul relatif sebesar 122,17 g/mol. Senyawa ini memiliki rumus molekul C7H10N2, titik didih 162ºC, dan titik leleh 110ºC (Sciencelab, 2013).
DMAP (14) merupakan basa nukleofilik (pKa 9,70) yang 10.000 lebih aktif dalam mempercepat reaksi asilasi dibandingkan piridina (pKa 5,29), karena gugus dimetilamino (Hofle dkk, 1978). DMAP (14) mudah didapat dengan harga yang terjangkau, Sehingga DMAP (14) secara luas digunakan sebagai katalis (Berry dkk, 2001).
2.4 Trietilamina (21)
Trietilamina atau TEA (21) berbentuk cairan jernih yang berbau sangat kuat. Senyawa dengan rumus molekul (CH3CH2)3N ini memiliki massa molekul relatif sebesar 101,1 g/mol dengan titik didih dan titik leleh adalah 89,7ºC dan -115ºC. Trietilamina
9
N
(21)
2.5 3-Bromoanilina (16)
3-Bromoanilina (16) berbentuk cairan jernih hingga berwarna kuning. Massa molekul relatif 3-bromoanilina (16)
adalah 172,03 g/mol, titik didih dan titik leleh 3-bromoanilina
(16) adalah 251ºC dan 17ºC. Senyawa ini tidak larut dalam air tetapi larut dalam eter dan alkohol (Spectrumchemical, 2014).
2.6 4-Bromoanilina (17)
4-Bromoanilina (17) berbentuk padatan kristal berwarna putih dan berbau agak manis (sweetish). Massa molekul relatif dan titik leleh 4-bromoanilina (17) adalah 172,03 g/mol dan 66ºC. Senyawa ini tidak larut dalam air dingin (Sciencelab, 2013).
2.7 Tetrahidrofuran
Tetrahidrofuran (THF) memiliki rumus molekul C4H8O dan massa molekul relatif 72,11 g/mol. THF berbentuk cairan jernih dan berbau seperti eter atau fruity. Titik didih dan massa jenis THF adalah 65ºC dan 0,8892 g/cm3 (Sciencelab, 2013). THF merupakan pelarut ramah lingkungan yang relatif tidak beracun dan larut dalam air dalam kondisi tertentu (Cai, 2013).
2.8 Pirazina-2-karboksamida (3)
Pirazina (6) adalah salah satu senyawa heterosiklik yang merupakan basa lemah dibandingkan dengan piridina akibat efek induksi atom nitrogen yang kedua. Beberapa turunan pirazina (6)
telah digunakan sebagai antioksidan, antimikobakteria dan anti auksin (Dolezal dkk, 2008).
Pirazina-2-karboksamida atau pirazinamida (3)
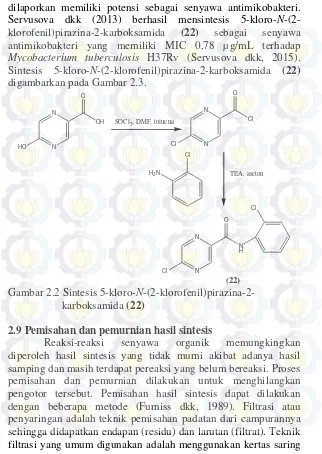
dilaporkan memiliki potensi sebagai senyawa antimikobakteri. Servusova dkk (2013) berhasil mensintesis 5-kloro-N-(2-klorofenil)pirazina-2-karboksamida (22) sebagai senyawa antimikobakteri yang memiliki MIC 0,78 µg/mL terhadap Mycobacterium tuberculosis H37Rv (Servusova dkk, 2015). Sintesis 5-kloro-N-(2-klorofenil)pirazina-2-karboksamida (22)
digambarkan pada Gambar 2.3.
N
N O
OH
HO
SOCl2, DMF, toluena
N
Gambar 2.2 Sintesis 5-kloro-N-(2-klorofenil)pirazina-2- karboksamida (22)
2.9 Pemisahan dan pemurnian hasil sintesis
11
yang ditempatkan pada corong, sehingga larutan ditarik turun oleh gravitasi melalui kertas saring dan padatan tertinggal pada kertas saring (Pavia dkk, 2001).
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak zat yang diinginkan tanpa melarutkan zat yang lainnya (Sulihono dkk, 2012). Prinsip ekstraksi adalah distribusi komponen campuran terhadap dua pelarut yang tak saling larut (Gilbert dan Martin, 2010; Skoog dkk, 2013). Ekstraksi dapat dilakukan dengan corong pisah (Zhang, 2007).
Kromatografi adalah suatu metode pemisahan yang didasarkan pada distribusi senyawa antara dua fasa yakni fasa gerak dan fasa diam. Proses pemisahan pada kromatografi tergantung pada kemampuan senyawa teradsorb pada fasa diam dan kelarutannya terhadap fasa gerak (Pavia, 2001). Kromatografi lapis tipis adalah salah satu teknik kromatografi menggunakan adsorben (fase diam) berupa lempeng kaca atau plat aluminium atau plastik yang terlapisi fasa diam seperti silika gel (Sherma, 1991; Mukhriani, 2014).
uap iod. KLT juga sering digunakan untuk memantau reaksi dan mengidentifikasi pembentukan hasil reaksi dalam sintesis organik (Dillon, 2012).
Jenis kromatografi yang lain adalah kromatografi kolom yang menggunakan silika gel dalam kolom sebagai fasa diam dan pelarut sebagai fase gerak. Sampel yang dimurnikan ditempatkan pada ujung kolom. Pelarut (eluen) kemudian dialirkan secara kontinu ke dalam kolom. Eluen melalui kolom dengan adanya gravitasi pada kromatografi kolom gravitasi. Molekul-molekul senyawa akan dibawa ke bagian bawah kolom dengan kecepatan yang berbeda-beda. Cairan yang keluar dari kolom ditampung dan diuji dengan KLT untuk mengetahui hasil pemisahannya (Kristanti dkk, 2006).
Uji titik leleh digunakan untuk mengidentifikasi dan mengetahui kemurnian senyawa. Pengujian dilakukan dengan menempatkan sejumlah kecil bahan yang dipanaskan perlahan-lahan dalam alat khusus yang dilengkapi dengan termometer atau termokopel, koil pemanas dan lensa pembesar untuk mengamati sampel. Titik leleh menunjukkan kemurnian senyawa. Senyawa organik murni umumnya memiliki titik leleh yang tajam dengan rentang tidak melebihi sekitar 0,5°C (Pavia dkk, 2001; Furniss, 1989).
2.10 Identifikasi Struktur Hasil Sintesis 2.10.1 Spektroskopi Inframerah
13
terletak pada daerah inframerah pertengahan dengan panjang gelombang 2,5- 15 µm (Skoog dkk, 2013)
Molekul cenderung tereksitasi ke tingkat energi yang lebih tinggi ketika menyerap radiasi inframerah yang memiliki frekuensi yang sesuai. Perubahan energi ketika mengadsorbsi sinar inframerah sekitar 8-40 kJ/mol (Pavia, 2001). Getaran molekul setelah dilewati sinar inframerah dibedakan menjadi dua jenis, yakni tipe ulur (stretching) dan tipe tekuk (bending). Tipe ulur ditandai dengan perubahan secara terus-menerus sepanjang sumbu ikatan antara dua atom. Tipe tekuk ditandai dengan perubahan sudut antara dua ikatan pada molekul. Tipe vibrasi tekuk memiliki empat macam getaran yakni scissoring, rocking, wagging dan twisting (Skoog dkk, 2013). Molekul yang simetris memiliki sifat aktif inframerah yang lebih kecil dari pada molekul asimetris. Vibrasi dari gugus C-C atau N=N akan memberikan pita serapan lemah, hal ini disebabkan perubahan momen dipol senyawa yang relatif kecil (Stuart, 2004). Data serapan dari beberapa gugus fungsi yang dapat dilihat pada Tabel 2.1.
Tabel 2.1 Data serapan IR
Tipe Serapan Gugus fungsi Daerah Serapan (cm-1) O-H Alifatik dan aromatik 3600-3000 N-H Amina sekunder dan
tersier
3600-3100
C-H Aromatik 3150-3000
C-H Alifatik 3000-2850
C≡N Nitril 2400-2200
C≡C Alkuna 2260-2100
C=O Ester 1750-1700
C=O Asam Karboksilat 1740-1670
C=O Aldehid dan Keton 1740-1660
C= Amida 1720-1640
C=C Alkena 1670-1610
Ar-OR Aromatik 1300-1180
Tidak semua molekul dapat menyerap energi inframerah meskipun inframerah memiliki frekuensi yang sesuai dengan vibrasi senyawa tersebut. Senyawa yang memiliki momen dipol yang mampu mengadsorbsi sinar inframerah (Pavia, 2001).
2.10.2 Spektroskopi Resonansi Magnetik Inti (NMR)
Spektroskopi resonansi magnetik inti (NMR) didasarkan pada pengukuran penyerapan radiasi elektromagnetik di wilayah frekuensi radio (4-900 MHz) (Skoog dkk, 2013). Inti yang sering digunakan dalam penentuan struktur senyawa organik adalah 1H dan 13C. Kedua atom tersebut dapat dianalisis menggunakan spektroskopi proton NMR (1H NMR) dan spektroskopi karbon NMR (13C NMR). Informasi yang diberikan oleh spektroskopi 1H NMR adalah jumlah serta susunan atom hidrogen dalam suatu molekul, sedangkan pada spektroskopi 13C NMR memberikan informasi mengenai jumlah dan kerangka karbon pada suatu molekul (Hart dkk, 2003).
Spektra 1H NMR menunjukkan tiga parameter yang terkait langsung dengan struktur molekul, yakni pergeseran kimia
(δ), konstanta kopling dan integrasi. Pergeseran kimia
berhubungan dengan jumlah sinyal dan posisi sinyal, integrasi adalah area puncak atau besaran sinyal dalam spektra NMR yang digunakan untuk mengetahui jumlah proton dari suatu molekul, dan konstanta kopling dapat digunakan mengetahui hubungan dengan ikatan kimia atau proton tetangga (Zhang, 2007).
15
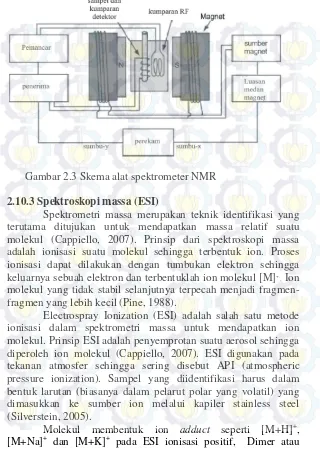
Berdasarkan perbedaan nilai pergeseran kimia, sinyal NMR dibedakan menjadi dua daerah, yakni daerah downfield terletak di sumbu-x sebelah kiri dan upfield terletak di sumbu-x sebelah kanan. Frekuensi resonansi meningkat dari upfield ke downfield yang menyebabkan daerah upfield lebih kaya elektron dan lebih terlindungi, sedangkan downfield kurang terlindungi (Zhang, 2007). Data pergeseran kimia pada 1H-NMR dan 13 C-NMR dapat dilihat pada Tabel 2.2 dan 2.3, skema spektrometer NMR digambarkan pada Gambar 2.5.
Tabel 2.2 Data pergeseran kimia pada 1H-NMR
Tipe proton δ (ppm) Tipe proton δ (ppm)
TMS 0 RC=CH 2,3-2,9
R-CH3 0,11-1,2 R-CO-CH3 2,0-2,7
R2CH2 1,2-1,4 R-O-CH3 3,3-3,9
R3CH 1,4-1,65 R2C=CHR 4,9-5,9
Ph-CH3 2,2-2,5 Ar H 6,0-8,0
R-CH2-I 3,1-3,3 RCHO 9,4-10,4
R-CH2-Br 3,4-3,6 RCOOH 10-12
R-CH2-Cl 3,6-3,8 ROH 1-6
R-CH2-F 4,3-4,4 ArOH 6-8
R-CH-Cl2 5,8-5,9 R2NH 2-4
R-S-H 1,0-4,0 O2N-CHR 4,1-4,3
R-S-CHR 2,0-3,0 R-CO-NHR 5,0-9,0
Tabel 2 3 Data pergeseran kimia pada 13C-NMR
Tipe karbon δ (ppm) Tipe karbon δ (ppm)
TMS 0 C≡C 75-95
RCH3 0-30 C=C 105-145
R2CH2 20-45 C (aromatik) 110-155
R3CH 30-60 C (heteroaromatik) 105-165
R4C 30-50 C≡N 115-125
-OCH3 50-60 C=O (karboksilat) 155-185
Gambar 2.3 Skema alat spektrometer NMR
2.10.3 Spektroskopi massa (ESI)
Spektrometri massa merupakan teknik identifikasi yang terutama ditujukan untuk mendapatkan massa relatif suatu molekul (Cappiello, 2007). Prinsip dari spektroskopi massa adalah ionisasi suatu molekul sehingga terbentuk ion. Proses ionisasi dapat dilakukan dengan tumbukan elektron sehingga keluarnya sebuah elektron dan terbentuklah ion molekul [M]+.. Ion
molekul yang tidak stabil selanjutnya terpecah menjadi fragmen-fragmen yang lebih kecil (Pine, 1988).
Electrospray Ionization (ESI) adalah salah satu metode ionisasi dalam spektrometri massa untuk mendapatkan ion molekul. Prinsip ESI adalah penyemprotan suatu aerosol sehingga diperoleh ion molekul (Cappiello, 2007). ESI digunakan pada tekanan atmosfer sehingga sering disebut API (atmospheric pressure ionization). Sampel yang diidentifikasi harus dalam bentuk larutan (biasanya dalam pelarut polar yang volatil) yang dimasukkan ke sumber ion melalui kapiler stainless steel (Silverstein, 2005).
17
trimer dari ion-ion tersebut juga sering terdeteksi pada spektra massa seperti [2M+Na]+. Selain itu, ion molekul yang bermuatan dobel dengan beberapa gabungan dari kation juga teridentifikasi seperti [M+Na+H]2+. Ion molekul yang sering terbentuk pada ESI ionisasi negatif, adalah [M-H]- (Eichhorn dan Knepper, 2001).
19
BAB III
METODOLOGI PERCOBAAN 3.1 Alat dan Bahan
3.1.1 Alat
Peralatan yang digunakan dalam penelitian adalah pipet ukur, neraca analitis Pioneer, kaca arloji, gelas kimia, pipet tetes, labu erlenmeyer, gelas ukur, pengaduk, mikropipet Socorex, corong, gelas ukur, labu bundar leher tiga, kondensor, termometer, seperangkat alat refluks, corong pisah, statif, pinset, pipa kapiler, hot plate stirrer Cimarec, magnetic stirrer bar, chamber KLT, rotatory evaporator Buchi, plat kromatografi lapis tipis (KLT) aluminium silica gel 60 F254, lampu UV (λ= 254 dan 365 nm), kolom kromatografi, alat ukur titik leleh Fisher John, FTIR – 8400S Shimadzu, spektrometer NMR Jeol Resonance 400 Hz dan spektrometer massa triple quadrupole TSQ Quantum Access Max.
3.1.2 Bahan
Bahan yang digunakan dalam penelitian adalah asam pirazina-2-karboksilat (15) (Merck 800615), 2,4,6-triklorobenzoil klorida (13) (Sigma-Aldrich 345504), trietilamina (21) (Merck 808352), 4-dimetilaminopiridin (DMAP) (14) (Fluka 39405), tetrahidrofuran (THF) (Merck 109731), 3-bromoanilina (16)
3.2 Prosedur Penelitian
3.2.1 Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
dilakukan dengan mengadaptasi metode esterifikasi Yamaguchi (Kamadatu dan Santoso, 2015). Larutan asam pirazina-2-karboksilat (15) (0,094 gram; 0,76 mmol) dalam 20 mL THF ditambah 2,4,6-triklorobenzoil klorida (13) (117,2 µL; 0,75 mmol) dan trietilamina (21) (104,0 µL; 0,75 mmol), larutan kemudian diaduk pada suhu kamar selama 20 menit. Hasil reaksi selanjutnya ditambah DMAP (14) (0,092 gram; 0,75 mmol) dan 3-bromoanilina (1) (54,4 µL; 0,50 mmol), dan direfluks pada suhu 66ºC selama 1,5 jam (pemantauan reaksi dilakukan dengan KLT)). Asam pirazina-2-karboksilat (15) (0,094 gram; 0,76 mmol) dalam 20 mL THF, 2,4,6-triklorobenzoil klorida (13)
(117,2 µL; 0,75 mmol), trietilamina (21) (104,0 µL; 0,75 mmol) dan DMAP (14) (0,092 gram; 0,75 mmol) selanjutnya ditambahkan pada campuran, dan campuran direfluks lebih lanjut selama 135 menit (pemantauan reaksi dilakukan dengan KLT). Asam pirazina-2-karboksilat (15) (0,094 gram; 0,76 mmol) dalam 20 mL THF, 2,4,6-triklorobenzoil klorida (13) (117,2 µL; 0,75 mmol), trietilamina (21) (104,0 µL; 0,75 mmol) dan DMAP (14)
21
sehingga diperoleh hasil sintesis yang kemudian dimurnikan dengan kromatografi kolom gravitasi menggunakan eluen kloroform:n-heksana (1:1). Uji kemurnian hasil kromatografi kolom gravitasi dilakukan dengan kromatografi lapis tipis dan titik leleh. Hasil sintesis yang telah murni, ditimbang serta diidentifikasi dengan spektrofotometer inframerah, spektrometer massa, dan spektrometer NMR.
3.2.2 Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
dilakukan dengan mengadaptasi metode sintesis N-(3-bromofenil)pirazina-2-karboksamida (18).Larutan asam pirazina-2-karboksilat (15) (0,093 gram; 0,75 mmol) dalam 20 mL THF ditambah 2,4,6-triklorobenzoil klorida (13) (117,2 µL; 0,75 mmol) dan trietilamina (21) (104,0 µL; 0,75 mmol), larutan kemudian diaduk pada suhu kamar selama 20 menit. Hasil reaksi selanjutnya ditambah DMAP (14) (0,092 gram; 0,75 mmol) dan 4-bromoanilina (17) (0,087 gram; 0,51 mmol), dan direfluks pada suhu 66ºC selama 5,5 jam (pemantauan reaksi dilakukan dengan KLT). Asam pirazina-2-karboksilat (15) (0,093 gram; 0,75 mmol) dalam 20 mL THF, 2,4,6-triklorobenzoil klorida (13) (117,2 µL; 0,75mmol), trietilamina (21) (104,0 µL; 0,75 mmol) dan DMAP
23
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
dilakukan dengan mengadaptasi metode esterifikasi Yamaguchi (Kamadatu dan Santoso, 2015). Sintesis dilakukan dengan mereaksikan asam pirazina-2-karboksamida (15), 2,4,6-triklorobenzoil klorida (13) dan trietilamina (21) dalam THF pada suhu kamar selama 20 menit. Campuran selanjutnya ditambah dengan DMAP (14) dan 3-bromoanilina (16), dan direfluks pada suhu 66ºC. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT) dan memberikan hasil sebagaimana dapat dilihat pada Gambar 4.1.
Gambar 4.1 Hasil pemantauan dengan KLT sintesis N-(3- bromofenil)pirazina-2-karboksamida (18)
Hasil pemantauan reaksi dengan KLT menunjukkan bahwa hasil reaksi telah terbentuk setelah direfluks selama 15 menit, yang ditandai dengan adanya noda dengan Rf yang berbeda dari Rf asam-pirazina-2-karboksilat (15) dan 3-bromoanilina (16). Noda kedua pereaksi masih terdapat pada noda hasil reaksi, hal ini menandakan reaksi belum berjalan tuntas. Refluks kemudian dilanjutkan hingga 90 menit, dan hasil pemantauan menunjukkan bahwa masih ada pereaksi yang belum bereaksi. Asam
pirazina-2-Keterangan : 1 = asam pirazina- 2-karboksilat (15)
2 = hasil reaksi
3 = 3-bromoanilina (16)
Eluen:
Etil asetat:n-heksana (1:2)
karboksilat (15), 2,4,6-triklorobenzoil klorida (13), trietilamina
(21), dan DMAP (14) dalam THF ditambahkan pada campuran, dan campuran direfluks lebih lanjut pada suhu 66ºC selama 135 menit untuk memaksimalkan reaksi. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT). Hasil dapat dilihat pada Gambar 4.2.
Gambar 4.2 Hasil pemantauan dengan KLT sintesis N-(3-
bromofenil)pirazina-2-karboksamida (18), setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP (14) dan 2,3,4-
trikklorobenzoil klorida (13) yang pertama
Hasil pemantauan dengan KLT menunjukkan bahwa pereaksi yang belum bereaksi semakin berkurang yang ditandai dengan menipisnya noda 3-bromoanilina (16) setelah penambahan pereaksi asam pirazina-2-karboksilat (15), trietilamina (21), DMAP (14) dan 2,3,4-trikklorobenzoil klorida
(13) yang pertama dan reaksi di refluks selama 15 menit. Pada menit ke-45 dan ke-90 menunjukkan bahwa noda dengan Rf yang sama seperti Rf 3-bromoanilina (16) semakin menipis. Refluks dilanjutkan hingga menit ke-135 untuk memastikan reaksi dapat berjalan sempurna. Pada menit ke-135, masih terdapat noda kedua pereaksi pada noda hasil sintesis. Asam pirazina-2-karboksilat
25
dan campuran direfluks lebih lanjut pada suhu 66ºC selama 135 menit untuk memaksimalkan reaksi. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT). Hasil dapat dilihat pada Gambar 4.3.
Gambar 4.3 Hasil pemantauan dengan KLT sintesis N-(3-
bromofenil)pirazina-2-karboksamida (18), setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP (14) dan 2,3,4-
trikklorobenzoil klorida (13) yang kedua
Hasil pemantauan menunjukkan bahwa reaksi belum berjalan tuntas yang ditandai dengan noda 3-bromoanilina (16)
Keterangan : Eluen =
n-heksana:kloroform (1:1) rendah dan diuji kemurnian dengan KLT. Gambar 4.5 menunjukkan bahwa hasil pemurnian memberikan noda tunggal yang menandakan sebagai senyawa murni. Hal ini diperkuat dengan uji titik leleh yang menunjukkan titik leleh sebesar 133-134ºC.
Gambar 4.4 Hasil uji KLT hasil pemurnian N-(3-
bromofenil)pirazina-2-karboksamida (18) dengan kromatografi kolom gravitasi
Gambar 4.5 Hasil uji kemurnian dengan KLT N-(3-
bromofenil)pirazina-2-karboksamida (18) hasil sintesis
Identifikasi hasil sintesis dalam (CDCl3) dengan spektrometer NMR memberikan spektrum 1H-NMR sebagaimana
Keterangan : Eluen :
a = diklorometana: n-heksana (2:1)
b = etil asetat:n-heksana (1:2) c = etil asetat : kloroform (1:2)
27
dapat dilihat pada Gambar 4.6 yang sesuai dengan struktur N-(3-bromofenil)pirazina-2-karboksamida (18). Spektrum dengan jelas menunjukkan sinyal-sinyal proton aromatik dan NH. Sinyal multiplet pada pergeseran kimia 7,24-7,30 ppm yang merupakan sinyal dari dua proton aromatik. Sinyal duplet pada pergeseran kimia 7,66 (J=7,6 Hz) merupakan sinyal satu proton aromatik dan sinyal triplet pada pergeseran kimia 8,01 merupakan sinyal dari satu proton aromatik. Sinyal triplet pada pergeseran kimia 8,58 ppm dan sinyal duplet pada pergeseran kimia 8,81 (J=2 Hz), dan sinyal singlet pada pergeseran kimia 9,49 merupakan sinyal dari tiga proton heteroaromatik. Sinyal singlet pada pergeseran kimia 9,66 merupakan sinyal proton NH.
Spektrum 13C NMR N-(3-bromofenil)pirazina-2-karboksamida (18) hasil sintesis (dalam CDCl3) dengan jelas menunjukkan 11 jenis karbon sebagaimana dapat dilihat pada Gambar 4.7. Karbon-karbon aromatik menunjukkan sinyal pada pergeseran kimia 118,335; 122,788; 127,908; 130,577; 142,505; 144,803; 147,892 untuk karbon tersier dan pada pergeseran kimia 122,912; 138,529; 144,040 untuk karbon kuartener. Karbon gugus karbonil menunjukkan sinyal pada pergeseran kimia 160,792. Spektrum IR sebagaimana dapat dilihat pada Gambar 4.8 dengan jelas memperkuat adanya gugus amida dengan munculnya serapan di FTIR pada bilangan gelombang 3282,95 cm-1 untuk NH sekunder dan 1672,34 cm-1 untuk gugus karbonil.
Pergeseran kimia (ppm)
29
Pergeseran kimia (ppm)
Gambar 4.7 Spektra 13C NMR N-(3-bromofenil)pirazina-2- karboksamida (18) hasil sintesis
Sebagai kesimpulan reaksi, asam pirazina-2-karboksamida (15) (0,281 gram; 2,26 mmol), 2,4,6-triklorobenzoil klorida (pereaksi Yamaguchi) (13) (351,6 µL; 2,25 mmol), trietilamina (21) (312,0 µL; 2,24 mmol), DMAP (14)
(0,277 gram; 2,27 mmol) dan 3-bromoanilina (16) (54,4 µL; 0,50 mmol) dalam 60 mL dan diperoleh N-(3-bromofenil)pirazina-2-karboksamida (18) berupa padatan kristalin kekuningan dengan massa 0,09 gram atau dengan rendemen 64%. Mekanisme reaksi pembentukan N-(3-bromofenil)pirazina-2-karboksamida (18)
disarankan sebagaimana mekanisme umum Yamaguchi (Kamadatu dan Santoso, 2015) sebagaimana dapat dilihat pada Gambar 4.10. Reaksi diawali dengan deprotonasi asam karboksilat (15) oleh trietilamina (21) sehingga terbentuk anion karboksilat yang kemudian menyerang karbonil pada 2,4,6-triklorobenzoil klorida (13) melalui mekanisme adisi-eliminasi sehingga terbentuk anhidrida tidak simetri. DMAP (14)
selanjutnya bereaksi dengan anhidrida tak simetri (23) dengan mekanisme adisi-eliminasi sehingga diperoleh asil tersubstitusi DMAP (24). Anilina (16-17) menyerang asil tersubstitusi DMAP
30
T
rans
m
it
an
(
%
T
)
Bilangan gelombang (cm-1)
Gambar 4.8 Spektra IR N-(3-bromofenil)pirazina-2-karboksamida (18)
33
4.2 Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
dilakukan dengan mengadaptasi metode sintesis N-(3-bromofenil)pirazina-2-karboksamida (18). Sintesis dilakukan dengan mereaksikan asam pirazina-2-karboksilat (15), 2,4,6-triklorobenzoil klorida (13) dan trietilamina (21) dalam THF pada suhu kamar selama 20 menit. Campuran selanjutnya ditambahkan dengan DMAP (14) dan 4-bromoanilina (17), dan direfluks pada suhu 66ºC. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT) dan memberikan hasil sebagaimana dapat dilihat pada Gambar 4.10.
Gamba.1
Gambar 4.11 Hasil pemantauan dengan KLT sintesis N-(4- bromofenil)pirazina-2-karboksamida (19)
Hasil pemantauan reaksi dengan KLT menunjukkan bahwa hasil reaksi telah terbentuk setelah direfluks selama 30 menit, yang ditandai dengan adanya noda dengan Rf yang berbeda dari noda asam-pirazina-2-karboksilat (15) dan 4-bromoanilina
(17). Noda kedua pereaksi masih terdapat pada noda hasil reaksi, hal ini menandakan reaksi belum tuntas. Refluks kemudian dilanjutkan hingga 5,5 jam, dan hasil pemantauan menunjukkan bahwa masih ada pereaksi yang belum bereaksi sempurna yang ditandai dengan adanya noda pereaksi. Asam pirazina-2-karboksilat (15), 2,4,6-triklorobenzoil klorida (13), trietilamina
(21) dan DMAP (14) dalam 20 mL THF selanjutnya ditambahkan pada campuran dan campuran direfluks lebih lanjut pada suhu
Keterangan : 1 = asam pirazina- 2-karboksilat (15)
2 = hasil reaksi
3 = 4-bromoanilina (17)
Eluen:
Etil asetat:n-heksana (1:1) 66ºC, untuk memaksimalkan reaksi. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT) dan memberikan hasil sebagaimana dapat dilihat pada Gambar 4.12.
Gambar 4.12 Hasil pemantauan dengan KLT sintesis N-(4- bromofenil)pirazina-2-karboksamida (19), setelah penambahan asam pirazina-2-karboksilat (14), trietilamina (20), DMAP (13) dan 2,3,4- trikklorobenzoil klorida (12) yang pertama
Hasil pemantauan dengan KLT menunjukkan bahwa pereaksi yang belum bereaksi semakin berkurang yang ditandai dengan menipisnya noda 4-bromoanilina (17) setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP (14) dan 2,3,4-trikklorobenzoil klorida (13) yang pertama dan reaksi direfluks selama 30 menit. Refluks dilanjutkan hingga 5,5 jam, tetapi noda pereaksi belum sepenuhnya hilang. Asam pirazina-2-karboksilat (15), 2,4,6-triklorobenzoil klorida (13), trietilamina (21) dan DMAP (14) dalam THF selanjutnya ditambahkan pada campuran, dan direfluks lebih lanjut pada suhu 66ºC selama 1 jam. Reaksi yang berlangsung dipantau dengan kromatografi lapis tipis (KLT) dan memberikan hasil sebagaimana dapat dilihat pada Gambar 4.12. Hasil pemantauan menunjukkan bahwa reaksi belum berjalan tuntas yang ditandai dengan noda 4-bromoanilina (16) yang tipis. Reaksi kemudian dihentikan, hasil reaksi didinginkan sehingga dan padatan yang diperoleh disaring. Filtrat yang diperoleh ditambah 30 mL
35
akuades, kemudian diekstrak dengan diklorometana (2x25 mL). Ekstrak yang diperoleh dicuci dengan larutan HCl 5% (25 mL), larutan NaOH 5% (25 mL), larutan NaHCO3 5% (25 mL) dan akuades (25 mL), dikeringkan dengan magnesium sulfat anhidrat dan diuapkan pada tekanan rendah sehingga diperoleh hasil sintesis berupa padatan kekuningan.
Gambar 4.13 Hasil pemantauan KLT sintesis N-(4-
bromofenil)pirazina-2-karboksamida (19) setelah setelah penambahan asam pirazina-2-karboksilat (15), trietilamina (21), DMAP (14) dan 2,3,4-
triklorobenzoil klorida (13) yang kedua.
Uji kemurnian hasil sintesis menggunakan KLT dengan tiga eluen yang dapat dilihat pada Gambar 4.14 menunjukkan noda tunggal yang menandakan sebagai senyawa murni. Hal ini diperkuat dengan uji titik leleh yang menunjukkan titik leleh sebesar 163-165ºC.
1 jam
Keterangan : 1 = asam pirazina- 2-karboksilat (15)
2 = hasil reaksi
3 = 4-bromoanilina (17)
Eluen:
Gambar 4.14 Hasil uji kemurniann N-(4-bromofenil)pirazina-2- karboksamida (19) hasil sintesis
Identifikasi hasil sintesis (dalam CDCl3) dengan spektrometer NMR memberikan spektrum 1H-NMR sebagaimana dapat dilihat pada Gambar 4.15 yang sesuai dengan struktur N-(4-bromofenil)pirazina-2-karboksamida (18). Spektrum dengan jelas menunjukkan sinyal-sinyal proton aromatik dan NH. Dua sinyal doublet pada pergeseran kimia 7,49 ppm (J=9,2 Hz) dan 7,65 ppm (J=9,2 Hz) masing-masing merupakan sinyal dari dua proton aromatik. Sinyal triplet pada pergeseran kimia 8,57 ppm, sinyal duplet pada pergeseran kimia 8,81 (J=2,4 Hz), dan sinyal doublet pada pergeseran kimia 9,49 (J=1,6 Hz), merupakan sinyal dari tiga proton heteroaromatik. Sinyal singlet pada pergeseran kimia 9,65 merupakan sinyal proton NH.
Spektrum 13C NMR N-(4-bromofenil)pirazina-2-karboksamida (19) hasil sintesis (dalam CDCl3) dengan jelas menunjukkan 9 jenis karbon sebagaimana dapat dilihat pada Gambar 4.16. Karbon-karbon aromatik menunjukkan sinyal pada pergeseran kimia 121,42; 132,62; 142,45; 144,80; 147,81 untuk karbon tersier dan pada pergeseran kimia 117,58; 136,38; 144,17 untuk karbon kuartener. Karbon gugus karbonil menunjukkan sinyal pada pergeseran kimia 160,75. Spektrum IR sebagaimana dapat dilihat pada Gambar 4.17 dengan jelas memperkuat adanya
a b c
Keterangan : Eluen :
a = diklorometana: n-heksana (2:1)
b = etil asetat:n-heksana (1:1)
37
Pergeseran kimia (ppm)
gugus amida dengan serapan pada bilangan gelombang 3344,68 cm-1 untuk NH sekunder dan 1678,13 cm-1 untuk gugus karbonil.
Identifikasi hasil sintesis dengan spektrometer massa (ESI) memberikan spektrum massa ion positif sebagaimana dapat dilihat pada Gambar 4.18. Spektrum massa hasil sintesis menunjukkan puncak ion [2M+Na+H]2+ pada m/z 291,032. Massa relatif hasil perhitungan N-(4-bromofenil)pirazina-2-karboksamida (19) untuk ion [2M+Na+H]2+ yaitu 290,108.
Pergeseran kimia (ppm)
Gambar 4.16 Spektra 13C NMR N-(4-bromofenil)pirazina-2- karboksamida (19) hasil sintesis
Sebagai kesimpulan reaksi, asam pirazina-2-karboksamida
(15) (0,278 gram; 2,25 mmol), 2,4,6-triklorobenzoil klorida (pereaksi Yamaguchi) (13) (351,6 µL; 2,25 mmol), trietilamina
(21) (312,0 µL; 2,24 mmol), DMAP (14) (0,276 gram; 2,26 mmol) dan 4-bromoanilina (17) (0,087 gram; 0,51 mmol) dalam 60 mL dan diperoleh N-(4-bromofenil)pirazina-2-karboksamida
(19) berupa padatan kekuningan dengan massa 0,13 gram atau dengan rendemen 93%. Mekanisme reaksi pembentukan N-(4-bromofenil)pirazina-2-karboksamida (19) dapat dilihat pada Gambar. Perbandingan data 1H-NMR senyawa hasil sintesis (18-19) dapat dilihat pada Tabel 4.10, sedangkan perbandingan data 13
39
Tabel 4.1 Perbandingan data 1H-NMR senyawa hasil sintesis (18- 19)
40
T
rans
m
it
an
(
%
T
)
45
DAFTAR PUSTAKA
Berry, D. J., DiGiovanna, C. V., Metrick, S. S., & Murugan, R. (2001). Catalysis by 4-dialkylaminopyridines. USA: Reilly Industries.
Cai, M. C., Zhang, T., Kumar, R. & Wyman, E. C. (2013). THF Co-solvent Enhances Hydrocarbon Fuel Precursor Yields from Lignocellulosic Biomass. 15, 3140-3145.
Capiello, A.,2007. Advance in LC-MS Instrumentation. Journal of Chromatography Library, 72, 1-5.
Chen, T., Guo, L., Li, Q., Yu, L., Li, Z., Guo, H., et al. (2015). Lower cytotoxicity, high stability, and long-term antibacterial activity of a poly (methacrylic acid) /isoniazid /rifampin nanogel against multidrug-resistant intestinal Mycobacterium tuberculosis. Materials Science & Engineering C, 58, 659-665
Dhimitruka, I., & Jr, J. S. (2006). Investigation of the Yamaguchi Esterification Mechanism. Synthesis of a Lux-S Enzyme Inhibitor Using an Improved Esterification Method. Organic Letters, 8, 47-50.
Dillon, J. T., Aponte, J. C., Tsai, Y.J., & Huang, Y. (2012). Thin layer chromatography in the separation of unsaturated organic compounds. Journal of Chromatography A, 1251, 240.
Dolezal, M., Lesnanka, K., Pesko, M., Jampilek, J., & Kral'ova, K. (2008). Pyrazinecarboxamides, Their Synthesis and Evaluation as Potential Herbicides. 12th International Electronic Conference on Synthetic (ECSOC-12).
N-benzylpyrazine-2-carboxamides, Their Synthesis, Hydro-lipophilic Properties and Evaluation of Their Antimycobacterial, and Photosynthesis-inhibiting Activity. 12th International Electronic Conference on Synthetic (ECSOC-12).
Evangelopoulos, D., da Fonseca, J. D., & Waddell, S. J. (2014). Understanding anti-tuberculosis drug efficacy: rethinking bacterial populations and how we model them. International Journal of Infectious Diseases, 32, 76-80. Eichhorn, P. & Knepper, P. T. (2001). Electrospray Ionization
Mass Spectrometric Studies on the Amphoteric Surfactant Cocamidopropylbetaine. Journal of Mass Spectrometry,
36, 677-684
Ewin R. A. & Pertusati F. (2013). 2,4,6-Trichlorobenzoyl Chloride. e-EROS Encyclopedia of Reagents for Organic Synthesis.
Fernandes, J. P. S., Pavan, F. R., Leite, C. Q. F., Felli, V. M. A. (2014). Synthesis and evaluation of a pyrazinoic acid prodrug in Mycobacterium tuberculosis. Saudi Pharmaceutical Journal, 22, 376-380.
Fisherci.ca, 2015. Safety Data Sheet 2-Pyrazinecarboxlic Acid (diakses pada 3 Januari 2016).
Furniss, B. S., Hannaford, J. A., Smith, P. W., & Tatchell, A. R. (1989). VOGEL's Text Book Of Practical Organic (Fifth ed.). New York: John Wiley & Sons, Inc.
Gilbert, J. C. & Martin, S. F., 2010. Experimental Organic Chemistry A Miniscale and Microscale Approach. 5th ed. United State of America: Changage Learning.
47
Hofle, G., Steglich, W., & Vorbruggen, H. (1978). 4-Alkylaminopyridines as High Active Acylation Catalysts. Angew. Chem. Int. Ed, 17, 569-583.
Inanaga, J., Hirata, K., Saeki, H., Katsuki, T., & Yamaguchi, M. (1979). a rapid esterification by means of mixed anhydride and its application to large-ring lactonization. Bulletin of the Chemical Society, 52, 1989-1993.
Jandourek, O., Dolezal, M., Peterova, P., Kubicek, V., Pesko, M., Kunes, J., et al. (2014). N-Substituted 5-Amino-6-methylpyrazine-2,3-dicarbonitriles: Microwave-Assisted Synthesis and Biological Properties. molecules , 19, 651-671.
Kamadatu, L., & Santoso, M. (5 Agustus 2015). Synthesis and Cytotoxicity of 4-Allyl-2-methoxy Phenol Derivatives. The 1st International Seminar on Science and Technology. Surabaya.
Kawanami, Y., Dainobu, Y., Inanaga, J., Katsuki, T., & Yamaguchi, M. (1981). Synthesis of Thiol Esters by Carboxylic Trichlorobenzoic Anhydrides. The Bulletin Chemical Society of Japan, 54, 934-944.
Kemenkes RI. (2015). Tuberkulosis, Temukan Obati sampai sembuh. Pusat Data dan Informasi Kementrian Kesehatan Republik Indonesia
Kristanti, A. N., Aminah, N. S., Tanjung, M., & Kurniadi, B. (2008). Buku Ajar Fitokimia. Surabaya: Airlangga University Press.
Lu, P., Haagsma, A. C., Pham, H., Maaskant, J. J., Mol, S., Lill, H., & Bald, D. (2011). Pyrazinoic Acid Decreases the Proton Motive Force, Respiratory ATP Synthesis Activity, and Cellular ATP Levels. Antimicrobial Agents and Chemotherapy, 55, 5354-5357.
Manzeera, A. S., Sireesha, P. N., Aswini, M., Rao, P. M., Sree, K. N., & Mallikharjunarao, K. L. (2013). Synthesis and Anti-inflammatory Activity of Pyrazine Derivatives. Asian Journal of Research in Pharmceutical Sciences and Biotechnology, 1, 10-15.
Mukhriani. (2014). Ekstraksi, Pemisahan Senyawa, Dan Identifikasi Senyawa Aktif. Jurnal Kesehatan Program Studi Farmasi Fakultas Ilmu Kesehatan UIN Alauddin Makassar ,7, 361-367.
Pavia, D., Lampman, G., & Kriz, G. (2001). Introduction to Spectroscopy : A Guide for Students of Organic Chemistry (third ed.). USA: Thomson Learning.
Pine, S., Hendrickson, J., Cram, D., & Hammond, G. (1988). Kimia Organik 1, Terjemahan Roehyati Joedodibroto dan Susanti W; Purbo-Hadiwidjoyo, Edisi keempat. Bandung: Penerbit ITB.
Sciencelab.com, 2013. Material Safety Data Sheet 4-Dimethylaminopyridine (diakses pada 3 Januari 2016). Sciencelab.com, 2013. Material Safety Data Sheet Triethylamine
49
Sciencelab.com, 2013. Material Safety Data Sheet 4-bromoaniline (diakses pada 3 Januari 2016).
Sciencelab.com, 2013. Material Safety Data Sheet Tetrahydrofuran (diakses pada 3 Januari 2016).
Servusova, B., Vobickova, J., Peterova, P., Kubicek, V., Kunes, J., Dolezal, M., et al. (2013). Synthesis and antimycobacterial evaluation of N-substituted 5-chloropyrazine-2-carboxamides. Bioorganic & Medicinal Chemistry Letters, 23, 3589-3591.
Sherma, J. & Fried, B. (1991). Handbook of Thin-layer Chromatography. Journal of Labelled Compounds and Radiopharmaceuticals, 29, 1097.
Silverstein, R. M., Webster, F. X. & Kiemle, D. J., 2005. Spectrometric Identification of Organic Compounds 7th ed. USA: John Wiley & Sons, Inc.
Skoog, A. D., West, M. D., Holler, J. F. & Crouch, R. S. (2013). Fundamentals of Analytical Chemistry. Cengage Learning.
Sorgi, K. L. (2001). Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons.
Spectrumchemical.com, 2014. TCI America Safety Data Sheet 3-Bromoaniline (diakses pada 3 Januari 2016).
Striegel, M. F., & Hill, J. (1996). Thin-Layer Chromatography for Binding Media Analysis. Los Angeles: The Getty Conservation Institute.
WHO. (2014). Global Tuberculosis Report 2014. WHO.
Zhang, C., 2007. Fundamentals of Environmental Sampling and Analysis. New Jersey: John Wiley & Sons, Inc.
51
Diaduk pada suhu ruang selama 20 menit
Ditambahkan DMAP (14) (0,092 g; 0,75 mmol) dan 3-bromoanilina (16) (54,4 µL; 0,50 mmol)
Direfluks pada suhu 66ºC selama 135 menit (reaksi dipantau dengan KLT)
LAMPIRAN A
SKEMA KERJA
1. Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
Larutan asam
Direfluks pada suhu 66ºC selama 135 menit (reaksi dipantau dengan KLT)
Ditambahkan larutan asam pirazina-2-karboksilat
(15) (0,094 g; 0,76 mmol) dalam 20 mL THF, trietilamina (21) (104 µL; 0,75 mmol), 2,4,6-triklorobenzoil klorida (13) (107,2 µL; 0,75 mmol) dan DMAP (14) (0,092 g; 0,75 mmol)
Ditambahkan larutan asam pirazina-2-karboksilat
(15) (0,093 g; 0,75 mmol) dalam 20 mL THF, trietilamina (21) (104 µL; 0,75 mmol), 2,4,6-triklorobenzoil klorida (13) (107,2 µL; 0,75 mmol) dan DMAP (14) (0,092 g; 0,75 mmol)
Hasil reaksi disaring
Residu Filtrat*
Filtrat*
Ditambahkan 30 mL akuades dingin
Diekstraksi dengan diklorometana (2x25 mL) Fasa organik
Dicuci dengan larutan HCl 5% (3x25 mL), NaOH 5% (3x25 mL), NaHCO3 5% (3x25 mL) dan akuades (2x25 mL)
Dikeringkan dengan MgSO4 anhidrat dan diuapkan pada tekanan rendah
N-(3-bromofenil)pirazina-2-karboksamida (18)**
** diuji kemurnian dengan KLT dan titik leleh dan diidentifikasi struktur dengan spektroskopi inframerah, spketroskopi NMR dan spektroskopi massa (ESI)
Dimurnikan dengan kromatografi kolom gravitasi menggunakan eluen kloroform:n-heksana (1:1)
53
Diaduk pada suhu ruang selama 20 menit
Ditambahkan larutan asam pirazina-2-karboksilat
(15) (0,093 g; 0,75 mmol) dalam 20 mL THF, trietilamina (21) (104 µL; 0,75 mmol), 2,4,6-triklorobenzoil klorida (13) (107,2 µL; 0,75 mmol) dan DMAP (14) (0,092 g; 0,75 mmol)
2. Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
Larutan asam 4-bromoanilina (17) (0,0867 g; 0,51 mmol)
Direfluks pada suhu 66ºC selama 5,5 jam (reaksi dipantau dengan KLT)
Direfluks pada suhu 66ºC selama 5,5 jam (reaksi dipantau dengan KLT)
Ditambahkan larutan asam pirazina-2-karboksilat
(15) (0,093 g; 0,75 mmol) dalam 20 mL THF, trietilamina (21) (104 µL; 0,75 mmol), 2,4,6-triklorobenzoil klorida (13) (107,2 µL; 0,75 mmol) dan DMAP (14) (0,092 g; 0,75 mmol) Direfluks pada suhu 66ºC selama 1 jam (reaksi dipantau dengan KLT)
Hasil reaksi disaring
LAMPIRAN B
Filtrat*
Ditambahkan 30 mL akuades dingin
Diekstraksi dengan diklorometana (2x25 mL) Fase organik
Dicuci dengan larutan HCl 5% (25 mL), NaOH 5% (25 mL), NaHCO3 5% (25 mL) dan akuades (25 mL)
N-(4-bromofenil)pirazina-2-karboksamida (19)**
** diuji kemurnian dengan KLT dan titik leleh dan diidentifikasi struktur dengan spektroskopi inframerah, spektroskopi NMR dan spektroskopi massa (ESI)
Dikeringkan dengan MgSO4 anhidrat dan diuapkan pada tekanan rendah
55
LAMPIRAN B
PERHITUNGAN
1. Sintesis N-(3-bromofenil)pirazina-2-karboksamida (18)
Tahap pertama mol N-(3-bromofenil)pirazina-2-karboksamida (18) =0,50 mmol Mr N-(4-bromofenil)pirazina-2-karboksamida (17) =278,12 g/mol Massa (17) teoritis = 0,50 mmol x 278,12 g/mol
Massa (17) yang diperoleh = 0,09 g
Rendemen (17) = x 100%
= x 100% = 64%
2. Sintesis N-(4-bromofenil)pirazina-2-karboksamida (19)
57
mol N-(4-bromofenil)pirazina-2-karboksamida (19) =0,51 mmol Mr N-(4-bromofenil)pirazina-2-karboksamida (19) =278,12 g/mol Massa (18) teoritis = 0,51 mmol x 278,12 g/mol
= 141,84 mg = 0,14 g Massa (18) yang diperoleh = 131,4 mg = 0,13 g Rendemen (16) = x x 100%
= x 100%
= 93 %
massa yang diperoleh massa teoritis 0,13 g
59
BIODATA PENULIS
Penulis bernama First Ambar Wati, lahir di Sidoarjo pada tanggal 07 November 1994, merupakan anak pertama dari dua barsaudara. Pendidikan formal yang telah ditempuh oleh penulis yaitu di SDN Mulyodadi, SMPN 1 Wonoayu, dan SMAN 1 Wonoayu. Pada tahun 2012, penulis lulus dari jenjang SMA dan melanjutkan pendidikan di jurusan Kimia ITS melalui jalur SNMPTN Tulis dengan Nomor Registrasi Pokok 1412100087.