HASIL DAN PEMBAHASAN
Preparasi Sampel
Akar tanaman sungkai sayur digunakan pada penelitian ini diperoleh dari hutan tropika basah, secara administratif masuk di wilayah desa Pendreh Kabupaten Muara Teweh Propinsi Kalimantan Tengah. Berdasarkan hasil identifikasi tumbuhan oleh Pusat Penelitian Biologi LIPI, tumbuhan ini termasuk dalam suku Menispermaceae dengan nama latin Albertisia papuana Becc.
Albertisia papuana Becc yang digunakan sebagai contoh uji, dipilih dari tumbuhan yang sehat secara fisik tanpa melihat usia tumbuhan karena diperoleh dari hutan tanpa budidaya dan bagian yang diambil adalah akar tunggang, sehingga diharapkan senyawa-senyawa di dalam akar telah terbentuk sempurna. Akar yang digunakan adalah akar yang berwarna coklat yang berkualitas baik. Akar yang berkualitas baik adalah yang tidak terinfeksi oleh virus, bakteri atau jamur (Harbone 1997). Untuk menghindari pencemaran akibat komponen pengotor seperti debu dan tanah, maka akar sebelum dianalisis dicuci dalam waktu yang singkat dan tidak diulang untuk mencegah berkurangnya rendemen alkaloid karena sebagian kecil alkaloid akan larut bersama air pencuci. Bagian akar dipilih sebagai sampel didasarkan pada kearifan lokal masyarakat setempat yang memanfaatkan akar ini sebagai obat tradisional untuk menurunkan tekanan darah tinggi.
Pengeringan dilakukan pada suhu ruangan tanpa menggunakan suhu tinggi selama 3 hari untuk mencegah terjadinya perubahan kimia yang tidak diinginkan. Dihasilkan 2.500 gram serbuk akar sungkai sayur berwarna coklat terang yang telah dikering anginkan dari 6.500 gram berat kotor akar.
Kadar Air Sampel Albertisia papuana Becc
Kadar air berguna untuk menyatakan kandungan zat dalam tumbuhan sebagai persen bahan kering dan untuk mengetahui ketahanan suatu bahan dalam penyimpanan. Tujuan pengeringan sampel untuk menghindari pertumbuhan mikroba, sebab kadar air pada bahan akan mempengaruhi daya tahan terhadap serangan mikroba. Kadar air yang terkandung dalam sampel tersebut ditentukan banyak faktor seperti kelembaban udara,
perlakuan terhadap bahan, waktu pengambilan bahan, dan besarnya penguapan. Kadar air sampel Albertisia papuana Becc adalah 3,53 %, Secara lengkap kadar air Albertisia
papuana Becc disajikan pada Lampiran 4.
Ekstraksi
Ekstraksi dilakukan dengan cara soxhletasi dan maserasi mengikuti metode Lohombo-Ekomba et al. (2004). Metode sokhlet dengan pelarut n-heksana bertujuan untuk mengambil senyawaan yang bersifat non polar seperti lemak dan terpen. Senyawaan lemak tersebut bila tidak dihilangkan maka pada proses ekstraksi akan didapat emulsi sehingga menyulitkan proses analisis selanjutnya. Pemanfaatan metode ini lebih efektif dari segi waktu karena dibantu oleh pemanasan. Struktur alkaloid yang ingin dijaring dalam penelitian ini memiliki struktur yang tahan terhadap pemanasan. Selanjutnya residu hasil soxhletasi dihilangkan pelarut dengan cara menguapkannya pada suhu ruang selama 24 jam, dilakukan maserasi dengan etanol 80 % selama 24 jam sebanyak 3 kali pengulangan dibantu dengan pengadukan. Metode maserasi dilakukan karena memiliki kelebihan yaitu cara pengerjaan dan peralatan sangat sederhana dan mudah, meskipun memiliki kekurangan yaitu pengerjaan lama dan pengekstrakan kurang sempurna.
Filtrat hasil maserasi dilakukan pemekatan dengan rotary evaporator sampai etanol menguap, dengan perhitungan kurang lebih 1/10 cairan tersisa dari volume filtrat awal, ekstrak kental diperoleh berwarna coklat tua. Penggunaan etanol sebagai bahan pengekstrasi pada proses maserasi karena menurut Harbone (1996), alkaloid dari tumbuhan bersifat basa sehingga untuk melarutkannya dapat dilakukan dengan alkohol yang bersifat asam lemah. Etanol merupakan pelarut serbaguna yang baik untuk ekstraksi pendahuluan. Selain itu menurut Achmadi (1990), cara pemilihan pelarut didasarkan pada selektifitas, mudah penanganannya, ekonomis, dan ramah lingkungan.
Ekstrak kental berwarna coklat tua selanjutnya diasamkan dengan HCl 0,1 M sampai memiliki pH 2-3. Tujuan pengasaman ini untuk melarutkan alkaloid di dalam air dalam bentuk garam amina (Robinson 1995). Amina bereaksi dengan asam kuat membentuk garam alkilamonium. Jenis reaksi ini digunakan untuk memisahkan amina dari zat netral atau zat yang larut dalam air bersuasana asam. Gambar 6 menampilkan mekanisme reaksi sebagai berikut (Fessenden & Fessenden 1997, Hart et al. 2003) :
+ H X R3N H X
R3N +
Gambar 6 Reaksi amina dengan asam kuat
(Sumber : Fessenden dan Fessenden 1997, Hart et al. 2003)
Hasil pengasaman dipartisi dengan menggunakan diklorometan (CH2Cl2) sebanyak 3 kali sehingga didapat dua lapisan yaitu lapisan air atau asam dan lapisan diklorometan. Lapisan air diambil kemudian dibasakan dengan NH4OH 6 % sampai pH 9-10 dan membentuk endapan. Proses tersebut sesuai dengan Robinson (1995) serta Hart, Craine & Hart (2003). Pada reaksi amina dengan asam kuat menghasilkan garam amina, yang dapat dibebaskan dari garamnya dengan membasakan larutan dengan basa kuat seperti NH4OH (Gambar 7).
R3NH Cl- R3NH2 + NH4+Cl- + H2O
NH4OH
air
Gambar 7 Reaksi pembasaan asam amina dengan cara pembasaan
Prosedur untuk mendapatkan ekstrak kasar alkaloid dari akar Albertisia papuana Becc yang dilakukan dalam penelitian ini, pada prinsipnya sesuai dengan pernyataan Wet (2005) dalam disertasinya, ada dua prosedur umum untuk mendapatkan ekstrak alkaloid yaitu ekstraksi alkaloid secara analitik dan secara bulk yaitu melalui tahap pengasaman dengan mengunakan asam kuat dan tahapan pembasaan untuk mengendapkan alkaloid.
Rendemen
Hasil ekstraksi sampel Albertisia papuana Becc mendapatkan rendemen sebesar 0,43 % dari berat kering serbuk sampel. Lavault et al. (1987) mengekstraksi alkaloid dari Albertisia Papuana, diperoleh rendemen sebesar 4,6 % dari serbuk kering sebesar 207 gram. Barbosa-Filho et al. (2000) memperoleh rendemen sebesar 1,24 % ekstrak kasar alkaloid dari daun Albertisia delageonsis dan 0,5 % rendemen untuk bagian tanaman yang menjalar di tanah (rizome) tumbuhan tersebut. Sementara Lohombo-Ekomba et al. (2004) pada jenis Albertisia sp bagian tumbuhan kulit akar, diperoleh rendemen yang lebih besar, yaitu 6,6 %.
Perbedaan hasil rendemen tersebut diduga disebabkan proses pembasaan amina dari garamnya tidak maksimal. Uji fitokimia pada Albertisia papuana Becc bagian supernatan fase basa menunjukkan adanya kandungan alkaloid cukup pekat (+++), yang mengindikasikan belum maksimal proses pembasaan, diduga disebabkan pH yang dibutuhkan harus lebih dari 10. Perbedaan rendemen ini disebabkan tempat tumbuh ekstrak sampel tumbuhan, karena kondisi alam dan tanah mempengaruhi kandungan metabolit sekunder (Harbone 1996). Perbedaan tersebut juga karena perbedaan sampel yang digunakan, serta dengan bertambahnya usia tumbuhan dan menumpuknya senyawa metabolit sekunder pada bagian tumbuhan. Umumnya senyawa alkaloid terkonsentrasi pada bagian bagian kulit tumbuhan, daun, akar dan bakal buah (Robinson 1995).
Kandungan Fitokimia
Simplisia Albertisia papuana Becc mengandung alkaloid, fenol hidrokuinon, triterpenoid, steroid, tanin dan saponin, akan tetapi yang negatif untuk flavonoid (Tabel 2). Adanya senyawa golongan alkaloid pada simplisia, sesuai dengan yang dilaporkan pada suku Menispermaceae (Henry 1913, Merie 1986, Simanjuntak 1995, Lohombo-Ekomba et al. 2004, Wet 2005). Uji kualitatif alkaloid pada ekstrak pekat alkaloid menunjukkan adanya alkaloid, yang lebih banyak dibandingkan supernatan fase basa maupun simplisianya.
Tabel 2 Hasil uji fitokimia Albertisia papuana Becc pada simplisia, ekstrak kasar alkaloid dan supernatan fase basa
Senyawa Simplisia Ekstrak kasar
alkaloid Supernatan fase basa Alkaloid Flavonoid Fenol Hidrokuinon Triterpenoid Steroid Tanin Saponin ++ - + + ++ + ++ ++++ - + + + + ++ +++ - + + - ++ +++
Keterangan: (-) : tidak terdeteksi; (+) : positif lemah; (++) : positif; (+++) : positif kuat; dan (++++) : positif sangat kuat.
Gambar 8 Uji fitokimia alkaloid: Dragendorf (D), Wagner (W) dan Mayer (M) terhadap simplisia (S), ekstrak kasar alkaloid (E), dan supernatan fase basa (Sp) dari Albertisia papuana Becc.
Hasil uji positif alkaloid ditunjukkan dengan terbentuknya endapan berwarna berturut-turut putih, coklat, dan merah jingga terhadap pereaksi Dragendorf, Wagner, dan Mayer (Gambar 8). Prinsip uji ini adalah reaksi penggantian ligan. Atom nitrogen yang mempunyai pasangan elektron bebas pada alkaloid dapat mengganti lignan iodo pada pereaksi Mayer sehingga membentuk endapan putih sebagai kompleks alkaloid. Pada uji ini, sebagai pengekstrak alkaloid dari bahan tumbuhan awal adalah kloroform-amoniak dan digunakan larutan asam untuk memisahkan.
Terbentuknya warna merah, kuning, atau jingga pada lapisan amil alkohol merupakan dasar penentuan adanya senyawa flavonoid pada sampel. Uji positif untuk triterpenoid serta steroid ditandai dengan terbentuknya warna merah atau ungu triterpenoid serta hijau atau biru untuk steroid. Saponin dapat membentuk buih yang stabil selama 10 menit setelah larutan sampelnya dikocok selama 10 menit. Senyawa tanin umumnya terdapat pada tanaman berpembuluh dan memberikan rasa sepat sehingga dapat berpotensi sebagai antifeedant, antioksidan, dan penghambat pertumbuhan tumor. Senyawa triterpenoid juga dapat memberikan rasa pahit dan saponin jika dikonsumsi berlebihan bersifat toksik.
Kandungan alkaloid pada simplisia terdeteksi lebih lemah dibandingkan alkaloid pada ekstrak kasar alkaloid, kemungkinan alkaloid masih ada didalam rongga sel tumbuhan (Fengel dan Wegener 1995). Pada ekstrak alkaloid dan supernatan, alkaloid
D W M
S
E
mampu dilarutkan oleh pelarut etanol sementara pada supernatan masih ada alkaloid dalam bentuk garam amina.
Uji Anti Plasmodium Ekstrak Kasar Alkaloid Albertisia papuana Becc Hasil perhitungan uji anti plasmodium ekstrak kasar alkaloid dari Albertisia
papuana Becc terlampir pada Lampiran 5, data hasil analisisnya ditampilkan pada Tabel
3. Dasar panen P. falciparum pada inkubasi 48 jam karena masa siklus parasit fase eritrosit dari bentuk cincin dan tropozoit membelah dan berkembang membentuk skizon membutuhkan waktu 48 jam. Waktu inkubasi 72 jam untuk melihat pengaruh penghambatan pada parasit sesudah siklus pertama lengkap (Pasvol 1992, Sutamihardja
et al. 2009).
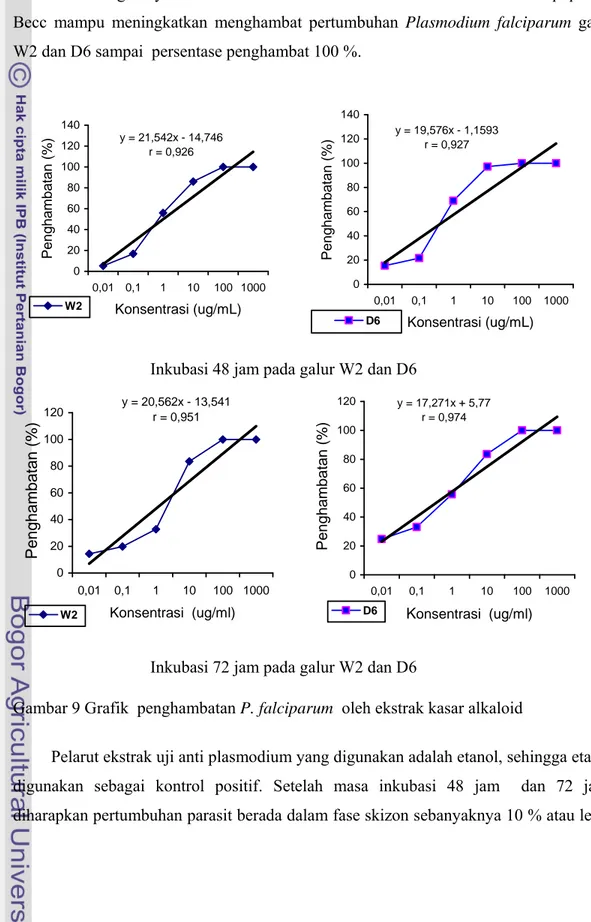
Persentase penghambatan P. falciparum galur W2 dan D6 dengan masa inkubasi 48 jam dan 72 terhadap ekstrak kasar alkaloid, baik pada konsentrasi 10 µg/mL dan 1000 µg/mL tidak menunjukkan perbedaan yang signifikan, berdasarkan Tabel 3 dan grafik pada Gambar 9.
Tabel 3 Persentase penghambatan P. falciparum terhadap ekstrak kasar alkaloid
Penghambatan (%)
Inkubasi 48 jam Inkubasi 72 jam Konsentrasi (µg/mL) W2 D6 W2 D6 0,01 5,17 15,43 14,31 24,78 0,1 16,79 21,65 19,86 33,13 1 55,88 69,90 32,79 55,47 10 86,06 97,16 83,60 83,60 100 100,00 100,00 100,00 100,00 1000 100,00 100,00 100,00 100,00 Keterangan: W2 : galur resisten klorokuin, D6 : galur sensitif
klorokuin
Hasil penelitian Syamsudin et al. (2007), menunjukkan adanya perbedaan masa inkubasi 72 jam lebih besar persentase penghambatan dibanding dengan masa inkubasi 24 jam. Hal ini kemungkinan disebabkan karena semakin lamanya kultur terpapar dengan ekstrak uji dan siklus fase hidup parasit kemungkinan sudah memasuki siklus berikutnya.
Pengujian antipalsmodium dengan menggunakan galur W2 dan D6, tujuannya untuk mengetahui efektivitas ekstrak/obat antimalaria yang dinilai dari sensitivitas atau resistensi parasit terhadap ekstrak tersebut (Purwantiningsih 2003). Hasil pengujiannya ditampilkan pada Tabel 3. Persentase penghambat pertumbuhan parasit pada galur resisten klorokuin (W2) dan galur sensitif klorokuin (D6) menunjukkan adanya perbedaan, D6 lebih besar tingkat persentase penghambatnya dibandingkan dengan W2 baik untuk 48 jam inkubasi dan 72 jam inkubasi. Menurut Tuti (1992) bahwa dalam tubuh parasit ada gen yang resisten dan yang sensitif terhadap ekstrak/obat tertentu, gen yang satu dapat menjadi/lebih dominan dari pada gen yang lain, sehingga menimbulkan resisten dan galur sensitif. Adanya mutasi gen dapat terjadi dalam tubuh parasit, yang memungkinkan parasit resisten terhadap ekstrak/obat dengan dosis tertentu. Sehingga parasit tersebut hidup dalam tubuh manusia, berkembang biak dan menimbulkan gejala penyakit walaupun telah diberikan pengobatan secara teratur baik dengan konsentrasi standar maupun pada konsentrasi yang lebih tinggi, yang masih dapat ditolerir oleh pemakai obat ( Tjitra 2000).
Jenis galur W2 yang digunakan dalam penelitian ini resisten terhadap klorokuin (NAMRU-2 2009). Berdasarkan data tersebut sehingga ekstrak kasar alkaloid dari akar
Albertisia papuana Becc, diduga kemampuan penghambatan pertumbuhan parasit serta
mekanisme sama dengan klorokuin. Menurut Tjitra (1994) dan Simanjuntak (1995), klorokuin merupakan obat antimalaria kelompok 4-animokuinolin yang bersifat skizontosida darah untuk semua jenis Plasmodium manusia dan gametositosida P. vivax dan P. malarie.
Uji anti plasmodium bahwa ekstrak kasar alkaloid dari akar Albertisia papuana Becc mampu menghambat pertumbuhan skizon P. falciparum. Pertumbuhan skizon terhambat bila protein yang berlangsung pada tahap trofozoit tidak terjadi (Iwo 1996). Mekanisme ekstrak kasar alkaloid ini diduga berhubungan dengan mekanisme kerja obat sintetik klorokuin, karena struktur klorokuin menunjukkan struktur alkaloid. Menurut Tuti (1992) serta Sukarban dan Zunilda (1995) mekanisme kerja klorokuin ini diduga berhubungan dengan sintesis asam nukleat dan nukleoprotein yaitu terhambat sintesa enzim pada parasit dalam polimerisasi DNA (Asam Deoksiribonukleat) dan RNA (Asam Ribonukleat). Ekstrak alkaloid bersenyawa dengan DNA sehingga proses
pembelahan dan pembentukan RNA terganggu pada parasit P. falciparum maka pertumbuhan parasit terhambat.
Gambar 9 menunjukkan grafik regresi linier sederhana yang menunjukkan semakin meningkatnya konsentrasi ekstrak kasar alkaloid dari akar Albertisia papuana Becc mampu meningkatkan menghambat pertumbuhan Plasmodium falciparum galur W2 dan D6 sampai persentase penghambat 100 %.
y = 21,542x - 14,746 r = 0,926 0 20 40 60 80 100 120 140 0,01 0,1 1 10 100 1000 Konsentrasi (ug/mL) Peng hamba tan (% ) W2 y = 19,576x - 1,1593 r = 0,927 0 20 40 60 80 100 120 140 0,01 0,1 1 10 100 1000 Konsentrasi (ug/mL) Peng hamba tan (% ) D6 y = 20,562x - 13,541 r = 0,951 0 20 40 60 80 100 120 0,01 0,1 1 10 100 1000 Konsentrasi (ug/ml) P enghambatan (% ) W2 y = 17,271x + 5,77 r = 0,974 0 20 40 60 80 100 120 0,01 0,1 1 10 100 1000 Konsentrasi (ug/ml) P eng hamba tan (%) D6
Gambar 9 Grafik penghambatan P. falciparum oleh ekstrak kasar alkaloid
Pelarut ekstrak uji anti plasmodium yang digunakan adalah etanol, sehingga etanol digunakan sebagai kontrol positif. Setelah masa inkubasi 48 jam dan 72 jam, diharapkan pertumbuhan parasit berada dalam fase skizon sebanyaknya 10 % atau lebih
Inkubasi 48 jam pada galur W2 dan D6
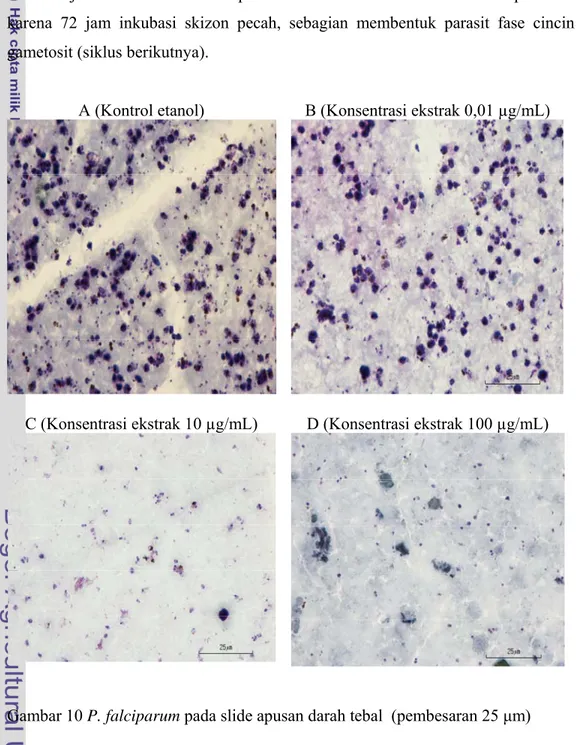
(20 skizon atau lebih per 200 asexual parasit) pada sumur kontrol etanol (WHO 2008). Kalau pertumbuhan skizon kurang dari 10 artinya skizon tidak tumbuh dengan baik, atau diduga terhambat oleh pelarut ekstrak uji atau etanol. Persentase pertumbuhan skizon pada media kontrol etanol pada 72 jam inkubasi W2 sebesar 41,5 % dan D6 sebesar 46,5 %. Pada 48 jam inkubasi W2 sebesar 56,5 % dan D6 sebesar 68,17 %. Penelitian ini pertumbuhan parasit sudah memenuhi standart WHO dalam pengujian ekstrak uji atau obat. Perbedaan pertumbuhan skizon berdasarkan masa panen diduga karena 72 jam inkubasi skizon pecah, sebagian membentuk parasit fase cincin dan gametosit (siklus berikutnya).
A (Kontrol etanol) B (Konsentrasi ekstrak 0,01 µg/mL)
C (Konsentrasi ekstrak 10 µg/mL) D (Konsentrasi ekstrak 100 µg/mL)
Gambar 10 menunjukkan bahwa parasit P. falciparum pada fase skizon tumbuh dengan baik dalam media kontrol etanol. Pada konsentrasi terendah yaitu 0,01 μg/mL, skizon masih tumbuh dengan baik. Terlihat dari ciri-ciri bentuk skizon yaitu terdapat inti parasit lebih dari tiga berwarna merah menyala, plasma berwarna biru kecoklatan dari titik-titik Maurer (ciri-ciri parasit) berwarna merah. Pada konsentrasi 10 μg/mL masih terdapat tropozoid dan skizon dan pada konsentrasi 100 μg/mL skizon sudah tidak tumbuh bahkan parasit dalam bentuk cincin di temukan dalam keadaan tidak sehat, terlihat hanya titik kecil berwarna hitam tanpa plasma berbentuk ekor atau cincin berwarna biru.
Kromatografi Lapis Tipis
Ekstrak kasar alkaloid difraksinasi menggunakan kromatografi kolom kilas tetapi terlebih dahulu ditentukan eluen terbaik mengunakan kromatografi Lapis Tipis analitik (KLT), dengan penyerap silika gel. Metode pemisahan kandungan tumbuhan menurut Harbone (1996), dilakukan dengan menggunakan salah satu tehnik kromatografi atau gabungan dari teknik tersebut.
Kombinasi pelarut yang digunakan adalah campuran diklorometan : metanol (1:1) dan campuran aseton : metanol (9:1). Hasil penapisan ini menunjukkan pelarut diklorometana : metanol memiliki pemisahan spot yang terbaik dan diperoleh 8 spot. Campuran pelarut aseton : metanol menghasilkan pola spot yang tidak baik. Pola spot kedua kombinasi pelarut ditampilkan pada Gambar 11, terlihat adanya pemisahan spot yang kurang baik polanya pada campuran aseton : metanol dibandingkan dengan pola spot campuran diklorometan : metanol yang baik. Pemilihan pelarut pengembang dalam penelitian ini mengacu pada hasil penelitian Lohombo-Ekomba et al. (2004), tehnik pemilihan ini didukung juga oleh Gritter et al. (1991), menyatakan bahwa pemilihan pelarut pengembang dapat didasari dari informasi pustaka yang diacu.
A B
Gambar 11 Pola KLT ekstrak kasar alkaloid: Campuran A (diklorometana : metanol (1:1)) dan Campuran B (aseton : metanol (9:1)).
Pola pada KLT dihitung nilai Rfnya. Nilai Rf menunjukkan adanya perbedaan sifat molekul senyawa tersebut. Molekul paling lemah diabsobrsi oleh absorben terlebih dahulu dan akan bergerak membentuk pola yang paling tinggi kemudian diikuti oleh molekul senyawa yang lebih rendah. Sehingga kecilnya nilai Rf menunjukkan semakin tingginya berat molekul senyawa. Pergerakan suatu senyawa dalam ekstrak alkaloid di KLT akan bergantung pada kesamaan polaritasnya dengan polaritas eluen. Senyawa yang non polar akan semakin lama tertahan pergerakannya jika menggunakan pelarut yang polar begitu juga sebaliknya. Banyak spot pada KLT mengindikasikan banyaknya senyawa metabolit sekunder pada ekstrak kasar alkaloid.
Fraksinasi dengan Kromatografi Kolom Kilas
Fase gerak yang digunakan pada kromatografi kolom kilas yaitu diklorometana : metanol (1:1). Semakin menurunnya nilai polaritas sistim eluen, semua komponen akan terelusi lebih lambat. Sebaliknya, semakin meningkatnya nilai polaritas sistem eluen, semua komponen akan terelusi lebih cepat. Fasa diam yang digunakan adalah silika gel (SiO) yang bersifat polar. Laju alir yang digunakan adalah laju alir sedang, yaitu 3 mL/menit dengan suhu berkisar 27-28 oC. Sampel yang akan disuntikkan dilarutkan terlebih dahulu menggunakan diklorometana : metanol (1:1). Sebanyak 3 mL sampel disuntikkan agar proses elusi dapat berjalan secara lancar dan ekstrak pekat alkaloid tidak tersumbat pada pori silika gel. Elusi yang digunakan dalam fraksinasi ini adalah elusi isokratik. Elusi ini digunakan karena untuk menghemat pelarut dan efisiensi waktu.
Meningkatnya laju eluen dalam proses elusi sampel disebabkan oleh tekanan udara. Waktu pemisahan cepat disebabkan oleh mekanisme partisi solut antara eluen dan fasa diam menjadi lebih cepat. Eluen dan kromatografi kolom kilas dipisahkan berdasarkan volume retensi senilai 3 mL. Bila warna sampel yang disuntikan dalam kromatografi kolom kilas berwarna kuning pudar, menunjukkan bahwa sampel mengandung alkaloid terelusi seluruhnya. Proses fraksinasi dengan kromatografi kolom kilas dihentikan, dan menghasilkan sebanyak 268 tabung reaksi.
Penentuan jumlah fraksi dilakukan dengan menggunakan KLT analitik, yaitu eluat yang memiliki pola KLT (nilai Rf dan warna pola) yang sama digabungkan menjadi satu fraksi. Pola penggabungan fraksi tersebut tergambar pada Gambar 12.
Gambar 12 Penggabungan fraksi KLT berdasarkan pola dari ekstraksi Albertisia
papuana Becc
Setiap fraksi dikeringkan lalu beratnya ditimbang dan dihitung rendemennya. Fraksi F7 memiliki rendemen yang paling besar, yaitu sebesar 7,80%, sedangkan rendemen yang terkecil sebesar 3,01% pada fraksi F8. Ke 8 fraksi ini selanjutnya di uji anti plasmodium untuk memperoleh fraksi teraktif. Rendemen dari delapan fraksinasi tersebut di tampilkan pada Tabel 4.
Tabel 4 Rendemen delapan fraksi dari ekstrak kasar alkaloid
Albertisia papuana Becc
Fraksi Rendemen (%) Warna fisik fraksi F1 F2 F3 F4 F5 F6 F7 F8 6,80 7,40 6,29 5,87 4,74 6,10 7,96 3,01 Kuning pucat Kuning Kuning pekat Kuning pink Pink pekat Pink muda
Kuning pink pucat Kuning pudar
Uji Anti Plasmodium Fraksi Alkaloid Albertisia papuana Becc Hasil uji aktivitas antiplasmodium pada beberapa konsentrasi fraksi alkaloid dari
Albertisia papuana Becc, ditampilkan dalam bentuk Tabel 5 dan Gambar 13
menunjukkan hubungan antara konsentrasi fraksi terhadap persentase penghambatan pertumbuhan P. falciparum.
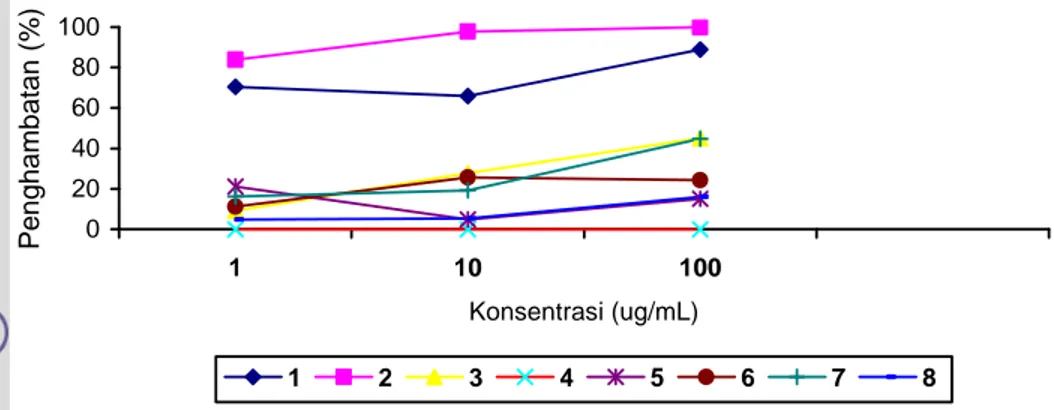
Tabel 5 Persentase penghambatan P. falciparum pada beberapa konsentrasi fraksi alkaloid Albertisia papuana Becc
Konsentrasi (μg/mL) Fraksi 1 10 100 F1 F2 F3 F4 F5 F6 F7 F8 70,50 83,90 9,29 0,00 21,15 11,22 16,35 4,81 66,00 97,75 27,88 0,00 4,81 25,64 19,23 5,45 89,00 100,00 45,19 0,00 15,06 24,36 44,87 16,03
0 20 40 60 80 100 1 10 100 Konsentrasi (ug/mL) Pe ngh ambatan ( %) 1 2 3 4 5 6 7 8
Gambar 13 Grafik persentase penghambat P falciparum terhadap fraksi alkaloid
Albertisia papuana Becc
Delapan fraksi yang dilakukan uji anti P. falciparum, fraksi F1 dan F2 menunjukkan persentase penghambatan diatas 66 %. Terutama pada fraksi F2 menunjukkan persentase penghambatan 100 % pada konsentrasi 100 μg/mL. Fraksi F3, F5, F7 dan F8 menunjukkan persentase penghambatan yang kecil, yang berarti ketidak aktifan fraksi terhadap pertumbuhan P. falciparum. Pada fraksi F4 tidak ada persentase penghambatan, menurut Tuti et al. (1994) diduga pada fraksi F4 mengandung bakteri dan jamur, sehingga mengkontaminasi parasit pada sumur uji. Ditandai adanya perubahan warna darah pada sumur uji menjadi berwarna coklat yang berarti sel darah merah sudah lisis. Waktu pemanenan tidak terjadi pemisahan antara darah dan supernatan. Sehingga tidak dapat dibuat slide apusan darah tebal. Warna darah rusak tersebut ditampilkan pada Gambar 14.
Dibandingkan dengan ekstrak alkaloid bisbenzylisoquinolin dari batang Triclisia
patens nilainya IC50 (paeantin) = 1,43 µg/mL, piknamin = 0,15 µg/mL, aromalin = 0,67 µg/mL terhadap P. falciparum (Simanjuntak 1995). Ekstrak alkaloid dari daun
Albertisia delegoensis dengan nilai IC50 = 4,1 µg/mL dan batangnya IC50 = 1,6 µg/mL mampu menghambat pertumbuhan P. falciparum (Wet 2005), menunjukkan bahwa fraksi alkaloid dari Albertisia papuana Becc daya persentase penghambatnya lebih baik. Hasil uji anti plasmodium ekstrak kasar alkaloid (Tabel 3) dengan alkaloid fraksi F2 (Tabel 5) pada pada konsentrasi 10 µg/mL memperlihatkan persentase penghambatan yang tidak berbeda nyata, diduga proses pemisahan belum sempurna dan pada fraksi F2 merupakan bukan senyawa alkaloid murni didukung dengan pola penggabungan pola (Gambar 12). Gambar 12 menampilkan Fraksi aktif F2 ditampung dari tabung reaksi nomor 35 sampai 77 yang mempunyai pola yang sama.
Karakteristik Fraksi Aktif Identifikasi Spektrofotometer UV-VIS
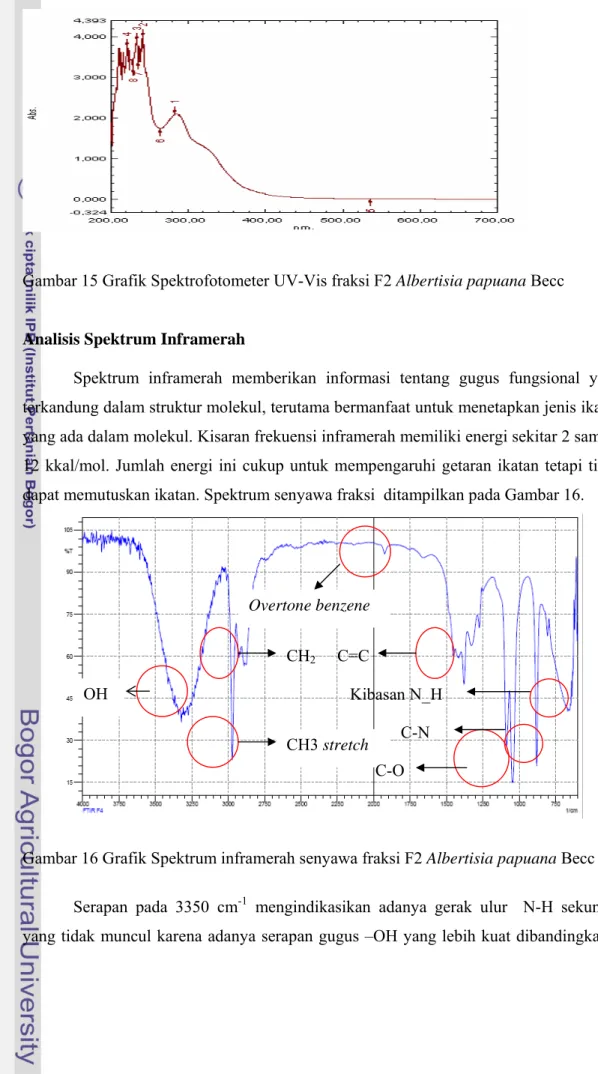
Hasil spektrofotometer UV fraksi F2 ekstrak kasar alkaloid dari Albertisia
papuana Becc menunjukkan serapan maksimum pada panjang gelombang 282,5 nm dan
serapan tambahan pada panjang gelombang 241 nm, 232,5 nm dan 220,5 nm (Gambar 15). Serapan antara 220-230 nm adalah serapan untuk imina terkonjugasi transisi π - π *. Adanya serapan maksimum pada panjang gelombang 282,5 nm disebabkan pengasaman dari amina menghasilkan suatu muatan positif pada nitrogen sehingga terjadi geseran serapan ke arah 270-290 nm (Silverstein et al. 1984).
Gambar 15 Grafik Spektrofotometer UV-Vis fraksi F2 Albertisia papuana Becc
Analisis Spektrum Inframerah
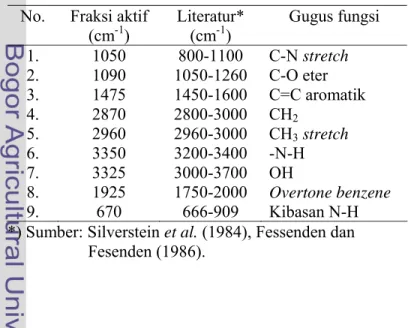
Spektrum inframerah memberikan informasi tentang gugus fungsional yang terkandung dalam struktur molekul, terutama bermanfaat untuk menetapkan jenis ikatan yang ada dalam molekul. Kisaran frekuensi inframerah memiliki energi sekitar 2 sampai 12 kkal/mol. Jumlah energi ini cukup untuk mempengaruhi getaran ikatan tetapi tidak dapat memutuskan ikatan. Spektrum senyawa fraksi ditampilkan pada Gambar 16.
Gambar 16 Grafik Spektrum inframerah senyawa fraksi F2 Albertisia papuana Becc
Serapan pada 3350 cm-1 mengindikasikan adanya gerak ulur N-H sekunder yang tidak muncul karena adanya serapan gugus –OH yang lebih kuat dibandingkan –
OH CH3 stretch CH2 Overtone benzene C-O C-N C=C Kibasan N_H
NH. Pendapat tersebut didukung oleh Fessenden dan Fessenden (1999), ikatan hidrogen mempunyai pengaruh pada lebarnya absorpsi infra merah yang berasal dari ikatan OH atau NH. Absorpsi amina (NH) lebih lemah dari pada alkohol (OH). Karena ikatan hidrogen amina lebih lemah dari pada ikatan gugus fungsi alkohol (Silverstein et al. 1984). Adanya serapan pada 1050 cm-1 merupakan serapan gugus C-N stretch tak terkonjugasi dalam amina sekunder yang mendukung adanya gugus N-H sekunder. Serapan pada 1095 cm-1 diduga merupakan serapan dari C=O. Adanya gugus aromatik atau benzen diikuti oleh tiga ciri pada spektrum yaitu overtone pada 1090 cm-1, terdapat gugus aromatik C=C yang di tunjukkan adanya empat puncak lemah pada kisaran 1450-1600 cm-1, serta pada daerah sidik jari terdapat banyak puncak, walaupun tidak selalu demikian. Gugus fungsi pendukung lain yang ditunjukan oleh gambar spektrum inframerah adalah CH3 stretch didaerah 2980 cm-1 dan CH2 2870 cm-1. Hasil interpretasi tersebut menunjukkan bahwa pada fraksi Albertisia papuana Becc memiliki senyawa aktif anti malaria di duga golongan alkaloid. Hasil pembacaan spektrum inframerah pada Gambar 16 dikelompokan dalam beberapa gugus fungsi, yang ditampilkan pada Tabel 5. Pendapat tersebut didukung Leboeuf et al.(1982), Lavault et al. (1987), Simanjuntak (1995), Lohombo-Ekomba et al. (2004), Wet (2005), bahwa jenis
Triclisia patens, Tiliacora triandra, Albertisia villosa, Albertisia delagoensis termasuk
suku Menispermacea. Suku ini sama dengan Albertisia papuana Becc mengandung senyawa golongan alkaloid berdasarkan gugus fungsi hasil interpretasi spektrum inframerah.
Tabel 5 Perbandingan panjang gelombang (cm-1) No. Fraksi aktif
(cm-1) Literatur* (cm-1) Gugus fungsi 1. 2. 3. 4. 5. 6. 7. 8. 9. 1050 1090 1475 2870 2960 3350 3325 1925 670 800-1100 1050-1260 1450-1600 2800-3000 2960-3000 3200-3400 3000-3700 1750-2000 666-909 C-N stretch C-O eter C=C aromatik CH2 CH3 stretch -N-H OH Overtone benzene Kibasan N-H *) Sumber: Silverstein et al. (1984), Fessenden dan