BAB I PENDAHULUAN Enzim
Enzim adalah biomolekul yang berfungsi sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis bereaksi) dalam suatu reaksi kimia. Hampir semua enzim merupakan protein. Pada reaksi yang dikatalisasi oleh enzim, molekul awal reaksi disebut sebagai substrat, dan enzim mengubah molekul tersebut menjadi molekul-molekul yang berbeda, disebut produk. Hampir semua proses biologis sel memerlukan enzim agar dapat berlangsung dengan cukup cepat.
Enzim bekerja dengan cara menempel pada permukaan molekul zat-zat yang bereaksi dan dengan demikian mempercepat proses reaksi. Percepatan terjadi karena enzim menurunkan energi pengaktifan yang dengan sendirinya akan mempermudah terjadinya reaksi. Sebagian besar enzim bekerja secara khas, yang artinya setiap jenis enzim hanya dapat bekerja pada satu macam senyawa atau reaksi kimia. Hal ini disebabkan perbedaan struktur kimia tiap enzim yang bersifat tetap. Sebagai contoh, enzim α-amilase hanya dapat digunakan pada proses perombakan pati menjadi glukosa.
Enzim Amilase
Proses pencernaan makanan dalam tubuh manusia dapat dilakukan melalui dua cara, yaitu secara mekanik dan kimiawi. Proses pencernaan secara mekanik terjadi di rongga mulut melalui bantuan gigi. Makanan masuk ke rongga mulut, dicerna secara mekanik dengan cara dipotong-potong, dicincang, dihaluskan dengan bantuan gigi seri, gigi taring dan gigi geraham. Selain itu makanan yang ada dirongga mulut juga mengalami pencernaan secara kimiawi dengan bantuan enzim. Amilase merupakan enzim yang berada dalam saliva(air liur) yang berfungsi sebagai pemecah amilum(polisakarida) menjadi maltosa(disakarida)dan glukosa. Maltosa yang terbentuk akan dicerna lebih lanjut menjadi glukosa (monosakarida) dengan bantuan enzim maltase.
Amilase dipecah menjadi gula oleh enzim amilase yang terdapat pada saliva. Saliva diproduksi dan dikeluarkan oleh kelenjar salivary. Saliva/air liur memiliki beberapa fungsi, salah satu diantaranya adalah menginisiasi pencernaan zat tepung.
Gambar 1. Enzim Amilase
Amilase adalah enzim pencernaan yang diklasifikasikan sebagai saccharidase (enzim yang memecah polisakarida). Amilase memecah rantai karbohidrat yang panjang (seperti zat tepung/amilum) menjadi unit-unit yang lebih kecil.
Amilase dapat dikelompokkan menjadi 3 golongan enzim, yaitu:
α-amilase
Enzim ini memecah ikatan 1-4 yang terdapat dalam amilun dan disebut endoamilase sebab enzim ini memecah bagian dalam atau bagian tengah molekul amilum. Enzim α-amilase terdapat pada tanaman, jaringan mamalia dan mikroba. α-amilase mruni dapat diperoleh dari berbagai sumber, misalnya malt, ludah manusia dan pankreas. Dapat juga diisolasi dari Aspergillus oryzae dan Bacillus subtilis. Berat molekul α-amilase sekitar 50.000. setiap molekul mengandung satu ion Ca++. Dengan filtrasi gel dapat dipisahkan dua jenis α-amilase, yaitu yang cepat bergerak dengan BM 50.000 dan yang lambat dengan BM 100.000. Enzim dengan BM 50.000 merupakan monomer enzim α-amilase. Enzim dimer terjadi bila ada ion zink, dan kedua enzim dihubungkan melalui ion zink tersebut. Cara kerja α-amilase melalui 2 tahap:
Degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Degradasi ini terjadi sangat cepat dan diikuti dengan menurunnya viskositas dengan cepat pula.
Pembentukkan glukosa dan maltosa sebagai hasil akhir. Yang kedua ini reaksinya relatif sangat lambat.
Kedua reaksi tersebut merupakan kerja enzim α-amilase pada molekul amilosa saja.
Aktivitas enzim α-amilase ditentukan dengan mengukur hasil degradasi pati. Pati merupakan karbohidrat polisakarida yang terdiri atas rantai unit glukosa dan penting sebagai simpanan energi pada
tumbuhan. Pati disintesis selama proses fotosintesis dan mudah diubah menjadi glukosa oleh enzim amilase.
Hasil degradasi pati biasanya dari penurunan kadar pati yang larut atau kadar dekstrinnya dengan menggunakan substrat jenuh. Ptialin adalah enzim amilase yang ditemukan pada air liur dan memecah amilum menjadi maltosa dan dextrin. Aksi dari amilase dapat diuji dengan test iodine. Iodin memiliki warna merah kecoklatan dan jika ditambah dengan zat tepung maka akan berubah menjadi biru kehitaman. Pada saat amilum dihidrolisis oleh amilase menjadi maltosa, maka jumlah amilum menurun dan ditandai dengan menghilangnya warna biru kehitaman dari larutan (iodine+zat tepung). Amilase tidak dapat bekerja pada suhu tinggi karena dapat terjadi denaturasi.
Disamping itu, keaktifan enzim α-amilase dapat juga dinyatakan dalam berbagai cara, misalnya dengan pengukuran viskositas dan jumlah pereduksi yang terbentuk.
β-amilase
Enzim ini berfungsi menghidrolisis unit-unit gula dari ujung molekul pati. Oleh karena itu maka disebut sebagai eksoamilase.
β-amilase terdapat pada berbagai hasil tanaman, tetapi tidak terdapat pada mamalia dan mikroba. Secara murni telah dapat diisolasi dari kecambah barley, ubi jalar dan kacang kedelai.
Meskipun namanya β-amilase namum enzim ini tidak memecah ikatan glukosida β-1,4. Enzim β-amilase ini memecah ikatan
glukosida α-1,4 pada pati dan glikogen dengan membalikkan konfigurasi karbon anomeri glukosa dari α menjadi β. Karena perubahan konfigurasi dari α ke β inilah maka enzim tersebut dinamakan β-amilase.
Cara hidrolisis ikatan α-1,4 oleh β-amilase terjadi secara bertahap, dari arah luar atau ujung rantai gula yang bukan pereduksi. Hidrolisis terjadi dengan memotong 2 unit glukosa.
Enzim β-amilase aktif pada pH 5,0 - 6,0. β-amilase yang berasal dari barley lebih tahan panas daripada α-amilase. Molekul β-amilase lebih berat dari BM α-β-amilase, tidak memerlukan koenzim baik dalam bentuk kofaktor inorganik maupun organik, dan inaktivasinya dengan pereduksi sulfhidril (p-kloro merkuri benzoate) atau oleh oksidasi.
γ-amilase diketahui terdapat dalam hati, enzim ini dapat memecah ikatan 1-1 dan 1-6 pada glikogen dan menghasilkan glukosa.
Hal yang berkaitan dengan enzim dipelajari dalam enzimologi. Dalam dunia pendidikan tinggi, enzimologi tidak dipelajari tersendiri sebagai satu jurusan tersendiri tetapi sejumlah program studi memberikan mata kuliah ini. Enzimologi terutama dipelajari dalam kedokteran, ilmu pangan, teknologi pengolahan pangan, dan cabang-cabang ilmu pertanian.
Kerja enzim dipengaruhi oleh beberapa faktor, terutama adalah substrat, suhu, keasaman, kofaktor dan inhibitor. Tiap enzim memerlukan suhu dan pH (tingkat keasaman) optimum yang berbeda-beda karena enzim adalah protein, yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Di luar suhu atau pH
yang sesuai, enzim tidak dapat bekerja secara optimal atau strukturnya akan mengalami kerusakan. Hal ini akan menyebabkan enzim kehilangan fungsinya sama sekali. Kerja enzim juga dipengaruhi oleh molekul lain. Inhibitor adalah molekul yang menurunkan aktivitas enzim, sedangkan aktivator adalah yang meningkatkan aktivitas enzim. Banyak obat dan racun adalah inihibitor enzim.
SUBSTRAT adalah substansi yang mengalami perubahan kimia setelah bercampur dengan enzim, sedangkan PRODUK adalah substansi baru yang terbentuk setelah reaksi mencapai keseimbangan.
APOENZIM bagian enzim yang merupakan protein, mempunyai struktur 3 dimensi. Pada enzim tersebut sangat penting untuk aktifitas kalalisis, oleh karena itu perubahan konformasi yang sedikit saja pada struktur enzim akan mempengaruhi aktifitasnya. Seperti protein pada umumnya enzim dapat mengalami denaturasi oleh berbagai faktor, seperti : perubahan pH yang mencolok, temperatur, pelarut organik, urea dan dapat dihambat oleh racun enzim.
Susunan enzim
• Komponen utama enzim adalah protein
• Protein yang sifatnya fungsional, bukan protein struktural • Tidak semua protein bertindak sebagai enzim
International Commision On Enzymes mengelompokkan enzim menjadi enam kelompok besar berdasarkan jenis reaksi yang dikatalisis yaitu:
a. Oksidoreduktase.
Enzim oksidoreduktase berperan dalam pemindahan elektron (sebagai e-, atom H, atau ion hidrida) dari suatu senyawa ke suatu akseptor.
b. Transferase.
Enzim transferase memiliki fungsi dalam pemindahan gugus fungsional misalnya gugus asil, amino, metil atau fosfat.
Enzim
Protein
Enzim proteinsederhana
Protein +
Bukan Protein
Protein = apoenzimEnzim
Konjugasi
Bukan protein = Gugus prostetik Organik = Koenzim Anorganik = kofaktorc. Hidrolase.
Jenis reaksi yang dikatalisis oleh enzim hidrolase adalah pemisahan ikatan C-O, C-N, atau C-S dengan penambahan H2O pada ikatan.
d. Liase.
Enzim liase mengkatalisis reaksi penambahan gugus ke ikatan rangkap atau pembentukan suatu ikatan rangkap yang baru.
e. Isomerase.
Jenis reaksi yang dikatalisis oleh enzim isomerase adalah reaksi pemindahan gugus di dalam molekul untuk menghasilkan bentuk isomerik.
f. Ligase.
Enzim ligase mengkatalisis reaksi pembentukan ikatan C, S, O dan C-N disertai penguraian berenergi tinggi misalnya ATP.
Tubuh manusia menghasilkan berbagai macam enzim yang tersebar di berbagai bagian dan memiliki fungsi tertentu. Salah satu enzim yang penting dalam sistem pencernaan manusia adalah enzim amilase. Enzim ini terdapat dalam saliva atau air liur manusia. Saliva yang disekresikan oleh kelenjar liur selain mengandung enzim amilase juga mengandung 99,5% air, glikoprotein, dan musin yang bekerja sebagai pelumas pada waktu mengunyah dan menelan makanan. Amilase yang terdapat dalam saliva adalah α-amilase liur yang mampu membuat polisakarida (pati) dan glikogen dihidrolisis menjadi maltosa dan oligosakarida lain dengan menyerang ikatan glikosodat α(1 4). Amilase liur akan segera terinaktivasi pada pH 4,0 atau kurang sehingga kerja pencernaan makanan dalam mulut akan terhenti apabila lingkungan lambung yang asam menembus partikel makanan.
Struktur dan Mekanisme
Diagram pita yang menunjukkan karbonat anhidrase II. Bola abu-abu adalah kofaktor seng yang berada pada tapak aktif. Enzim umumnya merupakan protein globular dan ukurannya berkisar dari hanya 62 asam amino pada monomer
4-oksalokrotonat tautomerase, sampai dengan lebih dari 2.500 residu pada asam lemak sintase. Terdapat pula sejumlah kecil katalis RNA, dengan yang paling umum merupakan ribosom. Jenis enzim ini dirujuk sebagai RNA-enzim ataupun ribozim. Aktivitas enzim ditentukan oleh struktur tiga dimensinya (struktur kuaterner). Walaupun struktur enzim menentukan fungsinya, prediksi aktivitas enzim baru yang hanya dilihat dari strukturnya adalah hal yang sangat sulit.
Kebanyakan enzim berukuran lebih besar daripada substratnya, tetapi hanya sebagian kecil asam amino enzim (sekitar 3–4 asam amino) yang secara langsung terlibat dalam katalisis. Daerah yang mengandung residu katalitik yang akan mengikat substrat dan kemudian menjalani reaksi ini dikenal sebagai tapak aktif. Enzim juga dapat mengandung tapak yang mengikat kofaktor yang diperlukan untuk katalisis. Beberapa enzim juga memiliki tapak ikat untuk molekul kecil, yang sering kali merupakan produk langsung ataupun tak langsung dari reaksi yang dikatalisasi. Pengikatan ini dapat meningkatkan ataupun menurunkan aktivitas enzim. Dengan demikian ia berfungsi sebagai regulasi umpan balik.
Sama seperti protein-protein lainnya, enzim merupakan rantai asam amino yang melipat. Tiap-tiap urutan asam amino menghasilkan struktur pelipatan dan sifat-sifat kimiawi yang khas. Rantai protein tunggal kadang-kadang dapat berkumpul bersama dan membentuk kompleks protein. Kebanyakan enzim dapat mengalami denaturasi (yakni terbuka dari lipatannya dan menjadi tidak aktif) oleh pemanasan ataupun denaturan kimiawi. Tergantung pada jenis-jenis enzim, denaturasi dapat bersifat reversibel maupun irreversibel.
Kespesifikkan
Enzim biasanya sangat spesifik terhadap reaksi yang ia kataliskan mauapun terhadap substrat yang terlibat dalam reaksi. Bentuk, muatan dan katakteristik hidrofilik/hidrofobik enzim dan substrat bertanggung jawab terhadap kespesifikan ini. Enzim juga dapat menunjukkan tingkat stereospesifisitas, regioselektivitas, dan kemoselektivitas yang sangat tinggi.
Beberapa enzim yang menunjukkan akurasi dan kespesifikan tertinggi terlibat dalam pengkopian dan pengekspresian genom. Enzim-enzim ini memiliki mekanisme "sistem pengecekan ulang". Enzim seperti DNA polimerase mengkatalisasi reaksi pada langkah pertama dan mengecek apakah produk reaksinya benar pada langkah kedua. Proses dwi-langkah ini menurunkan laju kesalahan dengan 1 kesalahan untuk setiap 100 juta reaksi pada polimerase mamalia. Mekanisme yang sama juga dapat ditemukan pada RNA polimerase, aminoasil tRNA sintetase dan ribosom.
Beberapa enzim yang menghasilkan metabolit sekunder dikatakan sebagai "tidak pilih-pilih", yakni bahwa ia dapat bekerja pada berbagai jenis substrat yang berbeda-beda. Diajukan bahwa kespesifikan substrat yang sangat luas ini sangat penting terhadap evolusi lintasan biosintetik yang baru.
Model "kunci dan gembok"
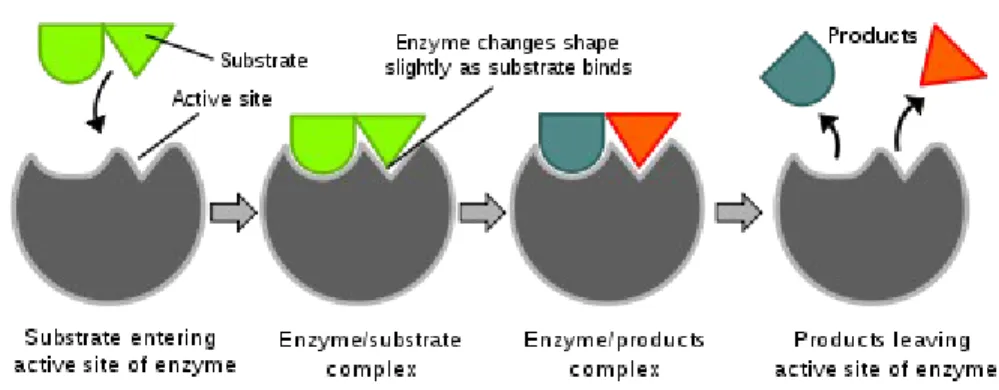
Enzim sangatlah spesifik. Pada tahun 1894, Emil Fischer mengajukan bahwa hal ini dikarenakan baik enzim dan substrat memiliki bentuk geometri yang saling memenuhi. Hal ini sering dirujuk sebagai model "Kunci dan Gembok". Manakala model ini menjelaskan kespesifikan enzim, ia gagal dalam menjelaskan stabilisasi keadaan transisi yang dicapai oleh enzim. Model ini telah dibuktikan tidak akurat, dan model ketepatan induksilah yang sekarang paling banyak diterima.
Model ketepatan induksi
Pada tahun 1958, Daniel Koshland mengajukan modifikasi model kunci dan gembok: oleh karena enzim memiliki struktur yang fleksibel, tapak aktif secara terus menerus berubah bentuknya sesuai dengan interaksi antara enzim dan substrat. Akibatnya, substrat tidak berikatan dengan tapak aktif yang kaku. Orientasi rantai samping asam amino berubah sesuai dengan substrat dan mengijinkan enzim untuk menjalankan fungsi katalitiknya. Pada beberapa kasus, misalnya glikosidase, molekul substrat juga berubah sedikit ketika ia memasuki tapak aktif. Tapak aktif akan terus berubah bentuknya sampai substrat terikat secara sepenuhnya, yang mana bentuk akhir dan muatan enzim ditentukan.
Mekanisme
Enzim dapat bekerja dengan beberapa cara, yang kesemuanya menurunkan ΔG :
• Menurunkan energi aktivasi dengan menciptakan suatu lingkungan yang mana keadaan transisi terstabilisasi (contohnya mengubah bentuk substrat menjadi konformasi keadaan transisi ketika ia terikat dengan enzim.)
• Menurunkan energi keadaan transisi tanpa mengubah bentuk substrat dengan menciptakan lingkungan yang memiliki distribusi muatan yang berlawanan dengan keadaan transisi.
• Menyediakan lintasan reaksi alternatif. Contohnya bereaksi dengan substrat sementara waktu untuk membentuk kompleks Enzim-Substrat antara.
• Menurunkan perubahan entropi reaksi dengan menggiring substrat bersama pada orientasi yang tepat untuk bereaksi. Menariknya, efek entropi ini melibatkan destabilisasi keadaan dasar, dan kontribusinya terhadap katalis relatif kecil.
Stabilisasi keadaan transisi
Pemahaman asal usul penurunan ΔG‡ memerlukan pengetahuan bagaimana enzim dapat menghasilkan keadaan transisi reaksi yang lebih stabil dibandingkan dengan stabilitas keadaan transisi reaksi tanpa katalis. Cara yang paling efektif untuk
mencapai stabilisasi yang besar adalah menggunakan efek elektrostatik, terutama pada lingkungan yang relatif polar yang diorientasikan ke distribusi muatan keadaan transisi. Lingkungan seperti ini tidak ada dapat ditemukan pada reaksi tanpa katalis di air.
Dinamika dan fungsi
Dinamika internal enzim berhubungan dengan mekanisme katalis enzim tersebut. Dinamika internal enzim adalah pergerakan bahagian struktur enzim, misalnya residu asam amino tunggal, sekelompok asam amino, ataupun bahwa keseluruhan domain protein. Pergerakan ini terjadi pada skala waktu yang bervariasi, berkisar dari beberapa femtodetik sampai dengan beberapa detik. Jaringan residu protein di seluruh struktur enzim dapat berkontribusi terhadap katalisis melalui gerak dinamik. Gerakan protein sangat vital, namun apakah vibrasi yang cepat atau lambat maupun pergerakan konformasi yang besar atau kecil yang lebih penting bergantung pada tipe reaksi yang terlibat. Namun, walaupun gerak ini sangat penting dalam hal pengikatan dan pelepasan substrat dan produk, adalah tidak jelas jika gerak ini membantu mempercepat langkah-langkah reaksi reaksi enzimatik ini. Penyingkapan ini juga memiliki implikasi yang luas dalam pemahaman efek alosterik dan pengembangan obat baru.
Modulasi alosterik
Enzim alosterik mengubah strukturnya sesuai dengan efektornya. Modulasi ini dapat terjadi secara langsung, di mana efektor mengikat tapak ikat enzim secara lngsung, ataupun secara tidak langsung, di mana efektor mengikat protein atau subunit protein lain yang berinteraksi dengan enzim alosterik, sehingga mempengaruhi aktivitas katalitiknya.
Inhibisi
Inhibitor kompetitif mengikat enzim secara reversibel, menghalangi pengikatan substrat. Di lain pihak, pengikatn substrat juga menghalangi pengikatan inhibitor. Substrat dan inhibitor berkompetisi satu sama lainnya.
Jenis-jenis inihibisi.
Klasifikasi ini diperkenalkan oleh W.W. Cleland. Laju reaksi enzim dapat diturunkan menggunakan berbagai jenis inhibitor enzim.
Inhibisi kompetitif
Pada inihibisi kompetitif, inhibitor dan substrat berkompetisi untuk berikatan dengan enzim. Seringkali inhibitor kompetitif memiliki struktur yang sangat mirip dengan substrat asli enzim. Sebagai contoh, metotreksat adalah inihibitor kompetitif untuk enzim dihidrofolat reduktase. Kemiripan antara struktur asam folat dengan obat ini ditunjukkan oleh gambar di samping bawah. Perhatikan bahwa pengikatan inhibitor tidaklah perlu terjadi pada tapak pengikatan substrat apabila pengikatan inihibitor mengubah konformasi enzim, sehingga menghalangi pengikatan substrat. Pada inhibisi kompetitif, kelajuan maksimal reaksi tidak berubah, namun memerlukan konsentrasi substrat yang lebih tinggi untuk mencapai kelajuan maksimal tersebut, sehingga meningkatkan Km.
Inhibisi tak kompetitif
Pada inhibisi tak kompetitif, inhibitor tidak dapat berikatan dengan enzim bebas, namun hanya dapat dengan komples ES. Kompleks EIS yang terbentuk kemudian menjadi tidak aktif. Jenis inhibisi ini sangat jarang, namun dapat terjadi pada enzim-enzim multimerik.
Inhibisi non-kompetitif
Inhibitor non-kompetitif dapat mengikat enzim pada saat yang sama substrat berikatan dengan enzim. Baik kompleks EI dan EIS tidak aktif. Karena inhibitor tidak dapat dilawan dengan peningkatan konsentrasi substrat, Vmax reaksi berubah. Namun, karena substrat masih dapat mengikat enzim, Km tetaplah sama.
Inhibisi campuran
Inhibisis jenis ini mirip dengan inhibisi non-kompetitif, kecuali kompleks EIS memiliki aktivitas enzimatik residual. Pada banyak organisme, inhibitor dapat merupakan bagian dari mekanisme umpan balik. Jika enzim memproduksi terlalu banyak produk, produk tersebut dapat berperan sebagai inhibitor bagi enzim tersebut. Hal ini akan menyebabkan produksi produk melambat atau berhenti. Bentuk umpan balik ini adalah umpan balik negatif. Enzim memiliki bentuk regulasi seperti ini sering kali multimerik dan mempunyai tapak ikat alosterik. Kurva substrat/kelajuan enzim ini tidak berbentuk hiperbola melainkan berbentuk S.
Aplikasi Enzim Dalam Kehidupan Harian dan Dalam Industri
Dalam kehidupan harian, enzim digunakan dalam keadaan berikut: Amilase
• Untuk menghilangkan kanji dalam buah-buahan dan koko semasa pemprosesan jus buah-buahan dan coklat.
• Ditambah dalam proses pencairan kanji sebelum penambahan malt dalam industri alkohol.
Lipase
• Menguraikan lemak dalam makanan seperti daging.
• Bertindak balas terhadap lemak susu dalam penyediaan keju. Protease
• Penyediaan pelembut daging bagi melembutkan daging yang liat supaya mudah dikunyah.
• Membantu menanggalkan kulit ikan dalam industri pengetinan ikan. Selulase
• Melembutkan sayur-sayuran dengan mencernakan sebagian selulosa sayur itu. • Mengeluarkan kulit daripada biji seperti gandum.
• Mengasingkan agar-agar daripada rumpai laut dengan menguraikan dinding sel daun rumpai dan membebaskan agar-agar yang terkandung dalamnya. Zimase
• Terdapat dalam yeast dan digunakan dengan meluas dalam penyediaan minuman beralkohol seperti bir dan wain.
Uji Coba Enzim
Untuk meneliti enzim, diperlukan suatu uji untuk mengukur aktivitas katalitik. Uji dirancang untuk mengatur kecepatan pembentukan produk atau kecepatan hilangnya substrat. Suatu uji yang mengukur pembentukan produk dipilih karena melibatkan suatu pengukuran langsung, berlawanan dengan pengukuran tidak langsung yang didapat dari suatu uji yang mengandalkan pada penentuan hilangnya substrat. Seringkali, jumlah produk yang dihasilkan dalam suatu rentang waktu yang lama diukur dalam suatu uji waktu tertentu. Cara bagaimana jumlah produk ditentukan tergantung pada sifat kimia dan fisiknya. Jika produk diwarnai atau dapat mengalami suatu reaksi untuk menghasilkan larutan yang berwarna, kemudian absorban dari cahaya pada panjang gelombang yang sesuai dapat diukur (uji kalorimetrik) dan dihubungkan dengan konsentrasi produk yang ditemukan pada saat sampling. Uji spektrofotometrik khususnya berguna karena kemajuan dalam reaksi dapat dipantau secara terus-menerus dalam uji kinetika. Aktivitas dari enzim yang menggunakan NAD+ atau NADH sebagai koenzim diuji secara spektrofotometrik karena NADH, tetapi bukan NAD+, memiliki suatu puncak absorban pada panjang gelombang 340nm yang merupakan daerah ultraviolet dari spektrum. Dengan demikian peningkatan atau penurunan dalam absorban yang masing-masing mengukur timbul atau hilangnya NADH dapat dipantau dengan enak dalam suatu spektrofotometer. Suatu uji radioaktif merupakan suatu uji lain yang umum digunakan untuk memantau aktivitas enzimatik. Dengan menggunakan suatu substrat yang diberi label dengan radioisotop yang sesuai, contohnya 3H, 14C, atau 32P dapat dibuat penentuan yang akurat mengenai jumlah kecil dari terisolasi, produk radioaktif.
Keadaan optimal juga ditentukan untuk suatu uji enzimatik termasuk penentuan pH optimum, suhu, dan kekuatan ionik untuk reaksi. Karena enzim merupakan protein globular maka sebagian besar adalah termolabil dan mulai mengalami denaturasi (ditunjukkan dengan kehilangan aktivitas enzimatik) pada suhu antara 45º dan 50ºC. Kekuatan ionik dan pH juga merupakan parameter yang penting karena menentukan muatan residu asam amino dan dapat berpengaruh terhadap struktur berdimensi tiga dari enzim, dan dengan demikian, aktivitas katalitiknya. Konsentrasi enzim dan kofaktornya yang tepat (jika diperlukan) yang digunakan dalam suatu volume campuran uji tertentu juga ditetapkan secara empiris.
Analisis enzim dalam serum dapat dipakai untuk diagnosis berbagai penyakit. Dasar penggunaan enzim sebagai penunjang diagnosis adalah bahwa:
1. sebagian besar enzim terdapat dan bekerja dalam sel
2. enzim tertentu dibuat dalam jumlah besar oleh jaringan tertentu.
Karena itu enzim intrasel seharusnya tidak ditemukan dalam serum dan bila ditemukan, berarti sel yang membuatnya mengalami disintegrasi. Bila enzim yang diukur dalam serum terutama dibuat oleh jaringan atau organ tertentu, maka peningkatan aktivitas dalam serum menunjukkan adanya kerusakan pada jaringan atau organ tertentu.
Karena struktur protein menentukan aktivitas enzim, maka jika struktur ini terganggu aktivitas akan berubah. Proses denaturasi protein berlaku pula untuk protein-protein enzim, dan bahan yang mendenaturasi adalah sama. Misalnya, enzim sering memperlihatkan kerapuhan akibat suhu. Jika dipanaskan sehingga kurang lebih di atas 50ºC, kebanyakan tetapi tidak semua enzim akan terdenaturasi. Denaturasi akibat suhu tinggi biasanya irreversible karena gaya-gaya ikatan lemah yang penting rusak akibat meningkatnya getaran termal komponen atom-atomnya, suatu fenomena yang merusak struktur tiga-dimensi. Pada kondisi yang tidak menyebabkan
denaturasi, kebanyakan enzim menunjukkan adanya suhu optimum, dengan keadaan lainnya sama, untuk mencapai aktivitas optimal. Beberapa enzim memperlihatkan penurunan aktivitas secara tajam dalam kisaran sangat kecil setelah melewati titik mulainya denaturasi. Ini sering dikatakan sebagai suatu “pelelehan” protein, dengan hilangnya gaya-gaya ikatan lemah yang penting secara cepat, analog dengan titik leleh dari senyawa organik sederhana.
Beberapa enzim juga sangat sensitive terhadap suhu rendah. ATPase mikondria, misalnya, dengan cepat menjadi tidak aktif jika didinginkan hingga 5ºC tapi cukup stabil dalam suhu ruangan. Salah satu penjelasannya ialah pada suhu yang lebih rendah gaya-gaya lemah antara berbagai bagian dari suatu subunit tunggal menjadi lebih besar daripada gaya-gaya antara subunit. Ini menyebabkan gangguan pada bentuk polimerik, yang sangat penting untuk aktivitas enzim. Namun beberapa enzim sangat tidak terpengaruh oleh panas. Beberapa protease dan fosfolipase dapat bertahan dalam suhu air mendidih tanpa atau hanya sedikit kehilangan aktivitasnya. Faktor-Faktor yang Mempengaruhi Aktivitas Enzim
Seperti molekul protein lainnya sifat biologis enzim sangat dipengaruhi berbagai faktor fisikokimia. Enzim bekerja pada kondisi tertentu yang relatif ketat.
Faktor-faktor yang mempengaruhi kerja enzim antara lain: 1. Suhu
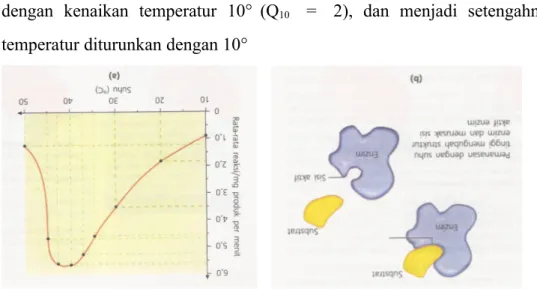
Pada suhu yang lebih tinggi, kecepatan molekul substrat meningkat, sehingga pada saat bertumbukan dengan enzim, energi molekul substrat berkurang. Hal ini memudahkan terikatnya molekul substrat pada sisi aktif enzim. Aktivitas enzim meningkat dengan meningkatnya suhu sampai pada titik tertentu. Peningkatan suhu meningkatkan energi kinetik pada molekul substrat dan enzim, sehingga kecepatan reaksi meningkat pula. Perbandingan yang tepat di mana kecepatan berubah untuk setiap kenaikan temperatur 10° C adalah Q10, atau
koefisien temperatur. Kecepatan banyak reaksi biologis kurang lebih naik dua kali dengan kenaikan temperatur 10° (Q10 = 2), dan menjadi setengahnya bila temperatur diturunkan dengan 10°
Gambar 2. (a) Suhu optimum enzim (b) Denaturasi
Namun, tidak berarti bahwa peningkatan ini berlangsung tidak terbatas. Kecepatan enzim dalam mengkatalis reaksi mencapai puncaknya pada suhu tertentu. Suhu ini disebut suhu optimum enzim. Untuk kebanyakan enzim, suhu optimal adalah suhu sel atau suhu di atas suhu sel di mana enzim-enzim terdapat di dalamnya. Suhu optimum enzim berkisar antara 25° – 40° C.
Kenaikan kecepatan di bawah suhu optimal disebabkan oleh kenaikan energi kinetika molekul-molekul yang bereaksi. Akan tetapi bila suhu tetap dinaikkan terus, energi kinetik molekul-molekul enzim menjadi demikian besar sehingga melampaui energi penghalang untuk memecahkan ikatan-ikatan sekunder yang mempertahankan enzim dalam keadaan aslinya atau keadaan katalitik aktif. Akibatnya struktur sekunder dan tersier hilang disertai hilangnya aktivitas katalitik. Peningkatan suhu yang semakin tinggi menyebabkan putusnya ikatan hidrogen dan ikatan lain yang merangkai molekul enzim, sehingga enzim mengalami denaturasi. Denaturasi menyebabkan aktivitas enzim menurun atau hilang.
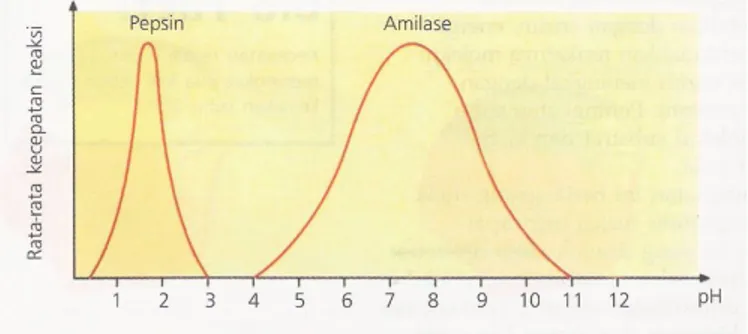
2. pH
pH juga mempengaruhi aktivitas enzim. Perubahan kondisi asam dan basa di sekitar molekul enzim mempengaruhi benuk tiga dimensi enzim dan dapat menyebabkan denaturasi. Setiap enzim memiliki pH optimum. Misalnya, pepsin (enzim yang bekerja di dalam lambung) mempunyai pH optimum sekitar 2 (sangat asam), sedangkan amilase (enzim yang bekerja di mulut dan usus halus) memiliki pH optimum sekitar 7,5 (agak basa).
Gambar 3. pH optimum beberapa jenis enzim. 3. Konsentrasi Enzim
Semakin besar konsentrasi enzim semakin cepat pula reaksi yang belangsung. Dengan kata lain konsentrasi enzim berbanding lurus dengan kecepatan reaksi. Sisi aktif suatu enzim dapat digunakan berulang kali oleh banyak substrat. Substrat yang berikatan dengan sisi aktif enzim akan membentuk produk. Pelepasan produk menyebabkan sisi aktif enzim bebas untuk berikatan dengan substrat lainnya. Oleh karenanya hanya dibutuhkan sejumlah kecil enzim untuk mengkatalis sejumlah besar substrat.
Gambar 4. Pengaruh konsentrasi enzim terhadap kecepatan reaksi
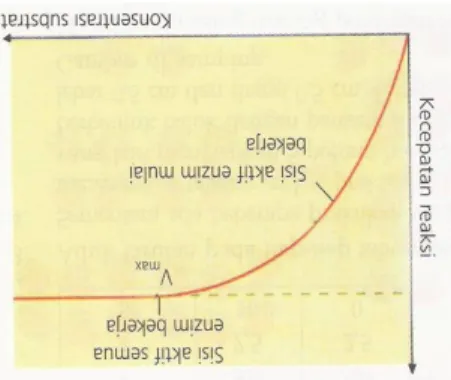
4. Konsentrasi Substrat
Bila sejumlah enzim dalam keadaan tetap, kecepatan reaksi akan meningkat dengan adanya peningkatan konsentrasi substrat. Namun, pada saat sisi aktif semua enzim bekerja, penambahan substrat tidak dapat meningkatkan kecepatan reaksi enzim lebih lanjut. Kondisi ini disebut konsentrasi substrat pada titik jenuh atau disebut kecepatan maksimum (Vmax).
Gambar 5. Pengaruh konsentrasi substrat terhadap kecepatan reaksi 5. Inhibitor
Inhibitor merupakan suatu molekul yang menghambat ikatan enzim dengan substratnya. Ada dua macam inhibitor enzim, yaitu inhibitor kompetitif dan non-kompetitif.
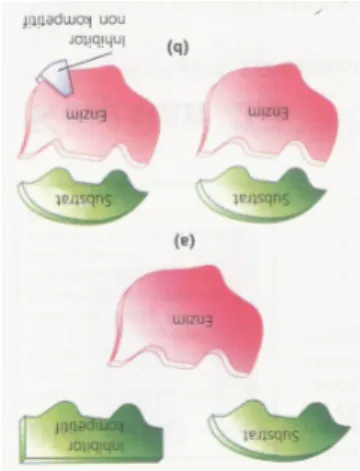
Inhibitor kompetitif adalah molekul penghambat yang cara kerjanya bersaing dengan substrat untuk mendapatkan sisi aktif enzim. Contohnya, sianida bersaing deengan oksigen untuk mmendapatkan Hb dalam rantai respirasi terakhir. Inhibitor kompetitif dapat diatasi dengan cara penambahan konsentrasi substrat.
Inhibitor non-kompetitif adalah molekul penghambat enzim yang bekerja dengan cara melekatkan diri pada luar sisi aktif, sehingga bentuk enzim berubah, dan sisi aktif tidak dapat berfungsi.
Gambar 6. Inhibitor : (a) Kompetitif (b) Non-Kompetitif
Selain faktor-faktor diatas, kerja enzim juga dapat dipengaruhi oleh:
Oksidasi oleh udara disekitar atau senyawa lain
Sinar ultraviolet
Sinar X
Terjadi perubahan fisiologi pada organ-organ tubuh, jadi sekresinya enzim menurun. Sehingga secara kuantitas dan kualitasnya kerja enzim pun turun.
Konsentrasi produk
Semakin tinggi konsentrasi produk akan semakin menghambat kerja enzim. Spektrofotometri
Spektrofotometri merupakan teknik pengukuran jumlah zat yang juga berdasar spektroskopi. Hanya saja pada spektrofotometri, lebih spesifik untuk panjang gelombang UV ( ultra violet ) – dekat, visible, dan infra merah. Spektrofotometri dimasukkan dalam elektromagnetik spektroskopi. Alat yang digunakan dalam spektrofotometri disebut spektrofotometer. Alat ini termasuk dalam jenis fotometer, suatu alat unutk mengukur intensitas cahaya. Spektrofotometer dapat mengukur intensitas sebagai fungsi dari warna, atau secara lebih khusus, fungsi panjang gelombang.
Spektofotometri adalah suatu alat yang digunakan untuk memeriksa jumlah energi radiasi cahaya yang diserap oleh molekulnya. Spektrum yang diasorbsi atau tepatnya jumlah absolut spektrum sinar yang terserap oleh suatu senyawa adalah sejumlah sinar yang diserap atau hilang ( extinction ) oleh satu senyawa dengan panjang gelombang tertentu. Untuk senyawa berwarna akan memiliki satu atau lebih penyerapan spektrum yang tertinggi ( extinction maximum ) dan di daerah spektrum terbaca 400 – 700 mm. Spektrum yang terserap pada ultra violet ( 200 – 400 mm ) dan daerah nampak terjadi karena adanya perubahan energi elektron terluar dari molekul yang disebabkan adanya ikatan dan bukan ikatan.
Umumnya elektron yang berpindah tempat ini disebabkan adanya ikatan rangkap karbon – karbon atau pasangan nitrogen dengan oksigen. Biasanya elektron dalam molekul berada dalam keadaan dasar pada suhu kamar. Spektrum dalam keadaan ini memberikan informasi pada tingkat ini atau di atasnya. Panjang gelombang sinar yang terserap ditentukan oleh perpindahan yang terjadi. Puncak serapan dapat ditunjukkan dan berhubungan dengan struktur rinci dari molekulnya.
Istilah kromofor muncul untuk menggambarkan bagian kecil dari suatu molekul yang dapat meningkatkan serapan spektrum tertentu secara mandiri, misalnya gugus karbonil, - C=O. Dua ikatan rangkap yang hanya terpisah satu unit ( conjugated ) menurunkan jumlah tenaga yang diperlukan untuk perpindahan elektron ini sehingga menyebabkan peningkatan panjang gelombang di tempat kromofor menyerap. Peningkatan panjang gelombang ini disebut, perpindahan batokhromik ( bathoromic ) sedangkan sebaliknya penurunan panjang gelombang disebut hipokhromik.
BAB II
TUJUAN PERCOBAAN
1. Pengaruh Temperatur terhadap Aktivitas Enzim Amilase
Tujuan: membuktikan bahwa kecepatan reaksi enzimatik sampai suhu tertentu sebanding dengan kenaikan suhu. Reaksi enzimatik mempunyai suhu maksimum. 2. Pengaruh Kadar Enzim terhadap Enzim Amilase
Tujuan: membuktikan bahwa kecepatan reaksi enzimatik berbanding lurus dengan konsentrasi enzim.
BAB III
BAHAN DAN CARA
1. Pengaruh Temperatur terhadap Aktivitas Enzim Amilase Reagen dan bahan:
Liur, sumber amylase
Larutan pati 0,4 mg/mL
Larutan iodium Prosedur:
1. Tampung 2 ml air liur dalam tabung reaksi yang bersih dan kering 2. Encerkan 10x dengan air suling
3. Siapkan 6 pasang tabung reaksi yang bersih dan kering. Tiap pasangan tabung diberi tanda B untuk blanko dan U untuk uji.
4. Pipetkan ke dalam tiap-tiap tabung:
Larutan Tabung B Tabung U
Larutan Pati 0,4 ml 0,4 ml
Diamkan 5 menit pada suhu masing-masing
Liur - 0,2 ml
Campur baik-baik, diamkan 1 menit Larutan iodium (untuk suhu 60 dan 100 ˚C dilakukan di luar penangas)
0,4 ml 0,4 ml
Air suling 9,2 ml 9 ml
Segera baca serapan (A) pada panjang gelombang 680 nm. Hitung selisih serapan (ΔA) antara tabung B (A pada t = 0 menit) dengan tabung U dari tiap suhu.
Keterangan:
Pasangan kedua ditempatkan dalam bejana berisi air yang suhunya dipertahan 25 ˚C.
Pasangan ketiga ditempatkan di rak tabung reaksi, pada suhu ruang.
Pasangan keempat ditempatkan dalam bejana berisi air yang suhunya dipertahan 37 ˚C.
Pasangan kelima ditempatkan dalam bejana berisi air yang suhunya dipertahan 60 ˚C.
Pasangan keenam ditempatkan dalam bejana berisi air yang suhunya dipertahan 100 ˚C.
Buatlah tabel berikut:
Suhu Ab Au ΔA/menit (v) 0 ˚C 25 ˚C Suhu ruang 37 ˚C 60 ˚C 100 ˚C
Buatlah kurva yang menggambarkan hubungan kecepatan reaksi enzimatik (v = ΔA/menit) dengan suhu.
2. Pengaruh Kadar Enzim terhadap Enzim Amilase Reagen dan Bahan:
Liur sebagai sumber amylase. Tampung 2 ml air liur dalam gelas kimia atau tabung reaksi yang bersih dan kering.
Larutan pati 0,4 mg/dl
Prosedur:
Encerkan liur 100x, 200x, 300x, 400x dan 500x dengan air suling. Siapkan 5 pasang tabung reaksi yang bersih dan kering. Tiap pasangan tabung diberi tanda B untuk blangko dan U untuk uji. Pipetkan ke dalam tabung sesuai table berikut:
Larutan Tabung B Tabung U
Larutan Pati 0,4 ml 0,4 ml
Inkubasi pada suhu 37 ˚C selama 5 menit
Liur diencerkan - 200 μl
Campurkan baik-baik, inkubasi 1 menit
Larutan iodium 0,4 ml 0,4 ml
Air suling 9,2 ml 9 ml
Segera baca serapan pada panjang gelombang 680 nm. Hitung selisih serapan antara tabung B (A pada t = 0 menit) dengan tabung U dari tiap pengenceran enzim.
Buatlah tabel sebagai berikut:
Pengenceran Enzim Ab Au ΔA/menit (v) 500x
400x 300x 200x 100x
Buatlah kurva yang menggambarkan hubungan antara kecepatan reaksi enzimatik (v = ΔA/menit) dengan konsentrasi atau pengenceran enzim.
BAB IV
HASIL DAN PEMBAHASAN 1. Pengaruh Temperatur terhadap Aktivitas Enzim Amilase
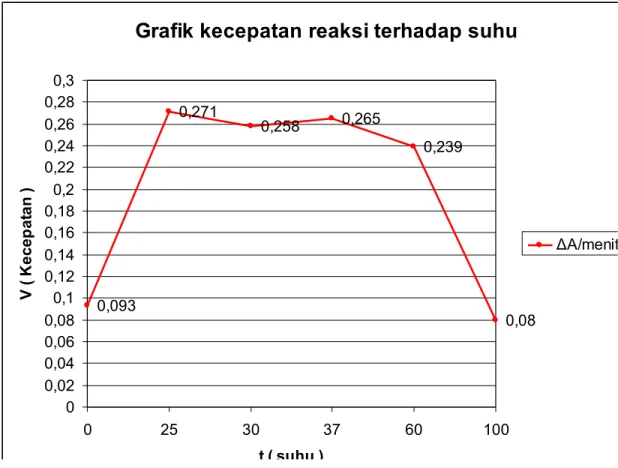
Suhu Ab Au ΔA/menit (v) 0 ˚C 0,15 2 0,05 9 0,093 25 ˚C 0,29 0 0,01 9 0,271 Suhu ruang 0,28 3 0,02 5 0,258 37 ˚C 0,28 6 0,02 1 0,265 60 ˚C 0,26 8 0,02 9 0,239 100 ˚C 0,12 7 0,04 7 0,08
Grafik kecepatan reaksi terhadap suhu
0,093 0,271 0,258 0,265 0,239 0,08 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 0,18 0,2 0,22 0,24 0,26 0,28 0,3 0 25 30 37 60 100 t ( suhu ) V ( K e ce p at a n ) ΔA/menit (v)Setiap enzim mempunyai suhu optimum tertentu. Laju reaksi meningkat sesuai dengan kenaikkan suhu, dan akhirnya enzim kehilangan semua aktivitas jika protein menjadi rusak akibat panas (denaturasi). Banyak enzim berfungsi optimal dalam batas-batas suhu antara 25 ºC-37 ºC.
Enzim pada suhu rendah menyebabkan reaksi berlangsung lambat. Pada suhu yang jauh lebih rendah (0 ºC) daripada suhu optimum enzim dapat mengalami proses inaktivasi sehingga aktivitas katalitiknya terganggu, sedangkan pada suhu tinggi (melewati suhu optimum) enzim akan terdenaturasi. Kenaikkan suhu sebelum mencapai titik dimana enzim akan terdenaturasi menyebabkan kecepatan reaksi akan meningkat. Sebagian besar enzim terdenaturasi pada suhu di atas suhu 60 ºC
Enzim amilase bekerja pada suhu kompartemen ± 37˚C. Pemanasan yang dilakukan meningkatkan suhu, mengakibatkan enzim amilase menjadi inaktif.
Bahkan bila diberi perlakuan termal berlebihan dapat menyebabkan denaturasi koenzim (kompenen enzim yang berupa protein) denaturasi adalah kerusakan sturuktural dari sebuah makromolekul ( enzim amilase)yang disebabkan beberapa faktor sehingga tidak dapat mengubah amilum menjadi maltosa dengan produk antara berupa dekstrin. Akibatnya, amilum yang bereaksi dengan indikator warna, larutan Iodium, tetap menghasilkan warna ungu meskipun didiamkan dalam waktu yang lama. Ini menunjukan pada suhu 45˚C aktivitas enzim masih menunjukkan kenaikan, jika suhu > 45˚C, akan timbul efek yang berlawanan dan menjelang suhu 55˚C fungsi katalitik enzim akan musnah.
Dilihat dari grafik yang ada, data yang kami peroleh tidak sesuai dengan teori yang dimana seharusnya pada suhu 37 ºC yang mana merupakan suhu optimal tapi di sini yang merupakan suhu optimal, adalah suhu 25 ºC.
Peninggian suhu reaksi akan meningkatkan jumlah molekul yang dapat bereaksi, baik dengan meningkatkan energi kinetiknya maupun dengan peningkatan frekuensi benturannya. Seperti yang terlihat pada gambar 1, jika molekul yang energi kinetiknya melampaui rintangan energi terjadinya energinya (garis vertikal) akan bertambah seiring suhu naik dari rendah (A), melalui suhu intermediat (B), hingga mencapai suhu (C) tinggi di samping itu, setiap kenaikkan suhu meningkatkan gerakan molekul dan dengan demikian kenaikkan frekuensi berkurang. Kedua faktor ini turut menyebabkan peningkatan kecepatan reaksi yang menyertai kenaikkan suhu reaksi. Meskipun demikian peningkatan reaksi ini tidak berlangsung tanpa batas karena pada akhirnya akan mencapai suatu suhu, yang pada suhu ini, molekul yang bereaksi tidak lagi stabil. Suhu yang membatasi reaksi ini cenderung sangat tinggi bagi kebanyakan molekul organik, tetapi tetap di bawah 100 °C bagi sebagian besar reaksi dalam lingkup bidang biologi.
Sementara peningkatan suhu akan meningkatkan kecepatan reaksi yang dikatalisis enzim, kenyataan ini hanya berlaku pada suhu yang sangat terbatas.
Kecepatan reaksi mula-mula meningkat seiring meningkatnya suhu akibat peningkatan energi kinetik pada molekul-molekul yang bereaksi. Akan tetapi, pada akhirnya, energi kinetik enzim akan melampaui rintangan energi untuk memutuskan ikatan hidrogen dan hidrofobik yang lemah, yang mempertahankan struktur sekunder-tersiernya. Pada suhu ini, terutama terjadi denaturasi, disertai hilangnya aktivitas katalitik secara cepat. Kisaran suhu yang suatu enzim akan mempertahankan konfirmasi yang stabil serta memiliki kemampuan katalisis umumnya akan bergantung pada suhu sel tempat enzim itu terdapat dan sedikit melebihi suhu sel tersebut. Enzim dari manusia, yang mempertahankan suhu tubuh pada 37 °C, umumnya memperlihatkan stabilitas hingga suhu setinggi 45-55 °C. Enzim dari mikroorganisme yang hidup dalam mata air panas alam atau pada tempat-tempat ventilasi hipertermal di dasar samudra dapat tetap stabil pada suhu 100 °C atau lebih.
Faktor yang menyebabkan peningkatan kecepatan proses biologik untuk kenaikkan suhu sebesar 10 °C adalah koefisien suhu atau Q10. Kecepatan banyak proses biologik misal, kecepatan kontraksi jantung yang dieksisi akan meningkat kurang lebih dua kali lipat dengan kenaikkan suhu sebesar 10 °C (Q10 = 2). Perubahan pada kecepatan banyak reaksi yang dikatalisis enzim yang menyertai kenaikkan atau penurunan suhu tubuh merupakan gambaran mendasar upaya mempertahankan kelangsungan hidup bagi bentuk-bentuk kehidupan seperti kadal yang tidak mempertahankan suhu tubuh yang konstan. Sebaliknya, organisme homeotermik seperti manusia hanya dapat mentoleransi perubahan suhu tubuh yang sangat terbatas. Bagi manusia, perubahan kecepatan reaksi akibat perubahan suhu memiliki pemaknaan fisiologis terbatas, kecuali dalam keadaan demam atau hipotermia.
Karena upaya meningkatkan jumlah molekul yang memiliki cukup energi kinetik untuk mengatasi rintangan energi bagi terjadiinya reaksi memberikan pilihan fisiologis yang terbatas bagi organisme yang homeotermik, bagaimana enzim dapat menaikkan kecepatan reaksi jawabannya terletak pada kemampuan enzim mengurangi rintangan enrgi bagi terjadinya reaksi dan menaikkan konsentrasi lokal reaktan.
2. Pengaruh Kadar Enzim terhadap Enzim Amilase
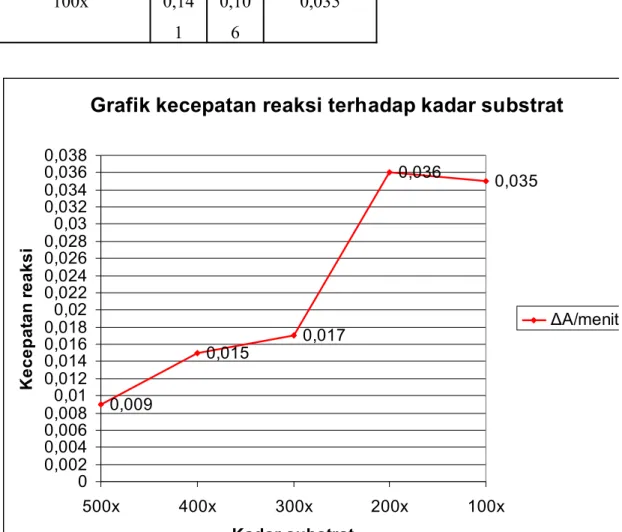
Pengenceran Enzim Ab Au ΔA/menit (v)
500x 0,14 8 0,13 9 0,009 400x 0,13 3 0,11 8 0,015 300x 0,14 1 0,12 4 0,017 200x 0,14 3 0,10 7 0,036 100x 0,14 1 0,10 6 0,035
Grafik kecepatan reaksi terhadap kadar substrat
0,009 0,015 0,017 0,036 0,035 0 0,002 0,004 0,006 0,0080,01 0,012 0,014 0,016 0,0180,02 0,022 0,024 0,026 0,0280,03 0,032 0,034 0,036 0,038 500x 400x 300x 200x 100x Kadar substrat K e c e p a ta n r e a k s i ΔA/menit (v)
Pada percobaan ini digunakan air liur yang merupakan sumber enzim amilase. Amilase adalah enzim untuk memecah amilum atau pati. Pada percobaan ini kami menggunakan variabel konsentrasi enzim untuk mengetahui pengaruhnya terhadap aktivitas enzim.
Pertama larutan pati dimasukkan ke dalam tabung blanko dan uji, kemudian di inkubasi pada suhu 370C selama 5 menit. Setelah 5 menit tabung uji ditanbahkan dengan air liur yang mengandung enzim amilase dan di inkubasi kembali pada suhu 370C selama 1 menit. Pemilihan suhu ini dikrenakan pada suhu tersebut enzim dapat bekerja secara optimum. Dalam waktu satu menit ini, diharapkan enzim amilase sudah bekerja cukup lama untuk mandegradasi pati yang ada. Optimal disini dalam pengertian bahwa pati yang didegradasi tidak terlampau sedikit, juga tidak terlampau banyak.
Setelah itu ditambahkan larutan iodium yang akan bereaksi dengan pati membentuk warna biru tua. Jadi semakin banyak sisa pati yang ada, maka larutan menjadi semakin gelap. Setelah itu masing-masing zat dalam tabung tersebut diencerkan menggunakan air suling. Adapun pengenceran ini berfungsi agar absorbansi dari zat tersebut dapat terbaca dengan menggunakan spektrofotometer. Setelah diencerkan, larutan tersebut kemudian diuji daya absorbansinya menggunakan alat spektrofotometer. Alat spektrofotometer ini berguna mengukur jumlah atau kuantitas sinar yang diserap oleh suatu larutan pada panjang gelombang tertentu. Biasanya pada larutan pekat atau yang berwarna gelap maka absorbansinya akan besar. Sebaliknya pada larutan encer atau yang berwarna terang maka absorbansinya akan kecil.
Kecepatan reaksi akan bertambah seiring bertambahnya konsentrasi substrat sehingga tercapai suatu keadaan yang enzimnya dikatakan jenuh oleh substrat. Jika jumlah substratnya sedikit, kecepatan kerja enzim juga rendah. Sebaliknya, jika jumlah substrat yang tersedia banyak, kerja enzim menjadi cepat. Pada keadaan substrat berlebih, kerja enzim tidak sampai menurun tetapi konstan.
BAB V KESIMPULAN
o Enzim amilase tidak dapat bekerja apabila diberi perlakuan termal berlebihan (di luar suhu optimum) karena mengalami denaturasi protein pada bagian apoenzimnya.
o Pada suhu optimum, 37 ºC, enzim amilase bekerja pada level optimum yang menghasilkan maltosa dan dekstrin sebagai produk samping , yang dapat terlihat pada warna campuran larutan yang didiamkan dalam jangka waktu tertentu akan menjadi jernih.
o Kerja enzim dipengaruhi beberapa faktor:
o Suhu
Semakin tinggi suhu, enzim akan semakin mempercepat reaksi sampai pada suhu optimum setelah itu kecepatan reaksi akan menurun karena enzim akan rusak.
o Konsentrasi substrat
Semakin besar kadar substrat maka semakin besar kerja enzim sehingga reaksi semakin cepat tetapi hanya sampai batas tertentu.
DAFTAR PUSTAKA http://id.wikipedia.org/wiki/Enzim
Whitford D., 2005. Protein, Stucture and Function. John Wiley & Sons, Ltd, England Murray, R.K., Granner D.K and Victor W.R., 2006. Biokimia Harper. Alih bahasa,
Bram U. Pendit, ed.27. EGC. Jakarta
Manz, Andreas, Nicole Pamme, dan Dimitri Iossifidis. 2004. Bioanalytical Chemistry. London: Imperial College Press.
Boyer, Rodney.2000.Modern Experimental Biochemistry third edition. San Fransisco : Benjamin/Cummings