Pengaruh Pemberian Ekstrak Temulawak (Curcuma Xanthorrhiza Roxb.) Secara Topikal Terhadap Eritema Pada Proses Penyembuhan Luka Diabetik Tikus Galur Wistar Kondisi Diabetes
Teks penuh
(2) HALAMAN PENGESAHAN TUGAS AKHIR PENGARUH PEMBERIAN EKSTRAK TEMULAWAK (CURCUMA XANTHORRHIZA ROXB.) SECARA TOPIKAL TERHADAP ERITEMA PADA PROSES PENYEMBUHAN LUKA DIABETIK TIKUS GALUR WISTAR KONDISI DIABETES Oleh: Hamdy Abdillah NIM 135070201111031 Telah diuji pada Hari : Rabu Tanggal : 29 Maret 2017 dan dinyatakan lulus oleh :. Penguji I. Dr. Husnul Khotimah, S.Si, M.Kes NIP. 197511252005012001 Pembimbing-I/Penguji-II. Pembimbing-II/Penguji-III. Ns. Heri Kristianto, S.Kep, M.Kep, Sp.KMB. Ns. Ika Setyo Rini, S.Kep, M.Kep. NIP. 198211262008121001. NIP. 1981082242015042001. Mengetahui Ketua Jurusan Keperawatan. Dr. Ahsan, S.Kp, M.Kes NIP. 196408141984011001. ii.
(3) KATA PENGANTAR. Puji syukur ke hadirat Tuhan Yang Maha Esa yang telah melimpahkan rahmat serta hidayah-Nya sehingga tugas akhir yang berjudul “Pengaruh Pemberian Ekstrak Temulawak (Curcuma Xanthorrhiza Roxb.) Secara Topikal Terhadap Eritema Pada Proses Penyembuhan Luka Diabetik Tikus Galur Wistar Kondisi Diabetes“ ini dapat di selesaikan dengan baik. Dengan selesainya penyusunan tugas akhir ini, penulis mengucapkan terimakasih yang tak terhingga kepada: 1. Dr. dr. Sri Andarini, M.Kes selaku Dekan Fakultas Kedokteran Universitas Brawijaya. 2. Dr. Ahsan, S.kp, M.Kes selaku Ketua Program Studi Ilmu Keperawatan Fakultas Kedokteran Universitas Brawijaya. 3. Ns. Heri Kristianto, S.Kep., M.Kep, Sp.Kep.MB selaku dosen pembimbing utama yang telah membimbing dengan penuh kesabaran dalam memberikan arahan dan masukan, dukungan yang konstruktif, serta motivasi yang luar biasa dalam penyusunan tugas akhir ini. 4. Ns. Ika Setyo Rini, S.Kep., M.Kep selaku dosen pembimbing kedua yang telah membimbing dengan penuh kesabaran dalam memberikan arahan dan masukan, dukungan yang konstruktif, serta motivasi yang luar biasa dalam penyusunan tugas akhir ini. 5. Segenap anggota tim tugas akhir FKUB yang telah banyak memfasilitasi kelengkapan sarana penyelesaian tugas akhir ini. 6. Segenap anggota tim Lab. Farmako FKUB yang telah banyak memfasilitasi kelengkapan sarana penyelesaian tugas akhir ini iii.
(4) 7. Papa Aminto, Mama Maulidawati, Mas Arya Fajar dan Adik Ayu tercinta yang senantiasa berdoa, dan memberikan semangat serta dukungan dalam penyusunan tugas akhir ini. 8. Teman-teman kelompok penlitian Pak Heri yang telah membantu dan memberi dukungan dari awal penelitian sampai akhir 9. Mas Amar Husni dan Mas Ipung yang bersedia menjadi teman bertukar pikiran di kala senang dan susah 10. Mbak Hesti Sriwahyuni yang selalu memberikan semangat dan dorongan dalam menyelesaikan tugas akhir ini 11. Teman-teman seperjuangan PSIK 2013 yang telah memberikan motivasi kepada penulis dalam penyusunan tugas akhir ini. 12. Semua pihak yang turut berperan dalam penyelesaian penyusunan tugas akhir ini. Penulis menyadari bahwa penulisan proposal ini masih terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun. Semoga tugas akhir ini dapat bermanfaat. Malang, 29 Maret 2017. Penulis. iv.
(5) DAFTAR ISI Halaman Judul ............................................................................................... i. Lembar pengesahan. ..................................................................................... ii. Kata Pengantar .............................................................................................. iii. Abstrak. ......................................................................................................... iv. Abstract. ........................................................................................................ v. Daftar Isi ....................................................................................................... vi. Daftar Tabel ................................................................................................... x. Daftar Gambar ............................................................................................... xi. Daftar Lampiran ............................................................................................. xii. BAB 1 PENDAHULUAN 1.1 Latar Belakang................................................................................ 1. 1.2 Rumusan Masalah .......................................................................... 4. 1.3 Tujuan Penelitian ............................................................................ 4. 1.3.1 Tujuan Umum ..................................................................... 4. 1.3.2 Tujuan Khusus ................................................................... 4. 1.4 Manfaat Penelitian .......................................................................... 5. 1.4.1 Manfaat Penelitian Secara Teoritis ..................................... 5. 1.4.2 Manfaat Praktis................................................................... 5. BAB 2 TINJAUAN PUSTAKA 2.1 Diabetes Mellitus ............................................................................ 6. 2.1.1 Definisi ............................................................................... 6. 2.1.2 Klasifikasi ........................................................................... 7. 2.1.3 Etiologi Diabetes Mellitus Tipe 2. ........................................ 7. v.
(6) 2.1.4 Patofisiologi ........................................................................ 8. 2.1.5 Komplikasi Diabetes Mellitus. ............................................. 9. 2.2 Anatomi kulit ................................................................................... 10. 2.2.1 Epidermis ........................................................................... 10. 2.2.2 Dermis ................................................................................ 11. 2.2.3 Hipodermis ......................................................................... 11. 2.3 Luka Diabetikum. ........................................................................... 11. 2.3.1 Definisi Luka Diabetikum. ................................................... 11. 2.3.2 Klasifikasi Luka Diabetikum. ............................................... 12. 2.3.3 Patogenesis Luka Diabetikum. ........................................... 13. 2.3.4 Perawatan Luka Diabetikum. .............................................. 15. 2.4 Tahapan Penyembuhan Luka. ....................................................... 17. 2.4.1 Penyembuhan Luka Pada Kondisi Diabetes. ...................... 19. 2.5 Eritema. ......................................................................................... 19. 2.6 Temulawak (Curcumin xanthorriza Roxb). ..................................... 20. 2.6.1 Definisi. .............................................................................. 20. 2.6.2 Taksonomi. ......................................................................... 20. 2.6.3 Morfologi............................................................................. 21. 2.6.4 Persebaran. ........................................................................ 21. 2.6.5 Manfaat. ............................................................................. 22. 2.6.6 Kandungan. ........................................................................ 22. 2.7 Manfaat Temulawak (Curcuma xanthorriza Roxb. Untuk Penyembuhan Luka. ........................................................................................... vi. 24.
(7) BAB 3 KERANGKA KONSEP DAN HIPOTESIS 3.1 Kerangka Konsep ........................................................................... 26. 3.2 Penjelasan Kerangka Konsep ......................................................... 27. 3.3 Hipotesis Penelitian ........................................................................ 28. BAB 4 METODE PENELITIAN 4.1 Rancangan Penelitian ..................................................................... 29. 4.2 Sampel Penelitian ........................................................................... 29. 4.2.1 Kriteria Sampel ................................................................... 30. 4.2.2 Besar Sampel ..................................................................... 31. 4.3 Variabel Penelitian .......................................................................... 31. 4.3.1 Variabel Bebas ................................................................... 31. 4.3.2 Variabel Tergantung ........................................................... 32. 4.4 Lokasi dan Waktu Penelitian ........................................................... 32. 4.5 Alat dan Bahan Penelitian ............................................................... 32. 4.5.1 Pembuatan Ektrak dan Salep Temulawak .......................... 32. 4.5.2 Pembuatan Tikus Model Diabetes Mellitus ......................... 33. 4.5.3 Pembuatan Luka Diabetes. ................................................ 33. 4.5.4 Perawatan Luka.................................................................. 34. 4.5.6 Pemeliharaan Tkius ............................................................ 35. 4.5.7 Teknik Pencegahan Infeksi ................................................. 35. 4.6 Definisi Operasional ........................................................................ 35. 4.7 Prosedur Penelitian / Pengumpulan Data ....................................... 37. 4.7.1 Cara Membuat Ekstrak Temulawak .................................... 37. vii.
(8) 4.7.2 Pembuatan Salep Temulawak ............................................ 38. 4.7.3 Pembuatan Tikus Model Diabetes Mellitus ......................... 39. 4.7.4 Pembuatan Luka pada Tikus Model Diabetes Mellitus ........ 39. 4.7.5 Perawatan Luka.................................................................. 30. 4.8 Prosedur Pengumpulan Data .......................................................... 42. 4.8.1 Metode Pengumpulan Data ................................................ 42. 4.8.2 Teknik Pengumpulan Data ................................................. 42. 4.8.3 Cara Pengambilan Gambar ................................................ 42. 4.9 Analisis Statistik ............................................................................. 43. 4.9.1 Uji Normalitas dan Homogenitas ........................................ 43. 4.9.2 Uji Antar Kelompok ............................................................. 43. 4.9.3 Uji Perbandingan Berganda .................................................. 43. 4.10. Justufikasi Etik .................................................................... 44. 4.11. Alur Kerja Studi Pendahuluan ............................................. 48. 4.12. Alur Penelitian .................................................................... 49. BAB 5 HASIL PENELITIAN DAN ANALISA DATA 5.1 Hasil Penelitian .............................................................................. 51. 5.1.1 Hasil Ekstraksi Temulawak (Curcuma Xanthorriza Roxb) ... 51. 5.1.2 Hasil Induksi Dengan Injeksi Streptozotocin (Stz) ............... 52. 5.1.3 Hasil Perawatan Luka Diabetic Terhadap Derajat Eritema. 55. 5.1.4 Hasil Pengamatan Terhadap Nilai Rerata Derajat Eritema Pada Jaringan Luka ............................................................ 55. 5.2 Analisa Data .................................................................................. 56. viii.
(9) 5.2.1 Hasil Uji Normalitas Dan Homogenitas ............................... 56. 5.2.2 Hasil Uji One Way Anova Derajat Eritema .......................... 57. 5.2.3 Hasil Uji Perbandingan Berganda (Post Hoc Test) ............. 57. BAB 6 PEMBAHASAN 6.1 Kondisi Diabetes Mellitus Pada Sampel Penelitian ........................ 59. 6.2 Pengaruh Normal Saline Dan Vaselin Terhadap Jumlah Eritema Pada Jaringan Luka Diabetes Mellitus .................................................... 62. 6.3 Pengaruh Ekstrak Temulawak (Curcuma Xanthorriza Roxb) ......... 63. 6.4 Analisis Perbedaan Jumlah Eritema Antara Kelompok Control Dan Kelompok Perlakuan ...................................................................... 68. 6.5 Analisis Pebedaan Jumlah Eritema Kelompok Perlakuan .............. 70. 6.6 Implikasi Keperawatan .................................................................... 72. 6.6.1 Akademik............................................................................ 72. 6.6.2 Praktik ................................................................................ 72. 6.7 Keterbatasan Penelitian ................................................................. 73. BAB 7 PENUTUPAN 7.1 Kesimpulan .................................................................................... 74. 7.2 Saran ........................................................................................... 74. DAFTAR PUSTAKA LAMPIRAN. ix.
(10) DAFTAR TABEL Halaman Tabel 2.1 Klasifikasi Luka Diabetes Wagner .......................................................... 39 Tabel 5.1Data Rerata (Mean ±SD) Berat Badan Tikus dan Kadar Glukosa Darah Sebelum injeksi dan Setelah Injeksi STZ ............................................... 52 Tabel 5.2 Data Rerata Berat Sisa Pakan, Minum, Sekam sebelum Injeksi STZ ..... 53 Tabel 5.3 Data Rerata Berat Sisa Pakan, Minum, Sekam setelah Injeksi STZ ....... 54 Tabel 5.4 Hasil Nilai Rata-rata Eritema .................................................................. 55 Tabel 5.5 Hasil Uji Normalitas dan Homogenitas Derajat Eritema ......................... 76 Tabel 5.6 Hasil Uji One Way ANOVA .................................................................... 77 Tabel 5.7 Hasil Uji Turkey HSD ............................................................................. 78. x.
(11) DAFTAR GAMBAR Halaman Gambar 3.1 Kerangka Konsep............................................................................... 25 Gambar 4.1 Alur Studi Pendahuluan ...................................................................... 48 Gambar 4.2 Alur Penelitian .................................................................................... 49. xi.
(12) DAFTAR LAMPIRAN Lampiran 1. Foto Luka Tikus. Lampiran 2. Hasil Uji Statistik Jumlah Eritema. Lampiran 3. Keterangan Kelayakan Etik. Lampiran 4. Determinasi Temulawak. Lampiran 5. Keterangan Sehat Tikus. Lampiran 6. Pernyataan Keaslian Tulisan. Lampiran 7. Curriculum Vitae Peneliti. Lampiran 8. Lembar Konsultasi Dosen Pembimbing. Lampiran 9. Dokumentasi Penelitian. xii.
(13) BAB I PENDAHULUAN. 1.1. Latar Belakang Diabetes mellitus merupakan suatu kelompok penyakit metabolik dengan. karakteristik diabetes yang terjadi karena kelainan sekresi insulin, kerja insulin, atau kedua-duanya (Smeltzer & Bare, 2008). Secara umum DM (Diabetes Mellitus) ini diklasifikasikan menjadi tiga tipe, yaitu DM tipe 1, DM tipe 2, dan diabetes Gestasional (International Diabetes Federation, 2013). Menurut WHO (World Health Organization) pada tahun 2011 menyatakan penderita DM di Indonesia menduduki peringkat ke-4 terbanyak di dunia, setelah Tiongkok, India, dan Amerika Serikat. WHO memprediksi kenaikan jumlah penyandang DM di Indonesia dari 8,4 juta pada tahun 2000 menjadi sekitar 21,3 juta pada tahun 2030. Senada dengan WHO, International Diabetes Federation (IDF) pada tahun 2009, memprediksi kenaikan jumlah penyandang DM di Indonesia dari 7,0 juta pada tahun 2009 menjadi 12,0 juta pada tahun 2030. Meskipun terdapat perbedaan angka prevalensi, laporan keduanya menunjukkan adanya peningkatan jumlah penyandang DM sebanyak 2-3 kali lipat pada tahun 2030 (Perkumpulan Endokrinologi Indonesia (PERKENI), 2011). Diabetes melitus dapat menimbulkan komplikasi pada makrovaskuler (peripheral arterial disease) dan mikrovaskuler (retinopati, nefropati, dan neuropati) yang menyebabkan gangguan dan ekstremitas bawah seperti luka diabetes atau ulkus diabetik (Frykberg, 2006). Luka diabetes merupakan luka pada kondisi kerusakan jaringan kulit yang dimulai dari epidermis, dermis, jaringan subkutan dan dapat menyebar ke jaringan yang lebih dalam, seperti tulang dan. 1.
(14) 2. otot (PERKENI, 2009). Penderita DM mempunyai risiko tinggi mengalami infeksi dan amputasi jika luka kronis berkembang menjadi luka diabetik (Singh et al, 2014). Sekitar 30-50% pasien pasca amputasi akan dilakukan tindakan amputasi pada sisi kaki lainnya dalam kurun waktu 1-3 tahun. Angka kematian 1 tahun pasca amputasi berkisar 14,8% dan akan meningkat pada 3 tahun pasca amputasi sebesar 37 % dengan rerata umur pasien hanya 23,8 bulan post amputasi (PERKENI, 2009). Proses penyembuhan luka dibagi dalam 4 fase yaitu fase hemostasis, fase inflamasi, fase poliferasi, dan fase remodelling/maturasi (Sen & Roy, 2013). Untuk dapat mencapai fase poliferasi dan maturasi, diperlukan percepatan capaian fase inflamasi yang efektif yakni dapat berujung dengan penggunaan terapi antiinflamasi. Pada pasien diabetes terjadi peningkatan sitokin pro-inflamasi selama proses penyembuhan luka sehingga mengakibatkan fase inflamasi memanjang dan tidak ada kemajuan penyembuhan (Pierce, 2001). Inflamasi ditandai dengan adanya bengkak, nyeri, panas, fungsiolesa, dan kemerahan atau eritema. Eritema atau kemerahan merupakan manifestasi fisiologis tubuh terhadap luka yang paling mudah diobservasi langsung dibandingkan dengan tanda-tanda yang lain (Smelztser and Bare, 2002). Pada penderita diabetes terjadi gangguan pada proses penyembuhan luka akibat disfungsi sel fibroblas dan epidermal, gangguan angiogenesis, menghambat migrasi keratinosit, dan kurangnya faktor pertumbuhan, keadaan ini menyebabkan proses penyembuhan luka sangat lama (Lodhi, 2013). Pada penderita diabetes, kapiler kulit kaki mengalami iskemia sehingga dapat menurunkan suplai nutrisi ke daerah luka. Adanya iskemia menyebabkan penurunan suplai darah yang menyebabkan antibiotik tidak efektif.
(15) 3. sampai pada luka. Selain itu pada kondisi diabetes respon imunologi mengalami kerusakan, hal ini menyebabkan leukosit gagal melawan patogen yang masuk. Akibatnya, infeksi dapat menyebar dengan cepat dan menghasilkan kerusakan jaringan yang signifikan dan tidak dapat diubah (Frykberg, 2006). Terapi perawatan luka diabetik yang adekuat diharapkan dapat mempercepat proses penyembuhan secara optimal. Saat ini, banyak penelitian yang dilakukan terhadap keanekaragaman hayati seperti tanaman obat, hasil pertanian, peternakan serta biota laut terkait manfaat yang dapat diberikan terhadap penyembuhan berbagai penyakit, termasuk penyembuhan luka. Proses penyembuhan luka diabetes yang sangat lama mendorong untuk di lakukan penelitian – penelitian baru. Tingginya ketertarikan penelitian terhadap tanaman obat disebabkan asumsi bahwa tanaman obat lebih sehat dibanding produk sintetis dan juga banyak tersedia di alam (Paarakh, 2010). Temulawak (Curcuma xanthorriza Roxb.) merupakan salah satu tumbuhan obat yang banyak tumbuh di Indonesia. Temulawak diketahui memiliki banyak manfaat antara antioksidan,. lain sebagai antihepatitis, antikarsinogenik, antimikroba,. antihiperlipidemia,. antiviral,. antiinflamasi,. dan. detoksifikasi.. Komponen utama yang berhasiat sebagai obat dalam rimpang temulawak adalah kurkumin dan minyak atsiri (Susanti, 2009). Komponen senyawa yang bertindak sebagai antioksidan dari rimpang temulawak adalah flavonoid, fenol dan kurkumin (Jayaprakhasha, 2006). Kurkumin yang dikandung temulawak selain mengandung senyawa fenolik, juga memiliki aktifitas menekan pembentukan NF-kB ( Nuclear factor kappa-lightchain-enhancer of activated B cell) yang merupakan factor transkripsi sejumlah.
(16) 4. gen penting dalam proses imunitas dan inflamasi.. Dengan menekan kerja NF-kB maka radikal bebas dari hasil sampingan inflamasi berkurang (Chattopadhyay et al., 2006). Berdasarkan potensi komplek sebagai antioksidan dan penurun kadar glukosa darah yang mempercepat proses penyembuhan luka dari temulawak (Curcuma xanthorriza Roxb.) yang telah dijelaskan sebelumnya maka diperlukan penelitian lebih lanjut mengenai pengruh ekstrak temulawak terhadap jumlah eritema pada kondisi diabetes sebagai salah satu komplikasi diabetes melitus.. 1.2. Rumusan Masalah Bagaimana pengaruh ekstrak temulawak (Curcuma xanthorriza Roxb.). terhadap jumlah eritema pada luka kondisi diabetes 1.3. Tujuan Penelitian. 1.3.1. Tujuan Umum Mengetahui pengaruh ekstrak temulawak (Curcuma xanthorriza Roxb.). terhadap eritema pada luka kondisi diabetes 1.3.2. Tujuan Khusus. 1. Mengetahui jumlah eritema tikus dengan gula darah normal dengan perawatan luka standar tikus dan pemberian olesan vaselin. 2. Mengetahui jumlah eritema tikus kondisi diabetes dengan perawatan luka standar dan pemberian olesan vaselin. 3. Mengetahui jumlah eritema tikus kondisi diabetes dengan perawatan luka standar dan pemberian krim temulawak 15%. 4. Mengetahui jumlah eritema tikus kondisi diabetes dengan perawatan luka standar dan pemberian olesan vaselin dan ekstrak temulawak 20%.
(17) 5. 5. Mengetahui jumlah eritema tikus kondisi diabetes dengan perawatan luka standar dan pemberian olesan vaselin dan ekstrak temulawak 25% 6. Menganalisis perbedaan jumlah eritema antara kelompok control dan kelompok perlakuan. 7. Menganalisis perbedaan jumlah eritema antara ketiga kelompok perlakuan.. 1.4 Manfaat Penelitian 1.4.1. Manfaat Penelitian Secara Teoritis. 1. Dapat di jadikan sebagai dasar teori untuk meningkatkan khasanah ilmu pengetahuan masyarakat dalam mengunakan temulawak (Curcuma xanthorriza Roxb.) yang efektif, alamiah, aman dan lebih terjangkau dalam terapi penyembuhan luka diabetesa. 2. Menjadi dasar penelitian lebih lanjut untuk mengembangkan zat yang terkandung dalam temulawak (Curcuma xanthorriza Roxb.) sebagai pengobatan alternative perwatan luka diabetesa.. 1.4.2. Manfaat Secara Praktis. 1. Dapat dijadikan sebagai dasar teori untuk memberikan informasi pada praktik keperawatan terkait terapi komplementer untuk perawatan luka diabetes yang bersifat cost effective. 2. Dapat dijadikan sebagai bahan pertimbangan perusahaan industri obat untuk memproduksi suatu alternative baru ekstrak temulawak (Curcuma xanthorrizaaRoxb.) dalam penyembuhan luka..
(18) BAB II Tinjauan Pustaka. 2.1 Diabetes Mellitus 2.1.1 Definisi Diabetes Mellitus adalah suatu kondisi penyakit metabolik yang ditandai dengan tingginya kadar glukosa darah (hiperglikemia) akibat gangguan sekresi insulin dan atau peningkatan resistensi seluler terhadap insulin (WHO, 2013). Pada keadaan diabetes melitus kinerja insulin menjadi tidak efisien, baik kerena ketidak sesuaian jumlah maupun kualitas (Lupolalan, 2008). Insulin adalah hormon yang bertanggung jawab dalam mempertahakan kadar glukosa darah yang normal, dengan mengkonversi glukosa menjagi glikogen. (Rother, 2007). Diagnosis DM ditegakkan melalui anamnesa dan juga hasil laboratorium. Pada anamnesa ditemukan gejala yang khas, yaitu poliuri (banyak kencing), polidipsia (banyak minum), polifagia (banyak makan), dan penurunan berat badan. Pada pemeriksaan laboratorium ditemukan hasil konsentrasi gula darah acak >11,1 mmol/L (200 mg/dl) atau gula plasma puasa >7,0 mmol/L (126 mg/dl) atau gula plasma 2 jam >11,1 mmol/L (200 mg/dl) selama tes toleransi glukosa oral (Stumvoll, 2008). Penderita diabetes mellitus mempunyai resiko untuk menderita komplikasi akibat perjalanan penyakit ini, yaitu retinopati, gagal ginjal, neuropati, aterosklerosis, dan gangrene (Foster, 2011).. 6.
(19) 7. 2.1.2 Klasifikasi Klasifikasi DM yang dianjurkan oleh PERKENI (Perkumpulan Endokrinologi Indonesia) adalah sebagai berikut : a. DM tipe 1 (destruksi sel beta, umumnya menjurus ke defisiensi insulin absolut) : 1. Melalui proses imunolgik 2. Idiopatik (tidak diketahui penyebabnya) b. DM tipe 2 (penyebab diketahui penyebabnya) c. DM tipe lain : 1. Defek genetik fungsi sel beta 2. Penyekit endokrin pancreas : pankreatitis, trauma/pankreatektomi, neoplasma, pankreatopati, fibroikaikulus. 3. Karena zat kimia : vacor, asam nikotinat, pentamidin 4. Infeksi : rubella kongenital, cytomegalovirus. 2.1.3 Etiologi Diabetes Mellitus Disebabkan berkurangnya produksi dan ketersediaan insulin dalam tubuh atau terjadinya gangguan fungsi insulin. Kekurangan insulin disebabkan adanya kerusakan sebagian kecil atau sebagian besar sel-sel B Langerhans dalam kelenjar pankreas yang berfungsi menghasilkan insulin. Namun, jika dirunut lebih lanjut, beberapa faktor penyebab sebagai berikut : 1. Genetik Diabetes. mellitus. cenderung. diturunkan.. Anggota. keluarga. kemungkinan lebih besar terserang penyakit ini dibandingkan dengan.
(20) 8. anggpta keluarga yang tidak menderita diabetes mellitus (Rossela, 2008). 2. Virus Virus penyebab diabetes mellitus adalah , rubelle, mumps, dan human coxackievirus B4. Melalui mekanisme infeksi dalam sle B pankreas, virus ini mengakibatkan destruksi atau perusakan sel (Rosella, 2008) 3. Bahan toksik Bahan beracun yang mampu merusak sel B pankreas secara langsung adalah alloxan, pyrinuron (rodentisida), dan streptozotocy (Rosella, 2008).. 2.1.4 Patofisiologi Diabetes Mellitus Diabetes melitus merupakan penyakit yang disebabkan oleh adanya kekurangan insulin secara relatif maupun absolut. Defisiensi insulin dapat terjadi melalui 3 jalan, yaitu rusaknya sel-sel β pankreas karena pengaruh dari luar (virus, zat kimia tertentu, dll), penurunan reseptor glukosa pada kelenjar pankreas, kerusakan reseptor insulin (down regulation) di jaringan perifer (Manaf, 2009). Aktivitas insulin yang rendah akan menyebabkan penurunan penyerapan glukosa oleh sel-sel disertai peningkatan pengeluaran glukosa oleh hati melalui proses glukoneogenesis dan glikogenolisis. Sebagian besar sel tubuh tidak dapat menggunakan glukosa tanpa bantuan insulin sehingga timbul keadaan ironis, yakni terjadi kelebihan glukosa ekstrasel sementara terjadi defisiensi glukosa intrasel. Kadar glukosa yang meninggi ke tingkat dimana jumlah glukosa yang difiltrasi melebihi kapasitas sel-sel tubulus melakukan. reabsorpsi akan.
(21) 9. menyebabkan glukosa muncul pada urin, keadaan ini dinamakan glukosuria. Glukosa pada urin menimbulkan efek osmotik yang menarik H2O bersamanya. Keadaan ini menimbulkan diuresis osmotik yang ditandai oleh poliuria (sering berkemih). Cairan yang keluar dari tubuh secara berlebihan akan menyebabkan dehidrasi, yang pada gilirannya dapat menyebabkan kegagalan sirkulasi perifer karena volume darah turun mencolok. Sel-sel kehilangan air karena tubuh mengalami dehidrasi akibat perpindahan osmotik air dari dalam sel ke cairan ekstrasel yang hipertonik. Akibatnya timbul polidipsia (rasa haus berlebihan) sebagai mekanisme kompensasi untuk mengatasi dehidrasi. Defisiensi glukosa intrasel menyebabkan “sel kelaparan” akibatnya nafsu makan (appetite) meningkat sehingga timbul polifagia (pemasukan makanan yang berlebihan). penurunan. Efek defisiensi insulin pada metabolisme lemak menyebabkan sintesis. trigliserida. dan. peningkatan. lipolisis.. Hal. ini akan. menyebabkan mobilisasi besar-besaran asam lemak dari simpanan trigliserida. Peningkatan asam lemak dalam darah sebagian besar digunakan oleh sel sebagai sumber energi alternatif karena glukosa tidak dapat masuk ke dalam sel. Efek insulin pada metabolisme protein menyebabkan pergeseran kearah katabolisme protein. Penguraian protein-protein otot menyebabkan otot rangka lisut dan melemah sehingga terjadi penurunan berat badan (Sherwood, 2001).. 2.1.5. Komplikasi Diabetes Mellitus Komplikasi kronik pada dasarnya terjadi pada semua pembuluh darah di. seluruh bagian tubuh disebut dengan angiopati diabetic (Waspadji, 2000). Angiopati diabetic dibagi menjadi dua yaitu : makroangiopati (makrovaskuler) dan mikroangiopati (mikrovaskuler)..
(22) 10. Komplikasi kronik DM yang sering terjadi adalah sebagai berikut : a. Mikrovaskuler Kompikasi mikrovaskuler DM meliputi : nefropati, retinopati, neuropati. Mikrovaskuler timbul akibat penyumbatan pembuluh darah kecil khususnya kapiler (Waspadji, 2000) b. Makrovaskuler Komplikasi makrovaskuler DM meliputi : penyakit kardiovaskuler, stroke,. dan. penyakit. pembuluh. darah. perifer.. Komplikasi. makrovaskuler timbul akibat penyumbatan pembuluh darah besar, khususnya akibat penimbunan plak atheroma.. 2.2 Anatomi kulit Menurut Muttaqin (2011), kulit terdiri atas tiga lapisan, yang masing-masing memiliki berbagai jenis sel dan memiliki fungsi yang bermacam-macam. Ketiga lapisan tersebut adalah epidermis, dermis, subkutis/hypodermis.. 2.2.1. Epidermis Epidermis merupakan struktur lapisan kulit terluar. Sel-sel epidermis terus-. menerus mengalami mitosis, dan berganti dengan yang baru sekitar 30 hari sekali. Epidermis mengandung reseptor-reseptor sensorik untuk sentuhan, suhu, getaran, dan nyeri. Komponen utama epidermis adalah protein keratin yang dihasilkan oleh sel-sel yang disebut keratinosit. Keratin memiliki fungsi mencegah hilangnya cairan tubuh dan melindungi epidermis dari iritan atau mikroorganisme penyebab infeksi..
(23) 11. Bagian dasar epidermis terdapat melanosit atau sel pigmen. Melanosit merupakan sel-sel khusus epidermis yang terutama terlibat dalam produksi pigmen melanin yang mewarnai kulit dan rambut. Semakin banyak melanin, semakin banyak gelap warnanya. Melanin diyakini dapat menyerap sinar ultraviolet dan juga melindungi seseorang terhadap efek pancaran sinar ultraviolet yang berbahaya.. 2.2.2. Dermis Dermis adalah lapisan kulit yang berada di bawah epidermis dan di atas. hypodermis yang merupakan bangian terbesar kulit serta memberikan kekuatan dan struktur pada kulit. Lapisan papila dermis berada di bawah epidermis yang tersusun terutama dari sel-sel fibroblast yang dapat menghasilkan kolagen, yaitu komponen dari jaringan ikat. Dermis juga tersusun dari pembuluh darah limfe, serabut saraf, kelenjar keringat dan sabasea, serta rambut. 2.2.3. Hipodermis Hipodermis merupakan bagian terbawah kulit. Hipodermis terdiri dari. jaringan adipose dimana berfungsi untuk memberikan bantalan antara lapisan kulit dan struktur internal seperti otot dan tulang, serta sebagai pengatur homeostasis, regulator temperatur, dan metabolism. 2.3 Luka Diabetik 2.3.1 Definisi Luka Diabetik Luka diabetik adalah luka terbuka pada permukaan kulit pasien diabetes mellitus. Luka dapat berkembang menjadi infeksi dan ulkus diabetic jika tidak diberi.
(24) 12. perawatan luka yang baik (Mayfield et al, 2000). Luka diabetikum pada pasien diabetes. mellitus. mengalami. penyembuhan. luka. yang. lambat. karena. penyumbatan aliran darah, mengakibkan sirkulasi darah yang kurang baik, pemberian nutrisi dan oksigenasi kurang (Mayfield et al, 2000). Luka diabetik merupakan penyebab tersering dilakukanya amputasi yang didasari oleh kejadian non traumatik. Resiko amputasi 15 – 40 kali lebih sering pada penderita DM dibandingkan dengan non DM. Sebagian besar amputasi pada luka diabetik bermula dari luka pada kulit. Bila dilakukan deteksi dini dan pengobatan yang adekuat akan mengurangi kejadian tindakan amputasi. Ironisnya evaluasi dini dan penanganan yang adekuat di rumah sakit tidak optimal (Washilah, 2014). 2.3.2 Klasifikasi Luka Diabetik Klasifikasi luka diabetikum pada penderita diabetes mellitus menurut Wagner terdiri dari 6 tingkatan yaitu : Tabel 2.1 Klasifikasi Luka Diabetes (Wagner, 2008) Superficial wound Stadium 0. Kulit dalam keadaan baik dengan. (tidak ada luka terbuka). bentuk tulang kaki yang menonjol. Stadium 1. Terbatas pada lapisan epidermis. (luka superfisialis). dan dermis. Deep wound / ulcers Stadium 2. Lesi terbuka dengan penetrasi ke. (luka lebih dalam). tulang. atau. dikategorikan diabetikum. tendon.. Dapat. sebagai. ulkus.
(25) 13. Gangrene Stadium 3. Penetrasi. hingga. dalam. (ulkus dalam yang melibatkan tulang osteomyelitis, plantar abses atau sendi dan abses). infeksi hingga tendon. Stadium 4. Terlokalisir pada ibu jari kaki,. (ulkus dengan kematian jaringan). bagian depan kaki atau tumit. Gangrene. sebagian,. menyebar. hingga sebagian jari kaki, kulit sekitarnya. selulitis,. gangrene. lembab/kering Stadium 5. Ulkus dengan kematian jaringa. (ulkus dengan kematian jaringan). tubuh pada seluruh kaki. 2.3.3. Patogenesis Ulkus Diabetes Gangguan penyembuhan luka pada diabetes mellitus merupakan. penyebab penderita jatuh pada kondisi ulkus diabetik (Singh et al, 2014). Ulkus diabetes mrupakan komplikasi dari berbagai faktor resiko yang berbeda yaitu : neuropati perifer, penyakit vaskular perifer, deformitas kaki, trauma dan adanya infeksi dan sebagainya (Saba Noor, 2015). Neuropati yang diawali oleh iskemik merupakan akibat terjadinya stress oksidativ intra sel (Clayton et al, 2009). Neuropati adalah penyakit yang mengenai saraf menyebabkan gangguan di sensasi, pergerakan dan aspek lain bergantung pada sistem saraf yang terkena. Neuropati perifer pada diabetes merupakan satu dari penyebab utama ulkus diabetes. Lebih dari 60% pasien dengan neuropati perifer pada ekstremitas bawah. Meuropati pada pasien diabetes dimanifestasikan dalam 3 devisi sistem.
(26) 14. saraf yaitu neuropati motorik, neuropati sensori dan neuropati otonom (Saba Noor, 2015). Peningkatan level gula darah memicu peningkatan produksi enzim seperti aldose reductase dan sorbitol dehydrogenase (SDH) enzim ini merubah glukosa menjadi sorbitol dan fruktosa (Simerjit Singh, 2013). Degradasi sorbitol berjalan lambat sehingga sorbitol menumpuk dan mengakibatkan peningkatan tekanan osmotic dan merusak sel. Masuknya subrat (substrat flux) melalui jalur ini, selain dapat meningkatkan kadar gliserol dan fruktosa intraseluler, juga menurunkan rasio NADPH yang berakibat pada penghambatan aktivitas enzim lain serta meningkatkan kadar Reactive Oxygen Species ( ROS ) dalam tubuh. Peningkatan ROS mengakibatkan rusaknya DNA nuklear sehingga mengaktivasi Poly( ADP – Ribose) Poly merase (PARP). Aktivasi PARP ini dapat meningkatkan aktivitas lyceraldehyde. 3. phosphate. dehydrogenase. (GADPH).. GADPH. dapat. mengaktivasi jalur poliol kembali, protein kinase C (PKC) dan Advanced Gycation End – Production (AGE). Aktivasi PKC dapat menurunkan vasodilator Nitric Oxidase (NO) yang menyebabkan adanya oklusi atau penyumbatan pada pembuluh darah sehingga terjadi iskemia yang berujung pada mikroangiopati. Sedangkan peingkatan AGE dapat mengaktivasi jalur NF – kB yang berperan dalam peningkatan sitokinin proinflamasi. Jika terjadi luka, kondisi ini mempengaruhi lambatnya proses penyembuhan luka. ROS juga memicu terjadinya stress oksidatif. (Singh et al, 2014). Stress oksidatif merupakan faktor patogesis penting pada komplikasi ulkus diabetik terkait replikasi dan siklus sel pada penyembuhan luka (Gamal Badr, 2013). Stress oksidativ juga memicu terjadinya vasokonstriksi pembuluh darah, sehingga terjadi iskemik dan kematian jaringan meningkat (Clayton, 2009).
(27) 15. Gangguan proliferasi sel dan penutupan luka dipengaruhi oleh ROS melalui mekanisme merusak cytokine yang mengakibatkan disregulasi cytokine yang memicu peningkatan produksi proinflamasi salah satunya adalah Tumor Necrosis Factor α (TNF-α) (Singh et al, 2014). TNF-α memegang peran penting dalam perbaikan luka, melalui stimulasi keratinocyte dan proliferasi fibroblast. Penelitian terkini menemukan disregulasi TNF-α menghambat penyembuhan ulkus diabetik terkait peningkatan apoptosis dan penurunan proliferasi fibroblast (Gamal Badr, 2013). Hasil penelitian Gamal Badr (2013), melaporkan bahwa dengan memperbaiki peningkatan cytokine proinflamasi (TNF-α) pada jaringan luka dapat mengurangi pemanjangan fase inflamasi.. 2.3.4 Perawatan Luka Diabetikum Berbagai teknik perawatan luka diabetikum telah berkembang meliputi teknik konvensional dan modern. Teknik konvensional menggunakan kassa, cairan normal saline, dan antibiotik, sedangkan teknik modern menggunakan balutan sintetik seperti balutan alginate, balutan foam, hidropolimer, hidrokoloid, dan hidrogel (Mine, 2003). Perawatan luka diabetikum adalah sebagai berikut : 1. Normal saline Menurut pedoman klinik AHCPR (The Agency far Health Care Policy and Research), cairan pembersih yang diajurkan adalah normal saline. Normal saline merupakan cairan fisiologis. Membersihkan luka secara hati-hati dengan normal saline dan memasang balutan yang dibasahi normal. saline. merupakan. cara. yang. sering. digunakan. untuk. menyembuhkan luka dan melakukan debridemen luka. Penggunaan.
(28) 16. normal saline untuk mempertahankan permukaan luka agar tetap lembab sehingga dapat meningkatkan perkembangan dan migrasi jaringan epitel (Mine, 2003). 2. Antiseptic a. Iodine Iodine merupakan antiseptik dengan kerja spectrum luas digunakan sebagai disinfektan dan membersihkan luka infeksi. Karakteristik iodine mempunyai sifat sitotoksik terhadap fibroblas, memperlambat epitelisasi danmenurunkan kontraksi otot (Dealley, 2005). b. Ptassium permanganat Potassium permanganat sering digunakan dengan kondisi luka dengan eksudat yang berlwbihan (Dealey, 2005). 3. Antibiotik Framycetin sulfat adalah golongan antibiotik yang digunakan untuk berbagai macam terapi luka infeksi, luka bakar, ulkus diabetes, ulkus dekubitus, dan skin graft. Namun, penggunaan jangka panjang framycetin sulfat dapat menyebabkan pertumbuhan berlebih dari bakteri tertentu, jamur, atau organisme lain. Sehingga hal ini dapat menyebabkan munculnya berbagai infeksi lain seperti infeksi jamur (Depkes, 2008). 4. Balutan Modern a. Balutan hidrogel Terdiri dari polimer yang mampu menyimpan air. Hidrogel mempunyai sifat tidak berminyak, tiksotropi, mudah menyebar, dan mudah dibersihkan..
(29) 17. Mampu menyerap eksudat dalam jumlah sedang sampai banyak. Digunakan untuk membersihkan luka dan autolitik debridement (Landry, 2003). b. Balutan alginate Balutan alginate mempunyai kemampuan menyerap eksudat jumlah sedang sampai banyak. Balutan ini mempunyai kemampuan menjaga lingkungan lembab dan merangsang autolitik debridement (Landry, 2003). c. Balutan foam Komposisi. terdiri. dari. polimer. yang. memiliki. kemampuan. mempertahankan cairan pada luka dengan kedalaman parsial atau kedalaman penuh untuk mempertahankan luka lembab. Balutan foam mampu menyerap eksudat (Landry, 2003) d. Balutan hidropolimer Mampu menyerap jumlah eskudat dalam jumlah sedang sampai banyak. Mampu mempertahankan kelembaban sehingga merangsang terjadinya autolitik debridement. (Landry, 2003).. 2.4 Tahapan penyembuhan luka Tanpa memandang penyebab, tahapan penyembuhan luka terbagi atas : a. Fase koagulasi Setelah luka terjadi, timbul perdarahan pada daerah luka yang diikuti dengan aktifasi kaskade pembekuan darah sehingga terbentuk klot hematoma. Proses ini diikuti oleh proses selanjutnya yaitu fase inflamasi. b. Fase inflamasi.
(30) 18. Fase inflamasi mempunyai prioritas fungsional yaitu menggalakkan hemostasis, menyingkirkan jaringan mati, dan mencegah infeksi oleh bakteri patogen terutama bakteria. Pada fase ini platelet yang membentuk klot hematom mengalami degranulasi, melepaskan faktor pertumbuhan seperti platelet derived growth factor (PDGF) dan transforming growth factor ß (βTGF), granulocyte colony stimulating factor (G-CSF), C5a, TNFα, IL-1 dan IL-8. Leukosit bermigrasi menuju daerah luka. Terjadi deposit matriks fibrin yang mengawali proses penutupan luka. Proses ini terjadi pada hari 2-4. c. Fase proliferasi Fase proliferasi terjadi dari hari ke 4-21 setelah trauma. Keratinosit disekitar. luka. mengalami. perubahan. fenotif.. Regresi hubungan. desmosomal antara keratinosit pada membran basal menyebabkan sel keratin bermigrasi kearah lateral. Keratinosit bergerak melalui interaksi dengan matriks protein ekstraselular (fibronectin,vitronectin dan kolagen tipe I). Faktor proangiogenik dilepaskan oleh makrofag, vascular endothelial growth factor (VEGF) sehingga terjadi neovaskularisasi dan pembentukan jaringan granulasi. d. Fase remodeling Remodeling. merupakan. fase. yang. paling. lama. pada. proses. penyembuhan luka,terjadi pada hari ke 21-hingga 1 tahun. Terjadi kontraksi luka, akibat pembentukan aktin myofibroblas dengan aktin mikrofilamen yang memberikan kekuatan kontraksi pada penyembuhan luka. Pada fase ini terjadi juga remodeling kolagen. Kolagen tipe III digantikan kolagen tipe I yang dimediasi matriks metalloproteinase yang.
(31) 19. disekresi makrofag, fibroblas, dan sel endotel. Pada masa 3 minggu penyembuhan, luka telah mendapatkan kembali 20% kekuatan jaringan normal (Ting, 2008).. 2.4.1 Penyembuhan Luka Pada Kondisi Diabetes Luka diabetes menyebabkan penurunan vaskuler yang menyebabkan hipoksia dan peningkatan oksigen radikal bebas. Hipoksia dan peningkatan radikal bebas meingkatkan peningkatan advance glycatin and products (AGE) (Abiko, 2010). Penigkatan AGE akan meningkatkan angiogenesis dengan cara merusak pembentukan pembuluh darah baru. Ketika terjadi penurunan pembuluh darah baru maka akan terjadi penururnan substansi penting untuk penyembuhan luka antara lain, Platelet Derivet Growth Factor (PDGF) dan fibroblast Growth Factor (FGF) (Abiko, 2010). , Platelet Derivet Growth Factor (PDGF) dan fibroblast Growth Factor (FGF) berperan dalam proses poliferasi fibroblast (Mathew, 2000). Penurunan poliferasi fibroblast akan menurunkan produksi kolagen. Penurunan produksi kolagen menyebabkan penyembuhan luka yang lemah dan waktu yang lebih panjang (Abiko, 2010).. 2.5 Eritema Fase penyembuhan luka didukung oleh beragam proses seluler seperti regenerasi sel, poliferasi sel, dan pembentukan kolagen. Sedangkan respon jaringan terhadap cedera melewati beberapa fase, yaitu inflamasi, pliferasi, dan remodelling (maturasi). Untuk dapat mencapai fase poliferasi dan maturasi, diperlukan percepatan capaian fase inflamasi yang efektif yakni.
(32) 20. dapat ditunjang dengan penggunaan terapi antiinflamasi. Inflamasi ditandai dengan adanya bengkak, nyeri, panas, fungsio lesa, dan kemrahan atau eritema. Eritema atau kemerahan merupakan manifestasi fisiologis tubuh terhadap luka yang paling muda diobservarsi langsung dibandingkan dengan tanda-tanda yang lain (Smeltzer and Bare, 2002).. 2.6 Temulawak (Curcumin xanthorriza Roxb) 2.6.1. Definisi Curcuma berasal dari kata arab, kurkum yang berarti kuning. Xanthorriza. berasal dari kata yunani, xanthos yang berarti kuning dan rhiza berarti umbi akar. Jadi Curcuma xanthorriza Roxb. berarti akar kuning. Dalam bahasa Indonesia Curcuma xanthorriza Roxb. disebut temulawak, yang berarti akar kuning. Dalam bahasa Belanda disebut geel wortel dan dalam bahasa Jerman disebut javanischergelbwurzel. (Efidantim Lentera,2006). 2.6.2. Taksonomi Temulawak (Curcuma xanthorrizaRoxb.) termasuk family Zingiberaceae.. Temulawak satu family dengan anggota temu-temuan lainya, yakni temu hitam (Curcuma. aeruginosa),. (Kaempferiagalaga),. kunyit lengkuas. (Curcuma. domestica. (Lenguasgalaga),. Val.),. kencur. dan. jahe. (ZingiberofficinaleRosc). Di sepanjang daerah tropis dan subtropis, family Zingiberaceae terdiri dari 47 genus dan 1.400 spesies. (Efidantim Lentera,2006) Temulawak termasuk dalam divisi Spermathophyta, subdivisi Angiospermae, kelas Monocotyledoneae, bangsa Scitamineae, suku atau family Zingiberaceae marga Curcuma, dan spesies Curcuma xanthorrizaRoxb. (Efidantim Lentera,2006).
(33) 21. 2.6.3. Morfologi Temulawak merupakan tumbuhan tahunan yang hidup berumpun dan. berbatang semu dan berupa gabungan beberapa pangkal daun yang terpadu. Tiap batang memiliki 2-9 helai daun, bunganya berukuran pendek dan lebar, warna putih atau kuning tua dan pangkal bunga berwarna ungu. Temulawak termasuk jenis tumbuh-tumbuhan herba yang batang pohonnya berbentuk batang semu dan tingginya dapat mencapai 2 meter. Daunnya lebar dan pada setiap helaian dihubungkan dengan pelapah dan tangkai daun yang agak panjang. Temulawak mempunyai bunga yang berbentuk unik (bergerombol) dan berwarna kuning tua. (Azwar, 2011). 2.6.4. Persebaran Temulawak banyak di temukan di hutan-hutan daerah tropis di tanah. tegalan sekitar pemukiman, terutama pada tanah gembur, sehingga buah rimpangnya mudah berkembang menjadi besar. Daerah tumbuhnya selain di dataran rendah juga dapat tumbuh baik sampai pada ketinggian tanah 1.500 mdpl. (Azwar, 2011) Temulawak tersebar di daerah tropika, terutama di Asia Selatan dan Asia Tenggara. Temulawak merupakan tumbuhan asli untuk wilayah Indo-Malesia, mulai dari India, Indonesia sampai Cina Taiwan, dan Australia. Adapun C. xanthorhiza merupakan tumbuhan asli pulau Jawa, Bali dan Maluku, dan banyak di budidayakan di pulau Jawa. (Achmad, 2008) Curcuma xanthorrhiza di Indonesia umumnya dikenal sebagai temulawak. Di beberapa daerah tumbuhan ini juga dikenal dengan nama koneng gede, temu.
(34) 22. raya, temu besar (Sunda), koneng tegel (Jawa), temolobak (Madura), tommo (Bali), tommon (Sulawesi Selatan), dan karbanga (Ternate). (Achmad, 2008). 2.6.5. Manfaat Curcuma xanthorrhiza atau temulawak banyak sekali digunakan dalam. pengobatan tradisional. Di berbagai daerah di Indonesia rimpang C. xanthorrhiza merupakan salah satu bahan ramuan obat tradisional jamu yang penting. Terdapat lebih dari 50 resep yang menggunakan temulawak untuk pengobatan berbagai penyakit, antara lain penyakit yang berhubungan dengan saluran pencernaan , seperti diare, disentri, cacingan, kurang nafsu makan, gangguan hati, sakit kuning, pengobatan sakit ginjal, kencing batu, dan empedu, pengobatan rematik, kejangkejang, dan pegal linu. Rimpang C. xanthorrhiza juga digunakan untuk pengobatan penyakit yang berhubungan dengan kolesterol, tekanan darah tinggi, sebagai ramuan untuk peluruh haid, pengobatan haid yang tidak lancer, perawatan setelah melahirkan, atau obat untuk meningkatkan produksi air susu. (Achmad, 2008) Di Filipina C. xanthorrhizajuga digunakan untuk menumbuhkan nafsu makan, pengobatan penyakit cacing, dan demam, sedangkan di cina digunakan untuk gangguan saluran pencernaan. Di eropa rimpang C. xanthorrhiza digunakan sebagai obat choleretik. (Achmad, 2008). 2.6.6. Kandungan Sama seperti Curcuma domestica, ciri kimia yang utama tumbuhan C.. xanthorrhiza ialah terdapatnya senyawa-senyawa turunan diarilheptan atau.
(35) 23. kurkuminoid, dan senyawa-senyawa seskuiterpen jenis bisabolen, bersama-sama dengan sejumlah senyawa monoterpene. Rimpang tumbuhan C. xanthorrhiza ditemukan tiga senyawa kurkuminoid yang utama, yaitu 1,7-bis (4-hidroksi-3metoksifenil)-1,6-heptadien-3,5-dion atau dikenal dengan nama kurkumin, monodemetoksirkurkumin. atau. disebut. juga. demetoksikurkumin,. dan. bisdemetoksikurkumin. (Achmad, 2008) Kandungan kimia C. xanthorrhiza ialah senyawa-senyawa seskuiterpen jenis bisabolen. Minyak atsiri dari rimpang C. xanthorrhiza ditemukan banyak turunan bisabolen seperti β-kurkumen, β-seskuifelandren, β-atlanton, turmeron, ar-kurkumen, α-kurkumen, α-turmeron, dansantorizol. β-kurkumen dan arkurkumen adalah dua senyawa yang merupakan komponen utama minyak atsiri. (Achmad, 2008) Di Indonesia dan banyak negara lain C. xanthorrhiza banyak digunakan untuk menyembuhkan berbagai penyakit. Senyawa-senyawa aktif, diarilhepan atau kurkuminoid, dan kandungan minyak atsiri, terutama seskuiterpen jenis biasbolen telah banyak dan masih merupakan objek studi farmakologi dan klinik. Banyak efek farmakologi senyawa-senyawa ini yang menarik telah dilaporkan, seperti antiinflamasi, menurunkan kadar lemak dan antibakteri. Senyawa arilheptaoid non-fenol yang ditemukan pada rimpang C. xanthorrhiza yang disebut juga alnuston bersifat antiinflamsi. Senyawa alnuston memperlihatkan aktivitas antiinflamasi topical yang tinggi, sebanding dengan obat oksifenbutazon. Senyawa α-kurkumen yang berasal dari minyak atsiri C. xanthorrhiza dapat menurunkan kadar. kolesterol. dan. trigliserida. dalam. darah.. Sedangkan. kurkumin. memperlihatkan sifat-sifat koleretik yang menghambat aliran empedu. Selanjutnya senyawa seskuiterpen utama pada C. xanthorrhiza memperlihatkan aktivitas anti.
(36) 24. tumor. Senyawa 5’-metoksikurkumin yang diisolasi dari rimpang C. xanthorrhiza memperlihatkan aktivitas antioksidan yang tinggi terhadap asam linoleate. Senyawa germakron yang mempunyai sifat menekan system saraf pusat pada pengujian mengunakan tikus. (Achmad, 2008) Aktivitas antibakteri xantorizol yang berasal dari C. xanthorrhiza terhadap Streptococcus telah diselidiki pula, dan ternyata senyawa ini memperlihatkan aktivitas antibakteri yang kuat terhadap beberapa mikroorganisme, terutama bakteri Gram positif, dibandingkan senyawa-senyawa antikariogenik alaminya. (Achmad, 2008). 2.7 Manfaat temulawak (Curcuma xanthorriza Roxb.) untuk penyembu- han luka Kurkumin antiinflamasi,. pada. antibakteri,. Curcuma. xanthorriza. antihepatotoksik,. Roxbsebagai. antikolesterol,. dan. antioksidan, antikanker.. Kurkuminoid memiliki mekanisme yang dapat menurunkan reactive oxygen species dan mencegah terjadinya oxidative burst pada neutrophil yang berpotensi merusak jaringan di sekitarnya (Purnamasari, 2014). Reactive oxygen species merupakan radikal bebas atau oksidan yang sangat reaktif, ROS adalah sebuah molekul yang mempunyai satu atau lebih elektron tidak berpasangan di orbit terluarnya. Radikal ROS yang bersifat tidak stabil ini berupaya mendapatkan pasangfan elektron dari molekul lain. Setiap ROS yang terbentuk dapat memulai suatu reaksi berantai yang terus berlanjut sampai ROS itu dihilangkan sendiri oleh ROS lain atau sistem antioksidannya. Produksi ROS secara berlebih dapat menyebabkan ketidakseimbangan antara ROS dan sistem antioksidannya yang berujung pada stress oksidatif yang dapat memicu.
(37) 25. terjadinya kerusakan pada stress oksidatif yang dapat memacu terjadinya kerusakan pada asam lemak tidak jenuh ganda yang terdapat pada membrane sel neutrofil (Purnamasari, 2014). Antioksidan tambahan akan dibutuhkan untuk mencegah terjadinya kematian sel karena produksi jumlah ROS yang berlebihan. Sumber antioksidan alami terdapat pada kurkumin dalam temulawak. Mekanisme antioksidan pada kurkumin terjadi melalui reaksi pemecahan berantai, yaitu kurkumin memberikan atom H dari senyawa OH yang dimiliki untuk mengikat radikal bebas dan molekul aktif. Kurkumin terdiri dari dua kelompok senyawa fenolik dan satu kelompok metilen (CH2). Kedua kelompok tersebut melepaskan atom hydrogen yang dimiliki untuk menangkap ROS. Flavonoid memiliki daya antioksidan kuat dengan daya penangkap radikal bebas yang luas dan dapat mengahambat formasi radikal bebas. Sedangkan tannin juga dapat bersifat sebagai antioksidan karena keampuannya menghambat peroksidasi lipid (Purnamasari, 2014). Minyak atsiri (xanthorrhizol) yang dikandung. temulawak memiliki. kemampuan menghambat pertumbuhan bakteri . ekstrak rimpang temulawak yang dinkubasi selama 3 jam pada neutrofil telah mampu membunuh bakteri sehingga neutrofil tetap viabel (Purnamasari, 2014)..
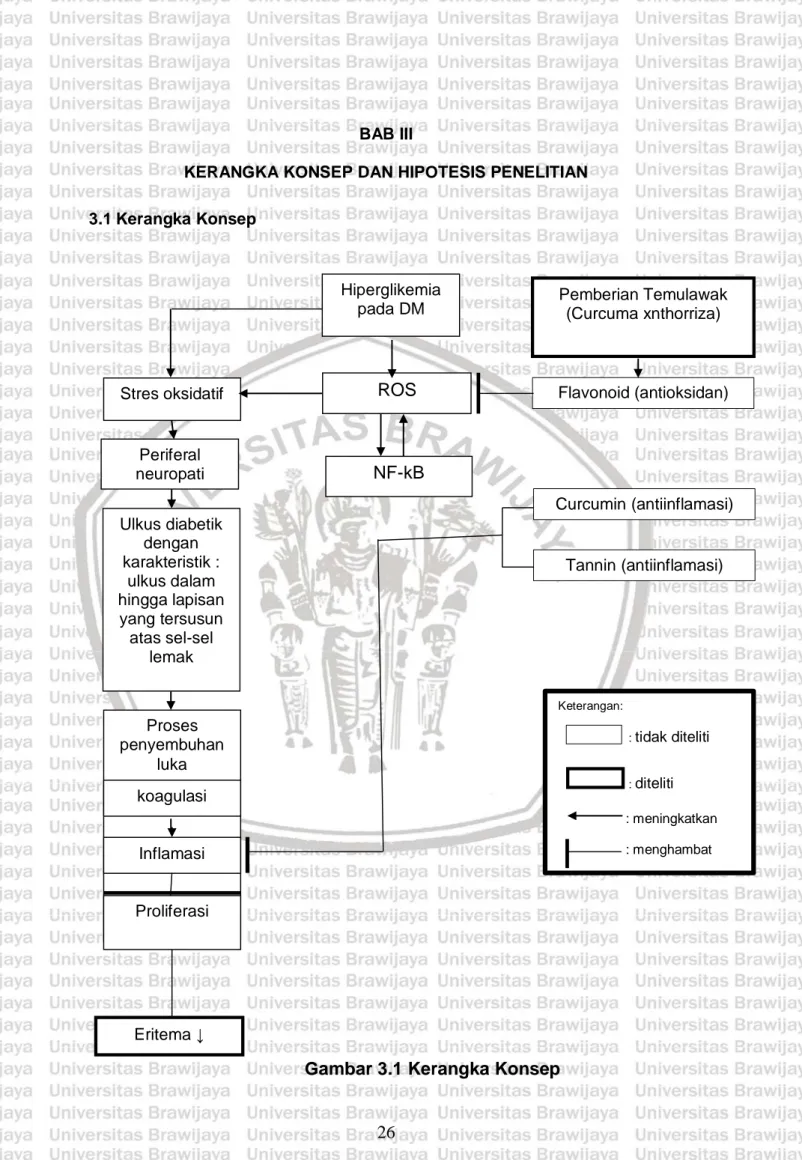
(38) BAB III KERANGKA KONSEP DAN HIPOTESIS PENELITIAN 3.1 Kerangka Konsep. Hiperglikemia pada DM. Stres oksidatif. ROS. Periferal neuropati. NF-kB. Pemberian Temulawak (Curcuma xnthorriza). Flavonoid (antioksidan). Curcumin (antiinflamasi) Ulkus diabetik dengan karakteristik : ulkus dalam hingga lapisan yang tersusun atas sel-sel lemak. Tannin (antiinflamasi). Keterangan:. Proses penyembuhan luka. : tidak. diteliti. : diteliti. koagulasi. : meningkatkan : menghambat. Inflamasi. Proliferasi. Eritema ↓. Gambar 3.1 Kerangka Konsep. 26.
(39) 27. 3.2 Penjelasan Kerangka Konsep Kondisi hiperglikemik kronik pada DM memicu stress oksidatif yang menimbulkan komplikasi neuropati. Periferal neuropati pada DM menyebabkan kerusakan inservasi otot kaki intrinsik sehingga dapat menimbulkan kerusakan kulit dan ulserasi pada kaki. Luka diabetik dikarakteristikkan dengan luka dalam dan hilangnya lapisan subkutan yang tersusun atas sel-sel lemak. Penyembuhan luka diabetik berbeda dengan proses penyembuhan luka biasa. Stres oksidatif merupakan akibat dari peningkatan radikal bebas. Radikal bebas adalah suatu molekul yang kehilangan salahbuah elektron dari pasangan elektron bebasnya. Peningkatan ROS dapat mengakibatkan kerusakan makro molekul seperti lipid berupa lipid peroksidasi, protein oksidasi dan juga kerusakan DNA yang merupakan kunci terhadap pathogenesis dari terjadinya kerusakan pada berbagai jaringan tubuh yang merupakan komplikasi DM. ROS (Reactive Oxygen Species) merupakan radikal bebas yang akan meningkatkan faktor inflamasi sehingga fase inflamasi tidak terkontrol. Hal ini akan mengakibatkan fase proliferasi ikut terhambat sehingga proses penyembuhan luka juga akan terhambat. Dengan demikian jumlah eritema meningkat akibat inflamasi tidak terkontrol dan menyebabkan fase proliferasi terhambat. Curcuma xanthorrhiza atau temulawak mengandung senyawa curcumin dan tannin yang bersifat antiinflamsi. Curkumin yang dikandung temulawak selain mengandung senyawa fenolik, juga memiliki aktifitas menekan pembentukan NFkB ( Nuclear factor kappa-light-chain-enhancer of activated B cell) yang merupakan factor transkripsi sejumlah gen penting dalam proses imunitas dan inflamasi.. Dengan menekan kerja NF-kB maka radikal bebas dari hasil sampingan inflamasi berkurang (Chattopadhyay et al., 2006).
(40) 28. Kandungan flavonoid dan tannin berperan penting pada penurunan jumlah eritema. Flavonoid memiliki daya antioksidan kuat dengan daya penangkap radikal bebas yang luas dan dapat mengahambat formasi radikal bebas. Flavonoid menangkap radikal bebas hidroksil dengan meregenerasi OH menjadi H2O. Sedangkan tannin memiliki peran untuk meningkatkan proses penyembuhan luka melalui beberapa mekanisme sel seperti peningkatan fibroblast, meningkatkan angiogenesis dan peningkatan kontraksi luka. Senyawa. alnuston. (arilheptaoid. non-fenol). memperlihatkan. aktivitas. antiinflamasi topical yang tinggi, sebanding dengan obat oksifenbutazon. arilheptaoid non-fenol memiliki efek protektif melaan toksisitas H2O2, menstimulus pertumbuhan sel, serta memiliki aktivitas antibakterial, antikoagulan, fibrilosis, mitogenik, dan juga antioksidan. Hal ini menyebabkan arilheptaoid non-fenol berperan dalam regenerasi jaringan dan penyembuhan luka. Secara in vivo arilheptaoid non-fenol yang diberikan secara langsung pada kulit yang terluka dapat meningkatkan sintesis EGF dan FGF (fibroblast growth factor) dan meningkatkan proliferasi sel yang mendukung proses penyembuhan luka (Achmad, 2008).. 3.2 Hipotesis Penelitian Pemberian ekstrak temulawak (Curcuma xanthorrhiza) secara topical berpengaruh terhadap penurunan nilai eritema luka pada model tikus putih galur wistar (Rattus novergicus) jantan dengan kondisi diabetes.
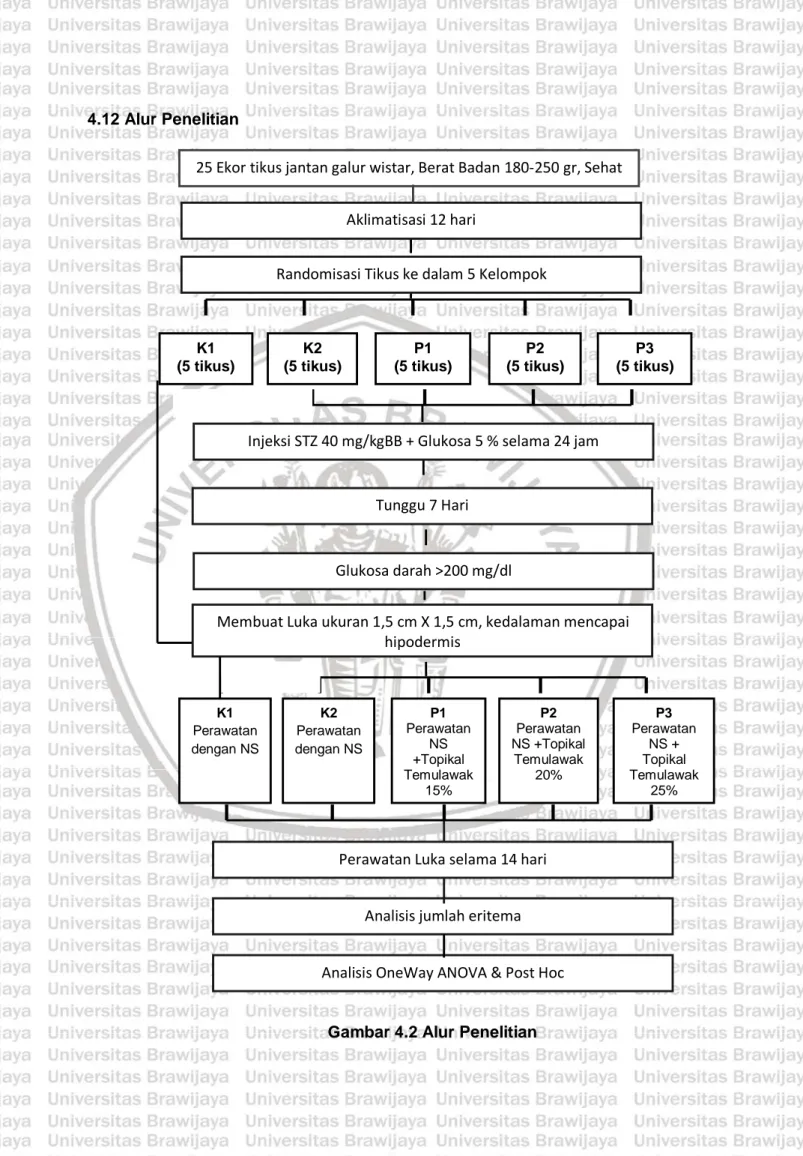
(41) BAB IV METODE PENELITIAN. 4.1. Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental murni (true experimental laboratory)dengan pengamatanpost-test only control group design (Nursalam, 2011) untuk mengetahui pengaruh terapi topikal menggunakan ekstrak temulawak (Curcuma xhantorrhiza) terhadap penurunan jumlah eritema pada luka tikus putih (Rattus novergicus) galur wistar model diabetes mellitus. Pada rancangan ini terdapat 3 kelompok perlakuan dan 2 kelompok kontrol meliputi Kelompok perlakuan 1 (P1), perlakuan 2 (P2) perlakuan 3 (P3), kontrol positif (+) dan kontrol negatif (-).. Tikus semua perlakuan. K(-). Kelompok normal dengan perawatan vaselin. K(+). Kelompok DM dengan perawatan vaselin. P1. Kelompok DM dengan perawatan salep Temulawak 15%. P2. Kelompok DM dengan perawatan salep Temulawak 20%. P3. Kelompok dengan perawatan salep Temulawak 25%. 4.2 Sampel Penelitian Sampel yang digunakan pada penelitian ini yaitu hewan coba tikus (Rattus novegicus) galur wistar jantan karena mempunyai persamaan filogenik dengan. 29.
(42) 30. manusia dan mempunyai sifat-sifat respons biologis yang mendekati manusia. Penelitian yang pernah dilakukan menggunakan Rattus novegicus adalah penelitian tentang hipertensi, diabetes insipidus, katarak, obesitas, diabetes mellitus, dan lain-lain (Sirois, 2005). Untuk menghindari faktor-faktor perancu yang dapat mempengaruhi proses penyembuhan luka, maka ditentukan kriteria inklusi untuk menghomogenkan sampel.. 4.2.1 Kriteria Sampel Penelitian Kriteria Inklusi 1. Jenis kelamin jantan, untuk menghindari kerancuan hasil penelitian dikarenakan pengaruh hormon estrogen dan progesterone yang dapat meningkatkan jumlah pembuluh darah pada penyembuhan luka dan mempercepat proses inflamasi. 2. Umur tikus 2,5 – 3 bulan (usia pertumbuhan) karena proliferasi sel pada usia pertumbuhan ini cepat sehingga mendukung penyembuhan luka 3. Berat badan antara 180-250 gram. 4. Kondisi sehat ditandai dengan pergerakan aktif, bulunya licin, mengkilat dan bersih, bulunya tebal dan tak ada kerontokan bulu yang berarti, badannya tegap tidak kerempeng, tidak keluar lendir, nanah, atau darah dari mata atau telinga, tidak terlalu banyak ludah, tidak mencret dan pernafasan tenang. 5. Tidak mendapat pengobatan sebelumnya. Kriteria Ekslusi 1. Tikus yang mengalami luka sebelum perlakuan. 2. Tikus yang mendapatkan pengobatan sebelum perlakuan..
(43) 31. 4.2.2 Besar Sampel Untuk menghitung jumlah tikus yang diperlukan sebagai hewan coba, dapat digunakan rumus sebagai berikut (Supranto, 2000): (t-1)(n-1) ≥ 15, dengan t = banyaknya kelompok perlakuan, n = jumlah sampel tiap perlakuan Jika di dalam penelitian ini diketahui perlakuan (t) = 5, yaitu, 2 kelompok kontrol dan 3 kelompok perlakuan sehingga didapat nilai n sebagai berikut: (5-1)(n-1) ≥ 15 n-1 ≥ 15/4 n ≥ 3,75+ 1 n ≥ 4,75 Jadi jumlah sampel untuk tiap kelompok perlakuan minimal 5 ekor tikus, sehingga jumlah total tikus yang dibutuhkan adalah 25 ekor tikus.. 4.3 Variabel Penelitian Variabel penelitian dibedakan menjadi variabel dependen (variabel tergantung) dan variabel independen (variabel bebas).. 4.3.1 Variabel Bebas (Variabel Independen) Variabel bebas dalam penelitian ini adalah temulawak topikal dengan konsentrasi 15%, 20% dan 25%. Setiap dilakukan perawatan luka, sebelumnya telah dibersihkan dengan normal saline..
(44) 32. 4.3.2 Variabel Tergantung (Variabel Dependen) Variabel tergantung pada penelitian ini adalah jumlah eritema dalam proses penyembuhan luka diabetes pada tikus (Rattus novergicus) galur wistar.. 4.4. Lokasi dan Waktu Penelitian Penelitian ini dilaksanakan di laboratorium Farmakologi Fakultas Kedokteran. Universitas Brawijaya Malang yang dilaksanakan pada bulan Mei-Juni 2016. Proses perlakuan berlangsung selama 14 hari. 4.5. Alat dan Bahan Penelitian. 4.5.1 Pembuatan Ekstrak dan Salep Temulawak 1.. Oven. 2.. Penggiling/blender. 3.. Timbangan/neraca analitik. 4.. Gelas erlenmeyer. 5.. Corong gelas. 6.. Kertas saring. 7.. Labu evaporator. 8.. Labu penampung etanol. 9.. Evaporator. 10. Pendingin spiral/rotary evaporator 11. Selang water pump 12. Water pump 13. Water bath 14. Vacum pump.
(45) 33. 15. Lemari pendingin/freezer 16. Pemanas air 17. Botol hasil ekstrak 18. Temulawak 19. Aquades 20. Etanol 96% 21. Vaselin. 4.5.2 Pembuatan Tikus Model Diabetes Mellitus 1. Sarung tangan 2. Spuit 1 cc 3. Alkohol 70% 4. Streptozotocin (40 mg/kgBB dalam pelarut buffer sitrat 0,1 M pH 4.5) 5. Larutan Glukosa 5% 6. Glukometer 7. Glukostick. 4.5.3 Pembuatan Luka Diabetes 1.. Gunting bedah. 2.. Mezt. 3.. Underpad. 4.. Sarung tangan. 5.. Pinset anatomis 2 buah. 6.. Kassa. 7.. Spuit.
(46) 34. 8.. Ketamine hydrocloride. 9.. Bak steril. 10. Alat cukur 11. Air Steril 12. Alkohol 70% 13. Bengkok 14. Penggaris 15. Alat Tulis. 4.5.4 Perawatan Luka 1.. Bak instrument. 2.. Sarung tangan steril. 3.. Kassa steril. 4.. Kassa bersih. 5.. Bengkok. 6.. Perlak. 7.. Hipafix. 8.. Pinset anatomis 2 buah. 9.. Normal saline. 10. Ekstrak temulawak konsentrasi 15%, 20% dan 25% 11. Gunting nekrotomi 12. Gunting 13. Kom steril 14. Spuit 1cc 15. Spuit 10cc.
(47) 35. 4.5.6 Pemeliharaan Tikus 1.. Kandang/bak tikus. 2.. Penutup kandang dari anyaman kawat. 3.. Botol air. 4.. Makanan tikus (katul). 5.. Sekam. 4.5.7 Teknik Pencegahan Infeksi. 4.6. 1.. Tempat cuci tangan/wastafel. 2.. Sabun cuci tangan. 3.. Hand Sanitizer. 4.. Kain handuk kecil. 5.. Sarung tangan bersih/steril. Definisi Operasional Tabel 4.1 Definisi Operasional Variabel. No Penelitian 1.. Hasil. Skala. Ukur. Ukur. -. -. Definisi Operasional. Ekstrak. Temulawak. yang. digunakan. yaitu. temulawak. Temulawak. dengan Jenis Curcuma xhantorrhiza. Temulawak ini diperoleh dari UPT Materia Medika Batu, Jawa Timur. Temulawak akan diekstrak sesuai dengan metode yang ada di Laboratorium Farmakologi FKUB, yaitu dengan cara temulawak yang kering kemudian dihaluskan. Setelah halus dicampur.
(48) 36. dengan pelarut etanol 96%. kemudian direndam. (maserasi) selama 4 hari. 2. Pembuatan. Tikus. dianastesi. ketamine. intraperitoneal. 25. Luka. mg/kgBB dengan posisi pronasi. Bulu daerah. Diabetes. punggung dicukur dengan ukuran 5x3 cm, lalu. Mellitus. dilakukan desinfeksi dengan alkohol 70%. Kemudian. -. -. dibuat ukuran luka dengan ukuran 1,5x1,5 cm kemudian eksisi bagian kulit dengan kedalaman epidermis hingga hypodermis.Klasifikasi luka yang dibuat adalah klasifikasi wagner skala 2 yaitu hingga jaringan subkutan (Li et al, 2011). 3. Nilai. rata-. Nilai rata-rata eritema dimulai dari hari ke-0 setelah. rata eritema. dinduksi ulkus diabetik yang digunakan sebagai. luka. ukuran. diabetik. kemudian diukur dan diamati pada hari ke-1, ke-7. luka. awal. sebelum. diberi. pixel. Ratio. perlakuan. dan ke-14 setelah luka dirawat dan diberi perlakuan. Luka difoto menggunakan kamera digital beresolusi 14 megapixel dengan pencahayaan yang sama dan jarak 10 cm dari area luka setelah luka dibersihkan. Kemudian diukur dengan corel photo-paint x6 4. Perawatan. Perawatan luka menggunakan terapi topikal ekstrak. luka. temulawak dengan konsentrasi 15%, 20%, dan 25%.. diabetes. Ekstrak temulawak di berikan secara topikal pada kelompok perlakuan. Sebelumnya luka dibersihkan dahulu dengan larutan Normal Saline dan ditutup dengan kassa steril, perawatan ulkus dilakukan setiap hari selama 14 hari.. -. -.
(49) 37. 4.7. Prosedur Penelitian. 4.7.1 Cara Membuat Ekstrak Temulawak Metode yang digunakan untuk pembuatan ekstrak temulawak ini adalah metode maserasi. Metode ini merupakan salah satu cara untuk memisahkan campuran padat-cair. Ekstraksi temulawak diproses melalui pemisahan senyawasenyawa dari campuran bahan-bahan lain dengan menggunakan pelarut etanol 96% yang larut dengan air dan dibuat dengan evaporator. Pembuatan ekstrak temulawak mengikuti standar pembuatan ekstrak di Laboratorium Farmakologi Fakultas Kedokteran Universitas Brawijaya Malang, meliputi : 1. Tahap pengeringan a. Temulawak yang akan dikeringkan dicuci bersih. b. Temulawak dipotong menjadi bagian-bagian yang lebih kecil dan dan dimasukkan ke dalam oven dengan suhu 80° C atau dengan panas matahari sampai kering (bebas kandungan air). 2. Tahap Ekstraksi a. Setelah kering, menghaluskan dengan blender sampai halus. b. Menimbang sebanyak 300 gram (sampel kering). c. Memasukkan 300 gram sampel kering ke dalam gelas erlenmeyer ukuran ± 1 liter. d. Merendam dengan etanol 96% sampai volume menjadi 1 liter. e. Mengocok sampai benar-benar tercampur (± 30 menit). f.. Diamkan 3-4 malam sampai benar-benar mengendap.. 3. Tahap Evaporasi.
(50) 38. a. Mengambil lapisan atas campuran etanol (pelarut) dengan zat aktif yang sudah tercampur (bisa dengan cara penyaringan menggunakan kertas saring). b. Masukkan dalam labu evaporasi ukuran satu liter. c. Isi water bath dengan air sampai penuh. d. Pasang semua rangkaian alat, termasuk rotary evaporator, pemanas water bath (atur sampai 70° C atau sesuai dengan titik didih pelarut), sambungkan dengan aliran listrik. e. Biarkan larutan etanol memisah dengan zat aktif yang sudah ada dalam labu evaporasi. f.. Tunggu sampai aliran etanol berhenti menetes pada labu penampung (± 1,5 sampai 2 jam untuk satu labu) ± 900 mL.. g. Hasil yang diperoleh kira-kira 1/4 dari jumlah temulawak. h. Masukkan hasil ekstraksi ke dalam botol plastik/kaca. i.. Ekstrak disimpan di dalam lemari pendingin/freezer untuk dipakai saat penelitian.. 4.7.2 Pembuatan Salep Temulawak Formula standar dasar salep menurut Goeswin Agoes (2006) ialah: - R/ Adeps lanae. 15 g. - Vaselin album. 85 g. - m.f. salep. 100 g. Adapun pembagian formulanya adalah sebagai berikut : 1.10. Formula I, konsentrasi 15% v/b : Ekstrak temulawak sebanyak 0,75. ml + vaselin 5 gram.
(51) 39. 2.10. Formula II, konsentrasi 20% v/b : Ekstrak temulawaksebanyak 1 ml. + vaselin 5 gram 3.10. Formula III, konsentrasi 25% v/b Ekstrak temulawaksebanyak 1,25. ml +vaselin 5 gram. 4.7.3 Pembuatan Tikus Model Diabetes Mellitus Tikus diinduksi DM dengan injeksi Streptozotocin (STZ) intraperitonial single dose 40 mg/kgBB dalam pelarut buffer sitrat 0,1 M pH 4.5 setelah sebelumnya dipuasakan selama 12 jam. Setelah itu tikus diberikan larutan glukosa 5 % selama 24 jam untuk menghindari kematian akibat hipoglikemia. Tujuh hari setelah injeksi STZ, glukosa darah diukur melalui vena ekor dengan menggunakan glukometer dan tikus dengan glukosa darah diatas 200 mg/dL dinyatakan sebagai diabetes (Mekala et al, 2014; Nagmoti, 2015). 4.7.4 Pembuatan Luka pada Tikus Model Diabetes Mellitus 1.. Lakukan cek kadar gula darah sebelum dilakukan pembuatan luka. Dilakukan pembuatan luka jika kadar gula darah puasa mencapai >200 mg/dL diukur dengan glukometer.. 2.. Anastesi umum pada hewan coba dengan Ketamine hydrochloride 25 mg/kgBB secara intraperitoneal. 3.. Masukkan hewan coba pada kandang dan tunggu selama 5 menit hingga hewan coba hilang kesadaran. 4.. Lakukan pencukuran dengan menggunakan Mesh pada bagian punngung hewan coba dengan ukuran 5x3 cm.. 5.. Tandai daerah yang akan dibuat luka dengan ukuran 1,5x1,5 cm.
(52) 40. 6.. Kemudian desinfeksi menggunakan alkohol 70% dibagian yang akan dilukai. 7.. Cubit bagian kulit dengan pinset kemudian eksisi bagian kulitdengan kedalaman epidermis hingga hipodermis, yang sudah ditandai menggunakan gunting bedah. 8.. Setelah luka dibuat lakukan perawatan luka dengan prosedur yang telah ditentukan. 9.. Masukkan tikus kedalam kandang dan biarkan kesadarannya kembali.. 4.7.5 Perawatan luka Perawatan luka dilakukan satu kali sehari. Luka pada semua kelompok dibersihkan terlebih dahulu dengan normal saline lalu diberikan perlakukan sebagai berikut 1. Kelompok kontrol negatif luka tikus sehat dirawat dengan olesan vaselin. 2. Kelompok kontrol positif luka tikus diabetes dirawat dengan olesan vaselin. 3. Kelompok P1 luka tikus diabetes dirawat dengan terapi topikal ekstrak temulawak dengan konsentrasi 15% 4. Kelompok P2 luka tikus diabetes dirawat dengan terapi topikal ekstrak temulawak dengan konsentrasi 20% 5. Kelompok P3 luka tikus diabetes dirawat dengan terapi topikal ekstrak temulawak dengan konsentrasi 25% Prosedur perawatan ulkus:.
(53) 41. a) Sebelum memulai melakukan perawatan luka, tangan dicuci hingga bersih. b) Perlak yang dilapisi kain ditempatkan dibawah luka yang akan dirawat. c) Tikus diposisikan sehingga memudahkan pelaksanaan tindakan. d) Bengkok ditempatkan dekat dengan luka yang akan dirawat. e) Masker dan sarung tangan steril dipakai. f) Ukuran kassa disiapkan sesuai besarnya luka g) Luka. dibersihkan. dengan. cara. mengirigasi. daerah. ulkus. menggunakan normal saline. h) Daerah luka yang telah di irigasi dikeringkan dengan kassa (kassa steril). i). Pada kelompok control negatif dan positif diberi olesan vaselin, sedangkan pada kelompok perlakuan 1 diberikan olesan temulawak 15%, kelompok perlakuan 2 diberikan olesan temulawak 20% dan kelompok perlakuan 3 diberikan olesan temulawak 25%.. j). Kassa steril ukuran 2x3 cm yang telah dibasahi dengan normal saline ditempelkan pada area luka.. k) Hipafix ditempelkan untuk mempertahankan balutan primer. l). Luka dibalut dengan kassa gulung ukuran 6x50 cm. Bentuk balutan seperti gurita bayi..
(54) 42. 4.8. Prosedur Pengumpulan Data. 4.8.1 Metode Pengumpulan Data Peneliti langsung mengamati hasil penelitian secara berulang. Pengumpulan data dilakukan sekali setiap hari pada hari ke-1 sampai hari ke-14 pada saat perawatan luka di Laboratorium Farmako FKUB. 4.8.2 Teknik Pengumpulan Data Penelitian ini menggunakan teknik observasi eksperimen, dimana sampel dibagi menjadi 3 kelompok perlakuan dan 2 kelompok kontrol. Peraatan luka dilakukan pada masing-masing sampel setiap hari hingga hari ke-14. Penilaian terhadap penurunan eritema dilakukan dengan mengambil nilai eritema pada 4 titik ujung ulkus diabetik yang dibentuk segiempat kemudian diambil nilai mean rataratanya. Keseluruhan proses perhitugan nilai rata-rata eritema menggunakan program corel photo paint suite graphic x6. 4.8.3 Cara Pengambilan Gambar 1. Siapkan kamera digital 2. Pengambilan foto dilakukan dengan pencahayaan yang sama 3. Nyalakan kamera dengan cara menekan tombol on pada kamera 4. Atur kamera 5. Ambil jarak 10 cm antara tikus dan kamera kemudian fokuskan 6. Ambil foto tikus 7. Matikan kamera.
(55) 43. 4.9 4.9.1. Analisis Statistik Uji Normalitas dan Homogenitas Dari hasil perhitungan nilai rata-rata eritema ulkus diabetik masing-masing sampel setiap perlakuan, dilakukan uji asumsi statistik SPSS statistic for windows dengan cara uji normalitas dan uji homogenitas. Uji normalitas menggunakan statistic uji Shapiro-Wilk dengan a = 0,05, karena jumlah sampel kurang dari 30. Jika data menunjukkan p value > 0,05, maka data homogenity normal. Kemudian pada uji homogenitas data menggunakan uji Lavane Statistic dengan a = 0,05, jika pada tabel test of homogenity of varience menunjukkan nilai signifikansi p value > 0,05, maka data adalah homogen dan memiliki varian sama, sehingga dapat dilakukan uji parametrik lebih lanjut menggunakan one way ANOVA (Dahlan, 2009).. 4.9.2. Uji Antar Kelompok Data hasil penelitian kemudian dianalisa dengan uji statistik one way ANOVA untuk mengetahui perbedaan antar kelompok uji coba. Jika diperoleh nilai signifikansi p value < a (0,05), maka terdapat perbedaan yang signifikan terhadap proses terjadinya eritema ulkus diabetik pada hari ke-1 sampai hari ke-14 (Dahlan, 2009). 4.9.3. Uji Perbandigan Berganda Setelah hasil penelitian dianalisa dengan One way ANOVA kemudian dianalisa dengan Post Hoc Test untuk mengetahui kelompok perlakuan mana yang paling signifikan di antara kelompok-kelompok uji coba. Nilai.
(56) 44. signifikansi antar kelompok yang paling bermakna adalah yang memiliki nilai signifikansi paling kecil dengan nilai p value < a (0,05) (Dahlan, 2009).. 4.10. Justifikasi Etik Penelitian ini menggunakan hewan coba sebagai sampel sehingga. peneliti akan menerapkan prinsip 3R dalam penelitiannya yaitu Replacement, Reduction dan Refinement . 1. Replacement, adalah keperluan memanfaatkan hewan percobaan sudah diperhitungkan dengan seksama, baik dari literature maupun pengalaman terdahulu untuk menjawab pertanyaan penelitian dan tidak dapat digantikan oleh sel atau biakan jaringan (Ridwan, 2013). 2. Reduction, adalah pemanfaatan hewan dalam penelitian sesedikit mungkin, tetapi tetap mendapatkan hasil yang optimal. Pengurangan jumlah penggunaan hewan coba dilakukan sampai pada batas jumlah yang masih dapat dianalisis secara statistik. Dalam penelitian ini jumlah sampel dihitung berdasarkan rumus yaitu (t-1) (r-1) ≥ 15, dengan r adalah banyak sample pada setiap kelompok dan t adalah banyak perlakuan. Pada penelitian ini dibutuhkan jumlah sampel minimal sebanyak 5 ekor tikus tiap kelompok dengan total 25 ekor tikus yang dibutuhkan 3. Refinement, adalah memperlakukan hewan percobaan secara manusiawi, dengan prinsip dasar membebaskan hewan coba dalam beberapa kondisi (Ridwan, 2013). a. Bebas dari rasa lapar dan haus, pada penelitian ini hewan coba diberikan pakan standar dan minum secara ad libitum(semaunya)..
(57) 45. b. Bebas dari ketidak-nyamanan, pada penelitian hewan coba ditempatkan di animal house dengan suhu terjaga 20-25°C, kemudian hewan coba terbagi menjadi 1 ekor tiap kandang. Animal house berada jauh dari gangguan bising dan aktivitas manusia serta dijaga kebersihannya. c. Bebas dari nyeri dan penyakit dengan menjalankan program kesehatan, pencegahan, dan pemantauan, serta pengobatan terhadap hewan percobaan jika diperlukan. d. Bebas dari stres, dengan memberikan waktu adaptasi selama 7 hari sebelum dilakukan perlakuan. Prosedur pemeliharaan, perlakuan dan pengambilan data selama penelitian mempertimbangkan tindakan manusiawi dan pada akhir penelitian akan dilakukan tindakan injeksi ketamine 25 mg/kgBB sebelum dilakukan tindakan dislokasi servikal untuk menewaskan hewan coba. Kemudian, tubuh kadaver tikus dibersihkan dan dilakukan tindakan aseptik dengan pemberian alcohol 70% kemudian diautoklaf. Setelah itu tikus dikubur dengan baik. Sedangkan 5F yaitu: 1.. Freedom from hunger andthirst (bebas dari rasa lapar dan haus). Tikus diberi makan 1x sehari dengan makanan dan minuman yang diberikan secara da libitum. Makanan tikus terdiri dari jagung, katul, pollard, DDGS, rape seed, copra meal, biji batu, CPO, vitamin, dan mineral dicampur dengan tepung terigu dengan perbandingan 2:1 dan dibentuk bulatan dengan masing-masing tikus mendapat 80 gram makanan. Air.
(58) 46. minum diberikan secara ad libitum. Pakan dan minum diberikan dengan jumlah dan waktu yang sama secara adil. 2. Freedom. from. discomfort. (bebas. dari. ketidaknyamanan).. Rasa tidak nyaman karena ditempatkan di dalam kandang diatasi dengan membersihkan kandang dengan mengganti sekam setiap hari sekali agar tetap kering dan lembab. 3. Freedom from pain, injury, and disease (bebas dari rasa sakit, trauma, dan penyakit). Rasa sakit pada hewan coba karena diberikan perlakuan luka insisi setelah induksi DM untuk mengatasinya dilakukan pemberian anestesi sebelum prosedur berupa obat Ketamine25 mg/kg intraperitoneal, disinfeksi area pada tikus yang akan dibuat luka insisi dan penggunaan alat yang sudah di sterilisasi untuk mencegah kemungkinan infeksi. Rasa sakit yang dirasakan pada saat pengambilan darah untuk pemeriksaan kadar gula darah pada tikus diminimalisir dengan cara pengambilan darah dilakukan di ekor tikus. Infeksi karena pembuatan luka diminimalisir dengan cara sebelum dilakukan prosedur tikus dianastesi, kemudian tempat injeksi di bersihkan dengan povidone iodine, dan setelah dibuatkan luka, luka tersebut di bersihkan dengan normal saline dan ditutup dengan kasa steril. Saat dilakukan terminasi (sacrified) tikus dieutanasia dengan klorofom. Sebelum dilakukan pembedahan tikus dipastikan benar-benar mati dengan tanda tidak bernafas, tidak ada denyut jantung, dan tidak ada reflek palpebral dan kornea.Setelah dilakukan pembedahan, tubuh tikus dibersihkan dan dilakukan tindakan aseptik dengan alkohol 70% kemudian dan dikubur dengan baik. Pada tikus yang mengalami infeksi atau luka melebar karena tergigit atau terkena benda lainnya, tetap diberikan.
(59) 47. makanan dan minuman standar tikus dan dilakukan perawatan luka menggunakan normal salin serta dibalut dengan teknik steril. Pada tikus dengan luka yang terinfeksi, selain diberikan balutan steril juga diberikan antibiotik topikal. Perawatan dilakukan hingga waktu terminasi yaitu hari ke-15 bersama dengan kelompok yang masih termasuk di dalam penelitian. 4. Freedom from fear and distress (bebas dari ketakutan dan stress jangka panjang). Stress yang dirasakan tikus diminimalisasi dengan cara tikus diaklimatisasi selama 7 hari untuk menyesuaikan dengan kondisi lingkungan baru dan ditempatkan dalam kandang dengan masing-masing kandang berisi 1 tikus. Kandang berbentuk balok berukuran 45 cm x 35,5 cm x 14,5 cm dengan bagian atas terbuka dan ditutup dengan jaring kawat berbentuk kotak. Ventilasi ruangan cukup dengan suhu sekitar 35-38oC (sedang). 5. Freedom to express natural behavior (bebas mengekspresikan tingkah laku alami). Tikus diaklimatisasi selama 7 hari untuk menyesuaikan dengan kondisi lingkungan baru. Kandang berbentuk balok berukuran 45 cm x 35,5 cm x 14,5 cm dengan bagian atas terbuka dan ditutup dengan jaring kawat berbentuk kotak. Ventilasi ruangan cukup dengan suhu sekitar 35-38oC (sedang). Kandang dijaga agar selalu dalam keadaan bersih dan tidak lembab dengan mengganti sekam setiap 3 hari sekali..
(60) 48. 4.11 Alur Kerja Studi Pendahuluan. Tikus galur wistar jantan usia 2-3 bulan dengan BB180-250 gr. A (1 Tikus). B (1 Tikus). C (1 Tikus). D (1 Tikus). E (1 Tikus). Aklimatisasi 7 hari Induksi STZ 40 mg/kgBB. Pemberian glukosa 5% post injeksi STZ selama 24 jam. cek gula darah 2 hari satu kali. ditunggu 7 hari. gula darah >200 mg/dl pembuatan luka. A Tikus Sehat, NS. B Tikus Diabetes. C Tikus Diabetes + NS + Topikal 15%. D Tikus Diabetes + NS+ Topikal 20%. Perawatan luka selama 14 hari. Cek ukuran Luka Hasil dosis STZ dan konsentrasi ekstrak topikal yang tepat. Gambar 4.1 Alur Studi Pendahuluan. E Tikus Diabetes + NS + Topikal 25%.
Gambar



Garis besar
Dokumen terkait
Bilamana Watt memandang naskh dalam al-Qur‟an dalam sudut pandang sosiologis yang berarti bahwa adanya wahyu yang turun yang berubah dibandingkan wahyu sebelumnya dikarenakan
Dari hasil pengambilan data yang telah diperoleh, data tersebut akan digunakan sebagai acuan untuk menentukan berapa banyak orang yang dapat disuplay air bersih dan
19) Life is like an onion.. Hidup itu seperti sebuah bawang. Pada kalimat terbsebut, kata life dibandingkan dengan onion, karena hidup dalam hal ini life adalah hal yang
Pada tahap ini hasil dari ekstraksi ciri akan masuk ke Singular value decomposition yang akan mereduksi data yang kurang penting dan nantinya akan mengambil ciri penting yang
Tako se ističe da «kada se čovjek bavi različitim znanostima, kao što su filozofija, pov- ijest, matematika, prirodne znanosti i kad njeguje umjetnost, može vrlo mnogo pridonijeti
Penelitian skripsi dengan judul “Analisis Pengaruh Kontrak Psikologis dan Leader Member Exchange terhadap Kinerja Karyawan dengan Kepuasan Kerja sebagai Variabel Intervening
Teknik SEFT dapat membantu melatih narapidana memahami dan menerima keadaan diri mereka sendiri, selain itu dapat melatih narapidana untuk menyadari sisi negatif
Seluruh rekan dan pihak yang tidak dapat kami sebutkan satu-persatu, yang turut membantu dalam penyusunan skripsi ini secara langsung maupun tidak langsung.. Penulis telah