`7 BAB II
TINJAUAN PUSTAKA
2.1 Silika Gel
Silika gel adalah salah satu contoh produk sintesis pada proses sol-gel dengan prekusor silikon alkoksida atau larutan silikat. Silika gel umumnya dibuat dengan cara presipitasi larutan silikat dan sol silikat. Proses pembuatan silika gel dari natrium silikat dan asam klorida telah dilakukan oleh Patrick (Yateman, 2009).
Rumus kimia silika gel adalah SiO2.xH2O. Struktur satuan mineral silika
pada dasarnya mengandung Si4+ yang terkoordinasi secara tetrahedral dengan O2-. Namun susunan tetrahedral SiO4 pada silika gel tidak beraturan mengakibatkan
gugus-gugus OH- yang terikat pada permukaan Si tidak sama sehingga daya
adsorptifitasnya juga berbeda (Oscik, 1982). Silika gel merupakan silika amorf yang tersusun dari tetrahedral SiO4 yang tersusun secara tidak beraturan dan
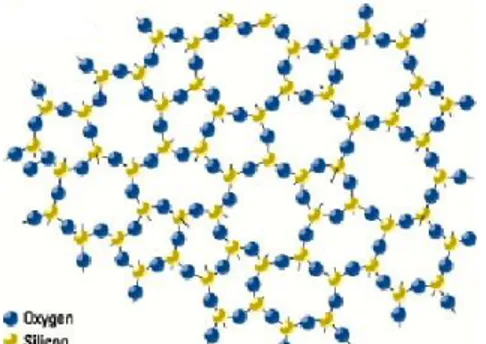
beragregasi membentuk kerangka tiga dimensi yang terbentuk karena kondensasi asam orthosilikat. Struktur satuan mineral silika pada dasarnya mengandung kation Si4+ yang terkoordinasi secara tetrahedral dengan anion O2- (Nuryono dan Eko, 2009). Struktur kimia silika gel secara umum dapat dimodelkan dalam Gambar 2.1 dan Gambar 2.2.
Gambar 2.1 Model Stuktur Amorf Silika (Brinker dan Scherer, 1990)
Menurut Osman, 2004 silika gel umumnya digunakan sebagai adsorben dalam pemisahan maupun prekosentrasi karena silika gel mempunyai beberapa keuntungan diantaranya adalah bersifat inert, mempunyai sifat adsorpsi dan pertukaran kation yang baik, mudah dipreparasi dengan senyawa kimia atau dengan media impregnasi tertentu sehingga menghasilkan bermacam-macam modifikasi permukaan silika, mempunyai kestabilan mekanik dan termal yang tinggi, bisa digunakan untuk pemisahan atau prekosentrasi karena proses penahanan atau pengikat analit (adsorpsi, pembentukan kompleks, pertukaran kation) dalam permukaan silika yang bersifat bolak-balik (reversible).
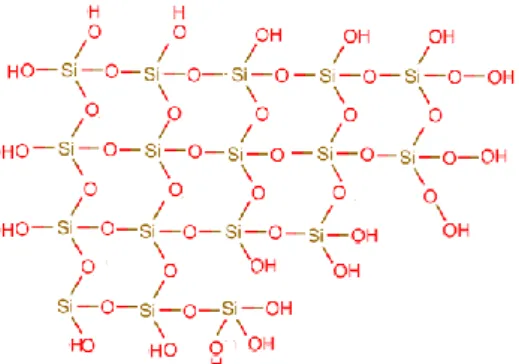
Adapun bentuk dasar dari struktur silika gel dapat dilihat pada Gambar 2.3.
Gambar 2.3 Struktur Dasar Silika Gel (Kaim dan Schwederski, 1994)
Matriks dari partikel silika gel adalah inti yang terdiri dari atom silikon yang terikat bersama atom silikon lain oleh adanya atom oksigen dengan ikatan
Gambar 2.2 Penataan SiO4 Tetrahedral Pada Silika Gel
siloksan (Si-O-Si) dan gugus silanol (Si-OH) inilah yang memberikan sifat polar pada silika gel dan merupakan sisi aktif dari silika gel (Nuryono dan Eko, 2009). Kemampuan adsorpsi silika gel dipengaruhi oleh adanya situs aktif pada permukaannya yakni berupa gugus silanol (Si-OH) dan gugus siloksan (Si-O-Si). Ketidakteraturan susunan permukaan tetrahedral SiO4 pada silika gel
menyebabkan jumlah distribusi satuan luas bukan menjadi ukuran kemampuan adsorpsi silika gel walaupun gugus silanol dan siloksan terdapat pada permukaan silika gel. Kemampuan adsorpsi silika gel tidak tergantung pada jumlah silanol dan siloksan yang ada pada permukaan silika gel, namum tergantung pada distribusi OH- per satuan luas adsorben (Oscik, 1982).
2.2 Logam Kromium
Kromium atau dikenal dengan logam Cr merupakan salah satu logam mineral yang keberadaannya terkandung dalam lapisan bumi. Kromium adalah elemen yang secara alamiah ditemukan dalam konsentrasi yang rendah di batuan, hewan, tanaman, tanah, debu vulkanik dan juga gas. Logam Cr sering ditemukan dalam bentuk persenyawaan padat/mineral dengan unsur-unsur yang lain. Kata kromium berasal dari kata Yunani “Chroma” yang berarti warna. Kromium ditemukan pertama kali oleh Vagueline pada tahun 1797. Kromium merupakan logam transisi yang mempunyai konfigurasi elektron [Ar] 4s13d5 (Manahan, 1992), kromium memiliki nomor atom 24 dan massa atom relatif 51,996 gram/mol, titik didih 2665oC, titik leleh 1875oC, jari-jari atom 128 pm (Sugiyarto, 2003). Kelimpahan kromium di kerak bumi 0,033% dengan beberapa isotop : 52Cr
dengan berat jenis 7,19 g/mL serta panas laten penguapannya 1474 kal/kg (Vogel, 1985). Logam ini memiliki tingkat oksidasi +2 sampai +6, namun yang sering dijumpai adalah tingkat oksidasi +3 dan +6 (Manahan, 1992). Kromium tidak larut dalam air dan asam nitrat, tetapi larut dalam asam sulfat encer dan asam klorida. Kromium juga tidak dapat bercampur dengan basa, halogen, peroksida, dan logam. Kromium harus dihindarkan dari panas api, percikan api dan sumber-sumber yang dapat menyebabkan kebakaran (Vogel, 1985).
Dalam larutan asam kuat dikromat yang merupakan oksidator akan direduksi menjadi kromium Cr(III) yang berwarna hijau. Reaksinya sebagai berikut (Sugiyarto, 2003):
Cr2O72- + 14H+ + 6e 2Cr 3+ + 7H2O ...(2.1)
Hijau
Cara mendapatkan logam kromium adalah dengan menginteraksikan logam Al ke dalam larutan Cr2O3 kemudian dipanaskan dan diagitasi, logam
kromium yang diperoleh melalui cara ini sekitar 94% (Khopkar, 1990):
Cr2O3 + Al(s) → Al2O3 + 2Cr(s) ……..………..………..(2.2)
Kromium banyak digunakan secara luas dalam penyepuhan, penyamakan kulit, pelapis kromat dan pelapis logam (Malkoc, 2007). Kromium mempunyai sifat tidak mudah teroksidasi oleh udara, karena itu banyak digunakan sebagai pelapis logam, pengisi stainless stell, lapisan perlindungan untuk mesin-mesin otomotif dan alat perlengkapan tertentu (Sax, 1987). Asam kromat di laboratorium digunakan sebagai oksidator, mencuci perabotan laboratorium, dan sebagai katalis. Na2Cr2O7 dalam jumlah banyak digunakan dalam penyamakan kulit
Isotop Kromium (Palar, 1994). Asam kromat dalam industri digunakan sebagai bahan untuk kaca berwarna, pembersih logam, bahan untuk tinta, dan cat.
Ion Cr(VI) merupakan bentuk logam Cr yang paling banyak dipelajari sifat racunnya. Sifat racun yang dibawa oleh logam ini dapat mengakibatkan terjadinya keracunan kronis, akut dan dapat menyebabkan kanker (Palar, 1994). Kromium(VI) dalam sistem perairan lebih berbahaya dan beracun dari pada kromium(III), hal ini disebabkan karena kromium(VI) mempunyai kelarutan dan mobilitasnya sangat tinggi, sedangkan kromium(III) tidak larut dan mempunyai mobilitas yang rendah. Kromium(VI) dalam sistem biologis sangat aktif larut dan beracun karena dapat berdifusi sebagai anion kromat CrO42- yang menembus
membran sel yang bermuatan negatif dan menyebabkan oksidasi (Thownshend 1995, dalam Ningsih, 2006).
Kromium(VI) merupakan turunan dari CrO3, dapat dijumpai dalam dua
macam senyawa yang sangat terkenal yaitu kromat-kuning CrO42-, dengan
struktur tetrahedral, larutan ini dapat terbentuk dalam larutan basa diatas pH 6, dan dikromat merah-orange Cr2O72-, dengan struktur dua tetrahedron yang
bersekutu dalam salah satu titik sudutnya (atom O), larutan ini berada dalam kesetimbangan, pada larutan asam antara pH 1 terbentuk HCrO4- (Cotton 1989:
456, Sugiyarto, 2003: 222).
Spesies utama akuatik Cr(VI) adalah HCrO4-, CrO42-, dan Cr2O72-. Pada
pH lebih besar dari 6,5 kadar kromat (CrO42-) lebih dominan sedangkan HCrO4
-mendominasi pada rentang pH lebih kecil dari 6,5. Pembentukan dikromat (Cr2O72-) berlangsung pada kondisi asam dengan adanya konsentrasi Cr(VI) yang
2.3 Adsorpsi
Adsorpsi didefinisikan sebagai suatu proses kinetika yang terjadi antara partikel gas atau cairan yang menempel pada permukaan zat padat dan akhirnya membentuk suatu lapisan tipis (film) pada permukaan zat padat. Berbeda dengan absorpsi, dimana fluida terserap oleh fluida lainnya dengan membentuk suatu larutan (Alberty dan Cornowel, 1992).
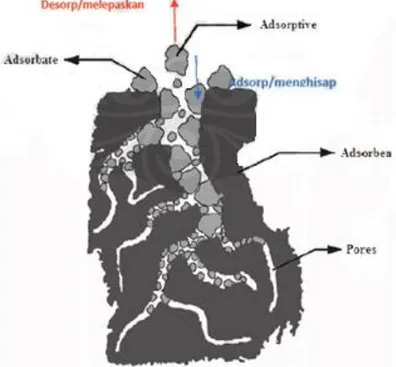
Untuk mengetahui karakteristik yang terjadi dalam proses adsorpsi dapat diilustrasikan dengan Gambar 2.4, padatan berpori (pores) yang menghisap (adsorp) dan melepaskan (desorp) suatu fluida disebut adsorben. Molekul fluida yang dihisap tetapi tidak terakumulasi/melekat kepermukaan adsorben disebut
adsorptive, sedangkan yang terakumulasi/melekat disebut adsorbat (Gupta, 2006).
Melekatnya zat cair atau gas pada permukaan adsorben terjadi secara fisika ataupun kimia (Gupta, 2006). Gaya yang terjadi dalam proses adsorpsi pada permukaan zat padat disebabkan gaya tarik menarik Van Der Waals, pembentukan
ikatan hidrogen, pertukaran ion, dan pembentukan ikatan kovalen. Semakin kuat ikatannya, maka zat yang teradsorpsi (adsorbat) tidak mudah lepas dari adsorbennya. Jumlah maksimum adsorbat yang dapat teradsorpsi pada permukaan adsorben tiap gramnya disebut dengan kapasitas adsorpsi (Khan, 1980).
Adsorpsi larutan oleh zat padat pada umumnya berdasarkan sifat polar dan non polar dari zat padat dan komponen larutan. Adsorben yang polar lebih cenderung mengadsorpsi lebih kuat zat terlarut yang polar (Ansari, 2005). Menurut Bernasconi (1995) proses adsorpsi dipengaruhi oleh beberapa faktor, antara lain :
1. Konsentrasi
Proses adsorpsi sangat sesuai untuk memisahkan bahan dengan konsentrasi yang rendah dari campuran yang mengandung bahan lain dengan konsentrasi tinggi.
2. Luas Permukaan
Proses adsorpsi tergantung pada banyaknya tumbukan yang terjadi antara partikel-partikel adsorbat dan adsorben. Tumbukan efektif antara partikel itu akan meningkat dengan meningkatkanya luas permukaan. Jadi, semakin luas permukaan adsorben maka adsorpsi akan semakin besar.
3. Suhu
Adsorpsi akan lebih cepat berlangsung pada suhu rendah. Namun demikian pengaruh suhu adsorpsi zat cair tidak sebesar pada adsorpsi gas.
4. Ukuran partikel
Semakin kecil ukuran partikel yang diadsorpsi maka proses adsorpsinya akan berlangsung lebih cepat.
5. pH
pH mempunyai pengaruh dalam proses adsorpsi. pH optimum dari suatu proses adsorpsi ditetapkan melalui uji laboratorium.
6. Waktu kontak
Waktu untuk mencapai keadaan setimbang pada proses serapan logam oleh adsorben berkisar antara beberapa menit hingga beberapa jam.
Menurut Oscik (1982) adsorpsi dibedakan menjadi dua jenis, yaitu adsorpsi fisika (physisorption) yang disebabkan oleh gaya Van Der Waals yang ada pada permukaan adsorben dan adsorpsi kimia (chemisorption) yang disebabkan karena terjadi reaksi antara zat yang diserap dengan adsorben.
Adsorpsi fisika, adalah adsorpsi yang disebabkan oleh gaya Van Der Waals yang ada pada permukaan adsorben, panas adsorpsinya rendah dan lapisan terjadi pada permukaan adsorben biasanya lebih dari satu molekul (multilayer). Energi adsorpsi yang terlibat berkisar beberapa ratus sampai beberapa ribu kal/mol. Oleh karena itu ikatannya tidak terlalu kuat sehingga molekul yang teradsorpsi relatif lebih mudah dilpaskan dari adsorben. Bila nilai ΔG adsorpsi < 20,92 KJ/mol maka adsorpsi dikategorikan sebagai adsorpsi fisik (Osipow, 1962). Adsorpsi kimia, adalah adsorpsi yang terjadi karena adanya reaksi antara zat yang diserap dengan adsorben, panas adsorpsinya tinggi, lapisan molekul pada permukaan adsorben hanya satu lapis (monolayer). Adsorpsi kimia cenderung melibatkan ikatan kovalen sebagai hasil penggunaan elektron bersama oleh adsorbat dan adsorben. Energi adsorpsi yang terlibat sangat kuat dan sebanding dengan pembentukan senyawa kimia, biasanya 100 kkal/mol, sehingga sulit untuk
diputuskan. Bila nilai ΔG adsorpsi > 20,92 KJ/mol maka adsorpsi dikategorikan sebagai adsorpsi kimia (Van-Olphen, 1977).
Molekul-molekul di permukaan zat padat atau zat cair mempunyai gaya tarik ke arah dalam karena tidak ada yang mengimbanginya, gaya-gaya ini menyebabkan zat padat atau zat cair mempunyai daya adsorpsi. Adsorpsi menurunkan ketidakseimbangan gaya tarik yang terjadi di permukaan (Alberty dan Cornowel, 1992). Teradsorpsinya zat terlarut pada permukaan zat padat dapat disebabkan oleh gaya tarik antar molekul zat terlarut dengan zat padat. Daya tarik yang paling kuat terjadi pada pelapisan monolayer zat terlarut yang langsung kontak dengan permukaan zat padat. Gaya tarik terhadap lapisan monolayer berikutnya akan semakin berkurang karena terhalang oleh lapisan monolayer tadi, serta akibat bertambahnya jarak antara lapisan monolayer zat terlarut dengan permukaan zat padat (Sukardjo, 1985).
2.4 Isoterm Adsorpsi
Isoterm adsorpsi adalah hubungan kesetimbangan antara konsentrasi dalam fase fluida dan konsentrasi di dalam partikel adsorben pada suhu tertentu. Untuk zat cair, konsentrasi biasanya dinyatakan dalam satuan massa, seperti bagian per juta (ppm). Konsentrasi adsorbat pada zat padat dinyatakan sebagai massa yang teradsorpsi per satuan massa adsorben semula (McCabe et al., 1989). Kesetimbangan adsorpsi terjadi apabila jumlah antara adsorbat yang diserap oleh adsorben (pada fasa permukaan) dengan adsorbat yang tersisa dalam larutan (pada fasa ruah) relatif tetap terhadap waktu pengocokan (Herawati, dkk, 2009).
Isoterm adsorpsi digunakan untuk karakterisasi dari persamaan antara jumlah adsorbat yang terakumulasi dalam adsorben dan konsentrasi larutan adsorbat. Isoterm adsorpsi Langmuir dan Isoterm adsorpsi Freundlich adalah dua persamaan isoterm yang sering dipakai (Rousseaus, 1987).
Dalam menetapkan korelasi yang paling sesuai untuk data keseimbangan didalam rancangan sistem adsorpsi, terdapat dua model isoterm yang digunakan yaitu Langmuir dan Freundlich. Aplikasi persamaan isoterm dibandingkan dengan nilai koefisien regresi linier yaitu R2(Hameed dan R. Krishni, 2009).
2.4.1 Isoterm Adsorpsi Langmuir
Menurut Adamson (1990) Isoterm adsorpsi diasumsikan sebagai proses adsorpsi yang terjadi pada permukaan dengan sisi adsorpsi dan energi yang sama, dengan satu molekul yang terserap persisi adsorpsi sampai menutup satu lapisan permukaan biomassa. Model adsorpsi Langmuir memperkirakan kapasitas adsorpsi maksimum pada seluruh permukaan satu lapisan (monolayer) molekul pada permukaan adsorben (Hameed dan R. Krishni, 2009). Langmuir menggambarkan bahwa pada permukaan adsorben terdapat sejumlah tertentu situs aktif yang sebanding dengan luas permukaan. Pada setiap situs aktif hanya ada satu molekul yang dapat diadsorpsi (Khoirunnisa, 2005).
Isoterm Langmuir memiliki beberapa asumsi yaitu masing-masing adsorben hanya dapat mengikat satu ion (monolayer), semua adsorben memiliki energi yang sama, tidak ada interaksi antar ion atau molekul-molekul yang terserap. Bersifat irreversibel dan proses adsorpsi terjadi secara kimia (P´erez-
Mar´ın dkk, 2007). Persamaan isoterm adsorpsi Langmuir adalah (Adamson, 1990):
𝑄𝑒 = 𝑋𝑚 𝐾 𝐶𝑒
(1+𝐾𝐶𝑒) ……….(2.3)
Dimana: Q e = banyaknya zat yang terserap per satuan berat adsorben (mol/g)
Ce = Konsentrasi adsorbat pada saat kesetimbangan (mol/L)
Xm = Kapasitas adsorpsi maksimum (mol/g)
K = Konstanta Langmuir (L/mol)
Persamaan diatas dapat disusun secara linear menjadi:
𝐶𝑒 𝑄𝑒= 1 𝑋𝑚 𝐾+ 𝐶𝑒 𝑋𝑚 ……….(2.4)
Sehingga dapat disusun menjadi grafik sebagai berikut:
Gambar 2.5 Grafik Isotermis Adsorpsi Langmuir (Adamson, 1990)
2.4.2 Isoterm Adsorpsi Freundlich
Menurut Adamson (1990) persamaan isoterm adsorpsi Freundlich merupakan perbandingan zat yang teradsorpsi perberat adsorben dalam konsentrasi larutan. Isoterm adsorpsi Freundlich memiliki beberapa asumsi yaitu adsorben mempunyai permukaan yang heterogen. Setiap molekul adsorben mempunyai potensi penyerapan yang berbeda-beda (multilayer). Dan teori isoterm
adsorpsi Freundlich ini berlaku untuk adsorpsi fisika yaitu membentuk lapisan
multilayer (Kriswiyanti dan Danarto, 2007). Persamaan isoterm adsorpsi
Freundlich adalah:
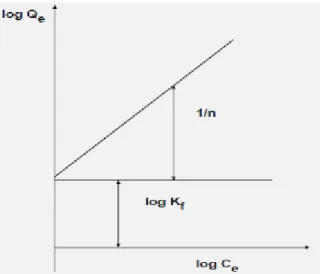
Qe = K f C e1/n ...(2.5)
Dimana: Q e = banyaknya zat yang terserap per satuan berat adsorben (mol/g)
Ce = Konsentrasi adsorbat pada saat kesetimbangan (mol/L)
n = Kapasitas adsorpsi maksimum (mol/g) Kf = Konstanta Freundlich (L/mol)
Persaman diatas dapat diubah kedalam bentuk linier dengan mengambil bentuk logaritmanya:
log 𝑄𝑒 = log 𝐾𝑓 + 1
𝑛log 𝐶𝑒 ………..(2.6)
Sehingga dapat dibuat grafik sebagai berikut:
Gambar 2.6 Grafik Isotermis Adsorpsi Freundlich (Adamson, 1990)
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara mengeplotkan C/Q vs Ce. Konstanta Langmuir K dan
sedangkan harga 1/Xm dan 1/n merupakan harga slop. Bila Xm dan n diketahui
maka K dan Kf dapat dicari, semakin besar harga K dan Kf maka daya adsorpsi
akan semakin baik dari harga K dan Kf yang diperoleh, maka energi adsorpsi akan
dapat dihitung menggunakan persamaan berikut (Rousseau, 1987):
E ads = RT ln K ...(2.7)
Dengan R adalah tetapan gas ideal (8,314 J/Kmol), T adalah temperatur (dalam Kelfin), dan K adalah konstanta keseimbangan adsorpsi.
2.5 Kapasitas Adsorpsi
Kapasitas adsorpsi ion oleh adsorben adalah jumlah gugus yang dapat dipertukarkan dalam adsorben. Kapasitas penukaran adsorpsi ion dari suatu adsorben adalah jumlah ion yang dapat ditukar untuk setiap 1 g adsorben kering, atau jumlah ion yang dapat ditukar untuk setiap 1 mL adsorben basah. Besarnya nilai kapasitas adsorpsi suatu adsorben bergantung dari jumlah gugus-gugus ion yang dapat ditukarkan yang terkandung dalam setiap g adsorben tersebut. Semakin besar jumlah gugus-gugus tersebut semakin besar pula nilai kapasitas adsorpsinya (Underwood, 2002).
Kapasitas adsorpsi dapat ditentukan berdasarkan banyaknya zat terlarut yang teradsorpsi per gram adsorben pada keadaan jenuh (sesuai dengan waktu setimbangnya). Perhitungan kapasitas adsorpsi menurut Lowell dan Shields (1984) dapat digunakan persamaan :
Wads = C1−C2
1000 x V x 1
B ………...…(2.8)
Keterangan :
Wads = berat adsorbat yang terserap oleh 1 gram sampel (mg/g)
B = berat sampel yang digunakan (g)
C1 = konsentrasi larutan adsorbat awal adsorbat (ppm)
V = volume larutan adsorbat yang digunakan (mL)
2.6 Luas Permukaan Adsorben
Luas permukaan adsorben merupakan salah satu karakter fisik yang memiliki peranan penting dari proses adsorpsi, karena banyaknya zat yang dapat teradsorpsi selain tergantung pada situs aktif, juga ditentukan oleh luas permukaannya (Bernasconi, 1995). Luas permukaan spesifik ditentukan oleh luas permukaan dalam yaitu mikropori dan mesopori. Luas permukaan yang diproleh merupakan kemampuan adsorpsinya terhadap adsorbat dimana, semakin besar luas permukaan maka kapasitas adsorpsinya semakin besar sehingga memberikan kontak lebih besar terhadap adsorben dan adsorbatnya yang terserap lebih banyak. Namun, hal ini tidak selalu berlaku karena pori-pori juga memiliki diameter yang beragam sehingga penyerapan juga tidak seragam (Subroto, 2007).
Persamaan luas permukaan spesifik (S) menurut Lowell dan Shields (1984) adalah :
S = Wads . N .a
Mr ...(2.9)
Dimana,
S = luas permukaan adsorben (m2/g) N = bilangan avogadro (6,022 x 1023 mol-1)
a = luas penampang lintang adsorbat (m2/molekul)
Mr = massa molekul relatif adsorbat (g/mol)
Wads = berat adsorbat yang terserap oleh 1 gram sampel (g/g)
2.7 Titrasi Asam Basa untuk Penentuan Keasaman
Titrasi adalah salah satu teknik analisis yang paling banyak digunakan. Teknik ini didasarkan atas pengukuran sejumlah volume tertentu zat baku yang mempunyai konsentrasi tertentu yang bereaksi dengan sejumlah volume tertentu
analit. Teknik ini memberikan hasil yang cukup cepat dengan ketelitian yang relatif tinggi (Rivai, 1995).
Dalam suatu titrasi, senyawa uji (analit) bereaksi dengan pereaksi, yaitu suatu larutan dengan konsentrasi tertentu, yang biasanya ditambahkan melalui buret. Larutan pereaksi ini disebut titran yang merupakan baku (standar). Volume titran yang diperlukan adalah volume agar sejumlah analit tepat habis bereaksi dengan mol titran. Oleh konsentrasi zat baku dan reaksi analit dengan titran diketahui dengan pasti, maka konsentrasi analit dapat dihitung (Christian, 1980).
Berbagai senyawa baik organik maupun anorganik, asam ataupun basa dapat dititrasi dengan larutan asam maupun basa kuat. Titik akhir titrasi ini mudah sekali dideteksi baik dengan indikator ataupun dengan mengikuti perubahan pH dengan pH-meter.titrasi asam-basa adalah titrasi yang melibatkan reaksi netralisasi, dimana asam bereaksi dengan sejumlah ekivalen basa. Dasar titrasi asam-basa adalah reaksi antara ion H+ (H3O+) dari asam dan ion cc dari basa yang
membentuk air. Persamaan reaksinya dapat dituliskan sebagai berikut (Christian, 1980) :
H3O+ + OH- 2H2O
Untuk melihat akhir titrasi seara visual, diperlukan suatu indikator. Indikator asam-basa pada umumnya adalah senyawa organik yang bersifat asam atau basa lemah yang berwarna, dimana warna dalam bentuk terionisasinya sangat berbeda dengan warna indiator yang tidak terionisasi. Pada titrasi asam-basa indikator yang dipilih harus dapat nerubah warna tepat atau mendekati titik ekivalen. Untuk titrasi asam-basa salah satu indikator yang sering dipakai adalah
cocok asam lemah dan basa lemah. Phenolptalein dalam suasana asam tidak berwarna, sedangkan dalam suasana basah berwarna merah (Vogel, 1985).
2.8 Ligan
Ligan adalah suatu ion atau molekul yang memiliki sepasang elektron atau lebih yang dapat disumbangkan. Ligan merupakan basa Lewis yang dapat terkoordinasi pada ion logam atau sebagai asam Lewis membentuk senyawa kompleks. Ligan dapat berupa anion atau molekul netral (Cotton dan Wilkinson, 1989). Jika suatu logam transisi berikatan secara kovalen koordinasi dengan satu atau lebih ligan maka akan membentuk suatu senyawa kompleks, dimana logam transisi tersebut berfungsi sebagai atom pusat. Logam transisi memiliki orbital d yang belum terisi penuh yang bersifat asam Lewis yang dapat menerima pasangan elektron bebas yang bersifat basa Lewis. Ligan memiliki beberapa jenis yaitu ligan monodentat, ligan bidentat dan ligan polidentat (Cotton dan Wilkinson, 1989).
Ligan monodentat merupakan ligan yang hanya mampu menyumbangkan satu pasang elektron bebas saja atau dengan kata lain hanya dapat membentuk satu ikatan kovalen koordinasi dengan ion logam pusat (misalnya F-, Cl-, Br-, H2O, NH3, CO dan OH-) (Cotton dan Wilkinson, 1989). Ligan bidentat
merupakan ligan yang mempunyai dua atom, yang masing-masing mempunyai satu pasangan elektron menyendiri, maka molekul itu mempunyai dua atom penyumbang dan akan membentuk dua ikatan koordinasi dengan ion logam yang sama. Salah satu contoh ligan ini adalah ligan dithiokarbamat, karboksilat, sulfat dan sebagainya. Sedangkan ligan polidentat merupakan ligan yang mengandung
NH
NH NH
O
NH
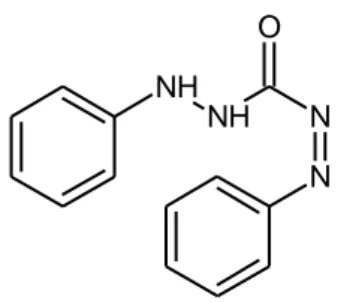
dua atau lebih atom, yang masing masing serempak membentuk ikatan dua donor elektron kepada ion logam yang sama. Salah satu contoh ligan ini adalah ligan difenilkarbazon dan difenilkarbazida.
Difenilkarbazida merupakan suatu molekul dengan rumus C13H14N4O
yang memiliki berat molekul 242,28 g/mol, titik lebur 170-173℃, indeks bias 1.697, dan kepadatan sebesar 1.292g/cm3 dengan nama IUPAC 1,5-difenil karbazida. Difenilkarbazida biasanya digunakan sebagai reagen. Reagen ini digunakan dalam penentuan kromium, Cr (VI), dari suatu larutan dimana akan dibentuk suatu molekul kompleks dengan kromium tersebut (Cotton dan Wilkinson, 1989). Struktur reagen pengompleks tersebut yaitu dilihat pada Gambar 2.7 :
Gambar 2.7 Struktur Difenilkarbazida
Difenilkarbazon merupakan suatu molekul dengan rumus C13H12N4O dan
memiliki berat molekul 240,27 g/mol serta titik leleh 153-1580C, indeks bias 1.622, dan kepadatan sebesar 1.206g/cm3. Sifat difenilkarbazon tidak larut dalam air dan asam mineral encer tetapi larut dalam ammonia. Reagen ini digunakan dalam penentuan kromium dari suatu larutan dimana akan dibentuk suatu molekul kompleks berperan sebagai ligan yang bersifat polidentat yang akan menyumbangkan dua atau lebih pasangan elektron bebas dalam pembentukan
NH
NH N
O
N
ikatan (Anonim, 2008). Gambar 2.8 menunjukkan struktur pengompleks difenilkarbazon:
Gambar 2.8 Struktur Difenilkarbazon
2.9 Spetrofotometer UV-Vis
Spektrofotometri UV-Vis merupakan salah satu metoda analisis kimia instrumental yang berdasarkan pada interaksi energi radiasi UV-Vis dengan analit. Fenomena absorpsi sinar radiasi elektromagnetik di daerah ultraviolet (λ = 200-380 nm) dan di daerah sinar tampak (200-380-780 nm) oleh larutan sampel anorganik maupun organik. Spektrum elektronik UV-Vis terjadi sebagai hasil interaksi radiasi UV-Vis terhadap molekul yang mengakibatkan molekul tersebut mengalami transisi elektronik (Cahyono, 2000).
Spektra UV-Vis dari senyawa organik berkaitan erat dngan transisi elektron di antara tingkatan-tingkatan elektronik. Transisi yang terjadi dipengaruhi oleh gugus kromofor dan auksokrom. Kromofor (chromophore) merupakan gugus tak jenuh kovalen yang bertanggung jawab terhadap terjadinya absorpsi (misalnya: C=C, C=O, dan O=N=O). Sedangkan auksokrom (auxochrome) adalah gugus jenuh yang apabila terikat pada kromofor dapat menyebabkan perubahan panjang gelombang dan intensitas absorpsi maksimum (misalnya: OH, NH2, dan
Instrumen untuk spektrofotometer UV-Vis pada umumnya terdiri dari lima komponen yaitu: Sumber radiasi, monokromator, wadah sampel, detektor dan rekorder (Paseda, 2011) dengan skema sebagai berikut :
Sumber Radiasi
Mono
Kromator Sampel Detektor
Rocorder Read Out
Gambar 2.9 Skema Spektrofotometer UV-Vis
Serapan spektrofotometri UV-Vis mengikuti Hukum Lambert –Beer yaitu penyerapan energi radiasi sebanding dengan jumlah molekul yang menyerap sehingga dapat diketahui hubungan antara transmitansi, tebal cuplikan dan konsentrasi larutan. Hubungan ini dapat dinyatakan sebagai berikut :
LogIt
Io= −ε. b. C………..(2.10)
It
Io= T………(2.11)
Jadi Log T = −ε. b. C………(2.12) Dimana, Io adalah intensitas cahaya yang datang, It adalah intensitas cahaya yang ditransmisikan, T adalah Transmitan, ε adalah absorptivitas molar (L mol-1 cm-1),
b adalah ketebalan sampel (cm) yang dibuat konstan sedangkan C adalah konsentrasi larutan (mol/L).
Jika harga –Log T = A (absorbansi) maka :
A = ε.b.C ………..…………(2.13) Apabila konsentrasi dinyatakan dalam gram per liter maka persamaannya menjadi :
Dimana, a (cm-1 g-1 L) disebut dengan absorptivitas yang harganya tergantung pada panjang gelombang dan sifat materi penyerap radiasi.
2.10 Spetrofotometer Serapan Atom (SSA)
Spektrofotometri serapan atom digunakan untuk analisis kandungan logam-logam seperti Cu, Pb, Zn, Cr, Cd dan lain-lain dalam jumlah yang relatif kecil secara kualitatif Metode SSA menjadi pilihan yang tepat dalam analisis karena kecepatan analisisnya, ketelitian yang tinggi dan tidak memerlukan pemisahan terlebih dahulu terhadap sampel yang akan dianalisis. Selain itu metode SSA sangat tepat untuk analisis zat pada konsentrasi rendah (Khopkar, 1990).
Metode Spektrofotometri Serapan Atom (SSA) ini didasarkan pada penyerapan energi cahaya oleh atom-atom netral dalam keadaan gas pada panjang gelombang tertentu. Prinsip kerja analisis Spektrofotometri Serapan Atom (SSA) adalah mengukur serapan yang dilakukan oleh atom-atom logam hasil dari pengubahan larutan sampel menjadi fase uap. Beberapa atom mengalami oksidasi termal dan sebagian besar tetap tinggal dalam keadaan dasar (ground state) dapat menyerap radiasi yang dihasilkan oleh suatu sumber khusus yang dibuat dari unsur tersebut (lampu katoda). Panjang gelombang yang dikeluarkan dari sumber radiasi sama dengan yang diserap oleh atom-atom (Skoog D.A, 1991).
Besarnya energi yang diserap oleh atom pada tingkat energi dasar untuk dapat tereksitasi disebabkan karena energi eksitasi elektron sangat karakteristik untuk setiap unsur, sehingga hanya pada panjang gelombang tertentu suatu unsur dapat mengalami eksitasi elektron. Sebagai contoh kromium yang menyerap pada
panjang gelombang (λ) = 357,9 nm. Penyerapan tersebut menyebabkan tereksitasinya atom dari tingkat energi dasar ke tingkat energi yang lebih tinggi (Skoog D.A, 1991).
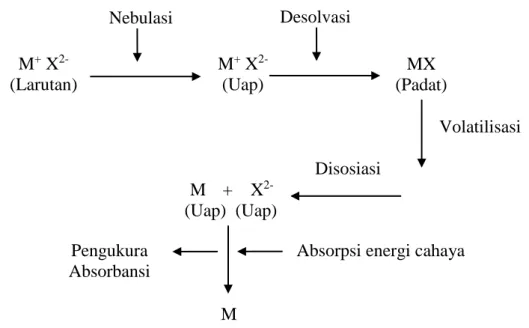
Proses atomisasi yang terjadi dalam Spektrofotometri Serapan Atom (SSA) adalah sebagai berikut: Larutan sampel disemprotkan dalam bentuk aerosol ke dalam nyala api. Mula-mula terjadi penguapan pelarut sehingga tertinggal partikel-partikel padat. Selanjutnya partikel padat berubah menjadi gas, selanjutnya mengalami disosiasi menjadi atom netral. Di dalam nyala, atom-atom netral menyerap radiasi energi cahaya yang dikenakan padanya dengan panjang gelombang yang sesuai.
Ringkasan proses atomisasi yang terjadi dalam Spektrofotometri Serapan Atom (SSA) dapat dilihat pada gambar berikut (Zainuddin, 1986):
Gambar 2.10 Rangkaian proses atomisasi pada AAS
Sumber: Zainuddin, 1986
Atom-atom logam menyerap sinar pada panjang gelombang tertentu, penyerapan sinar ini sebanding dengan konsentrasi atom-atom dalam nyala.
M+ X 2-(Larutan) Nebulasi M+ X 2-(Uap) Desolvasi MX (Padat) Volatilisasi Disosiasi M 8*
Absorpsi energi cahaya M + X
2-(Uap) 2-(Uap) Pengukura
Hubungan antara penyerapan cahaya dengan konsentrasi dinyatakan oleh hokum Lambert Beer, dimana absorbans berbanding langsung dengan tebal larutan dan konsentrasi larutan yaitu:
A = a. b. C ………...………(2.14) Dimana, A = absorban
a = absorptivitas b = panjang burner C = konsentrasi larutan
Jika konsentrasi dinyatakan dalam mol/L (Molar) dan panjang burner dinyatakan dalam centimeter (cm) maka absorptivitas molar dengan symbol ε (koefisien ekstingsi molar L mol-1 cm-1), jadi A = ε . b , C. Hukum Lambert Beer ini merupakan dasar analisis kuantitatif secara spektroskopi pada umumnya.
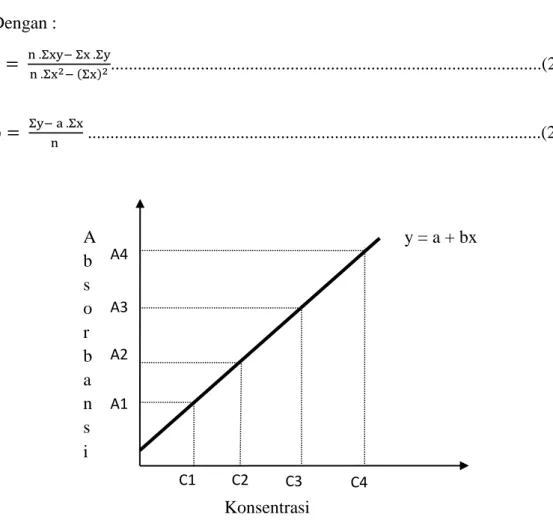
2.11 Kurva Kalibrasi
Kurva kalibrasi atau disebut juga kurva standar diperoleh dengan mengukur absobans dari sederetan konsentrasi larutan standar. Jika suatu sistem mengikuti hukum Lambert Beer, grafik antara absorban terhadap konsentrasi (Gambar 2.10 ) akan menghasilkan garis lurus melalui.
Dengan kurva kalibrasi konsentrasi larutan sampel dapat dengan mudah diketahui atau dihitung dari pembacaan absorbans sampel seperti terlihat pada Gambar 2.10. Jika jumlah sampelnya banyak sekali, perhitungan konsentrasi dapat dilakukan dengan menggunakan persamaan regresi linear y = ax + b, dimana y adalah absorbans dan x adalah tangen arah, dan b adalah intersep (Khopkar, 1990).
C1 C2 C3 C4 A2 A3 A4 A1 Konsentrasi A b s o r b a n s i y = a + bx Dengan : a = n .Σxy− Σx .Σy n .Σx2− (Σx)2...(2.15) b = Σy− a .Σx n ...(2.16)