SKRIPSI
ISOLASI DAN IDENTIFIKASI FUNGI PADA IKAN MASKOKI (Carassius auratus) DI BURSA IKAN HIAS
GUNUNG SARI SURABAYA, JAWA TIMUR
PROGRAM STUDI S-1 BUDIDAYA PERAIRAN
Oleh:
AMALIA HAPSARI SIDOARJO–JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SKRIPSI
ISOLASI DAN IDENTIFIKASI FUNGI PADA IKAN MASKOKI (Carassius auratus) DI BURSA IKAN HIAS
GUNUNG SARI SURABAYA, JAWA TIMUR
PROGRAM STUDI S-1 BUDIDAYA PERAIRAN
Oleh:
AMALIA HAPSARI SIDOARJO–JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
Yang bertanda tangan di bawah ini, saya : N a m a : Amalia Hapsari
N I M : 141011059
Tempat, tanggal lahir : Sidoarjo, 30 Januari 1992
Alamat : Delta Sari Indah Blok O/69 Waru Sidoarjo Judul Skripsi : Identifikasi dan Isolasi Fungi pada Ikan Maskoki
(Carassius auratus) di Bursa Ikan Hias Gunung Sari Surabaya, Jawa Timur
Pembimbing : 1. Rahayu Kusdarwati, Ir. M. Kes 2. Ir. Sudarno, M. Kes
Menyatakan dengan sebenarnya bahwa hasil tulisan lapporan skripsi yang saya buat adalah murni hasil karya saya sendiri (bukan plagiat) yang berasal dari Dana Penelitian : Pribadi. Di dalam skripsi / karya tulis ini tidak terdapat keseluruhan atau sebagian tulisan atau gagasan orang lain yang saya ambil dengan cara
menyalin atau meniru dalam bentuk rangkaian kalimat atau symbol yang saya aku seolah-olah sebagai tulisan saya sendiri tanpa memberikan pengakuan pada penulis aslinya, serta kami bersedia :
1. Dipublikasikan dalam Jurnal Ilmiah Perikanan dan Kelautan Fakultas Perikanan dan Kelautan Universitas Airlangga;
2. Memberikan ijin untuk mengganti susunan penulis pada hasil tulisan skripsi / karya tulis saya ini sesuai dengan peranan pembimbing skripsi; 3. Diberikan sanksi akademik yang berlaku di Universitas Airlangga,
termasuk pencabutan gelar kesarjanaan yang telah saya peroleh (sebagai diatur di dalam Pedoman Pendidikan Unair 2010/2011 Bab, XI pasal 38 - 42), apabila dikemudian hari terbukti bahwa saya ternyata melakukan tindakan menyalin atau meniru tulisan orang lain yang seolah-olah hasil pemikiran saya sendiri.
Demikian surat pernyataan yang saya buat ini tanpa ada unsur paksaan dari siapapun dan dipergunakan sebagaimana mestinya.
Surabaya, 3 Oktober 2014 Yang membuat pernyataan,
RINGKASAN
AMALIA HAPSARI. Isolasi dan Identifikasi Fungi pada Ikan Maskoki (Carassius auratus) di Bursa Ikan Hias Gunung Sari Surabaya, Jawa Timur Dosen Pembimbing Rahayu Kusdarwati, Ir., M.Kes dan Ir. Sudarno, M,Kes
Ikan maskoki (Carassius auratus) merupakan ikan hias air tawar yang banyak ditemukan di Indonesia salah satunya daerah Jawa Timur. Ikan Maskoki memiliki beberapa keunggulan diantaranya dapat dijadikan ikan hias yang jinak, dan memiliki warna yang indah dan bentuk tubuh unik. Salah satu penyakit yang berbahaya bagi kegiatan budidaya adalah fungi. Mendefinisikan penyakit sebagai suatu keadaan atau sakit yang disebabkan oleh organisme patogen, yaitu parasit, virus, bakteri, dan fungi. Penelitian ini bertujuan untuk mengidentifikasi jenis fungi yang menginfeksi ikan Maskoki di Bursa Ikan Hias Gunung Sari Surabaya, Jawa Timur.
Metode penelitian ini adalah survey. Parameter utama yang diamati dalam penelitian ini adalah jenis fungi yang menginfeksi ikan maskoki di Bursa Ikan Hias Gunung Sari Surabaya, Jawa Timur. Sedangkan sebagai parameter temperatur, amonia, dan Oksigen terlarut yang diukur selama kegiatan pengambilan sampel.
Hasil penelitian menunjukkan bahwa dari 25 sampel ikan yang diambil dari 6 lokasi, 11 ekor ikan positif terinfeksi fungi. Fungi tersebut adalah Aspergillus flavus, Aspergillus niger, Penicillium glabrum, Saprolegnia. Perlu
dilakukan penelitian mengenai tingkat patogenitas dari masing-masing spesies fungi sehingga diperoleh data yang dapat digunakan untuk melakukan pencegahan.
SUMMARY
The gold fish (Carassius auratus) is one of ornamental fresh water fish in indonesia, specially in east java. The gold fish is benign fish and it has beauty color and unique body. The fungi is one of the problem in fish culture. Obsereved, parasite, virus, bacteria and fungi are the organism pathogen which can spread the diseases.
The purpose of this research if to identify the species of fungi that infected the gold fish in fish market Gunung Sari Surabaya East Java. The survey method is used in this research. The parameter is fungi that infected the gold fish in fish market Gunung Sari Surabaya, East Java. The temperate, amonia and dissolved oxygent are noted when sampling. The results were 25 fish sample from 6 location, 11 samples were positive infected by fungi. The fungus are Aspergillus flavus, Aspergillus niger, Penicillium galbrum, Saprolegnia. It needs more study
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas limpahan rakhmat dan hidayahnya, sehingga Skripsi dengan judul “ Isolasi dan Identifikasi Fungi pada Ikan Maskoki di Bursa Ikan Hias Gunung Sari Jawa Timur” ini dapat terselesaikan. Hasil disusun berdasarkan Penelitian yang
dilaksanakan di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Surabaya I Sidoarjo pada tanggal 11 – 28 Agustus 2014.
Penulis menyadari bahwa laporan ini masih jauh dari kesempurnaan, sehingga kritik dan saran yang membangun sangat diharapkan demi perbaikan dan kesempurnaan Hasil Penelitian Skripsi selanjutnya. Penulis berharap semoga Skripsi ini dapat bermanfaat dan memberikan informasi bagi semua pihak guna perkembangan ilmu pengetahuan dan teknologi dibidang perikanan. Akhir kata penulis mengucapkan terimakasih.
Surabaya, 23 September 2014
UCAPAN TERIMA KASIH
Pada kesempatan ini, tidak lupa pula penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Prof. Dr. Hj. Sri Subekti B, S., drh., DEA. Selaku Dekan Fakultas dan dosen penguji, Perikanan dan Kelautan Universitas Airlangga Surabaya. 2. Ibu Rahayu Kusdarwati, Ir. M. Kes dan Bapak Ir. Sudarno, M. Kes selaku
dosen pembimbing yang telah memberikan arahan, petunjuk dan
bimbingan sejak penyusunan usulan hingga selesainya penyusunan Hasil Penelitian Skripsi ini.
3. Bapak Agustono, Ir., M..Kes. dosen penguji yang telah memberikan arahan dalam penulisan Hasil Penelitian Skripsi ini.
4. Bapak Prof. Dr. Ir. Hari Suprapto., dosen penguji yang telah memberikan arahan dalam penulisan Hasil Penelitian Skripsi ini.
5. Kedua orang tua saya tercinta, Alm. Bapak Ir. Hasto Sunako dan Ibu Ami Samiagustini, terimaksih atas doa yang tulus, semangat yang kuat dan kerja kerasnya yang menjadi motivasi terbesar saya dalam menyelesaikan Hasil Penelitian Skripsi ini.
6. Bapak Yusuf Arif Wahyudi, S. St.Pi. terima kasih telah membimbing saya selama melakukan penelitian di Laboratorium Balai Karantina Ikan kelas I Juanda.
8. Semua teman-teman Budidaya Perairan khususnya angkatan 2010, Sinta, Mentari, Shasa, Devi, Rahma, Sari, Catur, Dhanik, Maya, Fifit, Mega, Oktan, Sofie, Arlisa yang selalu memberikan bantuan, dukungan dan semangat.
DAFTAR ISI
4.3 Metodologi Penelitian………. 20
4.3.2 Prosedur Penelitian... 20
4.3.3 Parameter Penelitian... 23
4.3.4 Analisis Data... 23
V. Hasil dan Pembahasan ... 24
5.1 Hasil Penelitian ... 24
5.1.1 Identifikasi Fungi... 24
5.1.2 Nilai Kualitas Air... 31
5.2 Pembahasan... 31
VI. Kesimpulan dan saran ... 35
6.1 Kesimpulan ... 35
6.2 Saran ... 35
Daftar Pustaka ... 36
DAFTAR GAMBAR
Gambar Halaman
1. Ikan Maskoki (Carassius auratus) ... 5
2. Hifa Fungi ... ... 8
3. Saprolegnia ... ... 11
4. Aspergilus flavus ……… 12
5. Aspergilus niger ... ... 14
6. Kerangka Konsteptual... ... 18
7. Koloni Aspergilus flavus... ... 26
8. Bagian-bagian Aspergilus flavus... ... 27
9. Koloni Aspergilus niger... ... 28
10. Bagian-bagian Aspergilus niger... ... 29
11. Koloni Saprolegnia... 31
12. Bagian-bagian Saprolegnia... ... 32
13. Penicillium glabrum... ... 33
DAFTAR LAMPIRAN
I PENDAHULUAN
1.1 Latar Belakang
Usaha perikanan di Indonesia saat ini telah berkembang dengan pesat terutama dalam bidang budidaya, baik sektor ikan hias maupun, konsumsi (Lingga dan Susanto, 2003). Indonesia memiliki perairan tawar yang sangat luas dan berpotensi besar untuk usaha budidaya berbagai jenis ikan. Ikan hias air tawar merupakan salah satu alternatif usaha untuk menjalankan perekonomian yang banyak menghasilkan devisa.
Usaha budidaya ikan tidak terlepas dari masalah penyakit dan fungi pada ikan. (Handajani dan Samsundari, 2005) mendefinisikan penyakit sebagai suatu keadaan atau sakit yang disebabkan oleh organisme patogen, yaitu parasit, virus, bakteri, dan fungi maupun faktor-faktor lain seperti pakan dan kondisi lingkungan yang buruk. Penyakit merupakan salah satu masalah yang penting dalam budidaya ikan.
Ikan maskoki merupakan ikan hias air tawar yang banyak ditemukan di Indonesia salah satunya yaitu daerah Jawa Timur. Ikan maskoki memiliki beberapa keunggulan diantaranya dapat dijadikan ikan hias yang jinak, dan memiliki warna yang indah dan bentuk tubuh unik. Selain itu ikan maskoki mudah dipelihara.
telur, larva, tokolan (juvenil) dan ikan dewasa. Pada ikan yang terinfeksi terlihat adanya sekumpulan hifa di bagian kepala, operkulum dan sirip. Ikan yang terinfeksi menjadi kurus dan menggosokkan badan pada benda lain. Gejala yang dapat dilihat secara klinis adalah adanya benang halus menyerupai kapas yang menempel pada telur atau luka pada bagian eksternal ikan. Selain itu, perubahan warna sirip dan tubuh ikan menjadi merah. Fungi tersebut dengan cepat menular kepada ikan lain yang berada dalam satu kolam. Sehingga penyebarannya semakin cepat dan berpotensi kerugian yang cukup besar bagi pembudidaya dan pedagang ikan Maskoki.
Bursa ikan hias di Gunung Sari Surabaya merupakan sentra ikan hias yang terbesar di Surabaya dan komoditas ikan hias terbanyak adalah ikan maskoki. Ikan maskoki merupakan salah satu komoditas yang mudah terserang penyakit yaitu parasit dan fungi sehingga perlu dilakukan penelitian untuk mengetahui jenis fungi.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas maka dapat dirumuskan permasalahan sebagai berikut:
1. Jenis fungi apa saja yang dapat diisolasi dan diidentifikasi dari ikan maskoki (Carassius auratus) di bursa ikan hias Gunung Sari Surabaya? 2. Apakah terdapat jenis fungi yang berpotensi menyebabkan penyakit pada
1.3 Tujuan
Tujuan dilaksanakannya penelitian ini yaitu:
1. Untuk mengetahui jenis fungi apa saja yang menginfeksi ikan maskoki (Carassius auratus) di bursa ikan hias Gunung Sari Surabaya?
2. Untuk mengetahui jenis fungi apa saja yang berpotensi menyebabkan penyakit pada ikan maskoki (Carassius auratus) di bursa ikan Gunung Sari Surabaya?
1.4 Manfaat
II TINJAUAN PUSTAKA
2.1 Ikan Maskoki
2.1.1 Klasifikasi dan Morfologi
Ikan maskoki (Carassius auratus) merupakan salah satu jenis ikan dari famili Cyprinidae. Klasifikasi ikan maskoki adalah sebagai berikut (Yanovsky, 1967) :
Spesies : Carassius auratus
Secara umum ikan maskoki memiliki bentuk tubuh pendek dan bulat, mata lebar dan besar, di sisi tubuhnya terdapat gurat sisi dan mempunyai lembaran insang (Yanovsky, 1967). Di bagian hidung maskoki terdapat tunas pembau yang tidak berhubungan dengan organ pernafasan. Secara umum ikan maskoki mempunyai sirip lengkap yang berfungsi sebagai alat gerak dan keseimbangan yaitu sirip dada (pectoral fin), sirip perut (ventral fin), sirip dubur (anal fin), sirip ekor (caudal fin) dan sirip punggung (dorsal fin). Sirip perut dan sirip dada bekerja sama dengan gelembung udara sebagai control terhadap gerakan ke atas dan ke bawah (Yanovsky, 1967).
Pada beberapa ikan maskoki, bagian atas kepala dan pipinya tampak ditumbuhi tumpukan otot tebal lensa mata pada ikan maskoki tidak dapat berkontraksi luas sehingga jarak pandang terbatas (Yanovsky, 1967). Kondisi tersebut menyebabkan ikan maskoki hanya mengandalkan indra penciuman dalam mencari makan. Gambar morfologi ikan Maskoki dapat dilihat pada Gambar 2.1
Gambar 2.1 : Morfologi ikan maskoki (Yanovsky, 1967) 2.1.2 Habitat
Ikan maskoki seperti halnya ikan air tawar lainnya yang bersifat eurythermal, dapat hidup pada kisaran suhu 0-350C, sedangkan suhu optimal untuk melakukan aktifitas dan makan berkisar antara 20-300C. Secara alami, ikan maskoki menyukai habitat kolam berlumpur, waduk, sungai dan danau (Wheeler 1975).
2.2 Fungi
mengandung klorofil. Fungi mendapat makanan secara heterotrof dengan mengambil makanan dari bahan organik. Bahan organik di sekitar tempat tumbuhnya diubah menjadi molekul sederhana dan diserap langsung oleh hifa, oleh karena itu fungi tidak seperti organisme heterotrof lainnya yang menelan makanan kemudian mencernanya sebelum diserap (Post, 1987).
Fungi merupakan organisme heterofilik yang merupakan senyawa organik untuk nutrisinya (Pelezar dan Chan, 1986). Bersifat heterotrof, menyerap nutrien melalui dinding selnya dan mengekskresikan enzim ekstraseluler ke lingkungan, menghasikan spora atau konidia dan melakukan reproduksi seksual ataupun aseksual (Sigler 1983).
Fungi memerlukan oksigen untuk hidupnya (bersifat aerobik). Habitat (tempat hidupnya) fungi terdapat pada air dan tanah. Cara hidupnya bebas atau bersimbiosis, tumbuh sebagai saprofit atau parasit pada tanaman, hewan dan manusia (Sigler 1983).
2.2.1 Morfologi Fungi
Badan vegetatif fungi yang tersusun dari filamen-filamen disebut thallus, yang pada dasarnya terdiri atas dua bagian yaitu miselium dan spora. Miselium merupakan kumpulan beberapa filamen yang disebut sebagai hifa (Dixon et. al 1991).
bereproduksi mempunyai ukuran tebal berkisar 100-150 µm. Hifa dewasa mempunyai tambahan bahan pada dinding selnya, yaitu melanin dan lipid (Sigler, 1983).
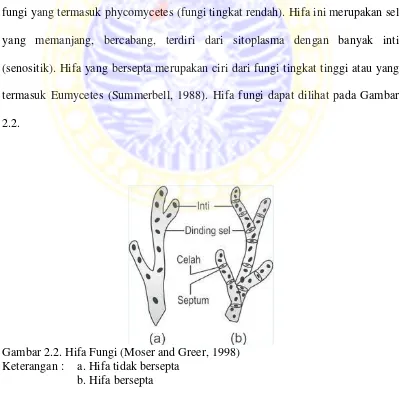
Berdasarkan fungsinya dibedakan dua macam hifa, yaitu hifa fertil dan hifa vegetatif. Hifa fertil adalah hifa yang dapat membentuk sel reproduksi atau spora. Apabila hifa tersebut arah pertumbuhannya keluar dari media disebut hifa udara. Hifa vegetatif adalah hifa yang berfungsi untuk menyerap makanan dari substrat. Berdasarkan bentuknya dibedakan lagi menjadi dua macam hifa, yaitu hifa tidak bersepta dan hifa bersepta. Hifa yang tidak bersepta merupakan ciri fungi yang termasuk phycomycetes (fungi tingkat rendah). Hifa ini merupakan sel yang memanjang, bercabang, terdiri dari sitoplasma dengan banyak inti (senositik). Hifa yang bersepta merupakan ciri dari fungi tingkat tinggi atau yang termasuk Eumycetes (Summerbell, 1988). Hifa fungi dapat dilihat pada Gambar 2.2.
Gambar 2.2. Hifa Fungi (Moser and Greer, 1998) Keterangan : a. Hifa tidak bersepta
2.2.2 Reproduksi Fungi
Fungi yang telah dewasa akan membentuk struktur untuk melakukan reproduksi agar spesiesnya menyebar dan tidak punah (Weitzman, 1991). Fungi bereproduksi secara aseksual dan seksual. Kebanyakan fungi memproduksi spora. Spora merupakan unit transmisi primer. Reproduksi secara aseksual (biasa disebut sebagai reproduksi vegetatif) yang tidak melibatkan sel lain (Post, 1987). Reproduksi secara aseksual membentuk karpus yang di dalamnya mengandung hifa fertil yang menghasilkan spora atau konidia (Weitzman, 1991). Sedangkan reproduksi secara seksual, spora yang dihasilkan dari pelebaran dua nucleus dari induknya (Pelezar dan Chan, 1986).
2.2.3 Fungi pada Ikan
Infeksi fungi umumnya terjadi jika ikan mendapat luka baik secara mekanik maupun infeksi oleh parasit yang lain. Beberapa jenis fungi yang digolongkan pathogen karena dapat menimbulkan kematian pada ikan antara lain Ichthyophonus hoferi, Aphanomyces invandans, Branchiomyces sanguinis, Achlya
rasemosa (Hoog, 1983).
kerugian bagi para pedagang tetapi menyebabkan ikut terinfeksinya ikan yang sehat.
Fungi tersebut menyerang ikan air tawar seperti, ikan maskoki, ikan nila, ikan gurami, ikan patin, ikan lele, dan belut. Berikut spesifikasi dari fungi tersebut:
1. Saprolegnia parasitica
Menurut Bruno and Wood (1994), klasifikasi Fungi Saprolegnia parasitica adalah sebagai berikut :
Phylum : Oomycota Class : Oomycotea Order : Saprolegniales Family : Saprolegniaceae Genus : Saprolegnia Species : Saprolegnia sp
Saprolegnia sp merupakan infeksi fungi pada ikan dan telur ikan yang berasal dari famili Saprolegniaceae. Penyakit yang disebabkan oleh fungi Saprolegnia parasitica adalah Saprolegniasis. Semua ikan dan telur ikan di perairan tawar dan payau berpotensi terinfeksi saprolegniasis (Post, 2007).
Saprolegnia sp merupakan fungi yang menyerang bagian tubuh ikan yang
terluka dan dalam beberapa waktu akan menyebar pada jaringan sehat lainnya. Infeksi Saprolegnia biasanya berkaitan dengan kondisi kualitas air yang buruk, seperti sirkulasi air rendah, kadar oksigen terlarut rendah, kadar amonia tinggi dan kadar bahan organik tinggi (Post, 2007).
pada kulit, sirip, insang, mata atau telur ikan (Dana dan Angka, 1990). Identifikasi fungi diperlukan untuk mendiagnosis suatu penyakit yang disebabkan oleh fungi. Saprolegnia sp merupakan fungi bercabang yang hifanya tidak bersepta. Fungi tersebut bereproduksi secara aseksual dimana zoosporangium lengkap yang ujung dari hifanya fertil (Post, 1987). Pengamatan Saprolegnia parasitica secara mikroskopis di bawah mikroskop menunjukkan hifa
transparan (hialin), bercabang, tidak bersepta dan hifa berukuran besar dengan ukuran 7-50 µm (Dewi, 2011). Zoospora Saprolegnia parasitica dapat dilihat pada Gambar 2.3.
Gambar 2.3. Saprolegnia (Alexopoulos, 1979)
Saprolegnia parasitica merupakan fungi yang berfilamen, organisme tidak
bersekat koenositik yang hidup pada habitat air tawar dan untuk mendapatkan makanan mereka hidup secara saprofit atau parasit. Ciri lain yang dimiliki oleh Saprolegnia parasitica adalah memiliki sporangium yang berdiameter 100 lebih
menghasilkan zoospora. Fungi ini dapat tumbuh pada suhu 0-350C, dengan pertumbuhan optimal 15-300C (Dewi, 2011).
Terjadinya infeksi tergantung pada suhu air dan kondisi ikan. Infeksi bisa mencapai 40 atau 50% dari permukaan tubuh ikan, insang, dan mata. Degenerasi jaringan yang dihasilkan dari infeksi fungi dapat mengganggu keseimbangan osmotik ikan. Ikan yang sakit menjadi semakin lemah dan kehilangan keseimbangan sesaat sebelum kematian. Mortalitas ikan dapat mencapai 10-15% dari populasi (Graham, 2005).
2. Aspergillus Flavus
Menurut Samson and Pitt (2000), klasifikasi Aspergillus Flavus adalah sebagai berikut :
Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichocomaceae Genus : Aspergillus Spesies : Aspergillus flavus
Gambar 2.4. Aspergillus flavus (Alexopaulus dan Mims 1979) Aspergillus flavus merupakan fungi yang menghasilkan aflatoksin. Aflatoksin merupakan toksin yang terdapat pada pakan ikan yang apabila terkonsumsi menyebabkan ikan tersbut dapat terinfeksi. Salah satu jenis aflatkosin yang menimbulkan masalah serius pada akuakultur adalah aflatoksin B1 (AFB1). (Weitzman, 1991).
Aflatoksin yang terdapat pada ikan dapat menyebabkan pertumbuhan ikan menjadi terganggu (Effiong and Alatise, 2009). Gejala klinis ikan yang terinfeksi antara lain, insang pucat, sistem peredaran darah terganggu, sisterm kekebalan menurun, anemia, petumbuhan terganggu dan kurangnya berat badan dan efek jangka panjang menyebabkan tumor dan gangguan pada hati yang berakibat tingginya mortalitas ikan (Russo and Yanog, 2010).
3. Aspergillus niger
Menurut Zhao et al. (2009), klasifikasi Aspergillus niger adalah sebagai berikut :
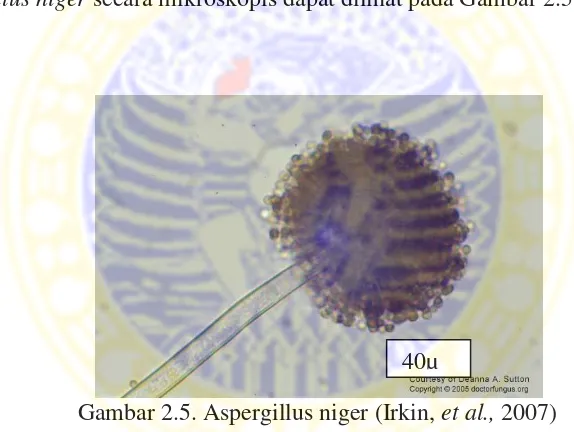
Secara mikroskopis Aspergillus niger memiliki ciri-ciri yaitu, memiliki konidiofor yang transparan serta konidia yang berwarna hitam kecoklatan serta sporangium yang berbentuk bulat dan berwarna hitam. Hal ini sesuai dengan Larone (2002) yang menyatakan bahwa Aspergillus niger memiliki konidifor yang panjangnya 400-3000 µm, halus dan berwarna hitam, memiliki vesikel yang berbentuk bulat dengan diameter 30-75 µm, memiliki konidia yang berwarna coklat sampai hitam, kasar dan bulat dengan diameter 5-7 µm. Bagian-bagian Aspergillus niger secara mikroskopis dapat dilihat pada Gambar 2.5.
Gambar 2.5. Aspergillus niger (Irkin, et al., 2007)
Aspergillus niger merupakan merupakan fungi yang habitatnya di insang dan sisik ikan. Sebagian besar ikan yang diisolasi terinfeksi spesies Aspergillus niger yang sebagian besar memproduksi substansi mikotoksik (Wogu and Lyayi,
2011). Mikotoksik yang diproduksi oleh Aspergillus niger adalah oxalic acid dan kojic acid yang merupakan mikotoksin yang bersifat akut. Pada kasus tumbuhan yang terinfeksi Aspergillus niger dapat mengalami kebusukan yang menyebabkan perubahan tekstur, bentuk, warna serta mengeluarkan bau busuk. Keadaan
lingkungan yang tidak terkontrol merupakan faktor yang memicu pertumbuhan Aspergillus niger (Summerbell and Kane 1988).
Tidak hanya merugikan ikan dan tumbuhan, Aspergillus niger merupakan salah satu fungi yang mempunyai nilai ekonomis. Aspergillus niger diketahui sebagai penghasil asam sitrat terbaik yang banyak digunakan di industri. Seperti penggunaan asam sitrat pada industri pangan dan minuman karena daya larut besar, toksisitas rendah serta memiliki rasa yang lembut (Summerbell and Kane 1988).
2.3 Pemeriksaan Fungi pada Ikan a) Metode Slide Culture
Pengamatan isolat fungi dilakukan melalui dua tahap. Tahap pertama yaitu, pengamatan fungi secara makroskopis yang meliputi pengamatan terhadap warna dan bentuk koloni. Tahap kedua yaitu, pengamatan secara mikroskopis yang dilakukan dengan membuat slide preparation. Salah satu metode yang digunakan adalah slide culture yang meliputi pengamatan terhadap bentuk hifa, bentuk spesies fungi, dan ukuran spora (Balai karantina Ikan, 2011c).
object glass serta tutup dengan cover glass. Cawan petri tersebut diinkubasi pada
suhu ruangan selama kurang lebih empat hari atau sampai tumbuh fungi. Setelah empat hari atau sampai fungi tumbuh amati fungi yang tumbuh di atas mikroskop dengan cara meneteskan Lactophenol cotton Blue pada object glass sebanyak satu tetes kemudian cover glass yang sudah di tumbuhi fungi diletakkan pada object glass tersebut dan diamati di bawah mikroskop dan fungi tersebut sudah dapat
untuk diidentifikasi (Balai Karantina Ikan, 2011c).
b) Metode Heinrich’s
Selain metode slide culture, terdapat metode lain yang dapat digunakan untuk proses pengamatan fungi yaitu metode Heinrichn’s. Metode ini dimulai dengan mempersiapkan peralatan. Peralatan yang digunakan harus dalam keadaan steril. Pertama-tama di siapkan object glass, cover glass, tissue basah yang dimasukkan dalam cawan dan disterilkan dengan autoklaf. Setelah selesai sterilisasi diberikan lilin (paraffin petrolatum) steril pada sebelah kiri dan kanan tempat yang akan ditutup cover glass. Tutup dengan cover glass lalu diteteskan suspensi spora fungi dalam media cair pada media cover glass yang tidak diberi lilin. Berikan sampai setengah luasan cover glass. Cover glass ditekan sampai media merata. Inkubasi pada suhu kamar selama 3x24 jam. Preparat diambil dan diamati di bawah mikroskop (Pradhika, 2008). Identifikasi merupakan membandingkan isolat yang belum diketahui dengan taksa yang ada untuk menetapkan identitasnya (Weitzman, 1991).
III KERANGKA KONSEPTUAL 3.1 KERANGKA KONSEPTUAL
Berkembangnya budidaya ikan hias khususnya ikan maskoki di dalam negeri merupakan suatu tantangan untuk meningkatkan produksi secara berkesinambungan. Upaya untuk meningkatkan produksi ikan hias telah dilakukan antara lain memperbaiki manajemen pemeliharaan yang meliputi manajemen kualitas air, pakan dan penanggulangan penyakit.
Kendala yang dihadapi dalam budidaya ikan hias salah satunya adalah infeksi jamur. Ikan yang terserang fungi akan ditumbuhi oleh benang-benang halus seperti kapas pada tubuhnya (Yanovsky, 1967). Fungi akan merusak jaringan luar tubuh ikan karena luka atau penyakit lain. Munculnya fungi disebabkan oleh adanya stres karena buruknya kualitas air, padat tebar serta teknik budidaya yang tidak diperhatikan yang menyebabkan perubahan. Perubahan tersebut menyebabkan terganggunya keseimbangan lingkungan dan menurunkan daya tahan tubuh ikan (Bruno and Wood, 1994).
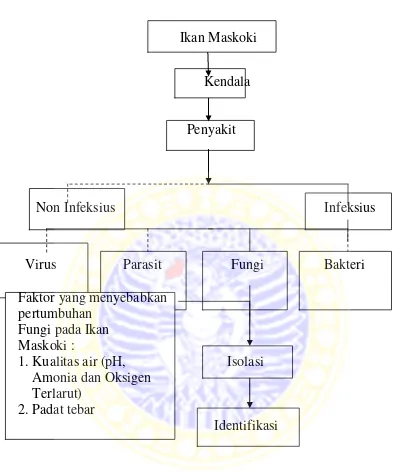
Keberadaan fungi ini akan merusak pemandangan pada ikan maskoki tersebut dan akan memberikan dampak negatif bagi para pembudidaya. Untuk itu, perlu dilakukan penelitian untuk mengetahui jenis fungi apa saja yang menyerang ikan maskoki, yang digunakan sebagai data acuan untuk memberantas penyebaran jamur pada ikan maskoki. Kerangka konseptual penelitian dapat dilihat pada gambar 3.1
Kerangka Konseptual Penelitian
Ikan Maskoki
Kendala
Penyakit
Non Infeksius Infeksius
Virus
Parasit FungiBakteri
Faktor yang menyebabkan
pertumbuhan
Fungi pada Ikan
Maskoki :
1. Kualitas air (pH, Isolasi
Amonia dan Oksigen
Terlarut)
2. Padat tebar
Identifikasi
IV METODE PENELITIAN 4.1 Tempat dan Waktu Pelaksanaan
Penelitian dilaksanakan di Laboraturium Balai Karantina Ikan, Kelas I Juanda Surabaya, dan pengambilan sampel ikan mas koki diambil di bursa ikan hias Gunung Sari Surabaya pada bulan Agustus 2014
4.2 Materi Penelitian 4.2.1 Alat Penelitian
a. Peralatan untuk pengambilan sampel.
Peralatan yang digunakan untuk mengambil sampel yaitu jaring kecil, baskom, cawan petri.
b. Peralatan untuk identifikasi fungi
Perlatan yang digunakan untuk proses identifikasi fungi yaitu mikroskop cahaya, pinset, bunsen, selotip, gunting bedah, pisau bedah, cawan petri, ose, beker glass, Object glass, autoklaf, thermometer, pH meter, DO meter, Amonia meter dan termometer, elenmeyer, Laminar air flow.
4.2.2 Bahan Penelitian
Bahan yang diperlukan untuk proses identifikasi fungi adalah ikan sampel berupa ikan mas koki sebanyak 25 ekor, di ambil secara acak dari setiap pedagang ikan maskoki di bursa ikan hias Gunung Sari Surabaya Jawa Timur. Bahan yang digunakan untuk penelitian ini adalah Sabouraud Dextrose Agar (SDA) menurut (Merck) dengan komposisi sebagai berikut: Peptic Digest of Animal Tissue 5.0g, Pancreatic Digest of Casein 5.0g, Dextrose 40.0g, Agar 15,0g. Lactophenol blue, akuades steril, Streptomicyin, dan Alkohol 70%.
4.3.1 Rancangan Penelitian
Penelitian ini menggunakan metode survey melalui pengambilan sampel pada lokasi secara langsung untuk mengidentifikasi jenis fungi pada ikan maskoki (Carassius auratus). Lokasi pengambilan sampel ikan ditentukan dengan cara sengaja atau dengan metode purposive sampling (random sampling) terhadap ikan dari beberapa lokasi di bursa ikan hias Gunung Sari Surabaya, Jawa Timur.
4.3.2 Prosedur Penelitian
a. Persiapan alat dan media SDA (Sabouraud Dextrose Agar)
Media SDA merupakan media yang digunakan untuk mengisolasi fungi. Tahap awal dari persiapan media ini adalah sterilisasi peralatan yang akan digunakan. Sterilisasi merupakan suatu proses untuk mematikan atau menghilangkan semua jasad renik yang ada, sehingga jika ditumbuhkan di dalam suatu media tidak ada lagi yang dapat berkembang biak (Hall, 1992).
Komposisi media SDA terdiri dari SDA 65g/1 liter akuades dipanaskan sampai mendidih mengunakan hot plate stirer larutan SDA dimasukkan autoklaf pada suhu 1210C dengan tekanan 1 atm selama 15 menit, kemudian ditambahkan antibiotik Streptomycin yang berfungsi sebagai penghambat pertumbuhan bakteri setelah itu dituangkan kedalam petri (Balai Karantina Ikan, 2011).
b. Pengambilan sampel Ikan Mas Koki
Pengambilan sampel ikan mas koki (Carassius auratus) dengan ukuran 4-7 cm diambil dari beberapa lokasi di bursa ikan hias Gunung Sari Surabaya Jawa Timur. Pengambilan sampel ikan mas koki dilakukan secara acak dengan menggunakan jaring kecil dari setiap pedagang ikan maskoki di bursa ikan hias Gunung Sari Surabaya, selanjutnya jamur yang ada pada tubuh ikan mas koki siap untuk diisolasi pada media SDA.
c. Isolasi Fungi pada Ikan Mas koki (Carassius auratus)
Fungi yang terdapat pada ikan maskoki bila dilihat secara makroskopis terdapat benda seperti kapas yang terdapat pada bagian sirip maupun kulit ikan (Hirschhorn, 1989). Fungi tersebut diisolasi menggunakan pinset dan kemudian ditanam pada media SDA kemudian diinkubasi pada suhu 25oC selama 3-4 hari (Weitzman, 1991).
diisolasi pada media SDA baru dan diinkubasi pada suhu 25oC selama 2-7 hari untuk mendapatkan isolat murni.
d. Pemeriksaan Sampel dan Identifikasi Fungi
Fungi yang sudah dimurnikan siap untuk dilakukan identifikasi. Teknik identifikasi yang digunakan untuk mengamati isolat fungi adalah metode selotip dimulai dengan menyiapkan object glass kemudian ditetesi dengan larutan lactophenol blue sebanyak satu tetes. Kemudian selotip diambil secukupnya lalu ditempelkan pada fungi yang tumbuh pada media. Selotip tersebut ditempelkan pada object glass yang sudah ditetesi dengan lactophenol blue lalu ditutup mengunakan cover glass diamati di bawah mikroskop dengan pembesaran 100 dan 400X dan fungi yang terlihat dapat diidentifikasi (Balai karantina Ikan, 2011). Identifikasi fungi menggunakan teknik identifikasi secara konvensional yang meliputi dua tahap yaitu pengamatan fungi secara makroskopis dan mikroskopis. Pengamatan secara makroskopis meliputi bentuk koloni dan warna koloni sedangkan pengamatan secara mikroskopis meliputi bentuk hifa, bentuk spora, letak spora dan identifikasi dilakukan menurut prosedur identifikasi Yuasa dkk (2003).
Bagan Prosedur Kerja
Sampel Ikan Maskoki panjang tubuh 4-7cm Isolasi fungi (media SDA) Inkubasi pada suhu kamar 25oC selama 2-3 hari
Jenis Fungi Analisis data
4.3.3 Parameter Penelitian a. Parameter Utama
Parameter utama yang diamati adalah isolasi dan identifikasi jenis Genus, Spesies fungi pada ikan Maskoki (Carassius auratus). dengan acuan kunci determinasi.
b. Parameter penunjang
Parameter penunjang merupakan parameter yang menunjang parameter uji utama. Parameter penunjang diantaranya pH, temperatur, amonia dan Oksigen terlarut. Pengujian parameter penunjang di dapat dari air setiap akuarium yang berisi sampel ikan Maskoki (Carassius auratus).
4.3.4 Analisis Data
V HASIL DAN PEMBAHASAN
5.1 Hasil Penelitian
5.1.1 Identifikasi dan Isolasi Fungi pada Ikan Maskoki Tabel 1. Hasil Identifikasi dan Isolasi Fungi pada ikan Maskoki :
zoospora yang panjang (Weitzman, 1991)
Hasil identifikasi fungi pada ikan Maskoki ditemukan 4 spesies yaitu: Aspergillus flavus, ditemukan pada lokasi A, D, dan F; Penicillium, ditemukan pada lokasi C dan E; Saprolegnia sp,ditemukan pada lokasi F; Aspergillus niger, ditemukan pada lokasi F. Jamur pada ikan Maskoki yang ditemukan pada penelitian ini yaitu Aspergillus flavus, Aspergillus niger, Penicillium, Saprolegnia sp. Berikut jamur yang ditemukan pada penelitian ini:
1. Aspergillus flavus
Menurut Summerbell and Kane (1998), klasifikasi Aspergillus flavus adalah sebagai berikut:
Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Aspergillus Spesies : Aspegillus flavus
Gambar 5.1 Koloni Aspergillus flavus pada media SDA (Dokumen pribadi, 2014)
Secara mikroskopis Aspergillus flavus memiliki ciri-ciri yaitu, memiliki konidiofor yang panjang, vesikel dan konidia yang berbentuk bulat. Aspergillus flavus memiliki konidiofor yang panjangnya 400-800 µm dan cenderung kasar,
vesikel bulat dengan diameter 25-45 µm, phialids berada di atas vesikel dan memiliki konidia yang bulat, halus atau kasar. Bagian-bagian Aspergillus flavus secara mikroskopis dapat dilihat pada gambar 5.2.
Gambar 5.2 Bagian-bagian Aspergillus flavus secara mikroskop dengan pembesaran 1000X. (Dokumen pribadi, 2014)
Keterangan : A; konidia, B; Phialid, C; Metula, D; Vesicule, E; Konidiofor A
B
C
D
2. Aspergillus niger
Menurut Zhao et al.(2009), klasifikasi Aspergillus niger adalah sebagai berikut:
Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichomaceae Genus : Aspergillus Spesies : Aspergillus niger
Hasil identifikasi yang telah dilakukan Aspergillus niger secara makroskopis memiliki ciri-ciri yaitu, memiliki koloni yang berwarna hitam dan pada bagian pinggir berwarna putih. Koloni Aspergillus niger berwarna hitam. Koloni dari Aspergillus niger dapat dilihat pada gambar 5.3
Gambar 5.3 Koloni Aspergillus niger pada media SDA (Dokumen pribadi, 2014)
berwarna coklat sampai hitam, kasar dan bulat dengan diameter 6-7 µm. Bagian-bagian Aspergillus niger secara mikroskopis dapat dilihat pada gambar 5.4
Gambar 5.4 Bagian-bagian Aspergillus niger secara mikroskop dengan pembesaran 400X. (Dokumen pribadi, 2014)
Keterangan : A; Konidiofor, B; Sporangium, C; Phialid
3. Saprolegnia
Menurut Bruno and Wood (1994), Klasifikasi Saprolegnia adalah sebagai berikut:
Phylum : Oomycota Class : Oomycotea Ordo : Saprolegniales Family : Saprolegniaceae Genus : Saprolegnia
Hasil identifikasi yang telah dilkukan Saprolegnia secara makroskopis memiliki ciri-ciri yaitu, koloni seperti kapas dan berwarna putih. Genus Saprolegnia memiliki ciri yaitu, terdapat koloni yang menyerupai kapas, berwarna
putih dan koloni tersebut dapat ditemukan pada permukaan kulit, sirip dan insang. Koloni Saprolegnia dapat dilihat pada gambar 5.5.
A
Gambar 5.5 Koloni Saprolegnia pada media SDA (Dokumen pribadi, 2014)
Secara makroskopis Saprolegnia memiliki ciri-ciri yaitu, memiliki hifa yang tidak bersepta dan memiliki zoospora di dalam tubuh. Saprolegnia merupakan jamur yang memiliki hifa panjang yang tidak bersepta, reproduksi secara aseksual yang menghasilkan zoospora yang panjang, ramping dan berflagel. Selain itu, zoospora genus Saprolegnia dihasilkan dari hifa yang panjang. Zoospora Saprolegnia yang panjang dan silindris memiliki panjang 180-350 µm dengan lebar 20-24 µm. Bagian-bagian Saprolegnia secara mikroskopis dapat dilihat pada gambar 11.
Gambar 11. Bagian-bagian Saprolegnia secara mikroskopis dengan pembesaran 400X. (Dokumen pribadi, 2014)
Keterangan : A; Hifa, B; Konidiofor, C; Sporangium A
B
4. Penicillium glabrum
Menurut Summerbell and Kane (1998), klasifikasi Penicillium glabrum adalah sebagai berikut:
Phylum : Ascomycota Class : Euascomycetes Ordo : Eurotiales Family : Trichomaceae Genus : Penicillium
Spesies : Peniccilium glabrum
Hasil identifikasi yang telah dilakukan Penicilliun glabrum secara makroskopis memilki ciri-ciri yaitu, memiliki koloni berbentuk bulat kecil, berwarna hijau tua, dan pinggirannya terdapat benang-benang putih. Penicillium glabrum memiliki koloni yang berwarna hijau, hijau keabuan dan tumbuh pada suhu 25oC. Koloni Penicillium glabrum dapat dilihat pada gambar 5.7.
Gambar 5.7 Penicillium glabrum pada media SDA (Dokumen pribadi, 2014)
membentuk badan spora yang disebut konidium. Konidium ini memiliki tangkai yang disebut phialid. Memiliki 10-12 phialid. Spora yang dihasilkan oleh phialid disebut dengan konidia. Konidia berbentuk bulat atau semi bulat yang membentuk rantai panjang dengan diameter 3-3,5 µm. Bagian-bagian Penicillium glabrum secara mikroskopis dapat dilihat pada gambar 5.8.
Gambar 5.8 Bagian-bagian Penicillium secara mikroskopis dengan pembesaran 1000X. (Dokumen pribadi, 2014)
Keterangan : A; Konidia, B; Phialid, C; Konidiofor 5.1.2 Nilai Kualitas Air
Hasil Pengukuran Kualitas air pada lokasi pengambilan sampel dapat dilihat pada tabel 2.
Tabel 2. Hasil pengukuran kualitas air
NO Parameter L1 L2 L3 L4 L5 L6
1. Suhu (oC) 33 31 33 31 33 33
2. DO (ppm) 2 2 4 6 4 2
3. Ph 8 7 7 7 7 7
4. Amonia (ppm) 1 0,25 1 0,25 1 0,25
Keterangan: A
B
L1 : Lokasi A, L2 : Lokasi B, L3 : Lokasi C, L4 : Lokasi D, L5 : Lokasi E, L6 : Lokasi F
Hasil pengukuran kualitas air pada lokasi pengambilan sampel menunjukkan,disi perairan yang masih dalam keadaan normal untuk kandungan Suhu, DO, pH, dan amonia. Data pengukuran kualitas air menunjukan nilai kisaran kualitas air yaitu: suhu 31-33oC, DO 2-6 ppm, pH 7-8 dan amonia 0,25-1 ppm.
5.2 Pembahasan
Fungi merupakan organisme eukariotik, tumbuh sebagai hifa atau sel khamir, memiliki dinding sel yang mengandung kitin, bersifat heterotrof, menyerap nutrient melalui dinding selnya dan mengekresikan enzim ekstraseluler ke lingkungan dan menghasilkan spora (Subandi, 2010).
Ikan yang terinfeksi fungi menujukkan gejala klinis seperti, terlihat adanya benda yang menyerupai kapas pada sirip dan permukaan kulit. Menurut, pernyataan Stoskopf (1993) yang meyatakan bahwa ikan yang terinfeksi jamur terlihat adanya benda yang menyerupai kapas pada permukaan kulit atau insang. Selain itu keberadaan jamur dalam jumlah banyak menyebabkan ikan yang terinfeksi mengalami kematian dan menyebabkan kerugian bagi para pembudidaya (Neish, 1977).
Fungi yang ditemukan pada penelitian ini yaitu Aspergillus flavus, Aspergillus niger, Penicillium, Saprolegnia. Menurut, Sheikh and Mughal (2012)
jamur pada ikan disebabkan karena perubahan lingkungan atau musim serta kurangnya perhatian terhadap kualitas air (Fadaeifard et al., 2011). Keberadaan fungi disebabkan karena lokasi tersebut tidak memperhatikan faktor lingkungan pemeliharaan ikan seperti, terdapat sisa pakan yang tidak dibersihkan dan tidak jarang pakan tersebut mengandung fungi yang akan membahayakan ikan Maskoki yang dibudidayakan. Menurut, Russo and Yanog (2010) yang menyatakan bahwa yang mengkonsumsi pakan yang berjamur dapat menyebabkan ikan tersebut terinfeksi dan apabila dalam jumlah banyak dapat menyebabkan ikan stres dan menurunkan sistem imun. Nabib dan Pasaribu (1989) menyatakan bahwa munculnya penyakit jamur disebabkan adanya perubahan lingkungan yang disebabkan oleh perubahan suhu, pemakaian antiboitika dan tingkat kebersihan kolam atau aquarium yang tidak diperhatikan yang menyebabkan terganggunya keseimbangan lingkungan dan menurunkan daya tahan tubuh ikan. Selain itu, Bruno and Wood (1994) yang menyatakan bahwa fungi yang menginfeksi ikan merupakan infeksi sekunder yang berasal dari infeksi bakteri, lingkungan perairan yang tidak diperhatikan, infestasi parasit, penanganan pasca panen, dan terlalu padatnya ikan pada perairan sehingga dapat menyebabkan sistem imun ikan menurun dan menyebabkan mudahnya ikan tersebut terinfeksi fungi.
V HASIL DAN PEMBAHASAN
5.1 Hasil Penelitian
5.1.1 Identifikasi dan Isolasi Fungi pada Ikan Maskoki Tabel 1. Hasil Identifikasi dan Isolasi Fungi pada ikan Maskoki :
zoospora yang panjang (Weitzman, 1991)
Hasil identifikasi fungi pada ikan Maskoki ditemukan 4 spesies yaitu: Aspergillus flavus, ditemukan pada lokasi A, D, dan F; Penicillium, ditemukan pada lokasi C dan E; Saprolegnia sp,ditemukan pada lokasi F; Aspergillus niger, ditemukan pada lokasi F. Jamur pada ikan Maskoki yang ditemukan pada penelitian ini yaitu Aspergillus flavus, Aspergillus niger, Penicillium, Saprolegnia sp. Berikut jamur yang ditemukan pada penelitian ini:
1. Aspergillus flavus
Menurut Summerbell and Kane (1998), klasifikasi Aspergillus flavus adalah sebagai berikut:
Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Aspergillus Spesies : Aspegillus flavus
Gambar 5.1 Koloni Aspergillus flavus pada media SDA (Dokumen pribadi, 2014)
Secara mikroskopis Aspergillus flavus memiliki ciri-ciri yaitu, memiliki konidiofor yang panjang, vesikel dan konidia yang berbentuk bulat. Aspergillus flavus memiliki konidiofor yang panjangnya 400-800 µm dan cenderung kasar,
vesikel bulat dengan diameter 25-45 µm, phialids berada di atas vesikel dan memiliki konidia yang bulat, halus atau kasar. Bagian-bagian Aspergillus flavus secara mikroskopis dapat dilihat pada gambar 5.2.
Gambar 5.2 Bagian-bagian Aspergillus flavus secara mikroskop dengan pembesaran 1000X. (Dokumen pribadi, 2014)
Keterangan : A; konidia, B; Phialid, C; Metula, D; Vesicule, E; Konidiofor A
B
C
D
2. Aspergillus niger
Menurut Zhao et al.(2009), klasifikasi Aspergillus niger adalah sebagai berikut:
Phylum : Ascomycota Class : Eurotiomycetes Ordo : Eurotiales Family : Trichomaceae Genus : Aspergillus Spesies : Aspergillus niger
Hasil identifikasi yang telah dilakukan Aspergillus niger secara makroskopis memiliki ciri-ciri yaitu, memiliki koloni yang berwarna hitam dan pada bagian pinggir berwarna putih. Koloni Aspergillus niger berwarna hitam. Koloni dari Aspergillus niger dapat dilihat pada gambar 5.3
Gambar 5.3 Koloni Aspergillus niger pada media SDA (Dokumen pribadi, 2014)
berwarna coklat sampai hitam, kasar dan bulat dengan diameter 6-7 µm. Bagian-bagian Aspergillus niger secara mikroskopis dapat dilihat pada gambar 5.4
Gambar 5.4 Bagian-bagian Aspergillus niger secara mikroskop dengan pembesaran 400X. (Dokumen pribadi, 2014)
Keterangan : A; Konidiofor, B; Sporangium, C; Phialid
3. Saprolegnia
Menurut Bruno and Wood (1994), Klasifikasi Saprolegnia adalah sebagai berikut:
Phylum : Oomycota Class : Oomycotea Ordo : Saprolegniales Family : Saprolegniaceae Genus : Saprolegnia
Hasil identifikasi yang telah dilkukan Saprolegnia secara makroskopis memiliki ciri-ciri yaitu, koloni seperti kapas dan berwarna putih. Genus Saprolegnia memiliki ciri yaitu, terdapat koloni yang menyerupai kapas, berwarna
putih dan koloni tersebut dapat ditemukan pada permukaan kulit, sirip dan insang. Koloni Saprolegnia dapat dilihat pada gambar 5.5.
A
Gambar 5.5 Koloni Saprolegnia pada media SDA (Dokumen pribadi, 2014)
Secara makroskopis Saprolegnia memiliki ciri-ciri yaitu, memiliki hifa yang tidak bersepta dan memiliki zoospora di dalam tubuh. Saprolegnia merupakan jamur yang memiliki hifa panjang yang tidak bersepta, reproduksi secara aseksual yang menghasilkan zoospora yang panjang, ramping dan berflagel. Selain itu, zoospora genus Saprolegnia dihasilkan dari hifa yang panjang. Zoospora Saprolegnia yang panjang dan silindris memiliki panjang 180-350 µm dengan lebar 20-24 µm. Bagian-bagian Saprolegnia secara mikroskopis dapat dilihat pada gambar 11.
Gambar 11. Bagian-bagian Saprolegnia secara mikroskopis dengan pembesaran 400X. (Dokumen pribadi, 2014)
Keterangan : A; Hifa, B; Konidiofor, C; Sporangium A
B
4. Penicillium glabrum
Menurut Summerbell and Kane (1998), klasifikasi Penicillium glabrum adalah sebagai berikut:
Phylum : Ascomycota Class : Euascomycetes Ordo : Eurotiales Family : Trichomaceae Genus : Penicillium
Spesies : Peniccilium glabrum
Hasil identifikasi yang telah dilakukan Penicilliun glabrum secara makroskopis memilki ciri-ciri yaitu, memiliki koloni berbentuk bulat kecil, berwarna hijau tua, dan pinggirannya terdapat benang-benang putih. Penicillium glabrum memiliki koloni yang berwarna hijau, hijau keabuan dan tumbuh pada suhu 25oC. Koloni Penicillium glabrum dapat dilihat pada gambar 5.7.
Gambar 5.7 Penicillium glabrum pada media SDA (Dokumen pribadi, 2014)
membentuk badan spora yang disebut konidium. Konidium ini memiliki tangkai yang disebut phialid. Memiliki 10-12 phialid. Spora yang dihasilkan oleh phialid disebut dengan konidia. Konidia berbentuk bulat atau semi bulat yang membentuk rantai panjang dengan diameter 3-3,5 µm. Bagian-bagian Penicillium glabrum secara mikroskopis dapat dilihat pada gambar 5.8.
Gambar 5.8 Bagian-bagian Penicillium secara mikroskopis dengan pembesaran 1000X. (Dokumen pribadi, 2014)
Keterangan : A; Konidia, B; Phialid, C; Konidiofor 5.1.2 Nilai Kualitas Air
Hasil Pengukuran Kualitas air pada lokasi pengambilan sampel dapat dilihat pada tabel 2.
Tabel 2. Hasil pengukuran kualitas air
NO Parameter L1 L2 L3 L4 L5 L6
1. Suhu (oC) 33 31 33 31 33 33
2. DO (ppm) 2 2 4 6 4 2
3. Ph 8 7 7 7 7 7
4. Amonia (ppm) 1 0,25 1 0,25 1 0,25
Keterangan: A
B
L1 : Lokasi A, L2 : Lokasi B, L3 : Lokasi C, L4 : Lokasi D, L5 : Lokasi E, L6 : Lokasi F
Hasil pengukuran kualitas air pada lokasi pengambilan sampel menunjukkan,disi perairan yang masih dalam keadaan normal untuk kandungan Suhu, DO, pH, dan amonia. Data pengukuran kualitas air menunjukan nilai kisaran kualitas air yaitu: suhu 31-33oC, DO 2-6 ppm, pH 7-8 dan amonia 0,25-1 ppm.
5.2 Pembahasan
Fungi merupakan organisme eukariotik, tumbuh sebagai hifa atau sel khamir, memiliki dinding sel yang mengandung kitin, bersifat heterotrof, menyerap nutrient melalui dinding selnya dan mengekresikan enzim ekstraseluler ke lingkungan dan menghasilkan spora (Subandi, 2010).
Ikan yang terinfeksi fungi menujukkan gejala klinis seperti, terlihat adanya benda yang menyerupai kapas pada sirip dan permukaan kulit. Menurut, pernyataan Stoskopf (1993) yang meyatakan bahwa ikan yang terinfeksi jamur terlihat adanya benda yang menyerupai kapas pada permukaan kulit atau insang. Selain itu keberadaan jamur dalam jumlah banyak menyebabkan ikan yang terinfeksi mengalami kematian dan menyebabkan kerugian bagi para pembudidaya (Neish, 1977).
Fungi yang ditemukan pada penelitian ini yaitu Aspergillus flavus, Aspergillus niger, Penicillium, Saprolegnia. Menurut, Sheikh and Mughal (2012)
jamur pada ikan disebabkan karena perubahan lingkungan atau musim serta kurangnya perhatian terhadap kualitas air (Fadaeifard et al., 2011). Keberadaan fungi disebabkan karena lokasi tersebut tidak memperhatikan faktor lingkungan pemeliharaan ikan seperti, terdapat sisa pakan yang tidak dibersihkan dan tidak jarang pakan tersebut mengandung fungi yang akan membahayakan ikan Maskoki yang dibudidayakan. Menurut, Russo and Yanog (2010) yang menyatakan bahwa yang mengkonsumsi pakan yang berjamur dapat menyebabkan ikan tersebut terinfeksi dan apabila dalam jumlah banyak dapat menyebabkan ikan stres dan menurunkan sistem imun. Nabib dan Pasaribu (1989) menyatakan bahwa munculnya penyakit jamur disebabkan adanya perubahan lingkungan yang disebabkan oleh perubahan suhu, pemakaian antiboitika dan tingkat kebersihan kolam atau aquarium yang tidak diperhatikan yang menyebabkan terganggunya keseimbangan lingkungan dan menurunkan daya tahan tubuh ikan. Selain itu, Bruno and Wood (1994) yang menyatakan bahwa fungi yang menginfeksi ikan merupakan infeksi sekunder yang berasal dari infeksi bakteri, lingkungan perairan yang tidak diperhatikan, infestasi parasit, penanganan pasca panen, dan terlalu padatnya ikan pada perairan sehingga dapat menyebabkan sistem imun ikan menurun dan menyebabkan mudahnya ikan tersebut terinfeksi fungi.
DAFTAR PUSTAKA
Alexopoulos, C. J, and C. W. Mims. 1979. Introductory Mycology. John willey And sons. New York-Chiechester-Brisbane-Toroto-Singapore.
Bachtiar, Y dan Tim Lentera, Mencemerlangkan Warna ikan maskoki, ArgoMedia Pustaka,2002
Balai Karantina Ikan. 2011a. Pembuatan Media SDA. Balai Karantina Ikan Kelas II.Tanujung Emas. Semarang.
Balai Karantina Ikan. 2011b. Teknik Identifikasi Jamur Metode Selotip. Balai Karantina Ikan Kelas II. Tanjung Emas Semarang.
Balai Karantina Ikan. 2011c. Teknik Identifikasi Jamur Metode Slide Culture. BalaiKarantina Ikan Kelas II. Tanjung Emas. Semarang.
Blezer, V. S., J. H. Lilley., W. B. Schill., Y, Kiryu., C. L. Desmore., V. Panyawachira., and S. Cinabut. 2002. Aphanomyces invadansi in Atlantic Menhaden along the East Coast of the United State.Aquaculture Health. 14:1-10.
Bruno, D.W., and B. P. Wood 1994. Saprolegnia and other Oomycetes. In Fish Diseases and Disorders, Volume 3, Viral, Bacterial and Fungal Infections. Edited by P.T.K. Woo and D.W. Bruno. Cabi Publishing. Wallingford. Oxon.United Kingdom. Pp. 599-659.
Dana, D. dan Angka, 1990. “Masalah Penyakit Parasit dan Bakteri pada Ikan Tawar Serta CaraPenaggulangannya”. Prosiding Seminar Nasional II, Penyakit Ikan dan Udang. Balai Penelitian Perikanan Air Tawar, Pusat Penelitian dan Pengembangan Perikanan, Bogor.
Dewi. R. R. 2011. Pengendalian Saprolegnia sp. Pada telur ikan Menggunakan BakteriKitinolotik. Tesis. Program Studi Magister Biologi. Fakultas Matematika dan IlmuAlam. Universitas Sumatra Utara. Medan.72 Hal. Effiong, B. N., And S. P. Alaties. 2009. Effect Of Mold Infested Feeds On The
Growth And Survival Of Heterobranchus longifilis Fingerlings. Report And Opinion 1(3):9-14.
Fadaeifard, F., M. Raissy., H. Bahrami., E. Rahmi., A. Najafipoor. 2011. Freshwater Fungi Isolated from Eggs and Broodstock with an Emphasis on Saprolegnia in rainbow trout Frams in West Iran.Microbio 4(22):3647-3651.
Gay, L. R. and Diehl, P.L. 1992. Research Methods for Business and Management.Macmillan Publising. New York.
Graham, D. 2005. Saprolegniasis. Fish Diseases Unit. Disease Surveillance and Investigation.Veterinary Sciences Division. Departement of Agriculture and Rural Development.Stoney Road. Stormont. Belfast BT4 3SD. Northem Ireland.
Hamdiyanti, Y., Ammi dan Kusnadi, 2003. Petunjuk Praktikum Mikrobiologi. Fakultas Farmasi Universitas Indonesia. Jakarta. hal 49-53
Handajani, A. dan S. Samsundari. 2005. Parasit dan Penyakit Ikan. Muhammadiyah University Press. Malang. 201 hal.
Hall, G.S., K. Pratt-Rippin, J.A. Washington. 1992. Evaluation of Chemiluminescent probe assay for identification of Hitoplasma Capsulatum isolate. Journal of Clinical Microbiology 30:3003-3004. Hirschhorn, H. H. 1989. Handbook of Fish Disease. TFH Publication. United
StatesOf America. 160 P.
Hoog, G.S. de. 1983. On the potentially pathogenic dematiaceous Hyphomycetes. pp. 149-216 In D.H. Howard (ed.), Fungi Phatogenic for humans and animals. Marcel Dekker, New York.
Hussein, M. M. A., K. Hatai., and T. Nomura. 2001. Saprolegniosis in salmonids And their eggs in Japan. Journal of Wildlife Diseases. 37(1) 204-207. Irkin, R and M. Korukluoglu. 2007. Control of Aspergillus Niger with garlic,
Onion and leek extracts. African. Journal of Biotecnology. 386 Balikesir University. Turkey vol. 6 (4), pp. 384-387.
Iswanto, A. H. 2009. Identifikasi Jamur Perusak Kayu. Karya Tulis. Departemen Kehutanan. Fakultas Pertanian. Universitas Sumatra Utara. 13 Hal
Jantrarotai, W and R.T. Lovell. 1990. Subchronic Toxicity of Dietary Aflatoxin B1 to Channel catfish. Aquatic Animal 2: 248-251.
Larone, D. H. 2002. P. 175 and 266. Medically Important Fungi. 4th ed. ASM Press. Washington, DC.
Lilley, J. H., M. J. Phillips and K. Tonguthai. 1992. A Reviw of Epizootic Ulcerative Syndrome (EUS) in Asia Aquatic Animal Health. Research Institute- Kasetsart.University Campus. Bangkok. 73 p.
Lilley, J. H., R. B. Callinan., S. Chinabut., S. Kanchanakhan., I. H. Macrae and M.J.Phillips. 1998. Epizootic Ulcerative Syndrome (EUS) Technical Handbook.Aquatic Animal Health Research Institute. Bangkok. Thailand. Lingga, P., dan Susanto, 2003. Ikan Hias Air Tawar (Edisi Revisi). Penebar
Swadaya. Jakarta. 238 hal.
Moser, S.A., F.L. Lyon, D.L. Greer. 1988. Systemic mycoses, pp. 173-238. In B.B. Wentworth (ed.), Diagnostic Prosedures for mycotic and parasitic Infection American Public Health Association, .Washington, D.C.
Murray, P. R., E. J. Baron., J. H, Jorgensen., M. L. Landry., and M. A. Pfaller., 2007.Manual of Clinical Mikrobiology. 9th Edition. Washington, D.C ASM Press.pp. 1726
Nabib, R dan F. H, Pasaribu. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan dan Kebudayaan, Direktorat Jendral pendidikan Tinggi. IPB. Bogor. 158 hal.
Neish, G. W. 1997. Observations on Saprolegniasis of Adult Sockeye Salmon, Oncorhynchus nerka. Fish. 10:513-522.
Nevarez, L., V. Vasseur., A. LeMadec., M. A. Lebras., L. Coroller., I. Leguerinel., G. Barbie. 2009. Physiological Traits of Penicillium Strain LPC 08.5568, a Filamentous Fungus Isolated from Bottled Aromatised Mineral Water. Food Microbio. 130(3):166-171.
Pascod, M. B. 1973. Investigation of Rational Effluent and Stream Standarts for Tropical Countries. Asean Institute of Technology. Bangkok. 54pp.
Pelczar, M. dan E. C. S. Chan. 1986. Dasar-dasar mikrobiologi. Universitas Indonesia. Jakarta. 443 hal.
Pickering, A. D., Willoughby, L. G., 1982. Saprolegnia infection of salmonid Fish. In: Roberts, R. J. (Ed.), Microbial Diseases of Fish. Academic Press London, pp. 271-297.
Pradhika, I. 2008. Mikrobiologi Dasar. http://www.repository.usu.ac.id 03 Maret
Samson, R. A., J. I. Pitt. 2000. Intergration of Moderen Taxonomic Methods for Penicillium and Aspergillus Classofication. Harwood Scientific Publishers. Amsterdam.
Samson, R. A., Frisvad, J. C. 2004. Penicillium Subgenus Penicillium: New Taxonomic Schemes, Mycotoxins and Other Extrolites. Study Mycology. 49:1-173.
Sayuti, 2003. Budidaya Koki. Pengalaman dari Tulungagung. Agromedia Pustaka. Sheikh, U and Mughal, R. 2012. Fungal Infections in Some Economically
Important Freshwater Fishes. Pakistan Veteriner Journal, 32(3):422-426. Sharma, O. P. 1989. Text Book of Fungi. Matta Me Graw-Hill. New Delhi.
Sigler, L., J.W. Carmichael. 1983. Redisposition of some fungi referred to Oidium microspermum and a review of Arthrographis. Microbiology 18:495-507. Steel, R. G. D dan J. H. Torrie. 1993. Prinsip Prosedur Statistika. Terjemahan
Oleh Bambang Sumantri. Gramedia Pustaka.
Stoskopf, M. K. 1993. Fish Medicine. WB Saunders Company. Mexico. Subandi. 2010. Mikrobiologi. PT Remaja Rosdakarya. Bandung. Hal 91
Summerbell, R.C., S.A. Rosenthal and J. Kane. 1988. Rapid method for Differention of Trichophyton rubhum, Trichophyton mentagrophytes, And related dermatophyte species. Journal of Clinic Microbio 26:2279-2282. Susanto, 1989. Maskoki. Penebar Swadaya. Jakarta. 150 hal.
Vandenberg, G. 2008. Evaluation of Antifungal Activity of CHCx Formulaion Against Saprolegnia Paracitica. Research Report. Canada.
Vedca, 2009. Teknologi Pengelolaan Kualitas Air. Bogor. 37 hal.
Weitzman, I., J. Kane. 1991. Dermatophytes and agents of superficial mycoses, pp. 601-616, In A. Balows, W.J. Hausler jr., K.L. Herrmann, H.D. Isenberg, H.J. Shadomy. Manual of Clinical Microbiology, 5th ed. American Society for Mycrobiology, Washington, D.C.
Wheeler. E.L., and R.R. Ferrel, 1971. Habitat Carassius auratus, Cereal Chem 48: 230-312.
Willoughby, L. G. 1994. Fungi and Fish Disease. Pisces Stirling. 57 P.
Wogu, M. D., and A. D. Lyayi, 2011. Mycoflora of Some Smoked Fish Varieties In Benin City Nigeria. Ethiopian Env Studies and Management (4):1-3. Yanovsky, E.G. 1967. On the biology of common carp in the Ural Riverln:
Biological principles of the fisheries in Middle Asia and Kazakhstan. Balkhash. Pp. 319-320.
Yuasa, K., N. Panigro., M. Bahnan. dan E. B. Kholidin. 2003. Panduan Diagnosa Penyakit Ikan : Teknik Diagnosa Penyakit Ikan Budidaya Air Tawar di Indonesia.Japan Intrnasional Cooperation Argency dan Balai Budidaya Air Tawar.Jambi. Hal 49-54
Zhao, K., W. Ping., Q. Li., S. Hao., T. Gao and D. Zhou. 2009. Aspergillus niger Var. taxi, a New Species Variant of Taxol-Producing Fungus Isolated from Taxus Cuspidate in China. Journal Microbiology. (2009):1202-1207.
Lampiran
Imersol Aquades Sreril
Hecting Set Selotip
Suhu dan PH Meter Digital Ammonia Meter
Media SDA Metode Slide
Sample Ikan Maskoki Pengambilan Sample pada sisik dan insang
Penanaman sample pada Media SDA dan PDA Sample yang siap diidentifikasi
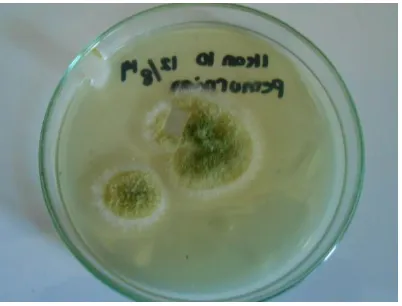
Jenis Fungi Penicillium Jenis Fungi