STUDI ELEKTROLISIS LARUTAN KALIUM IODIDA
Oleh : Aceng Haetami
ABSTRAK
Telah dilakukan penelitian dengan judul : “Studi Elektrolisis Larutan Kalium Iodida”. Penelitian ini bertujuan untuk mengetahui : waktu optimum, kuat arus optimum, dan batas konsetrasi terbentuknya iod (I2) pada elektrolisis larutan kalium iodida (KI). Penelitian ini menggunakan metode eksperimen dengan pendekatan pengukuran pH dan titrasi. Hasil penelitian menunjukkan bahwa secara visual hasil eletrolisis larutan KI ditandai dengan adanya : (1) gelembung I2 berwarna merah kecoklatan di sekitar anoda; (2) larutan berwarna merah muda di sekitar katoda yang telah ditetesi indikator PP. Sedangkan secara analitis reaksi ditandai dengan adanya kenaikan pH dari waktu ke waktu di sekitar katoda. Dari hasil analisis pada elektrolisis larutan KI diperoleh bahwa : (1) waktu elektrolisis optimum adalah 3, 4, 5, 6, dan 7 menit ; (2) kuat arus optimum adalah 4, 5 dan 6 mA; dan (3) batas konsetrasi terkecil dari larutan KI yang dapat menghasilkan iod (I2) adalah 0,0026 M.
Kata kunci : elektrolisis larutan KI, waktu dan kuat arus optimum, konsentasi minimum
PENDAHULUAN
Ilmu kimia merupakan salah satu cabang ilmu yang berlandaskan eksperimen, sehingga dalam mempelajarai ilmu kimia selain harus memahami konsep-konsep teoritis juga harus memahami prosedur eksperimen. Konsep teori ilmu kimia muncul dari keteraturan fakta eksperimen.
Perkembangan teknologi di berbagai bidang sangat pesat. Salah satunya terkait dengan bidang kimia yaitu elektrokimia. Elektrokimia adalah cabang ilmu kimia yang telah banyak memberi sumbangan bagi banyak hal dalam kehidupan manusia, misalnya proses elektrolisis. Elektrolisis merupaka proses yang penting dalam industri, sebab elektrolisis memiliki banyak kegunaan antara lain : pembentukan unsur-unsur logam yang tidak terdapat bebas di alam, pembuatan gas halogen, pembuatan gas oksigen dan hidrogen, pemurnian logam, dan penyepuhan (electroplating).
Salah satu garam yang dapat dielektrolisis adalah garam kalium iodida (KI). Garam ini dapat dielektrolisis baik larutannnya maupun leburannya. Jika larutannya dielektrolisis, pada anoda dihasilka iod (I2) dan di katoda dihasilkan ion hidroksida (OH─). Garam KI merupakan garam yang mudah diperoleh dan dalam penggunaannya sangat sederhana dan menarik, sehingga banyak digunakan dalam pelaksanaan praktikum khususnya elektrolisis di laboratorium.
Pada tahun 1833, Faraday menunjukkan bahwa jumlah zat-zat yang teroksidasi dan tereduksi pada elektroda-elektroda berbanding lurus dengan waktu dan jumlah kuat arus yang melalui sel elektrolisis tersebut. Berdasarkan Hukum Faraday tersebut, sedikitnya tiga permasalahan akan timbul pada elektrolisis larutan KI, yaitu : (1) berapa waktu optimum yang diperlukan; (2) berapa kuat arus optimum yang harus digunakan, dan (3) berapa batas minimum konsetrasi larutan KI yang bisa digunakan sehigga terbentuknya iod (I2) di katoda dan ion hidroksida (OH─) di katoda.
Permasalahan tersebut di atas, akan dijawab melalui penelitian “ Studi Elektrolisis Larutan Kalium Iodida” , sehingga diharapkan tidak terjadi lagi pemborosan waktu, energi listrik, dan penggunaan garam KI di laboratorium.
METODE PENELITIAN Bahan dan Alat yang Digunakan
Bahan yang digunakan adalah garam KI, larutan HCl, larutan NaOH, larutan asam oksalat (H2C2O4), CHCl3, aquadest, dan indikator PP. Sedangkan alat yang digunakan adalah tabung U, elektroda karbon, power supply, tabung reaksi, labu erlenmeyer, pipet volum, timbangan analitik, buret, pipit tetes, dan pH meter.
Prosedur Penelitian
Pembuatan Larutan KI : larutian KI dibuat dengan variasi konsentrasi tertentu. Untuk penentuan waktu optimum dan kuat arus optimum digunakan konsentrasi larutan KI sebesar 0,25 M yang merupakan konsentrasi yang selama ini digunakan di
laboratorium. Untuk penentuan batas konsetrasi minimum digunakan larutan KI dengan konsentrasi bervariasi : 0,0010 M sampai dengan 0,0030 M atau hingga konsentrasi yang tidak menghasilkan lagi iod (I2) pada saat dielektrolisis. Prosedur Elektrolisis : larutan KI yang telah dibuat kemudian dimasukkan ke dalam tabung U masing-masing sebanyak 30 mL dan ditetesi indikator PP. Kemudian dipasang elektroda karbon pada tabung tersebut dan dihubungkan dengan power supply dengan kuat arus yang divariasikan (untuk penentuan kuat arus optimum) : 1, 2,, 3, 4, 5, 6, 7, 8, 9, dan 10 mA, sedangkan untuk penentuan waktu optimum dan batas konsentrasi minimum digunakan kuat arus 5 mA. Elektrolisis dilakukan selama 5 menit untuk penentuan kuat arus optimum dan batas konsentrasi minimum , sedangkan untuk penentuan waktu optimum digunakan waktu elektrolisis berturut-turut selama : 1, 2,, 3, 4, 5, 6, 7, 8, 9, dan 10 menit kemudian arus diputuskan. Adanya warna merah muda menunjukkan terbentuknya ion hidroksida di ruang katoda dan diukur pH nya dengan pH meter (untuk penentuan batas konsetrasi minimum larutan KI), sedangkan untuk penentuan waktu dan kuat arus optimum, pengukuran konsentrasi ion OH─ ditentukan melalui metode titrasi dengan larutan HCl yang telah distandarisasi. Pada ruang anoda, dengan cara yang sama diambil dan ditambahkan CHCl3. Terbentuknya dua lapisan merah-coklat menunjukkan terbentuknya iod (I2) pada ruang anoda.
HASIL DAN PEMBAHASAN A. Hasil Penelitian
Hasil pengamatan terhadap elektrolisis laruta KI teragkum dalam tabel 1 berikut ini :
Tabel 1. Hasil Pengamatan Elektrolisis Larutan KI
Elektroda Pengamatan
Anoda ■ Terbentuk warna kuning kecoklatan
■ Setelah ditambahkan CHCl3, terbentuk dua lapisan merah-coklat Katoda ■Terbentuk gelembung gas
Pengaruh waktu elektrolisis terhadap jumlah mol ion hidroksida yang dihasilkan pada elektrolisis larutan KI disajikan dalam tabel 2 berikut :
Tabel 2. Pengaruh Waktu Elektrolisis terhadap Jumlah Mol Ion Hidroksida Waktu
(menit)
Jumlah mol OH─ (dinyatakan dalam 10─6) Teoritis Hasil Penelitian
1 3,11 5,01 2 6,22 5,01 3 9,33 11,04 4 12,44 15,03 5 15,54 17,04 6 18,65 21,03 7 21,76 23,07 8 24,87 22,02 9 27,98 20,04 10 31,09 13,02
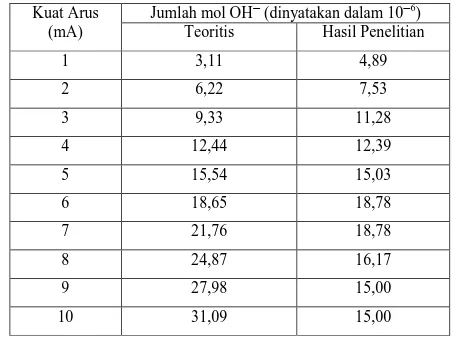
Sedangkan pengaruh kuat arus yang digunakan terhadap jumlah mol ion OH− yang dihasilkan pada elektrolisis larutan KI disajikan dalam tabel 3 berikut :
Tabel 3. Pengaruh Kuat Arus terhadap Jumlah Mol Ion Hidroksida Kuat Arus
(mA)
Jumlah mol OH─ (dinyatakan dalam 10─6) Teoritis Hasil Penelitian
1 3,11 4,89 2 6,22 7,53 3 9,33 11,28 4 12,44 12,39 5 15,54 15,03 6 18,65 18,78 7 21,76 18,78 8 24,87 16,17 9 27,98 15,00 10 31,09 15,00
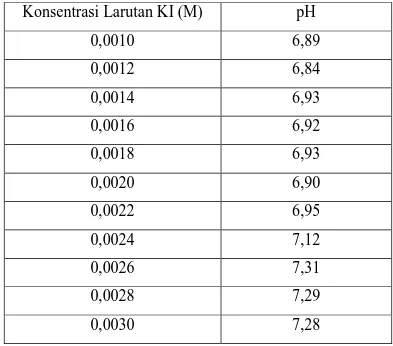
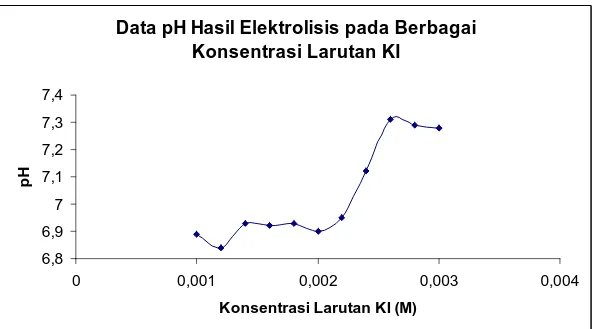
Adapun variasi konsetrasi larutan KI yang digunakan dan pH yang dihasilkan pada saat larutan KI dielektrolisis selama 5 menit dapat ditujukkan tabel 4 berikut :
Tabel 4. Data pH Hasil Elektrolisis pada Berbagai Konsentrasi Larutan KI Konsentrasi Larutan KI (M) pH 0,0010 6,89 0,0012 6,84 0,0014 6,93 0,0016 6,92 0,0018 6,93 0,0020 6,90 0,0022 6,95 0,0024 7,12 0,0026 7,31 0,0028 7,29 0,0030 7,28 B. Pembahasan
Berdasarkan pengamatan pada elektroda positif (anoda), terjadi oksidasi ion iodida (I─) menjadi iod (I2) sesuai dengan reaksi :
2I─ → I2 + 2e
Hal ini disebabkan karena potensial oksidasi standar I─ (E0oks= 0,54 V) lebih besar dari potensial oksidasi standar air (E0oks= ─ 1,23 V). Adanya I2 ditunjukkan dengan adanya gelembung berwarna kuning kecoklatan pada anoda dan setelah dimasukkan pada pelarut CHCl3 terbentuk dua lapisan.
Sedangkan pada elektroda negatif (katoda), terjadi reaksi reduksi H2O karena potensial reduksi standar air (E0red= ─ 0,83 V) lebih besar dari potensial reduksi standar ion K+ (E0red= ─ 2,93 V)
Adanya gas H2 ditunjukkan dengan adanya gelembug gas di ruang katoda dan terbentuknya OH− ditunjukkan dengan adanya warna merah muda disekitar katoda setelah ditetesi indikator PP.
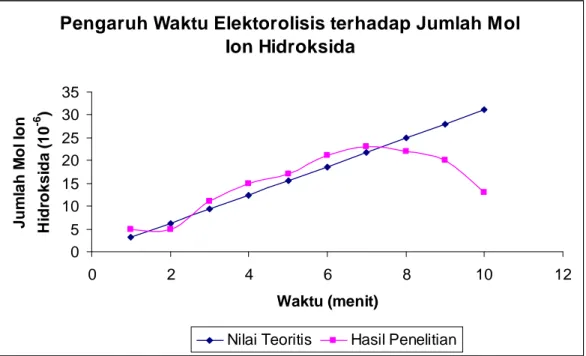
Pengaruh waktu terhadap jumlah mol ion hidroksida dapat dijelaskan dengan grafik 1 berikut :
Pengaruh Waktu Elektorolisis terhadap Jumlah Mol Ion Hidroksida 0 5 10 15 20 25 30 35 0 2 4 6 8 10 12 Waktu (menit) J u m la h M o l Io n H id ro k s id a ( 1 0 -6 )
Nilai Teoritis Hasil Penelitian
Gambar 1. Grafik Pengaruh Waktu Terhadap Jumlah Mol Ion Hidroksida Berdasarkan grafik tersebut dapat ditunjukkan bahwa jumlah mol ion hidroksida pada menit ketiga sampai menit ketujuh membentuk sebuah garis lurus dan sejajar (hampir berdekatan) dengan grafik standar . Hal ini berarti bahwa pada rentang waktu elektrolisis tersebut berlaku Hukum Faraday, sedangkan jumlah mol ion hidroksida pada menit pertama dan kedua tersebut tidak berlaku Hukum Faraday. Jumlah mol ion hidroksida pada menit ke-8, ke-9, dan ke-10 semakin lama semaki berkurang (tidak berlaku Hukum Faraday). Hal ini disebabkan karena pada waktu tersebut, konsentrasi io I− semakin kecil, sehingga di anoda, air ikut teroksidasi membentuk, ion H+ sesuai reaksi :
ion H+ yang terbentuk bereaksi dengan ion OH− membentuk air, sehingga mengurangi konsentrasi OH−
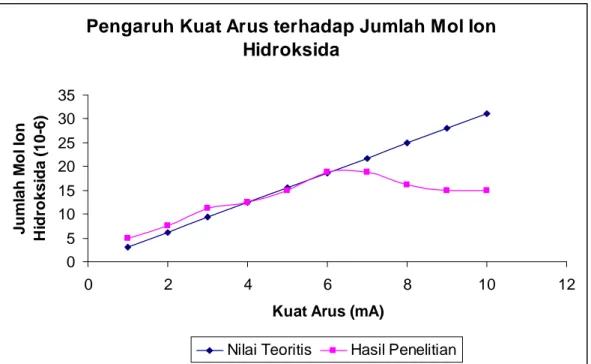
Pengaruh kuat arus yang digunakan terhadap jumlah mol ion hidroksida yang dihasilkan pada elektrolisis larutan KI dapat dijelaskan dalam grafik 2 berikut :
Pengaruh Kuat Arus terhadap Jumlah Mol Ion Hidroksida 0 5 10 15 20 25 30 35 0 2 4 6 8 10 12
Kuat Arus (mA)
J u m la h M o l Io n H id ro k s id a ( 1 0 -6 )
Nilai Teoritis Hasil Penelitian
Gambar 2. Grafik Kuat Arus Terhadap Jumlah Mol Ion Hidroksida
Berdasarkan grafik tersebut dapat ditunjukkan bahwa jumlah mol ion hidroksida pada kuat arus 4, 5, dan 6 mA membentuk sebuah garis lurus yang berimpit dengan grafik standar . Hal ini berarti bahwa pada rentang kuat arus tersebut berlaku Hukum Faraday, sedangkan jumlah mol ion hidroksida pada kuat arus 1, 2, 3 mA tidak berimpit dengan grafik standar, sehingga sedikit menyimpang dari Hukum Faraday. Jumlah mol ion hidroksida pada kuat arus 7, 8, 9, dan 10 semakin lama semakin berkurang (menyimpang dari Hukum Faraday). Hal ini disebabkan karena pada kuat arus tersebut, konsentrasi io I− semakin kecil, sehingga di anoda, air ikut teroksidasi membentuk ion H+ yang berakibat pada berkurangnya konsentrasi OH−
Adapun pH yang diperoleh dari masing-masing variasi konsentrasi laruta KI setelah dielektrolisis selama 5 menit dapat dilihat pada garafik 3 berikut :
Data pH Hasil Elektrolisis pada Berbagai Konsentrasi Larutan KI 6,8 6,9 7 7,1 7,2 7,3 7,4 0 0,001 0,002 0,003 0,004 Konsentrasi Larutan KI (M) p H
Grafik 3. Pengaruh Konsentrasi terhadap pH larutandi Katoda
Berdasarkan gambar 3 di atas dapat dikatakan bahwa pada interval konsentrasi 0,0026 M sampai dengan 0,00215 terjadi penurunan pH yang cukup signifikan dibandingkan dengan konsentrasi yang lainnya. Konsentrasi 0,0026 M merupakan konsentrasi transisi di mana di anoda bukan lagi ion iodida yang teroksidasi melainkan air, sehingga larutan hasil elektrolisis akan meningkat kesamaanya (pH turun) karena ion OH− yang dihasilkan di katoda diimbangi oleh ion H+ yang dihasilkan di anoda.
PENUTUP
Berdasarkan hasil penelitian dan pembahasan, maka dapat ditarik kesimpulan bahwa (1) waktu elektrolisis optimum adalah 3, 4, 5, 6, dan7 menit ; (2) kuat arus optimum adalah 4, 5 dan 6 mA; dan (3) batas konsetrasi terkecil dari larutan KI yang dapat menghasilkan iod (I2) adalah 0,0026 M..
Berdasarkan simpulan di atas, maka peneliti menyarankan bahwa untuk menghemat waktu dan energi listrik serta menghindarkan dari pemborosan bahan laboratorium , kepada para praktisi laboratorium, hendaknya pada elektrolisis larutan
KI menggunakan larutan KI dengan konsentrasi 0,0026 M dengan kuat arus 5 mA dan waktu elktrolisis 5 menit.
DAFTAR PUSTAKA
Atkins, P.W. 1999. Kimia Fisika. Edisi Keempat. Jilid 2. Penerbit Erlangga. Jakarta.
Emsley, J. 1991. The Elements. Second edition. Clarendon Press. Oxford.
Keenan, Kleinfelter dan Wood. 1984. Kimia untuk Universitas. Edisi Keenam. Jilid 2.
Oxtoby, Gills Dan Nachtrieb. 2001. Prinsip-Prinsip Kimia Modern. Edisi Keempat. Jilid 1. Penerbit Erlangga. Jakarta.
Petrucci, R. 1987. Kimia Dasar, Prinsip dan Terapan Modern. Edisi Keempat. Jilid 2. Penerbit Erlangga. Jakarta.