Bab II Tinjauan Pustaka
II.1 Deterjen
Secara umum istilah dari deterjen digunakan untuk bahan atau produk yang mempunyai fungsi meningkatkan kemampuan pemisahan suatu materi dari permukaan benda, misalnya kotoran dari pakaian, sisa makanan dari piring atau buih sabun dari permukaan benda serta mendispersi dan menstabilisasi dalam matriks seperti suspensi butiran minyak dalam fase seperti air (Showell, 2006). Kemampuan deterjen tersebut tergantung kepada komposisi dari formulanya, persyaratan penggunaan, sifat alami dari permukaan yang akan dibersihkan, sifat dari bahan yang akan dipisahkan. Oleh karena itu, penentuan formula deterjen merupakan proses yang rumit karena harus memperhitungkan beberapa hal, seperti kebutuhan pengguna, nilai ekonomi, pertimbangan lingkungan dan kemampuan spesifik yang dibutuhkan supaya fungsi deterjen menjadi efektif.
II.1.1 Kandungan Deterjen
Deterjen yang digunakan untuk keperluan rumah tangga dan industri menggunakan formula yang sangat kompleks yaitu lebih dari 25 bahan. Namun secara umum penyusun deterjen dikelompokan menjadi empat, yaitu surfaktan,
builders, bleaching agent dan bahan aditif (Smulders, 2002).
Surfaktan berfungsi untuk mengangkat kotoran pada pakaian baik yang larut dalam air maupun yang tak larut dalam air. Setelah surfaktan, kandungan lain yang penting adalah penguat (builders) yang meningkatkan efisiensi surfaktan.
Builders digunakan untuk melunakkan air sadah dengan cara mengikat
mineral-mineral yang terlarut, sehingga surfaktan dapat berfungsi dengan lebih baik. Selain itu, builders juga membantu menciptakan kondisi keasaman yang tepat agar proses pembersihan dapat berlangsung dengan lebih baik serta membantu mendispersikan dan mensuspensikan kotoran yang telah lepas. Senyawa kompleks
fosfat, natrium sitrat, natrium karbonat, natrium silikat atau zeolit dan fluorescent sering digunakan dalam builders.
Senyawa fosfat dapat mencegah menempelnya kembali kotoran pada bahan yang sedang dicuci. Senyawa fosfat yang digunakan oleh semua merk deterjen memberikan andil yang cukup besar terhadap terjadinya proses eutrofikasi yang menyebabkan alga blooming (meledaknya populasi tanaman air). Formulasi yang tepat antara kompleks fosfat dengan surfaktan menjadi kunci utama kehebatan daya cuci deterjen.
Menurut Connell (1995) berdasarkan sifat ionisasi senyawa aktifnya, surfaktan diklasifikasikan ke dalam 3 kelompok, yaitu :
1. Surfaktan anionik
Jenis ini memiliki sisi permukaan aktif negatif. Secara umum gugusnya adalah sulfat dan sulfonat yang dapat larut dalam air. Surfaktan yang tergolong ke dalam kelompok ini adalah sodium dodecylbenzene
sulphonate (SDS). Surfaktan anionik banyak digunakan dalam produk
pembersih pakaian dan peralatan rumah tangga, serta produk pembersih pribadi. Surfaktan jenis ini merupakan produk terbesar hingga saat ini.
Gambar II.1. Struktur dari SDS 2. Surfaktan kationik
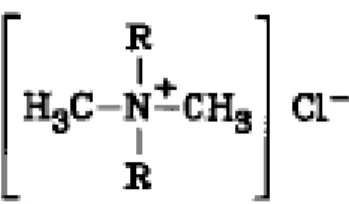
Jenis ini memiliki sisi permukaan positif. Senyawa utamanya yaitu alkil dengan gugus utama ammonium. Surfaktan yang tergolong jenis ini adalah dialkyldimethylammonium chlorides .
Gambar II.2. Struktur dari Dialkyldimethylammonium chlorides
3. Surfaktan nonionik
Jenis ini merupakan produk kondensasi alkilfenol atau alkohol lemak dengan etilenoksida. Surfaktan jenis nonionik banyak pula digunakan sebagai pembersih pakaian.
Gambar II.3. Struktur dari Ethylated Alkohol
Pada awalnya surfaktan (senyawa aktif) yang digunakan dalam komposisi deterjen yaitu dari jenis BAS (Branched Alkylbenzene Sulphonate) yang memiliki rantai karbon bercabang. BAS ini dikenal sebagai sebagai hard detergent karena sifatnya yang tahan penguraian biologis. Rantai cabang BAS inilah yang membuat BAS tidak terurai sehingga peningkatan konsentrasinya berjalan cepat. Oleh karena itu BAS dikenal sebagai senyawa pencemar yang toksik terhadap biota perairan (Connell, 1995).
Para ahli terus berusaha menemukan bahan aktif deterjen sintesis baru yang mudah terurai, akhirnya pada tahun 1965 mulai dikenal LAS (Linear Alkylbenzene
Sulphonate). Seperti halnya BAS, senyawa ini pun dibuat dari senyawa
hidrokarbon minyak bumi. Senyawa aktif LAS termasuk ke dalam kriteria surfaktan anionik yang memiliki rantai alkil lurus. Dengan struktur demikian LAS ini bila tidak segera terurai seluruhnya akibat akumulasi yang terus-menerus maka akan bersifat lebih toksik dibandingkan BAS. Struktur rantai alkilnya yang lurus membuat senyawa LAS ini lebih bersifat lipofilik sehingga menyebabkan kerusakan yang lebih besar pada membran sel. Sebagai surfaktan, LAS dapat menurunkan tegangan permukaan dan mengemulsi lemak sehingga dimanfaatkan
sebagai pelarut lemak dan denaturasi protein. Dengan sifat ini LAS berpotensi merusak membran sel organisme dan mematikan bakteri-bakteri yang berguna di perairan.
II.1.2 Mekanisme Deterjen sebagai Pembersih
Sebagai bahan aktif deterjen, surfaktan yang juga disebut zat aktif permukaan (surface active agent) memiliki kemampuan menurunkan tegangan permukaan cairan khususnya air dari sekitar 73 dyne/cm menjadi 30 dyne/cm. Selain itu kemampuan surfaktan membentuk gelembung serta pengaruh permukaan lainnya membuat surfaktan bertindak sebagai zat pembersih dan pengemulsi dalam industri dan rumah tangga. Secara struktur, surfaktan memiliki polaritas lipofilik dan hidrofilik. Kutub lipofilik terletak pada rantai alkil yang bersifat larut dalam minyak atau lemak, sedangkan kutub hidrofilik terletak pada gugus aril (yang mengandung garam) yang larut dalam air.
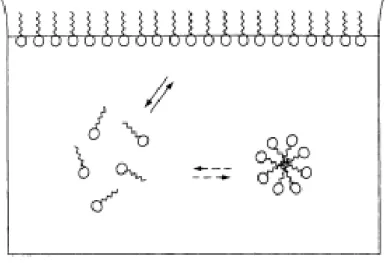
Gambar III.4. Kondisi gugus surfaktan dalam air
Kutub lipofilik cenderung muncul keluar dari fase air menghadap ke udara, sedangkan kutub hidrofilik menghadap ke fase air (Gambar II.3), yaitu tempat ion-ion bermigrasi menuju batas antara air-udara yang bekerja mengurangi energi bebas permukaan sehingga tegangan permukaan berkurang. Pada konsentrasi surfaktan yang cukup tinggi di air, gugus lipofilik saling tarik menarik dan membentuk agregat atau micelle, sedangkan gugus hidrofilik terdapat disebelah luar micelle. Dengan demikian zat yang lipofil dapat tertimbun dalam inti lipofilik
dari micelle dan dengan cara inilah kotoran dilarutkan (disolubilisasi). Mekanisme tersebut di atas memungkinkan surfaktan bertindak sebagai pembersih kotoran. Proses pembersihan oleh surfaktan terdiri atas tiga tahap, yaitu :
1. Pembahasan (wetting) kotoran oleh larutan deterjen 2. Lepasnya kotoran dari permukaan bahan
3. Pembentukan suspensi kotoran yang stabil.
Menurut Showell, 2006 mekanisme pembersihan kotoran (umumnya berupa tanah) terdiri beberapa tahapan, yaitu :
1. Perpindahan surfaktan ke interfase. Hal ini terjadi pada kondisi surfaktan dalam bentuk monomer, dimana kinetika perpindahannya sangat cepat (10-5 cm2/detik) atau juga terjadi pada kondisi surfaktan berbetuk agregat atau micelle dimana kinetika perpindahannya relatif lambat (10-7 cm2/detik). Kinetika perpindahan surfaktan dan adsorpsi pada permukaan dapat diukur dengan tegangan permukaan dinamik.
2. Adsorpsi surfaktan pada interfase air-tanah, interfase air-udara, dan interfase permukaan-air. Tahapan ini terjadi dengan menurunkan tegangan permukaan pada masing-masing interfase tersebut.
3. Membentuk kompleks surfaktan-tanah. Hal ini menunjukkan bahwa surfaktan akan menyelimuti tanah yang akan dipisahkan dalam satu lapisan atau pada konsentrasi surfaktan yang tinggi akan menghasilkan dua lapisan. Pada tahapan ini surfaktan dapat mendorong padatan tanah menjadi lunak dan berbentuk cairan. Tahapan ini merupakan tahapan yang kritis untuk menuju proses emulsi yang dapat terjadi jika tanah berbentuk cairan.
4. Desorpsi kompleks surfaktan-tanah. Untuk tanah yang berminyak, proses ini dapat terjadi melalui mekanisme penggulungan atau melalui pelarutan minyak menjadi agregat micelle dari surfaktan.
5. Perpindahan kompleks surfaktan-tanah menjauh dari permukaan. Pada tahapan ini tanah yang mengandung minyak dengan massa jenis yang lebih rendah dari air akan mengapung di permukaan. Padahal dibutuhkan
energi mekanik atau pengadukan untuk menjauhkan kompleks surfaktan-tanah dari permukaan.
6. Stabilisasi tanah yang terdispersi untuk mencegah terjadinya redeposisi
II.2. Proses Laundry
Laundry merupakan proses kompleks yang melibatkan interaksi antara beberapa
faktor fisik dan kimiawi. Pada proses ini kotoran yang melekat pada pakaian dibersihkan dengan mempergunakan air dan deterjen. Tahapan yang terjadi pada proses ini adalah kotoran yang melekat pada pakaian akan dilepaskan oleh larutan deterjen dan dilanjutkan dengan stabilisasi air yang berisi kotoran supaya kotoran tersebut tidak menempel kembali pada permukaan pakaian. Kemampuan membersihkan pakaian dalam proses laundry sangatlah tergantung pada beberapa faktor seperti jenis bahan pakaian, jenis kotoran, kualitas air, peralatan mencuci, dan komposisi deterjen (Smulders, 2002). Diantara faktor tersebut yang memegang peranan penting adalah komposisi deterjen.
Air pada proses laundry berfungsi sebagai pelarut bagi deterjen dan kotoran yang menempel di pakaian. Air juga berfungsi sebagai media perpindahan untuk komponen tanah yang terlarut maupun terdispersi. Proses laundry dimulai dengan membasahi dan penetrasi larutan deterjen pada pakaian yang kotor. Air mempunyai tegangan permukaan yang sangat tinggi yaitu 72 mN/m padahal proses pembasahan pakaian dapat berjalan lebih cepat dan efektif jika tegangan permukaannya berkurang sampai 30 mN/m. Pada proses inilah peranan dari surfaktan sebagai bahan baku deterjen untuk menurunkan tegangan permukaan. Kualitas air yang jelek dapat mempengaruhi proses pencucian dan menimbulkan masalah pada mesin cuci. Ion kalsium dan magnesium yang bertanggung jawab terhadap kesadahan air dapat menimbulkan terbentuknya endapan. Endapan ini disebabkan oleh terbentuknya residu pada proses laundry dan dapat membentuk kerak pada mesin cuci sehingga berakibat pada terganggunya fungsi dari elemen pemanas dan komponen mesin cuci yang lain. Kandungan kalsium yang tinggi dalam air dapat menghalangi proses menghilangkan partikel tanah pada kotoran yang melekat pada pakaian. Selain itu, keberadaan ion logam seperti besi,
tembaga dan mangan dapat merugikan proses laundry. Ion-ion tersebut dapat menjadi katalis dari dekomposisi agen pemutih (bleaching agents) sehingga fungsinya menjadi terganggu.
Kotoran yang melekat pada pakaian dapat digolongkan menjadi tiga, yaitu : debu dari udara, kotoran yang dihasilkan badan (misalnya keringat), pengotor yang berasal dari aktifitas domestik, komersial dan industri. Menurut Smulders, 2002 jenis kotoran tersebut dapat digolongkan menjadi :
a. Bahan yang mudah larut, seperti : garam, gula, urea, dan keringat b. Partikel, seperti : oksida logam, karbonat, silika, humus, dan arang
c. Minyak dan lemak, seperti : minyak hewani, minyak nabati, pelembab, minyak dan logam mineral, dan lemak yang berasal dari serangga
d. Protein yang berasal dari : darah, telur, susu dan keratin dari kulit e. Karbohidrat, seperti : kanji
f. Zat pewarna dari : buah-buahan, sayuran, anggur, kopi dan teh.
II.3. Air Limbah Laundry
Air limbah yang dihasilkan dari proses laundry mempunyai komposisi dan kandungan yang bervariasi. Hal ini disebabkan variasi kandungan kotoran di pakaian, komposisi dan jumlah deterjen yang digunakan serta teknologi yang dipakai. Selain itu terdapat perbedaan konsentrasi antara air limbah laundry yang dihasilkan dari rumah tangga dengan jasa laundry. Untuk jasa laundry, kandungan air limbahnya mengandung deterjen dengan jumlah yang lebih sedikit, dikarenakan pemakaian yang lebih ekonomis dan juga penggunaan peralatan pelunakan air.
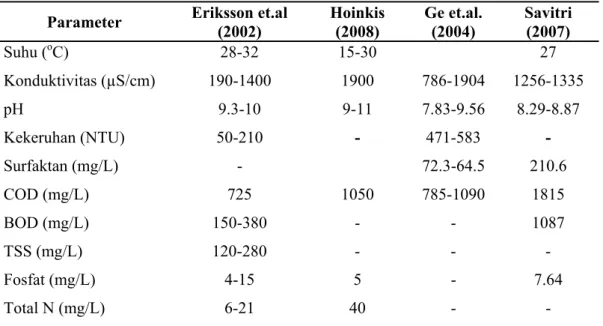
Sedangkan karakteristik dari air limbah laundry yang diperoleh dari beberapa penelitian dapat dilihat pada Tabel II.1.
Tabel II.1. Karakteristik air limbah laundry
Parameter Eriksson et.al (2002) Hoinkis (2008) Ge et.al. (2004) Savitri (2007) Suhu (oC) 28-32 15-30 27 Konduktivitas (µS/cm) 190-1400 1900 786-1904 1256-1335 pH 9.3-10 9-11 7.83-9.56 8.29-8.87 Kekeruhan (NTU) 50-210 - 471-583 - Surfaktan (mg/L) - 72.3-64.5 210.6 COD (mg/L) 725 1050 785-1090 1815 BOD (mg/L) 150-380 - - 1087 TSS (mg/L) 120-280 - - - Fosfat (mg/L) 4-15 5 - 7.64 Total N (mg/L) 6-21 40 - -
Konsumsi air untuk kegiatan mencuci di rumah tangga mempunyai jumlah yang signifikan, yaitu sekitar 22% dari total kebutuhan air bersih (Woodwell et.al., 1995). Sedangkan menurut Smulders (2002) penggunaan air untuk kegiatan
laundry sekitar 17 L atau 13% dari kebutuhan air bersih atau sekitar 8% dari air
yang masuk ke sistem air buangan. Selain kontribusi volume air, air limbah
laundry menyumbang beban kontaminan yang cukup tinggi ke dalam air buangan.
Pada Tabel II.2 dapat terlihat bahwa air limbah laundry menyumbang sekitar 10% untuk COD, BOD dan TSS sedangkan untuk fosfat dan nitrogen cenderung lebih rendah.
Tabel II.2. Kontribusi air limbah laundry terhadap air buangan perkotaan Parameter Kons. di air
limbah laundry (mg/L)
Beban per kapita air limbah
laundry (g/hari)
Beban per kapita air buangan perkotaan (g/hari)
Kontribusi air limbah
laundry terhadap air
buangan (%) COD 600 10.2 120 8.5 BOD 350 5.95 60 10 TSS 450 7.65 72 10.6 Total N 7 0.12 12 1 Total P 2 0.03 2.4 1 Sumber : Smulders, 2002
Untuk mengurangi beban pencemaran yang berasal dari aktifitas laundry maka perlu dilakukan pengolahan terutama di tempat jasa laundry yang menghasilkan
volume air limbah yang cukup besar. Terdapat beberapa sistem pengolahan yang dapat digunakan, misalnya sedimentasi dan filtrasi (Ahmad, 2008), oksidasi elektrokimia (Kong, 2006 dan Koparal et al., 2006), ultrasonik (Abu-Hassan et. al, 2006), koagulasi dan membran filtrasi (Sostar-Turk, 2005), membran bioreaktor (Buchheistera et. al, 2006 dan Hoinkis, 2008), oksidasi Fenton (Lin et.al, 1999), ultraviolet (Tabrizi, 2006), adsorpsi (Adak et.al, 2005), koagulasi flokulasi (Aboulhassan et.al, 2006) dan elektrokoagulasi (Ge, 2004).
II.4 Elektrokoagulasi
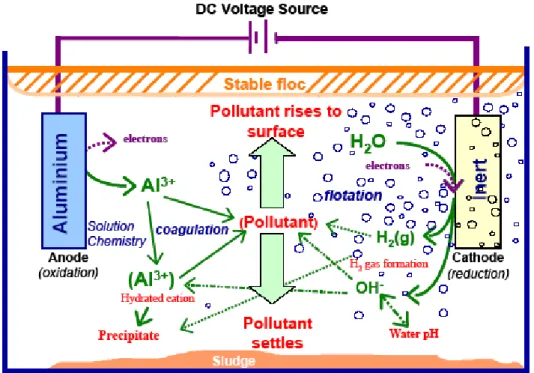
Elektrokoagulasi merupakan metode pengolahan air secara elektrokimia dimana pada anoda terjadi pelepasan koagulan aktif berupa ion logam (biasanya alumunium atau besi) ke dalam larutan, sedangkan pada katoda terjadi reaksi elektrolisis berupa pelepasan gas hidrogen (Holt et al., 2004). Sedangkan menurut Mollah, (2004), elektrokoagulasi adalah proses kompleks yang melibatkan fenomena kimia dan fisik dengan menggunakan elektroda untuk menghasilkan ion yang digunakan untuk mengolah air limbah.
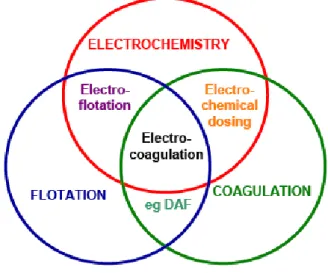
Gambar II.5. Diagram Venn (Holt et al., 2001)
Diidentifikasi terdapat tiga proses mendasar yang terjadi dalam elektrokoagulasi, yaitu elektrokimia, koagulasi dan flotasi. Ketiga proses ini dapat digambarkan dengan diagram Venn dimana kombinasi dari ketiganya menghasilkan teknologi
elektrokoagulasi, sedangkan kombinasi yang lain menghasilkan teknologi yang berbeda.
Elektrokoagulasi bukan merupakan teknologi baru, dari literatur yang ada menunjukkan bahwa teknologi ini telah ditemukan lebih dari seratus tahun yang lalu. Contoh aplikasi yang ada misalnya adalah pada akhir abad 19, telah terdapat beberapa instalasi pengolahan air bersih yang cukup besar di London yang mempergunakan teknologi ini (Matteson et al., 1995 dalam Holt et al., 2004). Sementara instalasi pengolahan lumpur secara elektrolisis dioperasikan di beberapa tempat di Amerika Serikat pada awal tahun 1911 yang memiliki ukuran yang serupa dengan instalasi pengolahan air limbah pada masa tersebut (Vik et al., 1984 dalam Holt et al., 2004). Namun sejak tahun 1930-an semua instalasi tersebut tidak dioperasikan lagi dikarenakan biaya operasional yang tinggi dan adanya alternatif lain berupa penggunaan bahan kimia sebagai koagulan (Holt et al., 2004).
Pada masa sekarang penggunaan teknologi elektrokoagulasi mulai dikembangkan kembali untuk meningkatkan kualitas effluen air limbah. Elektrokoagulasi digunakan untuk mengolah effluen dari beberapa air limbah yang berasal dari industri makanan, limbah tekstil, limbah rumah makan, limbah yang mengandung senyawa arsenik, air yang mengandung fluorida, dan air yang mengandung partikel yang sangat halus, bentonit dan kaolinit.
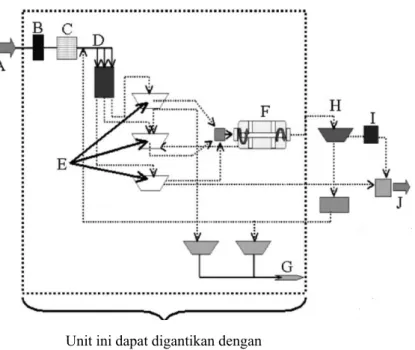
Pada sistem pengolahan limbah yang konvensional, reaktor elektrokoagulasi dapat menggantikan beberapa unit pengolahan sehingga menghasilkan instalasi pengolahan yang lebih sederhana dan tidak membutuhkan lahan yang luas.
Gambar II.6 Diagram alir IPAL konvensional dan unit yang dapat digantikan oleh Elektrokoagulasi (ket : A: air limbah, B: bar screen, C: grit chamber, D:bak distribusi, E: primary sedimentation, F: Oxidation Ditch, G: pengolahan lumpur, H: Clarifier, I:klorinasi, J: effluen) (Mollah, 2004)
Untuk pertimbangan penentuan penggunaan elektrokoagulasi maka Mollah (2001) telah memberikan gambaran tentang keuntungan dan kerugiannya. Keuntungan dari penggunaan elektrokoagulasi adalah sebagai berikut :
1. Elektrokoagulasi membutuhkan peralatan yang sederhana dan mudah dioperasikan.
2. Air limbah yang diolah dengan elektrokoagulasi menghasilkan effluen yang jernih, tidak berwarna, dan tidak berbau.
3. Lumpur yang dihasilkan elektrokaogulasi realtif stabil dan mudah dipisahkan karena terutama berasal dari oksida logam. Selain itu jumlah lumpur yang dihasilkan sedikit.
4. Flok yang terbentuk pada elektrokoagulasi memiliki kesamaan dengan flok yang berasal dari koagulasi kimia. Perbedaannya adalah flok dari elektrokoagulasi berukuran lebih besar dengan kandungan air yang sedikit, lebih stabil dan mudah dipisahkan secara cepat dengan filtrasi.
Unit ini dapat digantikan dengan elektrokoagulasi
5. Elektrokoagulasi menghasilkan effluen yang mengandung TDS dalam jumlah yang lebih sedikit dibandingkan pengolahan kimiawi. Jika air hasil pengolahan ini digunakan kembali, kandungan TDS yang rendah akan mengurangi biaya recovery.
6. Proses elektrokoagulasi mempunyai keuntungan dalam mengolah partikel koloid yang berukuran sangat kecil karena dengan pemakaian arus listrik menyebabkan proses koagulasi lebih mudah terjadi dan lebih cepat.
7. Proses elektrokoagulasi tidak memerlukan pemakaian bahan kimia sehingga tidak bermasalah dengan netralisasi kelebihan bahan kimia dan tidak membutuhkan kemungkinan pengolahan berikutnya jika terjadi penambahan senyawa kimia yang terlalu tinggi seperti pada penggunaan bahan kimia.
8. Gelembung gas yang dihasilkan selama proses elektrolisis dan membawa polutan yang diolah untuk naik ke permukaan (flotasi) dimana flok tersebut dengan mudah terkonsentrasi, dikumpulkan dan dipisahkan.
9. Perawatan reaktor elektrokoagulasi lebih mudah karena proses elektrolisis yang terjadi cukup dikontrol dari pemakaian listrik tanpa perlu memindahkan bagian di dalamnya.
10. Teknologi elektrokoagulasi dapat dengan mudah diaplikasikan di daerah yang tidak terjangkau layanan listrik yakni dengan menggunakan panel matahari yang cukup untuk terjadinya proses pengolahan.
Sedangkan kerugian dari penggunaan elektrokoagulasi adalah :
1. Elektroda yang digunakan dalam proses pengolahan ini harus diganti secara teratur.
2. Penggunaan listrik kadang kala lebih mahal pada beberapa daerah.
3. Terbentuknya lapisan di elektroda dapat mengurangi efisiensi pengolahan.
4. Teknologi ini membutuhkan konduktivitas yang tinggi pada air limbah yang diolah.
II.4.1 Mekanisme Dalam Elektrokoagulasi
Reaktor elektrokimia merupakan sebuah sel elektrokimia dimana kutub anoda yang berupa logam (biasanya aluminum atau terkadang besi) dimana ion logam yang terlepas berfungsi sebagai agen koagulan. Dan secara simultan terjadi gelembung gas hidrogen di kutub katoda.
Elektrokoagulasi mempunyai kemampuan untuk mengolah berbagai macam polutan termasuk padatan tersuspensi, logam berat, tinta, bahan organik (seperti air limbah domestik), minyak dan lemak, ion dan radionuklida. Karakteristik fisik kimia dari polutan mempengaruhi mekanisme pengolahan, misalnya polutan berbentuk ion akan diturunkan melalui proses presipitasi sedangkan padatan tersuspensi yang bermuatan akan diabsorbsi ke koagulan yang bermuatan. Kemampuan elektrokoagulasi untuk mengolah berbagai macam polutan menarik minat industri untuk menggunakannya.
Pada gambar dibawah ini memperlihatkan proses elektrokoagulasi yang sangat kompleks. Dimana koagulan dan produk hidrolisis saling berinteraksi dengan polutan atau dengan ion yang lain atau dengan gas hidrogen.
Menurut Mollah (2004) mekanisme penyisihan yang umum terjadi di dalam elektrokoagulasi terbagi dalam tiga faktor utama, yaitu : (a) terbentuknya koagulan akibat proses oksidasi elektrolisis pada elektroda, (b) destabilisasi kontaminan, partikel tersuspensi dan pemecahan emulsi, dan (c) agregatisasi dari hasil destabilisasi untuk membentuk flok. Sedangkan proses destabilisasi kontaminan, partikel tersuspensi dan pemecahan emulsi terjadi dalam tahapan sebagai berikut :
- Kompresi dari lapisan ganda (double layer) difusi yang terjadi disekeliling spesies bermuatan yang disebabkan interaksi dengan ion yang terbentuk dari oksidasi di elektroda.
- Netralisasi ion kontaminan dalam air limbah dengan menggunakan ion berlawanan yang dihasilkan dari elektroda. Dengan adanya ion tesebut menyebabkan berkurangnya daya tolak menolak antar partikel dalam air limbah sehingga gaya van der Waals sehingga proses koagulasi bisa berlangsung.
- Terbentuknya flok, dimana flok ini terbentuk akibat proses koagulasi sehingga terbentuk sludge blanket yang mampu menjebak dan menjembatani partikel koloid yang masih ada di air limbah.
II.4.2 Pelarutan Logam di Elektroda
Pada percobaan elektrokoagulasi, elektroda yang digunakan selalu dihubungkan dengan sumber listrik DC. Jumlah logam yang larut tergantung pada jumlah arus listrik yang mengalir pada elektroda tersebut. Hukum Faraday membuat hubungan antara kuat arus (I) yang mengalir dengan jumlah massa yang terlepas ke larutan, hal ini merupakan pendekatan secara teoritis untuk menghitung jumlah aluminium yang terlepas ke larutan. Adapun rumus dari hukum Faraday adalah sebagai berikut : F Z MW t I m . . . = (II.1) dimana
I = kuat arus yang digunakan (A) t = waktu detensi (detik)
MW = berat molekul aluminium, yaitu 27 g mol Z = valensi aluminium, yaitu 3
F = konstanta Faraday, 96500 C/mol
Jika menggunakan kerapatan arus (A/m2) maka satuan dari m adalah g/m2. Dengan menggunakan persamaan tersebut kita dapat membandingkan antara jumlah logam yang larut secara teoritis dengan percobaan di lapangan. Seringkali diperoleh hubungan yang cukup baik antara hasil percobaan dengan teori. Walaupun kadangkala terdapat perbedaan/error yang signifikan yang dapat terjadi karena tidak memperhatikan bentuk dan ukuran elektroda yang tepat serta pemasangan elektroda yang kurang baik.
Salah satu yang dapat menimbulkan ketidak tepatan pengukuran adalah tegangan/potensial yang digunakan pada reaktor elektrokoagulasi. Tegangan yang diukur merupakan gabungan dari tiga komponen (Bard, 2001), yaitu :
(II.2) dimana :
ηAP = overpotensial yang digunakan (V) ηK = overpotensial kinetik (V)
ηMt = overpotensial konsentrasi (V)
ηIR = overpotensial yang disebabkan hambatan larutan atau IR-drop (V)
IR-drop berkaitan dengan jarak (d dalam cm) antara elektroda, luas permukaan (A dalam m2) dari katoda dan konduktivitas spesifik dari larutan (K dalam µS/cm) dan kuat arus (I dalam A) yang dapat dinyatakan dalam persamaan :
Nilai IR-drop dapat diminimalkan dengan cara mengurangi jarak antara elektroda dan meningkatkan luas penampang elektroda serta menaikkan konduktivitas spesifik dari larutan.
Overpotensial konsentrasi (ηMt) juga dikenal sebagai tegangan transfer massa atau difusi yang disebabkan perubahan konsentrasi analit yang terjadi di permukaan elektroda akibat reaksi di elektroda tersebut. Overpotensial ini disebabkan terjadinya perbedaan konsentrasi spesies elektroaktif antara bulk larutan dan permukaan elektroda. Kondisi ini terjadi ketika reaksi elektrokimia yang cukup cepat menurunkan konsentrasi permukaan spesies elektroaktif di bawah larutan bulk. Overpotensial tegangan ini dapat diabaikan ketika konstanta laju reaksi lebih kecil dari koefisien transfer massa. Overpotensial transfer massa dapat dikurangi dengan cara meningkatkan transportasi ion logam dari permukaan anoda ke larutan dan hal ini dapat dicapai dengan meningkatkan turbulensi dari larutan.
Overpotensial kinetik atau juga disebut potensial aktifasi merupakan penghalang alami energi aktifasi dari reaksi transfer elektron.Overpotensial aktifasi akan menjadi tinggi ketika timbul gas pada elektroda. Selain itu overpotensial kinetik dan konsentrasi akan mengalami peningkatan ketika arus listrik yang mengalir juga meningkat.
II.4.3 Reaksi di Elektroda
Seperti disebutkan diatas bahwa reaktor elektrokoagulasi merupakan sel eleketrokimia, dimana dalam reaktor tersebut disusun elektroda-elektroda yang akan kontak dengan air yang akan diolah. Untuk menghasilkan koagulan diperlukan beda potensial diantara elektroda. Perbedaan potensial ini diperlukan untuk menimbulkan reaksi elektrokimia pada masing-masing elektroda.
Dari berbagai penelitian yang ada telah didesain berbagai macam konfigurasi elektroda seperti pemakaian pellet aluminium dengan reaktor fluidized bed (Barkley et al., 1993), elektroda aluminium bipolar (Mameri et al., 1998), elektroda mesh (Matteson et al., 1995), baja bipolar berbentuk lingkaran
(Ogutveren et al., 1992) dan juga elektroda sederhana berbentuk lempengan (Vik et al., 1984; mameri et al., 1998; Holt et al., 2001). Selain itu berbagai jenis elektroda telah dicoba seperti aluminium, besi, baja dan platinum. Bahan elektroda digunakan untuk mengetahui jenis koagulan yang timbul.
Aluminium merupakan elektroda yang paling banyak digunakan, dimana pada proses elektrokoagulasi terjadi proses pelarutan anodik yang reaksinya adalah sebagai berikut :
Al ↔ Al3+ + 3 e E0A = 1.66 V (II.4)
Pembentukan oksigen juga terjadi di anoda (Mameri et al., 1998) walaupun tidak terdeteksi oleh analisa Przhegorlinskii et al., 1987, reaksinya adalah :
4 OH- → O2 + 2 H2O + 4e E0A = - 0.40 V (II.5)
Selain itu secara simultan terjadi reaksi di kutub katoda, biasanya pembentukan gas hidrogen. Reaksi yang terjadi di katoda tergantung pada pH air yang diolah. Pada kondisi netral atau basa, gas hidrogen terjadi dengan reaksi :
2 H2O + 2e → 2 OH- + H2 E0C = - 0.83 V (II.6)
Sedangkan pada kondisi asam, reaksi pembentukan gas hidrogen adalah sebagai berikut :
2 H+ + 2e → H2 E0C = 0 V (II.7)
Reaktor yang mempergunakan aluminium pada kedua elektroda yaitu anoda dan katoda dilaporkan proses pelarutan aluminium melebihi 100% (Przhegorlinskii et al., 1987 ; Donini et al., 1994 ; Mameri et al., 1998 ; Bozin and Mikhailov, 1990 dalam Holt, 2002).
Untuk pengunaan aluminium pada kedua elektroda, reaksinya adalah sebagai berikut :
Al3+ + 3 H2O → Al(OH)3 + 1.5 H2 (II.8)
Al3+ + 4 H2O + e → Al(OH)-4 + 2 H2 (II.9)
Persamaan II.4 sampai II.7 merupakan reaksi separuh sel yang dominan terjadi pada reaktor dengan anoda aluminium dan katoda logam inert. Potensial dari reaksi yang terjadi tergantung pada bahan yang digunakan pada elektroda dan kondisi larutan.
II.4.4 Proses Koagulasi
Proses koagulasi merupakan faktor kunci dalam elektrokoagulasi, proses ini mengambarkan interaksi antara koagulan dengan bahan polutan yang hendak diolah. Prinsip dari koagulasi adalah destabilisasi partikel koloid dengan cara mengurangi semua gaya yang mengikat, kemudian menurunkan energi penghalang dan membuat partikel menjadi bentuk flok. Proses ini tergantung pada karakteristik fisik dan kimia dari larutan, jenis polutan dan koagulan, jenis mekanisme koagulasi yang terjadi. Pada reaktor elektrokoagulasi, mekanisme koagulasi yang dominan terjadi akan bervariasi tergantung kondisi pengoperasian reaktor, jenis dan konsentrasi polutan dan konsentrasi koagulan.
Elektrokoagulasi dapat dibandingkan dengan koagulasi kimiawi untuk menunjukkan efisiensi dan keuntungannya. Pada koagulasi kimiawi, bahan kimia yang ditambahkan sebagai koagulan yang berbentuk garam dan di dalam larutan akan mengalami disosiasi melalui hidrolisis dari kation aluminium (dan berhubungan dengan anion larutan) yang diukur dengan kondisi larutan dan nilai pH. Penambahan aluminium sulfat pada kaogulasi kimiawi akan membuat air menjadi asam sedangkan pada penambahan aluminium pada elektrokoagulasi yang tidak menyebabkan disosiasi pada anion garam di larutan, akan menyebabkan nilai pH relatif stabil dalam kisaran basa (Koparal and Ogutveren, 2002). Namun menurut Donini et al. (1994) dan Musquere et al. (1983) menyatakan bahwa mekanisme koagulasi antara elektrokoagulasi dengan koagulasi kimiawi relatif sama, walaupun pernyataan ini tidak didukung dengan data penelitian yang memadai.
Pada elektrokoagulasi, stabilitas polutan diukur dari karakteristik fisik kimia dari polutan tersebut. Polutan tersusun atas partikel bermuatan yang sama yang terikat satu dengan lainnya dan dengan gaya repulsive menyebabkan menjadi stabil. Proses perubahan ion yang berlawanan menjadi polutan yang bermuatan akan membentuk lapisan ganda elektrik (electric double layer) yang disebut lapisan diffuse dan Stern (Letterman et al., 1999; Thomas et al., 1999; Hunter, 1993; Lyklema, 1978 dalam Holt,2002). Repulsif elektrostatik diantara lapisan ganda elektrik akan membuat partikel terpisah, sedangkan gaya van der Waals akan menyatukan partikel tersebut.
Untuk memperoleh pemisahan yang kecil, terlebih dahulu dibutuhkan energi barrier yang repulsif. Zeta potensial dapat digunakan untuk mengukur secara eksperimen muatan efektif dari partikel untuk bergerak dalam larutan, hal ini merupakan indikator langsung dari stabilitas larutan (Letterman et al., 1999). Sedangkan Holt et al., (2002) melaporkan pada pengukuran di reaktor yang batch nilai titik isoelektrik berkaitan dengan tingkat removal polutan yang tinggi. Oleh sebab itu, pengukuran zeta potensial dapat menunjukkan karakteristik penting dari sistem elektrokoagulasi (Clemens, 1981; Ramirez, 1982) dan juga menunjukkan indikasi dari stabilitas dan indikasi kemungkinan mekanisme koagulasi yang terjadi.
Aluminum merupakan logam yang sering digunakan sebagai anoda dalam proses elektrokoagulasi. Ion positif (kation) aluminium yang terlepas (tergantung pada kondisi polutan, pH dan konsentrasi larutan) secara langsung akan berinteraksi dengan polutan dan akan terjadi hidrolisa membentuk kompleks hidro-aluminium atau juga terjadi presipitasi. Proses pembentukan kation ini sangat penting untuk dapat memahami meknisme elektrokoagulasi.
Thermodinamika dapat digunakan untuk mengukur dan menghitung zat yang bereaksi dalam larutan. Adapun reaksi yang terjadi pada aluminium ketika terlepas ke larutan adalah sebagai berikut :
Al3+ + H
2O → Al(OH)2+ + H+ (II.10)
Al(OH)2+ + H2O → Al(OH)30 + H+ (II.12)
Al(OH)30 + H2O → Al(OH)4- + H+ (II.13)
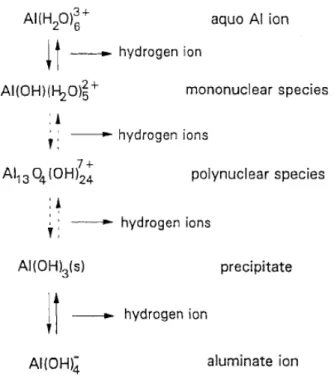
Reaksi tersebut menggambarkan reaksi yang sederhana dari ion aluminium dalam air karena setelah itu terjadi reaksi spontan yang menghasilkan dimeric, trimeric dan polynuclear (Gambar II.7).
Gambar II.8. Reaksi hidrolisa ion aluminium (Letterman, 1999)
Pada awalnya air ion logam aluminium di dalam air akan mengikat enam atom oksigen dari air disekelilingnya dan ikatan atom oksigen hidrogen pada air relatif lemah menyebabkan ion H+ terlepas atau mengalami deprotonasi (Gambar II.9).
. Gambar II.9 Deprotonasi ion aquo aluminum (Letterman, 1999)
Kemudian pada reaksi hidrolisa ion Al3+ akan menghasilkan Al(H2O)63+,
Al(H2O)5OH2+, Al(H2O)4(OH)2+ dan selanjutnya produk hidrolisa menghasilkan
berbagai bentuk spesies monomer dan polimer seperti Al(OH)2+, Al(OH)2+,
Al2(OH)24+, Al(OH)4-, Al6(OH)153+, Al7(OH)174+, Al8(OH)204+, Al13O4(OH)247+,
Al13(OH)345+ dimana spesies tersebut tergantung pada nilai pH.
Dengan memperhatikan hanya pembentukan mononuclear, jumlah aluminium dalam larutan (α) dengan nilai pH pada larutan dapat digambarkan dengan grafik dibawah ini. Dimana pada diagram tersebut, distribusi yang ada menggambarkan proses hidrolisis yang tergantung pada konsentrasi total dari logam dan pH larutan.
Gambar II.10. Diagram distribusi Al-H2O untuk mononuklear (Holt, 2002)
Sedangkan untuk kelarutan dari aluminium hidroksida, Al(OH)3(s) dapat dilihat
pada diagram berikut ini.
Batas kelarutan ditentukan oleh kesetimbangan termodinamika yang terjadi diantara kandungan aluminium yang dominan di larutan pada pH yang diberikan dengan padatan aluminium hidroksida. Minimum kelarutan (yaitu 0.03 mg Al/L) terjadi pada pH 6.3, dan nilai kelarutan bertambah apabila larutan menjadi semakin asam atau basa.
Sehingga kation logam aktif yang diproduksi pada anoda akan bereaksi dengan ion hidroksida yang diproduksi di katoda untuk membentuk logam hidroksida yang akan berfungsi sebagai agen koagulan. Ketika berinteraksi dengan partikel polutan, logam hidroksida akan membentuk agregat yang memungkinkan untuk mengalami pengendapan atau juga dapat terbawa oleh gelembung gas hidrogen (yang dihasilkan di katoda) ke permukaan. Pada penambahan koagulan, setiap presipitasi logam dari aluminium hidroksida menyebabkan removal polutan melalui mekanisme sweep coagulation (Gambar II.12).
II.4.5 Reaktor Elektrokoagulasi
Pada bentuk yang sederhana, reaktor elektrokoagulasi berupa reaktor elektrokimia dengan satu anoda dan satu katoda. Ketika dihubungkan dengan sumber listrik maka bahan anoda mengalami korosi akibat oksidasi sedangkan katoda menjadi subyek yang pasif. Namun susunan seperti ini tidak mencukupi untuk pengolahan air limbah dikarenakan kebutuhan laju pelepasan ion logam yang besar menuntut permukaan elektroda yang luas. Hal ini dapat dicapai dengan menggunakan reaktor yang memakai konfigurasi elektroda monopolar dengan rangkaian paralel. Susunan reaktor elektrokoagulasi dengan konfigurasi monopolar menggunakan rangkaian paralel dapat dilihat pada Gambar II.13.
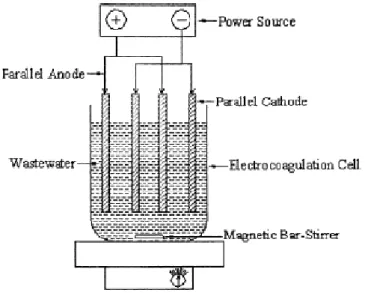
Gambar II.13. Reaktor elektrokoagulasi dengan konfigurasi monopolar (Mollah, 2001)
Selain konfigurasi monopolar, reaktor elektrokoagulasi dapat mempergunakan konfigurasi bipolar (Gambar II.14). Pada konfigurasi ini, hanya satu elektroda yang dihubungkan dengan kutub positif (anoda) dan satu elektroda dihubungkan dengan kutub negatif (katoda). Rangkaian seperti ini membuat reaktor elektrokoagulasi menjadi lebih sederhana dan mudah dalam perawatannya (Mollah, 2004). Ketika arus listrik dialirkan melalui dua elektroda, maka elektroda yang tidak dialiri akan berubah dari kondisi netral menjadi dua kutub yang berbeda pada masing-masing sisi, yaitu sisi yang menghadap kutub positif
menjadi negatif dan sisi yang menghadap kutub negatif menjadi postif. Elektroda yang memiliki sifat seperti ini disebut “bipolar”.
Gambar II.14. Reaktor elektrokoagulasi dengan konfigurasi bipolar (Mollah, 2001)
Menurut Mollah (2004) untuk menghasilkan efisiensi pengolahan yang maksimum maka dalam mendesain reaktor elektrokoagulasi perlu mempertimbangkan beberapa faktor berikut ini :
a. IR-drop antara elektroda harus diminimalkan
b. Akumulasi gas O2 dan H2 dipermukaan elektroda harus diminimalkan c. Penghalang proses transfer massa melewati daerah antar elektroda harus
diminimalkan.
Sedangkan nilai IR-drop tergantung kepada : - Konduktivitas dari larutan elektrolit - Jarak di antara dua elektroda
- Bentuk geometri dari elektroda
Untuk mengatasi permasalahan tersebut maka dapat dilakukan beberapa cara, seperti : menggunakan larutan dengan konduktivitas yang tinggi, mengurangi jarak antar elektroda.
Sebagai bagian dari reaktor elektrokimia maka reaktor elektrokoagulasi dapat dibedakan berdasarkan mode pengoperasian, yaitu reaktor batch (SBR), reaktor
aliran tersumbat (PFR) dan reaktor teraduk kontinu (CSTR). Skema dari reaktor tersebut dapat dilihat pada gambar berikut ini :
Gambar II.15. Skema reaktor elektrokimia (a) Single Batch Reactor, (b) Continuous Stirred Tank Reactor, (c) Plug Flow Reactor Di dalam mendesain reaktor elektrokimia, Rajeshwar (1997) menyatakan bahwa persamaan yang dapat digunakan dalam reaktor elektrokimia sebagai fungsi dari fraksi yang disisihkan (x) adalah sebagai berikut :
a. Reaktor batch (SBR) 1 (II.14) b. Reaktor kontinu (PFR) - single pass 1 (II.15) - dengan resirkulasi , 1 / (II.16) (a) (b) (c)
- cascade
, 1 (II.17)
c. Reaktor teraduk kontinu (CSTR) - single pass 1 1 (II.18) - dengan resirkulasi , 1 / (II.19) - cascade , 1 1 (II.20) dimana : VR = volume reaktor
A = luas penampang elektroda km = koefisien transfer massa
τR = waktu tinggal rata-rata
τt = waktu tinggal rata-rata di tangki resirkulasi
n = jumlah reaktor cascade
Q = debit
Beberapa peneliti yang lain (Emamjomeh, 2006; Ni’am et.al,2007; Mameri et.al,1998; Kong, 2006)) menyatakan bahwa laju penyisihan kontaminan di dalam reaktor elektrokoagulasi mengikuti reaksi orde satu, yaitu :
Apabila persamaan diatas diintegralkan akan menghasilkan persamaan :
(II.22)
dimana Ct adalah konsentrasi pada waktu t, Co adalah konsentrasi di awal
percobaan (t=0) dan k adalah nilai kinetika perubahan konsentrasi
Sedangkan hubungan antara nilai kinetika laju perubahan konsentrasi dengan konstanta transfer massa, dinyatakan oleh Bard (2001) dalam persamaan berikut :
(II.23)
II.5. Penelitian tentang pengolahan air limbah laundry dengan reaktor elektrokoagulasi
Aplikasi proses elektrokoagulasi dalam pengolahan air limbah sangat banyak, termasuk dalam pengolahan air limbah laundry. Beberapa penelitian yang telah dilakukan antara lain :
a. Penelitian yang dilakukan Onder et.al (2007) yaitu mengolah surfaktan LAS dan SLES menggunakan elektroda Fe dengan konfigurasi monopolar. Kerapatan arus yang digunakan adalah 0.275, 0.368 dan 0.460 mA/cm2 dengan waktu detensi 0-60 menit. Reaktor yang digunakan adalah batch dengan volume 1 L dan dilakukan variasi pH yaitu 3, 9, dan 11. Hasil yang diperoleh adalah penyisihan COD, BOD dan kekeruhan sebesar 60, 67 dan 73%, sedangkan untuk penyisihan surfaktan mendekati 100% .
b. Penelitian yang dilakukan oleh Kong (2006) yaitu mengolah surfaktan LAS dengan menggunakan elektroda Ti/Co/SnO2–Sb2O3 dengan konfigurasi
monopolar. Reaktor batch yang digunakan memiliki volume 0.25 L dengan
variasi kerapatan arus sebesar 38.1, 57.1 dan 71.4 mA/cm2 dan variasi pH 3, 6.5 dan 10. Hasil yang diperoleh untuk penyisihan COD sebesar 86% untuk waktu detensi 60 menit.
c. Penelitian oleh Ciorba (2000) yaitu mengolah surfaktan dengan menggunakan elektroda Al konfigurasi monopolar. Percobaannya menggunakan reaktor batch dengan volume air limbah yang diolah sebanyak 0.3 L. Dilakukan variasi pH 4, 7.5 dan 9 dan kerapatan arus 10 dan 30 A/m2. Hasil yang diperoleh adalah penyisihan surfaktan yang diukur dengan nilai COD sebesar 40 - 60%.
d. Penelitian yang dilakukan Ge (2004) yaitu mengolah air limbah laundry dengan menggunakan elektroda Al dan Ti dengan konfigurasi bipolar. Percobaan menggunakan reaktor kontinu dengan volume 2.8 L dan waktu detensi 0 – 30 menit. Variasi percobaannya adalah pH antara 3-10 dan kuat arus 0.8, 1, 1.2, 1.5 dan 2. Hasil yang diperoleh adalah penyisihan surfaktan, fosfat dan kekeruhan mencapai 90% sedangkan penyisihan COD mencapai 70%.