VARIASI GENETIK DAN TEKNIK PERBANYAKAN
VEGETATIF CEMARA SUMATRA (Taxus sumatrana)
HENTI HENDALASTUTI RACHMAT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Variasi Genetik dan Teknik Perbanyakan Vegetatif Cemara Sumatra (Taxus sumatrana) adalah karya saya sendiri dengan arahan dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Agustus 2008
ABSTRACT
HENTI HENDALASTUTI RACHMAT. Genetic Variation and Vegetative Propagation Technique of Sumatran Yew (Taxus Sumatrana). Under direction of Dr. ISKANDAR Z. SIREGAR and Dr. SUPRIYANTO
Genetic diversity and vegetatif propagation technique for Sumatran yew (Taxus sumatrana) are little known and could be useful for the management of this long-lived species either for conservation, habitat restoration or production of paclitaxel (Taxol® ), a promising anti-cancer agent. The objective of this research were: 1) To estimate genetic variation of Sumatran yew from three reproductive population (mother tree, planted tree in Cibodas Botanical Garden and natural seedling) using RAPD marker that is important in formulating appropriate conservation strategies for the species; and 2) To find out suitable rooting medium in propagating Sumatran yew vegetatively. In this study, the genetic diversity was estimated based on Random Amplified Polymorphic DNA (RAPD). Of the 28 universal primers screened, six produced polymorphic and clear RAPD bands. The result also showed that there was a relatively high genetic diversity within population with the percentage of polymorphic band (PPB) ranging from 45,8% – 83,33% with an average 69,43% and Nei’s genetic diversity index (He) of 0,2346, and moderate genetic differentiation among population (GST = 0,2892 ). The high genetic diversity found on population of Sumatran yew may result from their life history characteristic as an outcrossing, widespread distribution, wind-pollinated, animal digested seed and long-lived woody species. Results from shoot cutting experiment using three different rooting media showed that rooting ability was significantly affected by the medium. Among the three media tested, combination of cocodust and rice husk at the ratio 2:1 (v/v) gave the best result in rooting ability (66,7%).
4
RINGKASAN
HENTI HENDALASTUTI RACHMAT. Variasi Genetik dan Teknik Perbanyakan Vegetatif Cemara sumatra (Taxus sumatrana). Dibimbing oleh Dr. Ir. ISKANDAR Z. SIREGAR dan Dr. Ir. SUPRIYANTO
Kulit, daun, cabang, ranting, dan akar dari genus Taxus merupakan sumber paclitaxel (Taxol®), yang saat ini sangat sukses digunakan dalam mengobati kanker ovarium dan kanker payudara serta berbagai jenis penyakit non kanker lainnya seperti alzheimer, sarcoma kaposi (tumor jaringan pembuluh darah), dan sklerosis ginjal. Produksi 1 kg Taxol membutuhkan sekitar 30.000 kg biomasa. Menurut Smith & Cameron (2001), kebutuhan Taxol untuk Amerika Utara dan Eropa saja sekitar 400 kg/tahun (setara dengan 12 juta kg biomas) atau diprediksikan sekitar 1.000 kg/tahun untuk pasar dunia (setara dengan 30 juta kg biomas). Permintaan terhadap produk ini mengalami kenaikan rata-rata 20% setiap tahun. Oleh karena kondisi penurunan populasi Taxus yang sudah berada pada tingkat yang sangat memprihatinkan, maka Taxus telah dimasukan ke dalam Appendiks II CITES sejak tahun 2005 (CITES, 2005).
Indonesia merupakan sedikit dari negara yang memiliki sebaran alamiah Taxus di zona Asia. Taxus sumatrana yang dikenal di dunia internasional dengan nama Sumatran yew (Cemara sumatra) merupakan salah satu jenis pohon berdaun jarum yang tumbuh secara alamiah di Indonesia (Sumatera) pada ketinggian 1.400-2.300 mdpl.
Keragaman genetik suatu individu memegang peranan yang penting karena tingkat keragaman individu dalam populasi maupun antar populasi menggambarkan status keberadaan suatu jenis di alam. Pemilihan teknik RAPD dalam menganalisis keragaman genetik telah dilakukan pada beberapa jenis Taxus namun sampai saat ini belum ada laporan penggunaan teknik ini untuk menganalisis keragaman genetik Cemara sumatra yang tumbuh di Indonesia.
Upaya budidaya merupakan salah satu kunci penting dalam mempertahankan keberadaan suatu jenis. Karena sulitnya penanganan pada pematahan dormansi benih maka teknik perbanyakan paling umum dari genus Taxus dilakukan dengan penyetekan. Meskipun telah dilaporkan beberapa upaya dan keberhasilan perbanyakan jenis-jenis Taxus melalui perbanyakan dengan stek, namun sampai saat ini belum ada laporan hasil penelitian yang serupa terhadap jenis Cemara sumatra.
Research PTC-100. Primer yang digunakan adalah 6 primer hasil optimasi keluaran Operon Technology yaitu OPC-05, OPO-06, OPO-13, OPY-14, OPY-15 dan OPY-20. Variabel untuk keragaman genetik dalam populasi adalah: Persentase Lokus Polimorfik (PLP), jumlah alel efektif (Ae), indeks Shanon (S) dan keragaman genetik Nei-s (He). Sedangkan variabel yang diukur pada keragaman genetik antar populasi adalah : jarak genetik (do), diferensiasi genetik (GST), dan analisis gerombol.
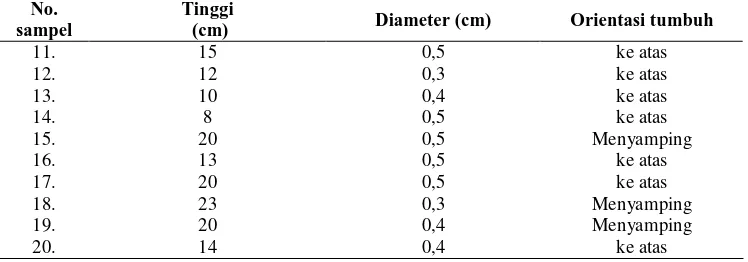
Pada kegiatan penelitian teknik perbanyakan vegetatif dengan stek, sumber bahan stek merupakan pohon induk Cemara sumatra yang tumbuh di Gunung Kerinci – Jambi yang diambil dari cabang ortotrof. Penanaman bahan stek di rumah kaca dilakukan pada 3 media yang berbeda yaitu : tanah : sekam pada rasio 1:1 (v/v) (M1), tanah : sekam : serbuk kelapa pada rasio 1:1:1 (v/v/v) (M2), dan serbuk kelapa: sekam pada rasio 2:1 (v/v) (M3). Setiap perlakuan diulang sebanyak 3 kali dengan masing-masing ulangan terdiri dari 7 bahan stek. Pengecekan akar dilakukan pada umur stek 16 minggu setelah tanam (MST), 20 MST, dan 24 MST sedangkan penyapihan dilakukan pada umur 28 MST. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Variabel pengamatan adalah persentase stek hidup, persentase stek berakar, jumlah dan panjang akar primer serta jumlah dan panjang akar sekunder. Pengamatan histologi akar dilakukan pada akhir pengamatan penyetekan dengan menggunakan metode parafinasi dengan tujuan mengetahui daerah munculnya akar pertama kali.
Dari total 48 lokus yang terdeteksi, 47 (97,92%) merupakan lokus polimorfik. Persentase lokus polimorfik memiliki nilai rata-rata 69,43%, dengan kisaran 45,83% - 83,33%. Rata-rata jumlah alel efektif per lokus adalah 1,4039. Keragaman genetik dalam populasi (He) tergolong tinggi dengan nilai 0,2346 dan indeks Shanon memiliki nilai 0,3524. Dari ketiga populasi yang dianalisis, populasi pohon induk alam (He = 0,2590) dan hasil perbanyakan di Kebun Raya Cibodas (He = 29,59) memperlihatkan tingkat variabilitas yang jauh lebih tinggi dibanding populasi anakan alam (He = 0,1490). Diferensiasi genetik antar populasi (Gst) tergolong sedang dengan nilai 0,2892. Sedangkan besarnya jarak genetik Nei (do) antar populasi berkisar dari 0,1308 – 0, 2598 dengan nilai rata-rata 0,2041. Berdasarkan jarak genetik Nei (1972), populasi Cemara sumatra terbagi menjadi 2 kelompok. Populasi pohon induk alam dan populasi hasil perbanyakan vegetatif berada pada satu kelompok yang sama dan kelompok kedua hanya terdiri dari populasi anakan alam.
Perlakuan pemakaian media yang berbeda dalam penyetekan Cemara sumatra menghasilkan perbedaan yang signifikan hanya pada variabel persentase stek berakar. Media serbuk kelapa : sekam pada 2:1 (v/v) (M3) menghasilkan persentase stek yang paling tinggi yaitu 66,7%. Berdasarkan hasil mikroteknik, pembentukan akar pada stek Cemara sumatra dimulai dari sel-sel meristem pada kambium. Namun demikian pada beberapa stek, akar terbentuk dengan didahului oleh terbentuknya kalus dan ada juga akar adventif pada batang yang tumbuh secara spontan.
6
Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB. 2. Dilarang mengumumkan dan memperbanyak sebagian atau
VARIASI GENETIK DAN TEKNIK PERBANYAKAN
VEGETATIF CEMARA SUMATRA (Taxus sumatrana)
HENTI HENDALASTUTI RACHMAT
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
8
Judul Tesis : Variasi Genetik dan Teknik Perbanyakan Vegetatif Cemara Sumatra (Taxus sumatrana)
Nama : Henti Hendalastuti Rachmat NIM : E051060431
Disetujui Komisi Pembimbing
Dr. Iskandar Z. Siregar Dr. Supriyanto
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pengetahuan Kehutanan
Prof. Dr. Ir. Imam Wahyudi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga segala upaya penulis dalam melaksanakan dan menyusun karya ilmiah dapat diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2007 ini adalah Variasi Genetik dan Teknik Perbanyakan Vegetatif Cemara Sumatra (Taxus sumatrana).
Pada kesempatan ini penulis mengucapkan terima kasih kepada Departemen Kehutanan atas kesempatan dan beasiswa yang telah diberikan untuk melanjutkan studi ke Program Studi Ilmu Pengetahuan Kehutanan Sekolah Pascasarjana Institut Pertanian Bogor. Terima kasih penulis ucapkan juga kepada Dr. Iskandar Z. Siregar dan Dr. Supriyanto selaku komisi pembimbing yang telah banyak memberikan arahan, bimbingan dan motivasi dalam penyelesaian karya ilmiah ini. Keberhasilan ini juga tidak terlepas dari peran suami, anak dan keluarga, terima kasih untuk semuanya.
Semoga dengan adanya karya ilmiah ini dapat bermanfaat.
x
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang, Jawa Barat pada tanggal 8 Agustus 1978 sebagai anak ketiga dari pasangan Bapak Mamat Rachmat dan Ibu Eceh Suwangsih (Alm). Pendidikan sarjana ditempuh di Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB, lulus pada bulan April 2001. Kesempatan untuk melanjutkan ke program master pada Progran Studi Ilmu Pengetahuan Kehutanan, sekolah Pascasarjana IPB diperoleh pada tahun ajaran 2006/2007. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Kehutanan.
Penulis bekerja sebagai peneliti pada Loka Penelitian dan Pengembangan Hasil Hutan Bukan Kayu yang selanjutnya institusi tempat penulis bekerja mengalami perubahan tugas pokok dan fungsi menjadi Balai Penelitian Hutan Penghasil Serat, Badan Litbang Kehutanan – Departemen Kehutanan.
Bogor, Agustus 2008
DAFTAR ISI
Hal
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN... v
PENDAHULUAN ... 1
Latar Belakang... 1
Perumusan Masalah ... 2
Tujuan ... 4
Hipotesis... 4
Manfaat... 4
TINJAUAN PUSTAKA ... 5
Taxus sumatrana (Miq) de Laubenfels ... 5
Keragaman Genetik ... 7
Random Amplified Polymorphic DNA (RAPD)... 8
Sistem Perbanyakan Vegetatif Stek ... 9
METODE PENELITIAN... 12
Analisis Keragaman Genetik... 12
Waktu dan Tempat Penelitian ... 12
Alat dan Bahan ... 12
Metode... 14
Teknik Perbanyakan Vegetatif ... 20
Waktu dan Tempat Penelitian ... 20
Alat dan Bahan ... 20
Metode... 20
xii
HASIL DAN PEMBAHASAN ... 26
Keragaman Genetik Cemara sumatra ... 26
Keragaman Genetik dalam Populasi ... 26
Keragaman Genetik antar Populasi... 33
Perbanyakan Vegetatif Stek ... 34
Persentase Stek Hidup dan Berakar ... 35
Jumlah dan Panjang akar Primer dan Sekunder ... 39
Pertumbuhan dan Perkembangan Akar pada Stek... 40
KESIMPULAN DAN SARAN ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
No. Hal
1. Koordinat, ketinggian tempat dan diameter pohon induk populasi alam Cemara sumatra yang dijadikan sampel untuk analisis RAPD
13
4. Komposisi buffer ekstraksi 15
5. Urutan basa nukleotida 28 primer dari Operon Technology 17 6. Komposisi untuk reaksi PCR dengan bahan Green Go Taq 18
7. Tahapan dalam proses PCR 18
8. Sekuensi primer dan jumlah pita polimorfik yang dihasilkan 26 9. Variabilitas genetik dalam populasi Cemara sumatra berdasarkan
analisis RAPD
berbeda terhadap perkembangan stek Cemara sumatra 28 MST
34
12. Hasil sidik ragam persentase hidup dan berakar stek Cemara sumatra
35 13. Hasil uji Duncan pengaruh media terhadap persentase berakar stek
Cemara sumatra
36 14. Kondisi perakaran stek Cemara sumatra 28 MST pada tiga kondisi
media yang berbeda
xiv
DAFTAR GAMBAR
No. Hal
1. Pohon, batang, dan daun Cemara sumatra 6
2. Penyebaran Cemara sumatra 7
3. Prosedur penelitian keragaman genetik 14
4. Cara penilaian pita dengan sistem skoring 19
5. Hasil amplifikasi pita yang diperlihatkan oleh primer 26
6. Amplifikasi RAPD oleh primer OPC-05 27
7. Amplifikasi RAPD oleh primer OPO-06 27
8. Amplifikasi RAPD oleh primer OPO-13 27
9. Amplifikasi RAPD oleh primer OPY-14 28
10. Amplifikasi RAPD oleh primer OPY-15 28
11. Amplifikasi RAPD oleh primer OPY-20 28
12. Persentase hidup dan berakar stek Cemara sumatra 35 13. Kondisi perakaran stek Cemara sumatra 28 MST pada tiga media
berbeda
36
14. Rata-rata jumlah akar primer dan sekunder stek Cemara sumatra 28 MST pada media yang berbeda
39 15. Panjang akar primer dan sekunder stek Cemara sumatra 28 MST
pada media yang berbeda
40
16. Penampang melintang akar Cemara sumatra hasil penyetekan 41
17. Akar yang tumbuh dari jaringan kalus 42
DAFTAR LAMPIRAN
No. Hal
1. Hasil analisis tanah dari Gunung Kerinci - Jambi 48 2. Hasil skoring pita DNA yang diamplifikasi oleh 6 primer dari
Operon Technology
49 3. Analisis sidik ragam untuk variabel persen hidup dan berakar stek
Cemara sumatra 28 MST
50 4. Hasil uji Duncan persen berakar stek Cemara sumatra 28 MST 50 5. Analisis sidik ragam untuk panjang akar utama, jumlah akar
utama, panjang akar sekunder dan jumlah akar sekunder stek Cemara sumatra 28 MST
PENDAHULUAN
Latar Belakang
Hutan merupakan salah satu sumberdaya alam yang banyak memberikan manfaat bagi kehidupan manusia, baik untuk produksi kayu, jasa lingkungan, maupun sumber plasma nutfah. Indonesia merupakan salah satu negara yang mempunyai hutan yang luas dengan berbagai tipe hutan yang tersusun atas berbagai jenis tumbuhan dengan keanekaragaman yang tinggi. Keanekaragaman hayati sebagai sumber kekayaan hayati bagi umat manusia merupakan pilar untuk mengembangkan tanaman pangan, bahan baku industri, maupun bahan baku obat-obatan.
Berangkat dari catatan sejarah, ketertarikan terhadap sumber daya hutan telah sekian lama terfokus hanya pada produk berupa kayu atau turunannya. Nilai-nilai sumber daya hutan yang lainnya ditempatkan pada kelas kedua dan dinilai sebagai produk tambahan dengan sebutan produk minor hutan. Dari hal tersebut tergambar secara jelas kurangnya ketertarikan dan perhatian terhadap produk hutan non kayu.
Seiring dengan waktu, telah terjadi peningkatan ketertarikan dan perhatian terhadap hasil hutan non kayu akhir-akhir ini. Perubahan iklim dunia merupakan salah satu faktor signifikan yang berkontribusi dalam meningkatkan perhatian berbagai kalangan terhadap nilai-nilai biodiversitas dan signifikansi jasa lingkungan yang terkandung di dalam hutan. Kondisi degradasi hutan di berbagai belahan dunia yang semakin tinggi juga telah menuntut dilakukannya upaya-upaya pelestarian dan pengelolaan hutan dan hasil hutan.
Diantara sekian banyak pengelompokan jenis hasil hutan non kayu, tumbuhan atau pohon sebagai sumber senyawa aktif obat-obatan (industri farmasi) merupakan salah satu kelompok hasil hutan non kayu dengan nilai ekonomis yang tinggi. Menurut Kuswiyati et al. (1999) dalam Anonim (1999), disebutkan bahwa Indonesia mempunyai 1260 jenis tumbuhan obat-obatan. Tanaman obat yang dimanfaatkan baru 456 jenis dari 646 jenis tanaman obat yang telah diteliti. Di negara lain seperti Cina, sudah terdaftar lebih dari 7000 spesies tanaman obat, Korea sejak 1983 melakukan standardisasi 530 jenis tanaman obat. Di Jerman, penelitian dan pemanfaatan obat-obatan dari bahan alam yang biasa disebut phytomedicines sudah jauh lebih maju. Tahun 1989 pasar obat-obatan dari bahan alam di Jerman mencapai nilai $1,7 milyar, atau 10% dari total nilai pasar Jerman. Hasil penelitian Allenbach Institute (1989) menyatakan bahwa 58% penduduk Jerman menggunakan obat dari bahan alam (Kompas, 22 Oktober 1998 dalam Budiatmoko 1999).
3 diprediksikan sekitar 1.000 kg/tahun untuk pasar dunia (setara dengan 30 juta kg biomas). Jika diasumsikan 1 ha hutan tanaman mampu menghasilkan 400 kg biomasa maka diperlukan 75.000 ha hutan tanaman Taxus untuk pemenuhan suplai bahan baku.
Permintaan yang sangat tinggi terhadap bahan aktif Taxol® dan berbagai senyawa Taxane lainnya yang diekstraksi dari Taxus berlangsung mulai tahun 1990-an dan mengalami kenaikan rata-rata sebesar 20% per tahun. Fenomena ini diprediksikan akan terus meningkat seiring dengan kenyataan bahwa Taxol® merupakan obat anti kanker paling dicari di dunia (Anonim, 2003). Upaya budidaya untuk pemenuhan bahan baku telah dilakukan di wilayah timur laut Pasifik dan Midwest Amerika Serikat namun sebagian besar bahan baku yang digunakan masih diimpor dari Asia terutama dari Cina dan India. Penurunan drastis populasi Taxus telah menyebabkan jenis ini dimasukan ke dalam Appendiks II CITES sejak tahun 2005 (CITES 2005).
mengenai keragaman genetik, teknik budidaya maupun strategi konservasi Cemara sumatra yang tumbuh alami di Indonesia. Dari kondisi ini muncul dua permasalahan utama, yaitu:
1. Bagaimana keragaman genetik intra maupun antar populasi Cemara sumatra di Indonesia dan strategi konservasi apa yang bisa disusun berdasarkan keragaman genetik yang dimilikinya?
2. Bagaimana tingkat keberhasilan perbanyakan vegetatif melalui penyetekan dengan media berbeda pada Cemara sumatra?
Tujuan Tujuan dilakukannya penelitian ini adalah :
1. Menduga keragaman genetik Cemara sumatra dari 3 populasi reproduktif (populasi pohon induk, populasi Cibodas, populasi anakan alam) dengan menggunakan Random Amplified Polymorphic DNA (RAPD) dan memformulasikan strategi konservasi yang paling sesuai.
2. Mengkaji metode penyetekan dengan tingkat keberhasilan yang paling tinggi dari beberapa media yang berbeda.
Hipotesis
1. Variasi genetik populasi Cibodas sebagai hasil perbanyakan vegetatif dari alam akan lebih mendekati populasi pohon induk alam dibanding dengan populasi anakan alam.
2. Pemakaian media tanam yang berbeda pada penyetekan Cemara sumatra akan menghasilkan perbedaan tingkat keberhasilan dalam memperbanyak jenis ini secara vegetatif.
Manfaat Penelitian
TINJAUAN PUSTAKA
Taxus sumatrana (Miq) de Laubenfels Aspek botanis
Taxus sumatrana termasuk ke dalam genus Taxus, famili Taxaceae dan sub-divisi Gymnospermae. Di dunia internasional Taxus sumatrana dikenal dengan nama Sumatran yews atau Cemara sumatra. Habitus dari tanaman ini berbentuk semak sampai pohon dengan tinggi bisa mencapai 30 m. Daun berbentuk elip-lanset, berwarna hijau zaitun dengan ukuran panjang 1,8 – 3,0 cm, lebar 2.0 – 2.5 mm, dan tebal 200 – 275 µm. Warna kulit batang merah keabu-abuan dengan tebal kulit 0,5-0,8 cm. Bunga kerucut jantan biasanya tidak terlihat, sedangkan bunga kerucut betina berbentuk subsilindris dengan panjang 2 mm, lebar 1 mm. Buah berbentuk kerucut kaku dengan panjang 4 mm dan lebar 3 mm, mengerucut dari tengah ke puncak. Seluruh genus Taxus dikenal sebagai jenis yang berumur panjang bahkan pohon tertua di daratan Eropa dengan umur diperkirakan 3.000 – 4.000 dan berdiameter lebih dari 4 meter adalah Taxus baccata (Spjut 2003).
Hampir semua jenis Taxus berumah dua (dioceous) hanya Taxus canadensis merupakan tumbuhan berumah satu (monoceous). Bunga berukuran kecil dan soliter dan tumbuh dari tunas aksilar. Kuncup bunga betina terdiri dari ovul tunggal yang dikelilingi oleh 5 kelopak bunga. Antesis diindikasikan dengan terdapatnya mikropolar pada oval yang terbuka, yang selanjutnya akan berkembang menjadi benih. Kuncup bunga jantan biasanya mengelompok di sepanjang bagian bawah percabangan. Bunga jantan memiliki 14 stamen, masing-masing dengan 5-9 mikrosporangia atau kantung polen. Polinasi terutama dilakukan oleh angin.
Gambar 1 Pohon, batang, dan daun Cemara sumatra.
Penyebaran, tempat tumbuh dan status ekologi
Cemara sumatra tumbuh di hutan sub tropis lembab dan hutan hujan pegunungan. Penyebaran alami jenis ini mencakup wilayah Afganistan, Tibet, Nepal, Bhutan, Burma, Vietnam, Taiwan dan Cina. Di Indonesia, Cemara sumatra tumbuh secara alami sebagai sub kanopi di hutan pegunungan ataupun punggung pegunungan di Pulau Sumatera dan Sulawesi pada ketinggian 1.400 – 2.300 mdpl (Spjut 2003). Di Taiwan, jenis ini dikenal sebagai jenis konifer yang terancam punah dengan pola penyebaran yang terpencar mengelompok (Huang et al. 2008). Untuk Cemara sumatra yang tumbuh di Indonesia sampai dengan saat ini belum dilaporkan adanya publikasi ilmiah aspek ekologi yang komprehensif tentang jenis ini. Adapun penyebaran jenis ini di Indonesia seperti terlihat pada Gambar 2.
Koleksi pribadi, 2006
7
Gambar 2 Penyebaran Cemara sumatra di Indonesia. (Sumber: http://www.conifer.org)
Keterangan : Titik merah mengindikasikan wilayah penyebaran Cemara sumatra di Indonesia
Produk perdagangan dalam dunia tumbuhan obat terdiri dari berbagai komoditas mulai dari bahan baku mentah (akar, kulit batang, daun dll) sampai dengan hasil ekstrak atau produk farmasi akhir yang sudah dikemas. Ekstrak Taxus baik berupa bahan kimia mentah, setengah dimurnikan atau senyawa aktif yang sudah dikemas dan siap dikonsumsi merupakan bentuk produk yang diperdagangkan luas di dunia. Tambahan anonasi #10 pada Apendix II CITES untuk Taxus sumatrana berimplikasi terhadapa mekanisme perdagangannya yaitu pelarangan perdagangan segala bagian pohon dan turunannya, kecuali biji dan produk farmasi akhir siap konsumsi (CITES 2007). Dengan demikian, pemenuhan bahan baku dalam pembuatan Taxol bertumpu hanya pada dua pilihan utama yaitu pembangunan hutan tanaman dan pemanfaatan bioteknologi dalam sintesis senyawa Taxol (kultur suspensi sel, kultur rambut akar, pemanfaatan kapang endofitik, teknik fermentasi sel tanaman).
Keragaman Genetik
keragaman genetik yang tinggi mempunyai peluang hidup yang lebih baik karena mempunyai kemampuan yang lebih baik untuk beradaptasi dengan lingkungannya. Menurut Finkeldey (2005), keragaman genetik adalah suatu besaran yang mengukur variasi fenotype yang disebabkan oleh faktor-faktor genetik.
Keragaman genetik dapat dibagi menjadi keragaman genetik di dalam populasi dan antar populasi dimana masing-masing memiliki besaran/parameter pengukuran. Keragaman genetik dalam populasi biasanya diukur dengan polimorfisme atau persentase lokus polimorfik, rata-rata jumlah alel per lokus, keragaman gametik, keragaman genetik dan rata-rata tingkat heterozigositas. Keragaman antar individu dalam suatu jenis merupakan hal yang penting karena keragaman materi genetik yang berbeda tersebut akan menggambarkan perbedaan tingkat adaptasi individu di dalam suatu jenis terhadap dinamika kondisi lingkungannya. Individu-individu dalam generasi tertentu yang memiliki tingkat adaptasi tinggi terhadap lingkungannnya akan mampu bertahan hidup dan menghasilkan individu-individu turunan untuk generasi selanjutnya. Keragaman genetik antar populasi dihitung dengan menggunakan parameter jarak genetik, diferensiasi, pengelompokan keragaman genetik, dan analisa gerombol (Hattemer 1991 dalam Siregar 2000; Yeh 2000)
Random Amplified Polymorphic DNA (RAPD)
9
akan dianalisis, tersedianya primer yang secara universal dapat digunakan untuk organisme prokariot maupun eukariot, mampu menghasilkan karakter yang relatif tidak terbatas jumlahnya, bahan-bahan yang digunakan relatif lebih murah, mudah dalam preparasi, dan relatif cepat memberikan hasil (Weissing et al. 1995).
Pemilihan teknik RAPD dalam menganalisis keragaman genetik telah dilakukan pada beberapa jenis Taxus diantaranya adalah Taxus bacata, Taxus canadensis dan Taxus brevifolia. Teknik RAPD berhasil mendeteksi keragaman klonal dalam populasi, struktur populasi, diferensiasi dan dinamika genetik populasi, serta mendeteksi pengaruh persilangan resiprokal terhadap terbentuknya kultivar/hybrid baru (Hilfiker et al. 2004; Collins et al. 2003). Meskipun teknik ini semakin berkembang dan banyak digunakan untuk analisis genetik pada berbagai jenis dalam genus Taxus namun sampai saat ini belum ada laporan penelitian mengenai penggunaan teknik RAPD untuk analisa genetik Cemara sumatra yang tumbuh di Indonesia.
Sistem Perbanyakan Vegetatif Stek
Didapatnya teknik perbanyakan yang paling sesuai terutama untuk jenis-jenis yang terancam punah dapat menjadi salah satu kontribusi yang sangat penting dalam upaya pelestarian jenis tersebut. Dari berbagai teknik perbanyakan yang ada, penyetekan merupakan metode yang paling populer dalam memperbanyak tanaman secara vegetatif (Maden 2003). Adapun menurut Balitbanghut (2007), beberapa alasan digunakannya perbanyakan vegetatif antara lain adalah : a) Memperoleh keturunan dari pohon induk yang memiliki keunggulan genetik. Hal ini berkaitan erat dengan program pemuliaan dari suatu jenis; b) Sulitnya mendapatkan pasokan benih suatu jenis; dan c) Perbanyakan vegetatif dinilai akan lebih efisien untuk diterapkan pada jenis-jenis tertentu.
melaporkan stek batang Taxus cuspidata yang diperlakukan dengan larutan IBA 0,2% + NAA 0,1% + Thiamine 0,08% memiliki persentase berakar 73,5%. Namun demikian tingkat keberhasilan stek berakar untuk jenis Taxus wallichiana sangat kecil yaitu 20-30% dengan waktu pembentukan akar yang panjang yaitu 3 bulan.
Penyetekan di rumah kaca pada kondisi ternaungi dengan suhu lapisan bawah polibag yang dikondisikan pada 21 oC dan kelembaban yang tinggi cukup berhasil untuk Taxus brevifolia, Taxus canadensis, Taxus globosa dan Taxus floridana. Adapun sumber bahan stek adalah anakan alam yang berumur 1-2 tahun, panjang stek 10 - 20 cm, dan pencelupan dengan hormone IBA berkonsentrasi 5.000 – 10.000 ppm. Media yang digunakan adalah campuran spaghnum peat moss, vermikulit kasar dan perlite atau pasir (Vance & Rudolph 2000).
Penelitian yang cukup menyeluruh dan intensif mengenai teknik penyetekan pada Taxus telah dilakukan untuk jenis Taxus canadensis. Pada jenis ini terindikasi bahwa penyetekan dapat dilakukan pada setiap musim namun biaya dan keberhasilan berakar stek bervariasi untuk tiap musimnya. Penyetekan dengan bahan stek dari pucuk yang tidak dorman dan masih aktif melakukan pemanjangan (bulan Mei-Juli) dapat menjadi sangat problematik karena bahan stek mudah pecah dan sulit dalam mempertahankan suhu dan kisaran kelembaban dalam rumah kaca selama musim panas. Bahan stek pada berbagai ukuran hampir semuanya mampu berakar, ukuran bahan stek yang dipilih lebih pada pertimbangan tipe dan ukuran kontainer atau polibag yang digunakan. Untuk kontainer persemaian berukuran 65 cm2 dengan masa tumbuh stek di rumah kaca sekitar 1 tahun maka ukuran panjang bahan stek yang direkomendasikan adalah 7,5 - 10 cm. Perakaran yang baik tumbuh tepat diatas nodul sehingga pemotongan bahan stek diatas nodul akan lebih baik dibandingkan pada bagian antar nodul.
11
IBA 0,8% bentuk serbuk. Sebaiknya dibuatkan lubang tanam terlebih dahulu pada media tumbuh untuk mengurangi pecah atau luka bahan stek. Bahan stek ditanamkan dengan kedalaman minimal 3,0 cm - 4,0 cm, media di sekitarnya dipadatkan dan pH media dipertahankan pada 5,5 cm - 6 cm (Yeates et al. 2005).
Terdapat banyak faktor yang mempengaruhi kemampuan berakar stek. Salah satu faktor yang sangat signifikan untuk keberhasilan berakar adalah juvenilitas bahan stek dimana stek yang berasal dari ortet muda memiliki nilai persentase berakar lebih tinggi yaitu 70,8%, sedangkan stek dari ortet tua memiliki nilai persentase berakar 48,6 % (Mitchell 1997).
Analisis Keragaman Genetik Tempat dan waktu penelitian
Penelitian keragaman genetik tanaman Cemara sumatra dilaksanakan di Laboratorium Analisis Genetika, Departemen Silvikultur Fakultas Kehutanan IPB, sedangkan untuk dokumentasi hasil PCR dilaksanakan di Laboratorium Biorin, Pusat Studi Ilmu Hayati dan Bioteknologi IPB. Waktu Penelitian selama 5 bulan (Nopember 2007 – Maret 2008). Bagian yang digunakan untuk analisis keragaman genetik adalah bagian daun. Sampel diambil dari 3 populasi reproduktif yaitu populasi pohon induk alam, populasi anakan alam, dan populasi hasil perbanyakan. Sampel daun untuk populasi reproduktif pohon induk dan anakan alam Cemara sumatra diambil dari Gunung Kerinci, Taman Nasional Kerinci Seblat - Jambi, sedangkan populasi hasil perbanyakan vegetatif diambil dari hasil perbanyakan vegetatif yang ditanam di Kebun Raya Cibodas.
Alat dan bahan
Untuk analisis keragaman genetik tanaman Cemara sumatra alat yang digunakan adalah GPS Garmin Type 76C, tube, gelas piala, gelas ukur, sarung tangan, UV transiluminator, kamera digital, mortar dan pestel, hotplate, stirer, neraca analitik, vortex, Peltier Thermal Cycler MJ-100 Reserach, pipet, freezer dan sentrifuse.
13
ditunjukkan oleh GPS untuk tiap lokasi pengambilan sampel pada populasi pohon induk alam seperti terlihat pada Tabel 1, sedangkan kondisi anakan alam dan tanaman hasil perbanyakan yang diambil sampel daunnya untuk analisis keragaman genetik dapat dilihat pada Tabel 2 dan 3.
Tabel 1 Koordinat, ketinggian tempat, tinggi dan diameter pohon induk populasi alam Cemara sumatra yang dijadikan sampel untuk analisis RAPD
(cm) Diameter (cm) Orientasi tumbuh
Tabel 3 Kondisi tanaman Cemara sumatra hasil perbanyakan vegetatif di (polyvinylpyrrolidone) 2%, agarose, ethidium bromida (EtBr), buffer ekstrak, CTAB, Cloroform IAA, phenol, propanol, NaCl, etanol (ETOH) 100%, Taq Polymerase dan Primer dari Operon Technology.
Metode penelitian
Metode analisis DNA dengan RAPD dibagi menjadi tiga tahapan yaitu ekstraksi, RAPD dan analisis data. Secara umum prosedur penelitian dengan metode RAPD dapat dilihat pada Gambar 3.
Gambar 3 Prosedur penelitian keragaman genetik
Pengambilan Sampel Daun
Ekstraksi dan Isolasi DNA
Seleksi Primer
PCR-RAPD
Pemotretan Hasil Amplifikasi
15
Ekstraksi dan isolasi DNA
Isolasi DNA dilakukan dengan menggunakan metode CTAB (Milligan 1989) yang meliputi beberapa kegiatan yaitu: ekstraksi, pemurnian dan presipitasi. Pada kegiatan ekstraksi, sampel daun digerus dalam pestel dengan penambahan larutan buffer ekstraksi sebanyak 300-500 µl dan larutan PVP 2% sebanyak 100 µl sampai berbentuk serbuk. Hasil gerusan tersebut kemudian dimasukkan ke dalam tabung plastik steril yang kemudian diisi dengan buffer pengekstrak CTAB (komposisi pada Tabel 4.) sebanyak 500 µl dan ditambahkan 100 µl PVP 2%. Tabung kemudian ditutup rapat dan dikocok lalu diinkubasi dalam water bath selama 45 menit – 1 jam pada suhu 65 0C. Setiap 15 menit sekali tabung-tabung tersebut diangkat dari water bath untuk dikocok perlahan-lahan.
Tabel 4 Komposisi buffer ekstraksi
No. Nama Bahan 1 sampel reaksi X sample reaksi
Setelah inkubasi selesai, tabung diangkat dan didinginkan pada suhu ruang selam 15 menit dan dicuci dengan menambahkan 500 µl Cloroform IAA dan phenol 10 µl. Selanjutnya disentrifugasi pada 13.000 rpm selama 2 menit. Supernatan yang diperoleh kemudian dipindahkan ke tabung baru dengan penambahan kembali 500 µl Cloroform IAA dan phenol 10 µl dan disentrifugasi kembali pada 13.000 rpm selama 2 menit.
disentrifugasi kembali pada 13.000 rpm selama 2 menit. Cairan dibuang kembali dengan hati-hati agar pellet DNA tidak ikut terbuang. Setelah yang tertinggal hanya pellet DNA yang menempel pada dinding tabung, tahapan selanjutnya adalah dikeringanginkan dalam desikator selama 15 menit. Setelah pellet DNA kering, ditambahkan buffer TE sebanyak 40 µl lalu ketuk-ketuk dan disentrifugasi sampai tercampur merata.
Uji kualitas DNA
Untuk pengujian kualitas DNA maka agarose 1% (0,33 gram agarose dalam 33 ml TAE) disiapkan bersamaan dengan proses pengeringan pellet DNA dalam desikator. Untuk proses elektroforesis, 3 µl DNA masing-masing sampel dicampur dengan 2 µl blue juice 10 X. Masukkan campuran DNA dan blue juice pada sumur agarose 1% dengan menggunakan pipet mikro. Running dilakukan pada tegangan 100 volt selama ± 24 menit. Hasil elektroforesis kemudian direndam dalam larutan ethidium bromide (EtBr) 0,005 % (10 µl EtBr dalam 200 ml aquades) selama 5-10 menit, dan selanjutnya dilihat pada UV transiluminator dan didokumentasikan dengan menggunakan foto gel.
Seleksi primer
17
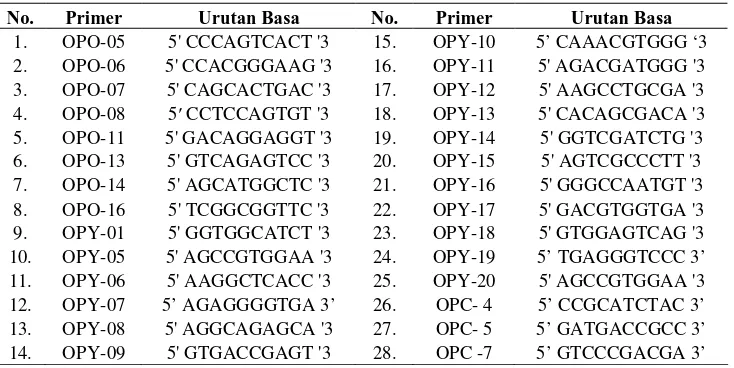
Tabel 5 Urutan basa nukleotida 28 primer dari Operon Technology
No. Primer Urutan Basa No. Primer Urutan Basa dan dicampur menjadi satu. Selanjutnya dilakukan pengenceran dengan penambahan 99 µl aquabidest. Ambil komponen campuran untuk reaksi PCR (green go Taq 7,5 µl, Nuclease-free water 2,5 µl, DNA mix masing-masing 2 µl dan primer masing-masing 1,5 µl) dan disentrifugasi selama 5-10 detik dan selanjutnya dimasukkan ke dalam mesin PCR.
DNA hasil PCR kemudian dielektroforesis dengan menggunakan agarose 2% (0,30 g agarose dalam 15 ml TAE) pada tegangan 90 volt selama 24 menit, selanjutnya dilihat pada UV transiluminator. Primer yang menghasilkan pita atau jumlah amplifikasi yang terbanyak digunakan untuk amplifikasi DNA dari 30 sampel yang diuji.
Amplifikasi dengan PCR (Polymerase Chain Reaction)
Sebelum melakukan amplifikasi PCR, DNA hasil ekstraksi diencerkan dengan aquabidest. Perbandingan antara DNA dengan aquabidest tergantung pada resolusi pita genomik hasil ekstraksi (misalnya pengenceran 100 X artinya 99 µl aquabides dan 1 µl DNA hasil ekstraksi.
sampel dari bibit tanaman, primer dan aquaidest. Komposisi bahan untuk PCR disajikan pada Tabel 6.
Tabel 6 Komposisi untuk reaksi PCR dengan bahan Green Go Taq
No. Nama Bahan 1 sampel reaksi X sample reaksi
1 H2O 2 mikro liter X x 2 mikro liter
2 Green Go Taq 7.5 mikro liter X x 7.5 mikro liter
3 Primer 1.5 mikro liter X x 1.5 mikro liter
4 Cetakan DNA 2 mikro liter X x 2 mikro liter
DNA hasil PCR dielektroforesis dengan menggunakan konsentrasi agarose 2% (0.66 gram agarose dalam 33 ml TAE), dirunning pada tegangan 90 volt selama 24 menit dan direndam dalam larutan etidium bromida 0,005% selama 5-10 menit. Visualisasi fragmen DNA dilakukan pada UV transiluminator. Selanjutnya hasil running tersebut didokumentasikan dengan menggunakan foto gel. Pengaturan suhu pada mesin PCR MJ Research PTC-100 disajikan pada Tabel 7.
Tabel 7 Tahapan dalam proses PCR
Tahapan Suhu (oC) Waktu (menit) Jumlah siklus
Berdasarkan foto DNA kemudian dilakukan skoring dan diterjemahkan dalam data biner berdasarkan ada tidaknya pita dengan ketentuan nilai 0 (nol) untuk tidak ada pita dan nilai 1 (satu) untuk adanya pita pada suatu posisi yang sama dari setiap individu yang dibandingkan (Gambar 10). Data yang diperoleh, diolah dengan menggunakan software POPGENE versi 3.2.
19
Gambar 4 Cara penilaian pita dengan sistem skoring (1 = ada pita, 0 = tidak ada pita).
Parameter yang diukur adalah keragaman genetik dalam populasi dan antar populasi. Parameter untuk keragaman genetik dalam populasi adalah:
- Persentase Lokus Polimorfik (PLP) - Jumlah alel efektif (Ae)
- Indeks Shanon (S)
- Keragaman genetik Nei-s/ Heterozigositas harapan (He)
Teknik Perbanyakan Vegetatif Stek
Tempat dan waktu penelitian
Penelitian teknik perbanyakan vegetatif dengan penyetekan dilaksanakan di rumah kaca Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam-Departemen Kehutanan. Penelitian dilakukan selama 7 bulan dari September 2007- Maret 2008.
Alat dan bahan
Alat yang digunakan untuk kegiatan ini adalah boks propagasi, gunting stek, ember plastik, pelubang media, dan cawan petri. Bahan penelitian terdiri dari bahan stek asal pohon induk di alam, tanah steril, sekam padi steril, serbuk kelapa steril, dan hormon perangsang akar (Rootone-F®).
Metode penyetekan
Secara garis besar metode penyetekan meliputi kegiatan mulai dari pengambilan bahan stek, penanaman, pemeliharaan, dan penyapihan. Secara lebih rinci diuraikan sebagai berikut.
Sumber bahan stek
Sumber bahan stek diambil dari cabang ortotrof pohon induk Cemara sumatra. Pohon induk yang dijadikan sumber bahan stek dipilih secara acak yang selanjutnya bahan stek dicampur menjadi satu.
Pengambilan bahan stek
21
mulai bahan stek diambil di alam sampai dengan ditanam di rumah kaca adalah 72 jam.
Pembuatan stek
Pemotongan bahan stek menjadi stek siap tanam dilakukan dengan gunting stek yang tajam dan bersih. Ukuran panjang stek yang ditanam adalah 7,5 -10 cm.
Penanaman stek
Penanaman stek dilakukan setelah media dan potongan stek disiapkan. Bahan dan alat yang diperlukan untuk penanaman stek adalah stek siap tanam, media tanam, air, ember besar, box propagasi, hormon tumbuh rootone-F pada konsentrasi 5 g per 100 bahan stek, pelubang media dan sungkup propagasi.
Media tanam merupakan faktor yang ingin dilihat pengaruhnya terhadap keberhasilan pembentukan akar. Media tanam yang digunakan dibagi menjadi 3 taraf yaitu :
M1 = tanah : sekam pada rasio 1:1 (v/v)
M2 = tanah : sekam : serbuk kelapa pada rasio 1:1:1 (v/v/v) M3 = sekam : serbuk kelapa pada rasio 1:2 (v/v)
Keterbatasan jumlah bahan stek yang diperoleh di lapangan membatasi jumlah ulangan yang dipakai. Jumlah bahan stek yang diperoleh di lapangan hanya 63 bahan stek sehingga pada penelitian ini setiap perlakuan diulang sebanyak 3 kali dan setiap ulangan terdiri dari 7 bahan stek. Dengan demikian, jumlah bahan stek yang ditanam untuk setiap perlakuan adalah 21.
box diberi tanda tanggal penanaman dan kode perlakuan untuk memudahkan proses pengecekan dan pencatatan data. Selanjutnya ditutup sungkup dan ditempatkan di dalam rumah kaca dengan sistem automatic misting.
Pemeliharaan di rumah kaca
Tindakan pemeliharaan stek pada tahap pembentukan akar di dalam rumah kaca meliputi penyiraman periodik, pembersihan gulma yang tumbuh pada box dan membuang guguran daun stek.
Penyapihan dan pengecekan akar
Pengecekan akar pertama dilakukan pada 12 minggu setelah tanam (MST), dilanjutkan pada 16 MST dan 20 MST. Penyapihan stek ke dalam polibag dilakukan pada 28 MST. Penyapihan dilakukan untuk menstimulir pertumbuhan stek setelah stek berakar.
Variabel Pengamatan
Parameter yang diamati untuk masing-masing perlakuan adalah:
- Persentase stek hidup (PSH), dihitung dengan membandingkan antara jumlah stek yang masih hidup normal pada akhir penelitian dengan jumlah stek yang ditanam pada awal penelitian.
- Persentase stek berakar (PSB), dihitung dengan membandingkan jumlah stek yang memiliki satu akar atau lebih pada akhir penelitian dengan jumlah stek yang diatanam pada awal penelitian.
- Jumlah akar primer (JAP), dihitung berdasarkan jumlah akar utama/primer yang terbentuk yaitu akar yang muncul langsung dari bahan stek.
- Panjang akar primer (PAP), dihitung dengan mengukur seluruh panjang akar primer.
- Jumlah akar sekunder (JAS), dihitung berdasarkan jumlah akar sekunder yang terbentuk yaitu akar yang tumbuh dari akar primer.
23
Pengamatan Histologi Akar
Pengamatan histologi akar dilakukan pada akhir pengamatan penyetekan untuk mengetahui daerah munculnya akar pertama kali. Untuk pengamatan ini dilakukan dengan membuat potongan longitudinal dari mulai pangkal stek. Tahapan kerja pembuatan preparat dengan menggunakan metode parafin adalah sebagai berikut:
Pematian, fiksasi dan dehidrasi
Pematian dan fiksasi dilakukan dengan merendam bahan ke dalam cairan FAA (Formaldehyd-Acetic Acid Alcohol) dengan komposisi 5:5:90 selama 3-4 hari. Fiksasi bertujuan untuk mengawetkan semua struktur sel sehingga sedapat mungkin berada pada keadaan yang sama dengan keadaan pada waktu masih hidup.
Dehidrasi dilakukan dengan merendam potongan bahan secara bertahap pada alkohol dengan kadar bertingkat yaitu 20%, 40%, 60% dan 100% secara rutin minimal 2 x 15 menit. Fungsi dehidrasi adalah untuk menghilangkan air dari jaringan agar dapat dimasuki cairan pelarut parafin (xylol).
Preparafinasi dan parafinasi
Preparafinasi dilakukan dengan memasukkan potongan bahan ke dalam campuran alkohol 100% dan xylol dengan perbandingan 4:0, 3:1, 2:2, 1:1, 1:3 dan 0:4 (v/v) secara berurutan masing-masing minimal selama 2 X 15 menit. Tahapan ini bertujuan untuk menghilangkan alkohol dari jaringan agar dapat dimasuki larutan parafin.
Penanaman dalam balok parafin
Penanaman dilakukan pada kotak dengan cetakan besi dengan cara meletakkan potongan bahan dalam cetakan, setelah sebelumnya parafin murni cair yang dituangkan terlebih dahulu dalam cetakan tersebut. Penanaman dilakukan dengan bantuan pinset sesuai dengan arah yang diinginkan (longitudinal). Setelah parafin mengeras, balok parafin beserta bahan dikeluarkan dari cetakan. Proses tersebut bertujuan menyimpan material ke dalam balok parafin agar memudahkan dalam penyayatan.
Penyayatan dan penempelan sayatan
Penyayatan dilakukan setelah terlebih dahulu balok parafin dibentuk trapesium dengan tujuan agar pita yang terbentuk lurus dan tidak pecah-pecah. Selanjutnya disayat pada mesin mikrotom putar dengan ketebalan diatur berkisar antara 5µ-20µ. Sayatan ditempel pada gelas preparat dengan menggunakan zat perekat berupa albumin. Setelah penempelan dilakukan, gelas preparat dipanaskan sebentar dengan oven pada suhu 40 – 60 o C agar sayatan merekat erat.
Pewarnaan dan penjernihan
Kegiatan pewarnaan berdasarkan pada metode SAS (1968) yang terbagi menjadi penjernihan tahap I (dedehidrasi I), pewarnaan, dan penjernihan tahap II (Dedehidrasi II).
Penjernihan tahap I dilakukan dengan memasukkan secara berurutan ke dalam xylol, xylol-alkohol (1:1), alkohol 100 %, ETOH 80 %, alkohol 60 % , alkohol 40 % dan alkohol 20 %, aquadest masing–masing selama 5 menit. Tujuan penjernihan ini adalah agar menghilangkan parafin dalam jaringan.
Pewarnaan dilakukan agar bagian-bagian tertentu pada jaringan menjadi lebih kontras dan mudah diamati. Pewarnaan dilakukan dengan menggunakan pewarna Easin, setelah itu dimasukkan ke dalam aquades selama 5 menit, dilanjutkan dengan metil blue. Pencelupan ke dalam zat warna masing-masing dilakukan minimal selama 30 menit.
25
bahan. Selanjutnya sayatan bahan yang diperoleh diolesi dengan etilen agar gelas penutup menempel dengan sempurna dan terlindungi.
Pemotretan
Keragaman Genetik Cemara sumatra Keragaman genetik dalam populasi
Dari 28 primer keluaran Operon Technology yang diseleksi, 6 primer mampu menghasilkan pita DNA yang jelas dan polimorfik. Keenam primer tersebut adalah OPO-6 (O6), OPO-13 (O13), OPY-14 (Y14), OPY-15 (Y15), OPY-20 (Y20), dan OPC-5 (C5). Keenam primer tersebut selanjutnya dipakai untuk menganalisis keragaman genetik Cemara sumatra berdasarkan penanda RAPD. Gambar 5 merupakan hasil amplifikasi pita DNA yang diperlihatkan oleh 28 primer yang dicobakan sedangkan sekuen primer yang menghasilkan pita polimorfik dan jumlah pita yang dihasilkannya terlihat pada Tabel 8. Hasil foto untuk masing-masing primer pada tiap populasi seperti terlihat pada Gambar 6 - Gambar 11.
Gambar 5 Hasil amplifikasi pita yang diperlihatkan oleh primer-primer yang dicobakan.
Keterangan : M= Marker; O= OPO; Y=OPY; C=OPC.
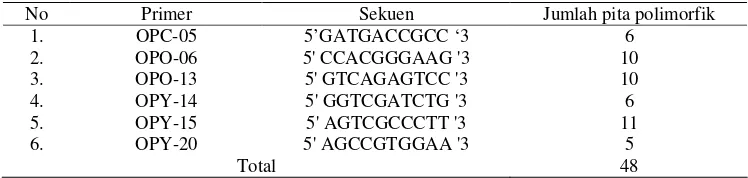
Tabel 8 Sekuen primer dan jumlah pita polimorfik yang dihasilkan
No Primer Sekuen Jumlah pita polimorfik
1. OPC-05 5’GATGACCGCC ‘3 6
2. OPO-06 5' CCACGGGAAG '3 10
3. OPO-13 5' GTCAGAGTCC '3 10
4. OPY-14 5' GGTCGATCTG '3 6
5. OPY-15 5' AGTCGCCCTT '3 11
6. OPY-20 5' AGCCGTGGAA '3 5
Total 48
27
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 M
100bp
500bp
1000bp
Gambar 6 Amplifikasi RAPD oleh primer OPC-05.
Keterangan : M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
Gambar 7 Amplifikasi RAPD oleh primer OPO-06.
Keterangan : M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
Gambar 8 Amplifikasi RAPD oleh primer OPO-13.
Keterangan : M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 M 21 22 23 24 25 26 27 28 29 30
100bp
500bp
1000bp
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 M 21 22 23 24 25 26 27 28 29 30
100bp
500bp
Gambar 9 Amplifikasi RAPD oleh primer OPY-14.
Keterangan M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
Gambar 10 Amplifikasi RAPD oleh primer OPY-15.
Keterangan : M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
Gambar 11 Amplifikasi RAPD oleh primer OPY-20.
Keterangan : M = Marker; 1-10 = individu populasi pohon induk; 11-20 = individu populasi anakan alam; 21-30 = individu populasi hasil perbanyakan vegetatif di Cibodas
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 M 21 22 23 24 25 26 27 28 29 30
100bp
500bp
1000bp
1500bp
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 M 21 22 23 24 25 26 27 28 29 30
100bp
500bp
1000bp
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20 M 21 22 23 24 25 26 27 28 29 30
100bp
29
Dari keseluruhan 30 individu sampel, enam primer yang terseleksi mampu menghasilkan jumlah total pita (lokus) sebanyak 48 dengan ukuran 100-1500 bp. Jumlah lokus yang dihasilkan setiap primer berkisar dari 5-11 lokus dengan rata-rata 8 lokus per primer.
Tabel 9 memperlihatkan bahwa dari total 48 lokus yang terdeteksi, 47 (97,92%) merupakan lokus polimorfik. Persentase lokus polimorfik pada tingkat populasi memiliki nilai rata-rata 69,43%, dengan kisaran 45,83% - 83,33%. Rata-rata jumlah alel efektif per lokus pada tingkat populasi dan jenis adalah 1,4039 dan 1,5715. Berdasarkan hukum kesetimbangan Hardy-Weinberg, rata-rata keragaman gen di tingkat populasi (He) adalah 0,2346 dan 0,3301 di tingkat jenis. Indeks Shanon memiliki nilai 0,3524 dan 0,4941 pada tingkat populasi dan jenis. Dari ketiga populasi yang dianalisis, populasi pohon induk alam (He = 0,2590) dan hasil perbanyakan di Kebun Raya Cibodas (He = 29,59) memperlihatkan tingkat variabilitas yang jauh lebih tinggi dibanding populasi anakan alam (He = 0,1490).
Tabel 9 Variabilitas genetik dalam populasi reproduktif Cemara sumatra berdasarkan analisis RAPD Keterangan : n = ukuran sampel; Ae = jumlah alel efektif per lokus; He = keragaman genetik Nei;
S = index Shanon; PLP = persentase lokus polimorfik, Gst = diferensiasi genetik antar
populasi.
Jika dibandingkan dengan jenis lain maka nilai keragaman genetik Cemara sumatra lebih tinggi dibanding jenis tumbuhan yang menyebar regional (He = 0,21) tetapi sedikit lebih rendah dibanding jenis dengan tipe penyerbukan menyilang (He= 0,27) (Nybom&Bartish, 2000; Nybom, 2004). Nilai index Shanon rata-rata sebesar 0,3524 hampir mendekati nilai index Shanon untuk jenis-jenis Gymnospermae secara umum (S=0,386) dan jauh lebih tinggi jika dibandingkan dengan index Shanon tumbuhan berkayu tahunan lainnya (S=0,241) (Nybom & Bartish, 2000).
Nilai keragaman genetik dalam populasi Cemara sumatra lebih tinggi jika dibandingkan dengan jenis Taxus lainnya seperti Taxus fuana asal Pakistan (He = 0,1165) (Shah et al. 2008), Taxus wallichiana asal India bagian Tenggara (Saikia et al. 2000), Taxus canadensis (He = 0,102) (Senneville et al. 2001), dan Taxus
31
angin. Bijinya juga disukai oleh burung dan vertebrata. Nilai keragaman genetik dalam populasi Cemara sumatra yang cukup tinggi bisa disebabkan oleh faktor-faktor diatas. Selain itu, kurang dikenalnya Cemara sumatra yang tumbuh di Indonesia menyebabkan jenis ini cukup aman dari eksploitasi. Tidak terjadinya eksploitasi terhadap jenis ini juga bisa menjadi faktor yang menyebabkan keragaman genetik Cemara sumatra asal Indonesia masih tergolong tinggi.
Tingkat keragaman genetik yang tinggi juga diperlihatkan oleh Taxus baccata (He = 0,279; PLP 71%). Tingginya keragaman jenis tersebut dikaitkan dengan tingkat adaptabilitas jenis yang tinggi terhadap lingkungan yang disertai dengan distribusi geografis yang luas (Lewandowski et al. 1995).
Keragaman genetik populasi anakan Cemara sumatra lebih rendah (He = 0,1490: S = 0,2249; PLP 45,83%) dibanding populasi pohon induk (He = 0,2590; S = 0,3968; PLP = 83,33%) dan hasil perbanyakan vegetatif (He = 0,2959; S = 0,4356; PLP = 79,17%). Hasil yang sama diperoleh untuk jenis Taxus baccata (Lewandowski et al. 1995) dimana tingkat homozigositas populasi hasil keturunan generatif sangat tinggi, sedangkan tingkat homozigositas untuk populasi induk sendiri sangat rendah. Taxus baccata merupakan jenis pohon dioceous sehingga segala bentuk inbreeding yang terjadi bisa dipastikan merupakan hasil perkawinan antar saudara. Hubungan kekerabatan yang terjadi diantara hasil keturunan generatif ini bisa disebabkan karena terbatasnya penyebaran biji dan terjadinya perkawinan antar tetangga dekat.
Menurut Hartman et al. (1997), perubahan gen dan kromosom dapat terjadi di dalam sel-sel somatik/vegetatif, jika hal ini diikuti dengan pembelahan mitosis akan berimplikasi terhadap perubahan permanen dalam sebuah klon. Satu perubahan kromosonal sendiri sebenarnya jarang terjadi namun karena pertumbuhan vegetatif dalam klon melibatkan jutaan pembelahan sel dalam satu rentang waktu yang cukup lama maka perubahan pada tingkat kromosom tersebut menjadi realistis. Selain dapat terjadi secara alami, mutasi dan perubahan kromosonal dapat terjadi secara buatan seperti pemberian bahan-bahan kimia tertentu pada titik tumbuh.
Dari hasil penelitian diperoleh bahwa tingkat keragaman genetik populasi Cemara sumatra lebih tinggi dibanding Taxus canadensis, Taxus brevifolia, Taxus fuana, dan Taxus wallichiana dan hanya sedikit lebih rendah dibanding Taxus baccata dan jenis konifer. Hal ini menunjukkan bahwa keragaman genetik jenis ini cukup besar. Karena tempat tumbuh alami Cemara sumatra di Indonesia sampai dengan saat ini diketahui hanya di wilayah Gunung Kerinci, strategi konservasi in-situ mutlak diperlukan untuk menjaga kelangsungan jenis ini. Tingkat keragaman genetik dalam populasi yang cukup tinggi merupakan satu hal yang cukup menguntungkan karena merupakan salah satu indikasi bahwa tingkat adaptabilitas jenis terhadap lingkungan cukup baik. Namun demikian, faktor luar yang mempengaruhi stabilitas lingkungan yang sifatnya tambahan terutama berupa gangguan kerusakan habitat akibat aktivitas manusia harus diminimalisir.
Berdasarkan hasil penelitian dapat diketahui bahwa keragaman genetik populasi hasil perbanyakan vegetatif memiliki nilai yang tinggi. Selain itu, keberadaan anakan pada habitat alaminya sangat langka dengan nilai keragaman yang rendah. Oleh karena itu maka strategi konservasi ex-situ sebagai upaya pelestarian jenis ini di luar habitat tumbuh alaminya perlu dikembangkan.
33
berlainan. Semakin banyak kelompok yang terwakili akan semakin baik untuk menjaga keragaman genetik yang tetap tinggi.
Keragaman genetik antar populasi
Diferensiasi genetik antar populasi (GST) memiliki nilai 0,2892 (Tabel 9) yang mengindikasikan bahwa 28,92% variabilitas genetik terdapat di antara populasi. Dari Tabel 10 dapat dilihat bahwa nilai keragaman genetik berdasarkan analisis keragaman genetik Nei (1972;1973) menunjukkan bahwa populasi hasil perbanyakan mempunyai keragaman lebih tinggi (29,59%) dibanding populasi pohon induk alam (25,90%) dan populasi anakan alam (14,90%). Sedangkan besarnya jarak genetik Nei (do) antar populasi berkisar dari 0,1308 – 0, 2598 dengan nilai rata-rata 0,2041 atau dengan kata lain sekitar 80% dari keragaman genetik berada di dalam populasi dan 20% sisanya merupakan jarak genetik antar populasi.
Tabel 10 Nilai keragaman genetik dalam populasi (diagonal) dan antar populasi (bawah diagonal) Cemara sumatra berdasarkan Nei’s Gene Diversity (1973) dan Nei’s Original Measures of Genetic Distance (1972).
Populasi Pohon induk alam (A) Anakan alam (B) Hasil perbanyakan (C)
Pohon induk alam (A) 0,2590 - -
Anakan alam (B) 0,2598 0,1490 -
Kebun Raya Cibodas (C) 0,1308 0,2216 0,2959
rendah dibanding Taxus fuana (GST = 0,5842) dan lebih tinggi dibanding Taxus brevifolia (GST = 0,077), dan Taxus canadensis (GST = 0,102).
Berdasarkan jarak genetik Nei (1972) populasi reproduktif Cemara sumatra terbagi ke dalam 2 kelompok. Populasi pohon induk alam dan populasi hasil perbanyakan vegetatif berada pada satu kelompok yang sama dan kelompok kedua hanya terdiri dari populasi anakan alam.
Sumber bahan stek dari populasi Cibodas berasal dari wilayah yang sama dari populasi pohon induk alam yaitu dari Gunung Kerinci-Jambi, dengan demikian antara populasi pohon induk dan populasi Cibodas tersebut memiliki jarak genetik yang lebih dekat (0,1308) dibanding dengan populasi anakan alam dimana jarak genetik antara populasi pohon induk dan anakan alam bernilai 0,2598. Populasi anakan alam merupakan hasil dari perbanyakan generatif dengan peleburan dua individu sehingga secara genetik merupakan perpaduan dari dua individu dan membentuk pola genetik tersendiri.
Perbanyakan Vegetatif Stek
Hasil pengolahan data menunjukkan bahwa dari ketiga media tanam stek yang dicobakan hanya terdapat satu variabel pengamatan yang berbeda secara nyata yaitu persen stek berakar (Tabel 11).
Tabel 11 Rekapitulasi hasil sidik ragam penggunaan tiga media tanam yang berbeda terhadap perkembangan stek Cemara sumatra 28 MST
Media
No Variabel
M1 M2 M3
1. Stek hidup (%) 71,4a 76,2a 95,2a
2. Stek berakar (%) 47,6ab 28,6b 66,7a
3. Rata-rata jumlah akar primer per stek (buah) 5,530a 4,833a 4,817a 4. Rata-rata panjang akar primer per stek (buah) 2.620a 3,580a 3,040a 5. Rata-rata jumlah akar sekunder per stek (buah) 0,390a 0,217a 0,563a 6. Rata-rata panjang akar sekunder per stek (buah) 0,163a 0,047a 0,253a Keterangan : angka pada baris yang diikuti satu atau lebih huruf yang sama tidak berbeda nyata
35
Persentase stek hidup dihitung berdasarkan jumlah stek yang masih segar (hidup) dan tidak memperlihatkan gejala kematian sedangkan persentase stek berakar dihitung berdasarkan jumlah stek yang memiliki satu akar atau lebih pada akhir penelitian. Tabel 12 menunjukkan pengaruh media tanam terhadap persentase stek hidup dan berakar sedangkan Gambar 12 memperlihatkan persentase stek hidup dan stek berakar untuk tiap perlakuan.
Tabel 12 Hasil sidik ragam persentase hidup dan berakar stek Cemara
Keterangan : ns = tidak berbeda nyata; * = berbeda nyata pada taraf 5%.
Gambar 12 Persentase hidup dan berakar stek Cemara sumatra.
pada Tabel 13 menunjukkan bahwa media serbuk kelapa : sekam pada 2:1 (v/v) (M3) menghasilkan persentase stek yang paling tinggi yaitu 66,7%.
Tabel 13 Hasil uji Duncan pengaruh media terhadap persentase berakar stekCemara sumatra
No. Perlakuan (Media) Rata-rata (%)
1. Tanah : sekam pada 1:1 (M1) 47,6ab
2. Tanah : sekam : serbuk kelapa pada 1:1:1 (M2) 28,6b
3. Serbuk kelapa : sekam pada 2:1 (M3) 66,7a
Keterangan : Angka yang diikuti satu atau lebih huruf yang sama tidak berbeda secara nyata.
Perlakuan pemakaian media yang berbeda dalam penyetekan Cemara sumatra menghasilkan perbedaan yang signifikan hanya pada variabel persentase stek berakar. Untuk variabel lainnya, perlakuan tidak berbeda nyata. Dengan kondisi ini berarti bahwa pada saat stek sudah mampu berakar maka perlakuan media apapun mampu menghasilkan jumlah dan panjang akar primer maupun sekunder yang sama banyaknya. Gambar 13 berikut memperlihatkan morfologi akar stek Cemara sumatra pada berbagai media yang dicobakan.
Gambar 13 Kondisi perakaran stek Cemara sumatra 28 MST pada tiga media berbeda.
Keterangan : M1 = media tanah-sekam pada 1:1 (v/v); M2 = tanah-sekam-serbuk kelapa pada 1:1:1 (v/v/v); M3 = serbuk kelapa-sekam pada 2:1(v/v).
M1 M2
M3 5 cm
5 cm
37
Berdasarkan hasil pengecekan terhadap akar stek Cemara sumatra, pemunculan kalus ataupun akar stek di ketiga media mulai terjadi pada minggu ke-16. Waktu yang sama dibutuhkan Taxus canadensis untuk pembentukan akar (Yeates et al. 2005) dan masih lebih lama jika dibandingkan dengan Taxus wallichiana yang hanya perlu 12 minggu untuk membentuk akar (Chee 1995 dalam Kulkarni 2000). Namun demikian, periode yang jauh lebih lama diperlukan stek Taxus baccata tanpa penambahan hormon untuk membentuk akar yaitu setelah bulan ke-6 dan bahkan pada beberapa bahan stek, akar baru muncul setelah bulan ke-12 (Maden 2003).
Seperti jenis tumbuhan lainnya yang mampu diperbanyak dengan penyetekan, jenis-jenis Taxus sebenarnya mampu berakar tanpa penambahan bahan kimia apapun asal berada pada kondisi lingkungan yang sesuai dimana mereka tumbuh secara alami. Hal ini sesuai dengan praktek masyarakat lokal di Nepal yang mampu memperbanyak Taxus baccata dengan teknik yang sangat sederhana tanpa penambahan hormon apapun. Untuk membuktikan hal tersebut maka Maden (2003) melakukan percobaan stek cabang Taxus baccata berdiameter 3-5 cm dengan panjang 15-20 cm dari pohon induk alam yang ditanam pada habitat alaminya tanpa perlakuan penambahan hormon perangsang akar dan hasilnya nilai persentase berakar mencapai 90% jika waktu penanaman dilakukan pada bulan Mei-Juni. Persentase berakar menurun drastis yaitu hanya 30% saja jika waktu penanaman dilakukan pada bulan Februari-Maret. Dari hal ini terlihat bahwa faktor lingkungan (iklim) sangat berperan signifikan terhadap keberhasilan pembentukan akar stek.
Untuk kegiatan perbanyakan melalui penyetekan di luar habitat aslinya (di rumah kaca atau persemaian), pemberian hormon secara signifikan meningkatkan keberhasilan berakar stek Taxus bervifolia dari 30,6% menjadi 50% (Mitchell 1997) dan Taxus canadensis dari 36% menjadi 49% (Webster 2005). Berdasar hasil tersebut maka pada penelitian ini pemberian hormon dilakukan secara seragam terhadap semua bahan stek Cemara sumatra.
mendukung dalam merangsang pembentukan akar bahan stek. Perbedaan media diketahui sebagai salah satu faktor yang berpengaruh dalam keberhasilan penyetekan. Yeates et al. (2005) menyatakan pada Taxus canadensis media yang paling cocok digunakan adalah campuran gambut - vermikulit pada perbandingan 2:1. campuran media gambut - vermikulit pada perbandingan 3:1 (v/v) harus dihindari karena akan mengurangi aerasi dan keberhasilan pembentukan akar. Pada Taxus globosa (Nicholson & Munn 2003), campuran media yang digunakan adalah pasir kasar - perlite kasar pada 1:1 (v/v), sedangkan Mitchell (1997) menggunakan campuran media pasir – gambut- perlite kasar pada 1:1:1 (v/v/v) untuk Taxus brevifolia.
Media stek merupakan salah satu unsur penentu keberhasilan proses pembentukan akar. Pemilihan media harus memperhatikan 3 karakteristik media yaitu; 1) Kandungan kimia, dimana media yang baik harus memiliki kandungan kkimia yang minimal agar tidak mengganggun proses penyerapan air oleh stek dari media; 2) Sifat fisik, berkaitan erat dengan kemampuan mengikat air dan porositas media. Media stek yang ideal adalah yang memiliki aerasi cukup namun dapat mengikat air; 3) Kandungan mikrobiologi, dimana media yang baik adalah media yang higienis atau populasi mikrobanya rendah (Balitbanghut 2007)
39
Jumlah dan panjang akar primer dan sekunder
Hasil pengamatan untuk variabel jumlah dan panjang akar primer dan sekunder seperti terlihat pada Tabel 14 berikut ini.
Tabel 14 Kondisi perakaran stek Cemara sumatra 28 MST pada tiga media yang berbeda
Keterangan : Angka pada baris yang diikuti satu atau lebih huruf yang sama tidak berbeda nyata pada taraf 0,5%.
Pada Gambar 14 dapat dilihat rata-rata jumlah akar primer yang terbentuk untuk media tanam M1 M2, dan M3 masing-masing adalah 5,530; 4,838, dan 4,817. Meskipun M1 memberikan rata-rata jumlah akar primer yang paling banyak diantara ketiga media yang dicobakan namun berdasarkan uji sidik ragam nilai-nilai tersebut tidak berbeda nyata.
Media M3 yang memiliki rata-rata jumlah akar primer paling sedikit ternyata menghasilkan rata-rata jumlah akar sekunder yang paling banyak yaitu 0,563. Namun demikian nilai rata-rata jumlah akar sekunder yang terbentuk pada ketiga media yang dicobakan juga tidak berbeda nyata.
3.040 a 3.580 a
2.620 a
0,047a 0.163 a
0.253 a
0,000 1,000 2,000 3,000 4,000 5,000
M1 M2 M3
Primer Sekunder
Panjang akar primer dan akar sekunder merupakan salah satu variabel yang diukur untuk melihat ada tidaknya perbedaan perakaran yang terbentuk. Seperti terlihat pada Gambar 15, rata-rata panjang akar primer yang terbentuk untuk masing-masing media M1, M2 dan M3 adalah 2,620; 3,590 dan 3,040. Meskipun terdapat perbedaan panjang akar primer yang terbentuk pada ketiga media namun secara statistik tidak berbeda nyata. Media yang menghasilkan panjang akar sekunder paling tinggi adalah M3 (0,253) namun demikian panjang akar sekunder pada M1, M2 maupun M3 secara statistik juga tidak berbeda nyata.
Gambar 15 Panjang akar primer dan sekunder stek Cemara sumatra 28 MST pada tiga media berbeda.
Pertumbuhan dan perkembangan akar pada stek
41
Gambar 16 Penampang melintang akar Cemara sumatra hasil penyetekan.
Keterangan : ep = epidermis; kr = korteks; ph = phloem; ka = kambium; aa = akar adventif
Biasanya asal dan perkembangan akar adventif terjadi di sebelah luar dari bagian tengah jaringan vaskular (Hartmann et al. 1997). Berdasarkan hasil mikroteknik, pembentukan akar pada stek Cemara sumatra dimulai dari sel-sel meristem pada kambium. Pada beberapa stek, akar terbentuk dengan didahului oleh terbentuknya kalus (Gambar 17). Kalus merupakan massa sel tak berbentuk yang merupakan kumpulan dari sel-sel parenkim dengan berbagai tahap lignifikasi. Pertumbuhan kalus ini berasal dari sel-sel muda dalam daerah jaringan kambium vaskular, meski sebenarnya berbagai sel korteks dan bahkan empulur dapat juga berkontribusi dalam pembentukan kalus ini.
Akar adventif yang muncul pada stek Cemara sumatra selain berasal dari jaringan meristem pada kambium dan jaringan kalus, ada juga akar adventif pada batang yang tumbuh secara spontan. Akar seperti ini berasal dari dalam jaringan batang dan kemudian tumbuh keluar (Gambar 18). Secara alami fenomena ini sering dijumpai pada tegakan di hutan alam.
ep
aa kr
ph