Pernyataan Keaslian
Yang bertanda tangan di bawah ini menyatakan secara jujur bahwa laporan yang saya buat adalah hasil kerja sendiri, tidak menjiplak hasil kerja orang lain dan atau tidak memanipulasi data. Jika terbukti ada hal-hal sebagai hasil menjiplak karya orang lain dan atau memanipulasi data, maka saya siap menerima sanksi yang semestinya. Selesai pada tanggal: 23 Mei 2013 yang menyatakan,
Jam : 20.00 WIB
Rian Bahar R.
Asisten Praktikum,
...
Total Nilai:
KESEIMBANGAN FASA DUA KOMPONEN
oleh:
Nama : RianBahar Rahmadi NIM : 11670023
Prodi : Pendidikan kimia Klp/Sift : IV/1
Total Nilai:
A. Tujuan percobaan
1. Menggambarkan fasa dua komponen cair-cair.
2. Menentukan titik kelarutan kritis pada kesetimbangan fasa dua komponen fasa cair-cair.
3. Menentukan fasa komponen dan derajat kebebasan suatu sistem kesetimbangan fasa dua komponen fasa cair – cair.
B. Dasar teori
1. Larutan dan kelarutan
Reaksi kimia kebanyakan berlangsung dalam lingkungan berair, oleh karenanya penting untuk memahami sifat-sifat larutan. Larutan adalah campuran homogen dari dua atau lebih zat, di mana zat yang lebih banyak disebut pelarut dan yang lebih sedikit disebut zat terlarut. Dalam cairan dan padatan, molekul-molekul saling terikat akibat adanya tarik-menarik antar molekul-molekul. Bila suatu zat (zat terlarut) larut dalam zat lainnya (pelarut), partikel zat terlarut akan menyebar ke seluruh pelarut. Partikel ini menempati posisi yang biasanya ditempati oleh molekul pelarut. Pelarutan ini berlangsung dalam tiga tahap berbeda. Tahap 1 ialah pemisahan molekul pelarut, dan tahap 2 adalah pemisahan molekul zat terlarut. Kedua tahap ini memerlukan input energi untuk memutuskan tarik-menarik antar molekul, dengan demikian tahap ini adalah tahap endotermik. Pada tahap 3 molekul pelarut dan molekul zat terlarut bercampur. Tahap ini dapat bersifat eksotermik atau endotermik (Chang, 2003).
Ukuran jumlah atau bilangan yang menyatakan rasio jumlah mol komponen terhadap jumlah mol semua komponen yang ada disebut dengan fraksi mol. Misalnya suatu larutan mengandung zat A dan zat B, maka fraksi mol untuk masing-masing zat yaitu:
Jumlah fraksi mol kedua zat adalah satu. Fraksi mol tidak memiliki dimensi (satuan), hal ini sesuai dengan persamaan diatas di mana satuannya saling meniadakan (Chang, 2003).
2. Fasa
Materi terdiri dari tiga wujud, yaitu cair, padat, dan gas. Setiap wujud ini disebut fasa, yang merupakan bagian homogen suatu sistem yang bersentuhan dengan bagian sistem yang lain dengan batas yang jelas. Perubahan fasa yaitu peralihan dari satu fasa ke fasa lain, terjadi apabila energi ditambahkan atau dilepaskan. Perubahan fasa merupakan perubahan fisis yang ditandai dengan perubahan dalam keteraturan molekul. Molekul-molekul dalam wujud padat memiliki keteraturan tertinggi, dan molekul-molekul dalam fasa gas memiliki keacakan tertinggi (Chang, 2003).
Perubahan fasa terjadi pada temperature dan tekanan tertentu. Es adalah fasa stabil dari air pada temperatur di bawah 0oC dan tekanan 1 bar, tetapi pada
temperatur di atas 0oC dan tekanan 1 bar, air cair lebih stabil. Hal ini menunjukan
bahwa potensial kimia es lebih rendah dari pada potensial kimia cairan pada temperatur di bawah 0oC (Atkins, 1996).
suatu cairan yang dapat berupa zat murni ataupun campuran. Sistem disebut biner karena terdiri atas dua komponen yaitu fenol dan akuades. Sistem biner fenol – akuades tergolong fasa padat – cair, fenol berupa padatan dan akuades berupa cairan. Kelarutan sistem ini akan berubah apabila dalam campuran itu ditambahan salah satu komponen penyusunnya yaitu fenol atau akuades. Temperatur mempengaruhi komposisi kedua fasa pada kesetimbangan. Kemampuan bercampurnya fenol – akuades akan bertambah apabila temperatur dinaikkan (Atkins, 1996).
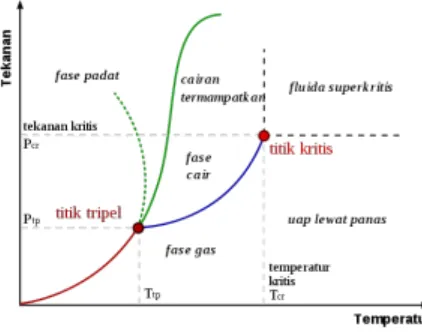
Diagram fasa adalah diagram yang menggambarkan daerah-daerah tekanan dan temperatur di mana berbagai fasa bersifat stabil.
Gambar 1 Diagram fasa untuk air
Batas-batas fasa menunjukan nilai-nilai tekanan dan temperatur di mana dua fasa berada dalam kesetimbangan. Titik kritis yaitu titik pertemuan antara temperatur kritis (Tc) dan tekanan kritis (Pc). Tc yaitu temperatur di mana batas antara dua fasa menghilang dan Pc yaitu tekanan di mana Tc terjadi. Sistem biner di atas Tc menjadi fasa tunggal dan tidak ada lagi bidang pemisah (Atkins, 1996).
Beberapa sistem mempunyai temperatur kritis atas (Tuc) dan temperatur
kritis bawah (Tlc). Tuc adalah batas atas temperatur di mana terjadi pemisahan fasa.
bawah temperatur di mana terjadi pemisahan fasa. Di bawah temperatur batas bawah kedua komponen bercampur dalam segala perbandingan dan di atas temperatur itu kedua komponen membentuk dua fasa. Salah satu contohnya adalah air dan trietilamina. Dalam hal ini, pada temperatur rendah kedua komponen lebih dapat bercampur karena komponen-komponen itu membentuk kompleks yang lemah, pada temperatur lebih tinggi kompleks itu terurai dan kedua komponen kurang dapat bercampur (Atkins, 1996).
3. Derajat kebebasan
Derajat kebebasan adalah jumlah variabel intensif yang dapat dipilih agar keberadaan variabel intensif dapat ditetapkan. Variabel intensif dapat berupa temperatur, tekanan, dan konsentrasi. Derajat kebebasaan dirumuskan
F= C + 2− P
Untuk kesetimbangan apapun dalam sistem tertutup, jumlah variabel bebas (F) sama dengan jumlah komponen (C) ditambah 2 dikurangi jumlah fasa (P) (Atkins, 1996).
4. Ikatan hidrogen
Hidrogen (H) apabila berikatan dengan atom lain (X), terutama F, O, N, atau Cl sedemikian hingga ikatan X–H benar-benar polar. H mengandung muatan parsial positif, sehingga dapat berinteraksi dengan atom lain yang kaya elektron (Y), membentuk ikatan hidrogen, ditulis sebagai
X−̵ ̵ ̵ H ̵ ̵ ̵ Y
Jarak H–Y ikatan hidrogen umumnya jauh lebih panjang dari ikatan kovalen H–Y yang normal. Ikatan hidrogen menjadi kuat apabila jarak X terhadap Y pendek, dan jarak X–H serta H–Y hampir sama besarnya (Cotton, 1989).
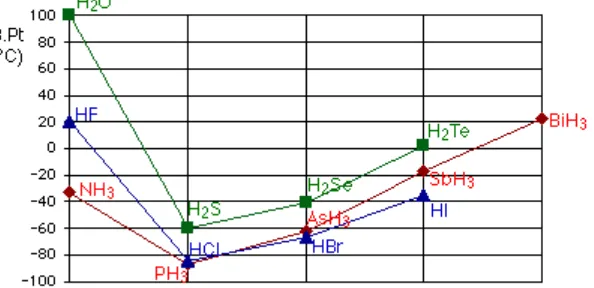
umumnya, titik didih sederet senyawa dalam golongan yang sama meningkat dengan meningkatnya massa molar. Tetapi senyawa hidrogen unsur-unsur golongan 5A, 6A, dan 7A (NH3, H2O, HF) tidak mengikuti kecenderungan
tersebut. Dalam setiap deret ini, senyawa yang paling ringan (NH3, H2O, HF)
memiliki titik didih tertinggi, bertentangan dengan dugaan berdasarkan massa molar. Alasannya adalah adanya ikatan hidrogen yang meluas antara molekul-molekul dalam senyawa tersebut (Chang, 2003).
Gambar 2Titik didih senyawa hidrogen untuk unsur golongan 5A, 6A, dan 7A Kekuatan ikatan hidrogen ditentukan oleh interaksi antara pasangan elektron bebas pada atom elektronegatif dan inti hidrogen (Chang, 2003).
C. Alat dan bahan
Alat-alat yang digunakan dalam percobaan adalah gelas piala 500 mL, termometer 150oC, gelas arloji besar, spatula, statif, klem, pipet ukur 5 mL, bola
hisap, tabung reaksi besar, gelas piala 100 mL dan botol akuades. Bahan-bahan yang digunakan dalam percobaan adalah fenol, akuades dan NaCl.
D. Cara kerja
dan ditambahkan 2 mL akuades, kemudian larutan dimasukkan kembali dalam penangas air dan dicacat temperatur ketika campuran larut. Langkah kerja yang terakhir diulang hingga volum total akuades 15 mL. Cara kerja tersebut diulang dengan penambahan 2 gram NaCl pada fenol.
E. Data pengamatan
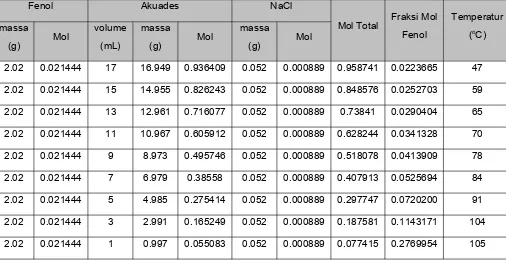
Tabel 1.2 Penentuan Titik Kritis Kesetimbangan Fasa Dua Komponen Cair-Cair
2.02 0.021444 17 16.949 0.936409 0.052 0.000889 0.958741 0.0223665 47 2.02 0.021444 15 14.955 0.826243 0.052 0.000889 0.848576 0.0252703 59 2.02 0.021444 13 12.961 0.716077 0.052 0.000889 0.73841 0.0290404 65 2.02 0.021444 11 10.967 0.605912 0.052 0.000889 0.628244 0.0341328 70 2.02 0.021444 9 8.973 0.495746 0.052 0.000889 0.518078 0.0413909 78 2.02 0.021444 7 6.979 0.38558 0.052 0.000889 0.407913 0.0525694 84 2.02 0.021444 5 4.985 0.275414 0.052 0.000889 0.297747 0.0720200 91 2.02 0.021444 3 2.991 0.165249 0.052 0.000889 0.187581 0.1143171 104 2.02 0.021444 1 0.997 0.055083 0.052 0.000889 0.077415 0.2769954 105
2. Grafik Pengamatan
Grafik 2.1 Penentuan Titik Kritis Kesetimbangan Fasa Dua Komponen Cair-Cair Tanpa Penambahan NaCl
0.02 0.03 0.03 0.03 0.04 0.05 0.07 0.11 0.28 0
20 40 60 80
Kurva Kelarutan Fenol + Air
Grafik 2.2 Penentuan Titik Kritis Kesetimbangan Fasa Dua Komponen Cair-Cair dengan Penambahan NaCl
0.02 0.03 0.03 0.03 0.04 0.05 0.07 0.11 0.28 0
Kurva Kelarutan Fenol + Air + NaCl
Fraksi Mol Fenol (x) Kelarutan Fenol dengan akuades dan NaCl
0.02 0.03 0.03 0.03 0.04 0.05 0.07 0.11 0.28
F. Pembahasan
Percobaan kesetimbangan fasa dua komponen merupakan percobaan yang dilakukan dengan mencampurkan antara dua cairan yang mempunyai perbedaaan kelarutan, di mana perbedaan kelarutan mempengaruhi pembentukan larutan. Prinsip kerja percobaan ini yaitu pengukuran titik kritis dengan menggambarkan diagram fasa sebagai fungsi fraksi mol dan temperatur. Prosedur percobaan ini meliputi dua tahap, yaitu penentuan titik kritis kelarutan pada kesetimbanagn fasa fenol dan akuades tanpa penambahan NaCl dan dengan penambahan NaCl.
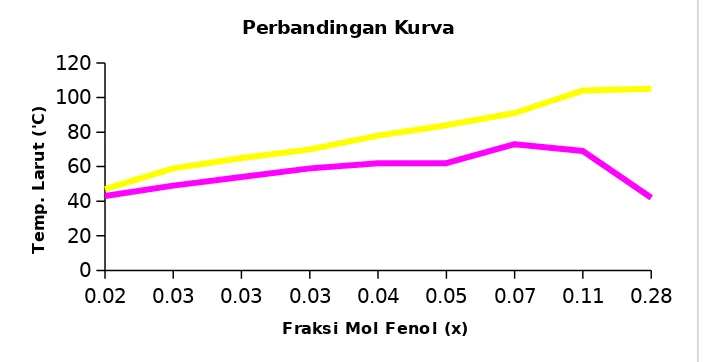
Fenol dan akuades membentuk warna putih ketika dicampurkan, hal ini menunjukan bahwa keduanya tidak saling melarutkan. Fenol dan akuades pada temperatur kamar tidak dapat larut karena adanya ikatan hidrogen yang kuat pada keduanya. Proses pelarutan fenol dengan akuades dilakukan dengan pemanasan dan pengocokan. Pemanasan dan pengokocan mengakibatkan molekul-molekul dalam campuran bergerak lebih cepat sehingga ikatan – ikatan yang ada menjadi renggang dan mudah putus. Perubahan warna putih menjadi tidak berwarna menandakan fenol dan akuades larut. Penambahan akuades secara bertahap meningkatkan temperatur larut sampai titik kritis. Hal ini dikarenakan semakin banyak ikatan yang harus diputus. Penambahan lebih lanjut akuades menurunkan temperatur larut. Hal ini dikarenakan jumlah akuades sebagai pelarut cukup membantu proses pelarutan fenol. Grafik 2.1 menunjukan temperatur kritis pelarutan fenol dan akuades. Temperatur kritis yaitu puncak dari kurva. Temperatur kritis fenol dan akuades yaitu 73 oC.
Penambahan NaCl bertujuan untuk mempelajari pengaruh penambahan zat pada proses pelarutan. Grafik 2.3 menunjukan temperatur pelarutan dengan penambahan NaCl lebih tinggi dibandingkan tanpa penambahan NaCl. NaCl yang ditambahkan terurai menjadi ion Na+ dan Cl-. Ion-ion tersebut meningkatkan kekuatan
ikatan hidrogen antar fenol dan kekuatan ikatan hidrogen antar akuades. Ion Na+
Ikatan yang lebih kuat membutuhkan temperatur yang lebih tinggi untuk melarutkan zat. Grafik 2.2 menunjukan bahwa titik kritis pelarutan fenol dengan penambahan NaCl belum di dapat. Temperatur tertinggi yaitu 105 0C menunjukan bahwa
temperatur kritis di atas 105 0C. Pemanasan di atas temperatur tersebut membutuhkan
intrumen yang lebih canggih, sehingga tidak dilanjutkan.
Komponen atau variabel intensif dalam pelarutan fenol dan akuades ada 2, yaitu fraksi mol dan temperatur, sedangkan jumlah fasanya ada 2. Derajat kebebasannya, F = C + 2 – P
= 2 +2 – 2 = 2
Komponen untuk pelarutan fenol dan akuades dengan penambahan NaCl ada 3, yaitu fraksi mol, temperatur, dan NaCl, sedangkan jumlah fasanya ada 2. Derajat kebebasannya, F = C + 2 – P
= 3 + 2 – 2 = 3
G. Kesimpulan
1. Fasa dua komponen cair – cair dapat digambarkan dalam grafik perbandingan antara fungsi temperatur (T) dengan fraksi mol (x).
2. Titik kelarutan kritis fenol dan akuades tanpa penambahan NaCl adalah 730C,
sedangkan titik kelarutan kritis fenol dan akuades dengan penambahan NaCl belum tercapai, dibutuhkan pemanasan di atas temperatur 105 0C.
H. Daftar pustaka
Atkins, P.W. 1996. Kimia Fisika Edisi Keempat Jilid 1. Jakarta: Erlangga
Chang, Raymond. 2005. Kimia Dasar Jilid 1. Jakarta: Erlangga.
Cotton, F. A. 1989. Kimia Anorganik Dasar. Jakarta: UI-Press.
Yogyakarta, 14 Maret 2013
Asisten, Praktikan,