BAB II
TINJAUAN PUSTAKA
2.1. Dasar Termodinamika 2.1.1. Siklus Termodinamika
Siklus termodinamika merupakan suatu urutan proses yang berawal dan berakhir pada keadaan yang sama. Pada akhir siklus, semua sifat akanmemiliki nilai yang sama dengan kondisi awal. Dengan demikian maka dalam suatu siklus sistem tidak akan mengalami perubahannetto. Contohnyauap yang bersirkulasi dalam suatu sistem pembangkit tenaga listrik membentuk sebuah siklus.
Pada suatu keadaan tertentu, setiap sifat memiliki nilai tertentu yang dapat ditentukan tanpa perlumengetahui bagaimana sistem dapat mencapai keadaan tersebut. Dengan demikian perubahan nilai suatu sifat pada sistem akan berpindah dari suatu keadaan ke keadaan lain sangat ditentukan oleh keadaan awal dan akhir sertatidakdipengaruhi oleh langkah perubahanyangterjadi. Perubahan tidak dipengaruhi olehsejarahdanrincian proses. Sebaliknya apabila nilai suatu besaran tidak dipengaruhi oleh prosesantara dua keadaan, maka besaran tersebut merupakan perubahan sifat.
2.1.2. Properti dan Proses
Properti suatu bahan adalah jumlah kuantitatif yangdapatdiukur atau di hitung untuk mengetahui kondisi keadaan tertentu pada bahan. Properti ini misalnya massa, tekanan, temperatur, volume, entalpi, dan entropi.
Proses adalah sebuah hal perlakuan yang terjadi untuk mengubah properti. Pada termodinamika proses biasanya melibatkan transfer energi seperti : pemanasan, pendinginan, penekanan (kompresi), pengembangan (ekspansi), pengadukan, atau pemompaan.
Proses yang berjalan pada satujenis properti tetap , disebut proses iso- diikuti nama properti-nya, misalnya proses isobar (tekanan konstan), proses isovolum (volume konstan), proses isotermal (temperatur konstan) dan lain-lain.
Suatu sistem disebut menjalani suatusiklus, apabila sistem tersebut menjalani rangkaianbeberapa proses, dengan keadaan akhir sistem kembali ke keadaan awalnya.
2.1.3. Sifat Ekstensif Dan Intensif
Sifat termodinamika terbagi menjadi dua bagian, yaitu sifat ekstensif dan sifat intensif. Sifat ekstensif yaitu jika nilai dari keseluruhan sistem merupakan penjumlahan dari nilai dari setiap bagian yang menyusun sistem tersebut, contohnya yaitu massa, volume, dan energi. Sifat ekstensif dipengaruhiolehukuransistem dandapat berubah menurut waktu. Sifat intensif tidakdapat diakumulasikanseperti pada sifat ekstensif. Nilai sifat intensif tidak dipengaruhi oleh ukuransistem dan dapat bervariasi disetiap bagian sistem pada waktu yang berbeda.Dengandemikian maka sifat intensif merupakanfungsi posisi danwaktusedangkansifatekstensif umumnya hanya merupakan fungsi waktu.Contohdari sifat ekstensif yaitu volume spesifik, tekanan, dan temperature.
2.1.4. Volumespesifik
Volume spesifik (υ) adalah jumlah volume dalam satu kilogram massa suatu zat (m3/kg) dan merupakan kebalikan dari densitas 𝞺𝞺 dengan satuan SI yaitu kg/m3.
2.1.5. Tekanan
Tekanan adalah gaya normal (F) tegaklurus yangdiberikan oleh suatufluida persatuan luas benda (A) yang terkena gaya tersebut.
Р
=
𝐹𝐹𝐴𝐴 𝑁𝑁
𝑝𝑝2
...(2.1)
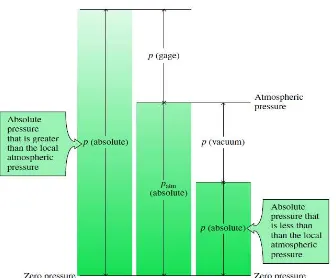
Gambar 2.1. Hubungan antara tekanan absolut, tekanan atmosfer, tekanan gauge, dan tekanan vakum
(Michael J. Moran dan Howard N, Saphiro, 2006)
Dalam Termodinamika, tekanan p umumnya dinyatakan dalam harga absolut (tekanan absolut/mutlak), maka dalam diktat ini simbol p menyatakan tekanan absolut dari sistem/zat. Tekanan absolut tergantung pada tekanan pengukuran sistem, jadi :
1. Bilatekanan pengukuran( pressure gauge) sistem di bawah tekanan atmosfir maka :
Tek absolut = Tek atmosfir - Tek pengukuran
𝑝𝑝𝑎𝑎𝑡𝑡𝑎𝑎𝑜𝑜𝑎𝑎𝑝𝑝𝑜𝑜𝑎𝑎 = 𝑝𝑝𝑎𝑎𝑜𝑜𝑝𝑝 − 𝑝𝑝𝑘𝑘𝑎𝑎𝑝𝑝𝑘𝑘𝑎𝑎...(2.2)
2. Bila tekanan pengukuran (pressure gauge) sistem diatas tekanan atmosfir maka : Tek absolut = Tek atmosfir +Tek pengukuran
𝑝𝑝𝑎𝑎𝑡𝑡𝑎𝑎𝑜𝑜𝑎𝑎𝑝𝑝𝑜𝑜𝑎𝑎 = 𝑝𝑝𝑎𝑎𝑜𝑜𝑝𝑝 + 𝑝𝑝𝑘𝑘𝑎𝑎𝑝𝑝𝑘𝑘𝑎𝑎...(2.3) 2.1.6. Temperatur
Temperatur dari suatu benda menyatakan keadaan termal benda tersebut dan kemampuan benda untukbertukar energi dengan benda lainyangbersentuhan dengan benda tersebut.
Benda yang bersuhu tinggi akan memberikan energinya kepada benda yang bersuhu rendah. Satuan untuktemperatur adalah Celcius (C) dan dapat diukur dengan menggunakan termometer.
Temperatur absolut (T) adalah derajat diatas temperatur nol absolut yang dinyatakan dengan satuan Kelvin (K).
T = t°C+273...(2.3) Konversi satuan pada temperatur
°F = 32 + (9/5 . °C)...(2.4)
2.1.7. Fase
Fase (phase) menggambarkan sejumlahmateri yanghomogen dalam komposisi kimia maupun struktur fisiknya.Homogenitas dalam struktur fisik berarti bahwa materi tersebut seluruhnya berada dalam kondisi padat, cair, uap atau gas.
2.1.8. Sistem
Sistem adalah suatumassa ataudaerah yang dipilih, untukdijadikan obyek analisis. Atau sistem adalah segala sesuatu yang ingin dipelajari.
Sistem Termodinamika ada tiga macam, yaitu : 1. Sistem tertutup
Dalam sistem tertutup massa dari sistem yang dianalisis tetap dan tidak ada massa keluar dari sistem ataumasukkedalamsistem,tetapivolumenya bisa berubah.Yang dapat keluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Atau dengan kata lain sistem tertutup berisi materi yang sama, dimana perpindahanmassa melalui batas sistem tidak dimungkinkan.
2. Sistem terbuka
Dalam sistem terbuka, energi dan masa dapat keluar sistem ataumasuk kedalam sistem melewati batas sistem. Sebagian besar mesin-mesin konversi energi adalah sistem terbuka.
Sistem mesinmotor bakar adalah ruang didalam silinder mesin, dimana campuran bahan bahanbakar danudara masuk kedalam silinder, dan gas buang keluar sistem melalui knalpot. Turbin gas, turbin uap, pesawat jet dan lain-lain adalah merupakan sistem termodinamika terbuka, karena secara simultan ada energi dan massa keluarmasuk sistem tersebut.
3. Sistem terisolasi
Tidak ada pertukaran massa dan energi sistem dengan lingkungan. Atau dengan kata lain sistem tidak terpengaruh sama sekali oleh lingkungan Misalnya: Tabung gas yang terisolasi.
2.1.9. BatasSistem
Batas sistem adalah batas antara sistem dengan lingkungannya. Dalamaplikasinya batas sistem merupakan bagian dari sistem maupunlingkungannya, dan dapat tetap atau dapat berubah posisi atau bergerak.
2.1.10 . Lingkungan
Lingkungan adalah segala sesuatu yang berada di luar sistem.
Gambar 2.2. Sistem termodinamika
2.1.11. Zat Murni
2.1.12. Hukum Pertama Termodinamika
Hukum pertama termodinamika dikenal dengan prinsipkonservasi energi yang menyatakan bahwa energi tidakdapat diciptakan dan dimusnahkan tetapi hanya dapat diubah dari bentuk satu kebentuk yang lainnya.
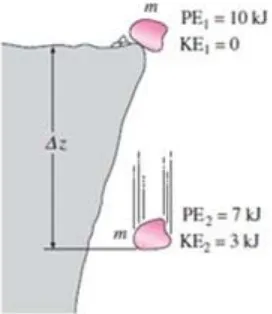
Dari gambar 2.3 kita dapatmelihat bentukperubahan dari energi dimana energi potensial sebagian akan berubah menjadi energi kinetik. Pada saat sebuah batu dengan massa m akan dijatuhkan dari suatu tebing, benda tersebut memilikienergi potensial sebesar 10 kJ dan sesaat setelah dijatuhkan hingga mencapaisisa energinya yaitu sebesar 3 kJ berubah menjadi energi kinetik.
Gambar 2.3 Konservasi energi
(Yunus A. Cengel dan Michael A. Boles,1994) 2.2 Perubahan Fase pada Zat Murni
Air dapat berada pada keadaan campuran antara cair dan uap, contohnya yaitu pada boiler dan kondenser dari suatu sistem pembangkit listrik tenaga uap. Dibawah ini akan dijelaskan secara lebih rinci mengenai perubahan fase pada zat murni, contohnya air.
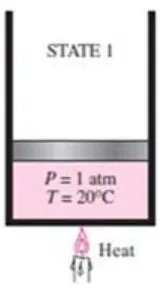
2.2.1 Cair Tekan (Compressed Liqud)
Gambar 2.4. Air pada fase cair tekan (compressed liquid)
(Yunus A. Cengel dan Michael A. Boles, 1994)
2.2.2 Cair Jenuh (Saturation Liquid)
Dengan semakinbertambahnya jumlah kalor yang dimasukkan kedalam silinder maka temperatur akan naik hingga mencapai 100 oC. Pada titik ini airmasih dalam fase cair, tetapi sedikit saja ada penambahan kalor maka sebagian dari air tersebut akan berubah menjadi uap. Kondisi ini disebut dengan cair jenuh (saturation liquid). Kondisi cair jenuh (saturation liquid)
dapat ditunjukkan seperti digambarkan pada gambar 2.5.
Gambar 2.5. Air pada fase cair jenuh (saturated liquid)
2.2.3. Campuran Air-Uap (Liquid-Vapor Mixture)
Saat pendidihan berlangsung, tidakterjadi kenaikan temperatur sampai cairanseluruhnya berubahmenjadi uap. Temperatur akan tetapkonstan selama proses perubahan fase jika temperatur juga dijaga konstan. Pada proses ini volume fluida didalam silinder meningkat karena perubahan fase yangterjadi, volume spesifikuaplebihbesar daripada cairan. Sehingga menyebabkan torak terdorong keatas.
Gambar 2.6. Campuran air dan uap (Yunus A. Cengel dan Michael A. Boles, 1994)
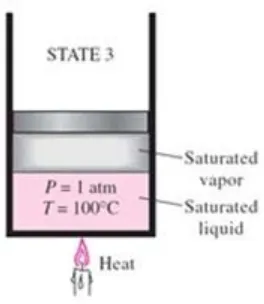
2.2.4 Uap jenuh (Saturated vapor)
Jika kalorterus ditambahkan,maka prosespenguapan akan terus berlangsung sampai seluruh cairan berubah menjadi uap, seperti ditunjukkan pada gambar 2.7. Sedangkan jika sedikit saja terjadi pengurangan kalor maka akan menyebabkan uap terkondensasi.
.
Gambar 2.7. Uap jenuh (saturated vapor)
2.2.5. Uap Panas Lanjut ( Superheated Vapor)
Setelah fluida didalam silinder dalam kondisi uap jenuh maka jika kalor kembali ditambahkan dan tekanan dijaga konstan pada 1 atm, temperatur uap akan meningkat seperti ditunjukkan pada gambar2.8. Kondisi tersebut dinamakan uap panas lanjut (
superheatedvapor) karena temperatur uap didalam silinder diatas temperatur saturasi dari uap
pada tekanan 1 atm yaitu 100oC.
Gambar 2.8 Uap panas lanjut (superheated vapor)
(Yunus A. Cengel dan Michael A. Boles, 1994)
Proses diatas digambarkan pada suatudiagramT-v seperti terlihat pada gambar 2.9.
2.3 Diagram Proses Perubahan Fase
Variasi properti selama proses perubahan fase akan lebih jelas jika menggunakan diagram properti, dibawah ini ada beberapa diagram yang menjelaskan perubahan fase tersebut diantaranya diagram T-v, P-v, dan P-T untuk air.
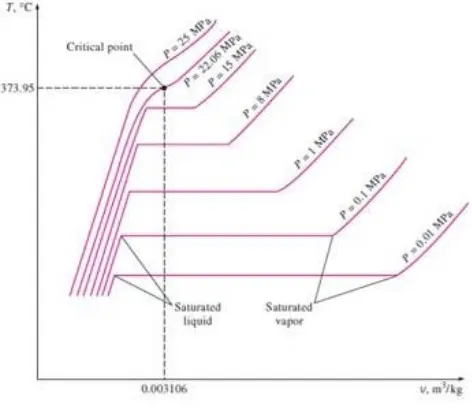
2.3.1 Diagram T-v
Proses perubahan fase pada air pada tekanan 1 atm telah dijelaskan sebelumnya dan digambarkan pada gambar 2.9. Selanjutnya akan dijelaskan proses tersebut tetapi pada tekanan yang berbeda.
Untuk itumaka kita harus menambah bebanpada bagian atas torak sehingga tekanan pada bagian dalam silinder mencapai tekanan 1 Mpa. Pada tekanan tersebut, volume spesifiknya lebih kecildibandingkan pada saat tekanan 1 atm. Proses perubahan fasenya sama seperti yang telah ditunjukkan pada gambar 2.9 tetapi air mulai mendidih pada temperatur yang lebih tinggi yaitu 179,9oC.Selainitu garishorizontal yangmenghubungkan antara titikcair jenuh dan uap jenuh menjadi lebih pendek dibandingkan pada tekanan 1 atm.
Gambar 2.10. Diagram T-v untuk proses perubahan fase pada beberapa variasi tekanan (Yunus A. Cengel dan Michael A. Boles, 1994)
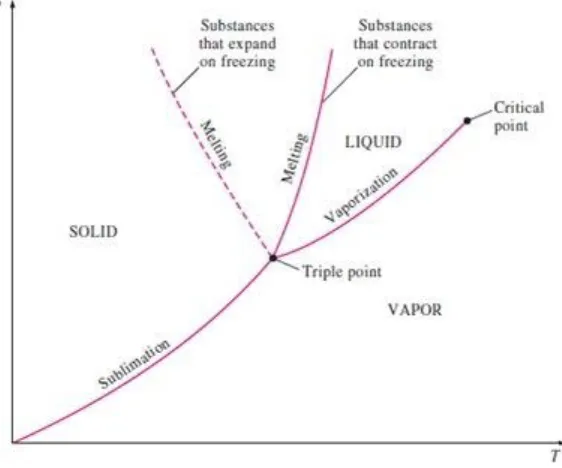
2.3.2Diagram P-T
Gambar2.11 menunjukkan diagram P-T pada air. Diagram ini sering disebut dengan diagram fase dimana ketiga fase yaitu cair, padat, dan uap biasanya ada pada diagram ini dan masing masing dibatasi oleh tiga buah garis. Garis sublimasi memisahkan daerah padat dan uap, garis penguapan memisahkan daerah cair dan uap, dan garis peleburan atau pencairan memisahkan daerah padat dan cair. Ketiga garis ini bertemu pada triple point, dimana ketiga fase yang ada berada pada kondisi setimbang. Garis penguapan berakhir pada titik kritis karena tidak ada perbedaan yang terjadi antara cair dan uap diatas titik kritis ini.
Gambar 2.11. Diagram P-T
(Yunus A. Cengel dan Michael A. Boles, 1994)
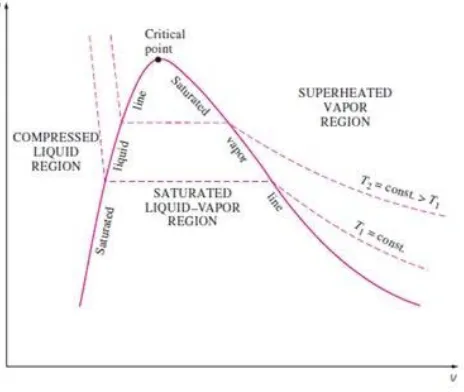
2.3.3 Diagram P-v
Gambar 2.12. Diagram P-V
(Yunus A. Cengel dan Michael A. Boles, 1994) 2.4 Tabel Properti
Properti dari suatuzat biasanya ditampilkan dalam bentuktabel. Properti termodinamika dapat diukur dengan mudah, tetapi ada yang tidak bisa langsung melainkan harus dihitung terlebihdahulu. Untukmasing-masingzat,properti termodinamika ditampilkan lebihdari satutabel.Pemisahantabel tersebut dipersiapkan untuk masing-masing daerah sepertisuperheated vapor, compressed liquid serta saturated.
2.4.1. Entalpi
Jika kita melihat tabel maka kita akan menemukan dua buah properti baru diantaranya yaituentalpi (h) dan entropi (s). Entalpi merupakan properti baru yang digunakan untuk menyatakan kombinasi antara u+P v yang dinyatakan dalam persamaan :
ℎ= 𝑝𝑝+𝑃𝑃𝑃𝑃...(2.5) atau
𝐻𝐻 =𝑈𝑈+𝑃𝑃𝑃𝑃...(2.6)
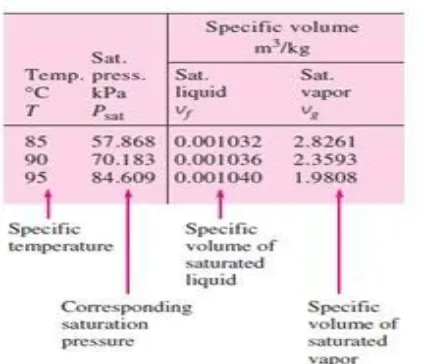
2.4.2. Keadaan cair jenuh dan uap jenuh
Gambar 2.13. Contoh tabel A-4
(Yunus A. Cengel dan Michael A. Boles, 1994)
Subscript f digunakan untuk properti pada cair jenuh dan subscript g digunakan untuk
properti pada uap jenuh. Sedangkan subscript fg digunakan untuk menyatakan selisih antara cair jenuh dan uap jenuh.
Vf = Volume spesifik pada cair jenuh Vg = Volume spesifik pada uap jenuh Vfg= Selisih antara Vgdan Vf
2.4.3. Keadaan campuran air dan uap
Selama proses penguapan, air terdiri dari dua bagian yaitu cair dan uap yang disebut dengan campuran. Untuk menganalisa campuran ini maka kita harus mengetahui perbandingan antara massa air dan massa uap yang disebut dengan kualitas (x) yang dinyatakan dalam persamaan
𝑥𝑥= 𝑝𝑝𝑝𝑝𝑝𝑝𝑎𝑎𝑝𝑝...(2.7) m = mcair + muap = mf + mg...(2.8)
V = Vca ir + Vua p...(2.9) Jika dibagi dengan massa total campuran m maka diperoleh volume spesifik ratarata (
𝑃𝑃
𝑎𝑎𝑃𝑃𝑘𝑘).𝑃𝑃
𝑎𝑎𝑃𝑃𝑘𝑘=
𝑝𝑝𝑃𝑃=
𝑃𝑃𝑐𝑐𝑎𝑎𝑖𝑖𝑡𝑡𝑝𝑝+
𝑃𝑃𝑝𝑝𝑎𝑎𝑝𝑝𝑝𝑝 ...(2.10)Karena fase cair adalah cair jenuh dan fase uap jenuh, 𝑃𝑃𝑐𝑐𝑎𝑎𝑖𝑖𝑡𝑡 = 𝑝𝑝𝑐𝑐𝑎𝑎𝑖𝑖𝑡𝑡𝑃𝑃𝑓𝑓 dan , 𝑃𝑃𝑝𝑝𝑎𝑎𝑝𝑝 =
𝑝𝑝𝑝𝑝𝑎𝑎𝑝𝑝𝑃𝑃𝑘𝑘 jadi,
𝑃𝑃
𝑎𝑎𝑃𝑃𝑘𝑘=
�
𝑝𝑝𝑝𝑝𝑐𝑐𝑎𝑎𝑖𝑖𝑡𝑡� 𝑃𝑃
𝑓𝑓+
�
𝑝𝑝𝑝𝑝𝑝𝑝𝑎𝑎𝑝𝑝� 𝑃𝑃
𝑘𝑘...(2.11)Kualitas didefinisikan sebagai, x = 𝑝𝑝𝑝𝑝𝑎𝑎𝑝𝑝/𝑝𝑝dan 𝑝𝑝𝑐𝑐𝑎𝑎𝑖𝑖𝑡𝑡/𝑝𝑝 =1 – x , sehingga apabila disubstitusikan kepersamaan diatas, akan diperoleh :
𝑃𝑃𝑎𝑎𝑃𝑃𝑘𝑘 = (1− 𝑥𝑥)𝑃𝑃𝑓𝑓 +𝑥𝑥𝑃𝑃𝑘𝑘...(2.12)
𝑃𝑃𝑎𝑎𝑃𝑃𝑘𝑘 =𝑃𝑃𝑓𝑓 +𝑥𝑥�𝑃𝑃𝑘𝑘− 𝑃𝑃𝑓𝑓�= 𝑃𝑃𝑓𝑓 +𝑥𝑥𝑃𝑃𝑓𝑓𝑘𝑘...(2.13)
Dan didapatkan persamaan untuk kualitas uap,
𝑥𝑥
=
𝑃𝑃𝑎𝑎𝑃𝑃𝑘𝑘−𝑃𝑃𝑓𝑓𝑃𝑃𝑓𝑓𝑘𝑘 ...(2.14)
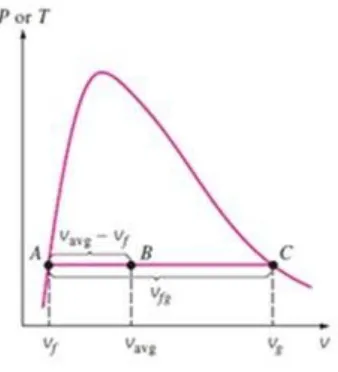
Berdasarkan persamaan ini, kualitas dapat dihubungkan dengan suatu garis horizontal pada diagram P-v atau T-v seperti ditunjukkan pada gambar 2.14.
Gambar 2.14. Kualitas uap air
Analisa yang telah diberikan diatas dapat digunakan untuk energi dalam (u) dan entalpi (h)yang akan menghasilkan persamaan dibawah ini
𝑝𝑝𝑎𝑎𝑃𝑃𝑘𝑘 = 𝑝𝑝𝑓𝑓 +𝑥𝑥𝑝𝑝𝑓𝑓𝑘𝑘...(2.15)
ℎ𝑎𝑎𝑃𝑃𝑘𝑘 = ℎ𝑓𝑓 +𝑥𝑥ℎ𝑓𝑓𝑘𝑘...(2.16)
Semua hasil persamaan dapat dirangkum dalam suatu persamaan umum, yaitu
𝑦𝑦𝑎𝑎𝑃𝑃𝑘𝑘 =𝑦𝑦𝑓𝑓 +𝑥𝑥𝑦𝑦𝑓𝑓𝑘𝑘...(2.17)
2.4.4. Keadaan Uap Panas Lanjut
Daerah ini terletak pada bagian kanan dari garis uap jenuh dan pada bagian atas temperatur titik kritis. Dengan membandingkan dengan uap jenuh maka uap panas lanjut memiliki beberapa karakteristik, diantaranya :
1. Tekanan lebih rendah ( P < Psat pada T yang sama) 2. Temperatur lebih tinggi (T > Tsat pada P yang sama)
3. Volume spesifik lebih tinggi (v > vg pada P atau T yang sama) 4. Energi dalam lebih tinggi (u > ug pada P atau T yang sama) 5. Entalpi lebih tinggi ( h > hg pada P atau T yang sama)
2.4.5 Keadaan Cair Tekan
Tabel cair tekan formatnya sama dengan tabel uap panas lanjut. Hanya saja pada umumnya tabel cair tekan memiliki variasi tekanan yang besar. Dengan membandingkan dengan uap jenuh maka cair tekan memiliki beberapa karakteristik, diantaranya : 1. Tekanan lebih tinggi (P > Psat pada T yang sama)
2. Temperatur lebih rendah ( T < Tsat pada P yang sama)
2.5. Analisis Energi 2.5.1. Bentuk Energi
Energi dapat terdiri dari berbagai bentukseperti termal, mekanik, kinetik, potensial, listrik, magnetik, kimia, dan nuklir yangkeseluruhannya merupakan energi total Edari sistem. Total energi dari sistem dalam unit massa dinotasikan dengan e dan dinyatakan sebagai :
e =
Em...(2.18)
Energi kinetik merupakan bentuk energi makrospik yang berhubungan dengan gerakan dan disimbolkan dengan EK. Ketika seluruh bagian dari suatu sistem bergerak dengan kecepatan yang sama, energi kinetik dinyatakan sebagai :
𝐸𝐸𝐸𝐸= 1
2𝑝𝑝𝑃𝑃
2...(2.19)
Dimana v menyatakan kecepatan dari suatu sistem yang relatif terhadap referensi yang tetap. Sedangkan energi yang berhubungan dengan elevasi atau ketinggian disebut dengan energi potensial yang dinyatakan sebagai :
𝐸𝐸𝑃𝑃 = 𝑝𝑝𝑘𝑘𝑚𝑚 (𝐸𝐸𝐾𝐾)...(2.20)
Dimana g adalah percepatan gravitasi dan z adalah elevasi dari titik tengah gravitasi. Total energi dari suatu sistem terdiri dari energi kinetik,energi potensial dan energi dalam yang dinyatakan dengan :
𝐸𝐸 = 𝑈𝑈+𝐸𝐸𝐸𝐸+𝐸𝐸𝑃𝑃 =𝑈𝑈+1
2𝑝𝑝𝑃𝑃
2+𝑝𝑝𝑘𝑘𝑚𝑚...(2.21)
2.5.2 Kerja Aliran
Kerja yang diperlukan untuk mendorong suatu massa fluida untukmasuk atau keluar dalam suatu volume atur disebut kerja aliran atau energi aliran. Untuk mendapatkan hubungan pada suatu kerja aliran maka digunakan skema seperti terlihat pada gambar 2.15. Fluida mengalir dan memberikan gaya kepada torak khayalan untuk masuk kedalam volume atur. Jika tekanan fluida adalah P dan luas permukaan dari fluida adalah A, maka gaya yang diberikan oleh fluida pada torak khayalan adalah :
F = P.A...(2.22) Untukmendorongfluida masukkedalam volume atur, maka gaya akan menyebabkan torakkhayal akan bergeraksejauh L. Jadi kerja yangdilakukan untuk mendorong fluida masuk kedalam sistem adalah:
Kerja aliran per unit massa diperoleh dengan cara membagi persamaan tersebut dengan massa dari fluida tersebut, sehingga didapatkan :
𝑊𝑊𝑓𝑓𝑎𝑎𝑜𝑜𝑓𝑓 = 𝑃𝑃𝑃𝑃...(2.24)
wflow = P v
Gambar 2.15. Skema untuk kerja aliran (Yunus A. Cengel dan Michael A. Boles, 1994)
2.5.3. Total Energi pada Fluida yang Mengalir
Seperti yang telah dijelaskan sebelumnya bahwa total energi dari suatu sistem terdiri dari energi kinetik, energi potensial dan energi dalam yang dinyatakan dalam unit massa yaitu dengan :
𝑎𝑎= 𝑈𝑈+𝑎𝑎𝐸𝐸+𝑎𝑎𝑃𝑃 =𝑈𝑈+12𝑃𝑃2+𝑘𝑘𝑚𝑚...(2.25)
Persamaan diatas merupakan persamaan untuk fluida yang tidak mengalir (non flowing
fluid), sedangkan total energi untuk fluida yang mengalir (flowing fluid) yang dinotasikan
dengan θ perunit massa yaitu :
𝜃𝜃 =𝑓𝑓𝑓𝑓𝑎𝑎𝑜𝑜𝑓𝑓 +𝑎𝑎 =𝑃𝑃𝑃𝑃+ (𝑝𝑝+𝑎𝑎𝑘𝑘+𝑎𝑎𝑝𝑝)...(2.26)
2.5.4. Analisis Energi pada Sistem Aliran Steady
Sejumlah besar peralatan seperti turbin, kompresor dan nosel dioperasikan dalam jangka waktuyanglama dan pada kondisi yangrelatif tetap. Peralatan tersebut diklasifikasikan kedalam peralatan aliran stedi yang didefinisikan sebagai proses mengalirnya suatu fluida yang melewati volume atur secara steady.
Gambar 2.16. Massa dan energi didalam volume atur konstan pada kondisi aliran steady
(Yunus A. Cengel dan Michael A. Boles, 1994)
Sifat-sifat fluida pada bagian inlet dan outlet konstan selama proses aliran steady. Kalor dan kerja yang berinteraksi antara sistem aliran steady dan lingkungan sekitarnya juga tidak berubah terhadap waktu. Keseimbangan massa untuk sistem aliran steady diberikan pada persamaan berikut,
∑ ṁ
𝑖𝑖𝑖𝑖=
∑
𝑜𝑜𝑝𝑝𝑜𝑜ṁ
...(2.27)Selama proses aliran steady, total energi yang terdapat pada volume atur konstan (𝐸𝐸𝑐𝑐𝑃𝑃 =𝑘𝑘𝑜𝑜𝑖𝑖𝑎𝑎𝑜𝑜𝑎𝑎𝑖𝑖) dan tidak ada perubahan total energi pada volume atur (𝐸𝐸𝑐𝑐𝑃𝑃 = 0). Jadi jumlah energi yang masuk kedalam volume atur dalam berbagai bentuk (oleh kalor, kerja dan massa) harus sama dengan jumlah energi yang keluar. Sehingga keseimbangan energinya menjadi,
...(2.28)
Atau
É𝑖𝑖𝑖𝑖 = É𝑜𝑜𝑝𝑝𝑜𝑜...(2.29)
dan jika dijelaskan lagi energi yang ditransfer oleh kalor, kerja dan massa maka persamaanya dapat ditulis menjadi,
𝑄𝑄𝑖𝑖𝑖𝑖 +Ẇ𝑖𝑖𝑖𝑖 +∑ ṁ𝜃𝜃𝑖𝑖𝑖𝑖 = 𝑄𝑄𝑜𝑜𝑝𝑝𝑜𝑜 +Ẇ𝑜𝑜𝑝𝑝𝑜𝑜 +∑𝑜𝑜𝑝𝑝𝑜𝑜ṁ𝜃𝜃...(2.30) Rate of net energy transfer by
heat, work, and mass
Karena energi pada fluida yang mengalir per unit massa adalah 𝜃𝜃 =ℎ+1
Jika perpindahan energi bersih melalui kalor (Q) dan kerja (Ẇ) yang melewati batas volume atur, maka persamaanya menjadi,
𝑄𝑄 − Ẇ=∑ ṁ(ℎ+1
2𝑃𝑃
2 +𝑘𝑘𝑚𝑚)
𝑜𝑜𝑝𝑝𝑜𝑜 − ∑ ṁℎ𝑖𝑖𝑖𝑖 +12𝑃𝑃2+𝑘𝑘𝑚𝑚...(2.32)
jika perpindahan energi yang melewati volume atur yaitu yang masuk kedalam volume atur dinotasikan dengan subscript 1 dan yang keluar dari volum atur dinotasikan dengan subscript 2 maka persamaanya menjadi,
𝑄𝑄 − Ẇ
=
ṁ �ℎ
2− ℎ
1+
𝑃𝑃22−𝑃𝑃122
+
𝑘𝑘
(
𝑚𝑚
2− 𝑚𝑚
1)
�
...(2.33)jika persamaanya dibagi dengan 𝑝𝑝maka keseimbangan energi per unit massa
𝑞𝑞 − 𝑓𝑓
=
ℎ
2− ℎ
1+
𝑃𝑃22−𝑃𝑃122
+
𝑘𝑘
(
𝑚𝑚
2− 𝑚𝑚
1)
...(2.34)Dimana :
q = laju perpindahan kalor antara volume atur dan lingkungan. Jika volume kontrol kehilangan kalor maka q bernilai negatif. Jika volume atur terisolasi dengan sempurna (adiabatik) maka q = 0
w = kerja. Jika tidak ada kerja pada sistem maka w = 0
Δh = ℎ2− ℎ1 .Merupakan perubahan entalpi pada fluida dapat ditentukan dengan mudah dengan cara melihat nilai entalpi pada sisi inlet dan outlet dari tabel.
Δek = 𝑃𝑃2
2−𝑃𝑃12
2 . Perubahan energi kinetik. Selisih kecepatan 45 m/s dapat disamakan
Δep = 𝑘𝑘(𝑚𝑚2− 𝑚𝑚1) . Perubahan energi potensial sebesar 1 kJ sama dengan perbedaan ketinggian sebesar 102 m. Perbedaan ketinggian antara sisi inlet dan outlet pada peralatan industri seperti turbin dan kompresor dibawah nilai ini, maka energi potensialnya dapat diabaikan
2.6. Entropi
2.6.1. Definisi Entropi
Sifat ataukeadaan perilakupartikel dinyatakandalam besaran entropi, entropi ini didefinisikan sebagai bentuk ketidakteraturan perilaku partikel dalam sistem. Entropi didasarkan pada perubahan setiap keadaan yang dialami partikel dari keadaan awal hingga keadaan akhirnya.
Semakin tinggi entropi suatu sistem, semakin tidak teratur pula sistem tersebut.Sistem menjadi lebih rumit, kompleks dan sulit diprediksi. Untuk mengetahui konsepketeraturan,mula-mula kita perlumembahas hukum kedua termodinamika yangdikenal sebagai ketidaksamaan Clausius dan dapat diterapkan pada setiap siklus tanpa memperhatikan dari benda mana siklus itumendapatkan energi ataukemana siklus itumelepaskan energi melaluiperpindahan kalor. Ketidaksamaan Clausius mendasari dua hal yangdigunakan untukmenganalisissistem tertutupdanvolume atur berdasarkan hukum kedua termodinamika yaitusifat entropi dan neraca entropi.Ketidaksamaan Clausiusmenyatakan bahwa:
∮ �
𝛿𝛿𝑄𝑄𝑇𝑇�
𝑡𝑡
=
−𝜎𝜎
𝑎𝑎𝑖𝑖𝑘𝑘𝑎𝑎𝑝𝑝𝑎𝑎...(2.35)Dimana 𝛿𝛿𝑄𝑄 mewakili perpindahan kalor pada batas system selama terjadinya siklus, T adalah temperatur absolut pada daerah tersebut. Subskrip b menunjukkan bahwa integral dihitung pada daerah batas sistem yang mengalami siklus. Integral dilakukan pada semua bagian dari batas tersebut dan siklus secara keseluruhan. Sedangkan
𝜎𝜎
𝑎𝑎𝑖𝑖𝑘𝑘𝑎𝑎𝑝𝑝𝑎𝑎 dapat mewakili tingkat ketidaksamaan atau nilai entropi yang dalam pembahasan selanjutnya menggunakan simbol S. Nilai𝜎𝜎
𝑎𝑎𝑖𝑖𝑘𝑘𝑎𝑎𝑝𝑝𝑎𝑎 positif pada saat terjadi ireversibilitas internal, nol saat tidak adanya irreversibilitas internal, dan tidak mungkin bernilai negatif.Jadi
𝜎𝜎
𝑎𝑎𝑖𝑖𝑘𝑘𝑎𝑎𝑝𝑝𝑎𝑎 merupakan ukuran dari efek yang ditimbulkan oleh ireversibilitas pada saat sistem menjalani suatu siklus. Kesamaan dan ketidaksamaan memiliki penjabaran yang sama seperti pada pernyataan Kelvin-Plank, yaitu kesamaan muncul pada saat tidak adanya ireversibilitas internal ketika sistem mengalami siklus, sedangkan ketidaksamaan akan terjadi pada saat sistem mengalami ireversibilitas internal.2.6.2. Penggunaan Persamaan T dS
Dengan mengambil simbol S yang menunjukkan suatu sifat yang disebut entropi, maka perubahan entropi dapat dituliskan sebagai :
𝑆𝑆2 =𝑆𝑆1
=
�∫
𝛿𝛿𝑄𝑄𝑇𝑇 2
1
�
𝑖𝑖𝑖𝑖𝑜𝑜 𝑡𝑡𝑎𝑎𝑃𝑃...(2.36)Dimana “int rev” menunjukkan bahwa integrasi tersebut dilakukan untuk setiapproses reversibel internal yangmenghubungkandua keadaan.Persamaan tersebut merupakan didefinisi dari perubahan entropi. Dalam bentuk diferensial, persamaan diatas dapat dituliskan menjadi,
𝑑𝑑𝑎𝑎
=
𝛿𝛿𝑄𝑄𝑇𝑇 𝑖𝑖𝑖𝑖𝑜𝑜 𝑡𝑡𝑎𝑎𝑃𝑃...(2.37)
Atau
(𝛿𝛿𝑄𝑄)𝑖𝑖𝑖𝑖𝑜𝑜 𝑡𝑡𝑎𝑎𝑃𝑃 =𝑇𝑇𝑑𝑑𝑆𝑆...(2.38)
Dimana 𝛿𝛿𝑄𝑄 adalah jumlah kalor yang masuk atau keluar dari sebuah sistem, dSadalah perubahan entropi sistem, dan T adalah temperaturnya.
2.6.3. Penggunaan Diagram Entropi
1. Diagram T-s
Bentuk umum dari diagram temperatur-entropi dapat dilihat pada gambar 2. 17.Pada daerah uappanas lanjut dalam diagram T-s, garis-garis entalpi spesifik konstan hampir membentuk garis lurus pada saat tekanan berkurang. Keadaan ini dirunjukkan pada daerah terarsir pada gambar 2.17. Untuk keadaan pada daerah ini, entalpi ditentukan hanya dengan temperatur. Variasi tekanan antara beberapa keadaan tidak berpengaruh besar.
Pada daerah uappanas lanjut dalam diagram T-s, garis-garis entalpi spesifik konstan hampir membentuk garis lurus pada saat tekanan berkurang. Keadaan ini dirunjukkan pada daerah terarsir pada gambar 2.17. Untuk keadaan pada daerah ini, entalpi ditentukan hanya dengan temperatur. Variasi tekanan antara beberapa keadaan tidak berpengaruh besar.
Gambar 2.17. Diagram temperatur-entropi (Michael J. Moran dan Howard N. Shapiro, 2006)
2. Diagram H-s
Gambar 2.18. Diagram entalpi-entropi (Michael J. Moran dan Howard N. Shapiro, 2006)
Garis-garis kualitas konstan ditunjukkan pada daerah campuran dua fase cair-uap. Grafik ini digunakan untuk mendapatkan nilai sifat pada keadaan uap panas lanjut dan untuk campuran dua fase cairuap. Data cairan umumnya jarangtersedia. Pada daerah uappanas lanjut, garis temperatur konstan mendekati horizontal pada saat tekanan berkurang yang ditunjukkan pada daerah terarsir pada gambar 2.18.
2.7 Pembangkit Listrik Tenaga Uap
Gambar 2.19. Skema pembangkit listrik tenaga uap (Yunus A. Cengel dan Michael A. Boles, 1994)
Uap superheated kemudian akan memasuki turbin untuk diekspansi secara isentropik dan akan menghasilkan kerja untuk memutar shaft yang terhubung dengan generator listrik sehingga dapat dihasilkan listrik. Tekanan dan temperatur uap akan turun dan masuk ke kondenser, dan kemudian dicairkan pada tekanan konstan didalam kondenser dan akan meninggalkan kondenser sebagai cairan jenuh yang akan masuk pompa.
2.8. SiklusIdeal Turbin Uap
Siklus ideal yangmendasarisiklus kerja dari suatupembangkit daya uap adalah siklus Rankine. Siklus Rankine berbeda dengan siklus-siklus udara ditinjau dari fluida kerjanya
yangmengalami perubahanfase selama siklus pada saat evaporasi dan kondensasi. Perbedaan lainnya secara termodinamika siklus uap
dibandingkan dengan siklus gas adalah bahwa perpindahan kalor pada siklus uap dapat terjadi secara isotermal.
Gambar 2.20. Siklus Rankine Sederhana (Yunus A. Cengel dan Michael A. Boles, 1994)
Temperatur hanya diatur oleh tekanan uap fluida. Kerja pompa pada siklusRankine untukmenaikkan tekanan fluida kerjadalam fase cair akan jauh lebih kecil dibandingkan dengan pemampatanuntukcampuran uap dalam tekanan yang samapadasiklusCarnot.
Siklus Rankine ideal terdiri dari 4 tahapan proses : 1 -2 Kompresi isentropik dengan pompa.
2 -3 Penambahan panas dalam boiler secara isobar 3 - 4 Ekspansi isentropik pada turbin.
4 -1 Pelepasanpanas pada kondenser secara isobardan isotermal
2.9 Siklus Rankine Reheat Ideal
Pada siklus Rankine reheat ideal terjadi 2 kali proses ekspansi. Pada ekspansi pertama
(high-pressure turbine), uap diekspansikan secara isentropic ke tekanan medium dan dikirimkan
kembali ke boiler untuk dipanaskan kembali dengan tekanan konstan. Lalu pada proses ekspansi ke kedua (low-pressure turbine) uap diekspansikan secara isentropic ke tekanan kondenser. Maka total panas yang masuk ke boiler dan total kerja turbin pada siklus reheat dapat ditentukan dengan:
𝑞𝑞𝑖𝑖𝑖𝑖 =𝑞𝑞𝑝𝑝𝑡𝑡𝑖𝑖𝑝𝑝𝑎𝑎𝑡𝑡𝑦𝑦 +𝑞𝑞𝑡𝑡𝑎𝑎ℎ𝑎𝑎𝑎𝑎𝑜𝑜 = (ℎ3− ℎ2) + (ℎ4− ℎ5)……….(2.39)
Dan
𝑓𝑓𝑜𝑜𝑝𝑝𝑡𝑡𝑡𝑡,𝑜𝑜𝑝𝑝𝑜𝑜 =𝑓𝑓𝑜𝑜𝑝𝑝𝑡𝑡𝑡𝑡,1+𝑓𝑓𝑜𝑜𝑝𝑝𝑡𝑡𝑡𝑡,2 = (ℎ3− ℎ4) + (ℎ5− ℎ6)……….(2.40)
Gambar 2.21. Siklus Rankine Reheat
(Yunus A. Cengel dan Michael A. Boles, 1994)
Penggunaan dari pada reheat tunggal pada pembangkit listrik modern menaikkan efisiensi siklus menjadi 4 sampai 5 persen dengan cara meningkatkan suhu rata-rata uap yang ditransferkan kembali.
Suhu pada proses reheat sama dengan suhu inlet turbin. Tekanan maksimum proses
reheat adalah seperempat tekanan maksimum siklus. Contohnya tekanan optimum reheat pada
siklus dengan tekanan boiler 12 MPa adalah 3 MPa.
2.10. Siklus Rankine Regeneratif Ideal
Salah satu cara untuk menaikkan efisiensi siklus adalah dengan meningkatkan suhu air
(feedwater) sebelum masuk ke dalam boiler.Salah satu cara menaikkan suhu ini adalah dengan
mengirimkan panas ke feedwater dari uap ekspansi turbin yang dialirkan kembali sebagian yang disebut dengan proses regenerasi.
Proses regenerasi pada pembangkit tenaga uap didapatkan dari ekstraksi uap dari turbin pada titik atau stages tertentu. Uap ini digunakan untuk memanaskan feedwater. Alat untuk memanaskan feedwater pada regenerasi disebut dengan feedwater heater.
Proses regenerasi tidak hanya berfungsi untuk menaikkan efisiensi siklus, tapi juga dapat melakukan proses deaerasi (membuang kandungan gas pada air) pada feedwater yang akan mencegah korosi pada boiler.
2.10.1 Open Feedwater Heaters
Open Feedwater Heaters pada dasarnya adalah mixing chambers, dimana uap hasil
ekstraksi dari turbin dicampur dengan feedwater. Skema dari pembangkit listrik tenaga uap dengan satu open feedwater heater dan diagram T-s ditunjukkan oleh gambar 2.22 berikut ini
Gambar 2.22. Siklus Rankine Regeneratif dengan Open Feedwater Heater
Pada siklus regeneratif Rankine ideal, uap masuk ke turbin pada tekanan boiler (kondisi 5) dan diekspansikan secara isentropic ke tekanan medium (kondisi 6). Beberapa uap akan diekstraksi dan dikirim kembali ke feedwater heater, sementara uap yang tersisa diekspansikan lanjut secara isentropic ke tekanan kondenser (kondisi 7). Air kondensasi yang juga disebut dengan feedwater dipompakan kembali ke feedwater heater, dimana disana akan dicampur dengan uap ekstraksi dari turbin. Fraksi dari uap ekstraksi meninggalkan heater sebagai uap saturasi pada tekanan heater (kondisi 3). Pompa kedua meningkatkan tekanan air hingga mencapai tekanan boiler (kondisi 4). Siklus berakhir dengan dipanaskan air pada boiler hingga kondisi masuk turbin (kondisi 5).
Untuk setiap 1 kg uap yang meninggalkan boiler, y kg diekspansikan terpisah di dalam turbin dan diekstraksikan pada kondisi 6. Sisa (1-y) kg diekspansikan ke tekanan kondenser. Oleh karena itu Flow rate pada setiap komponen berbeda. Jika flow rate boiler adalah ṁ, maka (1-y)m melewati kondenser. Panas dan kerja pada siklus rankine regeneratif dengan satu
feedwater heater dapat dicari dengan :
𝑞𝑞𝑖𝑖𝑖𝑖 =ℎ5− ℎ4……….(2.41)
2.10.2. Closed Feedwater Heaters
Tipe feedwater heater lainnya yang biasa digunakan adalahClosed Feedwater Heaters,
Gambar 2.23. Siklus Rankine Regeneratif dengan Closed Feedwater Heater
(Yunus A. Cengel dan Michael A. Boles, 1994)
Pada Closed Feedwater Heater yang ideal, feedwater dipanaskan hingga suhu keluar dari uap ekstraksi, dimana idealnya meninggalkan heater sebagai cairan jenuh pada tekanan ekstraksi. Pada sistem pembangkit tenaga actual, feedwater meninggalkan heater dibawah suhu keluar dari uap ekstraksi karena perbedaan suhu beberapa derajad diperlukan untuk efektifitas perpindahan panas.
Uap kondensasi baik yang dipompakan ke aliran feedwater maupun dikembalikan lagi
ke heater lainnya atau ke kondenser disebut dengan trap. Trap dapat membuat cairan
dipompakan ke tekanan yang lebih rendah.
2.11. Analisis Energi Pada Sistem Pembangkit Listrik
Perpindahan kalor yang tidak dapat dihindari antara komponen pembangkit da sekelilingnya diabaikan untuk memudahkan analisis. Perubahan energykinetik dan potensialjuga diabaikan. Setiap komponen dianggap beroperasi padakondisi tunak (steady). Dengan menggunakan prinsip konservasi massa dan konservasi energi bersama-sama dengan idealisasi tersebut maka akan dikembangkan persamaan untuk perpindahan energi pada masing-masing komponen pembangkit.
1. Pompa
dan mengasumsikan tidak ada perpindahan kalor disekitarnya, kesetimbangan laju massa dan
Fluida kerja meninggalkan pompa pada kondisi 2 yang disebut dengan pemanas air umpan sampai jenuh dan diuapkan di dalam boiler. Dengan menggunakan volume atur yang melingkupi tabung boiler dan drum yang mengalirkan air-pengisian dan kondisi 2 ke kondisi 3, kesetimbangan laju massa dan energi menghasilkan
𝑞𝑞𝑖𝑖𝑖𝑖 = ℎ3− ℎ2...(2.50)
Dimana 𝑞𝑞𝑖𝑖𝑖𝑖 adalahlaju perpindahan kalor dari sumber energi ke dalam fluida kerja per unit massa yang melalui boiler.
3. Turbin
Di dalam turbin terjadi pelepasan energi untuk menggerakkan beban (generator dan kompresor). Uap yang disuplai dari boiler akan berekspansisehingga tekanannya naik dan mampu mendorong tingkat sudu turbin.
Uap dari boiler pada kondisi 3, yang berada pada temperatur dan tekanan yang sudah dinaikkan, berekspansi melalui turbin untuk menghasilkan kerja dan kemudian dibuang ke kondenser pada kondisi 4 dengan tekanan yang relatif rendah. Dengan mengabaikan perpindahan kalor dengan sekelilingnya, kesetimbangan laju energi dan massa untuk volume atur di sekitar turbin pada kondisi tunak menjadi :
𝑓𝑓𝑜𝑜 = ℎ3− ℎ4...(2.51)
4. Kondenser
kondisi tunak, kesetimbangan laju masa dan energi untuk volume atur yang melingkupi bagian kondensasi dan penukar kalor adalah :
𝑞𝑞𝑜𝑜𝑝𝑝𝑜𝑜 =ℎ4 − ℎ1...(2.52)
Dimana 𝑞𝑞𝑜𝑜𝑝𝑝𝑜𝑜 merupakan laju perpindahan energi dari fluida kerja ke air pendingin per unit massa fluida kerja yang melalui kondenser
Efesiensi termal mengukur seberapa banyak energi yang masuk kedalam fluida kerja yang masuk kedalam boiler yang dikonversi menjadi keluaran kerja netto.
𝜂𝜂𝑜𝑜ℎ
=
𝑓𝑓𝑜𝑜−𝑓𝑓𝑝𝑝𝑞𝑞𝑖𝑖𝑖𝑖
=
(ℎ3−ℎ4)−(ℎ2−ℎ1)
(ℎ3−ℎ2) ...(2.53)
2.12. Analisa Overall Efficiency
Analisis overall efficiency adalah efisiensi keseluruhan suatu sistem PLTU yang merupakan perbandingan antara energi yangdimasukkan kedalam sistem yaitu berupa energi yang berasal dari bahan bakar dengan energi yang dihasilkan oleh sistem berupa daya listrikyangdihasilkanoleh generator dan dinyatakan dalam persamaan.
𝜂𝜂
𝑜𝑜𝑃𝑃𝑎𝑎𝑡𝑡𝑎𝑎𝑎𝑎𝑎𝑎=
𝑊𝑊𝑘𝑘𝑎𝑎𝑖𝑖𝑎𝑎𝑡𝑡𝑎𝑎𝑜𝑜𝑜𝑜𝑡𝑡𝑄𝑄𝑡𝑡𝑎𝑎 ℎ𝑎𝑎𝑖𝑖𝑡𝑡𝑎𝑎𝑘𝑘𝑎𝑎𝑡𝑡 ...(2.54)
Dimana kerja yang dihasilkan oleh generator merupakan daya listrik aktual yang dihasilkan oleh sistem dimana
𝑊𝑊𝑘𝑘𝑎𝑎𝑖𝑖𝑎𝑎𝑡𝑡𝑎𝑎𝑜𝑜𝑜𝑜𝑡𝑡 = 𝑃𝑃.𝐴𝐴...(2.55) Sedangkan jumlah energi bahan bakar yang dimasukkan ke dalam sistem PLTU yaitu
𝑄𝑄𝑡𝑡𝑎𝑎ℎ𝑎𝑎𝑖𝑖𝑡𝑡𝑎𝑎𝑘𝑘𝑎𝑎𝑡𝑡 =ṁ𝑡𝑡𝑎𝑎ℎ𝑎𝑎𝑖𝑖𝑡𝑡𝑎𝑎𝑘𝑘𝑎𝑎𝑡𝑡 𝑥𝑥𝐻𝐻𝑃𝑃...(2.56)
Dimana HV (Heating Value) adalah nilai kalor bahan bakar yang digunakan untuk SPTU ini.
2.13. Analisa Jumlah Penggunaan Bahan Bakar
superheated yang akan di masukkan ke turbin. Proses pembentukan uapair dari fase cair menjadi uap melalui proses yang disebut panas sensibel dan panas laten. Panas sensibel ialah panas yang menyebabkan terjadinya kenaikan/ penurunan temperatur namun phasa (wujud) tidak berubah. Sedangkanpanas laten ialah panas yang diperlukan untuk mengubah phasa (wujud) benda namun temperaturnya tetap. Untuk mengetahui panas yang dibutuhkan untuk mengubah air menjadi uap dalam boiler dapat dicari dengan rumus berikut :
𝑄𝑄𝑜𝑜𝑜𝑜𝑜𝑜𝑎𝑎𝑎𝑎 =𝑄𝑄1+𝑄𝑄2+𝑄𝑄3...(2.57) 𝑄𝑄1 =ṁ.𝐶𝐶𝑝𝑝.𝛥𝛥𝑇𝑇1...(2.58) 𝑄𝑄2=ṁ.𝑝𝑝𝑎𝑎𝑖𝑖𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑜𝑜𝑎𝑎𝑖𝑖...(2.59) 𝑄𝑄3 =ṁ.𝐶𝐶𝑝𝑝.𝛥𝛥𝑇𝑇2...(2.60)
Dimana :
Q = Jumlah panas yang dibutuhkan, kJ/kg ṁ = Flow rate air/uap jenuh, ton/hr
Cp = Heat Capacity
𝛥𝛥𝑇𝑇1 = Selisih temperatur air dan air jenuh pada boiler
𝛥𝛥𝑇𝑇2 = Selisih temperatur uap jenuh dan uap superheated pada boiler
2.14REFPROP
Refprop adalah akronim dari Reference Fluid Properties. Program ini dikembangkan
oleh National Institute of Standards and Technology (NIST) yang berfungsi untuk menghitung sifat termodinamika dari fluida dan campurannya. Sifat –sifat termodinamika ini dapat ditampilkan dalam bentuk table dan diplot secara grafik.
Data Refprop berdasarkan data akurat dari fluida murni dan campurannya yang tersedia pada saat ini. Refprop menerapkan tiga model untuk sifat termodinamika fluida
murni: Persamaan energi Helmholtz, Persamaan Benedict-Webb-Rubin yang dimodifikasi dan
Extended corresponding states (ECS) yang dimodifikasi.
Pada software Refprop ini terdapat berbagai macam jenis fluida yang bisa tersedia.Mulai dari fluida murni sampai fluida dengan campuran. Untuk menentukan fluida yang ingin digunakan kita tinggal memilih di menu substance. Pada menu substance ini juga tersedia informasi mengenai fluida yang digunakan dan kita juga dapat mengetahui jenis fluida dengan cara memasukkan beberapa sifat atau properties yang diketaui.Gambar 2.Berikut ini merupakan tampilan menu substance.
Gambar 2.25Menu Substance
Gambar 2.26Saturation Table of water
Properties atau sifat fluida dapat juga di tampilkan dalam diagram. Diagram yang
tersedia adalah:
• Temperature vs. Entropy • Temperature vs. Enthalpy • Temperature vs. Density • Pressure vs. Enthalpy • Pressure vs. Density • Pressure vs. Volume • Pressure vs. Temperature
• Compressibility Factor vs. Pressure • Enthalpy vs. Entropy
• Isochoric Heat Capacity vs. Temperature • Isobaric Heat Capacity vs. Temperature • Speed of Sound vs. Temperature
• Exergy vs. Enthalpy
• Isothermal Compressibility vs. Temperature • Viscosity vs. Temperature
• Thermal Conductivity vs. Temperature
• Temperature vs. Composition (for binary mixtures only) • Pressure vs. Composition (for binary mixtures only)
Gambar 2.27 Diagram T-S Air
2.15SteamTab
SteamTab adalah perangkat lunak yang menyediakan data akurat dari daftar lengkap
sifat termodinamika dan fisik untuk air dan uap. SteamTab mengadopsi formulasi disetujui oleh International Association for the Properties of Water and Steam (IAPWS): The IAPWS Formulation of Ordinary Water for General and Scientific Use (IAPWS-95). Persamaan yang digunakan adalah persamaan Helmholtz energy bebas f. Persamaan ini tidak memilik dimensi dengan bentuk φ=f/(RT) dan dibedakan menjadi dua bagian yaitu gas ideal (φo) dan residual (φr
), maka :
...(2.61) Dimana δ=ρ/ρc dan τ = Tc/T
Bagian gas ideal dari persamaan Helmholtz energy bebas didapatkan dari persamaan umtuk heat capacity isobaric spesifik di perasmaan gas ideal yang dikembangkan oleh J.R. Cooper yaitu:
………(2.62)
..(2.63)
Dengan :
Gambar 2.28 ChemicaLogic SteamTab Companion
SteamTab dirancang untuk memudahkan mengakses nilai property dan uap air. SteamTab dapat mengevaluasi properties dari air dan uapdalam berbagai kondisi (suhu 190oK - 5000K ; tekanan 0 – 100.000 bar). Dengan menggunakan SteamTab dimungkinkan pemeriksaan scenario dan desain untuk optimasi dalam skala besar.SteamTab juga dapat digunakan untuk menghasilkan grafik Mollier dan table uap sesuai kebutuhan.
Fungsi SteamTab dibagi menjadi tiga kategori:
• Fungsi untuk uap, cair atau dua sifat fase jenuh (2 fungsi)
Gambar 2.29 Fungsi untuk fase uap,cair dan campuran • Fungsi untuk superheated uap atau sifat cairan subcooled (9 fungsi)
Fungsi dalam kategori ini menyediakanalat untuk menetukansifat konstan pada proses. Tergantung pada pilihan variabel independen, dapat dimodelkan isentropik, isenthalpic, volume konstan, atau proses energi internal konstan.Fungsi untuk
superheated uap atau sifat cairan subcooled ditunjukkan oleh gambar 2.30 berikut ini
• Fungsi untuk properti uap konstan (8 fungsi)
Fungsi dalam kategori ini memberikan akses ke properti uapdasar yang bukan merupakan fungsi temperatur atau tekanan, seperti: berat molekul, sifat kritis. Fungsi untuk fase uap konstan ditunjukkan oleh gambar 2.31 berikut ini
Gambar 2.31 Fase uap konstan
2.16Computer Aided Thermodynamic Tables 2(CATT2)
Computer Aided Thermodynamic Tables 2(CATT2) adalah software yang memuat
berbagai macam table termodinamika yang biasanya terdapat pada buku referensi. Dengan menggunakan software ini tidak diperlukan lagi interpolasi untuk mencari harga sifat temodinamik di table.Hanya dengan memasukkan nilai sifat yang ingin di evaluasi, kemudian akan didapatkan sifat-sifat lain yang ingin diketahui.
Dalam pengoperasian software ini,dibutuhkan parameter-parameter untuk menentukan sifat fluida yang ingin dicari. Parameter tersebut dapat berupa suhu, tekanan,enthalpy, atau entropi. Biasanya Cuma dibutuhkan dua buah parameter untuk mengetahui sifat selanjutnya. Contohnya dengan memasukkan nilai suhu dan tekanan dari fluida maka akan diketahui entalpi dan entropinya. Gambar 2.33 berikut menunjukkan tabel general properties.
Gambar 2.33 Tabel General Properties
Layar softwareCATT2terbagi 2 bagian yaitu bagian atas dan bawah.Pada bagian atas menampilkan nilai sifat yang terakhir dievaluasi dan posisi dari nilai tersebut secara grafik.Pada bagian atas menunjukkan diagram T-S dan posisi dari nilai sifat suatu fluida. Gambra 2.34 berikut menunjukkan diagram T-s yang ditampilkan software.
Pada bagian bawah berisikan halaman data yang memuat semua nilai sifat fluida yang dievaluasi. Di Halaman data tersebut akan ditampilkan dengan table sifat-sifat fluida yang ingin dievaluasi. Gambar 2. Berikut ini akan menunjukkan tampilan data dari pada CATT2:
Gambar 2.34 Diagram T-S
Gambar 2.35 Tampilan data CATT2
Pada softwareCATT2 ini terdapat berbagai macam fluida yang dapat dianalisis. Jenis fluida yang tersedia di CATT2 ini adalah air, refrigerant,cryogenic, udara, gas ideal, air bertekanan, psycometric .Untuk memilih jenis fluida yang ingin dicari dapat dilihat di bagian bawah layar software. Disitu dapat dilihat berbagai macam fluida.Dengan mengklik jenis fluida yang diinginkan ,maka software akan menganalisis sifat dari fluida tersebut setelah dimasukkan parameter yang ingin dicari.Gamabar 2. 36 berikut menampilkan jenis fluida yang ada pada CATT2.