13
Penelitian ini dilakukan di Laboratorium Bioteknologi Perikanan dan Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan (FPIK) Universitas Padjadjaran. Kegiatan penelitian ini dilaksanakan pada bulan Maret-Mei 2013.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat
- Alat dissecting kit untuk melakukan pembedahan pada ikan - Timbangan untuk menimbang bobot ikan
- Penggaris untuk mengukur panjang ikan dan panjang usus ikan - Baki untuk alas pembedahan
- Cawan petri untuk wadah usus ikan dan isolasi bakteri - Autoklaf untuk sterilisasi uap
- Mortar untuk melakukan penggerusan usus ikan
- Tabung reaksi untuk menyimpan NaCl Fisiologis dan pengenceran pada isolasi bakteri
- Rak tabung reaksi untuk menyimpan tabung reaksi - Gelas ukur untuk menakar volume larutan
- Pipet untuk mengambil sampel
- Mikropipet untuk mengambil sampel dibawah 1 ml - Hot plate untuk memanaskan saat pembuatan medium - Erlenmeyer untuk menyimpan medium
- Jarum ose untuk melakukan pemindahan bakteri - L glass untuk meratakan sampel pada medium
- Bunsen untuk memanaskan jarum ose agar terhindar dari kontaminasi - Inkubator untuk melakukan inkubasi
- Mikroskop untuk mengamati preparat
- Timbangan digital untuk menimbang bahan - Tabung falcon untuk tempat kultur cair - Shaker incubator untuk inkubasi bakteri - Mikrotube untuk wadah sample
- Rak mikrotube untuk tempat menyimpan mikrotube - Centrifuge untuk melakukan sentrifugasi
- Deep freezer untuk menyimpan sampel hasil ekstrasi - Waterbath untuk inkubasi sampel DNA
- Vortex untuk menghomogenkan larutan - Timer untuk penanda waktu
- Sarung tangan sekali pakai untuk mencegah terjadinya kontaminasi - Spidol marker untuk menulis kode pada mikrotube
- Thermal cycler untuk melakukan amplifikasi DNA - Sendok pipih untuk mengambil gel agarose
- Cetakan gel agarose untuk mencetak gel agarose dan membuat sumur-sumur untuk penempatan hasil ekstraksi
- Alat elektroforesis untuk memisahkan pita DNA - Power supply untuk penyalur arus listrik
- Ultraviolet transilluminator untuk melihat hasil akhir elektroforesis
3.2.2 Bahan
- Ikan lele ukuran 250 gram yang diperoleh dari pembudidaya lele Kecamatan Simpang Kabupaten Sumedang
- NaCl fisiologis - Kertas label
- Medium MRS (de-Man Rogosa Sharpe) agar - Soluble starch
- Agar
- Polypeptone - Yeast extract - Akuades
- Alkohol 70% - Plastik pembungkus - Almunium foil
- Zat warna gentian violet - Lugol
- Zat warna air fuchsin - Pati 1%
- NA (Nutrien Agar) - NB (Nutrient Broth) - Enzim lysozyme
- Wizard Genomic DNA Purification Kit A1120 ( terdiri dari Nuclei Lysis Solution, 0,5 EDTA pH 8, Proteinase, RNase Solution, Protein Precipitation Solution, Isopropanol Ethanol 70%, DNA Rehydration Solution)
- Es curai - Tisu
- DNA template
- KAPA2G Fast Ready Mix - Primer Forward 16S rRNA - Primer Reverse 16S rRNA - Primer Forward Amy-E F - Primer Reverse Amy-E R - Nuclease Free Water (NFW) - Gel agarose
- Loading dye - TBE
- EtBr
3.3 Metode Penelitian
Penelitian ini akan dilakukan dalam beberapa tahap yaitu kultivasi bakteri dari saluran pencernaan ikan lele dan uji aktifitas amilolitik, serta analisis molekuler gen penyandi amilase menggunakan metode PCR.
Aktifitas amilolitik pada bakteri dapat diketahui dengan terbentuknya zona bening oleh bakteri pada media agar yang ditambahkan 1% pati zona bening tersebut kemudian dihitung dengan menggunakan rumus sebagai berikut:
IA = IA = Indeks Amilolitik
X1 = Rata-rata diameter zona bening X2 = Rata-rata diameter koloni
Sumber : Lim dan Rahim dalam Jamilah (2011)
Metode PCR (Polymerase Chain Reaction) adalah suatu metode enzimatis untuk melipat gandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro. Metode ini pertama kali dikembangkan oleh Kary B. Mullis pada tahun 1985 (Yuwono 2006).
Adapun metode penelitian mengenai analisis gen penyandi amilase dapat dilihat pada gambar berikut ini:
Gambar 3: Metode Penelitian Kultivasi Bakteri - Pengambilan sampel - Isolasi bakteri - Pemurnian bakteri - Pewarnaan gram bakteri
Uji Aktifitas Amilolitik
Analisis Molekuler Gen Penyandi Amilase - Kultur cair bakteri
- Isolasi DNA genom Bakteri - Amplifikasi DNA dengan PCR - Elektroforesis
3.4 Prosedur Penelitian
3.4.1 Sterilisasi Alat dan Medium
Sterilisasi dilakukan pada alat dan medium guna mencegah terjadinya kontaminasi dari alat dan medium yang akan digunakan. Sterilisasi yang digunakan adalah sterilisasi fisik yaitu uap panas bertekanan
Sterilisasi uap panas bertekanan dilakukan dengan cara memasukan alat dan bahan yang akan disterilkan pada autoklaf. Autoklaf dinyalakan hingga suhu 121oC lalu biarkan selama 15 menit.
3.4.2 Pengambilan Sampel
Pengambilan sampel dilakukan dengan cara membedah ikan lele untuk diambil ususnya, sebelum dilakukan pembedahan ikan lele terlebih dulu ditimbang bobotnya dan diukur panjangnya. Pembedahan ikan lele dilakukan melalui beberapa tahap yaitu :
- Mematikan ikan dengan cara menusuk bagian kepala ikan untuk mematikan syarafnya
- Ikan diletakan diatas baki dengan kepala menghadap ke kiri - Membuat sayatan pada perut ikan hingga organ dalam tampak - Memotong usus ikan pada bagian pylorus caeca
- Menyimpan usus dalam cawan petri yang diberi NaCl fisiologis
3.4.3 Kultivasi Bakteri dan Pemurnian
Kultivasi bakteri dilakukan dengan menggunakan protokol laboratorium mikrobiologi oleh Benson (2001). Kultivasi bakteri pertama dilakukan dengan cara menimbang usus lele sebanyak 1 gram kemudian usus lele tersebut dihaluskan menggunakan mortar dan ditambahkan NaCl fisiologis sebanyak 9 ml. Usus lele yang telah dihaluskan kemudian dimasukan kedalam tabung reaksi berisi NaCl fisiologis untuk di encerkan hingga 10-6.
Pengenceran dilakukan dengan cara sebagai berikut memasukan NaCl Fisiologis ke dalam masing-masing tabung reaksi dengan ketentuan sebagai berikut : satu tabung pertama diisi dengan 10 ml NaCl Fisiologis dan enam tabung berikutnya
masing-masing diisi dengan 9 ml NaCl Fisiologis. Usus lele hasil penggerusan kemudian masukkan ke dalam tabung I, vortex sebentar agar suspense homogen Ambil sebanyak 1 ml suspensi dari tabung I dengan menggunakan mikropipet, kemudian masukkan ke dalam tabung II, vortex sebentar agar suspense homogen lakukan hal yang sama pada tabung III dan seterusnya.
Larutan hasil pengenceran 10-6 diambil sebanyak 0,5 ml dengan menggunakan mikropipet, kemudian dimasukan kedalam cawan petri yang telah berisi medium MRS agar, kemudian ratakan dengan menggunakan L glass. Tutup cawan petri dan bungkus menggunakan plastik pembungkus lalu diinkubasi pada suhu 30oC selama 48 jam.
Setelah bakteri tumbuh tahap selanjutnya adalah pemurnian bakteri yang dilakukan melalui beberapa tahap yaitu:
- Mengambil bakteri yang telah dikultivasi - Mengambil koloni bakteri yang terpisah
- Menyeleksi koloni bakteri yang akan dimurnikan berdasarkan bentuk koloni, warna dan kenampakan lainnya
- Mengambil bakteri yang akan dimurnikan menggunakan jarum ose
- Memindahkan bakteri yang diambil kedalam cawan petri berisi medium NA dengan menggunakan metode gores
- Menutup cawan petri dan membungkusnya menggunakan plastik pembungkus
Proses tersebut diulangi hingga benar-benar didapatkan koloni murni yakni hingga hanya terdapat satu koloni saja. Untuk memastikan bahwa koloni benar-benar murni dan mengetahui jenis gramnya maka dilakukan pewarnaan dan pengamatan bakteri.
Adapun langkah-langkah dari pewarnaan dan pengamatan bakteri adalah sebagai berikut:
- Membasahi objek glass menggunakan alkohol dan kemudian mengeringkannya di atas bunsen
- Mengambil isolat bakteri yang akan diamati dengan jarum ose lalu diletakan pada NaCl fisiologis yang ada pada objek glass dan meratakannya
- Mengeringkan NaCl yang tercampur dengan bakteri yang akan diamati di atas bunsen
- Meneteskan zat warna gentian violet diatas NaCl dan bakteri yang dikeringkan lalu meratakannya dan mendiamkannya selama 30 detik - Membilas zat warna gentian violet menggunakan akuades dan
mengeringkannya
- Meneteskan lugol lalu ratakan dan mendiamkannya selama 30 detik - Membilas dengan alkohol kemudian dikeringkan
- Membilas dengan menggunakan akuades biarkan selama 2 detik
- Meneteskan zat warna air fucshin lalu ratakan dan mendiamkannya selama 30 detik
- Membilasnya dengan akuades dan dikeringkan
- Mengamati bentuk koloni dan warna dibawah mikroskop
3.4.4 Uji Aktifitas Amilolitik
Uji ini dilakukan setelah isolat tunggal (Lampiran 1) didapatkan, pada pengujian ini dilihat zona bening yang dihasilkan. Pengujian dilakukan dengan menggunakan medium ATCC 455 (Lampiran 2) dimana medium ini merupakan medium khusus untuk mendeteksi produksi enzim amilase dari mikroorganisme (Atlas 2000). Sementara metode yang dilakukan adalah metode difusi agar adapun langkah – langkah dari uji aktifitas amilolitik adalah sebagai berikut:
- Mengkultur bakteri dalam kultur cair selama 24 jam
- Kultur cair bakteri kemudian di sentrifuse selama 3 menit dengan kecepatan 13.000 rpm
- Medium ATCC 455 dalam cawan petri diberi lubang menggunakan tip steril dan kemudian pada lubang tersebut dimasukan kertas cakram berdiameter 5,9 mm
- Supernatan bakteri hasil setrifugasi diambil sebanyak 1 ml dan dimasukan kedalam lubang pada medium ATCC 455 yang telah diberi kertas cakram berdiameter 5,9 mm tersebut
- Melakukan kultivasi bakteri selama 56 jam
- Setelah bakteri tumbuh luasan zona bening diperhatikan dan diukur
Dari seluruh isolat tunggal yang diuji diambil 2 sampel yang memiliki indeks amilolitik terbesar lalu diidentifikasi secara molekuler.
3.4.5 Analisis Molekuler
a. Persiapan Bakteri Mengunakan Kultur Cair
Kultur cair dilakukan untuk perbanyakan bakteri adapun tahapanya adalah sebagai berikut:
- Menyiapkan medium Nutrient Broth
- Memindahkan isolat dari sampel yang terpilih kedalam medium Nutrient Broth
- Melakukan inkubasi selama 24 jam pada suhu 37oC b. Isolasi DNA Genom Bakteri
Isolasi DNA genom bakteri dilakukan dengan menggunakan Kit Promega (Wizard Genomic DNA Purification Kit) dengan tahapan sebagai berikut:
- Sentrifugasi 1 ml sampel dari kultur cair selama dua menit dengan kecepatan 13.000 rpm
- Membuang supernatan
- Sampel dimasukan kedalam tube 1,5 ml
- Pada mikrotube ditambahkan 480 µl 50 mM EDTA - Menambahkan 120 µl enzim lysozime
- Inkubasi pada suhu 37oC selama 30 menit
- Sentrifugasi selama 2 menit dengan kecepatan 13.000 rpm - Membuang supernatan
- Menambahkan 600 µl Nuclei Lysis Solution dipipet perlahan untuk mencampur
- Inkubasi pada suhu 80oC selama 5 menit kemudian didinginkan pada suhu ruang
- Menambahkan 3 µl RNase Solution, campurkan
- Inkubasi pada suhu 37oC selama 15 menit kemudian didinginkan pada suhu ruang
- Menambahkan 200 µl Protein Precipitation Solution kemudian di vortex - Inkubasi di atas es selama 5 menit
- Sentifugasi selama 3 menit pada kecepatan 13.000 rpm
- Memindahkan supernatan kedalam mikrotube yang berisi 600 µl isopropanol
- Sentrifugasi dan buang supernatan - Menambahkan 600 µl Ethanol 70%
- Sentrifugasi selama 2 menit dengan kecepatan 13.000 rpm - Buang ethanol dan kering udarakan pellet selama 15 menit
- Rehydrate pellet DNA dalam 100 µl Rehydration Solution selama 1 jam pada suhu 65oC atau semalaman pada suhu 4oC
c. Amplifikasi Gen Dengan PCR
Amplifikasi gen dilakukan dengan menggunakan Polymerase Chain Reaction (PCR) untuk mendapatkan sekuen gen yang diinginkan. Sebelum amplipikasi gen dengan PCR dilakukan terlebih dulu dilakukan elektroforesis pada DNA genom hasil isolasi DNA genom bakteri untuk memastikan berhasil tidaknya DNA genom bakteri di isolasi.
Primer yang digunakan adalah primer 16S rRNA universal dengan urutan basa seperti yang tersaji pada tabel 1 dan primer gen penyandi amilase seperti yang tersaji pada tabel 2.
Tabel 1. Primer 16S rRNA Universal
Primer Urutan Nukleotida (5´- 3´)
Forward F/Sequence: GGTTACCTTGTTACGACTT
Reverse R/Sequence: AGAGTTTGATCATGGCTCAG
Tabel 2. Primer Gen Penyandi Amilase
Primer Urutan Nukleotida (5´- 3´)
Forward Amy-F/Sequence: GGGAGGAGAATCATGAAACA
Reverse Amy-R/Sequence:
CTATCTTTGAACATAAATTGAAACCGACCC Sumber: Pudjiraharti (2008)
Langkah-langkah melakukan amplifikasi adalah sebagai berikut:
- Membuat campuran reaksi PCR yang terdiri dari PCR master mix, Primer Forward Amy F, Primer Reverse Amy R, DNA template dan Nuclease Free Water (Tabel 3)
- Campuran reaksi dihomogenkan menggunakan sentrifugasi - Mikrotube dimasukan kedalam mesin PCR
- Mesin PCR diatur suhunya sesuai dengan siklusnya (Tabel 4 dan 5) Tabel 3. Formulasi PCR Mix
Komponen Konsentrasi Akhir Volume (µl)
KAPA2G Fast Ready Mix 1X 12,5
Primer Forward 16S rRNA 0,5 µM 1,25
Primer Reverse 16S rRNA 0,5 µM 1,25
NFW (Nuclease Free Water) - 8,5
Template DNA - 1,5
Total volume 25
Sumber: Rachim dalam Ramadhan (2012) Tabel 4. Pengaturan Suhu PCR 16S rRNA
Siklus Suhu Waktu Jumlah Siklus
Inisialisasi 940C 2 menit 1 - Denaturasi - Annealing - Elongasi 940C 400C 720C 30 detik 1 menit 2 menit 30
Final elongasi 720C 10 menit 1
Final hold 40C - 1
Tabel 5. Pengaturan Suhu PCR Gen Penyandi Amilase
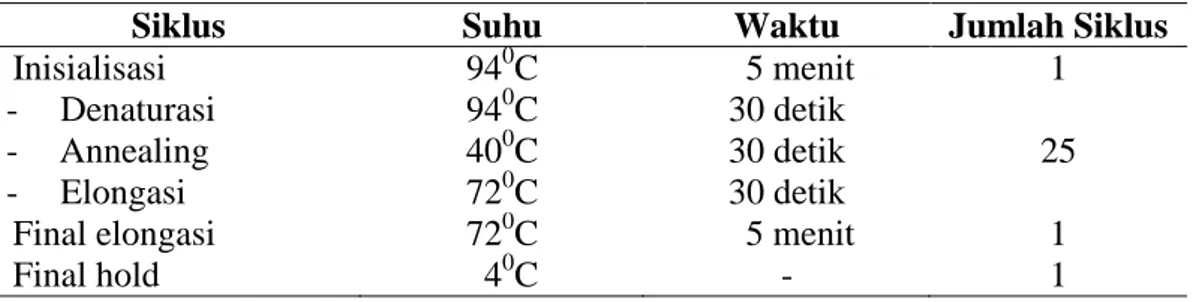
Siklus Suhu Waktu Jumlah Siklus
Inisialisasi 940C 5 menit 1 - Denaturasi - Annealing - Elongasi 940C 400C 720C 30 detik 30 detik 30 detik 25
Final elongasi 720C 5 menit 1
Final hold 40C - 1
Sumber: Pangastuti et al (2001)
d. Elektroforesis
Elektroforesis merupakan teknik pemisahan molekuler berdasarkan ukurannya dengan memanfaatkan muatan listrik yang ada pada makromolekul, ada beberapa tahapan untuk melakukan elektroforesis sebagai berikut:
- Membuat agarose yang dilarutkan pada TE buffer - Memanaskannya di atas hot plate
- Menuangkan gel ke atas lempeng
- Menancapkan cetakan (sisir) sebelum agar memadat untuk menciptakan sumur-sumur
- Mencabut cetakan (sisir) saat agar sudah memadat - Memasukan gel agarose padat pada tangki berisi buffer
- Memasukan hasil amplifikasi DNA dan marker pada setiap sumur
- Menutup tangki dan beri aliran listrik dengan cara menyambungkan kabel pada stop kontak
- Sisi yang berisi hasil amplifikasi diberi arus negatif dengan besar arus 75 volt selama 50 menit
- Setelah selesai lempeng agar diambil dari mesin elektroforesis dan direndam dalam EtBr selama 15 menit
- Perendaman kembali dilakukan dengan menggunakan akuades selama 5 menit
- Setelah selesai gel diangkat dan ditiriskan
- Gel diamati diatas UV trans illuminator dan didokumentasikan menggunakan kamera digital
3.5 Analisis Data
Setelah mendapatkan data hasil sekuensing dari isolat bakteri, dilakukan analisis menggunakan perangkat bioinformatik dan dicocokan dengan data di
www.ncbi.nih.gov melalui program BLAST N dan BLAST X untuk menetukan jenis dari isolat bakteri tersebut.
BLAST N digunakan untuk menganalisis hasil sekuensing dari gen 16S rRNA dan BLAST X digunakan untuk menganalisis hasil sekuensing dari gen penyandi amilase. Data yang diperoleh kemudian dianalisis secara deskriptif. Analisis ini dilakukan untuk memastikan bahwa hasil sekuensing pada penelitian ini merupakan sekuen dari gen penyandi amilase.