Bab IV Hasil dan Diskusi
IV.1 Hasil Eksperimen
Eksperimen dikerjakan di laboratorium penelitian Kimia Analitik. Suhu ruang saat bekerja berkisar 24-25˚C. Data yang diperoleh mencakup data hasil kalibrasi
terhadap buret, kalibrasi pipet volum 25 mL, kalibrasi pipet volum 10 mL, standarisasi larutan HCl, pembuatan kurva titrasi larutan jenuh Ca(OH)2 dengan
larutan HCl, dan data hasil pengukuran kelarutan Ca(OH)2.
Data hasil kalibrasi terhadap buret, kalibrasi pipet volum 25 mL, dan kalibrasi pipet volum 10 mL selengkapnya terdapat dalam Lampiran A. Sedangkan data hasil standarisasi larutan HCl selengkapnya pada Lampiran B. Kurva titrasi larutan jenuh Ca(OH)2 dengan larutan HCl selengkapnya pada Lampiran C.
IV.1.1 Kelarutan Ca(OH)2 dalam air
Data hasil pengukuran kelarutan Ca(OH)2 dalam air pada suhu ruang 25˚C
selengkapnya disajikan dalam Tabel D.1 pada Lampiran D. Dari hasil pengukuran diperoleh bahwa kelarutan Ca(OH)2 dalam air pada suhu ruang 25˚C adalah
0,0203 mol/L. Hasil eksperimen ini sesuai dengan yang diharapkan.
IV.1.2 Kelarutan Ca(OH)2 dalam larutan NaOH
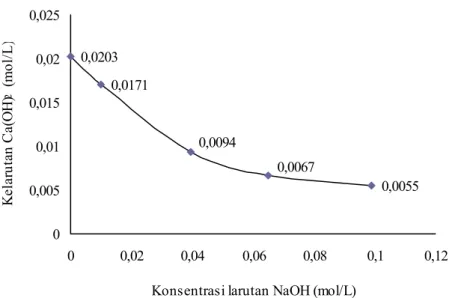
Data kelarutan Ca(OH)2 dalam larutan NaOH yang diukur pada suhu ruang 25˚C
0,0203 0,0171 0,0055 0,0067 0,0094 0 0,005 0,01 0,015 0,02 0,025 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi larutan NaOH (mol/L)
K ela ru ta n Ca (O H ) 2 ( m ol/L )
Gambar IV. 1 Grafik kelarutan Ca(OH)2 dalam larutan NaOH
Berdasarkan data pada Gambar IV.1 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan NaOH semakin kecil dengan meningkatnya konsentrasi larutan NaOH. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam
larutan NaOH 0,01 M mengalami penurunan sebesar 16%; 54% dalam larutan NaOH 0,04 M; 67% dalam larutan NaOH 0,065 M; dan sebesar 73% dalam larutan NaOH 0,1 M .
Larutan NaOH 0,01 M secara teoritis mempunyai pH = 12, larutan NaOH 0,04M mempunyai pH = 12,6, larutan NaOH 0,065 M mempunyai pH = 12,8, dan larutan NaOH 0,1 M mempunyai pH = 13. Dengan demikian dapat dikatakan bahwa kelarutan Ca(OH)2 semakin kecil pada larutan basa NaOH yang pH-nya semakin
besar.
Menurunnya kelarutan Ca(OH)2 dalam larutan NaOH dapat dijelaskan dengan
uraian berikut. Ketika Ca(OH)2(s) melarut, akan terbentuk ion Ca2+(aq) dan ion
OH−(aq). Kesetimbangan dicapai ketika laju pembentukan ion-ion dari fasa padat ke dalam larutan sama dengan laju di mana ion-ion dalam larutan kembali membentuk fasa padat. Karena laju pembentukan fasa padat meningkat dengan
diperlukan untuk melarut guna mencapai keadaan kesetimbangan menurun dengan adanya sejumlah ion OH− dalam pelarut yang berasal dari NaOH. Hal ini dikenal sebagai pengaruh pH dan dapat juga dikenal sebagai pengaruh ion senama.
IV.1.3 Kelarutan Ca(OH)2 dalam larutan CaCl2
Data kelarutan Ca(OH)2 dalam larutan CaCl2 yang diukur pada suhu ruang 25˚C
disajikan dalam Gambar IV.2.
0,0203 0,0182 0,0167 0,0162 0,0158 0 0,005 0,01 0,015 0,02 0,025 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi Larutan CaCl2 (mol/L)
K ela ru ta n C a( O H ) 2 (m ol/L )
Gambar IV. 2 Grafik kelarutan Ca(OH)2 dalam larutan CaCl2
Berdasarkan data pada Gambar IV.2 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan CaCl2 semakin kecil dengan meningkatnya konsentrasi larutan
CaCl2. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam
larutan CaCl2 0,01 M mengalami penurunan sebesar 10%; 18% dalam larutan
CaCl2 0,04 M; 20% dalam larutan CaCl2 0,08 M; dan 22% dalam larutan CaCl2
0,1 M.
Menurunnya kelarutan Ca(OH)2 dalam larutan CaCl2 dapat dijelaskan dalam
uraian berikut ini. Ketika Ca(OH)2(s) melarut, akan terbentuk ion Ca2+(aq) dan ion
membentuk fasa padat. Karena laju pembentukan fasa padat meningkat dengan meningkatnya konsentrasi ion-ion Ca2+ dan OH−, maka jumlah Ca(OH)2 yang
diperlukan untuk melarut guna mencapai keadaan kesetimbangan menurun dengan adanya sejumlah ion Ca2+ dalam pelarut yang berasal dari CaCl2. Hal ini
dikenal sebagai pengaruh ion senama.
IV.1.4 Kelarutan Ca(OH)2 dalam larutan Ca(NO3)2
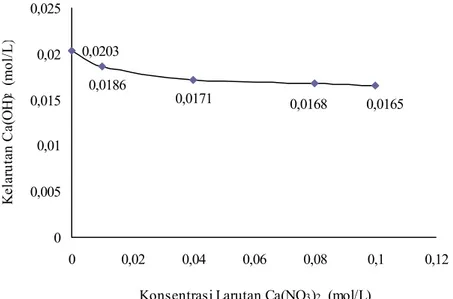
Data kelarutan Ca(OH)2 dalam larutan Ca(NO3)2 yang diukur pada suhu ruang
25˚C disajikan dalam Gambar IV.3.
0,0203 0,0186 0,0171 0,0168 0,0165 0 0,005 0,01 0,015 0,02 0,025 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi Larutan Ca(NO3)2 (mol/L)
K ela ru ta n C a( O H ) 2 ( m ol/L )
Gambar IV. 3 Grafik kelarutan Ca(OH)2 dalam larutan Ca(NO3)2
Berdasarkan data pada Gambar IV.3 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan Ca(NO3)2 semakin kecil dengan meningkatnya konsentrasi larutan
Ca(NO3)2. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2
dalam larutan Ca(NO3)2 0,01 M mengalami penurunan sebesar 8%; 16% dalam
larutan Ca(NO3)2 0,04 M; 17% dalam larutan Ca(NO3)2 0,08 M; dan 19% dalam
Menurunnya kelarutan Ca(OH)2 dalam larutan CaNO3)2 dapat dijelaskan dalam
uraian berikut. Ketika Ca(OH)2(s) melarut, akan terbentuk ion Ca2+(aq) dan ion
OH−(aq). Kesetimbangan dicapai ketika laju pembentukan ion-ion dari fasa padat ke dalam larutan sama dengan laju di mana ion-ion dalam larutan kembali membentuk fasa padat. Karena laju pembentukan fasa padat meningkat dengan meningkatnya konsentrasi ion-ion Ca2+ dan OH−, maka jumlah Ca(OH)2 yang
diperlukan untuk melarut guna mencapai keadaan kesetimbangan menurun dengan adanya sejumlah ion Ca2+ dalam pelarut yang berasal dari Ca(NO3)2. Hal
ini dikenal sebagai pengaruh ion senama.
IV.1.5 Kelarutan Ca(OH)2 dalam larutan urea
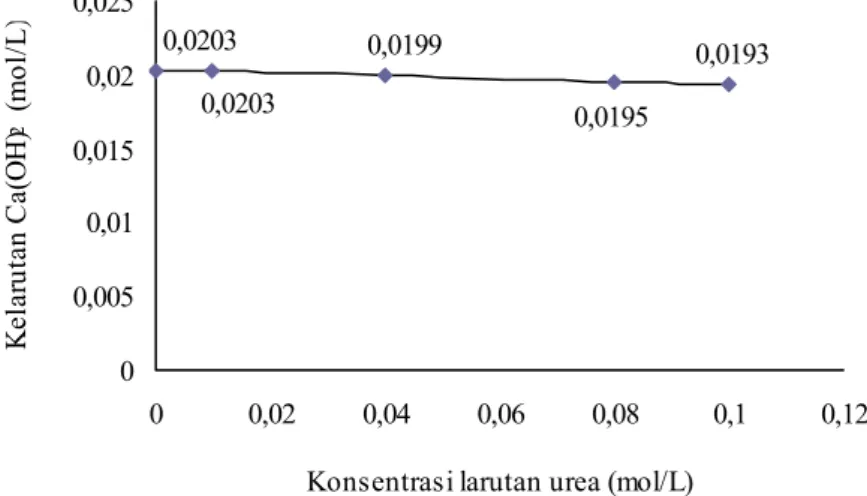
Data kelarutan Ca(OH)2 dalam larutan urea yang diukur pada suhu ruang 25˚C
disajikan dalam Gambar IV.4.
0,0203 0,0203 0,0199 0,0195 0,0193 0 0,005 0,01 0,015 0,02 0,025 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi larutan urea (mol/L)
K ela ru ta n Ca (O H ) 2 ( m ol/L )
Gambar IV. 4 Grafik kelarutan Ca(OH)2 dalam larutan urea
Berdasarkan data pada Gambar IV.4 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan urea semakin kecil dengan bertambahnya konsentrasi larutan urea. Penurunan kelarutan Ca(OH)2 relatif kecil, pada larutan urea 0,1 M penurunannya
Urea memiliki nilai pKb = 13,82 dan larutan urea 10% dalam air mempunyai pH =
7,2. Data ini menunjukkan bahwa larutan urea bersifat basa sangat lemah. Persamaan reaksi ionisasinya:
NH2−CO−NH2(aq) + H2O(l) → NH2−CO−NH3+(aq) + OH−(aq) (28)
Walaupun larutan urea bersifat basa tetapi tidak menunjukkan adanya reaksi dengan larutan HCl yang digunakan dalam titrasi. Hal ini telah dibuktikan melalui eksperimen. Campuran 10 mL larutan urea 0,1 M dan 10 mL larutan NaOH 0,084M, dititrasi menggunakan larutan HCl 0,078M. Data titrasi selengkapnya disajikan dalam Tabel I.2 pada Lampiran I. Hasil perhitungan menunjukkan bahwa jumlah mol NaOH sama dengan jumlah mol HCl. Jadi tidak ada reaksi antara urea dengan HCl. Dengan kata lain konsentrasi ion OH− dalam larutan urea 0,1 mol/L tidak dapat ditentukan melalui titrasi menggunakan HCl.
Menurunnya kelarutan Ca(OH)2 dalam larutan urea disebabkan oleh adanya ion
senama OH− yang berasal dari reaksi asam-basa antara molekul urea dengan air. Karena konsentrasi ion OH− dalam larutan urea sangat kecil maka pengaruhnya terhadap penurunan kelarutan Ca(OH)2 juga sangat kecil.
IV.1.6 Kelarutan Ca(OH)2 dalam larutan NaCl
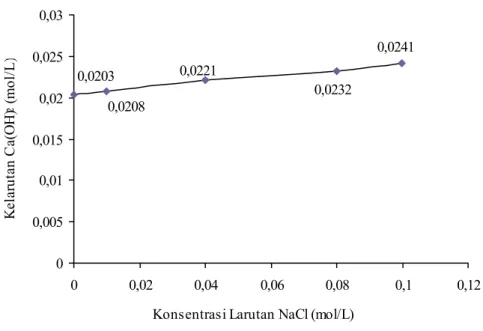
Data kelarutan Ca(OH)2 dalam larutan NaCl yang diukur pada suhu ruang 25˚C
disajikan dalam Gambar IV.5.
Berdasarkan data pada Gambar IV.5 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan NaCl semakin besar dengan bertambahnya konsentrasi larutan NaCl. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam
larutan NaCl 0,01 M mengalami kenaikan sebesar 3%; 9% dalam larutan NaCl 0,04 M; 14% dalam larutan NaCl 0,08 M; dan 19% dalam larutan NaCl 0,1 M.
0,0241 0,0232 0,0221 0,0208 0,0203 0 0,005 0,01 0,015 0,02 0,025 0,03 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi Larutan NaCl (mol/L)
K ela ru ta n C a( O H ) 2 (m ol/L )
Gambar IV. 5 Grafik kelarutan Ca(OH)2 dalam larutan NaCl
Keberadaan ion tak senama Na+ dan Cl− mempunyai pengaruh menstabilkan ion-ion Ca2+ dan OH−yang terlibat dalam kesetimbangan kelarutan. Hal ini terjadi karena ion-ion Ca2+ dan OH− dikelilingi oleh suatu atmosfer ion yang muatannya berlawanan. Ion Ca2+ dikelilingi oleh atmosfer ion Cl−, dan ion OH− dikelilingi oleh atmosfer ion Na+. Stabilisasi meningkat dengan meningkatnya konsentrasi ion-ion tak senama dalam larutan.(4)
Stabilisasi ion-ion Ca2+ dan OH− oleh ion-ion Na+ dan Cl− dalam larutan mempunyai pengaruh menggeser kesetimbangan kelarutan kearah peruraian Ca(OH)2(s) menjadi ion-on Ca2+(aq) dan OH−(aq).
Adanya ion-ion yang bermuatan berlawanan di sekitar ion Ca2+ dan OH− akan menurunkan muatan efektif sehingga mengurangi gaya tariknya. Muatan
pelindung berpengaruh menurunkan kecenderungan ion Ca2+ dan OH−
membentuk agregat, sehingga pencapaian kesetimbangan dalam larutan yang mengandung elektrolit akan membutuhkan konsentrasi Ca2+ dan OH− yang lebih tinggi.
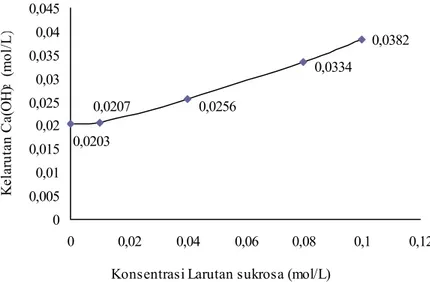
IV.1.7 Kelarutan Ca(OH)2 dalam larutan Sukrosa
Dari hasil eksperimen menunjukkan bahwa kelarutan Ca(OH)2 semakin besar
dengan meningkatnya konsentrasi larutan sukrosa, seperti pada gambar IV.6.
0,0382 0,0256 0,0334 0,0203 0,0207 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 0,045 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi Larutan sukrosa (mol/L)
K ela ru ta n C a( O H ) 2 ( m ol/L )
Gambar IV. 6 Grafik kelarutan Ca(OH)2 dalam larutan sukrosa
Berdasarkan data pada Gambar IV.6 menunjukkan bahwa kelarutan Ca(OH)2
dalam larutan sukrosa meningkat dengan meningkatnya konsentrasi larutan sukrosa. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam
larutan sukrosa 0,01 M mengalami kenaikan sebesar 2%; 26% dalam larutan sukrosa 0,04M; 65% dalam larutan sukrosa 0,08M; dan 88% dalam larutan sukrosa 0,1M.
Peningkatan kelarutan Ca(OH)2 ini karena adanya interaksi antara
molekul-molekul sukrosa dengan ion-ion yang berasal dari Ca(OH)2. Hal lain yang
mungkin terjadi adalah adanya reaksi antara larutan sukrosa dengan larutan HCl yang digunakan pada titrasi.
Dari hasil eksperimen menunjukkan bahwa tidak adanya reaksi antara HCl dengan sukrosa. Eksperimen yang dilakukan adalah mentitrasi campuran 10 mL larutan
Data selengkapnya disajikan dalam Tabel J.2 pada Lampiran J. Hasilnya menunjukkan bahwa jumlah mol NaOH sama dengan jumlah mol HCl, artinya HCl hanya bereaksi dengan larutan NaOH dan tidak bereaksi dengan sukrosa. Meningkatnya kelarutan Ca(OH)2 dalam larutan sukrosa diduga disebabkan
adanya interaksi antara ion-ion Ca2+ dengan gugus hidroksil pada molekul sukrosa. Blackwell dan Fosdick pada tahun 1954 menyatakan bahwa sukrosa membentuk senyawa dengan ion kalsium dalam larutan basa, dan senyawa yang dibentuk belum dikenal.(20)
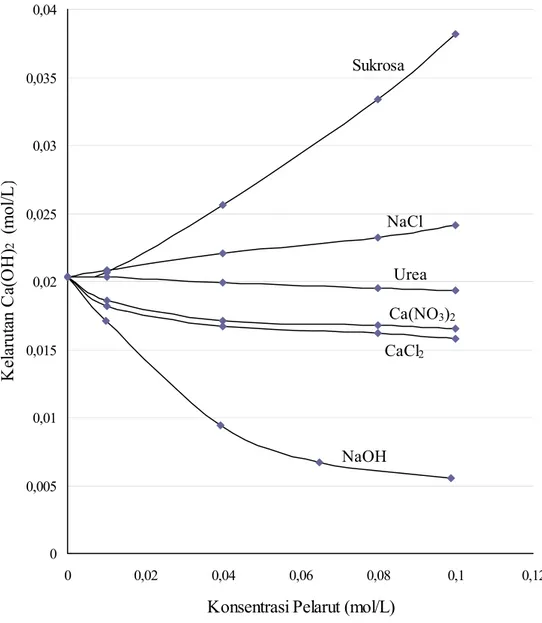
IV.1.8 Pengaruh zat-zat kimia pada kelarutan Ca(OH)2 dalam air
Gambar IV.7 menyajikan data secara lengkap yang dihasilkan sehingga dapat melihat secara jelas pengaruh zat-zat kimia terhadap kelarutan Ca(OH)2 dalam air.
Dari data pada gambar IV.7 menunjukkan bahwa kelarutan Ca(OH)2 dalam air
lebih besar dibandingkan kelarutannya dalam larutan urea, Ca(NO3)2, CaCl2, dan
NaOH. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam
larutan urea turun sebesar 5%; turun sebesar 19% dalam larutan Ca(NO3)2, turun
sebesar 22% dalam larutan CaCl2, dan turun sebesar 73% dalam larutan NaOH
pada konsentrasi masing-masing 0,1 M. Jadi senyawa NaOH mempunyai pengaruh paling besar dalam menurunkan kelarutan Ca(OH)2 dalam air.
Data pada gambar IV.7 juga menunjukkan bahwa kelarutan Ca(OH)2 dalam
larutan NaCl dan sukrosa lebih besar dibandingkan dalam air. Dibandingkan dengan kelarutannya dalam air, kelarutan Ca(OH)2 dalam larutan NaCl naik
sebesar 19%, dan naik sebesar 88% dalam larutan sukrosa pada konsentrasi masing-masing 0,1 M. Jadi senyawa sukrosa mempunyai pengaruh paling besar dalam meningkatkan kelarutan Ca(OH)2 dalam air.
CaCl2 Ca(NO3)2 NaCl Urea NaOH Sukrosa 0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04 0 0,02 0,04 0,06 0,08 0,1 0,12
Konsentrasi Pelarut (mol/L)
K ela ru ta n C a( O H ) 2 (mo l/L )
Gambar IV. 7 Grafik pengaruh zat-zat kimia pada kelarutan Ca(OH)2 dalam air
Selanjutnya akan didiskusikan tentang perbedaan kelarutan Ca(OH)2 dalam
larutan NaCl dan NaOH, kelarutan Ca(OH)2 dalam larutan CaCl2 dan Ca(NO3)2,
IV.1.8.1 Membandingkan kelarutan Ca(OH)2 dalam larutan NaCl dan
NaOH
Hasil eksperimen menunjukkan bahwa kelarutan Ca(OH)2 dalam larutan NaCl
meningkat, sebaliknya dalam larutan NaOH menurun.
Larutan NaCl dan larutan NaOH memiliki kesamaan yaitu keduanya mengandung ion Na+. Jika dianggap bahwa ion Na+ pada kedua larutan memiliki pengaruh yang sama, berarti yang membedakan kelarutan Ca(OH)2
dalam kedua pelarut adalah adanya ion Cl− dan OH−. Ion Cl− bersifat meningkatkan kelarutan Ca(OH)2 karena berinteraksi melalui pembentukan
atmosfer ion di sekitar ion Ca2+ dan menstabilkannya. Sedangkan ion OH− bersifat menurunkan kelarutan Ca(OH)2 karena bertindak sebagai ion senama yang
menyebabkan kesetimbangan kelarutan bergeser kearah pembentukan kristal Ca(OH)2.
IV.1.8.2 Membandingkan kelarutan Ca(OH)2 dalam larutan CaCl2 dan
Ca(NO3)2
Kelarutan Ca(OH)2 baik dalam larutan CaCl2 maupun Ca(NO3)2 lebih rendah
dibandingkan dalam air. Hal ini terjadi karena dalam larutan CaCl2 dan Ca(NO3)2
terdapat ion senama yaitu ion Ca2+ yang berperan menurunkan kelarutan. Pada konsentrasi pelarut yang sama, kelarutan Ca(OH)2 dalam larutan CaCl2 sedikit
lebih rendah dibandingkan dalam Ca(NO3)2. Hal ini sangat menarik untuk
didiskusikan.
Berdasarkan data rujukan pada Tabel IV.1 menunjukkan bahwa pada konsentrasi yang sama larutan CaCl2 memiliki koefisien aktivitas rata-rata sedikit lebih besar
dari pada larutan Ca(NO3)2. Karena koefisien aktivitas sebanding dengan
aktivitas, maka pada konsentrasi yang sama aktivitas ion Ca2+ dalam larutan
dalam menurunkan kelarutan Ca(OH)2. Selisih aktivitas ion Ca2+ pada kedua
pelarut dengan konsentrasi masing-masing sama besar adalah relatif kecil, misalnya pada konsentrasi pelarut 0,1 M mempunyai selisih aktivitas sebesar 4 x 10−3 , oleh karena itu perbedaan kelarutannya juga relatif kecil, yaitu 7 x 10−4 M. Tabel IV.1 menunjukkan data koefisien aktivitas rata-rata untuk larutan CaCl2
dan Ca(NO3)2 pada beberapa konsentrasi.(7)
Tabel IV. 1 Koefisien aktivitas rata-rata larutan CaCl2 dan Ca(NO3)2
Konsentrasi (M) Koefisien aktivitas rata-rata CaCl2 Koefisien aktivitas rata-rata Ca(NO3)2 0,01 0,05 0,1 0,2 0,73 0,57 0,52 0,48 0,71 0,54 0,48 0,42
IV.1.8.3 Membandingkan kelarutan Ca(OH)2 dalam larutan CaCl2 dan
NaOH
Kelarutan Ca(OH)2 dalam larutan CaCl2 maupun NaOH lebih rendah
dibandingkan dalam air. Hal ini terjadi karena dalam larutan CaCl2 terdapat ion
senama Ca2+ dan dalam larutan NaOH terdapat ion senama OH−. Pada konsentrasi pelarut yang sama, kelarutan Ca(OH)2 dalam larutan NaOH lebih rendah
dibandingkan dalam larutan CaCl2 dengan selisih yang relatif besar. Hal ini
menarik untuk didiskusikan.
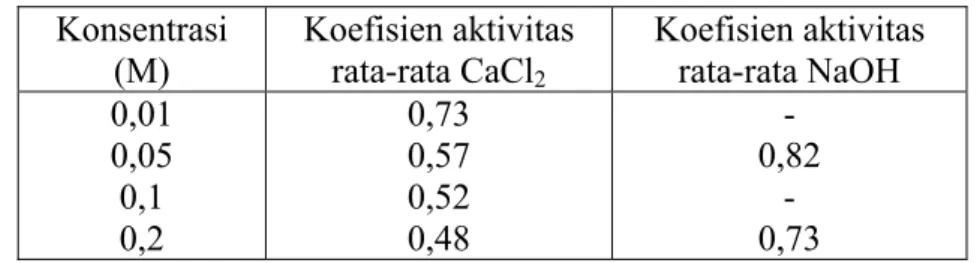
Berdasarkan data rujukan dalam Tabel IV.2 tersebut menunjukkan bahwa pada konsentrasi yang sama, larutan NaOH mempunyai koefisien aktivitas rata-rata lebih besar sampai kira-kira satu setengah kali dibandingkan larutan CaCl2.
Koefisien aktivitas sebanding dengan aktivitas. Jadi pada konsentrasi yang sama, aktivitas ion OH− dalam larutan NaOH kira-kira satu setengah kali dibandingkan dengan aktivitas ion Ca2+ dalam larutan CaCl2. Semakin besar aktivitas ion
CaCl2 pada konsentrasi yang sama relatif besar, misalnya dalam larutan 0,1 M
mempunyai selisih aktivitas sebesar 0,026, oleh karena itu perbedaan kelarutannya juga relatif besar, yaitu 0,0103 M.
Tabel IV.2 menunjukkan data koefisien aktivitas rata-rata untuk larutan CaCl2
dan NaOH pada beberapa konsentrasi.(7)
Tabel IV. 2 Koefisien aktivitas rata-rata larutan CaCl2 dan NaOH
Konsentrasi (M) Koefisien aktivitas rata-rata CaCl2 Koefisien aktivitas rata-rata NaOH 0,01 0,05 0,1 0,2 0,73 0,57 0,52 0,48 - 0,82 - 0,73
IV.2 Implementasi dalam Pembelajaran
Pada bagian ini berisi gagasan dalam mengimplementasikan eksperimen dalam pembelajaran di kelas. Gagasan ini tentunya mengacu pada pengalaman penulis sebagai guru, ketersediaan fasilitas, dan sistem pembelajaran yang ada dan berkembang di Madrasah Aliyah Negeri Insan Cendekia Gorontalo.
Berdasarkan standar isi dari kurikulum KTSP tahun 2006, materi pelajaran tentang kelarutan dan hasil kali kelarutan diberikan di kelas XI semester dua. Standar kompetensi dan kompetensi dasar materi pelajaran tentang kelarutan dan hasil kali kelarutan terdapat dalam tabel IV.3 berikut:(6)
Tabel IV. 3 Standar kompetensi dan kompetensi dasar untuk materi kelarutan dan hasil kali kelarutan
Standar Kompetensi Kompetensi Dasar
Memahami sifat-sifat
Berdasarkan kompetensi dasar pada Tabel IV.3 maka dapat dijabarkan dalam kegiatan pembelajaran dan indikator. Pokok-pokok kegiatan pembelajaran dan indikator capaian dipaparkan dalam Tabel IV.4.
Tabel IV. 4 Kegiatan pembelajaran dan indikator
Kegiatan Pembelajaran Indikator
Menentukan kelarutan Ca(OH)2
dalam air, larutan NaOH, larutan NaCl, dan dalam larutan CaCl2
melalui kegiatan eksperimen. (Alokasi waktu 3 jam pelajaran)
1. Mengukur dan membedakan kelarutan suatu zat dalam beberapa pelarut melalui eksperimen di laboratorium.
Penyajian materi tentang tetapan hasil kali kelarutan, hubungan kelarutan dengan Ksp, pengaruh ion
senama, pengaruh garam terhadap kelarutan menggunakan
pendekatan “lempar Mahkota”. (Alokasi waktu 3 jam pelajaran)
2. Menjelaskan hubungan antara kelarutan dan hasil kali kelarutan. 3. Menjelaskan pengaruh ion senama
terhadap kelarutan.
4. Menjelaskan pengaruh pH terhadap kelarutan.
5. Menjelaskan pengaruh garam terhadap kelarutan.
Penyajian materi tentang reaksi pengendapan disampaikan secara verbal dan diakhiri dengan demontrasi yang dilakukan oleh beberapa siswa yang ditunjuk. (Alokasi waktu 1 jam pelajaran)
6. Memprediksi terbentuknya endapan berdasarkan nilai Ksp dan Qc.
Menyelesaikan soal latihan dengan pendekatan “mencari pasangan” dan divariasikan dengan maju ke depan.
(Alokasi waktu 2 jam pelajaran)
7. Menyelesaikan dengan benar soal-soal latihan yang disiapkan oleh guru.
Ujian tertulis.
Adapun langkah-langkah kegiatan pembelajaran secara lebih rinci penulis paparkan dalam Tabel IV.5 berikut:
Tabel IV. 5 Uraian kegiatan pembelajaran
Kegiatan Pembelajaran Uraian
Menentukan kelarutan Ca(OH)2 dalam air,
larutan NaOH, larutan NaCl, dan dalam larutan CaCl2 melalui
kegiatan eksperimen. (Alokasi waktu 3 jam pelajaran)
Yang dilakukan guru meliputi:
1. Menyiapkan alat, bahan kimia, dan lembar kerja siswa yang dibutuhkan untuk terselenggaranya eksperimen.
2. Membagi siswa dalam sepuluh kelompok dan masing-masing kelompok mengerjakan tugas eksperimen yang tertera dalam lembar kerja siswa (LKS).
3. Membantu siswa dalam melaksanakan
eksperimen agar diperoleh data yang diharapkan. Data yang diperoleh setiap kelompok
dikomunikasikan kepada kelompok lain oleh ketua kelompok.
4. Memberikan kesempatan kepada siswa untuk melengkapi lembar kerja siswa.
5. Mendiskusikan hasil eksperimen agar semua siswa mendapatkan pemahaman yang tepat. 6. Mengamati kinerja dan sikap siswa selama
pelaksanaan eksperimen.
(LKS selengkapnya dalam Lampiran K) Penyajian materi
tentang tetapan hasil kali kelarutan, hubungan kelarutan dengan Ksp, pengaruh
ion senama, pengaruh garam terhadap
kelarutan menggunakan pendekatan “lempar Mahkota”.
(Alokasi waktu 3 jam pelajaran)
Yang dilakukan oleh guru meliputi:
1. Menyiapkan sebuah mahkota dari kertas yang bertuliskan “Empu Ksp”. Menyampaikan materi
pokok yang akan dipelajari, kemudian memberikan kesempatan kepada siswa untuk membaca materi dalam buku pegangan. Setelah itu siswa dipersilahkan menutup bukunya. Guru mengambil mahkota dan memasangkan pada kepala seorang siswa, setelah itu guru
memberikan pertanyaan dan siswa tersebut harus menjawabnya. Demikian seterusnya, sampai beberapa siswa. Pertanyaan yang diajukan guru diupayakan bersifat konseptual, bukan hitungan. (Paket soal dalam Lampiran L)
2. Mempresentasikan materi pelajaran secara verbal dengan bantuan media seperti OHP dan papan tulis untuk memberikan pemahaman yang tepat pada siswa.
Tabel IV.5. (Lanjutan)
Kegiatan Pembelajaran Uraian
Penyajian materi tentang reaksi pengendapan disampaikan secara verbal dan diakhiri dengan demontrasi yang dilakukan oleh beberapa siswa yang ditunjuk.
(alokasi waktu 1 jam pelajaran)
Yang dilakukan oleh guru:
1. Mempresentasikan secara verbal materi tentang reaksi pengendapan dengan bantuan media seperti OHP dan papan tulis.
2. Membagikan lembar kerja siswa dan meminta siswa memprediksi terbentuk/tidak endapan dari percampuran suatu larutan melalui perhitungan.
3. Meminta siswa tertentu untuk
mendemontrasikan percampuran dua larutan yang telah ditentukan untuk membuktikan ketepatan dari prediksi.
(LKS selengkapnya ada pada lampiran N) Menyelesaikan soal latihan dengan pendekatan “mencari pasangan” dan divariasikan dengan maju ke depan. (Alokasi waktu 2 jam pelajaran)
Yang dilakukan oleh guru:
1. Pada kira-kira 15 menit pertama digunakan pendekatan “mencari pasangan”. Untuk itu guru menyediakan 10 soal dan jawabannya. Setiap soal dan jawaban ditulis dalam selembar kertas yang disebut kartu soal. Kepada 10 siswa dibagikan masing-masing satu kartu soal dan diberikan kesempatan 2-5 menit untuk mempersiapkan jawabannya. Sementara itu kepada 10 siswa lainnya diminta maju ke depan dan dibagi kartu berisi jawaban. Setelah itu siswa yang mendapat kartu berisi soal diminta mencari pasangannya yaitu jawaban yang dibawa oleh siswa yang di depan. Setelah satu babak, bisa diulang.
(Paket soal dalam Lampiran O)
2. Guru menyiapkan paket soal dalam bahasa Inggris untuk diberikan kepada siswa, memberikan kesempatan untuk mencoba menyelesaikan dan menunjuk/mempersilahkan siswa untuk mengerjakan di papan tulis. Jika siswa tidak mampu menemukan jawabannya, maka guru memberikan bantuan sebagian atau seluruhnya. (Paket soal tersedia di Lampiran P) Ujian tertulis.
(Alokasi waktu 1 jam pelajaran)
Yang dilakukan oleh guru:
1. Menyusun soal ujian yang terdiri dari 10 soal pilihan ganda dan 3 soal uraian.
2. Menyiapkan kunci jawaban untuk memeriksa hasil pekerjaan siswa.
Demikianlah secara ringkas gagasan penulis dalam menyajikan materi pelajaran kimia pokok bahasan kelarutan dan hasil kali kelarutan. Melalui langkah-langkah yang penulis susun, baik siswa maupun guru dituntut secara aktif ambil bagian dalam kegiatan pembelajaran. Sangat jelas bahwa untuk terselenggaranya pembelajaran tersebut seorang guru harus melakukan persiapan yang maksimal, diantaranya:
1. Kondisi fisik harus dalam keadaan sehat. 2. Menyusun lembar kerja siswa yang dibutuhkan.
3. Membuat mahkota dari kertas bertuliskan “Empu Ksp” dan pertanyaan yang
bersifat konseptual.
4. Membuat kartu soal untuk permainan “mencari pasangan”, soal latihan dan soal ujian.
5. Menyusun materi presentasi yang akan disajikan dalam bentuk transparan atau power point, dan ringkasan materi pelajaran untuk dipelajari siswa.
6. Menyediakan alat-alat dan bahan kimia yang diperlukan untuk eksperimen. 7. Melakukan evaluasi pelaksanaan untuk penyempurnaan di kemudian hari.
8. Bekerja sama dengan rekan guru kimia untuk membantu pelaksanaan
eksperimen.
Demikian pula bagi siswa yang mengikuti pembelajaran dituntut secara aktif menggunakan dan mengembangkan potensi yang dimilikinya, di antaranya:
1. Kemampuan menggunakan alat-alat laboratorium.
2. Ketelitian dalam pengukuran, karena percobaan bersifat kuantitatif dan data yang diperoleh akan digunakan oleh kelompok siswa lainnya.
3. Kemampuan menghitung untuk mengolah data dan menyelesaikan soal-soal latihan maupun ujian yang umumnya bersifat algoritmik.
4. Kemampuan bekerja sama dalam kelompok, terutama dalam ekperimen. 5. Menyukai permainan, ini melalui kegiatan latihan soal yang menerapkan
pendekatan “Lempar Mahkota” maupun “Mencari Pasangan”.
6. Kemampuan membaca pemahaman, karena setelah membaca akan diberikan tanya jawab yang pertanyaanya bersifat konseptual.