A. ISOLASI DAN IDENTIFIKASI BAKTERI ASAM LAKTAT
Bakteri asam laktat merupakan bakteri gram positif dan bersifat katalase negatif. Dari pikel ketimun didapatkan 25 isolat bakteri dan dari acar 5 isolat bakteri. Foto pikel ketimun dan acar yang digunakan dalam penelitian ini dapat dilihat pada Gambar 3 dan Gambar 4. Adapun hasil uj i pewarnaan gram bakteri yang diisolasi dari pikel dapat dilihat pada Tabel 2. Dari hasil pewarnaan gram tersebut didapatkan 14 isolat bakteri gram positif dan 11 bakteri gram negatif: Sedangkan dari acar didapatkan 4 isolat bakteri gram positif dan 1 isolat bakteri gram negatif. Semua isolat bakteri ini bersifat katalase negatif. Ini berarti jumlah bakteri asam laktat yang berhasil diisolasi dari pikel ketimun sebanyak 14 isolat, yang terdiri dari 8 iso1at Lacto-bacillus plantarum, 3 isolat LactoLacto-bacillus heterofer-mentatif, 1 isolat Streptococcus, 1 isolat Leuconos-toc, dan 1 isolat Lb. fermentum. Dari acar berhasil diisolasi 4 kultur bakteri asam laktat, semuanya Pe-diococcus sp ..
Pemberian kode isolat berdasar.kan atas asal isolat bakteri, lama fermentasi pada saat isolasi di1akukan, dan urutan isolat bakteri asam laktat.
Gambar 3. Pikel Ketimun
Tabel 2. Hasi1 Uji Pewarnaan Gram Isolat Bakteri dari Pikel Ketimun
Fermentasi (hari) Jumlah isolat bakteri Gram positif Gram negatif 2 4 6 9 12 16 Jumlah Misalnya 2 4 5 2 1 14 1 1 5 2 2 11
kode pi 201 berarti isolat ini diisolasi dari pike1 ketimun dan merupakan isolat bakteri asam laktat yang pertama diiso1asi pada waktu fermentasi 2 hari, kode ca 104 b,rarti isolat ini diisolasi dari acar sehari sete1ah pembe1ian acar dan merupakan iso-lat bakteri asam laktat keempat yang dipero1eh dari acar.
Tabel uji fisiologi dan biokimia bakteri asam laktat yang diiso1asi dari pike1 ketimun dan acar dapat dilihat pada "Lampiran 2 dan Lampiran 3. Identi-fikasi bakteri asam laktat di1akukan berdasarkan Harrigan dan Cance (1976). Hasil identifikasi isolat bakteri dari pikel ketimun menunjukkan bahwa
streptococcus dan Lactobacillus heterofermentatif mengawali proses fermentasi, diikuti dengan Lb.
plan-tarum, Lb. fermentum, dan Lactobacillus fermentatif, kemudian oleh Leuconostoc dan Lb. plantarum, sete1ah
fermentasi 12 hari didominasi oleh Lactobacillus heterofermentatif. Menurut Olympia et al. (1992), rangkaian pertumbuhan mikroba dalam proses fermentasi tidak selalu sama, tergantung pada jenis mikroba awal yang terdapat pada bahan mentah, persyaratan nutrisi, dan sensitifitas terhadap pH yang rendah. Selain itu
tergantung juga pada kondisi lingkungan tempat fermentasi, misalnya pH.
Dalam penelitian ini, Lb. plantarum merupakan bakteri yang mendominasi fermentasi pikel ketimun. Foto mikroskopik Lb. plantarum dapat dilihat pada Gambar 5. Lb. plantarum menurut Jay (1986) merupakan spesies bakteri asam'laktat yang paling penting dalam proses fermentasi pikel ketimun. Frazier dan Westhoff (1988) menyatakan bahwa dalam sebagian besar fermenta-si larutan garam, Lb. plantarum merupakan bakteri yang paling penting sebagai penghasil asam baik dalam la-rutan garam berkonsentrasi garam tinggi maupun rendah.
Lb. plantarum mencapai jumlah yang cukup besar bebera-pa hari setelah fermentasi dimulai.
Pediococcus merupakan bakteri asam laktat yang mengawali proses fermentasi acar. Foto mikroskopik
Pediococcus sp. yang diisolasi dari acar dapat dilihat pada Gambar 6. Menurut Olympia et al. (1992), bila
Pediococcus mengawali proses fermentasi maka Lacto-bacillus akan muncul kemudian. Bila Pediococcus
Gambar 5. Lactobacillus plantarum pi 402
tidak berperan dalam proses fermentasi, maka
Lactoba-cillus yang akan muncul pad a awal, selama, dan akhir proses fermentasi.
Pemilihan isolat bakteri asam laktat yang akan dikontakkan dengan bakteri penguJi berdasarkan atas perbedaan spesies. Dari spesies bakteri asam laktat yang sama dipilih bakteri asam laktat yang mempunyai perbedaan dalam sifat fisiologi dan biokimia dan khusus bagi bakteri asam laktat yang diisolasi dari pikel ketimun hanya dipilih isolat bakteri asam laktat
,
yang sudah teridentifikasi sampai nama spesies.B. SELEKSI BAKTERI ASAM.LAKTAT
Seleksi dilakukan berdasarkan kemampuan bakteri asam laktat dalam menghambat pertumbuhan bakteri perusak ikan (Alcaligenes sp. dan P. fluorescens) dan bakteri patogen (Escherichia coli, staphylococcus aureus, Salmonella typhimurium, Vibrio
parahaemolyti-cus, dan Listeria monocytogenes). Penghambatan per-tumbuhan bakteri penguji dapat diketahui dengan tidak tumbuhnya bakteri penguji di sekitar sumur tempat dispotnya kultur bakteri asam laktat, yang ditandai dengan terbentuknya areal bening (Gambar 7).
Tabel hasil pengukuran areal penghambatan dapat dilihat pada Lampiran 4. Gambar 8 menunjukkan bahwa
Gambar 7. Uji difusi sumur terhadap S. aureus K = kontrol dan kode 1 - 10 = isolat bakteri asam laktat
yang terbesar terhadap Alcaligenes sp .. Makin besar areal penghambatan menunjukkan makin terhambatnya pertumbuhan bakteri penguji. Lb. fermentum pi 403
ti-dak dapat menghambat pertumbuhan Alcaligenes sp ..
P. fluorescens paling terhambat pertumbuhannya
oleh Lb. plantarum pi 402, tetapi tidak terhambat oleh Lb. fermentum pi 403 (Gambar 9). Menurut Price dan Lee (1969), hidrogen peroksida yang diproduksi oleh 1aktobasilli dapat menghambat pertumbuhan P.
fluorescens . Tetapi dari Lampiran 6 diketahui bahwa akumulasi hidrogen peroksida dari Lb. plantarum pi 402 pad a 2 hari inkubasi bUkanlah yang tertinggi, ini
Areal penghambatan (mm) Isolat
ElLb.
piem#rum pi 402 DLb. 1er".,.ntum pi 403 alb. p/enfllfum pi 602 &1Lb. pltmtlJfUm pi 603DLb.
pilJmlJfUm pi 604 DLb. pllJmerum pi 605 {3JLb. pl:tnhuum pi 901 ~Lb. pllJmlJtum pi 902 [dPediococcus ClI 101 OPediococcus CD 104Gambar 8. Areal penghambatan Alcaligenes sp.
Areal penghambatan (mm) 2; ; 1 . o~"---~---Isoiat -, . '. OLb. ptantarum pi 402 [Z] Lb. fermentum pi 403 .Lb. plentarum pi 602 &J Lb. plontarum pi 603 OLb. piamarum pi 604
OJ
Lb. plantorum pi 605 8Lb. plantarum pi 901 L2l Lb. pfanfarum pi 902 tBPediococcus cn 101 [SPediococcus ca 104berarti penghambatan terhadap P. fluorescens tidak semata-mata disebabkan oleh hidrogen peroksida.
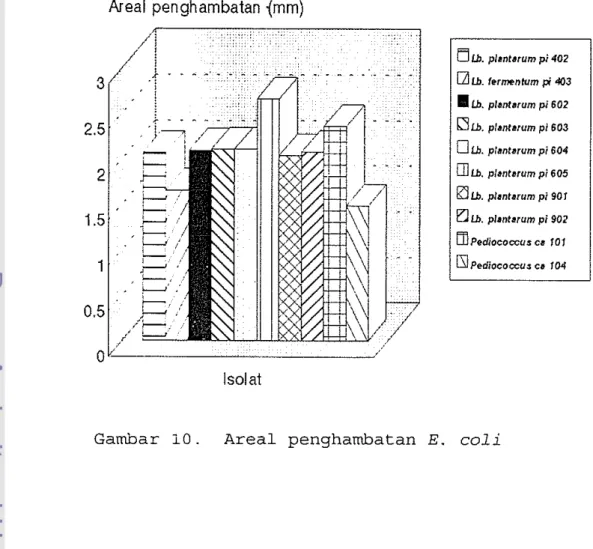
Lb. plantarum pi 605 bila dibandingkan dengan isolat yang lain mempunyai efek penghambatan yang tertinggi terhadap E. coli (Gambar· 10) . L. monocyto-genes paling terhambat pertumbuhannya oleh bakteri
Pe-diococcus ca 101. Lb. fermentum pi 403 tidak
dapat menghambat pertumbuhan L. monocytogenes (Gambar
11) . Menurut Garriga et al. (1993) Listeria
monocy-togenes dapat dihambat oleh bakteriosin yang dihasil-kan oleh laktobasilli dari produk fermentasi sosis.
3 2.5 1 1 Areal penghambatan {mm) Isolat D lb. pl.nt"um pi 402 [211.b. fftr~ntum pi 403 • Lb. plMtafam pi 602 b."jIb. pl.ntarum pi 603 OLb. planta,am pi 604 [ ] Lb. p/.nra,am pi 605 !{lib. pl.ntllrum pi 901 rJ Lb. pl.nt"am pi 902 l]Pedioeoccus ell 101
[SI Pediococcu$ ell 104
Areal penghamba!an (mm) Isola! OLb. pl"ntarum pi 402
o
Lb. fermemum pi 403 • Lb. pltmtorum pi S02rsJ
Lb. pillOtarum pi 603 DLb. p/"ntlJrum pi 604o
Lb. pllmhuum pi 605ca
Lb. pl.nterum pi 901 0Lb. pienta rum pi 902 Dpl'diococcus CD 101 [JPediococcus CD 104Gambar 11. Areal penghambatan L. monocytogenes
s.
typhimurium paling terhambat pertumbuhannya oleh Lb. plantarum pi 605 (Gambar 12) Menurut Jay(1986) S. typhimurium merupakan bakteri yang cukup tahan terhadap asaro, tetapi pada pH di bawah 4.0 pertumbuhan bakteri akan terganggu dan akan mati secara perlahan-lahan.
Dari Gambar 13 diketahui bahwa S. aureus paling terhambat pertumbuhannya oleh Lb. plantarum pi 402. Adanya kompetisi dengan mikroba lainnya yang tergolong
Lactobacillaceae di dalaro makanan merupakan salah satu sebab penting yang dapat menghambat pertumbuhan Sal-monella dan S. aureus (Fardiaz, 1989). Aktivitas penghambatan terhadap S. aureus oleh Lb. bulgaricus
dan Lb. lac tis disebabkan oleh hidrogen peroksida yang dihasilkan oleh laktobasili tersebut (Gilliland,
1985) .
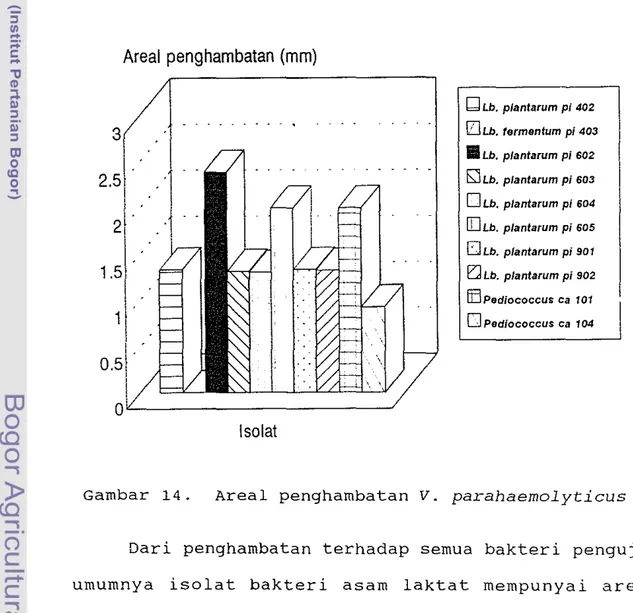
Lactobacillus fermentum pi 403 tidak dapat meng-hambat pertumbuhan v. parahaemolYticus. Pertumbuhan
v. parahaemolyticus paling terhambat oleh Lb.
planta-rum pi 602 (Gambar 14). V. parahaemolyticus merupakan bakteri yang tidak tahan terhadap asam (Pelczar dan Chan, 1988). 2. 1.5 1 0.5 Areal penghambatan (mm) Isolat
bI
Lb. plantarum pi 402 IZJ Lb. termontum pi 403 • Lb. plantarum pi 602EJ
Lb. plantarum pi 603D
Lb. plamarum pi 604 []Lb. plantarum pi 605 OLb. pJantarum pi 901 E::J Lb. plantarum pi 902 ff]PediococcUS ca 101D
Pod;ococcus ca 104Gambar 14. Areal penghambatan V. parahaemolyticus
Dari penghambatan terhadap semua bakteri penguji, umumnya isolat bakteri asam laktat mempunyai areal
penghambatan yang terbesar terhadap P. fluorescens. Diantara semua isolat bakteri asam laktat, Lb.
fermen-tum pi 403 tidak dapat menghambat banyak bakteri penguji. Sehingga untuk uji identifikasi senyawa an-timikroba bakteri asam laktat, Lb. fermentum pi 403 tidak disertakan lagi.
Dari Lampiran 4, 5, dan 6 diketahui bahwa peng-hambatan pertumbuhan bakteri penguji yang tertinggi tidak disebabkan oleh isolat bakteri asam laktat yang produksi asam organik dan hidrogen peroksida yang ter-besar. Hal ini berarti penghambatan terhadap pertum-buhan bakteri penguji tidak semata-mata disebabkan oleh pengaruh asam dan hidrogen peroksida yang dipro-duksi isolat bakteri asam laktat.
Isolat Lb. plantarum pi 402 dan Lb. plantarum pi 902 akan digunakan untuk uji selanjutnya, yaitu untuk mengetahui pengaruh bakteri asam laktat terhadap pertumbuhan bakteri perusak dalam media ekstrak ikan. Pemilihan kedua isolat itu berdasarkan kemampuannya dalam menghambat pertumbuhan bakteri perusak.
c.
IDENTIFlKASI SENYAWA ANTIMIKROBA~. Total Asam Tertitrasi
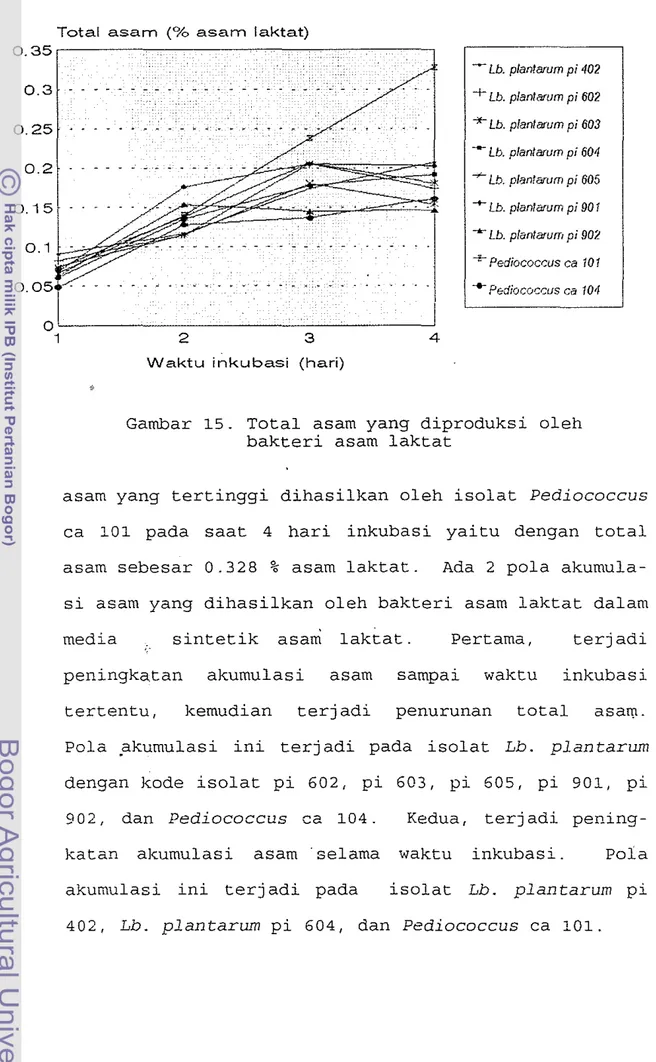
Total asam tertitrasi yang dihasilkan oleh isolat bakteri dapat dilihat pad a Lampiran 5 dan Gambar 15. Dari Gambar 15 terlihat bahwa akumulasi
Total asam (°/0 asarn laktat) 0.35.---~~~~--~~~----~~~__, 0.3 -~ Lb. plan/arum pi 402 + Lb. plantarum pi 602 ... Lb. plant arum pi 603 --- Lb. plant arum pi 604 0.25 . . . " " . . . " " " ' . 0.15 0.1 0.05 -+ Lb. plant arum pi 605 -+-Lb. plantarum pi 901 ... Lb. pfantafUrTt pi 902 + Pediococcus ca 101 ... P",diococcus ca 104 OL---~---~ 1 2 3 4
Waktu inkubasi (hari)
Gambar 15. Total asam yang diproduksi oleh bakteri asam laktat
asam yang tertinggi dihasilkan oleh isolat Pediococcus ca 101 pada saat 4 hari inkubasi yaitu dengan total asam sebesar 0.328 % asam laktat. Ada 2 pol a akumula-si asam yang dihaakumula-silkan oleh bakteri asam laktat dalam media sintetik asam 1aktat. Pertama, terjadi peningkatan akumulasi asam sampai waktu inkubasi tertentu, kemudian terjadi penurunan total asat(l. Pol a pkumulasi ini terjadi pada iso1at Lb. plantarum dengan kode isolat pi 602, pi 603, pi 605, pi 901, pi 902, dan Pediococcus ca 104. Kedua, terjadi pening-katan akumulasi asam' selama waktu inkubasi. Pola akumulasi ini terj adi pada isolat Lb. plantarum pi
Efek penghambatan oleh asam organik terutama tergantung pada jumlah asam tak terdisosiasi, karena asam terdisosiasi hanya memiliki efek penghambatan yang rendah. Asam tak terdisosiasi dapat berdifusi secara pasif ke dalam sel mikroba: Di dalam sel asam tak terdisosiasi akan memisah menjadi anion dan proton sesuai dengan pH internal. Hal ini menyebabkan terja-di gangguan terhadap fungsi metabolisme penting, seperti penghambatan transpor substrat, proses pro-duksi energi dan sintesa makromolekul, gangguan kemam-puan gerak proton,
(Ostling dan Lindgren,
dan 1993)
pengasaman sitoplasma Konsentrasi asam tak terdisosiasi dan a~am terdisosiasi tergantung pada nilai pKa (Lindgren dan Dobrogosz, 1990). Menurut Lazarova dan Peera(1994) , asam laktat akan terdisosia-si secara sempurna dalam larutan asam encer pada pH lebih besar dari nilai pKa, dimana nilai pKa sama dengan 3,858.
2. Hidrogen Peroksida
Akumulasi hidrogen peroksida dalam media air pep-ton 1% selama pertumbuhan isolat bakteri asam laktat dapat dilihat pada Lampiran 6 dan grafiknya dapat dilihat pada Gambar 16. Akumulasi hidrogen peroksida yang tertinggi terjadi pada saat inkubasi 3 hari pada isolat Lb. plantarum pi 901. Diantara isolat-isolat
Hidrogen Peroksida (J1g/ml)
35 ~-- - - - . - - - . .
-o
1 2 3 4 5Waktu inkubasi (hari)
-- Lb. ,o/antdfurn ,01 402 -lb. plantarum pi 602
*"
lb. plantarum pi 603 -- Lb. pfantarum pi 604"*
lb. plantarum pi 60; + lb. plan/arum pi 901 ... lb. plantarum pi 902 -I-Pedfococcus Cd 101 ... Pediococcus Cd 104Gambar 16. Hidrogen peroksida yang dihasilkan oleh bakteri asam laktat
tersebut terjadi perbedaan pola akumulasi hidrogen peroksida.
Akumulasi hidrogen peroksida yang dihasilkan oleh isolat bakteri asam laktat dalam media air pepton 1 % berkisar antara 7,92 - 31,03 Mg/ml. Dengan konsentrasi demikian hidrogen peroksida dapat bersifat bakteriostatik. Enam Mg/ml hidrogen peroksi-da bersifat bakteriostatik terhaperoksi-dap S. aureus peroksi-dan dengan konsentrasi antara 25 - 35 Mg/ml hidrogen peroksida bersifat bakterisidal (Dahiya dan Speck, 1967 ) Peningkatan konsentrasi hidrogen peroksida dari 2 Mg/ml ke 8 Mg/ml dapat memperpanjang fase
adaptasi P. fluorescens sp. dari 1 jam ke 7 jam. Peningkatan konsentrasi hidrogen peroksida dari 25
~g/ml ke 40 ~g/ml dapat memperpanjang fase adaptasi menjadi tidak terbatas (Price dan Lee, 1969).
Penurunan konsentrasi hidrogen peroksida dalam media air pepton 1 % dapat terjadi karena sifat hidro-gen peroksida itu sendiri. Hidrogen peroksida mempun-yai kecenderungan yang kuat untuk membebaskan oksigen, terurai menjadi air dan oksigen (Durrant 1960 dan Wood et al. ,1966). Peningkatan konsentrasi hidrogen peroksida terjadi apabila jumlah hidrogen peroksida yang diproduksi oleh bakteri asam laktat melebihi
jumlah hidrogen peroksida yang terurai.
Menurut Price dan Lee (1969), hidrogen peroksida merupakan metabolit yang dihasilkan oleh bakteri asam laktat selama masa pertumbuhan. Selain itu kemampuan bakteri untuk memproduksi hidrogen peroksida tergan-tung pada kandungan oksigen (Martin dan Gilliland, 1980) sehingga pr?duksi hidrogen peroksida akan menurun bila bakteri asam laktat memasuki fase kema-tian atau kandungan oksigen dalam substrat habis.
3. Prcduksi Bakteriosin
Produksi bakteriosin diuji dengan modifikasi uji difusi agar. Dari dua kali ulangan percobaan yang telah dilakukan, tidak didapatkan adanya aktivitas
antimikroba terhadap bakteri-bakteri penguji yang dipakai dalam percobaan ini. Terdapat dua alternatif penyebabnya. Pertama, isolat-isolat bakteri tidak memproduksi bakteriosin. Kedua, bakteoriosin yang dihasi1kan oleh iso1at bakteri asam laktat tidak me-miliki aktivitas penghambatan terhadap bakteri-bakteri penguji yang digunakan dalam penelitian ini. Marugg (1991) menyatakan bahwa bakteriosin mempunyai spektrum aktivitas antimikroba yang spesifik.
Menurut Lindgren dan Dobrogosz (1990), plantari-cin A, bakteriosin yang dihasilkan oleh ga1ur Lb. plantarum yang diisolasi dari fermentasi ketimun,
mempunyai spektrum aktivitas yang sempit dan antagonis terhadap kompetitor yang masih mempunyai hubungan kekerabatan dalam fermentasi sayuran. Pediosin A, bakteriosin yang dihasilkan oleh Pediococcus cerevi-siae ditemukan aktif menghambat pertumbuhan Clostridi-um botulinClostridi-um, C. sporogens,
s.
aureus, Lb. brevis, danL. monocytogenes.
Suatu bakteri meskipun sama spesies dan diiso1asi dari produk fermentasi yang sama, tetapi terdapat perbedaan kemampuan da1am memproduksi senyawa anti-mikroba. Seperti dalam pene1itian yang di1akukan oleh Jimenez-Diaz et al. (1993). Dari 26 galur Lb. plan-tarum yang diisolasi dari fermentasi buah zaitun,
penghambatan terhadap paling tidak pertumbuhan satu dari bakteri-bakteri penguji. Dan ada satu galur (Lb.
plantarum LPC010) yang mempunyai spektrum aktivitas yang paling 1uas diantara keempat galur tersebut dan akan digunakan untuk pengujian selanjutnya. Bakterio-sin yang dihasilkan oleh galur ini aktif terhadap beberapa bakteri gram positif, termasuk klostridia dan propionibakteria, juga terhadap kompetitor alami dalam fermentasi buah zaitun dalam larutan garam. Bakteriosin yang dihasilkan oleh Lb. plantarum LPC010 tidak mempunyai aktivitas antimikroba terhadap bakteri gram negatif (Alcaligenes sp., Escherichia coli, Klepsiella coli, Pseudomonas sp.), juga terhadap L. monocytogenes.
D. PENGARUH WAKTU KONTAK BAKTERI ASAM LAKTAT DENGAN
BAKTERI PERUSAK DALAM MEDIA EKSTRAK lKAN RUCAH
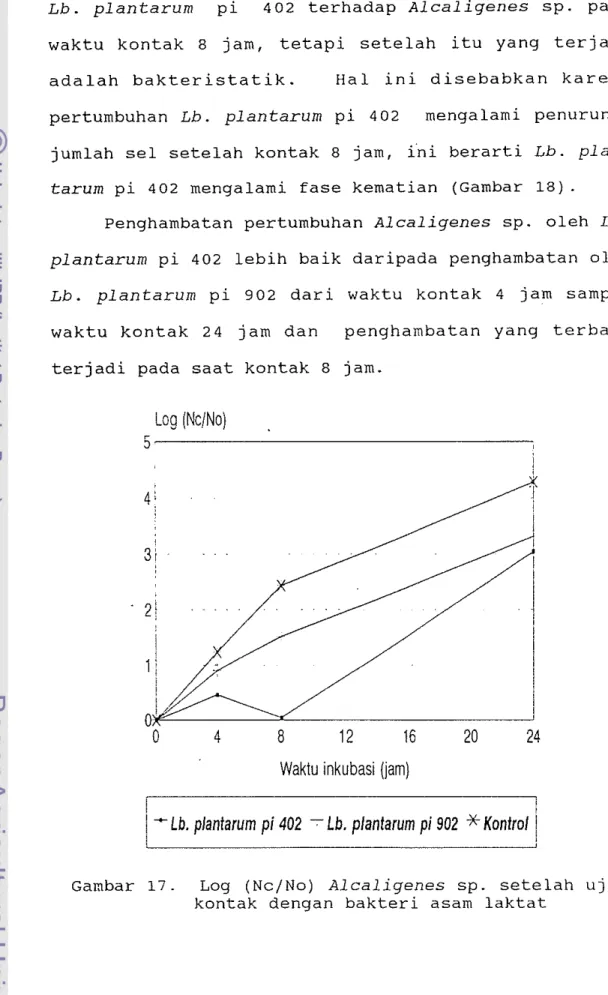
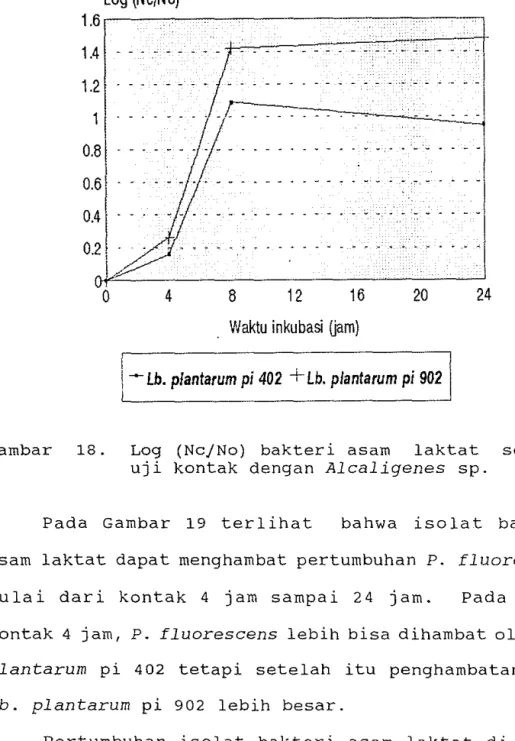
Pengaruh bakteri asam laktat terhadap pertumbuhan bakteri perusak dalam media ekstrak ikan dapat dilihat pada Lampiran 7. Seperti terlihat pada Gambar 17 terdapat penghambatan pertumbuhan Alcaligenes sp. dengan penambahan bakteri asam laktat bila dibanding dengan kontrol pad a media ekstrak ikan rucah pada suhu inkubasi 37°C. Penghambatan sudah terlihat pada waktu kontak 4 jam dan berlanjut sampai waktu kontak 24 jam. Gambar 17 menunjukkan adanya efek bakterisidal dari
Lb. plantarum pi 402 terhadap Alcaligenes sp. pada waktu kontak 8 jam, tetapi setelah itu yang terjadi adalah bakteristatik. Hal ini disebabkan karena pertumbuhan Lb. plantarum pi 402 mengalami penurunan jumlah sel setelah kontak 8 jam, fni berarti Lb.
plan-tarum pi 402 mengalami fase kematian (Gambar 18).
Penghambatan pertumbuhan Alcaligenes sp. oleh Lb.
plantarum pi 402 lebih baik daripada penghambatan oleh Lb. plantarum pi 902 dari waktu kontak 4 jam sampai
waktu kontak 24 jam dan penghambatan yang terbaik terjadi pada saat kontak 8 jam.
Log (Nc/No)
5---~4'
.~ 3i :21
Ol~---~L---~o
48
12
1620
24
Waktu inkubasi (jam)
I
:
i
~ Lb. plantarum pi 402 -;-Lb. plantarum pi 902*
Kontro/lI !
Gambar 17. Log (Nc/No) Alcaligenes sp. setelah uji kontak dengan bakteri asam laktat
Log (Nc,No) 1.6 ,----,--~~----~....,....,.-=-~--c-j 1.4 -, - - - - .. 1.2 0.81 0.6 -.-, -0.4
..
' -0.2 ; 0 4 8 12 16 20 24Waktu inkubasi (jam)
!
~ Lb. plantarum pi 402+
Lb. plantarum pi 902Gambar 18. Log (Nc/No) bakteri asam laktat setelah uji kontak dengan Alcaligenes sp.
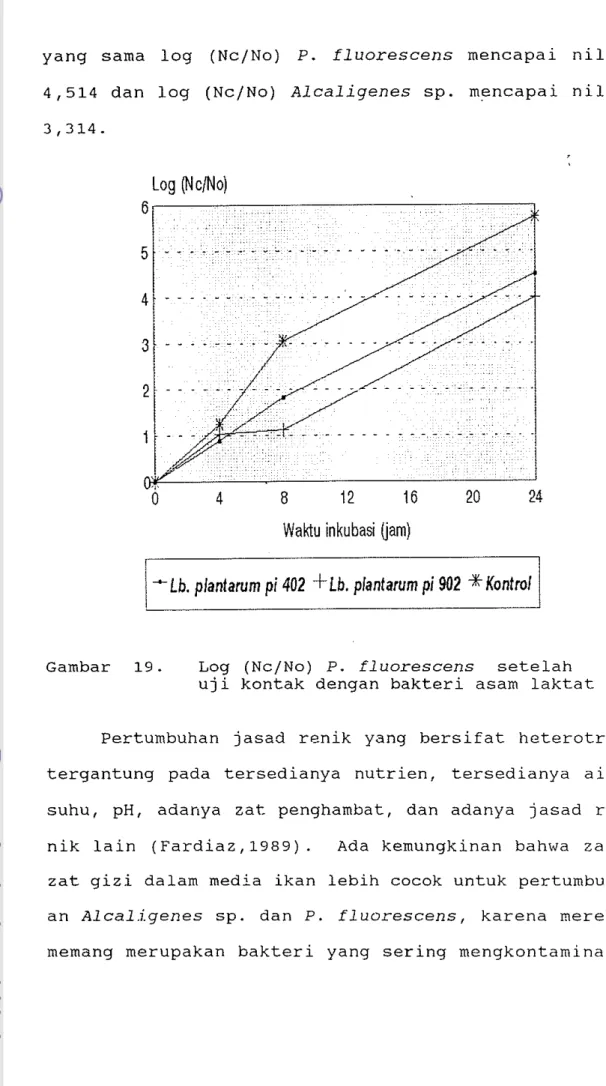
Pada Gambar 19 terlihat bahwa isolat bakteri asam laktat dapat menghambat pertumbuhan P. fluorescens
mulai dari kontak 4 jam sampai 24 jam. Pada waktu kontak 4 jam, P. fluorescens lebih bisa dihambat oleh Lb. plantarum pi 402 tetapi setelah itu penghambatan oleh Lb. plantarum pi 902 lebih besar.
Pertumbuhan isolat bakteri asam laktat di dalam media ekstrak ikan tidak sebagus pertumbuhan bakteri perusak. Pertumbuhan P. fluorescens lebih baik daripada pertumbuhan Alcaligenes sp .. Pada waktu kontak 24 jam, log (Nc/NO) bakteri asam laktat yang tertinggi mencapai nilai 2,368 sedangkan dalam keadaan
yang sarna log (Nc/No) P. fluorescens mencapal nilai 4,514 dan log (Nc/NO) Alcaligenes sp. mencapai nilai 3,314. Log
(N
ciNo) 6~--~~~---~--~ 5 - - .::. '.:.' .. - - .. - - .. - ... c .. ' •• -4 --. --. - \ . . - - . - . . ..,
. . I -I 4 8 12 1620
24Waklu inkubasi Uam)
I
I
~
Lb. plantarum pi
402
+
Lb.
plant arumpi
902
"*
Kontrol
,
Gambar 19. Log (Nc/No) P. fluorescens setelah uji kontak dengan bakteri asam laktat
Pertumbuhan jasad renik yang bersifat heterotrof tergantung pada tersedianya nutrien, tersedianya air, suhu, pH, adanya zat penghambat, dan adanya jasad re-nik lain (Fardiaz,1989). Ada kemungkinan bahwa zat-zat gizi dalam media ikan lebih cacak untuk pertumbuh-an Alcaligenes sp. dpertumbuh-an P. fluorescens, karen a mereka memang merupakan bakteri yang sering mengkantaminasi
ikan dan menyebabkan kerusakan pada ikan. Selain itu kebutuhan nutrisi Alcaligenes sp. dan P. f l uorescens
lebih sederhana. P. fluorescens dapat mensintesa faktor pertumbuhan dan vitamin. Sedangkan bakteri asam laktat bersifat sangat selektif terhadap substrat pertumbuhannya. Untuk pertumbuhan yang normal, bak-teri asam laktat membutuhkan sumber karbon dan nitro-gen, sebagian dalam bentuk asam amino, juga membutuh-kan beberapa vitamin, zat tumbuh dan mineral (Rahman, 1992) . Log (Nc/No) 2.5,-~~---.
.. -.-_
.. ----, --A
1 o .. / .. -,::. ::-::-//~
, - - ---- -
. . --/
- - - .. - - -4 8.;./
/ ' .. 12 16Waktu inkubasi (jam)
20 24
- - Lb. pfantarum pi 402 -t-Lb. pfantarum pi 902
Gambar 20. Log (Nc/No) bakteri asam laktat setelah uji kontak dengan P. fluorescens
Menurut Stanier et al. (1963) bakteri asam laktat membutuhkan faktor pertumbuhan yang sangat kompleks,
berbeda dengan pseudomonad dan bakteri koliform. Bakteri asam laktat pada umumnya hanya memperoleh sumber energi dari fermentasi gUla. Oleh sebab itu gula yang dapat difermentasi merupakan komponen nutri-si yang sangat penting bagi pertumbuhan bakteri asam
laktat secara aerobik maupun anaerobik. Umumnya bakteri asam laktat membutuhkan media pertumbuhan dengan kandungan glukosa sebanyak 1 - 5 %. Sedangkan kandungan karbohidrat dalam tubuh ikan berkisar antara 0,5-1,5 %.
Jumlah asam yang diproduksi oleh Lb. plantarum
pi 402 dan Lb. plantarum pi 902 dalam media ekstrak
ikan rucah selama uji kontak dapat dilihat pad a Gambar 21 untuk kontak dengan Alcaligenes sp. dan
Gambar 22 untuk kontak dengan P. fluorescens. Nilai pH media uji kontak berkisar antara 5,37 - 6,30 dengan keasaman berkisar antara 0,029 - 0,055 % asam laktat. Perubahan % asam laktat antara waktu kontak berkisar antara 0,003 - 0,009 %, sedangkan perubahan pH sebesar 0,25 - 0,064 satuan. Dengan rendahnya jumlah asam yang diproduksi oleh isolat bakteri asam laktat dalam media ekstrak ikan rucah dan nilai pH yang relatif tinggi, maka asam yang dihasilkan oleh Lb. plantarum
pi 402 dan Lb. plantarum pi 902 relatif tidak
berpen-garuh terhadap pertumbuhan Alcaligenes fluorescens.
% asam laktat nilai pH 0 . 0 6 , - - - 7 0.05 6 ' 5 0.04 ' 4 ' 3 0.02 ' 2 0.01 1 oL---~ 0 o 4 8 12 16 20 24 Waktu inkubasi (jam)
--- pH % asam laktat
~ Lb. planlarum pi 402
.... Lb.
planlarum
pi 902*
Konlrol
Gambar 21_ % asam laktat dan pH Alcaligenes sp. yang dikontakkan dengan isolat bakteri asam laktat dalam media ekstrak ikan rucah
0/0 asam laktat 0.05'1 ---~---~~ nilai pH
17
x- _-~- - - --~ i::-:-I . , -
>~~~~~~~~~~~~j
0.041 ~ ~- - - . " -::;:- - ~=.:.- '''':
~.- '1
6 -==
-
~ ~( ' 5 0.03~~~~~~~ - 4 . . 3 0.02 . . . 2 . 1 0 12 16 20 24 0.01[I
O~'---~ o 4 8Waktu inkubasi (jam)
--- pH % asam laktat
~ Lb. planlarum pi 402
... Lb. planlarum pi 902
-;(- Konlrol
Gambar 22. % asam laktat dan pH P. fluorescens yang dikontakkan dengan isolat bakteri asam laktat dalam media ekstrak ikan rucah
Rendahnya jumlah asam yang dihasilkan oleh isolat bakteri asam laktat dalam media ekstrak ikan rucah disebabkan oleh rendahnya kandungan karbohidrat pada ikan, sedangkan bakteri asam laktat membutuhkan karbo-hidrat untuk memproduksi asam. ,Pada media sintetik asam laktat produksi asam Lb. plantarum pi 402 dan Lb. plantarum pi 902 cukup tinggi berkisar antara
0,063 - 0,207 % asam laktat, hal ini disebabkan karena kandungan glukosa media sintetik asam yang cukup tinggi juga yaitu sebesar 50 gr/liter (5 %). walaupun produksi asam laktat dalam media ekstrak ikan rucah rendah, tetapi bisa menghambat pertumbuhan Alcaligenes
sp. dan P. fluorescens. Kondisi ini baik untuk penga-wetan produk-produk pangan non fermentasi. Karena
pada umumnya rasa asam tidak dikehendaki dalam pro-duk-produk pangan non fermentasi.
Penghambatan terhadap pertumbuhan Alcaligenes sp.
oleh Lb. plantarum pi 402 lebih baik bila dibandingkan
dengan penghambatan oleh Lb. plantarum pi 902.
Penghambatan ini terutama disebabkan oleh hidrogen peroksida yang diproduksi oleh Lb. plantarum pi 402.
Setelah inkubasi 1 hari Lb. plantarum pi 402
mempro-duksi hidrogen peroksida sebanyak 11,94 Mg/ml air pep ton 1 %, sedangkan Lb. plantarum pi 902 belum memproduksi hidrogen peroksida. Faktor penghambatan pertumbuhan P. fluorescens oleh Lb. plantarum pi 902
belum diketahui. Penghambatan terhadap P. fluorescBns oleh Lb. plantarum pi 902 telah terjadi pada kontak 4 jam, tetapi pada waktu kontak ini belum ada produksi hidrogen peroksida (Gambar 16) maupun asam (Gambar 22) .
Hidrogen peroksida merupakan senyawa aktif yang bersifat tidak stabil terhadap panas, dapat diinaktif-kan dengan penambahan katalase, dan dapat didialisis
(price & Lee, 1969). Efek bakterisidal hidrogen peroksida disebabkan oleh efek oksidasi yang kuat pada sel bakteri dan perusakan struktur molekul dasar dari sel protein (Lindgren & Dobrogosz, 1990).