DARI PATI BATANG SAWIT (Elaeis guineensis) MENGGUNAKAN PLASTICIZER
SORBITOL
SKRIPSI
WAKHIDAH ZAHARA HAYATI 130802041
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
PENGARUH PENAMBAHAN KITOSAN TERHADAP SIFAT TERMAL DAN GUGUS FUNGSI FILM BIOPOLIMER
DARI PATI BATANG SAWIT (Elaeis guineensis) MENGGUNAKAN PLASTICIZER
SORBITOL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
WAKHIDAH ZAHARA HAYATI 130802041
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
PENGESAHAN SKRIPSI
Judul : Pengaruh Penambahan Kitosan Terhadap Sifat Termal dan Gugus Fungsi Film Biopolimer dari Pati Batang Sawit (Elaeis guineensis) Menggunakan Plasticizer Sorbitol
Kategori : Skripsi
Nama : Wakhidah Zahara Hayati
Nomor Induk Mahasiswa : 130802041
Program Studi : Sarjana (S1) Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Sumatera Utara
Disetujui di
Medan, Desember 2017
Komisi Pembimbing
Pembimbing 2 Pembimbing 1
Dr. Amir Hamzah Siregar, M.Si Dr.Yugia Muis, M.Si
NIP. 196106141991031002 NIP. 195310271980032003
Ketua Program Studi
Dr. Cut Fatimah Zuhra, M.Si NIP. 197405051999032001
PERNYATAAN
PENGARUH PENAMBAHAN KITOSAN TERHADAP SIFAT TERMAL DAN GUGUS FUNGSI FILM BIOPOLIMER
DARI PATI BATANG SAWIT (Elaeis guineensis) MENGGUNAKAN PLASTICIZER
SORBITOL
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2017
WAKHIDAH ZAHARA HAYATI 130802041
PENGARUH PENAMBAHAN KITOSAN TERHADAP SIFAT TERMAL DAN GUGUS FUNGSI FILM BIOPOLIMER
DARI PATI BATANG SAWIT (Elaeis guineensis) MENGGUNAKAN PLASTICIZER
SORBITOL
ABSTRAK
Telah dilakukan penelitian pengaruh penambahan kitosan terhadap karakteristik sifat termal dan analisa gugus fungsi film biopolimer dari pati batang sawit. Film biopolimer dibuat dengan mencampurkan pati batang sawit (Elaeis guineensis) dan plasticizer sorbitol dengan variasi perbandingan 2:0,8 ; 2:1,0 ; 2:1,2 (g/ml), kemudian film dicetak diatas plat akrilik dan dikeringkan dengan oven pada suhu 40
oC selama 24 jam. Film dengan variasi terbaik kemudian ditambahkan dengan 2 gram kitosan. Hasil karakterisasi film biopolimer menunjukkan bahwa variasi terbaik pada perbandingan 2:0,8 (g/ml) dengan nilai % Swelling sebesar 133,59%.
Penambahan kitosan dapat meningkatkan ketahanan air sebesar 63,176%. Hasil uji ketahanan termal film juga cenderung meningkat, ditunjukkan dengan bertambahnya suhu endotermik dan eksotermik setelah adanya penambahan kitosan. Hasil uji Differential Scanning Calorimetry (DSC) menunjukkan terjadinya peningkatan suhu endotermik 115,75 oC dan suhu eksotermik 394,56 oC. Hasil uji Differential Thermal Analysis (DTA) menunjukkan adanya peningkatan suhu endotermik 150 oC dan suhu eksotermik 470 oC. Serta analisa gugus fungsi dengan Fourier Transform - Infra Red (FT-IR) menunjukkan bahwa pada film biopolimer hanya terjadi interaksi fisika saja, ditunjukkan dengan adanya pita serapan pada bilangan gelombang yang sama, yaitu OH/NH pada bilangan 3410,15 cm-1, CH pada bilangan 2924,09 cm-1, dan C-O/C-N pada bilangan 1026,13 cm-1 yang menunjukkan tidak terbentuknya gugus fungsi baru pada spektrum serapan film biopolimer.
Kata kunci : film biopolimer, karakterisasi, kitosan, pati batang sawit, sorbitol
THE EFFECT OF CHITOSAN ADDITION TOWARD OF THE THERMAL PROPERTIES AND FUNCTIONAL GROUP ANALYSIS
OF BIOPOLYMERS FILM OF OIL PALM TRUNK STARCH (Elaeis guineensis) USING
SORBITOL AS PLASTICIZER
ABSTRACT
The effect of chitosan addition toward of the thermal properties and functional group analysis of biopolymers film from oil palm trunk starch had been done. Biopolymers film made by mixing of oil palm trunk starch (Elaeis guineensis) and plasticizer sorbitol with the variation was 2:0,8 ; 2:1,0 ; 2:1,2 (g/ml), then the film was molded on acrylic plate and dried in an oven at 40 °C for 24 hours. The best variation film then was added by 2 grams of Chitosan. The results of the film characterization show that the best variation of biopolymers on comparison 2:0,8 (g/ml) with value of % Swelling was 133,59%. The Chitosan addition can increase of water resistance was 63,176%. The thermal properties of the film tended to rise indicated by increased of endothermic and exothermic temperature of biopolymers after of chitosan addition.
The results of Differential Scanning Calorimetry (DSC) showed increasing of the endothermic temperature was 115,75 oC and exothermic temperature was 394,56 oC.
The results of Differential Thermal Analysis (DTA) also showed an increased of the endothermic temperature was 150 °C and exothermic temperature was 470oC. As well as the Fourier Transform – Infra Red (FT-IR) result showed that in biopolymers film occurs physical interaction only, indicated by absorption band on the same wavelength, OH/NH at 3410,15 cm-1, CH at 2924,09 cm-1, and C-O/C-N at 1026,13 cm-1 indicated the non-formation of a new functional group on spectrum absorption of the biopolymers film.
Keywords : biopolymers film, characterization, chitosan. oil palm trunk starch, sorbitol
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Allah SWT. yang telah memberikan segala nikmat dan karunia-Nya, serta shalawat beriring salam kepada Nabi Besar Muhammad SAW. sehingga penulis dapat menyelesaikan penyusunan skripsi ini dengan judul Pengaruh Penambahan Kitosan terhadap Sifat Termal dan Gugus Fungsi Film Biopolimer dari Pati Batang Sawit (Elaeis guineensis) Menggunakan Plasticizer Sorbitol.
Terima kasih penulis sampaikan kepada Ibu Dr. Yugia Muis, M.Si selaku dosen pembimbing 1 dan Bapak Dr. Amir Hamzah Siregar, M.Si selaku dosen pembimbing 2 yang telah memberikan saran dan masukan kepada penulis selama penyusunan skripsi ini. Terima kasih juga kepada Ibu Dr. Cut Fatimah Zuhra, M.Si dan Ibu Dr. Sovia Lenny, M.Si selaku ketua program studi dan sekertaris program studi Kimia FMIPA-USU Medan, dekan dan wakil dekan FMIPA USU, seluruh staf dan dosen program studi kimia FMIPA USU yang telah memberikan ilmu, dan arahan yang baik selama masa kuliah. Terima kasih kepada teman-teman Kimia 2013 atas perhatian dan perjuangan bersama selama ini dan kepada sahabat terbaik yang telah memberikan doa, masukan dan semangat dalam menyelesaikan skripsi ini.
Akhirnya tidak terlupakan kepada kedua orang tua penulis Ayahanda Ansori dan Ibunda Khadijah, serta seluruh keluarga yang selama ini memberikan bantuan dan dorongan yang diperlukan. Semoga Allah SWT. akan membalasnya.
Medan, Desember 2017
WAKHIDAH ZAHARA HAYATI
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ii
ABSTRAK iii
ABSTRACT iv
PENGHARGAAN v
DAFTAR ISI vi
DAFTAR TABEL vii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
DAFTAR SINGKATAN x
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 4
1.5 Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1 Biopolimer 5
2.1.1 Film Biopolimer 6
2.1.2 Faktor-Faktor Pembentukan Film 7
2.1.3 Mekanisme Plastisasi 7
2.2 Kelapa Sawit 8
2.2.1 Pati Batang Kelapa Sawit 9
2.3 Kitosan 11
2.3.1 Karakteristik Kitosan 12
2.3.2 Kitosan pada Pembuatan Film 12
2.4 Plasticizer 13
2.4.1 Sorbitol sebagai Plasticizer 14
2.5 Karakteristik Film Biopolimer 15
2.5.1 Differential Thermal Analysis (DTA) 15 2.5.2 Differential Scanning Calorimetry (DSC) 16 2.5.3 Fourier Transform Infra-Red (FT-IR) 17
2.5.4 Uji Swelling 18
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 20
3.2 Alat dan Bahan 20
3.3 Isolasi Pati Batang Sawit 20
3.4 Pembuatan Larutan Asam Asetat 1% 21
3.5 Pembuatan Film Biopolimer dengan Penambahan
Sorbitol 21
3.6 Pembuatan Film Biopolimer dengan Penambahan
Sorbitol dan Kitosan 21
3.7 Karakterisasi Film Biopolimer 22
3.7.1 Analisa Fourier Transform Infra-Red (FT-IR) 22 3.7.2 Analisa Differential Scanning Calorimetry (DSC) 22 3.7.3 Analisa Differential Thermal Analysis (DTA) 22
3.7.4 Uji Swelling 23
3.8 Bagan Penelitian 24
3.8.1 Isolasi Pati Batang Kelapa Sawit 24
3.8.2 Pembuatan Film Biopolimer dengan Penambahan
Sorbitol 25
3.8.3 Pembuatan Film Biopolimer dengan Penambahan
Sorbitol dan Kitosan 26
3.8.4 Uji Swelling 26
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Analisa FT-IR Film Biopolimer Pati Batang 27 4.2 Hasil Analisa Differential Scanning Calorimetry (DSC)
Film Biopolimer Pati Batang Sawit 30
4.3 Hasil Analisa Differential Thermal Analysis (DTA)
Film Biopolimer Pati Batang 32
4.4 Pengukuran Derajat Mengembang (% Swelling) Film
Biopolimer Pati Batang Sawit 33
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 35
5.2 Saran 35
DAFTAR PUSTAKA 36
LAMPIRAN 40
DAFTAR TABEL
Nomor Tabel
Judul Halaman
2.1 Komposisi Batang Sawit (Elaeis guineensis) 9 4.1 Pita Serapan Gugus Fungsi Hasil Analisa Spektrum
FT-IR 29
4.2 Hasil Analisa DSC Film Biopolimer Pati Batang
Sawit 31
4.3 Hasil Analisa DTA Film Biopolimer Pati Batang
Sawit 33
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Kelapa Sawit (Elaeis guineensis) 8
2.2 Struktur Amilosa dan Amilopektin 10
2.3 Struktur Kitosan 12
2.4 Struktur Sorbitol 14
2.5 Termogram DSC atau DTA 16
2.6 Bagan Alat FT-IR 18
4.1 Hasil Analisa FT-IR Pati Batang Sawit; Film Biopolimer Pati Batang Sawit-Sorbitol 0,8 ml; Film Biopolimer Pati Batang Sawit-Sorbitol 0,8 ml-
Kitosan; dan Kitosan 28
4.2 Usulan Interaksi Hidrogen Antar Molekul Amilosa,
Amilopektin, dan Kitosan dalam Film Biopolimer 30 4.3 Grafik Hasil Analisa DSC Film Biopolimer Pati
Batang Sawit 31
4.4 Grafik Sifat Mengembang Film Biopolimer Pati
Batang Sawit 34
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Instrumentasi yang Digunakan dalam Penelitian 41
2. Proses Penelitian 42
3. Hasil Analisa Gugus Fungsi FT-IR 43
4. Data Hasil Pengujian DTA Film Biopolimer Pati
Batang Sawit-Sorbitol (0,8) ml 47
5. Data Hasil Pengujian DTA Film Biopolimer Pati
Batang Sawit-Sorbitol (0,8) ml-Kitosan 48 6. Data Hasil Pengujian DSC Film Biopolimer Pati
Batang Sawit-Sorbitol (0,8) ml 49
7. Data Hasil Pengujian DSC Film Biopolimer Pati
Batang Sawit-Sorbitol (0,8) ml-Kitosan 50 8. Perhitungan Nilai Sifat Mengembang (%
Swelling) Film Biopolimer Pati Batang Sawit 51 9. Gambar Proses Uji Sifat Mengembang (%
Swelling) dari Film Biopolimer Pati Batang Sawit 52
DAFTAR SINGKATAN
DTA = Differential Thermal Analysis DSC = Differential Scanning Calorimetry FT - IR = Fourier Transform - Infra Red
BAB I PENDAHULUAN
1.1 Latar Belakang
Plastik sintetis merupakan bahan yang sangat diperlukan bagi kehidupan manusia dan telah berkembang menjadi industri besar. Namun, polimer plastik tidak tahan terhadap panas dan dapat mencemari produk dengan migrasi komponen monomernya, sehingga berdampak terhadap keamanan dan kesehatan konsumen (Coniwanti, dkk., 2014). Sampah plastik bekas pakai tidak akan hancur meskipun telah ditimbun dalam waktu lama, sehingga mengakibatkan penumpukan sampah plastik yang dapat menyebabkan pencemaran dan kerusakan bagi lingkungan hidup.
Indonesian Solid Waste Association (InSWA) merilis data statistik sampah domestik Indonesia. Jenis sampah plastik menduduki peringkat kedua, yaitu sebesar 5,4 juta ton per tahun atau 14% dari total produksi sampah pada tahun 2014 (KLHK, 2016). Selain itu, Indonesia adalah negara kedua terbesar di dunia yang menyumbangkan sampah ke laut setelah Cina. Produksi sampah plastik yang ada di lautan Indonesia mencapai 187,2 juta ton/tahun (Jambeck et al., 2015). Untuk mengurangi terjadinya penimbunan sampah plastik maka dilakukan penelitian pembuatan film plastik ramah lingkungan dengan menggunakan bahan alami yang dapat diperbaharui (Coniwanti, dkk., 2014). Biopolimer, terutama yang berasal dari sumber daya organik terbarukan, telah dianggap sebagai sumber daya ramah lingkungan yang dapat menggantikan bahan plastik (Dehnad et al., 2014).
Penggunaan bahan berbasis biopolimer dapat mengatasi masalah pembuangan limbah dalam jumlah yang cukup besar (Tang et al., 2012).
Film biopolimer dapat dibuat dari berbagai variasi polisakarida, protein, lemak, dan komposit lainnya (Gennadious, 2002). Selain itu, film biopolimer dapat dibuat dari pati. Pati diperoleh dengan cara mengekstrak dari bagian beberapa tanaman seperti akar, umbi, batang dan biji-bijian. Pembuatan film berbasis pati pada dasarnya menggunakan prinsip gelatinasi (Cui, 2005).
Indonesia merupakan daerah yang cukup potensial sebagai penghasil pati seperti ubi kayu, sagu, jagung, ubi jalar dan lain sebagainya karena tanaman tersebut
tersebar di seluruh wilayah Indonesia. Disamping itu ada upaya baru untuk menghasilkan pati dari batang kelapa sawit. Areal perkebunan kelapa sawit Indonesia tumbuh dengan laju sekitar 11% per tahun, dari 1.126 juta ha pada tahun 1991 mencapai sekitar 3.584 juta ha pada tahun 2001 (Susila, 2003).
Limbah padat berupa batang atau kayu sawit dan pelepah kelapa sawit akan dihasilkan masing-masing sebesar 2.257.281 ton dan 514.480 ton per tahun, sedangkan pada kurun waktu tahun 2006–2010 ada kenaikan di dalam areal tanaman kelapa sawit yang diremajakan yaitu rata-rata setiap tahunnya seluas 89.965 ha. Hasil evaluasi sifat fisik dan kimia batang dan pelepah kelapa sawit menunjukkan bahwa kedua limbah tersebut dapat dimanfaatkan sebagai bahan baku industri berbasis serat seperti industri pulp dan kertas, industri pati, serta industri perkayuan. Pemanfaatan limbah-limbah padat ini tentunya akan memberikan keuntungan tambahan bagi perkebunan kelapa sawit (Guritno, 2003). Pada tahun 2013-2015, Kevin Kumala seorang pengusaha plastik dari Bali telah melakukan penelitian mengenai plastik dan berhasil membuat suatu produk plastik ramah lingkungan dari pati singkong yang dapat larut dalam air dan aman dikonsumsi.
Bagian pohon kelapa sawit yang memiliki kandungan yang tertinggi adalah pati dan gula yang terdapat pada bagian inti batang kelapa sawit yang dapat digunakan sebagai bahan baku pembuatan plastik (Hashim et al., 2011). Namun, pati kelapa sawit memiliki sifat yang kaku dan mudah rapuh. Matondang, dkk. (2013), telah meneliti dan membuat film plastik biodegradabel dari pati sagu kelapa sawit dengan menggunakan polipropylena tergrafting maleat anhidrida yang memenuhi persyaratan sebagai bahan kemasan.
Farhan et al. (2016), meneliti mengenai karakterisasi edible film kemasan berdasarkan cappa-carrageenan dengan plasticizer gliserol dan sorbitol, dimana diperoleh bahwa film yang dibuat dari pati menggunakan plasticizer sorbitol memiliki permukaan yang halus dengan penampilan yang baik, fleksibel, transparan, serta sifat mekanik yang baik dibandingkan dengan menggunakan bahan lain.
Menurut Coelho et al. (2017), film berbasis pati kitosan memiliki warna yang sedikit kuning, transparan, dan memiliki struktur yang lebih homogen.
Liu et al. (2014), telah meneliti mengenai sifat fisiokimia, mekanik dan termal film kitosan dengan dan tanpa menggunakan sorbitol, dimana diperoleh bahwa
3
penggunaan kitosan pada pembuatan film berbasis pati dapat meningkatkan ketahanan termal dari film dibandingkan dengan film yang menggunakan plasticizer sorbitol.
Berdasarkan permasalahan diatas, peneliti memanfaatkan pati batang sawit yang berpotensi sebagai bahan baku terbarukan dalam membuat film biopolimer sebagai upaya untuk mengurangi limbah batang kelapa sawit. Pada penelitian ini digunakan sorbitol sebagai plasticizer dan kitosan sebagai penguat dengan perbandingan konsentrasi tertentu agar dihasilkan film biopolimer yang kuat, tidak mudah rusak, dan lebih tahan panas. Serta diharapkan agar produk yang dihasilkan lebih mudah terurai dialam dalam jangka waktu yang lebih cepat dari plastik konversional agar produksi limbah plastik dapat berkurang di lingkungan masyarakat.
1.2 Permasalahan
1. Berapa variasi sorbitol yang paling optimum dalam pembuatan film biopolimer berbasis pati batang sawit.
2. Bagaimana karakteristik film biopolimer berbasis pati batang sawit-kitosan dengan plasticizer sorbitol yang dihasilkan dengan parameter yaitu, uji pengembangan (% Swelling), ketahanan termal dengan Differential Thermal Analysis (DTA) dan Differential Scanning Calorimetry (DSC), serta analisa gugus fungsi dengan Fourier Transform Infra-Red (FT-IR).
1.3 Tujuan Penelitian
1. Untuk mengetahui variasi sorbitol yang paling optimum dalam pembuatan film biopolimer berbasis pati batang kelapa sawit.
2. Untuk mengetahui karakteristik film biopolimer berbasis pati batang kelapa sawit-kitosan dengan plasticizer sorbitol yang dihasilkan dengan parameter yaitu, uji pengembangan (% Swelling), ketahanan termal dengan DTA dan DSC, serta analisa gugus fungsi dengan FT-IR.
1.4 Manfaat Penelitian
Penelitian ini diharapkan mampu memberikan informasi ilmiah tentang pemanfaatan limbah batang sawit yang dapat menghasilkan pati sebagai bahan pengisi (filler) dalam pembuatan film biopolimer dengan menggunakan sorbitol sebagai plasticizer. Selain itu penelitian ini diharapkan juga dapat menumbuhkan potensi sumber bahan plastik alternatif baru dalam mengurangi ketergantungan masyarakat untuk menggunakan plastik sintetis yang limbahnya dapat mencemari lingkungan dan sulit terurai.
1.5 Metodologi Penelitian
Penelitian ini dilakukan di laboratorium (experimental laboratory) melalui beberapa tahap, yaitu :
1. Tahap pertama yaitu, proses penyiapan empulur batang kelapa sawit yang kemudian diisolasi untuk mendapatkan patinya. Karakteristik yang digunakan yaitu analisa menggunakan FT-IR
2. Tahap kedua yaitu, proses pembuatan film biopolimer dari pati batang sawit dengan menggunakan sorbitol sebagai plasticizer
3. Tahap ketiga yaitu, proses pembuatan film biopolimer dari pati batang sawit dengan menggunakan sorbitol sebagai plasticizer dan adanya penambahan kitosan sebagai bahan penguat.
4. Tahap keempat yaitu, uji karakteristik film biopolimer yang meliputi uji pengembangan (% Swelling), ketahanan termal dengan DTA dan DSC, serta analisa gugus fungsi dengan FT-IR.
BAB 2
TINJAUAN PUSTAKA
2.1 Biopolimer
Polimer merupakan molekul besar yang terbentuk dari unit-unit berulang sederhana. Nama ini diturunkan dari bahasa Yunani Poly, yang berarti “banyak”, dan mer, yang berarti “bagian”. Makromolekul merupakan istilah yang sinonim dengan polimer (Stevens, 2001).
Polimer dibuat berasal dari sintetis, semisintetis, dan polimer yang tersedia di alam atau alami. Polimer alami atau disebut sebagai biopolimer adalah material polimer yang berasal dari alam. Biopolimer dapat digolongkan ke dalam dua jenis, yaitu:
1. Polimer yang diproduksi oleh sistem biologi seperti oleh hewan, tumbuhan, dan mikroorganisme
2. Polimer yang disintesis secara kimia tetapi merupakan turunan dari senyawa alami yang diproduksi oleh sistem biologi seperti gula dan asam amino.
Polimer alami salah satu contohnya adalah pati, yang merupakan bentuk polimer sebagai penyimpan energi. Pati termasuk dalam jenis polisakarida dan merupakan kopolimer yang tersusun atas dua jenis unit penyusun yang berbeda, yaitu amilosa dan amilopektin yang bisa dipisahkan menurut kelarutan (Plackett, 2011).
Polimer alami (biopolimer) mempunyai rantai yang pendek. Contohnya selulosa yang mempunyai derajat polimerisasi yang cukup besar diantara polimer alami lainnya hingga 15.000. Harga ini masih jauh dibandingkan harga derajat polimerisasi polimer sintesis seperti polietilen dengan berat molekul terendah 100.000 dan tertinggi 6.000.000 (Stevens, 2001). Kecilnya derajat polimerisasi mengindikasikan bahwa polimer alami mempunyai rantai yang pendek. Pendeknya rantai ikatan ini menjadikan kelemahan bagi polimer alami dalam hal ketahanan, namun menjadikan kelebihan dalam hal mampu terurai (degradabilitas), dimana semakin rendah berat molekul dan derajat polimerisasi, maka polimer akan semakin cepat terdegradasi (Pradipta, 2012).
2.1.1 Film biopolimer
Film merupakan lapisan tipis yang tersusun dari beberapa bahan polimer yang berpengaruh terhadap struktur film tersebut. Umumnya film terbuat dari polimer dengan penambahan matriks dan bahan aditif lainnya. Pembentukan film memerlukan paling sedikit satu komponen yang mampu membentuk struktur matriks yang saling berikatan (Rhim, 2013).
Film biopolimer merupakan suatu lapisan tipis yang terbuat dari bahan polimer alami yang dapat terurai di alam. Film biopolimer dapat dibuat dari berbagai variasi polisakarida, protein, lemak, dan komposit lainnya (Gennadious, 2002).
Selain itu film biopolimer dapat dibuat dari pati. Pembuatan film berbasis pati pada dasarnya menggunakan prinsip gelatinasi. Dengan adanya penambahan sejumlah air dan dipanaskan pada suhu yang tinggi maka akan terjadi gelatinasi. Gelatinasi mengakibatkan ikatan amilosa akan cenderung saling berdekatan karena adanya ikatan hidrogen. Proses pengeringan akan mengakibatkan penyusutan sebagai akibat lepasnya air sehingga gel akan membentuk film yang stabil (Cui, 2005).
Menurut Latief (2001), terdapat tiga kelompok biopolimer sebagai bahan dasar dalam pembuatan film kemasan, yaitu :
1. Polimer campuran dari biopolimer dengan polimer sintetik, biasanya dibuat dari pati dengan polimer sintetik dan bahan tambahan sehingga mempunyai daya biodegradabilitas rendah.
2. Polimer mikrobiologi poliester, biasanya dibuat dengan bantuan mikroba. Bahan kemasan ini dapat terdegradasi sempurna oleh mikroba, tetapi biaya produksinya mahal.
3. Polimer pertanian, diproduksi seluruhnya dari bahan pertanian sehingga dapat dimakan dan mudah rusak secara alami (ramah lingkungan). Kelompok polimer ini misalnya : selulosa, selulosa asetat, dan kitin. Biopolimer ini mudah dibentuk dan dicetak menjadi film kemasan dan tersedia sepanjang waktu.
Disamping itu kemasan biopolimer mempunyai keuntungan sebagai berikut : 1. Aman untuk dikonsumsi dan mudah rusak secara alami (ramah lingkungan).
2. Dapat diaplikasikan dengan cara dicelupkan, disemprotkan dan sebagai pembungkus.
7
3. Biopolimer bersifat antioksidan, antimikroba, dapat membentuk penghalang O2, CO2, uap air dan aroma yang dapat memperpanjang masa simpan makanan.
Dengan demikian, biopolimer mempunyai karakteristik dan keuntungan berbeda- beda sesuai dengan bahan dasarnya (Sentana, 2005).
2.1.2 Faktor-faktor pembentukan film
Menurut Anugrah (2015), terdapat beberapa faktor yang berpengaruh terhadap pembentukan film kemasan, yaitu:
a. Suhu
Perlakuan panas diperlukan untuk membentuk pati tergelatinisasi sehingga terbentuk pasta pati yang merupakan bentuk awal film. Suhu pemanasan pati akan menentukan sifat mekanik film yang terbentuk. Suhu pemanasan akan menentukan tingkat tergelatinasi yang terjadi yang pada akhirnya menentukan sifat fisik dari pasta yang terbentuk.
b. Konsentrasi pati
Konsentrasi pati memberikan kontribusi terhadap kadar amilosa dalam larutan pati sehingga berpengaruh terhadap sifat pasta yang dihasilkan.
c. Plasticizer dan bahan aditif lain
Konsentrasi plasticizer dan bahan aditif lain yang ditambahkan ke dalam formula film akan berpengaruh terhadap sifat film yang terbentuk, bahan-bahan tersebut akan berinteraksi dengan pati.
2.1.3 Mekanisme plastisasi
Interaksi antara polimer dengan pemlastis dipengaruhi oleh sifat afinitas kedua komponen, jika polimer pemlastis tidak terlalu kuat maka akan terjadi plastisasi antara struktur (molekul pemlastis hanya terdistribusi di antara struktur).
Plastisasi ini hanya mempengaruhi gerakan dan mobilitas struktur.
Jika terjadi interaksi polimer-polimer cukup kuat maka molekul pemlastis akan terdifusi ke dalam rantai polimer (rantai polimer amorf membentuk satuan struktur globular yang disebut bundle) menghasilkan plastisasi infrastuktur intra bundle. Dalam hal ini molekul pemlastis akan berada di antara rantai polimer dan
mempengaruhi mobilitas rantai yang dapat meningkatkan plastisasi sampai batas kompatibilitas yaitu sejumlah yang dapat terdispersi (terlarut) dalam polimer. Jika jumlah pemlastis melebihi batas ini, maka akan terjadi sistem yang heterogen dan plastisasi melebihi tidak efisien lagi, sehingga dihasilkan produk yang tidak sesuai atau kurang baik (Wirjosentono, 1995).
2.2 Kelapa sawit
Tanaman kelapa sawit (Elaeis guineensis) berasal dari Nigeria, Afrika Barat.
Pada kenyataannya tanaman kelapa sawit hidup subur di luar daerah asalnya, seperti Malaysia, Indonesia, Thailand, dan Papua Nugini. Kelapa sawit pertama kali diperkenalkan di Indonesia oleh pemerintah kolonial Belanda pada tahun 1848.
Tanaman kelapa sawit terdiri dari tiga bagian yaitu akar, batang, dan daun (Fauzi, dkk., 2002).
Gambar 2.1 Kelapa Sawit (Elaeis guineensis)
9
Kelapa sawit merupakan tanaman satu famili dengan pinang. Kelapa sawit memiliki taksonomi sebagai berikut :
Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Arecales Familia : Arecaceae Genus : Elaeis
Spesies : Elaeis guineensis Sumber : Mangoensoekarjo (2003)
Menurut hasil penelitian batang kelapa sawit terdiri dari beberapa komposisi penting penyusunnya yang diterangkan pada Tabel 2.1 berikut.
Tabel 2.1 Komposisi Batang Kelapa Sawit (Elaeis guineensis)
Penyusun Kadar (%)
Amilosa 23,42
Amilopektin 76,58
Protein 0,61
Lemak 0,45
Abu 1,07
Sumber : Salleh et al, ( 2015) 2.2.1 Pati batang kelapa sawit
Pati merupakan suatu senyawa karbohidrat kompleks dengan ikatan α- glikosidik. Pati dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa (sebagai produk fotosintesis) dalam jangka panjang (Wajira et al., 2009). Pati alami terdiri dari dua senyawa yang dapat dipisahkan, yaitu amilosa dan amilopektin.
Amilosa terdiri dari rantai panjang unit-unit glukosa yang tidak bercabang dan saling berikatan melalui ikatan α-(1,4), sedangkan amilopektin terdiri dari rantai glukosa yang bercabang pada ikatan α-(1,4) dan α-(1,6) (Moat et al., 2002). Struktur amilosa dan amilopektin dapat dilihat pada Gambar 2.2 berikut.
α-1,4 glikosidik
α-1,6 glikosidik
α-1,4 glikosidik
(1)
(2)
Gambar 2.2 Struktur Amilosa (1) dan Amilopektin (2) (Winarno, 1992)
Pati merupakan salah satu polimer alami dari ekstraksi tanaman yang digunakan untuk memproduksi material biodegradabel kerena sifatnya yang ramah lingkungan, mudah terdegradasi, ketersediaan yang besar dan terjangkau (Yihu, 2008). Pranamuda (2001), menyebutkan dalam penelitiannya, semakin besar kandungan pati, maka akan semakin tinggi biodegradabilitasnya.
Namun, pati memiliki beberapa kekurangan seperti sifat hidrofiliknya yang besar dan sifat mekanis yang lebih buruk jika dibandingkan dengan polimer sintetis.
Pati juga sebagian besar larut dalam air dan tidak dapat diproses melalui proses melting karena akan lebih dulu terdekomposisi sebelum mengalami proses gelatinisasi. Untuk meningkatkan kekuatan mekanis pada pati, sejumlah kecil pengisi berupa bahan anorganik biasanya ditambahkan ke dalam matriks polimer (Wang, 2008).
11
Batang kelapa sawit berfungsi sebagai penyangga tajuk serta menyimpan dan mengangkut bahan makanan. Batang kelapa sawit berbentuk silinder dengan diameter 20-75 cm. Pertambahan tinggi batang terlihat jelas setelah tanaman berumur 4 tahun (Fauzi, dkk., 2002). Batang kelapa sawit tersusun atas beberapa karakteristik kimia, yaitu selulosa, lignin, pentosa, abu, dan silika (Lubis, 2009).
Batang kelapa sawit memiliki kandungan pati yang cukup tinggi. Batang kelapa sawit terdiri atas jaringan ikatan pembuluh dan parenkim (Afandy, 2007).
Kadar air pada batang kelapa sawit cenderung turun dari atas batang ke bawah dan dari empulur ke tepi (Bakar, 2003).
2.3 Kitosan
Kitosan atau (1-4)-2-amina-2-deoksi-ß-D-glukan, merupakan polimer alami yang berasal dari deasetilasi kitin dengan menggunakan alkali (Wanjun et al., 2005).
Kitosan sebagai polimer alami dapat dihasilkan dari hewan berkulit keras terutama dari laut seperti udang, rajungan, kepiting, cumi-cumi dengan kadar kitosan antara 10-15%. Selain dari kulit hewan laut, kitosan juga dapat diperoleh dari dinding sel jamur antara lain Aspergillus niger (Handayani, 2010).
Sumber kitosan yang paling banyak adalah berasal dari cangkang udang.
Kitin dan kitosan memiliki banyak manfaat dalam berbagai bidang, salah satunya adalah sebagai adsorben logam berat. Kemampuan kitin dan kitosan dalam mengadsorpsi logam berat dipengaruhi oleh jumlah gugus –NH yang ditunjukkan oleh derajat deasetilasi. Perbedaan kitin dan kitosan terletak pada perbandingan gugus amina (-NH2) dengan gugus asetil (-OCH3) yang disebut derajat deasetilasi (Basuki, 2009). Menurut Thate (2004), dalam disertasinya disebutkan bahwa kitosan memiliki derajat deasetilasi lebih dari 70%, sedangkan kitin memiliki derajat deasetilasi kurang dari 70%. Menurut keterangan tersebut, kitin dapat disintesis menjadi kitosan dengan cara mengganti gugus asetil menjadi gugus amina (proses deasetilasi).
Kitosan dapat disintesis menjadi kitosan bead yang tidak larut dalam asam sehingga dapat dimanfaatkan lebih luas. Adanya asam lemah encer dalam matriks kitosan bead menyebabkan gugus –NH2 kitosan bead memiliki afinitas lebih tinggi dibanding kitosan. Afinitas yang dimiliki kitosan bead menyebabkan meningkatnya
kemampuan kitosan bead dalam mengadsorpsi logam berat. Kemampuan adsorpsi kitosan bead dapat ditingkatkan dengan mengikat silangkan kitosan bead dengan glutaraldehid (Basuki, 2009). Struktur kitosan dapat dilihat pada Gambar 2.3 berikut.
Gambar 2.3 Struktur Kitosan (Thate, 2004)
2.3.1 Karakteristik kitosan
Kitosan mempunyai karakteristik fisik, biologi dan kimiawi yang baik diantaranya dapat didegradasi, dapat diperbaharui, dan tidak toksik (Handayani, 2010). Karakteristik fisiko-kimia kitosan berwarna putih dan berbentuk kristal, dapat larut dalam larutan asam organik seperti asam asetat, tetapi tidak larut dalam pelarut organik lainnya. Dalam hal lain, sifat fisika-kimia larutan kitosan (pH, kerapatan, tegangan permukaan, viskositas, dan konduktifitasnya), dipengaruhi oleh berat molekul kitosan terlarut (Khan et al., 2011).
Berat molekul rata-rata rantai kitosan adalah antara 70.000–2.000.000, dan bila ukuran rantai polimer kitosan bertambah kecil, laju gerakan translasinya menjadi semakin cepat, sehingga viskositas larutannya bertambah rendah (Fernandez et al., 2004). Hal ini juga dapat berakibat pada kenaikan laju interaksi rantai molekul kitosan dengan molekul-molekul pereaksi lainnya, seperti asam lemak bebas (Seung, 2006). Sifat menonjol kitosan adalah kemampuan mengabsorpsi lemak hingga 4-5 kali beratnya (Arisman, 2004).
2.3.2 Kitosan pada pembuatan film
Kitosan banyak dipilih sebagai bahan baku pembuatan film. Kitosan dipilih berdasarkan pertimbangan bahwa ketersediaan limbah udang cukup banyak dan mudah diperoleh. Berdasarkan data Badan Pusat Statistik tahun 2004 potensi udang diperkirakan sebesar 785 ton, dari jumlah tersebut, 60-70% menjadi limbah yaitu bagian kulit dan kepala (Handayani, 2010).
13
Kitosan memiliki sifat hidrofobik sehingga dapat mengurangi sifat hidrofilik bioplastik plasticizer, seperti sorbitol adalah molekul dengan berat molekul dan volatilitas rendah yang dapat mengurangi ikatan intermolekuler antara rantai-rantai polimer. Penambahan plasticizer pada campuran film biodegradabel dibutuhkan untuk mengatasi kerapuhan film yang disebabkan oleh ikatan intermolekuler yang tinggi. Kitosan merupakan biopolimer yang banyak digunakan karena bersifat biocompatible dan mempunyai efek antithrombogenik dan antimikroba. Kitosan dapat dicetak membentuk film sebagai aplikasi dari kemasan (Smith, 2005).
Selain itu kitosan sering dipertimbangkan menjadi pengawet coating ideal untuk buah segar karena daya pembentukan filmnya yang bagus dan komposisi biokimianya (El-Ghaouth et al., 2000). Ada dua jenis pelarut asam yang digunakan untuk melarutkan kitosan yaitu asam asetat dan asam laktat. Pelarut terbaik yang digunakan dalam proses pembuatan membran polimer berbahan dasar kitosan adalah pelarut asam asetat (Aryanto, 2002).
2.4 Plasticizer
Menurut Gennadious (2002), pemlastis adalah bahan yang ditambahkan dengan maksud meningkatkan elastisitas. Pemlastis didefinisikan sebagai substansi non-volatil yang mempunyai titik didih tinggi, yang jika ditambahkan ke senyawa lain akan mengubah sifat fisik dan mekanik senyawa tersebut.
Secara umum pemlastis meningkatkan permeabilitas film terhadap gas, uap air, dan zat-zat terlarut, juga dapat meningkatkan elastisitas dan daya kohesi film, meningkatkan daya rentang, dan menghaluskan film. Pemlastis dapat mempengaruhi efisiensi dalam mengelastiskan, termasuk ukuran dan bentuk dari molekul pemlastis, jumlah atom oksigen, jarak struktur molekul dari pemlastis, dan daya ikat airnya.
Disamping efek ikatan hidrogennya, gaya tolak antar molekul sesamanya atau antara polimer polar atau non-polarnya dapat meningkatkan jarak antar molekulnya (Sothomvit et al., 2001).
2.4.1 Sorbitol sebagai plasticizer
Sorbitol yang biasa dikenal sebagai glusitol adalah gula yang metabolismenya lambat dalam tubuh. Sorbitol dihasilkan oleh reduksi glukosa dengan penggantian gugus aldehid dengan gugus hidroksil. Sorbitol memiliki rumus kimia C6H14O6. Sorbitol memiliki titik leleh 95 0C, titik didih 296 0C, massa molekul sebesar 182,17 g.mol-1, densitas sebesar 0,68 g.cm-3 (Perry et al., 1999). Struktur sorbitol dapat dilihat pada Gambar 2.4 berikut.
Gambar 2.4 Struktur Sorbitol (Perry et al., 1999)
Gliserol dan sorbitol banyak digunakan sebagai plasticizer karena stabilitas dan tidak beracun. Penambahan pemlastis dapat meningkatkan fleksibilitas dan permeabilitas terhadap uap air dan gas (Vieira et al., 2011). Gliserol dan sorbitol merupakan plasticizer untuk mengurangi kerapuhan, meningkatkan fleksibilitas dan ketahanan film terutama jika disimpan pada suhu rendah. Mchugh (1994), menyatakan bahwa poliol seperti sorbitol dan gliserol adalah plasticizer berfungsi mengurangi ikatan hidrogen internal sehingga akan meningkatkan jarak intermolekul. Penggunaan sorbitol sebagai plasticizer diketahui lebih efektif, sehingga dihasilkan film dengan permeabilitas oksigen yang lebih rendah bila dibandingkan dengan menggunakan gliserol.
Widyaningsih, dkk. (2012), menunjukkan persentase strain atau elongation (kuat pemanjangan) terbesar pada film biopolimer berbahan dasar pati dari kulit pisang pada berbagai variasi komposisi yaitu pada perlakuan penambahan 0,4%
kalsium karbonat dan 40% sorbitol. Penambahan sorbitol berbanding lurus dengan persentase strain atau elongation, artinya semakin besar penambahan sorbitol maka semakin besar nilai persentase strain atau elongation (Sanyang et al., 2015).
15
2.5 Karakterisasi film biopolimer
Berikut ini adalah beberapa karakterisasi yang dapat dilakukan untuk menguji produk film biopolimer yang dihasilkan, yaitu :
2.5.1 Differential Thermal Analysis (DTA)
Thermal analysis merupakan teknik untuk mengkarakterisasi sifat material yang dipelajari berdasarkan respon material tersebut terhadap temperatur. Untuk menentukan sifat termo-fisiknya metode yang biasa digunakan salah satunya adalah Differential Thermal Analysis (DTA). Differential Thermal Analysis adalah analisis termal yang menggunakan referensi sebagai acuan perbandingan hasilnya, material referensi ini biasanya material inert. Sampel dan material referensi dipanaskan secara bersamaan dalam satu tungku. Perbedaan temperatur sampel dengan temperatur material referensi direkam selama siklus pemanasan dan pendinginan (Grega et al., 2009). Komponen peralatan utama DTA terdiri atas sampel, tungku yang dilengkapi dengan termokopel, sistem pengendali aliran, sistem penguat sinyal, sampel pembanding, pengendali program tenaga tungku, dan perekam (Khopkar, 2007).
DTA melibatkan pemanasan atau pendinginan dari sampel pengujian dan sampel referensi dibawah kondisi yang identik saat dilakukan perekaman dalam berbagai perbedaan temperatur antara sampel dan referensi. Perbedaan temperatur ini lalu di plot berdasarkan waktu atau temperatur. Differential temperatur juga dapat meningkat diantara dua sampel inert saat respon mereka ke perlakuan panas yang diberikan tidak identik. DTA digunakan untuk studi sifat termal dan perubahan fasa.
Hasil pengujian DTA ini merupakan kurva yang menunjukkan diskontinuitas pada temperatur transisi dan kemiringan kurva pada titik tertentu akan tergantung pada mikrostruktur sampel pada temperatur tersebut. Kurva DTA secara garis besar adalah kurva perbedaan temperatur antara material sampel dengan material referensi (Bhadeshia, 2002). Kemudian data dari kurva tersebut di plot sebagai perbedaan terperatur (∆T) antara keduanya (Stevens, 2001).
Kurva DTA dapat digunakan sebagai finger print untuk tujuan identifikasi.
Area dibawah peak kurva DTA dapat diidentifikasi sebagai perubahan entalpi dan tidak dipengaruhi oleh kapasitas panas sampel (Bhadeshia, 2002).
2.5.2 Differential Scanning Calorimetry (DSC)
Differential Scanning Calorimetry (DSC) merupakan suatu teknik analisa termal yang digunakan untuk mengukur energi yang diperlukan untuk membuat perbedaan temperatur antara sampel dan pembanding mendekati nol, yang dianalisa pada daerah suhu yang sama, dalam lingkungan panas atau dingin dengan kecepatan yang teratur. Hal ini memungkinkan untuk mendeteksi dalam bentuk lelehan, transisi kaca, perubahan fasa dan pemanasan. DSC biasanya digunakan dalam bidang industri, farmasi, polimer, makanan, kertas, pencetakan, sektor manufaktur, pertanian dan elektronik. Keuntungan terbesar dari DSC adalah kecepatan dan kemudahan dalam melihat transisi dari material (Perkinelmer, 2013).
Terdapat perbedaan yang signifikan antara DSC dan DTA terutama dalam instrumentasinya. Pada DTA, sampel dan referensi keduanya dipanaskan oleh sumber pemanasan yang sama, dan dicatat perbedaan temperatur (∆T) antara keduanya. Ketika terjadi suatu transisi dalam sampel tersebut, temperatur sampel akan tertinggal dibelakang temperatur referensi jika transisi tersebut endotermik, dan akan mendahului jika transisi tersebut eksotermik. Sedangkan pada DSC, sampel dan referensi diberikan dengan pemanasnya masing-masing, dan energi disuplai untuk menjaga suhu-suhu sampel dan referensi tetap konstan. Kemudian data diplot sebagai
∆T (untuk DTA) atau d∆Q/dt (untuk DSC). Plot- plot demikian disebut termogram.
Termogram-termogram DSC dan DTA memiliki bentuk yang sama. Keuntungan utama DSC adalah bahwa area-area peak termogram berkaitan langsung dengan perubahan entalpi dalam sampel, oleh sebab itu dapat digunakan untuk pengukuran kapasitas panas, entalpi reaksi, dan lainnya (Stevens, 2001). Termogram DSC atau DTA dapat dilihat pada Gambar 2.5 berikut.
𝑑∆𝑄
𝑑𝑡 ∆T
(DSC) (DTA)
Gambar 2.5 Termogram DSC atau DTA (Stevens, 2001)
17
2.5.3 Fourier Transform Infra-Red Spectroscopy (FT-IR)
Spektroskopi infra merah adalah salah satu teknik analisis yang paling penting. Spektroskopi FT-IR (Fourier Transform Infra-Red) merupakan salah satu instrumen yang menggunakan prinsip spektroskopi inframerah yang dilengkapi dengan transformasi fourier untuk mendeteksi dan analisis hasil spektrumnya.
Spektroskopi FT-IR adalah suatu alat yang digunakan untuk menganalisis frekuensi dalam sinyal gabungan (Anam, 2007).
Spektroskopi infra merah menggunakan Hukum Lambert Beer untuk spektroskopi absorpsi. Jika suatu berkas sinar melewati suatu medium homogen, sebagian dari cahaya datang diabsorpsi, sebagian dapat diabaikan dipantulkan, sedangkan sisanya ditransmisikan (Khopkar, 2007).
Salah satu keuntungan terbesar dari spektroskopi inframerah adalah bahwa hampir semua sampel dapat dianalisis. Misalnya cairan, padatan, pasta, bubuk, film, serat, gas, dan permukaan suatu zat dapat diperiksa dengan teknik sampling yang sesuai (Salih, 2012). Selain itu, spektroskopi inframerah berguna untuk identifikasi senyawa organik karena spektrumnya yang sangat kompleks yang terdiri dari banyak puncak-puncak. Masing-masing kelompok fungsional menyerap sinar inframerah pada frekuensi tertentu. Spektrum inframerah tersebut dihasilkan dari pentransmisian cahaya yang melewati sampel, pengukuran intensitas cahaya dengan detektor dan dibandingkan dengan intensitas tanpa sampel sebagai fungsi panjang gelombang.
Spektrum inframerah yang diperoleh kemudian diplot sebagai intensitas fungsi energi, panjang gelombang (μm) atau bilangan gelombang (cm-1). Spektroskopi ini merupakan suatu metode yang dapat mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0,75–1.000 μm atau pada panjang gelombang 13.000–10 cm-1 (Anam, 2007). Dengan menggunakan FT- IR kita dapat mengetahui terjadinya interaksi antar molekul dalam suatu sampel berdasarkan perubahan gugus fungsi yang ditunjukkan. Analisis menggunakan FT-IR dapat digunakan untuk mengetahui sifat termal bahan dari suatu lapisan tipis. FT-IR digunakan untuk melakukan analisa kualitatif yaitu untuk mengetahui ikatan kimia yang dapat ditentukan dari spektra vibrasi yang dihasilkan oleh suatu senyawa pada panjang gelombang tertentu. Selain itu digunakan juga untuk analisa kuantitatif yaitu
melakukan perhitungan tertentu dengan menggunakan intensitas panjang gelombang tertentu (Salih, 2012).
Spektroskopi IR juga digunakan untuk penentuan struktur, khususnya untuk senyawa organik dan juga untuk analisis kuantitatif, seperti analisis kuantitatif untuk pencemaran udara. Spektrum infra merah memberikan puncak-puncak maksimal yang jelas sebaik puncak minimumnya. Spektrum absorpsi dibuat dengan bilangan gelombang pada sumbu X dan persentase transmitan (T) pada sumbu Y (Khopkar, 2007). Bagan alat spektroskopi infra merah ditunjukkan pada Gambar 2.6 berikut.
Gambar 2.6 Bagan Alat FT-IR (Fessenden dan Fessenden, 1982)
Pada ujung kiri tampak sumber cahaya yang memancarkan cahaya infra merah pada semua panjang gelombang. Cahaya dari sumber ini dipecah oleh cermin menjadi dua berkas cahaya, berkas rujukan (referensi) dan berkas contoh. Setelah masing-masing melewati sel rujukan dan sel contoh, kedua berkas ini digabung kembali dalam pemenggal (chopper; suatu sistem cermin lain), menjadi satu berkas yang berasal dari kedua berkas itu, yang selang-seling bergantian. Berkas selang- seling ini didifraksi oleh suatu kisi sehingga berkas itu terpecah menurut panjang gelombang. Detektor mengukur beda intensitas antara kedua macam berkas pada setiap panjang gelombang dan meneruskan informasi ini ke perekam, yang akan menghasilkan spektrum (Fessenden dan Fessenden, 1982). Ketebalan film untuk pengukuran berkisar antara 0,01-0,05 mm. Ketebalan film juga dapat bervariasi dari 0,002 sampai 3 mm (Khopkar, 2007).
2.5.4 Uji Swelling
Uji pengembangan (% Swelling) merupakan salah satu uji yang digunakan untuk mengetahui tingkat penyerapan dari suatu material polimer terhadap larutan atau cairan. Analisa ini dilakukan untuk mengetahui terjadinya ikatan dalam polimer serta tingkatan atau keteraturan ikatan dalam polimer yang ditentukan melalui
19
persentase penambahan berat polimer setelah terjadinya penyerapan air (Coniwanti, dkk., 2014).
Persentase Swelling dapat dihitung dengan menggunakan persamaan berikut ini : Persentase Swelling (%) = 𝑊𝑎𝑘 ℎ 𝑖𝑟 − 𝑊𝑎𝑤𝑎𝑙
𝑊𝑎𝑤𝑎𝑙 (2.1)
Keterangan: Wakhir = berat sampel setelah direndam Wawal = berat sampel sebelum direndam
3.1 Waktu dan Tempat
Penelitian dilakukan pada bulan Maret sampai bulan September 2017. Isolasi pati batang kelapa sawit dan pembuatan film biopolimer dilakukan di Laboratorium Kimia Polimer Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Analisa gugus fungsi dengan FT-IR dilakukan di Laboratorium Kimia Organik Fakultas Matematika dan Ilmu Pengetahun Alam Universitas Gajah Mada. Uji sifat termal dengan DSC dan DTA dilakukan di Laboratorium Mikroskop Elektron Politeknik Kimia Industri, Medan Sumatera Utara.
3.2 Alat dan Bahan
Adapun alat yang digunakan selama proses penelitian yaitu, seperangkat alat gelas yang terdiri dari gelas beaker, gelas ukur, dan labu takar (Pyrex), neraca analitis (Radwag), oven (Memmert), termometer (France), hot plate (Gallenkamp), pipet tetes, kertas saring, magnetic stirrer, ayakan 100 mess, dan blender (National).
Untuk karakterisasi menggunakan seperangkat alat FT-IR (Shimadzu), seperangkat alat DSC (DSC-60 Plus), seperangkat alat DTA (Shimadzu).
Bahan yang digunakan selama proses penelitian terdiri dari pati batang sawit yang diperoleh dari perkebunan kepala sawit milik masyarakat di daerah Tambak Bayan, Kecamatan Percut Sei Tuan, Medan Sumatera Utara, sorbitol komersil sebagai plasticizer, kitosan komersil (Merck) sebagai bahan penguat, asam asetat glacial (Merck), dan aquadest.
3.3 Isolasi Pati Batang Sawit (Matondang, dkk., 2013)
Batang sawit yang digunakan telah berumur 25 tahun lebih. Batang sawit diambil pada bagian 1-2 meter dari pucuk, diambil bagian empulur dalamnya lalu dicuci hingga bebas kotoran. Kemudian empulur batang sawit dipotong kecil-kecil dan dihaluskan hingga menjadi serbuk, ditambahkan air dan diblender hingga halus.
Campuran kemudian diperas melalui saringan kain kasa untuk mendapatkan patinya.
21
Dibiarkan selama 24 jam sampai pati mengendap lalu dicuci beberapa kali dengan air hingga cairannya jernih kemudian disaring dengan kertas saring biasa untuk memisahkan pati dengan air yang terkandung. Endapan pati yang diperoleh dikeringkan di dalam oven pada suhu 60 oC selama 22 jam. Pati kering kemudian dihaluskan dengan menggunakan alu dan lumpang dan diayak menggunakan saringan 100 mess kemudian disimpan dalam wadah tertutup.
3.4 Pembuatan Larutan Asam Asetat 1%
Diukur sebanyak 10 ml asam asetat glasial lalu diencerkan dengan aquadest dalam labu takar 1 Liter hingga garis batas.
3.5 Pembuatan Film Biopolimer dengan Penambahan Sorbitol
Disiapkan pati batang sawit sebanyak 2 gram. Dimasukkan kedalam beaker glass 250 ml, kemudian dilarutkan dengan aquadest sebanyak 50 ml sambil distirer pada suhu 72 oC hingga campuran tergelatinisasi. Kemudian ditambahkan plasticizer sorbitol sebanyak 0,8 ml. Setelah semua bahan tercampur merata, didinginkan campuran lalu dituangkan ke atas plat cetakan hingga merata. Kemudian dikeringkan di oven pada suhu 40 oC selama 24 jam dan dilepas film biopolimer dari plat cetakan.
Dilakukan perlakuan yang sama untuk variasi sorbitol 1,0 dan 1,2 ml.
Selanjutnya film biopolimer dikarakterisasi dengan parameter uji analisa gugus fungsi menggunakan FT-IR, ketahanan termal dengan DSC dan DTA, serta pengembangan (% Swelling) dengan menggunakan aquadest.
3.6 Pembuatan Film Biopolimer dengan Penambahan Sorbitol dan Kitosan Disiapkan pati batang sawit dan kitosan dengan perbandingan 1:1 masing- masing sebanyak 2 gram. Pati batang kelapa sawit dimasukkan kedalam beaker glass 250 ml, kemudian dilarutkan dengan aquadest sebanyak 50 ml sambil distirer pada suhu 72 oC hingga campuran tergelatinisasi. Pada wadah yang lain dilarutkan kitosan dengan asam asetat 1% sebanyak 80 ml sambil distirer dan dipertahankan selama 3 jam. Kemudian dicampurkan larutan pati yang telah tergelatinisasi kedalam larutan kitosan. Ditambahkan plasticizer sorbitol sebanyak 0,8 ml sambil distirer selama 20 menit. Setelah semua bahan tercampur merata dituangkan ke atas plat
cetakan hingga merata. Kemudian dikeringkan di oven pada suhu 40 oC selama 48 jam dan dilepas film biopolimer dari plat cetakan.
Selanjutnya film biopolimer dikarakterisasi dengan parameter uji analisa gugus fungsi menggunakan FT-IR, ketahanan termal dengan DTA dan DSC, serta pengembangan (% Swelling) dengan menggunakan aquadest.
3.7 Karakterisasi Film Biopolimer
Film biopolimer yang diperoleh dapat diuji karakterisasinya menggunakan beberapa Uji :
3.7.1 Analisa FT-IR (Fourier Transform Infra-Red)
Masing-masing sampel film biopolimer berbasis pati batang sawit-sorbitol- kitosan dengan perbandingan 2:0,8:2 ; 2:1,0:2 ; dan 2:1,2:2 (g/ml/g) dijepit pada tempat sampel pada alat FT-IR kearah sinar infra merah, kemudian diukur spektrumnya dengan alat spektrofotometer FT-IR model Shimadzu.
3.7.2 Analisa DSC (Differential Scanning Calorimetry)
Analisa DSC menggunakan instrumen DSC-60 Plus Shimadzu yang mengandung gas nitrogen. Sampel ditimbang dan dipanaskan pada suhu kamar sampai 600 oC dengan laju pemanasan 20 oC/menit. Analisa dilakukan dengan menaikkan suhu sampel secara bertahap dan menentukan berat terhadap temperatur.
Suhu dalam metode pengujian mencapai 600 oC. Perubahan berat akibat proses pemanasan dapat ditentukan langsung dari termogram yang diperoleh. Setelah data diperoleh dapat diketahui nilai DSC nya yang dilihatdari puncak dekomposisinya.
3.7.3 Analisa DTA (Differential Thermal Analysis)
Analisa DTA menggunakan instrumen DTA Type DT 30 Shimadzu yang mengandung gas nitrogen. Sampel ditimbang dan dipanaskan pada suhu kamar sampai 650 oC dengan laju pemanasan 10 oC/menit. Analisa dilakukan dengan menaikkan suhu sampel secara bertahap dan menentukan berat terhadap temperatur.
Suhu dalam metode pengujian mencapai 650 oC. Perubahan berat akibat proses pemanasan dapat ditentukan langsung dari termogram yang diperoleh dengan
23
kecepatan rekorder pencatat 2,5 mm/menit. Setelah data diperoleh dapat diketahui nilai DTA nya yang dilihatdari puncak dekomposisinya.
3.7.4 Uji Swelling
Film biopolimer dengan perbandingan 2:0,8:2 ; 2:1,0:2 ; dan 2:1,2:2 (g/ml/g) dipotong dengan ukuran 2 cm x 2 cm. Kemudian ditimbang masing-masing berat film biopolimer. Kemudian dimasukkan kedalam beaker glass yang masing-masing berisi 50 ml aquadest. Dibiarkan selama 24 jam dan dilihat perubahan dari film biopolimer. Kemudian diangkat dan ditimbang masing-masing sampel dalam keadaan basah. Persentase Swelling dari masing-masing film biopolimer dapat dihitung dengan menggunakan persamaan berikut ini :
Persentase Swelling (%) = 𝑊𝑎𝑘 ℎ 𝑖𝑟 − 𝑊𝑎𝑤𝑎𝑙
𝑊𝑎𝑤𝑎𝑙 (3.1)
Keterangan : Wakhir = berat sampel film biopolimer setelah direndam Wawal = berat sampel film biopolimer sebelum direndam.
3.8 Bagan Penelitian
3.8.1 Isolasi Pati Batang Kelapa Sawit (Elaeis guineensis) (Matondang, dkk., 2013)
25
3.8.2 Pembuatan Film Biopolimer dengan Penambahan Sorbitol
Catatan : Dilakukan perlakuan yang sama untuk variasi sorbitol 1,0 dan 1,2 ml.
3.8.3 Pembuatan Film Biopolimer dengan Penambahan Sorbitol dan Kitosan
3.8.4 Uji Swelling
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Analisa FT-IR Film Biopolimer Pati Batang Sawit
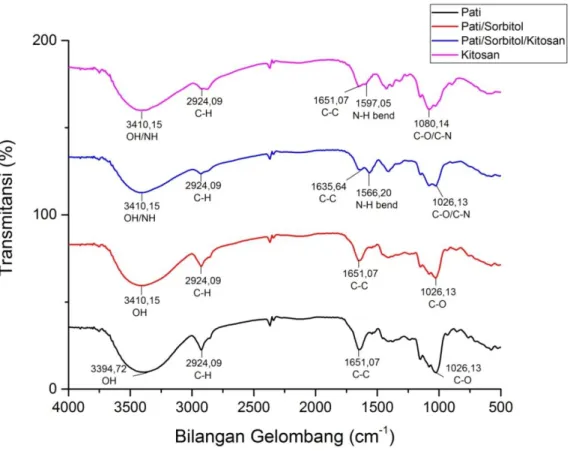
Analisa spektroskopi FT-IR terhadap film biopolimer dilakukan untuk mengidentifikasi gugus fungsional yang terdapat dalam pati, kitosan, dan film biopolimer pati batang sawit-kitosan untuk melihat adanya gugus fungsi baru atau tidak dalam film biopolimer yang dihasilkan. Analisa FT-IR ini dilakukan melalui pengamatan perbandingan spektogram FT-IR film biopolimer pati batang sawit menggunakan plasticizer sorbitol dengan spektogram FT-IR film biopolimer pati batang sawit-sorbitol dengan adanya penambahan kitosan.
Pada analisa ini sampel yang digunakan adalah film biopolimer dengan perbandingan pati batang sawit-sorbitol 2:0,8 (g/ml) dan film biopolimer pati batang sawit-sorbitol-kitosan 2:0,8:2 (g/ml/g). Hasil analisa spektrum FT-IR dapat dilihat pada Gambar 4.1.
Jika dilihat pada Gambar 4.1, pada proses pembentukan film biopolimer tidak ada gugus fungsi baru yang terbentuk. Hal ini menunjukkan bahwa film biopolimer yang dihasilkan merupakan proses pencampuran secara fisik. Pada Gambar 4.1 menunjukkan bahwa dari hasil FT-IR pati terlihat adanya serapan gugus OH pada bilangan gelombang 3394,72 cm-1. Hasil FT-IR kitosan terlihat adanya pita serapan gugus N-H tekukan (bending) pada bilangan gelombang 1597,06 cm-1. Hasil FT-IR film biopolimer pati batang sawit-sorbitol 0,8 ml dengan adanya penambahan kitosan terlihat spektrum FT-IR yang hampir sama dan tidak menunjukkan adanya perbedaan yang signifikan tetapi mengalami sedikit pergeseran. Pada spektrum FT-IR menunjukkan adanya serapan gugus C-C pada bilangan gelombang 1635,64 cm-1 dan pita serapan gugus N-H tekukan (bending) pada bilangan gelombang 1566,20 cm-1, sedangkan untuk serapan gugus OH dan N-H uluran (stretching )amina terlihat pada daerah yang sama yaitu pada bilangan gelombang 3410,15 cm-1 yang mengalami pelebaran karena adanya interaksi dan kemungkinan adanya serapan air pada film biopolimer sesuai dengan yang dilaporkan oleh Setiani, (2013). Serapan oleh ikatan- ikatan N-H kurang intensif dibandingkan serapan oleh OH, sebagian karena dalam
amina ikatan hydrogen lebih lemah dan sebagian karena ikatan NH kurang polar (Fessenden dan Fessenden, 1982).
Gambar 4.1 Hasil Analisa FT-IR Pati Batang Sawit; Film Biopolimer Pati Batang Sawit-Sorbitol 0,8 ml; Film Biopolimer Pati Batang Sawit-Sorbitol 0,8 ml-Kitosan; dan Kitosan
Hasil FT-IR film biopolimer pati batang sawit dengan menggunakan plasticizer sorbitol 0,8 ml terlihat adanya serapan gugus C-H yang sama dengan hasil FT-IR lainnya, yaitu pada bilangan gelombang 2924,09 cm-1. Untuk gugus-gugus lainnya memiliki daerah serapan yang sama, yaitu untuk gugus C-O terlihat pada bilangan gelombang 1026,13 cm-1 pada hasil FT-IR pati, pati-sorbitol 0,8 ml, dan pati-sorbitol 0,8 ml-kitosan, sedangkan pada kitosan serapan C-O terlihat pada bilangan gelombang 1080,14 cm-1. Serapan gugus C-N terlihat pada bilangan gelombang 1080,14 cm-1 pada FT-IR kitosan, sedangkan pada FT-IR film biopolimer pati-sorbitol 0,8 ml-kitosan terlihat pada bilangan gelombang 1026,13 cm-1. Serapan gugus C-C terdapat pada bilangan gelombang 1651,07 cm-1 yang terlihat pada hasil FT-IR pati, kitosan, dan film biopolimer pati-sorbitol 0,8 ml, dan serapan gugus OH
29
pada bilangan gelombang 3401,15 cm-1 terlihat pada hasil FT-IR kitosan, film biopolimer pati-sorbitol 0,8 ml, maupun film biopolimer setelah adanya penambahan kitosan. Adapun pita serapan gugus fungsi hasil analisis FT-IR dapat dilihat pada Tabel 4.1 berikut ini.
Tabel 4.1 Pita Serapan Gugus Fungsi Hasil Analisa Spektrum FT-IR Gugus Fungsi Bilangan Gelombang
cm-1
Standar Bilangan Gelombang cm-1
C-H 2924,09 2850-3000
OH 3394,72
3410,15 3200-3500
N-H stretching 3410,15 3100-3500
N-H bending 1566,20
1597,06 1538-1667
C-O/C-N
1026,13
1080,14 1000-1300
C-C 1635,64
1651,07 1500-1700
Sumber : Pavia, 1979.
Dari hasil FT-IR menunjukkan bahwa proses pembuatan film biopolimer merupakan proses pencampuran secara fisika dengan adanya interaksi hidrogen antar rantai yang menyebabkan adanya ikatan hidrogen. Ikatan hidrogen ini terjadi ketika sebuah atom O ataupun atom N yang terdapat dalam kitosan berinteraksi dengan atom H dari amilosa, amilopektin, ataupun dari kitosan itu sendiri. Interaksi hidrogen ini juga dapat terjadi antara amilosa maupun amilosa dengan amilopektin sesuai dengan yang dilaporkan oleh Setiani, (2013). Usulan interaksi hidrogen ini dapat dilihat pada Gambar 4.2 berikut.
O O O
OH
O
O
OH
O
O
O O
OH
O
O
O O
OH
O
O
O O
n
O O
O O
O N
O
O N
O O
O
O N
O O
n
O O
O HO O
O
O O
O O
O
O
O
O
O
O O
O
O
O
O O
CH2
O
OH
O O
n
Amilosa
Kitosan
Amilopektin
ikatan H intramolekuler
ikatan H intermolekuler
H
H
H H
H H
H
H
H H H
H H2
H H
H H
H H
H2 H2
H H
H
H H H H
H
Gambar 4.2 Usulan Interaksi Hidrogen Antar Molekul Amilosa, Amilopektin, dan Kitosan dalam Film Biopolimer (Setiani, 2013)
4.2 Hasil Analisa Differential Scanning Calorimetry (DSC) Film Biopolimer Pati Batang Sawit
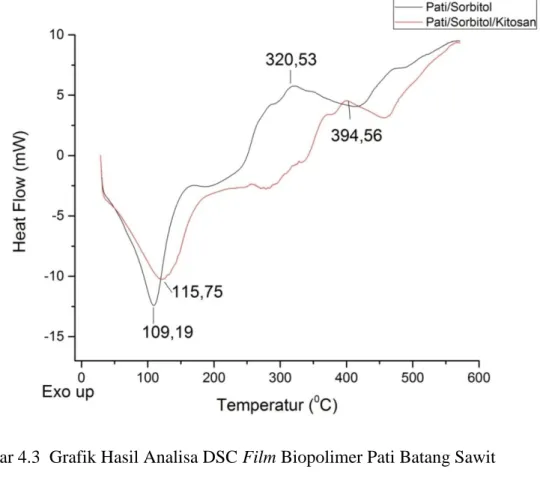
Analisa DSC bertujuan untuk melihat suhu endotermik dan suhu eksotermik dari sampel. Suhu endotermik kebawah menunjukkan pada suhu berapa material sampel akan mulai melebur, dan suhu eksotermik keatas menunjukkan pada suhu berapa material sampel akan terdekomposisi atau terurai. Pada analisa DSC sampel yang digunakan adalah film biopolimer pati batang sawit dengan perbandingan pati batang sawit-sorbitol 2:0,8 (g/ml) dan film biopolimer pati batang sawit-sorbitol- kitosan dengan perbandingan 2:0,8:2 (g/ml/g).
Berdasarkan analisa DSC kedua sampel yang ditunjukkan pada Gambar 4.3 dan Tabel 4.2 diperoleh hasil suhu endotermik untuk film biopolimer pati-sorbitol 0,8 ml pada suhu 109,19 0C. Pada tahap ini diduga bahwa film biopolimer melepas bahan volatil seperti air. Sesuai dengan yang dilaporkan oleh Martinez-Camacho (2010), menyatakan bahwa peristiwa endotermik antara suhu 40 0C-120 0C berkaitan dengan terlepasnya komponen mudah menguap dan kelompok hidrofilik pada film.
31
Kemudian pada tahap kedua, menunjukkan suhu eksotermik pada suhu 320,53 0C yang merupakan puncak degradasi. Pada tahap ini diduga bahan-bahan penyusun film biopolimer yaitu molekul pati dan sorbitol mengalami depolimerisasi atau terdekomposisi. Sedangkan dari analisa DSC untuk film biopolimer pati batang kelapa sawit-sorbitol 0,8 ml dengan adanya penambahan kitosan sebanyak 2 g diperoleh hasil suhu endotermik yaitu 115,75 0C dan suhu eksotermik yaitu pada suhu 394,56 0C. Hasil analisa DSC dari film biopolimer pati batang sawit dapat dilihat pada Gambar 4.3 dan Tabel 4.2 berikut.
Gambar 4.3 Grafik Hasil Analisa DSC Film Biopolimer Pati Batang Sawit Tabel 4.2 Hasil Analisa DSC Film Biopolimer Pati Batang Sawit
Sampel Parameter
Suhu Endotermik (0C) Suhu Eksotermik (0C) Film pati batang sawit- sorbitol
2:0,8 109,19 0C 320,53 0C
Film pati batang sawit-sorbitol- kitosan
2:0,8:2
115,75 0C 394,56 0C