i
ABSTRAK
EFEK ANTIMIKROBA EKSTRAK ETANOL DAUN KEMANGI (Ocimum sanctum Linn) TERHADAP Escherichia coli DAN
Staphylococcus aureus SECARA IN VITRO
Nurul Aprinda 1110075, 2014
Pembimbing I : Dr. Iwan Budiman, dr., MS, MM, M.Kes, AIF
Infeksi bakteri merupakan penyebab signifikan morbiditas dan mortalitas di seluruh dunia. Pemberian antibiotik yang irasional dapat menimbulkan resistensi, sehingga dibutuhkan obat lain sebagai alternatif pengobatan infeksi bakteri. Pengobatan herbal banyak dipilih karena efek sampingnya yang minimal dibandingkan obat-obatan berbahan kimia. Salah satu tanaman yang banyak terdapat disekitar kita adalah daun kemangi (Ocimum sanctum Linn). Kemangi sering digunakan untuk mengobati berbagai penyakit yang disebabkan oleh bakteri.
Tujuan dari penelitian ini adalah untuk mengetahui efek antimikroba ekstrak daun kemangi terhadap Escherichia coli dan Staphylococcus aureus.
Penelitian ini bersifat eksperimental murni laboratorik dengan metode disc diffusion. Analisis data menggunakan ANAVA dengan α = 0,05 dan dilanjutkan dengan uji LSD.
Dari hasil penelitian ini diketahui, pemberian ekstrak daun kemangi dengan konsentrasi 50%, 75% dan 100% akan menimbulkan zona inhibisi pada Escherichia coli dan Staphylococcus aureus. Konsentrasi ekstrak etanol daun kemangi yang menghasilkan zona inhibisi paling besar adalah konsentrasi 100%, yaitu dengan rata-rata zona inhibisi sebesar 12.28mm untuk Escherichia coli dan rata-rata zona inhibisi sebesar 12.31mm untuk Staphylococcus aureus, tetapi hasil ini masih lebih rendah dibandingkan dengan kontrol positif. Zona inhibisi yang dihasilkan oleh konsentrasi 75% dan 50% tidak mempunyai perbedaan secara statistik.
Simpulan dari percobaan ini adalah daun kemangi (Ocimum sanctum Linn) berefek antimikroba terhadap Escherichia coli dan Staphylococcus aureus.
.
ii ABSTRACT
THE ANTIMICROBIAL EFFECT OF ETHANOL EXTRACT OF BASIL LEAVES (Ocimum Sanctum Linn) AGAINST Escherichia coli AND
Staphylococcus aureus IN VITRO
Nurul Aprinda, 2014
1stAdvisor : Dr. Iwan Budiman, dr., MS, MM, M.Kes, AIF
Bacterial infections are a significant cause of morbidity and mortality worldwide. Problems in the management of bacterial infections is due to irrational antibiotics administration which can lead to bacterial resistance, so it takes other drugs as an alternative treatment of bacterial infections.
Recently, medicinal plants or herbs are becoming widely chosen because of its minimum side effects compared to medications based on chemical substances. One of those herbs which can be easily acquired is Basil leaves (Ocimum sanctum Linn). Basil often used to treat a variety of disease caused by bacteria.
This study aims to determine antimicrobial effects of basil extract against Escherichia Coli and Staphylococcus aureus.
This study was a true experimental laboratoric with disc diffusion method. Data analysis using ANOVA with α = 0.05 and followed by LSD test.
The research revealed the addition of basil extract with 50%,75%, and 100% concentrate would create inhibition zone in Escherichia coli and Staphylococcus aureus. The concentrate of basil ethanol extract that produced widest inhibition zone is 100% concentrate, which average in 12.28mm for Escherichia coli and 12.31 mm for Staphylococcus aureus, but this result was still lower compared to positive control provided. Inhibition zone produced by 75% and 50% concentrate didn’t show statistical difference.
The conclusion of the experiment is, basil has antimicrobial effects against Escherichia coli and staphylococcus aureus.
iii DAFTAR ISI
JUDUL ... i
LEMBAR PERSETUJUAN ... ii
LEMBAR PERNYATAAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
KATA PENGANTAR ... vi
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I : PENDAHULUAN... 1
1.1 Latar belakang ... 1
1.2 Identifikasi Masalah ... 2
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
1.5 Kerangka Pemikiran ... 3
1.6 Hipotesis Masalah ... 4
BAB II : TINJAUAN PUSTAKA ... 5
2.1 Daun Kemangi ... 5
2.1.1 Klasifikasi Daun Kemangi ... 5
2.1.2 Deskripsi dan Morfologi daun Kemangi ... 6
2.1.3 Kandungan Daun Kemangi ... 7
2.1.3.1 Eugenol ... 7
iv
2.1.3.3 Flavonoid ... 9
2.1.3.4 Tannin ... 10
2.1.3.5 Saponin ... 12
2.1.4 Aktivitas Daun Kemangi ... 12
2.1.4.1 Aktivitas Antibakteri ... 13
2.1.4.2 Aktivitas Antifungal ... 13
2.1.4.3 Aktivitas Antiviral ... 13
2.2 Escherichia coli ... 14
2.3 Staphylococcus aureus ... 18
2.4 Antibiotik ... 21
2.4.1 Klasifikasi Antibiotik ... 21
2.4.2 Tetrasiklin ... 22
2.4.3 Gentamisin ... 23
BAB III : METODE PENELITIAN ... 25
3.1 Bahan dan Subjek Penelitian ... 25
3.2 Tempat dan Waktu Penelitian ... 26
3.3 Metode Penelitian ... 26
3.3.1 Desain Penelitian ... 26
3.3.2 Variabel Penelitian... 27
3.3.3 Definisi Operasional Variabel ... 27
3.4 Prosedur Kerja ... 27
3.4.1 Sterilisasi Alat ... 27
3.4.2 Persiapan Bakteri Uji ... 28
v
3.4.4 Pembuatan Ekstrak Daun Kemangi ... 29
3.4.5 Pengenceran Ekstrak Daun Kemangi ... 29
3.4.6 Uji Aktivitas Antibakteri Ekstrak Daun Kemangi Terhadap Pertumbuhan Bakteri ... 30
3.4.7 Tes Sensitivitas Antibiotik ... 30
3.4.8 Pengukuran Zona Inhibisi ... 31
3.5 Analisis Data ... 31
3.6 Kriteria Uji ... 31
BAB IV : HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Uji Pendahuluan ... 32
4.2 Hasil Penelitian ... 33
4.2.1 Efek Antimikroba Ekstrak Etanol Daun Kemangi (Ocimum sanctum Linn) Terhadap Escherichia coli ... 33
4.2.2 Efek Antimikroba Ekstrak Etanol Daun Kemangi (Ocimum sanctum Linn) Terhadap Staphylococcus aureus ... 35
4.3 Pembahasan ... 38
BAB V : KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 44
vi
DAFTAR TABEL
Tabel 4.1 Diameter zona inhibisi ekstrak daun kemangi (Ocimum Sanctum L)
terhadap Escherichia coli pada uji pendahuluan ... 32 Tabel 4.2 Diameter zona inhibisi ekstrak daun kemangi (Ocimum Sanctum L)
terhadap Staphylococcus aureus pada uji pendahuluan ... 32 Tabel 4.3 Diameter zona inhibisi ekstrak daun kemangi (Ocimum Sanctum L)
terhadap Escherichia coli ... 33 Tabel 4.4 Tabel anava untuk diameter zona inhibisi ekstrak daun kemangi
(Ocimum Sanctum L) terhadap Escherichia coli ... 34 Tabel 4.5 Tabel LSD untuk diameter zona inhibisi ekstrak daun kemangi
(Ocimum Sanctum L) terhadap Escherichia coli ... 34 Tabel 4.6 Diameter zona inhibisi ekstrak daun kemangi (Ocimum Sanctum L)
terhadap Staphylococcus aureus ... 35 Tabel 4.7 Tabel anava untuk diameter zona inhibisi ekstrak daun kemangi
(Ocimum Sanctum L) terhadap Staphylococcus aureus ... 36 Tabel 4.8 Tabel LSD untuk diameter zona inhibisi ekstrak daun kemangi
vii
DAFTAR GAMBAR
Gambar 2.1 Daun kemangi ... 5
Gambar 2.2 Struktur kimia eugenol ... 8
Gambar 2.3 Struktur kimia linolool ... 9
Gambar 2.4 Struktur kimia flavonoid orientin ... 10
Gambar 2.5 Struktur kimia tanin ... 11
Gambar 2.6 Escherichia coli ... 14
Gambar 2.7 Dinding sel Escherichia coli ... 15
Gambar 2.8 Staphylococcus aureus ... 18
Gambar 2.9 Dinding sel Staphylococcus aureus ... 20
Gambar 2.10 Struktur kimia tetrasiklin ... 22
viii
DAFTAR LAMPIRAN
Lampiran 1 Zona inhibisi pada Escherichia coli dan Staphylococcus aureus
dengan pemberian ekstrak etanol daun kemangi 100% ... 44 Lampiran 2 Zona inhibisi pada Escherichia coli dan Staphylococcus aureus
dengan pemberian ekstrak etanol daun kemangi 75% ... 45 Lampiran 3 Zona inhibisi pada Escherichia coli dan Staphylococcus aureus
dengan pemberian ekstrak etanol daun kemangi 50% ... 46 Lampiran 4 Zona inhibisi pada Escherichia coli dan Staphylococcus aureus
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Infeksi bakteri merupakan penyebab signifikan morbiditas dan mortalitas di seluruh dunia. Data World Health Organization (WHO) tahun 2000 menunjukan peningkatan prevalensi infeksi bakteri mencapai 9% diseluruh dunia dalam satu dasawarsa. Escherichia coli dan Staphylococcus aureus merupakan bakteri komensal pada tubuh manusia. Tetapi bakteri tersebut seringkali menyebabkan penyakit yang banyak tersebar di masyarakat. Penyakit yang disebabkan Escherichia coli antara lain, diare, infeksi saluran kemih, infeksi saluran napas,
infeksi pembuluh darah, sedangkan Staphylococcus aureus dapat menyebabkan selulitis, folikulitis, impetigo, infeksi luka, abses, osteomyelitis, pneumonia, endokarditis dan syok septik.
Permasalahan dalam penatalaksanaan infeksi bakteri adalah pemberian antibiotik yang irasional karena dapat menimbulkan resistensi. Resistensi antibiotik terhadap bakteri merupakan ancaman global bagi kesehatan karena selain berdampak pada morbiditas dan mortalitas, juga memberi dampak negatif terhadap ekonomi dan sosial yang sangat tinggi. Pada awalnya resistensi terjadi di tingkat rumah sakit, tetapi lambat laun juga berkembang di lingkungan masyarakat terutama Escherichia coli dan Staphylococcus aureus (DepKes RI, 2011).
2
Angka resistensi terhadap antibiotik terus meningkat, sehingga dibutuhkan obat lain sebagai alternatif pengobatan infeksi bakteri. Belakangan ini tanaman obat sering yang digunakan untuk menanggulangi masalah kesehatan di masyarakat. Banyak penelitian yang menggunakan tanaman yang ada disekitar kita untuk mengobati berbagai macam penyakit. World Health Organization mengestimasi sekitar 80% populasi di dunia menggunakan tanaman alami sebagai bahan dasar pembuatan obat. Indonesia dikenal kaya dengan keanekaragaman hayatinya, maka pengobatan dengan menggunakan tumbuhan obat di Indonesia saat ini lebih digalakkan. Pengobatan secara herbal banyak dipilih karena efek sampingnya yang minimal dibandingkan obat-obatan berbahan kimia.
Salah satu tanaman yang banyak terdapat disekitar kita adalah daun kemangi. Biasanya daun kemangi digunakan untuk memasak dan sebagai lalapan. Ternyata selain sebagai bahan masakan dan lalapan, daun kemangi juga digunakan untuk mengobati berbagai penyakit yang disebabkan oleh bakteri seperti penyakit kulit, diare, disentri, sebagai antiseptik untuk luka, dan lain-lain. Di india, daun kemangi telah banyak dijadikan sebagai obat. Menurut Kumar, Daun kemangi memiliki peranan medis untuk mengobati bermacam penyakit termasuk penyakit infeksi (Kumar, Rahal, Chakraborty, Tiwari, Latheef, & Dhama, 2013).
Berdasarkan latar belakang di atas penulis tertarik untuk membuat karya tulis ilmiah tentang efek antimikroba ekstrak etanol daun kemangi (Ocimum Sanctum Linn) terhadap Escherichia coli dan Staphylococcus aureus.
1.2 Identifikasi Masalah
1. Apakah ekstrak etanol daun kemangi (Ocimum Sanctum Linn) berefek antimikroba terhadap Escherichia coli.
3 1.3 Tujuan Penelitian
1. Untuk mengetahui efek ekstrak etanol daun kemangi (Ocimum Sanctum Linn) terhadap Escherichia coli.
2. Untuk mengetahui efek ekstrak etanol daun kemangi (Ocimum Sanctum Linn) terhadap Staphylococcus aureus.
1.4 Manfaat Penelitian
Manfaat akademis : Menambah pengetahuan dan wawasan mengenai bahan alami yang bermanfaat sebagai antimikroba.
Manfaat Praktis : Masyarakat dapat mengetahui manfaat dari daun kemangi selain dipakai sebagai bahan makanan sehari-hari.
1.5 Kerangka Pemikiran
Daun Kemangi memiliki beberapa zat aktif yang bersifat antimikroba antara lain, eugenol, linolool, flavonoid, saponin dan tanin. Minyak atsiri pada daun kemangi mengandung eugenol yang dapat menyebabkan kerusakan membran sel bakteri dan dapat menstimulasi kebocoran ion kalium sehingga terjadi kematian sel bakteri (Khalid, 2008). Eugenol juga dapat menghambat aktivitas enzim ATPase sehingga energi yang dibutuhkan untuk perbaikan sel bakteri tidak terbentuk (Hyldgaard, Mygind, & Meyer, 2012).
4
Saponin meningkatkan permeabilitas membran sel dengan menurunkan tegangan permukaan sehingga menyebabkan keluarnya senyawa intraseluler. Tanin bekerja menghambat enzim DNA topoisomerase pada bakteri (Robinson, 1995). Selain itu tanin juga mengambil substrat yang diperlukan untuk pertumbuhan mikroba atau tindakan langsung pada metabolisme mikroba melalui penghambatan fosforilasi oksidatif (Scalbert, 1991).
Ekstrak etanol sering digunakan sebagai pelarut dalam ekstraksi daun kemangi. Etanol merupakan salah satu tipe alkohol, zat aktif yang terkandung dalam daun kemangi terutama larut dalam alkohol daripada air (Gupta, Kumar, & Mallaiah, 2013).
1.6 Hipotesis Penelitian
1. Ekstrak etanol daun kemangi (Ocimum Sanctum Linn) berefek antimikroba terhadap Escherichia coli.
40 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Ekstrak etanol daun kemangi (Ocimum Sanctum Linn) berefek antimikroba terhadap Escherichia coli.
2. Ekstrak etanol daun kemangi (Ocimum Sanctum Linn) berefek antimikroba terhadap Staphylococcus aureus.
5.2 Saran
1. Perlu dilakukan penelitian lebih lanjut tentang efek antimikroba daun kemangi (Ocimum Sanctum Linn) dengan menggunakan sediaan lain.
EFEK ANTIMIKROBA EKSTRAK ETANOL DAUN KEMANGI (Ocimum sanctum Linn) TERHADAP Escherichia coli DAN
Staphylococcus aureus SECARA IN VITRO
THE ANTIMICROBIAL EFFECT OF ETHANOL EXTRACT OF BASIL LEAVES (Ocimum Sanctum Linn) AGAINST Escherichia coli AND
Staphylococcus aureus IN VITRO
Iwan Budiman1, Nurul Aprinda2 1
Bagian Ilmu Gizi, Fakultas Kedokteran Universitas Kristen Maranatha,
2
Fakultas Kedokteran Universitas Kristen Maranatha
Jalan Prof. Drg. Suria Sumantri MPH No. 65 Bandung 40164 Indonesia
ABSTRAK
Infeksi bakteri merupakan penyebab signifikan morbiditas dan mortalitas di seluruh dunia. Pemberian antibiotik yang irasional dapat menimbulkan resistensi, sehingga dibutuhkan obat lain sebagai alternatif pengobatan infeksi bakteri. Pengobatan herbal banyak dipilih karena efek sampingnya yang minimal dibandingkan obat-obatan berbahan kimia. Salah satu tanaman yang banyak terdapat disekitar kita adalah daun kemangi (Ocimum sanctum Linn). Kemangi sering digunakan untuk mengobati berbagai penyakit yang disebabkan oleh bakteri.
Tujuan dari penelitian ini adalah untuk mengetahui efek antimikroba ekstrak daun kemangi terhadap Escherichia coli dan Staphylococcus aureus.
Penelitian ini bersifat eksperimental murni laboratorik dengan metode disc diffusion. Analisis
data menggunakan ANAVA dengan α = 0,05 dan dilanjutkan dengan uji LSD.
Dari hasil penelitian ini diketahui, pemberian ekstrak daun kemangi dengan konsentrasi 50%, 75% dan 100% akan menimbulkan zona inhibisi pada Escherichia coli dan Staphylococcus aureus. Konsentrasi ekstrak etanol daun kemangi yang menghasilkan zona inhibisi paling besar adalah konsentrasi 100%, yaitu dengan rata-rata zona inhibisi sebesar 12.28mm untuk Escherichia coli dan rata-rata zona inhibisi sebesar 12.31mm untuk Staphylococcus aureus, tetapi hasil ini masih lebih rendah dibandingkan dengan kontrol positif. Zona inhibisi yang dihasilkan oleh konsentrasi 75% dan 50% tidak mempunyai perbedaan secara statistik.
Simpulan dari percobaan ini adalah daun kemangi (Ocimum sanctum Linn) berefek antimikroba terhadap Escherichia coli dan Staphylococcus aureus.
Kata kunci: ekstrak etanol daun kemangi, Escherichia coli, Staphylococcus aureus, zona inhibisi
ABSTRACT
Bacterial infections are a significant cause of morbidity and mortality worldwide. Problems in the management of bacterial infections is due to irrational antibiotics administration which can lead to bacterial resistance, so it takes other drugs as an alternative treatment of bacterial infections.
disease caused by bacteria.
This study aims to determine antimicrobial effects of basil extract against Escherichia Coli and Staphylococcus aureus.
This study was a true experimental laboratoric with disc diffusion method. Data analysis using ANOVA with α = 0.05 and followed by LSD test.
The research revealed the addition of basil extract with 50%,75%, and 100% concentrate would create inhibition zone in Escherichia coli and Staphylococcus aureus. The concentrate of basil ethanol extract that produced widest inhibition zone is 100% concentrate, which average in 12.28mm for Escherichia coli and 12.31 mm for Staphylococcus aureus, but this result was still lower compared to positive control provided. Inhibition zone produced by 75% and 50% concentrate didn’t show statistical difference.
The conclusion of the experiment is, basil has antimicrobial effects against Escherichia coli and staphylococcus aureus.
Keywords: basil leaves ethanol extract, Escherichia coli, staphylococcus aureus, inhibition zone
PENDAHULUAN
Infeksi bakteri merupakan
penyebab signifikan morbiditas dan mortalitas di seluruh dunia. Data World Health Organization (WHO) tahun 2000 menunjukan peningkatan prevalensi infeksi bakteri mencapai 9% diseluruh dunia dalam satu dasawarsa. Escherichia coli dan Staphylococcus aureus merupakan bakteri komensal pada tubuh manusia. Tetapi bakteri tersebut seringkali menyebabkan penyakit yang banyak tersebar di masyarakat. Penyakit yang disebabkan Escherichia coli antara lain, diare, infeksi saluran kemih, infeksi saluran napas, infeksi pembuluh darah, sedangkan Staphylococcus aureus dapat menyebabkan selulitis, folikulitis, impetigo, infeksi luka, abses, osteomyelitis, pneumonia, endokarditis dan syok septik.
Permasalahan dalam
penatalaksanaan infeksi bakteri adalah pemberian antibiotik yang irasional karena dapat menimbulkan resistensi. Resistensi antibiotik terhadap bakteri merupakan ancaman global bagi kesehatan karena selain berdampak pada morbiditas dan mortalitas, juga memberi dampak negatif terhadap ekonomi dan sosial yang sangat tinggi. Pada awalnya resistensi terjadi di tingkat rumah sakit, tetapi lambat laun juga berkembang di
lingkungan masyarakat terutama
Escherichia coli dan Staphylococcus aureus (1).
Menurut penelitian dari
Antimicrobial resistant in Indonesia (AMRIN-Study), terbukti dari 2494 individu di masyarakat, 43% Escherichia coli resisten terhadap jenis antibiotik tertentu antara lain: ampisilin (34%), kotrimoksazol (29%) dan kloramfenikol (25%). Sementara dari 361 karier Staphylococcus aureus, 32,1% resisten terhadap 1 atau lebih antibiotik di mana 21,6% resisten terhadap 1 jenis antibiotik dan sisanya resisten terhadap 2 atau lebih antibiotik. Di dalam komunitas, tingkat resistensi tertinggi adalah terhadap tetrasiklin (25,1%).
Angka resistensi terhadap antibiotik terus meningkat, sehingga dibutuhkan obat lain sebagai alternatif pengobatan infeksi bakteri. Belakangan ini tanaman obat sering yang digunakan untuk menanggulangi masalah kesehatan di masyarakat. Banyak penelitian yang menggunakan tanaman yang ada disekitar kita untuk mengobati berbagai
macam penyakit. World Health
Organization mengestimasi sekitar 80% populasi di dunia menggunakan tanaman alami sebagai bahan dasar pembuatan obat.
Indonesia dikenal kaya dengan
keanekaragaman hayatinya, maka
Salah satu tanaman yang banyak terdapat disekitar kita adalah daun kemangi. Biasanya daun kemangi digunakan untuk memasak dan sebagai lalapan. Ternyata selain sebagai bahan masakan dan lalapan, daun kemangi juga digunakan untuk mengobati berbagai penyakit yang disebabkan oleh bakteri seperti penyakit kulit, diare, disentri, sebagai antiseptik untuk luka, dan lain-lain. Di india, daun kemangi telah banyak dijadikan sebagai obat. Menurut Kumar, Daun kemangi memiliki peranan medis untuk mengobati bermacam penyakit termasuk penyakit infeksi (2).
Berdasarkan latar belakang di atas penulis tertarik untuk membuat karya tulis ilmiah tentang efek antimikroba ekstrak etanol daun kemangi (Ocimum Sanctum Linn) terhadap Escherichia coli dan Staphylococcus aureus.
METODOLOGI
Desain penelitian ini bersifat eksperimental murni laboratorik dengan metode disc diffusion yang menggunakan cakram pada MHA. Efek antibakteri terhadap Staphylococcus aureus dan Escherichia coli diuji menggunakan ekstrak daun kemangi dengan berbagai konsentrasi.
Ekstrak daun kemangi diperoleh dari daun kemangi yang dilarutkan dengan pelarut etanol dan diencerkan menjadi konsentrasi 100%, 75%, 50%. Kontrol positif yang digunakan adalah cakram antibiotik tetrasiklin 30 µg dan gentamisin 10 µg. Zona bening yang terbentuk disekitar cakram yang ditetesi ekstrak daun kemangi pada biakan medium bakteri setelah diinkubasi dan diukur menggunakan jangka sorong.
Semua alat yang akan digunakan, terlebih dahulu disterilkan melalui proses sterilisasi yaitu cara sterilisasi kering dan cara sterilisasi basah. Sterilisasi dengan api langsung dilakukan terhadap peralatan seperti jarum oese, pinset, dan mulut tabung biakan. Sesudah disterilkan peralatan tersebut didinginkan terlebih dahulu sebelum digunakan.
Sterilisasi dengan oven pemanas dilakukan terhadap peralatan gelas yang tidak berskala seperti cawan petri, tabung
reaksi, dan pipet. Alat-alat yang akan disterilkan dimasukkan ke dalam oven pemanas setelah suhu 160oC selama 1-2 jam. Sterilisasi dilakukan dengan menggunakan otoklaf. Peralatan yang disterilkan dengan sterilisasi basah di antaranya sterilisasi medium, gelas ukur, gelas kimia, erlenmeyer, dan pipet tetes. Proses sterilisasi ini dilakukan pada suhu 121oC selama 15-20 menit.
Sampel yang digunakan pada penelitian ini adalah satu isolat bakteri Staphylococcus aureus dan satu isolat Escherichia coli yang diperoleh dari Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Maranatha. Escherichia coli dan Staphylococcus aureus dibiakan pada Nutrient Agar, lalu diinkubasi pada suhu 37°C selama 24 jam. Sebelum digunakan untuk penelitian, tiap bakteri diidentifikasi ulang dengan pewarnaan gram.
Tabung reaksi diisi dengan NaCl. Kemudian koloni dari medium pembiakan bakteri uji diambil dengan menggunakan oese. Koloni tersebut dimasukkan ke dalam tabung reaksi yang sudah berisi NaCl. Kemudian dicampurkan sampai didapatkan larutan yang homogen, dengan kekeruhan yang cukup (sesuai dengan standar 0,5 McFarland).
Suspensi bakteri Staphylococcus aureus dan Escherichia coli diinokulasikan pada medium Mueller Hinton Agar dengan menggunakan spreader. Sebanyak 20 µl ekstrak daun kemangi dengan konsetrasi 100%, 75%, dan 50% diteteskan pada masing-masing cakram kosong. Cakram berisi ekstrak daun kemangi diletakkan diatas permukaan medium Mueller Hinton Agar yang telah diinokulasi oleh bakteri. Medium uji diinokulasi pada inkubator dengan suhu 37°C selama 24 jam. Keesokan harinya, ukurlah zona inhibisi yang terbentuk pada medium agar dengan jangka sorong.
Analisis data menggunakan ANAVA
dengan α = 0,05. Kemaknaan ditentukan berdasarkan nilai p ≤ 0,05 dan bila bermakna
akan dilanjutkan dengan uji LSD.
Hasil tes ANOVA menunjukkan nilai p=0,000 baik pada kultur E. coli maupun S. aureus. Hasil tersebut menunjukkan bahwa terdapat setidaknya
sepasang kelompok yang berbeda secara signifikan pada kedua kultur bakteri. Hasil ANOVA dijabarkan pada tabel 1.
Tabel 1. Tabel anava untuk diameter zona inhibisi ekstrak etanol daun kemangi (Ocimum Sanctum L) terhadap Escherichia coli dan Staphylococcus aureus
Zona Inhibisi E. coli
Sum of Squares
Df Mean
Square
F Sig.
Between Groups 1444.338 3 481.446 451.215 .000
Within Groups 21.340 20 1.067
Total 1465.678 23
Zona Inhibisi S. aureus
Sum of Squares
Df Mean Square F Sig.
Between Groups 682.205 3 227.402 95.745 .000
Within Groups 47.502 20 2.375
Total 729.706 23
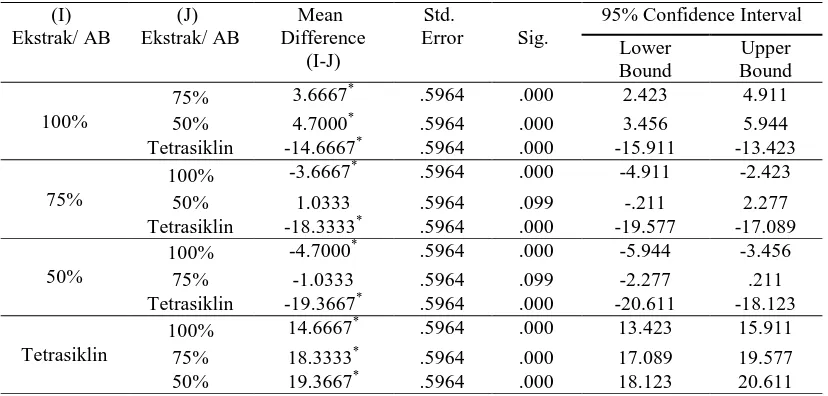
Pada kelompok E. coli, diketahui bahwa pengaruh kontrol positif tetrasiklin berbeda dengan pengaruh ekstrak 100%, dan berbeda dengan pengaruh ekstrak 75% dan 50%. Pengaruh ekstrak 100% juga berbeda dengan pengaruh ekstrak 75% dan 50%. Sedangkan pengaruh ekstrak 75% sama dengan pengaruh ekstrak 50%. Selain itu terlihat
bahwa kontrol positif tetrasiklin memberikan pengaruh yang paling besar terhadap diameter zona inhibisi, diikuti dengan pengaruh ekstrak etanol daun kemangi 100%. Hasil post-hoc test LSD untuk kelompok E. coli dijabarkan dalam tabel 2.
Tabel 2. Hasil LSD untuk kelompok E. coli
(I) Ekstrak/ AB (J) Ekstrak/ AB Mean Difference (I-J) Std.
Error Sig.
95% Confidence Interval
Lower Bound
Upper Bound
100%
75% 3.6667* .5964 .000 2.423 4.911
50% 4.7000* .5964 .000 3.456 5.944
Tetrasiklin -14.6667* .5964 .000 -15.911 -13.423
75%
100% -3.6667* .5964 .000 -4.911 -2.423
50% 1.0333 .5964 .099 -.211 2.277
Tetrasiklin -18.3333* .5964 .000 -19.577 -17.089
50%
100% -4.7000* .5964 .000 -5.944 -3.456
75% -1.0333 .5964 .099 -2.277 .211
Tetrasiklin -19.3667* .5964 .000 -20.611 -18.123
Tetrasiklin
100% 14.6667* .5964 .000 13.423 15.911
75% 18.3333* .5964 .000 17.089 19.577
50% 19.3667* .5964 .000 18.123 20.611
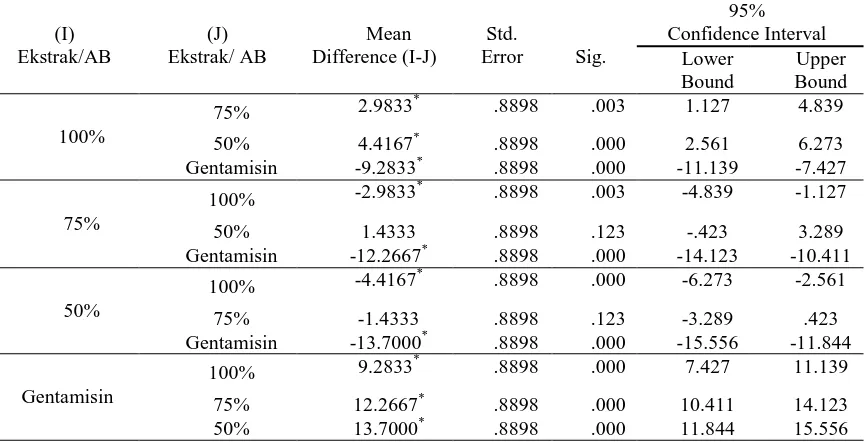
Pada kelompok S. aureus, diketahui bahwa pengaruh kontrol positif gentamisin berbeda dengan pengaruh ekstrak 100%, dan berbeda dengan pengaruh ekstrak 75% dan
terlihat bahwa kontrol positif gentamisin memberikan pengaruh yang paling besar terhadap diameter zona inhibisi, diikuti
dengan pengaruh ekstrak etanol daun kemangi 100%.
Tabel 3. Hasil LSD untuk kelompok S. aureus
Dari hasil penelitian di atas diketahui bahwa ektrak etanol daun kemangi memiliki aktifitas antimikroba. Hal ini sesuai dengan beberapa penelitian sebelumnya. Menurut penelitian dari Khalid, zona inhibisi terhadap Escherichia coli dengan pemberian minyak atsiri daun kemangi sebanyak 5µl adalah 11,5mm dan zona inhibisi terhadap Staphylococcus aureus dengan pemberian minyak atsiri daun kemangi sebanyak 5µl adalah 20 mm (3).
Penelitian lain didapatkan, zona inhibisi terhadap Escherichia coli dengan pemberian ektrak etanol daun kemangi dengan konsentrasi 200mg/mL sebanyak 5µl adalah 6.6mm sedangkan zona inhibisi terhadap Staphylococcus aureus dengan pemberian ektrak etanol daun kemangi dengan konsentrasi 200mg/mL sebanyak 5µl adalah 10.2mm (4).
Aktivitas antibakteri ini dikarenakan zat aktif yang terkandung di dalam daun
kemangi antara lain eugenol, linolool, flavonoid, saponin dan tanin. eugenol yang dapat menyebabkan kerusakan membran sel bakteri dan dapat menstimulasi kebocoran ion kalium sehinga terjadi kematian sel bakteri (3). Eugenol juga dapat menghambat aktivitas enzim ATPase sehingga energi yang dibutuhkan untuk perbaikan sel bakteri tidak terbentuk (5).
Aktivitas antibakteri linalool dengan cara merusak membran sel bakteri, menghambat enzim bakteri dan menekan translasi dari suatu produk gen tertentu (6). Flavonoid menghambat sintesis asam nukleat, menghambat metabolisme energi bakteri dan merusak fungsi membran sitoplasma (7). Kerusakan membran sel dikarenakan ion hidrogen dari flavonoid menyerang gugus polar (fosfat) membran sel, sehingga fosfolipid akan terurai menjadi gliserol, asam karboksilat dan asam fosfat (8). (I) Ekstrak/AB (J) Ekstrak/ AB Mean Difference (I-J) Std.
Error Sig.
95% Confidence Interval Lower Bound Upper Bound 100%
75% 2.9833* .8898 .003 1.127 4.839
50% 4.4167* .8898 .000 2.561 6.273
Gentamisin -9.2833* .8898 .000 -11.139 -7.427
75%
100% -2.9833* .8898 .003 -4.839 -1.127
50% 1.4333 .8898 .123 -.423 3.289
Gentamisin -12.2667* .8898 .000 -14.123 -10.411
50%
100% -4.4167* .8898 .000 -6.273 -2.561
75% -1.4333 .8898 .123 -3.289 .423
Gentamisin -13.7000* .8898 .000 -15.556 -11.844
Gentamisin
100% 9.2833* .8898 .000 7.427 11.139
75% 12.2667* .8898 .000 10.411 14.123
Saponin meningkatkan permeabilitas membran sel dengan menurunkan tegangan
permukaan sehingga menyebabkan
keluarnya senyawa intraseluler. Tanin
bekerja menghambat enzim DNA
topoisomerase pada bakteri. Selain itu tanin juga mengambil substrat yang diperlukan untuk pertumbuhan mikroba atau tindakan langsung pada metabolisme mikroba melalui penghambatan fosforilasi oksidatif (9).
KESIMPULAN
Ekstrak etanol daun kemangi
(Ocimum Sanctum Linn) berefek
antimikroba terhadap Escherichia coli dan Staphylococcus aureus.
DAFTAR PUSTAKA
1. Departemen Kesehatan Republik
Indonesia. Materia Medika Indonesia Jilid VI Jakarta: Departemen Kesehatan Republik Indonesia; 1995.
2. Kumar A, Rahal A, Chakraborty S, Tiwari R, Latheef SK, Dhama K.
Ocimum sanctum (Tulsi): A Miracle Herb and Boon to Medical Science - A Review. International Journal of Agronomy and Plant Production. 2013; 4(7).
3. Khalid M, Yaqoob U, Rukhsana B. Antibacterial Activity of Essential Oil of Ocimum Sanctum L. Mycopathology. 2008; 6(1-2).
4. Prasannabalaji N, Muralitharan G, Sivanandan RN, Kumaran S, Pugazhvendan SR. Antibacterial Activities of Some Indian Traditional Plant Extract. Asian Pacific Journal of Tropical Disease. 2012.
5. Hyldgaard M, Mygind T, Meyer RL. Essential Oils in Food Presentation: Method of Action, Synergies, and Interactions with Food Matrics
Components. Front Microbiol. 2012; 3.
6. Soon-Nang P, Yun KL, Marcelo OF, Eugene C, Dongchun J, Joong-Ki K. Antimicrobial Effecy of Linalool and Alfa-terpineol Against Periodontopatic
and Cariogenic Bacteria. Anaerobe. 2012.
7. Cushnie TT, Lamb AJ. Antimicrobial Activity of Flavonoids. International Journal of Antimicrobial Agent. 2005.
8. Retnowati Y, Bialangi N, Posangi NW. Pertumbuhan Bakteri Staphylococcus aureus pada Media yang Diekspos dengan Infusa Daun Sambiloto (Andrographis paniculata). Saintek. 2011; 6.
41
DAFTAR PUSTAKA
Brooks, G. F., Carroll, K. C., Butel, J. S., & Morse, S. A. (2007). Jawetz, Melnick & Adelberg's Medical microbiology (24 ed.). New York: McGraw-Hill
Companies.
Brunton, L. L., Lazo, J. S., & Parker, K. L. (2006). Goodman Gilman's Pharmacological Basis of Therapeutic. New york: McGraw-Hill.
ChemicalBook. (2010). Retrieved september 15, 2014, from http://www.chemicalbook.com/ChemicalProductProperty_EN_CB7208326. htm.
Cushnie, T. T., & Lamb, A. J. (2005). Antimicrobial Activity of Flavonoids. International Journal of Antimicrobial Agent .
Departemen Farmakologi dan Terapeutik FK UI. (2007). Pengantar Antimikroba. In R. Setiabudy, Farmakologi dan Terapi (5th ed.). Jakarta: Balai Penerbit FKUI.
DepkesRI. (1995). Materia Medika Indonesia Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia.
Farjam, M. F. (2012). Comparative study of the antimicrobial activity of essential oil and two different extract from Salvia urmiensis Bunge. Asian Pacific Journal of Tropical Biomedicine .
Gunawan, D., & Mulyani, S. (2002). Ilmu Obat Alam (Farmakognosi). Jakarta: Swadaya.
Gupta, B., Kumar, V., & Mallaiah, S. (2013). Assesment of Antimikrobial Activity of Various Concentration of Commercially Available Tulsi (Ocimum Sanctum) Powder Against Streptococcus Mutans. Open Jurnal of Dentistry and Oral Medicine , 2, 14-24.
Harborne, J. B. (1996). Metode Fitokimia: Cara Menganalisis Tanaman. Bandung: ITB.
42
Kayser, F. H., Bienz, K. A., Eckert, J., & Zinkernagel, R. M. (2005). Medical Microbiology. New York: Thieme.
Khalid, M., Yaqoob, U., & Rukhsana, B. (2008). Antibacterial Activity of Essential Oil of Ocimum Sanctum L. Mycopath (2008) 6(1&2): 63-65 , 64. Kumar, A., Rahal, A., Chakraborty, S., Tiwari, R., Latheef, S. K., & Dhama, K.
(2013). Ocimum sanctum (Tulsi): A Miricle Herb and Boon to Medical Science - A Review. Internatonal Journal of Agronomy and Plant Production , 4 (7), 1580-1589.
Mannito, P. (1981). Biosynthesis of Natural Product. Horwood: Chicster Ellis. Markham, K. R. (1988). Cara mengidentifikasi Flavonoid. Bandung: ITB.
Pattanayak, P., Behera, P., Das, D., & Panda, S. K. (2010). Ocimum Sanctum Linn. A Reservoir Plant For Therapeutic Application. Pharmacogn Rev , 7. Pelczar, M., & Chan. (1984). Dasar-Dasar Mikrobiologi. Jakarta: Penerbit
Universitas Indonesia Press.
Prasannabalaji, N., Muralitharan, G., Sivanandan, R. N., Kumaran, S., & Pugazhvendan, S. R. (2012). Antibacterial Activities of Some Indian Traditional Plant Extract. Asian Pasific Journal of Tropical Disease .
Retnowati, Y., Bialangi, N., & Posangi, N. W. (2011). Pertumbuhan Bakteri Staphylococcus aureus Padamedia yang dia Ekspos dengan Infusa Daun Sambiloto (Andrographis Paniculata). Saintek , 6.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi (6 ed.). (P. Kosasih, Trans.) Bandung: ITB.
Royal Society of Chemisrty. (2014). Retrieved september 15, 2014, from http://www.chemspider.com/Chemical-Structure.13849981.html.
Scalbert, A. (1991). Antimicrobial Properties of Tannins. Phytochemistry , 30. Soon-Nang, P., Yun, K. L., Marcelo, O. F., Eugene, C., Dongchun, J., &
Joong-Ki, K. (2012). Antimicrobial Effecy of Linalool and Alfa-terpineol Against Periodontopatic and Cariogenic Bacteria. Anaerobe .
Sudarsono, Gunawan, D., Wahyuono, S., Donatus, I. A., & Purnomo. (2002). Tumbuhan Obat II (hasil penelitian, sifat-sifat dan penggunaannya.
43