HASIL DAN PEMBAHASAN
Regulasi prebiotik dan probiotik
Regulasi pangan fungsional yang mengatur probiotik, prebiotik dan sinbiotik yang berlaku di Amerika Serikat, Jepang, Uni Eropa, Australia dan Indonesia berbeda antara negara yang satu dengan negara lainnya meliputi kelompok, definisi, level konsentrasi, klaim, label dan ketentuan persyaratan keamanan. Pengelompokan prebiotik dan probiotik
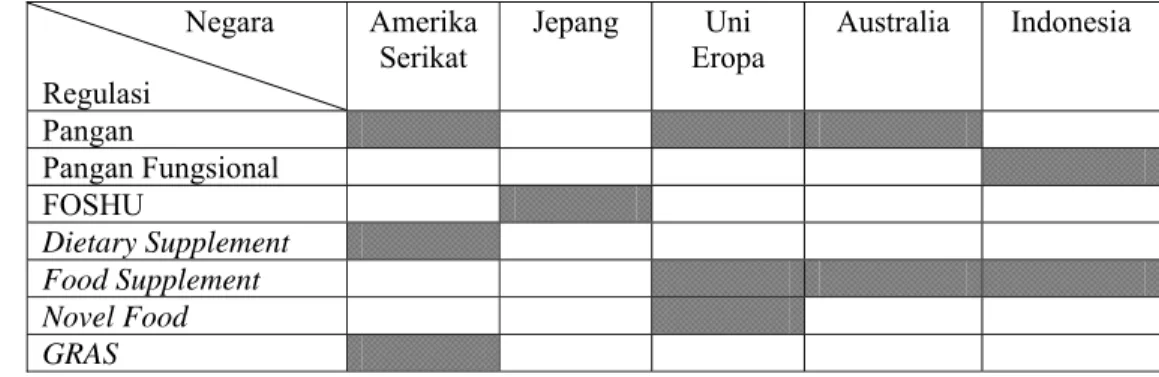
Regulasi prebiotik dan probiotik di beberapa negara seperti Amerika Serikat, Jepang, Uni Eropa, Australia dan Indonesia dimasukan dalam kelompok pangan fungsional, FOSHU, dietary supplement/food supplement, novel food dan obat, tergantung dari cara penggunaan dan bentuk sediaan, dapat dilihat pada Tabel 8.
Tabel 8 Kelompok yang mengakomodasi prebiotik, probiotik dan sinbiotik dalam regulasi beberapa negara
Prebiotik dan probiotik di negara Amerika, Jepang, Uni Eropa, Australia dan Indonesia dimasukan ke dalam kelompok pangan karena terminologi pangan (konvensional), pangan fungsional, FOSHU dan pangan rekayasa genetika (novel food) dapat dikelompokkan ke dalam pangan. Dietary supplement dan suplemen makanan dapat dikelompokkan dalam suplemen makanan karena bentuk sediaannya adalah kapsul, tablet, kaplet yang berbeda dengan pangan pada umumnya. Pengelompokan pangan fungsional yang mengatur probiotik dan
Negara Regulasi Amerika Serikat Jepang Uni Eropa Australia Indonesia Pangan Pangan Fungsional FOSHU Dietary Supplement Food Supplement Novel Food GRAS
probiotik berbeda antara satu negara dengan negara lain sesuai cara penggunaan dan bentuk sediaannya sesuai dengan pangan pada umumnya.
Definisi Prebiotik dan Probiotik
Umumnya definisi yang digunakan merujuk pendapat para ahli yang telah dipublikasikan. Amerika Serikat dan Australia menggunakan pendapat Gibson dan Roberfroid (1995) yang mendefinisikan prebiotik sebagai bahan makanan yang tidak dapat dicerna yang menguntungkan bagi inang dengan merangsang secara selektif pertumbuhan dan atau aktifitas satu atau sejumlah jenis bakteri yang berada dalam kolon sehingga dapat meningkatkan kesehatan inangnya. Definisi probiotik yang dirujuk di Amerika Serikat adalah sebagai bakteri hidup dalam kultur tunggal atau campuran yang mempunyai manfaat bagi kesehatan manusia (Salminen 1998). Australia, Jepang, Uni Eropa dan Indonesia tidak mengatur ketentuan tentang definisi prebiotik, probiotik, dan sinbiotik. Tidak ada standar definisi resmi yang mengatur prebiotik dan probiotik di negara Amerika Serikat, Uni Eropa, Jepang, Australia dan Indonesia. Sementara itu, FAO (2007) telah mendefinisikan prebiotik sebagai makanan yang tidak dapat dicerna yang menguntungkan dengan merangsang secara selektif pertumbuhan aktifitas sejumlah bakteri dalam kolon sehingga meningkatkan kesehatan. Sedangkan definisi probiotik adalah organisme hidup yang apabila dikonsumsi dalam jumlah cukup dapat memberi manfaat bagi kesehatan (FAO/WHO 2002) dan sinbiotik adalah suatu kombinasi prebiotik dan probiotik.
Jenis dan Konsentrasi
Konsentrasi prebiotik berbeda antara satu negara dengan lainnya tergantung jenis prebiotik dan tujuan penggunaannya misalnya untuk anak atau dewasa. Amerika Serikat (FDA) telah mengatur secara rinci konsentrasi prebiotik berdasarkan jenis prebiotik seperti inulin untuk anak < 1 tahun adalah 6 g/hari, anak > 1 tahun adalah 15 g/hari dan lebih atau sama dengan 2 tahun adalah 20 g/hari sedangkan dewasa 40-70 g/hari. Sedangkan konsentrasi FOS untuk anak kurang dari 1 tahun adalah 4,2 g/hari, untuk penggunaan umum adalah 20 g/hari namun tidak untuk
penggunaan susu bayi. Tabel 9 menunjukkan level konsentrasi prebiotik, probiotik dan sinbiotik di beberapa negara.
Tabel 9. Level konsentrasi prebiotik, probiotik dan sinbiotik dalam regulasi beberapa negara
Australia (draft) No Jenis AS Uni Eropa Jepang Indonesia Susu
bayi Mak. bayi 1 Prebiotik - 0,8g-100 mL - 10 g/hari a. Inulin <1thn=6g/hari, >1thn=15g/hari, >2thn=20g/hari Dewasa=40-70g/hari - - - 0,8 g/100 mL, 0,8 g/100 mL b. FOS <1 th=4,2 g/hari umum=20g/hari (tidak susu bayi)
2,5-10g/hari - - - -
c. GOS Ditunda 2,5g/hari - - 0,8g/10
0 mL 0,8 g/100 mL Kombinasi - 10% oligogalactos yl-lactose & 90% oligofructosyl -saccharose - - Inulin & GOS 0,8/100 mL Inulin dan GOS : 0,8 g/100 mL 2 Probiotik - - >107 CFU/ g 106-108 CFU/g 106-109 - B.lactis str Bb14 & S. thermophylus str Th4 106-108 CFU/g (susu bayi) L. acidophilus, L. Lactis, P. Acidilactici 106-108 cfu/g 3 Sinbiotik - - - -
Uni Eropa telah mengatur ketentuan penggunaan inulin adalah 0,8 g/hari, FOS adalah 2,5-10 g/hari, GOS 2,5 g/hari bahkan untuk penggunaan kombinasi diatur 10% oligogalactosyl-lactose dan 90% oligofructosyl saccharose. Australia (FSANZ) sedang mengajukan usulan regulasi penggunaan inulin, GOS dalam
bentuk tunggal dan kombinasi pada susu bayi sampai dengan 0,8g/100 mL dan penggunaan inulin dan GOS dalam bentuk tunggal dan kombinasi pada makanan bayi mencapai 0,8 g/100 ml. Sedangkan pada regulasi Indonesia masih mengatur penggunaan prebiotik secara umum yaitu 10 g/hari, belum secara rinci berdasarkan jenis prebiotik dalam bentuk tunggal maupun dalam bentuk kombinasi, seperti ditunjukkan pada Tabel 9.
Belum ada konsensus internasional mengenai dosis probiotik, namun dosis minimum yang dianjurkan adalah 106-109 CFU/hari dan sangat bergantung dari jenis strain mikroorganismenya. Sedangkan untuk Sinbiotik juga belum ada ketentuan yang mengatur tentang level konsentrasi yang digunakan.
Klaim
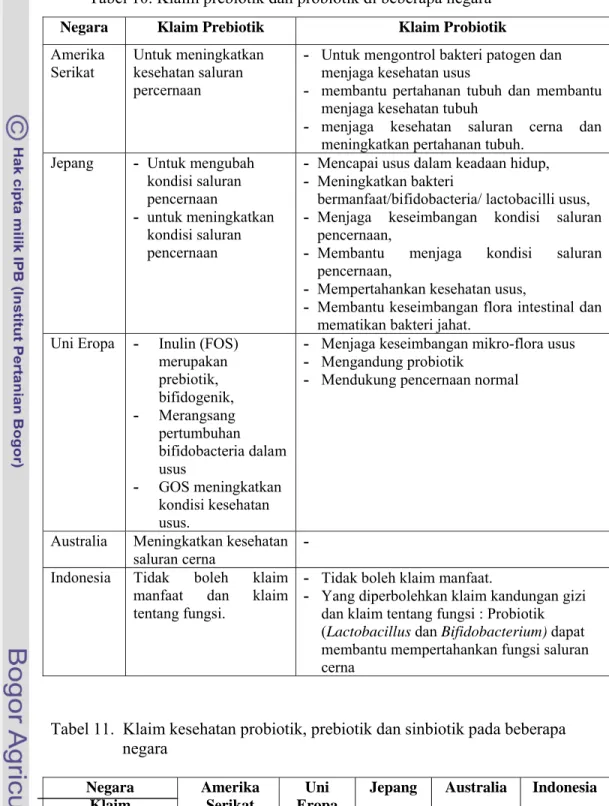
Saat ini di beberapa negara hanya klaim kesehatan umum yang diperbolehkan pada makanan yang mengandung probiotik. Umumnya klaim yang digunakan adalah klaim tentang kandungan dan klaim tentang fungsi, seperti yang ditunjukkan pada Tabel 10.
Klaim manfaat kesehatan di Amerika Serikat dan Jepang diizinkan namun di Jepang klaim manfaat kesehatan harus mendapat persetujuan dari Departemen Kesehatan sedangkan di Amerika tidak perlu mendapat izin dari FDA. Klaim manfaat kesehatan yang disetujui di Jepang untuk probiotik diantaranya adalah mencapai usus dalam keadaan hidup, meningkatkan bakteri bermanfaat/Bifidobacteria/ Lactobacilli usus, menjaga keseimbangan kondisi saluran pencernaan, membantu menjaga kondisi saluran pencernaan, mempertahankan kesehatan usus, membantu keseimbangan flora intestinal dan mematikan bakteri jahat. Klaim manfaat kesehatan di Uni Eropa dilarang karena ketentuan yang berlaku melarang penggunakan klaim pengobatan pada label pangan seperti mengobati atau mencegah penyakit karena menjurus kepada khasiat obat, seperti ditunjukkan pada Tabel 11.
Tabel 10. Klaim prebiotik dan probiotik di beberapa negara Negara Klaim Prebiotik Klaim Probiotik Amerika
Serikat
Untuk meningkatkan kesehatan saluran percernaan
- Untuk mengontrol bakteri patogen dan menjaga kesehatan usus
- membantu pertahanan tubuh dan membantu menjaga kesehatan tubuh
- menjaga kesehatan saluran cerna dan meningkatkan pertahanan tubuh.
Jepang - Untuk mengubah kondisi saluran pencernaan
- untuk meningkatkan kondisi saluran pencernaan
- Mencapai usus dalam keadaan hidup, - Meningkatkan bakteri
bermanfaat/bifidobacteria/ lactobacilli usus, - Menjaga keseimbangan kondisi saluran
pencernaan,
- Membantu menjaga kondisi saluran pencernaan,
- Mempertahankan kesehatan usus,
- Membantu keseimbangan flora intestinal dan mematikan bakteri jahat.
Uni Eropa - Inulin (FOS) merupakan prebiotik, bifidogenik, - Merangsang pertumbuhan bifidobacteria dalam usus - GOS meningkatkan kondisi kesehatan usus.
- Menjaga keseimbangan mikro-flora usus - Mengandung probiotik
- Mendukung pencernaan normal
Australia Meningkatkan kesehatan saluran cerna - Indonesia Tidak boleh klaim
manfaat dan klaim tentang fungsi.
- Tidak boleh klaim manfaat.
- Yang diperbolehkan klaim kandungan gizi dan klaim tentang fungsi : Probiotik (Lactobacillus dan Bifidobacterium) dapat membantu mempertahankan fungsi saluran cerna
Tabel 11. Klaim kesehatan probiotik, prebiotik dan sinbiotik pada beberapa negara Negara Klaim Amerika Serikat Uni Eropa
Jepang Australia Indonesia
Klaim Kesehatan
-Diizinkan V V
Sebaliknya FAO/WHO merekomendasikan penggunaan klaim manfaat kesehatan khusus pada makanan yang mengandung probiotik bila didukung dengan bukti ilmiah seperti klaim khusus yang menyatakan bahwa probiotik dapat menurunkan insiden terjadinya diare rotavirus pada bayi akan lebih informatif bagi konsumen daripada klaim umum yang menyatakan dapat meningkatkan kesehatan saluran pencernaan. Hal ini lebih sesuai dengan Codex General Guidelines on Claims (CAC/GL1-1979 (Rev. 1-1991) untuk mencegah informasi yang menyesatkan.
Di Jepang klaim kesehatan untuk prebiotik (Oligosaccharides, Raffinose, Lactolose) yang disetujui adalah untuk meningkatkan kondisi saluran pencernaan atau dapat meningkatkan kondisi saluran pencernaan. Berbeda dengan di Indonesia klaim prebiotik yang disetujui adalah hanya klaim kandungan gizi, sedangkan klaim fungsi inulin sebagai serat pangan boleh mencantumkan klaim fungsi yaitu dapat membantu menyehatkan saluran pencernaan (BPOM RI 2005).
Label
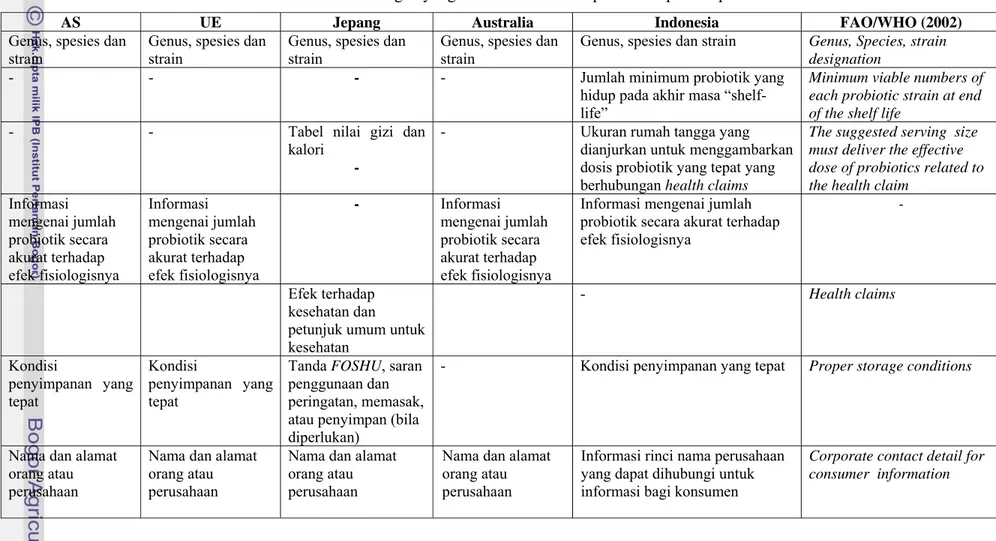
US the Nutrition Labelling and Education Act 1991 mengizinkan makanan klaim kesehatan tanpa persetujuan Food and Drug Administration (FDA). Sementara The Federal Trade Commission (FTC) berwenang mengatur iklan. Ketentuan persyaratan label pangan yang mengandung probiotik di Indonesia hampir sama dengan yang direkomendasikan FAO/WHO (2002). Hal ini menunjukkan pada saat penyusunan ketentuan probiotik, Indonesia mengacu pada rekomendasi FAO/WHO kecuali persyaratan klaim manfaat kesehatan, ditunjukkan pada Tabel 12. Yang menarik pada keterangan yang harus dicantumkan pada label di Indonesia adalah ukuran rumah tangga yang dianjurkan untuk menggambarkan dosis probiotik yang tepat yang berhubungan manfaat terhadap kesehatan, padahal pada peraturan tersebut dinyatakan bahwa label dan iklan tidak boleh mencantumkan klaim tentang manfaat terhadap kesehatan. Hal ini menunjukan Indonesia dalam menyusun peraturan mengacu pada ketentuan WHO yang seharusnya disesuaikan dengan ketentuan Indonesia yang melarang mencantumkan klaim manfaat terhadap kesehatan.
Tabel 12. Keterangan yang harus dicantumkan pada label produk probiotik
AS UE Jepang Australia Indonesia FAO/WHO (2002)
Genus, spesies dan strain
Genus, spesies dan strain
Genus, spesies dan strain
Genus, spesies dan strain
Genus, spesies dan strain Genus, Species, strain
designation
- - - - Jumlah minimum probiotik yang
hidup pada akhir masa “shelf-life”
Minimum viable numbers of each probiotic strain at end of the shelf life
- - Tabel nilai gizi dan
kalori -
- Ukuran rumah tangga yang
dianjurkan untuk menggambarkan dosis probiotik yang tepat yang berhubungan health claims
The suggested serving size must deliver the effective dose of probiotics related to the health claim
Informasi mengenai jumlah probiotik secara akurat terhadap efek fisiologisnya Informasi mengenai jumlah probiotik secara akurat terhadap efek fisiologisnya - Informasi mengenai jumlah probiotik secara akurat terhadap efek fisiologisnya
Informasi mengenai jumlah probiotik secara akurat terhadap efek fisiologisnya
-
Efek terhadap kesehatan dan petunjuk umum untuk kesehatan - Health claims Kondisi penyimpanan yang tepat Kondisi penyimpanan yang tepat
Tanda FOSHU, saran penggunaan dan peringatan, memasak, atau penyimpan (bila diperlukan)
- Kondisi penyimpanan yang tepat Proper storage conditions
Nama dan alamat orang atau perusahaan
Nama dan alamat orang atau perusahaan
Nama dan alamat orang atau perusahaan
Nama dan alamat orang atau perusahaan
Informasi rinci nama perusahaan yang dapat dihubungi untuk informasi bagi konsumen
Corporate contact detail for consumer information
Sementara itu untuk keterangan yang harus dicantumkan pada produk prebiotik sesuai dengan ketentuan label pangan yang umum berlaku.
Ketentuan Evaluasi Keamanan dan Manfaat
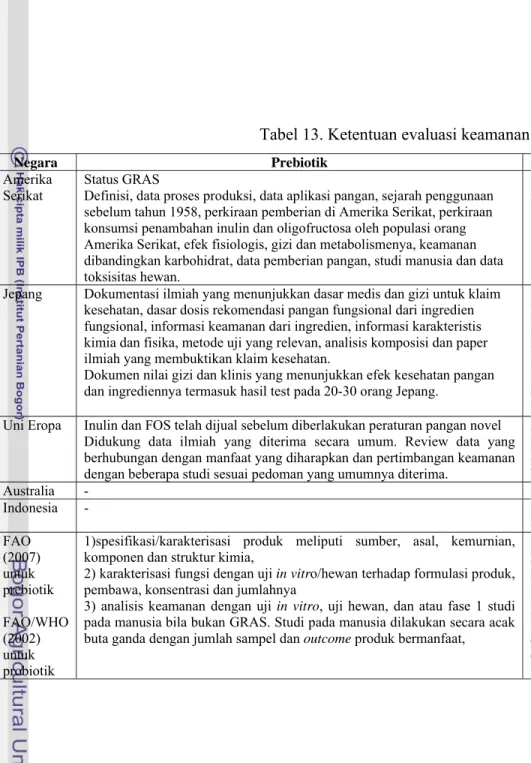
Persyaratan penting untuk persetujuan FOSHU di Jepang adalah manfaat yang dibuktikan secara ilmiah termasuk uji klinis, aman dikonsumsi dan analisa komponen aktif. Di Amerika Serikat, berdasarkan the US Federal Food Drug and Cosmetic Act, status GRAS dengan persyaratan senyawa atau mikroorganisme tersebut mempunyai sejarah keamanan digunakan dalam pangan sebelum 1 Januari 1958 atau telah diakui oleh para ahli karena aman. Uni Eropa telah mengembangkan pedoman untuk mengatur pangan fungsional dan pangan novel. Di peraturan novel food Uni Eropa diperlukan analisis keamanan dan studi gizi tambahan. Mikroorganisme yang tidak digunakan secara tradisional dalam produksi pangan dipertimbangkan sebagai pangan novel dan diatur dalam Regulation (EC) No. 258/97.
Aplikasi yang diperlukan produsen untuk FOSHU di Jepang diantaranya adalah dokumentasi ilmiah yang menunjukkan dasar medis dan gizi untuk klaim kesehatan, dasar dosis rekomendasi pangan fungsional dari ingredien fungsional, informasi yang menunjukkan keamanan dari ingredien, informasi karakteristis kimia dan fisika, metode uji yang relevan, analisis komposisi dan paper ilmiah yang membuktikan klaim kesehatan. Disamping itu diperlukan dokumentasi yang menunjukkan bukti klinik dan gizi dari efek fungsional produk untuk mempertahankan kesehatan, dokumentasi yang menunjukkan bukti klinik dan gizi dari jumlah yang digunakan pada produk atau komponen fungsionalnya. Tabel 13 menunjukkan ketentuan evaluasi keamanan dan manfaat di beberapa negara.
Tabel 13. Ketentuan evaluasi keamanan dan manfaat di beberapa negara
Negara Prebiotik Probiotik
Amerika
Serikat Status GRAS Definisi, data proses produksi, data aplikasi pangan, sejarah penggunaan sebelum tahun 1958, perkiraan pemberian di Amerika Serikat, perkiraan konsumsi penambahan inulin dan oligofructosa oleh populasi orang Amerika Serikat, efek fisiologis, gizi dan metabolismenya, keamanan dibandingkan karbohidrat, data pemberian pangan, studi manusia dan data toksisitas hewan.
Status GRAS dengan persyaratan senyawa atau mikroorganisme tersebut mempunyai sejarah keamanan digunakan dalam pangan sebelum 1 Januari 1958 atau telah diakui oleh para ahli karena aman.
Jepang Dokumentasi ilmiah yang menunjukkan dasar medis dan gizi untuk klaim kesehatan, dasar dosis rekomendasi pangan fungsional dari ingredien fungsional, informasi keamanan dari ingredien, informasi karakteristis kimia dan fisika, metode uji yang relevan, analisis komposisi dan paper ilmiah yang membuktikan klaim kesehatan.
Dokumen nilai gizi dan klinis yang menunjukkan efek kesehatan pangan dan ingrediennya termasuk hasil test pada 20-30 orang Jepang.
Dokumentasi ilmiah yang menunjukkan dasar medis dan gizi untuk klaim kesehatan, dasar dosis rekomendasi pangan fungsional dari ingredien fungsional, informasi keamanan dari ingredien, informasi karakteristis kimia dan fisika, metode uji yang relevan, analisis komposisi dan paper ilmiah yang membuktikan klaim kesehatan.
Dokumen nilai gizi dan klinis yang menunjukkan efek kesehatan pangan dan ingrediennya termasuk hasil test pada 20-30 orang Jepang.
Uni Eropa Inulin dan FOS telah dijual sebelum diberlakukan peraturan pangan novel Didukung data ilmiah yang diterima secara umum. Review data yang berhubungan dengan manfaat yang diharapkan dan pertimbangan keamanan dengan beberapa studi sesuai pedoman yang umumnya diterima.
Analisis keamanan dan studi gizi tambahan (Novel food). Mikroorganisme yang tidak digunakan secara tradisional dalam produksi pangan dipertimbangkan sebagai pangan novel dan diatur dalam Regulation (EC) No. 258/97.
Australia - -
Indonesia - Hasil pengujian manfaat probiotik dilakukan berdasarkan uji coba pada orang Indonesia minimal 20 orang
FAO (2007) untuk prebiotik FAO/WHO (2002) untuk probiotik
1)spesifikasi/karakterisasi produk meliputi sumber, asal, kemurnian, komponen dan struktur kimia,
2) karakterisasi fungsi dengan uji in vitro/hewan terhadap formulasi produk, pembawa, konsentrasi dan jumlahnya
3) analisis keamanan dengan uji in vitro, uji hewan, dan atau fase 1 studi pada manusia bila bukan GRAS. Studi pada manusia dilakukan secara acak buta ganda dengan jumlah sampel dan outcome produk bermanfaat,
1) identifikasi strain meliputi genus, spesies, strain atau deposit strain dari koleksi kultur internasional,
2) karakterisasi fungsi dengan uji in vitro dan uji hewan
3) analisis keamanan secara in vitro dan atau uji hewan dan fase 1 studi pada manusia secara acak buta ganda dan kontrol placebo fase 2 studi manusia atau desain lain yang mendekati dengan ukuran sampel dan outcome yang mendekati untuk menguji bila strain/produk bermanfaat 4) fase 3 uji manfaat untuk membandingkan probiotik dengan standar
Sementara prosedur klaim prebiotik (FAO 2007) dilakukan dengan 1) spesifikasi/karakterisasi produk meliputi sumber, asal, kemurnian, komponen dan struktur kimia, 2) karakterisasi fungsi dengan uji in vitro/hewan terhadap formulasi produk, pembawa, konsentrasi dan jumlahnya 3) analisis keamanan dengan uji in vitro, uji hewan, dan atau fase 1 studi pada manusia bila bukan GRAS.
Studi pada manusia dilakukan secara acak buta ganda dengan jumlah sampel dan outcome produk bermanfaat, bukti minimum korelasi outcome fisiologi dan modulasi mikrobiota pada tempat yang spesifik. Studi independen kedua lebih disukai untuk mengkonfirmasi hasil.
Pertimbangan keamanan bakteri harus mempunyai sejarah aman digunakan sepanjang rute penggunaan direkomendasikan, frekuensi, tidak memproduksi metabolit pada produk akhir yang berbahaya, resisten antibiotik, sensitifitas pada terapi antibiotik dan spesies yang menghasilkan toksin mamalia atau hemolisin.
Untuk evaluasi probiotik menurut FAO/WHO (2002) dilakukan dengan 1) identifikasi strain meliputi genus, spesies, strain atau deposit strain dari koleksi kultur internasional, 2) karakterisasi fungsi dengan uji in vitro dan uji hewan 3) analisis keamanan secara in vitro dan atau uji hewan dan fase 1 studi pada manusia secara acak buta ganda dan kontrol placebo fase 2 studi manusia atau desain lain yang mendekati dengan ukuran sampel dan outcome yang mendekati untuk menguji bila strain/produk bermanfaat 4) fase 3 uji manfaat untuk membandingkan probiotik dengan standar.
Indonesia mempersyaratkan hasil pengujian manfaat probiotik dilakukan berdasarkan uji coba pada orang Indonesia minimal 20 orang. Sementara Jepang untuk persetujuan produk probiotik dibutuhkan dokumen nilai gizi dan klinis yang menunjukkan efek kesehatan pangan dan ingrediennya termasuk hasil test pada 20-30 orang Jepang.
Analisis Gap Regulasi antar Negara
Setelah melakukan perbandingan dan analisa atas informasi yang disajikan di atas, dapat diuraikan sebagai berikut :
1. Berdasarkan regulasi di Amerika Serikat, Uni Eropa, Australia, Jepang, dan Indonesia, pengelompokan prebiotik dan probiotik dapat dimasukan sebagai pangan meskipun istilah yang digunakan berbeda seperti pangan konvensional, pangan fungsional, FOSHU dan pangan rekayasa genetika (novel food). Disamping itu, prebiotik dan probiotik dapat juga termasuk dalam kelompok supplemen seperti dietary supplement dan food supplemen. Adanya perbedaan tersebut menyebabkan regulasi yang mengatur prebiotik, probiotik dan sinbiotik juga berbeda tergantung cara penggunaan dan bentuk sediaannya. Pelaku usaha yang akan melakukan ekspor atau impor produk mengandung prebiotik, probiotik dan sinbiotik tentunya harus menyesuaikan dan memenuhi ketentuan dan persyaratan yang berlaku di negara tersebut. 2. Berdasarkan regulasi di Amerika Serikat, Uni Eropa, Australia dan Jepang,
ketentuan prebiotik telah diatur secara spesifik khususnya jenis dan konsentrasi prebiotik yang digunakan pada makanan. Sedangkan regulasi di Indonesia, ketentuan mengenai prebiotik diatur secara umum.
Regulasi di keempat negara telah mengatur secara spesifik jenis prebiotik yang digunakan seperti Inulin, Fructo-oligosaccarides (FOS), dan Galacto-oligosaccarides (GOS) bila ditambahkan ke dalam makanan, bahkan Amerika Serikat telah mengatur konsentrasi jenis prebiotik berdasarkan usia secara spesifik untuk anak<1tahun, anak>1tahun, anak>2 tahun dan dewasa. Sementara Australia sedang mempertimbangkan status regulasi dari inulin, fructo-oligosaccharides (FOS) dan GOS serta kombinasinya ditambahkan pada pangan umumnya dan pangan tujuan khusus seperti untuk bayi dan anak kecil, yang sebelumnya dilarang digunakan. Sedangkan regulasi di Indonesia tidak spesifik jenis prebiotik yang diizinkan seperti Fructo-oligosaccarides (FOS), Galacto-oligosaccarides (GOS) dan inulin. Adanya kesenjangan regulasi ini akan berdampak bagi petugas dalam melakukan pengawasan pre-market dan post-pre-market produk pangan yang mengandung jenis prebiotik yang spesifik seperti inulin, FOS dan GOS karena regulasi pangan fungsional di Indonesia yang diacu tidak menyebutkan secara spesifik jenis dan konsentrasinya. Dampak negatif juga akan dirasakan oleh pelaku usaha yang
akan melakukan perdagangan (ekspor/impor) produk pangan prebiotik ke Amerika Serikat karena masalah penggunaan GOS yang masih ditunda dan Australia karena pelarangan penambahan inulin, FOS dan GOS pada pangan khusus sementara di negara lain diijinkan beredar. Hal ini akan menyebabkan terjadinya hambatan perdagangan sehingga perlu diharmonisasikan dengan praktek perdagangan internasional sehingga akan menurunkan hambatan perdagangan.
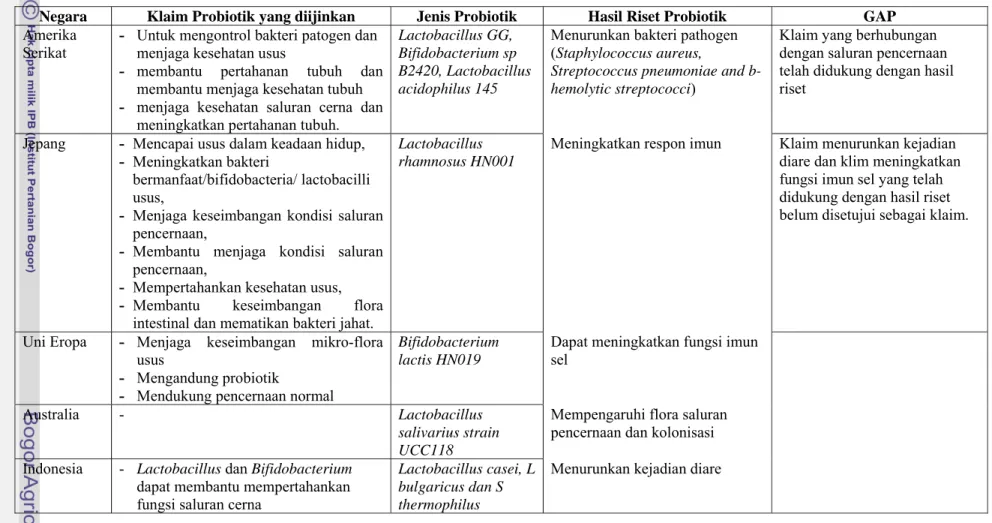
3. Berdasarkan regulasi di Amerika Serikat, Uni Eropa, Australia dan Jepang, klaim yang diijinkan digunakan untuk prebiotik umumnya klaim tentang kandungan gizi dan klaim tentang fungsi. Regulasi di Amerika Serikat dan Jepang mengijinkan klaim manfaat kesehatan sementara di Uni Eropa dilarang. Sementara itu Peraturan Teknis Ketentuan Pokok Pangan Fungsional (BPOMRI 2005) yang berlaku di Indonesia hanya mengizinkan klaim kandungan gizi dan melarang mencantumkan klaim fungsi dan klaim tentang manfaat kesehatan. Tabel 14 menunjukkan gap regulasi antar negara dengan hasil riset prebiotik. Sedangkan ketentuan inulin sebagai serat pangan di Indonesia dapat mencantumkan klaim fungsi yaitu dapat membantu menyehatkan saluran pencernaan. Regulasi di Uni Eropa dan Jepang membolehkan klaim fungsi inulin dan GOS untuk meningkatkan kondisi saluran pencernaan dan merangsang pertumbuhan bifidobacteria dalam usus dan mendukung kondisi kesehatan usus. Hal ini sesuai dengan hasil riset yang telah dilakukan secara in vitro, in vivo dan pada manusia yang menunjukkan efek dari penggunaan prebiotik yaitu inulin (Kapiki et al. 2007), GOS dalam bentuk tunggal (Ben 2004) maupun kombinasi dengan inulin dalam ratio 9:1 (Fanaro et al. 2005) dapat meningkatkan jumlah mikroorganisme Bifidobacteria dan Lactobacilli. Adanya ketentuan yang berbeda untuk klaim fungsi untuk prebiotik dan serat pangan di Indonesia perlu mendapat perhatian dari pihak yang terkait agar tidak terjadi standar ganda yang dapat membingungkan pengawas atau pelaku usaha. Tabel 14 menunjukkan gap regulasi antar negara dengan hasil riset prebiotik.
Tabel 14. Gap regulasi antar negara dengan hasil riset prebiotik Negara Klaim Prebiotik
yang diijinkan Jenis Prebio -tik Hasil Riset Prebiotik GAP Amerika Serikat Untuk meningkatkan kesehatan saluran pencernaan GOS Jumlah Bifidobacteria dan Lactobacilli meningkat Klaim yang diijinkan telah didukung dengan hasil riset Jepang − Untuk mengubah kondisi saluran pencernaan − untuk meningkatkan kondisi saluran pencernaan FOS − Menurunkan Ph medium − Merangsang populasi bakteri instestinal, − Meningkatkan penyerapan Ca, Mg, dan Phosphat Klaim meningkatkan penyerapan Ca, Mg dan Phosphat belum diizinkan walaupun telah didukung hasil riset
Uni Eropa - Inulin (FOS) merupakan prebiotik, bifidogenik, - Merangsang pertumbuhan bifidobacteria dalam usus - GOS meningkatkan kondisi kesehatan usus. Inulin - Menunjukkan sifat bifidogenik - Meningkatkan populasi Bifidobacteria Australia Meningkatkan kesehatan saluran cerna
Indonesia Tidak boleh klaim manfaat dan klaim tentang fungsi.
Indonesia
merupakan negara yang tidak boleh klaim fungsi walaupun telah ada hasil riset yang mendukung klaim fungsi tersebut
4. Berdasarkan regulasi di Uni Eropa, Australia, Jepang, dan Indonesia, ketentuan probiotik mengenai kultur probiotik dan konsentrasi telah diatur umum sementara regulasi di Amerika Serikat telah mengatur secara spesifik
strain mikroba dan konsentrasi yang digunakan pada suatu produk pangan. Dibandingkan dengan regulasi di Amerika Serikat yang secara spesifik telah membatasi penggunaan dan konsentrasi mikroorganisme pada produk tertentu seperti Bifidobacterium lactis B12 dan Streptococcus thermophilus Th4 pada produk susu bayi dengan konsentrasi 106-108 cfu/g maka regulasi di Indonesia belum menyebutkan strain probiotik secara spesifik namun masih secara umum Lactobacillus dan Bifidobacterium. Padahal menurut hasil riset probiotik secara in vitro, in vivo dan uji pada manusia menunjukkan bahwa strain spesifik probiotik dapat memberikan efek fungsional tertentu. Setiap probiotik mempunyai semua sifat fungsional tertentu karena ditentukan oleh strain tertentu contohnya L. salivarius strain UUCC118 dapat mempengaruhi flora saluran pencernaan. Namun demikian, dapat dicatat bahwa pada peraturan pangan fungsional yang ditetapkan di Indonesia telah mengakomodir bilamana proses seleksinya telah mencapai tingkat strain, sebaiknya spesifikasi dari strainnya diinformasikan karena efek fisiologi sangat terkait dengan jenis-jenis strain spesifik. Disamping itu pertimbangan keamanan merupakan persyaratan untuk membuktikan strain probiotik aman dan tanpa kontaminasi. Jumlah konsentrasi mikroba hidup yang harus terdapat pada produk probiotik masih belum ada konsensus internasional namun konsentrasi yang umumnya digunakan sebesar 106 sampai 109 CFU/g. Jumlah ini diharapkan dapat sampai usus dalam keadaan hidup sesuai kriteria probiotik agar organisme yang dikonsumsi dalam jumlah yang cukup dapat memberi manfaat bagi kesehatan (FAO/WHO 2001). Untuk itu ketentuan yang tegas tentang kultur mikroba dengan strain yang spesifik yang diijinkan di Indonesia diperlukan agar menjadi acuan petugas dalam melakukan pengawasan dan pelaku usaha dalam perdagangan. Tabel 15 menunjukkan gap regulasi antar negara dengan hasil riset probiotik.
Tabel 15. Gap regulasi antar negara dengan hasil riset probiotik
Negara Klaim Probiotik yang diijinkan Jenis Probiotik Hasil Riset Probiotik GAP
Amerika Serikat
- Untuk mengontrol bakteri patogen dan menjaga kesehatan usus
- membantu pertahanan tubuh dan membantu menjaga kesehatan tubuh - menjaga kesehatan saluran cerna dan
meningkatkan pertahanan tubuh.
Lactobacillus GG, Bifidobacterium sp B2420, Lactobacillus acidophilus 145
Menurunkan bakteri pathogen (Staphylococcus aureus,
Streptococcus pneumoniae and b-hemolytic streptococci)
Klaim yang berhubungan dengan saluran pencernaan telah didukung dengan hasil riset
Jepang - Mencapai usus dalam keadaan hidup,
- Meningkatkan bakteri
bermanfaat/bifidobacteria/ lactobacilli usus,
- Menjaga keseimbangan kondisi saluran pencernaan,
- Membantu menjaga kondisi saluran pencernaan,
- Mempertahankan kesehatan usus,
- Membantu keseimbangan flora intestinal dan mematikan bakteri jahat.
Lactobacillus rhamnosus HN001
Meningkatkan respon imun Klaim menurunkan kejadian
diare dan klim meningkatkan fungsi imun sel yang telah didukung dengan hasil riset belum disetujui sebagai klaim.
Uni Eropa - Menjaga keseimbangan mikro-flora
usus
- Mengandung probiotik
- Mendukung pencernaan normal
Bifidobacterium lactis HN019
Dapat meningkatkan fungsi imun sel
Australia - Lactobacillus
salivarius strain UCC118
Mempengaruhi flora saluran pencernaan dan kolonisasi Indonesia - Lactobacillus dan Bifidobacterium
dapat membantu mempertahankan fungsi saluran cerna
Lactobacillus casei, L bulgaricus dan S thermophilus
5. Menurut FAO/WHO (2002) untuk mengevaluasi probiotik diperlukan detail mengenai genus/spesies/strain, uji in vitro untuk menguji potensial probiotik, pertimbangan keamanan yang merupakan persyaratan untuk membuktikan strain probiotik aman dan tanpa kontaminasi, uji in vivo menggunakan hewan dan manusia dan klaim kesehatan serta label. Adanya persyaratan mengenai uji coba produk probiotik yang dibuktikan pada sejumlah orang seperti 20-30 orang di Jepang dan minimal 20 orang di Indonesia merupakan hambatan dalam perdagangan walaupun hal ini penting untuk mengetahui efeknya terhadap kesehatan. Regulasi di Indonesia belum ada pedoman yang mengatur prosedur klaim dan metode pengujian secara detail dilakukan baik untuk strain probiotik yang telah mempunyai sejarah penggunaan aman digunakan maupun strain probiotik yang merupakan inovasi baru.
6. Komponen yang diklaim sebagai prebiotik/probiotik harus dapat dikarakterisasi/identifikasi untuk setiap produk/strain meliputi sumber, asal, kemurnian, komposisi kimia, struktur dan karakterisasi fungsional dengan uji in vitro/uji hewan pada formulasi produk untuk mengevaluasi keamanan secara in vitro/hewan atau pada manusia secara acak, buta ganda dan dikontrol. Bukti korelasi antara outcome fisiologik yang dapat diukur dengan modulasi mikrobiota pada tempat tertentu (FAO 2007). Prosedur klaim yang dilakukan FAO (2007) dan FOSHU di Jepang dapat digunakan sebagai gambaran acuan bagi Indonesia untuk prosedur klaim. Inulin dan FOS telah diketahui mempunyai sejarah aman digunakan, pada dosis yang lebih tinggi dapat menyebabkan perasaan tidak nyaman pada saluran pencernaan pada beberapa studi orang dewasa yang mempunyai pengalaman. Adanya klaim-klaim probiotik yang membutuhkan studi klinis di Indonesia maka industri pangan dan pemerintah terkait membutuhkan pedoman lebih rinci untuk menerapkan peraturan pangan fungsional tersebut.
7. Berdasarkan regulasi di Amerika Serikat, Uni Eropa, Australia, dan Jepang, ketentuan tentang sinbiotik belum diatur, begitu juga dengan ketentuan di Indonesia. Untuk itu regulasi tentang sinbiotik perlu diatur untuk mengakomodasi produk-produk sinbiotik yang beredar di Indonesia.