OPTIMASI SUMBER NITROGEN PROBIOTIK KHAMIR R
1DAN R
110 DALAM MEDIUM EKSTRAK SINGKONG
(Optimization of Nitrogen Sources for R1 and R110 Yeast Probiotic
in Cassava Extracts)
IRAWAN SUGORO
Puslitbang Teknologi Isotop dan Radiasi BATAN
ABSTRACT
Production of ruminantia yeast probiotic was effected by nitrogen sources. The aims of experiment were to know sources, concentration and absorption of nitrogen for the growth of R1 and R110 yeast isolates. The nitrogen sources were urea and ammonium sulphate. This experiment were optimation of nitrogen sources (nitrogen concentration 0.125%, 0.25% and 0.5%), biomass production of the best nitrogen concentration, and measurement of nitrogen absorption. The results showed that the optimum of nitrogen concentration was 0.5% urea and 0.125% ammonium sulphate for R1, and 0.25% urea and 0.25% ammonium sulphate for R2. Prosentase of nitrogen absorption in ammonium sulphate was higher than urea, i.e. 30.93% for R1 and 8.81% for R110.
Key Words: Yeast Probiotic, Urea, Ammonium Sulphate and Ruminantia
ABSTRAK
Produksi probiotik khamir untuk ternak ruminansia dipengaruhi oleh sumber nitrogen. Tujuan dari percobaan ini adalah untuk mengetahui sumber, konsentrasi dan penyerapan nitrogen yang optimum untuk pertumbuhan isolat khamir R1 dan R110. Sumber nitrogen yang digunakan adalah urea dan ammonium sulfat. Penelitian ini terdiri dari optimasi medium pertumbuhan (konsentrasi nitrogen 0,125%, 0,25% dan 0,5%), produksi biomassa hasil medium perlakuan terbaik dan pengukuran penyerapan nitrogen. Hasil percobaan menunjukkan bahwa konsentrasi yang optimum untuk isolat khamir R1adalah urea 0,5% dan amonium sulfat 0,125% dan R110 adalah urea 0,25% dan amonium sulfat 0,25%. Persentase jumlah nitrogen yang diserap oleh sel khamir dengan amonium sulfat memberikan hasil yang lebih tinggi dibandingkan dengan urea, yaitu sebesar 20,93% untuk isolat khamir R1 dan 8,81% untuk isolat khamir R110.
Kata Kunci: Probiotik Khamir, Urea, Ammonium Sulfat, Ruminansia
PENDAHULUAN
Suplementasi kultur khamir pada pakan dapat meningkatkan produksi susu pada sapi dengan komposisi protein dan laktosa yang lebih tinggi (ALSHAIKH et al., 2002), menstimulasi nafsu makan, meningkatkan populasi mikroba menguntungkan, meningkat-kan kecernaan serat, menstabilmeningkat-kan pH rumen, meningkatkan produksi dan regulasi enzim pencernaan, produksi vitamin B untuk meningkatkan kecernaan dan nutrisi, menekan pertumbuhan bakteri patogen, menekan produksi ammonia, menginaktifkan toksin, dan
Isolat khamir yang digunakan adalah isolat khamir R1 hasil isolasi dari cairan rumen kerbau dan isolat mutan R110 hasil irradiasi sinar gamma. Produksi biomassa probiotik khamir dapat dilakukan dengan menggunakan bahan-bahan yang murah dan mudah didapat seperti singkong. Bahan ini memiliki kandungan karbohidrat tinggi sehingga cocok untuk pertumbuhan sel khamir tetapi memiliki kandungan nitrogen yang rendah (GRIFFIN, 1981). Oleh sebab itu perlu dilakukan optimasi dengan menggunakan berbagai sumber nitrogen serta berbagai konsetrasinya. Sumber nitrogen yang digunakan dalam percobaan ini
pelabelan karena ada yang bersifat isotop seperti N-15.
Hasil percobaan ini diharapkan dapat memberikan konsentrasi nitrogen yang optimum dari urea dan amonium sulfat terhadap pertumbuhan isolat khamir R1 dan R110, serta didapatkan jumlah nitrogen yang diserap oleh sel khamir yang akan digunakan untuk perunutan probiotik berlabel.
MATERI DAN METODE
Bahan. Isolat khamir yang digunakan adalah R1 yang merupakan mikroba khamir yang diisolasi dari cairan rumen kerbau serta isolat khamir R110 yang merupakan hasil iradiasi sinar gamma dengan dosis 10 Gy. Bahan percobaan yang digunakan adalah
Potato Dextrose Agar (PDA), Potato Dextrose broth (PDB), dan ekstrak singkong. Sterilisasi
bahan dilakukan dengan menggunakan autoklaf pada suhu 121°C dan tekanan 1 atm selama 15 menit.
Pembuatan kultur inokulum. Pembuatan kultur inokulum dilakukan dengan cara menginokulasikan isolat khamir R1 dan R110 sebanyak 1 öse ke dalam medium PDA miring, lalu diinkubasi selama 1 hari pada suhu kamar. Setelah 1 hari, isolat khamir R1 dan R110 dalam medium PDA miring diinokulasikan masing-masing sebanyak tiga öse ke dalam 30 ml medium PDB. Kemudian diinkubasi dalam
inkubator shaker selama 1 hari pada suhu
kamar, agitasi 120 rpm.
Optimasi medium perlakuan. Kultur inokulum diinokulasikan sebanyak 10% v/v (106 sel/ml), yaitu 1,2 ml untuk R
1 dan 0,34 ml untuk R110 ke dalam masing-masing medium perlakuan (Tabel 1), lalu diinkubasi dalam
inkubator shaker pada suhu kamar, agitasi 120
rpm. Hasilnya digunakan untuk perhitungan jumlah sel dan pengukuran pH, pengambilan dan pengukuran sampel dilakukan setelah diinkubasi pada jam ke 0, 5, 10, 17, dan 24. Perhitungan jumlah sel dilakukan dengan cara sampel dipipet sebanyak 0,1 ml dan dimasukkan ke dalam tabung eppendorf lalu ditambahkan 0,9 ml NaCl 0,85%, kemudian dihitung menggunakan kamar hitung Neubauer dengan bantuan mikroskop pembesaran 400x.
Pengukuran pH dilakukan dengan cara sebanyak 5 ml sampel dituang ke dalam tabung reaksi, kemudian diukur dengan menggunakan alat pH meter. Hasil dari optimasi medium perlakuan yang terbaik ini digunakan untuk produksi biomassa dan pengukuran penyerapan nitrogen.
Tabel 1. Komposisi medium perlakuan Komposisi Medium Ekstrak singkong Urea/ammo nium sulfat Asam laktat (ml) A 30 0,125 0,33 B 30 0,25 0,33 C 30 0,50 0,33 D 30 - 0,33
Produksi Biomassa. Kultur inokulum diinokulasikan sebanyak 10% v/v (106 sel/ml), yaitu 1,2 ml untuk R1 dan 0,34 ml untuk R110 ke dalam medium perlakuan terbaik kemudian diinkubasi selama 10 jam dan 24 jam dalam
inkubator shaker pada suhu kamar, agitasi 120
rpm. Lalu disentrifugasi pada 3000 rpm selama 10 menit, pelet yang diperoleh dikeringkan di oven pada suhu 60°C selama 1 hari.
Pengukuran Konsetrasi Nitrogen. Pelet hasil produksi biomassa ditempatkan dalam labu Kjeldahl ditambah 10 ml digestion
mixture lalu dipanaskan sampai bening dan
diencerkan dengan akuades 25 ml. Sampel diambil 5 ml dalam labu destilasi, ditambahkan 10 ml HCl 0,1 N, indikator PP (phenolphthalein) 3 tetes dan 15 ml NaOH 50%. Hasil destilasi ditampung sampai 50 ml kemudian dititrasi dengan NaOH 0,1 N sampai berubah warna dari jernih menjadi merah muda. Analisis data. Data dianalisis dengan menggunakan uji korelasi bivariat dan uji lanjut Spearman (P < 0,01) dengan bantuan program SPSS. Pembuatan kurva dilakukan dengan program Excel. Penghitungan % penyerapan N dilakukan dengan menggunakan rumus sebagai berikut:
% penyerapan = _ jumlah N dalam sel x 100 % jumlah N dalam medium
HASIL DAN PEMBAHASAN Optimasi urea sebagai sumber nitrogen
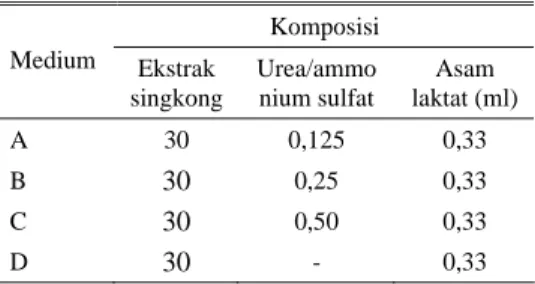
Pertumbuhan isolat khamir R1 dan R110 menunjukkan adanya perbedaan pola kurva pertumbuhan untuk masing-masing variasi konsentrasi urea (Gambar 1). Umumnya, pertumbuhan tidak melalui fase adaptasi terlebih dahulu tetapi langsung fase eksponensial. Hal tersebut menunjukkan bahwa isolat khamir R1 maupun R110 mampu memanfaatkan urea sebagai sumber nitrogen secara efisien sehingga tidak memerlukan waktu yang lama untuk tumbuh dan bereproduksi.
Data hasil uji statistik terhadap pertumbuhan isolat khamir R1 menunjukkan bahwa pertumbuhan pada medium perlakuan B dengan C terdapat hubungan yang sangat signifikan yaitu tingkat pertumbuhan yang tidak berbeda nyata (P < 0,01). Puncak pertumbuhan pada setiap medium perlakuan terjadi pada waktu yang berbeda-beda, medium perlakuan A dan D terjadi pada jam ke-17 sedangkan medium perlakuan B dan C terjadi pada jam ke-10 (Gambar 1A). Puncak pertumbuhan tertinggi terjadi pada medium perlakuan A dengan jumlah sel sebesar 107 sel/ml. Hal tersebut dapat terjadi karena pemberian konsentrasi urea yang sangat rendah
pada medium perlakuan A yaitu hanya sebesar 0,125%. Dalam pemenuhan unsur nitrogen, khamir dapat tumbuh optimal pada konsentrasi yang sangat rendah (GRIFFIN, 1981).
Sedangkan data hasil uji statistik terhadap pertumbuhan isolat khamir R110 menunjukkan bahwa pertumbuhan pada medium perlakuan B dengan D terdapat hubungan yang sangat signifikan yaitu tingkat pertumbuhan yang tidak berbeda nyata (P < 0,01). Puncak pertumbuhan pada setiap medium perlakuan terjadi pada waktu yang berbeda–beda, medium perlakuan A terjadi pada jam ke-17 sedangkan medium perlakuan B dan C berturut-turut yaitu jam ke-10 dan jam ke-24 (Gambar 1B). Puncak pertumbuhan tertinggi terjadi pada medium perlakuan D (kontrol) pada jam ke-10 dengan jumlah sel sebesar 106 sel/ml. Pertumbuhan sel pada medium perlakuan D (kontrol) yang lebih tinggi dibandingkan medium perlakuan A, B dan C, hal ini dapat disebabkan dari penggunaan konsentrasi urea yang terlalu tinggi sehingga menimbulkan efek racun bagi pertumbuhan sel khamir dan dapat pula terjadi karena sel khamir R110 telah mengalami mutasi DNA akibat dari iradiasi sinar gamma dengan dosis 10 Gy sehingga kemampuan pertumbuhannya menjadi berkurang (SUGORO, 2004).
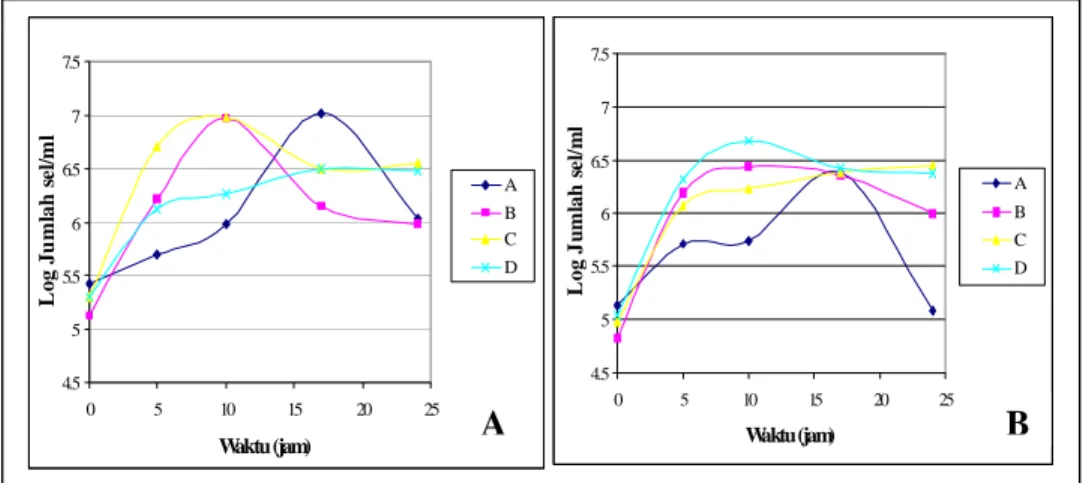
Perubahan pH medium isolat khamir R1 yaitu berkisar 5,02 – 8,22, sedangkan medium
Gambar 1. Kurva pertumbuhan isolat khamir R1 (A) dan R110 (B) dalam medium Perlakuan A (ekstrak singkong + asam laktat + urea 0,125%)
Perlakuan B (ekstrak singkong + asam laktat + urea 0,25%)
4.5 5 5.5 6 6.5 7 7.5 0 5 10 15 20 25 Waktu (jam) L o g J u m lah s el /m l A B C D 4.5 5 5.5 6 6.5 7 7.5 0 5 10 15 20 25 Waktu (jam) L o g J u m lah s e l/ m l A B C D
A
B
isolat khamir R110 yaitu berkisar 5,05 – 8,03 (Gambar 2). Nilai pH yang diperoleh pada umumnya masih berada pada kisaran pH untuk pertumbuhan khamir. Kisaran pH untuk pertumbuhan khamir minimum 1,5 – 3,5; optimum 4,0 – 6,8 dan maksimum 8,0 – 8,5 (FIELDS, 1979). Kenaikan pH terjadi karena urea terhidrolisis oleh enzim urease menjadi amonia dan karbondioksida, dimana amonia yang terbentuk selama proses pertumbuhan sel dapat menyebabkan meningkatnya pH (BROWN
1980).
Pertumbuhan terbaik untuk isolat khamir R1 terjadi pada medium perlakuan C dimana puncak pertumbuhannya terjadi pada jam ke-10 dengan jumlah sel sebesar ke-106 sel/ml, laju pertumbuhan yang tercepat yaitu 0,65 sel/jam, dan berada pada pH pertumbuhan yang optimum yaitu 6,36. Sedangkan untuk isolat khamir R110 pertumbuhan yang terbaik terjadi pada medium perlakuan B dimana puncak pertumbuhannya terjadi pada jam ke-10 dengan jumlah sel sebesar 106 sel/ml, laju pertumbuhan yang tercepat yaitu 0,63 sel/jam, dan berada pada pH pertumbuhan yang optimum yaitu 6,26.
Optimasi ammonium sulfat sebagai sumber nitrogen
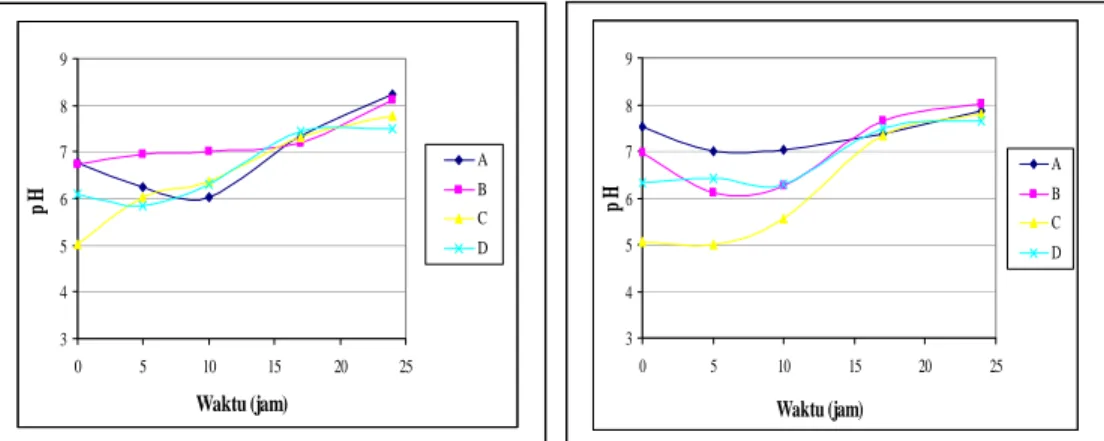
Pertumbuhan jumlah sel dari isolat khamir R1 maupun R110 dengan pemberian ammonium
sulfat sebagai sumber nitrogen, pada umumnya menunjukkan adanya perbedaan pola kurva pertumbuhan.
Sebagian besar mikroorganisme memiliki kemampuan untuk memanfaatkan amonium sebagai sumber nitrogen (HARDER dan DIJKHUIZEN, 1983). Hal tersebut tidak berlaku untuk pertumbuhan sel dari isolat khamir R1 maupun R110, dengan pemberian amonium sulfat memberikan pertumbuhan sel yang abnormalitas ditandai dengan pertumbuhan awal yang mengalami fase adaptasi terlebih dahulu. Hal tersebut menunjukkan bahwa isolat khamir R1 maupun R110 memerlukan waktu beradaptasi terhadap penggunaan amonium sulfat sebagai sumber nitrogen untuk tumbuh dan bereproduksi.
Data hasil uji statistik terhadap pertumbuhan isolat khamir R1 menunjukkan bahwa pertumbuhan pada setiap medium perlakuan tidak terdapat hubungan yang sangat signifikan (P < 0,01). Puncak pertumbuhan pada medium perlakuan A, B dan D terjadi pada waktu yang sama yaitu jam ke-10, sedangkan medium perlakuan C terjadi pada jam ke-17 (Gambar 3). Puncak pertumbuhan tertinggi terjadi pada medium perlakuan D (kontrol) dengan jumlah sel sebesar 105 sel/ml. Hal tersebut dapat disebabkan dari penggunaan konsentrasi amonium sulfat yang terlalu tinggi sehingga menimbulkan efek racun bagi sel khamir serta pertumbuhannya pun menjadi terhambat dan dapat pula terjadi karena isolat
Gambar 2. Kurva perubahan pH isolat khamir R1 (A) dan R110 (B) dalam medium Perlakuan A (ekstrak singkong + asam laktat + urea 0,125%)
Perlakuan B (ekstrak singkong + asam laktat + urea 0,25%) Perlakuan C (ekstrak singkong + asam laktat + urea 0,5%)
Perlakuan D (ekstrak singkong + asam laktat) dengan inkubasi pada suhu kamar dan agitasi 120 rpm
3 4 5 6 7 8 9 0 5 10 15 20 25 Waktu (jam) pH A B C D 3 4 5 6 7 8 9 0 5 10 15 20 25 Waktu (jam) pH A B C D
khamir R1 dapat memanfaatkan zat – zat yang terkandung dalam ekstrak singkong secara lebih optimal. Sedangkan data hasil uji statistik terhadap pertumbuhan isolat khamir R110 menunjukkan bahwa pertumbuhan pada medium perlakuan B terdapat hubungan yang sangat signifikan yaitu tingkat pertumbuhan yang tidak berbeda nyata dengan medium perlakuan C dan D, medium perlakuan C
dengan B dan medium perlakuan D dengan B (P < 0,01). Puncak pertumbuhan pada setiap medium perlakuan terjadi pada waktu yang berbeda-beda, medium perlakuan A, C dan D terjadi pada jam ke-10 sedangkan medium perlakuan B terjadi pada jam ke-17. Puncak pertumbuhan tertinggi terjadi pada medium perlakuan B dengan jumlah sel sebesar 106 sel/ml.
Gambar 3. Kurva pertumbuhan isolat khamir R1 (A) dan R110 (B) dalam medium Perlakuan A (ekstrak singkong + asam laktat + amonium sulfat 0,125%)
B (ekstrak singkong + asam laktat + amonium sulfat 0,25%) C (ekstrak singkong + asam laktat + amonium sulfat 0,5%)
D (ekstrak singkong + asam laktat) dengan inkubasi pada suhu kamar dan agitasi 120 rpm
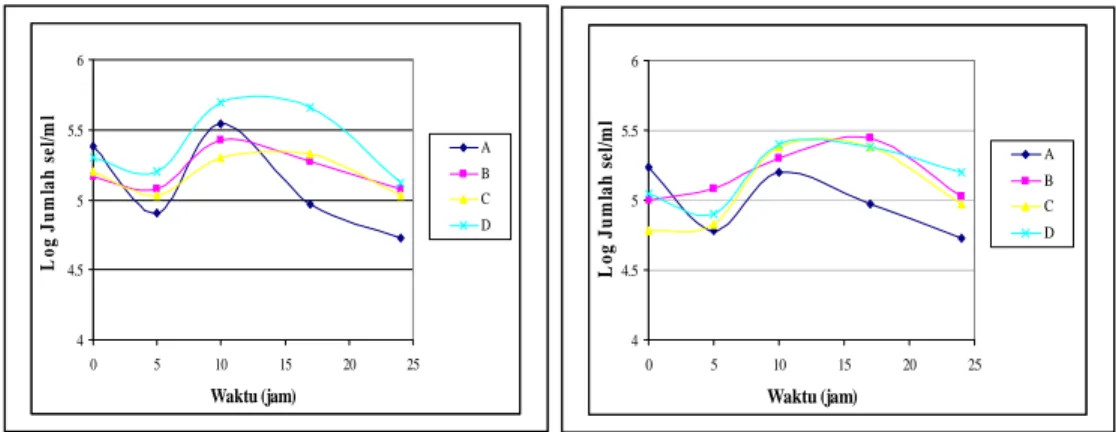
Gambar 4. Kurva perubahan pH isolat khamir R1 (A) dan R110 (B) dalam medium Perlakuan A (ekstrak singkong + asam laktat + amonium sulfat 0,125%)
B (ekstrak singkong + asam laktat + amonium sulfat 0,25%) C (ekstrak singkong + asam laktat + amonium sulfat 0,5%)
D (ekstrak singkong + asam laktat) dengan inkubasi pada suhu kamar dan agitasi 120 rpm 4 4.5 5 5.5 6 0 5 10 15 20 25 Waktu (jam) L o g J u m la h s el/m l A B C D 4 4.5 5 5.5 6 0 5 10 15 20 25 Waktu (jam) L o g J u m lah s el /m l A B C D 4 4.5 5 5.5 6 6.5 7 7.5 8 0 5 10 15 20 25 Waktu (jam) pH A B C D 4 4.5 5 5.5 6 6.5 7 7.5 8 0 5 10 15 20 25 Waktu (jam) pH A B C D
Pertumbuhan terbaik untuk isolat khamir R1 terjadi pada medium perlakuan A, dimana puncak pertumbuhannya terjadi pada jam ke-10 dengan jumlah sel sebesar ke-105 sel/ml, laju pertumbuhan yang tercepat yaitu 0,29 sel/jam, dan berada pada pH pertumbuhan khamir yaitu 7,61. Sedangkan untuk isolat khamir R110 pertumbuhan yang terbaik terjadi pada medium perlakuan B dimana puncak pertumbuhannya terjadi pada jam ke-10 dengan jumlah sel sebesar 105 sel/ml, laju pertumbuhan yang tercepat yaitu 0,04 sel/jam, dan berada pada pH pertumbuhan yang optimum yaitu 5,23.
Perbandingan optimasi medium terbaik urea dan amonium sulfat
Pertumbuhan sel pada medium perlakuan terbaik yang dihasilkan oleh isolat khamir R1 maupun R110 dengan pemberian urea sebagai sumber nitrogen memberikan hasil yang lebih tinggi dibandingkan dengan amonium sulfat sebagai sumber nitrogen (Gambar 1 dan 2). Hal tersebut disebabkan amonium sulfat mempunyai efek tekanan amonium yang dapat menekan sintesis beberapa enzim yang berperan dalam proses metabolisme sel sehingga pertumbuhan sel pun menjadi terhambat (BROWN, 1980).
Pengukuran penyerapan nitrogen
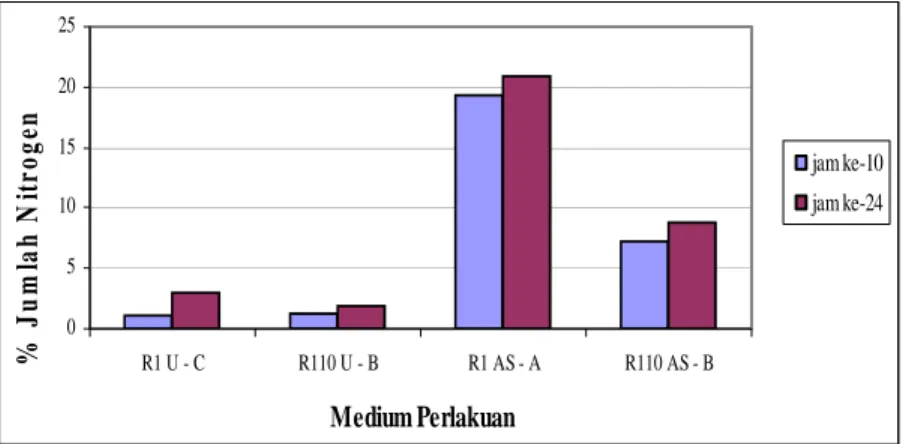
Persentase jumlah nitrogen yang diserap oleh sel pada isolat khamir R1 dan R110 dengan amonium sulfat sebagai sumber nitrogen memberikan hasil yang lebih tinggi dibandingkan urea sebagai sumber nitrogen dengan persentase tertinggi terjadi pada jam ke-24 untuk isolat khamir R1 yaitu sebesar 20,93% dan untuk isolat khamir R110 yaitu sebesar 8,81%. Hal tersebut dapat terjadi karena senyawa amonium sulfat merupakan senyawa yang lebih sederhana dibandingkan dengan urea. Senyawa amonium sulfat merupakan bentuk garam yang lebih mudah larut dalam air sehingga amonium sulfat akan lebih cepat terurai menjadi 2 molekul amonium (WANG, et. al., 1979). Sedangkan urea akan terhidrolisis oleh air membentuk 2 molekul amonia dan 1 molekul CO2. Amonia yang terbentuk akan bereaksi dengan air membentuk gugus ammonium (BROWN, 1980). Ion amonium yang terbentuk akan diserap oleh sel, sehingga jumlah nitrogen yang diserap oleh sel dengan pemberian amonium sulfat sebagai sumber nitrogen akan memberikan hasil yang lebih tinggi dalam waktu yang relatif singkat.
Gambar 5. Grafik % jumlah nitrogen pada medium perlakuan terbaik (R1 U – C = isolat khamir R1 pada medium
Perlakuan C dengan sumber urea; R110 U - B = isolat khamir R110 pada medium Perlakuan B dengan sumber urea; R1 AS – A = isolat khamir R1 pada medium
Perlakuan A dengan sumber amonium sulfat; R110 AS – B = isolat khamir R110 pada medium perlakuan A dengan sumber amonium sulfat)
0 5 10 15 20 25 R1 U - C R110 U - B R1 AS - A R110 AS - B Medium Perlakuan % Ju m la h N it roge n jam ke-10 jam ke-24
KESIMPULAN
Penggunaan urea sebagai sumber nitrogen untuk pertumbuhan isolat khamir R1 dan R110 memberikan pertumbuhan yang lebih tinggi dibandingkan amonium sulfat sebagai sumber nitrogen de. Konsentrasi urea yang optimum untuk pertumbuhan isolat khamir R1 adalah 0,5% dan isolate khamir R110 adalah 0,25%, sedangkan konsentrasi amonium sulfat yang optimum untuk pertumbuhan isolat khamir R1 adalah 0,062% dan isolat khamir R110 adalah 0,125%. Persentase jumlah nitrogen yang diserap oleh sel pada isolat khamir R1 dan R110 dengan amonium sulfat sebagai sumber nitrogen memberikan hasil yang lebih tinggi dibandingkan urea sebagai sumber nitrogen dengan persentase tertinggi terjadi pada jam ke-24 untuk isolat khamir R1 yaitu sebesar 20,93% dan untuk isolat khamir R110 yaitu sebesar 8,81%.
DAFTAR PUSTAKA
ALSHAIKH,MA.,Y.M.ALSIADI,S.M.ZAHRAN,H.H. MOGAWER and T.A. AALSHOWIME. 2002. Effect of feeding yeast culture from different sources on the performance of lactating holstein cows in Saudi Arabia, Asian-Aust, J.
Anim. Sci. 15(3): 352 – 356.
KUNG, L.J.R, E.M. KRECK, R.S. TUNG, A.O. HESSION, A.C. SHEPERD, M.A. COHEN, H.E. SWAIN and J.A.Z. LEEDLE. 1997. Effect od a Live Yeast Culture and Enzymes on In Vitro Ruminal Fermentastion and Milk Production of Dairy Cow”. J. Dairy. Sci. pp. 2045 – 2051. GRIFFIN,D.H. 1981. Fungal Physiology, A Wiley
Interscience Publication, New York, p. 138. SUGORO, I. 2004. Peran Teknik Nuklir di Bidang
Peternakan, Kompas tanggal 22 Mei 2004. FIELDS, M.L. 1979. Foundatiomentals of Food
Microbiology, Mc. Graw Hill Book Co, New York.
BROWN, C.M. 1980. Ammonia Assimilation and Utilization In Bacteria and Fungi. In:, Microorganisms and Nitrogen Sources: Transport and Utilization of Amino Acids, Peptides, Proteins and Related Substrates. PAYNE, J.W. (Ed.) John Wiley & Sons, Toronto. pp. 511 – 538.
HARDER,W.andL.DIJKHUIZEN. 1983. Physiological Responses to Nutrien Limitation, Ann. Rev. Microbial. p. 12.
STANBURY,P.F. and A.WHITAKER. 1987. Principles of Fermentation Technology, Pergamon Press, Toronto. pp. 74 – 80.
WANG, D.I.C., C.L. COONEY., A.L. DEMAIN., P. DUNNIL, A.E. HUMPREY and M.D. LILLY. 1979. Fermentation and Enzyme Technology, John Wiley & Sons, New York. p. 90.