Alva AK, Edwards DG, Asher CJ, Blamey FPG. 1986. Relationships between root length of soybean and calculated activities of aluminum monomers in nutrient solution. Soil Sci Soc Am J 50:959-962.
Alviana VF. 2005. Optimasi pemupukan pada budidaya cabai merah dengan irigasi tetes dan mulsa polyethylene [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Anas I, Tampubolon JLO. 2004. Media campuran tanah-pasir dan pupuk kandang untuk memproduksi inokulum cendawan mikoriza arbuskula. Bul Agron 32(1): 26-31.
Archambaault DJ, Zhang G, Taylor GJ. 1996. Accumulation of Al in the root mucilage of an Al-resistant and Al-sensitive cultivars of wheat. Plant Physiol 112: 1471-1478.
Bago B, Philip E, Pfeffer PE, Shachar-Hill Y. 2000. Carbon metabolism and transport in arbucular mycorrhizal. Plant Physiol 124: 949-957.
Bago B, Vierheilig H, Piche Y, Azcon CA. 1996. Nitrate depletion and pH changes induced by the extraradical mycelium of the arbuscular mycorrhizal fungus Glomus intraradices grown in monoxenic culture. New Phytol 133: 273-280.
Bakhtiar, Purwoko BS, Trikoesoemaningtyas, Chozin MA, Dewi I, Amir M. 2007. Penapisan galur haploid ganda padi gogo hasil kultur antera untuk toleransi terhadap cekaman aluminium. Buletin Agronomi 35(1):8-14. Baligar VC, Pitta GVE, Gama EEG, Shaffer EE, Clark RB. 1997. Soil acidity
effects on nutrient use efficiency in exotic maize genotypes. Plant Soil 192: 9-13.
Balsberg-Pahlsson AM. 1990. Influence of aluminum on biomass, nutrients, soluble carbohydrate and phenols, in beech (Fagus sylvatica). Physiologia Plantarum 78:79-84.
Blamey FPC, Asher CJ, Kerven GL, Edwards DG. 1993. Factors affecting aluminum sorption by calcium pectate. Plant and Soil 149:87-94.
Bolan NS. 1991. A critical review on the role of mycorrhizal fungi in the uptake of phosphorous by plants. Plant and Soil 134:189-209.
Bonfante P, Perotto S. 1995. Strategies of arbuscular mycorrhizal fungi when infecting host plants. New Phytol 132: 3-21.
Brundrett MC, Bouger N, Dells B, Grove T, Malajczuk N. 1996. Working with Mycorrhizas in Forestry and Agriculture. Canberra: ACIAR. Monograph. 374hlm.
Bushamuka VN, Zobel RW. 1998. Maize and soybean top, basal, and lateral root responses to stratified acid, aluminum toxic soil. Crop Sci 38:416-421.
Clark RB. 1997. Arbuscular mycorrhizal adaptation, spore germination, root colonization and host plant growth and mineral acquisition at low pH. Plant and Soil 192: 15-22.
Cruz C, Green JJ, Watson CA, Wilson F, Martin-Lucao MA. 2004. Functional aspects of root architecture and mycorrhizal inoculation with respect to nutrient uptake capacity. Mycorrhiza 14: 177-184.
Cuenca G, Andrade DZ, Meneses E. 2001. The presence of aluminum in arbuscular mycorrizhas of Clusia multiflora exposed to increased acidity. Plant and Soil 231(2): 233-241.
Cuming JC, Cuming AB, Taylor GJ. 1992. Pattern in root respiration associated with the induction of aluminum tolerance in Phaseolus vulgaris. J.Exp.Bot. 43:1075-1091.
Cumming JR, Ning J. 2003. Arbuscular mycorrhizal fungi enhance aluminum resistance of broomsedge (Andropogon virginicus, L.). J Exp Bot. 54: 1447-1459.
Delhaize E, Ryan PR, Randall. 1993. Aluminum tolerance in wheat (Triticum aestivum L.): II Aluminum stimulated in plants excretion of malic acid from root apices. Plant Physiol 103:695-702.
Delhaize E, Ryan PR. 1995. Aluminum toxicity and tolerance in plants. Plant Physiol 107:315-312.
Departemen Pertanian. 2007. Statistik Pertanian 2006. Jakarta: Pusat Data dan Informasi Departemen Pertanian.
Doud DD Jr, Nagahashi G, Kayser WM. 2005. On-farm production and utilization of arbuscular mycorrhizal fungus inoculum. Can J Plant Sci 85:15-21.
Enggarini W, Marwani E. 2006. Pengaruh cekaman aluminium terhadap kandungan asam organik dalam kalus dan pinak tomat (Lycopersicon esculentum Mill.). Jurnal AgroBiogen 2(1):24-28.
Gianinazzi-Pearson V, Branzanti B, Gianinazzi S. 1989. In vitro enhancement of spore germination and early hyphae growth of a vesicular arbuscular mycorrhizal fungus by host root exudates and plant flavonoid. Symbiosis 7:243-255.
Hanum C. 2004. Penapisan beberapa galur kedelai (Glycine max L. Merr.) toleran cekaman aluminium dan kekeringan serta tanggap terhadap mikoriza vesikular arbuskular [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Hapsoh, Yahya S, Soepandie D, Purwoko BS. 2005. Respon morfologi beberapa genotipe kedelai terhadap inokulasi MVA pada berbagai tingkat cekaman kekeringan. Jurnal Penelitian Pertanian 24(2):111-117.
Hart MM, Reader RJ. 2002. Host plant benefit from association with arbuscular mycorrhizal fungi: variation due to differences in size of mycellium. Biol Fertil Soils 36(5):357-366.
Haryantini BA, Santoso M. 2001. Pertumbuhan dan hasil cabai merah pada andisol yang diberi mikoriza, pupuk fosfor dan zat pengatur tumbuh. Biosain 1(3): 50-57.
Haynes RJ. 1990. Active ion uptake and maintenance of cation-anion balances: a critical examination of their role in regulating rhizospher pH. Plan and Soil 126: 247-264.
Heryati T. 2002. Uji daya hasil 39 genotipe dari empat spesies cabai (Capsicum spp. L) [skripsi]. Bogor: Jurusan Budidaya Pertanian Fakultas Pertanian, Institut Pertanian Bogor.
Hidayat A, Mulyani A. 2002. Lahan Kering untuk Pertanian. Di dalam: Adimihardja A, Mappaona, Saleh A, editor. Teknologi Pengelolaan Lahan Kering. Bogor: Pusat Penelitian Tanah dan Agroklimat. hlm 1-34.
Idris K. 1995. Evaluasi pemberian fosfat alam dari Jawa dan pengapuran pada tanah masam: I. Modifikasi ciri kimia tanah. J Ilmu Pert Indon 5(2):57-62. Iriani F. 2003. Identifikasi cendawan mikoriza pada tanah ultisol bekas pertanaman padi gogo dan ubi kayu, serta pengaruhnya terhadap pertumbuhan setek tebu. hlm.49-54. Di dalam: Simarmata T, Arief DH, Sumarni Y, Hindersah R, Azirin A, Kalay AM, editor. Teknologi Produksi dan Pemanfaatan Inokulan Endo-ektomikoriza untuk Pertanian, Perkebunan, dan Kehutanan. Bandung: Asosiasi Mikoriza Indonesia Jawa Barat.
Joner EJ, Johansen A. 2000. Phosphatase activity of external hyphae of two arbuscular mycorrhizal fungi. Mycol Res 104: 81-86.
Joner EJ, Magid J, Gahoonia TS, Jacobsen I. 1995. Phosphorus depletion and activity of phosphatases in rhizosphere of mycorrhizal and non mycorrhizal Cucumber. Soil Biol.Biochem. 27: 1157-1159.
Jones DL, Brassington DS. 1998. Sorption of organic acids in acid soil and its implications in the rhizosphere. Eur J Soil Sci 49: 447-455.
Kasim N, Sopandie D, Harran S, Yusuf M. 2001. Pola akumulasi dan sekresi asam sitrat dan asam malat pada beberapa genotipe kedelai toleran dan peka aluminium. Hayati 8:58-61.
Kochian LV, Heokenga OA, Pineros MA. 2004. How do crop plants tolerate acid soil? Mechanism of aluminum tolerance and phosphorus efficiency. Annu Rev Plant Biol 55:459-493.
Kormanik PP, McGraw AC. 1982. Quantification of versicular arbuscular mycorrhizae in plant roots. In Schenck NC (ed). Methods and Principles of Mycorrhizal Research. St.Paul Minnesota: The American Phytopathological Society.
Ma JF. 2000. Role of organic acid in detoxification of aluminum in higher plants. Plant Cell Physiol 41(4): 383-390.
Ma JF, Hiradate S, Nomoto K, Iwashita T, Matsumoto H. 1997. Internal detoxification mechanism of Al in Hydrangea macrophylla: identification of Al form in the leaves. Plant Physiol 113:1033-1039.
Ma JF, Ryan PR, Delhaize E. 2001. Aluminum tolerance in plants and the complexing role of organic acids. Trends in Plant Sci. 6(6):273-279. Ma JF, Shen R, Nagao S, Tanimoto E. 2004. Aluminum target elongation cells by
reducing cell wall extensibility in wheat roots. Plant Cell Physiol 45:583-589.
Mc Gee PA, Torrisi V, Pattinson GS. 1999. The relationship between density of Glomus mossae propagules and the initiation and spread of arbuscular mycorrhizae in cotton roots. Mycorrhiza 9:221-225.
Marschner H. 1995. Mineral Nutrition of High Plants. Ed ke-2. San Diego: Academic Press.
Matsumoto H. 1988. Inhibition of proton transport activity of microsomal membrane vesicles of barley roots by aluminum. Soil Sci Plant Nutr 34:499-506.
Matsumoto H. 1991. Biochemical mechanism of the toxicity of aluminum and the sequestration of aluminum in plant cell. Di dalam : Wright RJ, editor. Plant Soil Interaction at Low pH. Dordrech: Kluwer. hlm 325-838.
Matsumoto H, Senoo Y, Kasai M, Maeshima M. 1996. Response of the plant root to aluminum stress: analysis of the inhibition of the root elongation and changes in membrane function. J Plant Res. 109: 99-105.
Matsumoto H, Yang ZM, You JF, and Nian H. 2003. The physiological mechanism of aluminum tolerance in Glycine max L. Plant Physiol. 6:237-261.
Miyasaka SC, Buta JG, Howell RK, Foy CD. 1991. Mechanism of aluminum tolerance in snabbeans: root exudation of citric acid. Plant Physiol 96: 737-743.
Naidu R, Tillman RW, Syers JK, Kirkman JH. 1990. Lime-aluminum-phosphorus interactions and the growth of Leucaena leucocephala: I. plant growth studies. Plant and Soil 126:1-8.
Nikolaou N, Karagiannidis N, Koundouras S, Fysarakis I. 2002. Effect of different P sources in soil on increasing growth and mineral uptake of mycorrhizal Vitis vinifera L. (cv Victoria) Vines. J Int Sci Vigne Vin 36(4):195-204.
Nurlaeny N, Marschner H, George E. 1998. Effect of liming and mycorrhizal colonization on soil phosphate depletion and phosphate by maize and soybean grown in two tropical acid soils. Plant and Soil 181: 275-285. O’Connor PJ, Smith SE, Smith FA. 2001. Arbuscular mycorrhizal associations in
the southern Simpson Desert. Aust J Bot 49:493-499.
Ojima K, Ohira K. 1988. Aluminum-tolerance and citric acid release from a stress-selected cell line of carrot. Commun Soil Sci Plant Anal 19:1229-1236.
Pellet DM, Grunes DL, Kochian LV. 1995. Organic acid exudation as an aluminum-tolerance mechanisms in maize (Zea mays L.). Planta 196: 788-795.
Pellet DM, Papernik LA, Jones DL, Darrah PR, Grunes DL, Kochian LV. 1997. Involvement of multiple aluminum exclusion mechanisms in aluminum tolerance in wheat. Plant Soil 192: 63-68.
Pineros MA, Magalhaes JV, Carvalho VMA, Kochian LV. 2002. The physiology and biophysics of an aluminum tolerance mechanism based on root citrate exudation in maize. Plant Physiol. 129:1194-1206.
Rahayu A, Setyono, Rochman N. 2002. Pengaruh mikoriza dan stres air terhadap respon tanaman cabai merah. Laporan Penelitian Proyek Pengkajian dan Penelitian Ilmu Pengetahuan Terapan. Bogor: Fakultas Pertanian Unida.. Ralalage D, Malkanthi R, Moritsugu M, and Yokohama K. 1995. Effect of low
pH and Al on absorption and translocation of some essential nutrient in excised barley roots. Soil Sci Plant Nutr 41: 253-262.
Rengel Z. 1997. Role of calcium in aluminum toxicity. New phytol 121:499-513. Rohyadi A, Smith FA, Murray RS, Smith S. 2004. Effects of pH on mycorrhizal
colonization and nutrient uptake in cowpea under conditions that minimize confounding effects of elevated available aluminum. Plant and Soil 260:283-290.
Rout GR, Samantaray S, Das P. 2001. Aluminum toxicity in plants: a review. Agronomie 21:3-21.
Rubatzky VE, Yamaguchi M. 1997. World Vegetables, Principles, Production and Nutritive Values. Second Edition. New York: Chapman and Hall. 843p.
Saini VK, Bhandari SC, Tarafdar JC. 2004. Comparison of crop yield, soil, mikrobial C, N and P, N-fixation, nodulation and mycorrhizal infection in inoculated and non inoculated sorghum and chickpea crops. Field Crops Res 89(1):39-47.
Samac DA, Tesfaye M. 2003. Plant improvement for tolerance to aluminum in acid soils. Plant Cell Tissue and Organ culture 75:189-207.
Samuel T, Kucukakyuz K, Zachary K. 1997. Al partitioning pattern and root growth as related to Al sensitivity and Al tolerance in Wheat. Plant Physiol 133: 527-534.
Sasaki M, Kasai M, Yamamoto Y, Matsumoto H. 1994. Comparison of the early response to aluminum stress between tolerant and sensitive wheat cultivars: root growth, aluminum content and efflux of K+. J Plant Nutr 17:1275-1288.
Setiadi Y. 2000. Status penelitian pemanfaatan cendawan mikoriza arbuskula untuk merehabilitasi lahan terdegradasi. hlm 11-23. Di dalam: Setiadi Y, Hadi S, Santoso E, Turjaman M, Irianto RSB, Prematuri R, Maryanti D, Widopratiwi R, editor. Prosiding Seminar Nasional Mikoriza I. Jakarta: Pusat Penelitian dan Pengembangan Hutan dan Konservasi Alam.
Shetty KG, Hetrick BAD, Schwab AP. 1995. Effects of mycorrhizae and fertilizer amendments on zink tolerance of plant. Environ Pollut 88(195): 307-314. Sivaguru M, Paliwal K. 1993. Differential Al-tolerance in some tropical rice
cultivars: I. growth performance. J Plant Nutr 16:1705-1716.
Slaski JJ, Zhang G, Basu U, Stephens JL, Taylor GJ. 1996. Aluminum resistance in wheat is associated with rapid-Al-induced changes in the activities of glucose-6-phosphate dehydrogenase and 6-phosphogluco dehydrogenase. Physiol Plantarum 98: 477-484.
Smith FA, Smith SE. 1996. Mutualism and parasitism: diversity in function and structure in the arbuscular mycorrhizal symbiosis. Adv Bot Res 22:1-43. Smith SE, Read DJ. 1997. Mycorrhizal Symbiosis. London: Academic Press
Hacourt Brace & Company Publisher.
Sopandie D, Marzuki I, Jusuf M. 2003. Aluminum tolerance in soybean: protein profiles and accumulation of Al in roots. Hayati 10(1): 30-33.
Sopandie D. 1999. Perbedaan toleransi terhadap aluminium pada beberapa genotipe kedelai dalam kaitannya dengan metabolisme nitrat dan eksudasi asam organik. Comm Ag 5(1): 13-20.
Spehar CR, Sauza LAC. 2006. Selection for aluminum tolerance in tropical soybeans. Pesquisa Agropecuaria Tropical 36:1-6.
Subagyo H, Suharta N, Siswanto AB. 2000. Tanah-tanah pertanian di Indonesia. hlm 21-65. Di dalam: Adimihardja A, Hidayat A, Agus F, Santoso D, Saleh A, editor. Sumberdaya Lahan Indonesia dan Pengelolaannya. Bogor: Pusat Penelitian Tanah dan Agroklimat.
Suhayda CG, Haug A. 1986. Organic acid reduce aluminum toxicity in maize root membranes. Physiol Plant 68: 189-195.
Sumarni N. 1996. Budidaya tanaman cabai merah. hal 36-47. Di dalam: Duriat AS, Wijaya A, Hadisoeganda W, Soetiarso TA, Prabaningrum L, editor. Teknologi Produksi Tanaman Cabai. Lembang, Bandung: Balitsa.
Sutaryo B, Purwantoro A, Nasrullah. 2005. Seleksi beberapa kombinasi persilangan padi untuk ketahanan terhadap keracunan aluminium. Ilmu Pertanian 12(1):20-31.
Takita E, H Keyama, T Hara. 1999. Organic acid metabolism in Al-phosphate utilizing cells of carrot (Daucus carota L.). Plant Cell Physiol. 40(5):489-495.
Tan K, Keltjens WG, Findenegg GR. 1993. Aluminum toxicity in sorghum genotypes as influenced by solution acidity. Soil Sci Plant Nutr 39:291-298.
Tawaraya K, Watanabe S, Yosida E, Wagatsuma T. 1996. Effect of onion root exudates on the hyphal growth of Gigaspora margarita. Mycorrhiza 6:57-59
Taylor GJ. 1988. The physiology of aluminum tolerance in higher plants. Commun Soil Sci Plant Anal 19:1179-1194.
Vitorello VA, Capaldi FL, Stefanuto VA. 2005. Recent advances in aluminum toxicity and resistance in higher plants. Braz J Plant Physiol 17:129-143. Watanabe T, Okada K. 2005. Interactive effects of Al, Ca, and other cations on
root elongation of rice cultivars under low pH. Ann Bot 95:379-385. Watanabe T, Osaki M. 2002. Mechanisms of adaptation to high aluminum
condition in native plant species growing in acid soils. Communication Soil Science Plant Analysis 33:1247-1260.
Watanabe T, Osaki M, Yano H, Rao I. 2006. Internal mechanism of plant adaptation to aluminum toxicity and phosphorus starvation in tree tropical forages. J Plant Nutr 29:1243-1255.
Widiastuti H, Guhardja E, Sukarno N, Darusman LK, Goenadi DH, Smith S. 2003. Arsitektur akar bibit kelapa sawit yang diinokulasi beberapa cendawan mikoriza arbuskula.Menara Perkebunan 71(1): 28-43
Widiastuti H, Kramadibrata K. 1993. Identifikasi VA mikoriza pada perkebunan kelapa sawit di Jawa Barat. Menara Perkebunan 61: 56-60.
Yoshida S, Forno DA, Cock JH, Gomea KA. 1976. Laboratory Manual for Physiologycal Studies of Rice. Los Banos, Phillippines: The International Rice Research Institut (IRRI). 70p.
Zheng Sj, Yang JL, He YF, Yu XH, Zhang L, You JF, Shen RF, Matsumoto H. 2005. Immobilization of aluminum with phosphorus in roots is associated with high aluminum resistance in buckwheat. Plant Physiol 138:297-303.
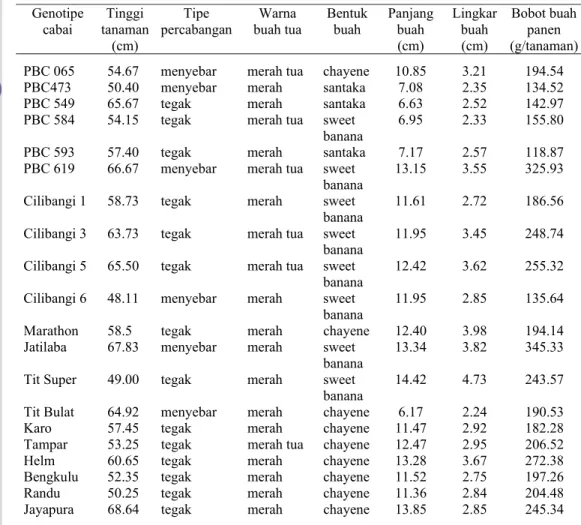
Tabel Lampiran 1. Beberapa karakteristik genotipe cabai yang digunakan dalam percobaan (koleksi Laboratorium Genetika dan Pemuliaan Tanaman Departemen Agronomi dan Hortikultura, Faperta IPB)
Genotipe
cabai tanaman Tinggi
(cm)
Tipe
percabangan buah tua Warna Bentuk buah Panjang buah
(cm) Lingkar buah (cm) Bobot buah panen (g/tanaman)
PBC 065 54.67 menyebar merah tua chayene 10.85 3.21 194.54
PBC473 50.40 menyebar merah santaka 7.08 2.35 134.52
PBC 549 65.67 tegak merah santaka 6.63 2.52 142.97
PBC 584 54.15 tegak merah tua sweet
banana
6.95 2.33 155.80
PBC 593 57.40 tegak merah santaka 7.17 2.57 118.87
PBC 619 66.67 menyebar merah tua sweet
banana 13.15 3.55 325.93
Cilibangi 1 58.73 tegak merah sweet
banana 11.61 2.72 186.56
Cilibangi 3 63.73 tegak merah tua sweet
banana 11.95 3.45 248.74
Cilibangi 5 65.50 tegak merah tua sweet
banana 12.42 3.62 255.32
Cilibangi 6 48.11 menyebar merah sweet
banana 11.95 2.85 135.64
Marathon 58.5 tegak merah chayene 12.40 3.98 194.14
Jatilaba 67.83 menyebar merah sweet
banana 13.34 3.82 345.33
Tit Super 49.00 tegak merah sweet
banana 14.42 4.73 243.57
Tit Bulat 64.92 menyebar merah chayene 6.17 2.24 190.53
Karo 57.45 tegak merah chayene 11.47 2.92 182.28
Tampar 53.25 tegak merah tua chayene 12.47 2.95 206.52
Helm 60.65 tegak merah chayene 13.28 3.67 272.38
Bengkulu 52.35 tegak merah chayene 11.52 2.75 197.26
Randu 50.25 tegak merah chayene 11.36 2.84 204.48
Jayapura 68.64 tegak merah chayene 13.85 2.85 245.34
Tabel Lampiran 2. Rekapitulasi hasil analisis ragam pada percobaan evaluasi karakter pertumbuhan dan hasil untuk toleransi terhadap cekaman Al.
Nilai kuadrat tengah pada variabel pengamatan : Sumber keragaman Tinggi tanaman Bobot Kering tajuk Jml buah
total Jml buah panen Panjang buah
Bobot per buah Bobot buah panen Genotipe (G) 113.42 ** 282.99 ** 534.14 ** 553.18 ** 49.70 ** 20.37 ** 42782.85 ** Cekaman Al (A) 1796.91 ** 3274.13 **4937.52 **3377.35 **111.17 ** 0.63 * 102915.05 ** Interaksi GxA 30.96 tn 116.97 ** 159.75 ** 178.57 * 1.79 tn 0.08 tn 4104.34 ** KK (%) 9.81 11.57 17.80 20.97 12.84 5.93 14.17
Keterangan : ** = berpengaruh sangat nyata berdasarkan uji F pada taraf 1% * =berpengaruh nyata berdasarkan uji F pada taraf 5%
tn =tidak nyata berdasarkan uji F
Tabel Lampiran 3. Rekapitulasi hasil analisis ragam pada percobaan tanggap pertumbuhan dan hasil terhadap inokulasi FMA pada genotipe cabai yang mengalami cekaman Al
Nilai kuadrat tengah pada variabel pengamatan : Sumber
keragaman Panjang akar tanamanTinggi Kering Bobot
tajuk
Jml buah
panen Panjang buah Bobot per
buah Bobot buah panen Genotipe (G) 68.69 ** 688.87 ** 360.72 ** 666.89 ** 9.02 ** 4.81 ** 13947.80 ** Cekaman Al (A) 1556.10 ** 3864.64 **3573.51 **3136.33 ** 83.27 ** 20.24 ** 52438.45 ** FMA (M) 175.19 ** 1676.79 ** 750.34 **1302.08 ** 29.52 ** 11.65 ** 23081.76 ** Interaksi GxA 76.44 ** 211.93 ** 208.56 ** 154.33 ** 5.99 * 3.21 ** 4653.94 ** Interaksi GxM 13.56 * 15.53 tn 49.41 * 1.64 tn 0.90 tn 0.17 tn 2235.38 tn Interaksi AxM 0.46 tn 277.92 * 75.70 * 114.08 * 8.07 * 3.06 * 5428.10 * Interaksi GxAxM 1.19 tn 9.88 tn 0.48 tn 84.08 * 1.49 tn 0.44 tn 2696.18 * KK (%) 8.43 12.36 8.08 12.87 12.06 13.15 11.19
Keterangan : ** = berpengaruh sangat nyata berdasarkan uji F pada taraf 1% * =berpengaruh nyata berdasarkan uji F pada taraf 5%
Tabel Lampiran 4. Prosedur pengamatan koloni FMA dengan teknik pewarnaan akar untuk menghitung derajat infeksi akar
Bahan dan Alat :
Bahan-bahan yang diperlukan adalah KOH 10%, H2O2 3 %, HCl 2%,
gliserol, asam laktat, trypan blue, PVLG dan aquades. Peralatan yang digunakan adalah botol vial, scapel, gunting, cawan petri, glass side, cover glass, mikroskop dan saringan.
Prosedur Kerja :
1. Akar dicuci dengan air mengalir hingga bersih, kemudian dipotong-potong sepanjang 1 cm dan dimasukkan kedalam tabung.
2. Tambahkan larutan KOH 10 % untuk merendam sampel akar, kemudian tutup tabungnya dan biarkan selama 24 jam. Setelah itu ganti larutan KOH dengan yang baru dan direndam lagi selama 24 jam.
3. Larutan KOH dibuang, sampel akar dicuci berulang kali kemudian ditiris dalam saringan.
4. Sampel akar tersebut kemudian direndam dengan HCl 2% dalam tabung selama 24 jam. Pada proses ini akar akan berwarna putih atau pucat.
5. Buang larutan HCl, kemudian sampel akar direndam dalam larutan staining (trypan blue 0.05%) biarkan selama 24 jam.
6. Buang larutan trypan blue dan diganti dengan larutan destaining (lacto glycerol) rendam selama 24 jam.
7. Selanjutnya sampel akar siap untuk diamati.
8. Untuk pengamatan kolonisasi akar, potongan sampel akar sepanjang 1 cm yang telah diwarnai diambil sebanyak 10 potong, kemudian disusun di permu-kaan kaca preparat yang telah ditetesi larutan PVLG dan ditutup dengan cover glass. Buatlah 3-5 preparat untuk diamati dibawah mikroskop.
9. Amati ada tidaknya kolonisasi CMA, dan catat jumlah sampel akar yang terinfeksi. Akar terinfeksi ditandai dengan adanya kolonisasi minimal salah satu dari struktur internal CMA terlihat, yaitu hifa internal, arbuskula atau vesikula. Persentase akar terinfeksi merupakan perbandingan antara jumlah akar terinfeksi dan total jumlah akar yang diamati.
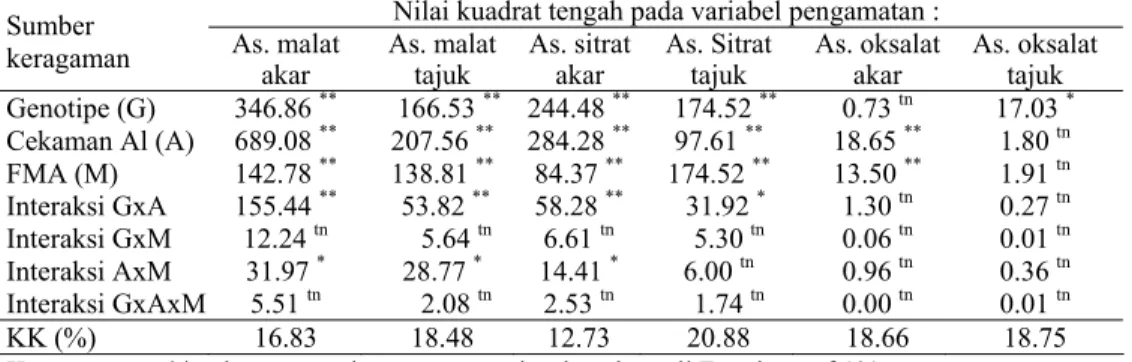
Tabel Lampiran 5. Rekapitulasi hasil analisis ragam pada percobaan tanggap fisiologi terhadap cekaman Al pada genotipe cabai yang bermikoriza
Nilai kuadrat tengah pada variabel pengamatan : Sumber
keragaman As. malat akar As. malat tajuk As. sitrat akar As. Sitrat tajuk As. oksalat akar As. oksalat tajuk
Genotipe (G) 346.86 ** 166.53 ** 244.48 ** 174.52 ** 0.73 tn 17.03 * Cekaman Al (A) 689.08 ** 207.56 ** 284.28 ** 97.61 ** 18.65 ** 1.80 tn FMA (M) 142.78 ** 138.81 ** 84.37 ** 174.52 ** 13.50 ** 1.91 tn Interaksi GxA 155.44 ** 53.82 ** 58.28 ** 31.92 * 1.30 tn 0.27 tn Interaksi GxM 12.24 tn 5.64 tn 6.61 tn 5.30 tn 0.06 tn 0.01 tn Interaksi AxM 31.97 * 28.77 * 14.41 * 6.00 tn 0.96 tn 0.36 tn Interaksi GxAxM 5.51 tn 2.08 tn 2.53 tn 1.74 tn 0.00 tn 0.01 tn KK (%) 16.83 18.48 12.73 20.88 18.66 18.75
Keterangan : ** = berpengaruh sangat nyata berdasarkan uji F pada taraf 1% * =berpengaruh nyata berdasarkan uji F pada taraf 5%
Lampiran 6. Teknik pengenceran dan tata letak medium pada uji MPN (Most Probable Number) yang dimodifikasi dari Sieverding (1991)
Media uji dibuat menjadi 10 seri pengenceran berkelipatan 4 (perbandingan 1:3), tahapan pengenceran adalah sebagai berikut:
1. 100 gram tanah dari kultur pot yang mengandung propagul mikoriza selanjutnya disebut dengan pengenceran media uji 40.
2. Untuk membuat seri pengenceran media uji 4-1 = 25 gram tanah dari kultur pot dicampur dengan 75 gram zeolit steril.
3. Untuk seri pengenceran media uji 4-2 = 25 gram campuran media uji pada pengenceran 4-1 dicampur dengan 75 gram zeolit steril.
4. Untuk seri pengenceran media uji 4-3 = 25 gram campuran media uji pada
pengenceran 4-2 dicampur dengan 75 gram zeolit steril.
5. Pengenceran dilanjutkan sampai dengan seri pengenceran media uji 4-9, sehingga diperoleh sepuluh seri pengenceran.
50 gram zeolit
100 gram media uji yang mengandung propagul mikoriza arbuskular (dibuat 10 seri pengenceran)
Tabel Lampiran 7. Prosedur penghitungan MPN (Most Probable Number) menurut Sieverding (1991)
1. Tahapan awal penghitungan MPN dilakukan dengan pencatatan ada tidaknya infeksi yang diwujudkan dalam bentuk tabel, sebagai contoh :
Ulangan Seri Pengenceran I II III IV V Jumlah Infeksi 4-0 + + + + + 5 4-1 + + + + + 5 4-2 + + + + + 5 4-3 + + + + - 4 4-4 - + - + + 3 4-5 - + - - - 1 4-6 - - - 0 4-7 - - - 0 4-8 - - - 0 4-9 - - - 0
Jumlah keseluruhan infeksi : 23 Keterangan : + : ada infeksi ; - : tidak ada infeksi
2. Nilai MPN dihitung menggunakan rumus : Log Ω = X . log a-K;
di mana : Ω = nilai MPN
X = rerata jumlah infeksi
a = 4 (seri pengenceran berkelipatan 4)
K= besaran yang diperoleh pada tabel Fisher dan Yates
3. Nilai K dicari berdasar pada tabel Fisher dan Yates dengan cara sebagai berikut : X Nilai K Y Nilai K 0,4 0,707 3,5 0,550 0,6 0,618 3,0 0,548 0,8 0,577 2,5 0,545 1,0 0,559 2,0 0,537 1,5 0,555 1,5 0,522 2,0 0,553 1,0 0,488 2,5 0,552 0,8 0,464 0,6 0,431 0,4 0,375
Catatan : Jika X > 2,5 atau Y > 3,5 nilai K = 0,552 Contoh : X = 23/5 = 4,6
Y = 10 - 4,6 = 5,4; a = 4 K = 0,552
Log Ω = X . log a-K
= 4,6 . 0,6021 - 0,552 = 2,2177
Ω = 165,1