Seminar Nasional Teknologi Peternakan dan Veteriner _____________________________________________________________________________________________
_____________________________________________________________________________________________ Puslitbang Peternakan, Bogor 29 – 30 September 2003 365
PEMBENTUKAN PRONUKLEUS DAN PERKEMBANGAN AWAL
EMBRIO HASIL ICSI PADA TIKUS: PENGARUH
POLYVINYLPYRROLIDONE PADA MEDIUM
MANIPULASI SPERMATOZOA
SYAHRUDDIN SAID danBAHARUDDIN TAPPA
Pusat Penelitian dan Pengembangan Bioteknologi LIPI, Jl. Raya Bogor Km. 46 Cib inong 16911
ABSTRACT
The Effect of Polyvinylpyrrolidone (PVP) in Manipulation Medium of Spermatozoa on Normal Fertilization and Early Embryo Development Resulted from ICSI in the Rat
In the experiment, we compared 2 groups treatment, ICSI was conducted with addition of PVP in manipulation medium of spermatozoa (group 1) and without PVP (group 2). In the group 1, 161 oocytes were injected, 110 (68%) oocytes were activated, and the activated oocytes 67 (61%) perform pronuclear formation. In the group 2, the activated oocytes 123/144 (85%) were no significantly different compared with group 1, however, pronuclear formation in group 2 (94/123, 76%) were significantly higher (P<0.001) than group 1. When the embryos in group 1 were cultured in vitro, only 10/46 (22%) embryos develop to = 4-cell, no embryo can develop until morula and blastocyst. Whereas in group 2, when 60 embryos were cultured in vitro, 8 (13%) develop to morula stage and 6 (10%) to blastocyst stage. These results demonstrated that (1) ICSI in the rat could be performed without PVP, (2) injecting PVP in the oocyte is negative effect on normal fertilization and early development embryos
Key words: Pronucleus, embryo, PVP, ICSI, rat
PENDAHULUAN
Intracytoplasmic sperm injection (ICSI) telah digunakan sebagai dasar penelitian fertilisasi pada ternak. Beberapa keberhasilan ICSI telah diperoleh pada beberapa jenis ternak mamalia seperti hamster (UEHARA dan YANAGIMACHI, 1976), kelinci (KEEFER, 1989; Hosoi et al., 1998), sapi (GOTO et al., 1990; GOTO, 1993), babi (IRITANI et al., 1992), manusia (PALERMO et al., 1992; MANSOUR et al., 1995), Kuda (SQUIRES et al., 1996) dan domba (CATT et al., 1996). Selanjutnya ICSI secara rutin digunakan sebagai alat bantu fertilisasi pada manusia (GREENBLATT et al., 1995; PALERMO et al., 1997). Akan tetapi muncul berbagai perdebatan akan keamanan memasukkan spermatozoa kedalam sel telur langsung dengan bantuan pipet injeksi (LAMB, 1999; SCHLEGEL, 1999). Walaupun ICSI tidak memperlihatkan adanya cacat bawaan, tetapi timbul berbagai kontroversi akan resiko genetik dari penggunaan teknik ini (BONDUELLE et al., 1996a,b; ENGEL et al., 1996; GOVAERTS et al., 1996). Uji sebelum kelahiran (prenatal) menunjukkan tingginya kejadian kerusakan kromosom sex hasil ICSI (IN’T VELD et al., 1995). Walaupun alasan tingginya kerusakan kromosom setelah ICSI masih belum jelas, beberapa hipotesa bermunculan. BONDUELLE et al. (1998) mengemukakan bahwa kerusakan kromosom janin hasil ICSI mungkin disebabkan karena penggunaan spermatozoa yang tidak mampu membuahi sel telur secara alami. Dari beberapa alasan, hampir
tidak ada yang mengemukakan karena alasan teknik. Pada pelaksanaan ICSI bukan hanya spermatozoa yang masuk kedalam sitoplasma sel telur tetapi juga medium manipulasi juga terikut masuk. Jika ada material asing yang berefek negatif terhadap pertumbuhan embrio kemungkinan juga menyebabkan kerusakan kromosom embrio tersebut. Polyvinylpyrrolidone (PVP) merupakan benda asing, dimana telah menjadi metode umum dalam pelaksanaan ICSI material tersebut ditambahkan dalam medium manipulasi spermatozoa yang bertujuan untuk memudahkan spermatozoa disedot ke dalam pipet injeksi dan menghindari perlengketan spermatozoa dengan pipet injeksi. Berangkat dari hal tersebut, pada penelitian ini akan menguraikan pengaruh polyvinylpyrrolidone (PVP) terhadap pembentukan pronukleus dan perkembangan awal embrio setelah ICSI pada tikus. Disamping itu juga kami akan melihat tingkat efisiensi pelaksanaan ICSI dengan menggunakan PVP dan tanpa PVP.
MATERI DAN METODE
Media
Medium dasar yang digunakan untuk manipulasi sel telur dan spermatozoa adalah modified Krebs-Ringer
bicarbonate solution dengan penambahan Hepes
berikut; 94.6 mM NaCl, 4.78 mM KCl, 1.71 mM CaCl2, 1.19 mM KH2PO4, 1.19 mM MgSO4, 5.0 mM NaHCO3, 5.56 mM glukosa, 21.58 mM laktat, 0.5 mM Na-piruvat, 4 mg/ml BSA (A-7638; Sigma Chemical Co., St Louis, MO), 75 µg/ml K-penisilin G, 50 µg/ml streptomisin sulfat dan 20 mM Hepes (Sigma), medium ini sama dengan yang digunakan TOYODA danCHANG (1974) untuk in vitro fertilization pada sel telur tikus, kecuali penurunan konsentrasi NaHCO3 dari 25.07 mM menjadi 5,0 mM dan penambahan 20 mM Hepes. Medium yang digunakan untuk mengkultur embrio adalah mR1ECM dengan kompisisi 76.7 mM NaCl, 3.2 mM KCl, 2.0 mM CaCl2, 0.5 mM MgCl2, 25.0 mM NaHCO3, 10.0 mM Na-laktat, 0.5 mM Na-piruvat, 7.5 mM glukosa, 1.0 mg/ml polivinilalkohol, 2% (v/v) Minimal Essential Medium (MEM) essential amino
acid solution (No. 11130-051; Gibco Laboratories,
Grand Island, NY), 0.1 mM glutamin (Sigma), and 1% (v/v) MEM nonessential amino acid solution (No. 11140-050; Gibco) (MIYOSHI et al., 1995a,b).
Koleksi sel telur
Tikus Wistar betina (umur 8-12 minggu) disuperovulasi dengan menyuntikan secara intra -peritoneal 25-30 IU pregnant mare serum gonadotropin (PMSG), diikuti dengan penyuntikan 25-30 IU human
chorionic gonadotropin (hCG) 48 jam kemudian, sel
telur dikoleksi 15-16 jam setelah penyuntikan hCG. Sel kumulus dihilangkan dengan menggunakan 0,1% bovine testicular hyaluronidase (Sigma) dalam Hepes-mKRB. Sel telur yang terkoleksi dicuci dan disimpan dalam mKRB pada suhu 370C, 5% CO2 sambil menunggu persiapan mikromanipulator.
Koleksi spermatozoa dan solasi kepala sperma
Spermatozoa dikoleksi dari cauda epididymis tikus Wistar jantan (umur 4-8 bulan) berdasarkan metode SAID et al. (1999). Pemisahan kepala spermatozoa dengan ekor dilakukan dalam media isolasi. Sonikasi dilakukan pada suhu 00C selama 10 detik dengan menggunakan Ultrasonic sonicator Model Bronson Sonifier 250 pada 30 duty cycle dan 4 out-control. Larutan spermatozoa yang telah disonikasi diencerkan dengan Hepes -mKRB dan dicuci dengan cara sentrifugasi 1,000 g selama 3 menit. Endapan spermatozoa selanjutnya dipindahkan ke kedium manipulasi spermatozoa yang mengandung 5 µg/ml cytocalasin B. Pada penelitian ini dibuat 2 macam medium manipulasi spermatozoa yaitu (1) Hepes-mKRB + 5µg/ml cytocalasin B ditambah dengan 12% (w/v) PVP (360 kDa), dan (2) Hepes-mKRB + 5µg/ml
cytocalasin B tanpa penambahan PVP.
Injeksi spermatozoa ke dalam oosit
Kepala spermatozoa dimasukkan ke dalam sitoplasma sel telur dengan menggunakan mikropipet yang dihubungkan dengan piezo-injection manipulator (PMM-150FU, Prime Tech LTD, Japan). Untuk perlakuan penambahan PVP (kelompok 1), kepala spermatozoa ditempatkan pada spot terpisah dengan spot sel telur. Sedangkan untuk perlakuan tanpa penambahan PVP, kepala spermatozoa dan sel telur ditempatkan bersama dalam satu drop 5 µl Hepes-mKRB mengandung 5 µg/ml cytocalasin B ditutup dengan mineral oil pada temperatur 370C. Kepala spermatozoa diaspirasi ke dalam pipet injeksi, selanjutnya ujung pipet disentuhkan ke zona pellucida sel telur dengan posisi polar body pada jam 6 atau 12. Sambil menekan, dengan sedikit elektrik piezo, zona akan terlubangi. Ujung injeksi pipet secara mekanik ditekan lebih ke dalam sel telur, dan pipet akan masuk ke dalam oolemma sel telur dengan memberikan sedikit elektrik piezo. Kepala sperma dikeluarkan dan masuk ke dalam ooplasma bersama sedikit medium manipulasi.
Pengamatan
Untuk melihat aktivasi sel telur dan status inti kepala spermatozoa, 9-11 jam setelah ICSI sel telur diamati dengan menempatkan di atas slide glass, ditekan dengan penutup glass dan difiksasi dengan glutaraldehyde 2,5% dalam phosphate buffer saline (PBS) pH 7,4. Selanjutnya dicelupkan ke dalam 10% formalin netral selama 4-6 jam pada temperatur ruang. Setelah difiksasi, sampel di-dehidrasi menggunakan ethanol 95%, selanjutnya diwarnai dengan 0,25% lacmoid dalam 45% acetic acid. Sitologi sel telur hasil ICSI secara rinci diamati di bawah mikroskop fase kontras pembesaran 400X (Nikon, Optiphop, HFX-IIA, Japan).
Rancangan percobaan
Percobaan 1 bertujuan untuk melihat pengaruh penambahan polyvinylpyrrolidone (PVP) pada medium panipulasi spermatozoa terhadap activasi dan pembuahan normal sel telur tikus setelah ICSI. Sel telur yang berhasil diinjeksi dengan kepala spermatozoa dari kedua kelompok (medium dengan PVP dan tanpa PVP), dicuci dengan mKRB dan dikultur dengan medium yang sama dalam inkubator CO2 (5% CO2 , 370C). Setelah 9-12 jam sel telur hasil ICSI dari kedua kelompok tersebut difiksasi seperti yang telah diuraikan di atas untuk melihat aktivasi dan status inti kepala spermatozoa.
Seminar Nasional Teknologi Peternakan dan Veteriner _____________________________________________________________________________________________
_____________________________________________________________________________________________ Puslitbang Peternakan, Bogor 29 – 30 September 2003 367
Percobaan 2 untuk melihat kemampuan pertumbuhan awal embrio secara in vitro setelah di ICSI dengan menggunakan medium manipulasi spermatozoa yang mengandung PVP dan tanpa PVP. Embrio yang mempunyai 2 pronuklei pada kedua kelompok penelitian 9-12 jam setelah diinjeksi dicuci dengan mR1ECM dan dikultur dengan medium yang sama sampai 120 jam dalam incubator CO2 (5% CO2, 37C). Setiap 24, 72, 96 dan 120 jam kultur embrio diamati dan perkembangannya dicatat.
Analisa statistik
Data yang diperoleh sebanyak 4 kali ulangan setiap percobaan diuji dengan ANOVA dan perbedaan yang ada diuji dengan uji Fisher’s menggunakan STATVIEW program (Abacus Concepts, Berkeley, CA).
HASIL
Percobaan 1, seperti yang terlihat pada Tabel 1 bahwa 9-12 jam setelah ICSI pada kelompok 1 dari 161 sel telur yang di uji 110 sel telur (68%) teraktivasi ditandai dengan terbentuknya pronukleus betina. Hasil ini tidak memperlihatkan perbedaan yang nyata dengan yang diperoleh dari kelompok 2 123/144 (85%) sel telur. Dari sel telur terativasi, pada kelompok 1 yang berhasil membentuk pronukleus jantan sebanyak 67 (61%) dan berbeda nyata (P<0,001) lebih rendah dengan kelompok 2 94 (76%). Selanjutnya kepala spermatozoa membesar setelah ICSI pada kelompok 1
sebanyak 10/110 (9%) tidak berbeda dengan kelompok 2 sebesar 16/123 (13%). Kepala spermatozoa yang tidak mengalami pembesaran setelah ICSI pada kelompok 1 sebesar 33/110 (30%) nyata lebih tinggi (P<0,001) dengan kelompok 2 yaitu 13/144 (11%).
Percobaan 2, seperti pada Tabel 2 terlihat bahwa pada kelomp ok 1, sel telur hasil ICSI yang dikultur sebanyak 46 berhasil membelah sebanyak 29 embrio (63%) tidak berbeda nyata dengan kelompok 2 45/60 (75%). Embrio yang tumbuh sampai tahap 4 sel atau lebih pada kelompok 1 sebanyak 10 embrio (22%) berbeda nyata lebih rendah (p<0,001) dengan kelompok 2 sebanyak 31/60 (52) embrio. Setelah kultur sampai dengan 120 jam, pada kelompok 1 tidak satupun embrio yang mampu tumbuh sampai tahap morula dan blastosis, sebaliknya pada kelompok 2 embrio mampu tumbuh sampai tahap morula 8/60 (13%) embrio dan blastosis 6/60 (10%) embrio.
PEMBAHASAN
Intracytoplasmic sperm injection (ICSI) merupakan
prosedur yang saat ini semakin luas digunakan sebagai alat bantu fertilisasi. Namun dalam perkembangannya semakin menimbulkan kekhawatiran akan resiko yang mungkin ditimbulkannya. Beberapa factor potensi resiko saat ini sedang diperdebatkan, yaitu (1) dalam pelaksanaan ICSI spermatozoa tidak terseleksi secara alami sehingga ada kemungkinan memasukkan spermatozoa yang tidak normal atau rusak. CUMMINS dan JEQUIER (1994) mengingatkan adanya tanda-tanda
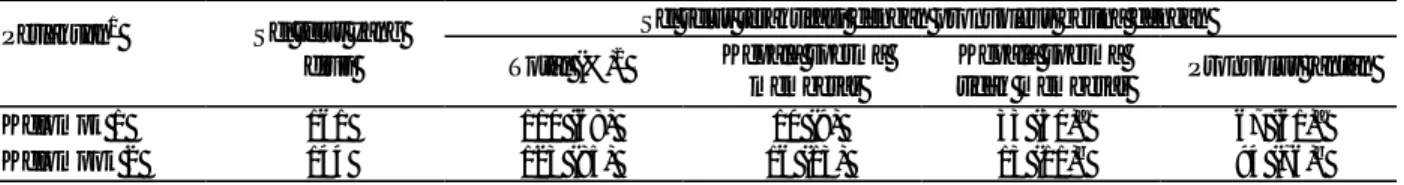
Tabel 1. Pengaruh penambahan polyvinylpyrrolidone (PVP) pada medium panipulasi spermatozoa terhadap aktivasi dan pembuahan normal sel telur tikus setelah ICSI
Sel telur teraktifasi dengan pronukleus betina dengan Perlakuan1 Sel telur yang
diuji Total (%)2 Kepala sperma
membesar
Kepala sperma
tidak membesar Pronuklus jantan
Kelompk 1 161 110 (68) 10 (9) 33 (30)a 67 (61)a
Kelompok 2 144 123 (85) 16 (13) 13 (11)b 94 (76)b
1
Perlakuan sebanyak 4 kali ulangan
3Di dalam kurung menandakan waktu (jam) setelah kultur 4 ICSI dengan PVP 5 ICSI tanpa PVP a,b : p < 0,001
Tabel 2. Pengaruh penambahan polyvinylpyrrolidone (PVP) pada medium panipulasi spermatozoa terhadap pertumbuhan in vitro sel telur tikus setelah ICSI
Jumlah (%)2 embrio berkembang sampai Perlakuan1 Embrio yang dikultur 2-sel
(24)3 4-sel (72)3 Morula (96)3 Blastocyst (120)3 Kelompok 14 46 29 (63) 10 (22)a 0 0 Kelopok 25 60 45 (75) 31 (52)b 8 (13) 6 (10)
kerusakan genetik pada beberapa kasus infertility pria yang berpotensi memberikan resiko negatip jika dilakukan fertilisasi buatan; (2) adanya kemungkinan memasukkan material asing yang tidak diketahui kedalam sitoplasma selama pelaksanaan ICSI, misalnya PVP, runtuhan sel, mineral oil; (3) adanya kemungkinan kerusakan sel telur selama pelaksanaan ICSI, misalnya kerusakan spindle meiotic.
Pada penelitian ini memperlihatkan bahwa penambahan PVP pada medium manipulasi spermatozoa selama pelaksanaan ICSI memberikan efek negatif terhadap pemb entukan pronukleus dan perkembangan awal embrio pada tikus. Sebanyak 67 dari 110 (61%) sel telur teraktivasi setelah ICSI dengan penambahan PVP dalam medium manipulasi spermatozoa mampu membentuk pronukleus jantan. Ketika ICSI dilaksanakan tanpa penambahan PVP, dari 123 sel telur teraktivasi 94 (76%) sel telur mampu membentuk pronukleus jantan, berbeda nyata lebih tinggi (P<0,001) dibanding dengan penambahan PVP. Proporsi kepala spermatozoa yang tertahan atau tidak membesar setelah ICSI dengan PVP 33/110 (30%) berbeda nyata (P<0,001) lebih besar dengan hasil ICSI tanpa PVP 13/123 (11%). Sedangkan efisiensi pelaksanaan ICSI dengan dan tanpa PVP memperlihatkan hasil yang tidak berbeda masing-masing 110/161 (68%) dan 123/144 (85%). Hasil ini memperlihatkan bahwa kalaupun tingkat efisiensi ICSI dengan dan tanpa PVP tidak berbeda namun dalam perkembangan lebih lanjut sampai pembentukan pronukleus jantan ICSI tanpa PVP berbeda nyata lebih baik. Hasil ini mungkin disebabkan karena PVP yang terintroduksi masuk ke dalam sitoplasma membuat “disulphide reducing factor” (factor yang mereduksi disulfide bond yang menyebabkan kepala sperma membesar atau proses dekondensasi) yang terdapat dalam sitoplasma sel telur tidak bekerja maksimal. Terhambatnya proses dekondensasi ke pala sperma mengakibatkan tingkat terjadinya pembuahan normal yang ditandai terbentuknya 2 buah pronukleus (jantan dan betina) dan polar bodi ke-2 menjadi rendah. Hal ini sesuai dengan data yang diperlihatkan pada Tabel 1. PERREAULT et al. (1984) mengemukakan bahwa DNA spermatozoa yang akan membuahi sel telur harus terlebih dahulu melalui proses dekondensasi di dalam sel telur pada saat terjadinya fertilisasi. Proses ini diawali dengan mereduksi rantai disulfide (-S-S-) pada inti spermatozoa yang dibentuk selama di epididimal.
Selanjutnya, sel telur hasil ICSI dengan PVP setelah dikultur selama 120 jam, hanya mampu tumbuh sampai tahap 4-8 sel embrio dan tidak ada embrio yang mampu tumbuh sampai morula dan blastosis. Sebaliknya, ICSI tanpa PVP mampu tumbuh sampai morula 8/60 (13%) dan blastosis 6/60 (10%). Hasil inipun memperlihatkan bahwa ICSI tanpa PVP memiliki daya tumbuh secara in
vitro lebih baik dibanding dengan ICSI dengan PVP.
KESIMPULAN
Dari urain di atas dapat disimpulkan bahwa ICSI pada tikus dapat dilakukan tanpa menggunakan PVP, lebih lanjut bahwa penggunaan PVP memberikan pengaruh negatif terhadap pembuahan normal dan perkembangan awal embrio.
DAFTAR PUSTAKA
BONDUELLE, M., J.LEGEIN, A.BUYSSE, E.VAN ASSCHE, A.WISANTO, P.DEVROEY, A.C.VAN STEIRTEGHEM andI. LIEBAERS. 1996a. Prospective follow-up study of 423 children born after intracytoplasmic sperm injection. Hum. Reprod., 11, 1558-1564.
BONDUELLE, M., A. WILIKENS and A. BUYSSE. 1996b. Prospective follow-up study of 877 children born after intracytoplasmic sperm injection (ICSI), with ejaculated epididymal and testicular spermatozoa and after replacement of cryopreserved embryos obtained after ICSI. Hum. Reprod., 11 (Suppl. 4), 131-155; discussion, 156-159.
CATT, S.L., J.W. CATT, M.C. GOMEZ, W.M.C.MAXWELL and G. EVANS. 1996. The developmental competence of in vitro matured ovine oocytes, cytoplasmically injected with unsorted sperm or sperm sorted for sex by flow cytometry. In: Congress Programme of the 13th International Congress on Animal Reproduction, Sydney, Australia, pp.24.
CUMMINS, J.M. and A.M. JEQUIER. 1994. Treating male infertility needs more clinical andrology, not less. Hum. Reprod., 9, 1214-1219.
ENGEL, W., D. MURPHY and M . SCHMID. 1996. Are the genetic risks associated with microassisted reproduction? Hum. Reprod., 11, 2359-2370.
GOTO, K. 1993. Bovine microfertilization and embryo transfer. Mol. Repro. Dev. 43, 107-119.
GOTO, K., A. KINOSHITA, Y. TAKUMA andK. OGAWA. 1990. Fertilization of bovine oocytes by injection of immobilized, killed spermatozoa. Vet. Rec. 127, 517-520.
GREENBLATT, E.M., J. MERIANO and R.F. CASPER. 1995. Types of stimulation protocol affects oocytes maturity, fertilization rate, and cleavage rate after intracytoplasmic sperm injection. Fertil. Steril. 64, 557-563.
HOSOI, Y., M. MIYAKE, K. UTSUMI and A. IRITANI. 1998. Development of rabbit oocytes after microinjection of spermatozoa (abstract). In: Proceedings of the 11th International Congress on Animal Reproduction and Artificial Insemination, Dublin, Ireland, p.331.
IRITANI, A., K. UTSUMI andY. HOSOI. 1992. Fertilization by assisted micromanipulation of gametes. In: Embryonic Development and Manipulation in Animal Production, ed. A. Lawrie & F. Gandolfi, pp.51-57. London and Chapel Hill: Portland Press.
Seminar Nasional Teknologi Peternakan dan Veteriner _____________________________________________________________________________________________
_____________________________________________________________________________________________ Puslitbang Peternakan, Bogor 29 – 30 September 2003 369 KEEFER, C.L. 1989. Fertilization by sperm injection in the
rabbit. Gamete Res. 22, 59-69.
LAMB, D.J. 1999. Debate: is ICSI a genetic time bomb? Yes [comment]. J. Androl., 20, 23-33.
MANSOUR, R.T., M.A. ABOULGHAR, G.I. SEROUR and I. SALAH. 1995. Intracytoplasmic injection of sperm head only (abstract). J. Assist. Reprod. Gamet. Suppl. 12, OC-293.
MIYOSHI, K., N. TANAKA andK. NIWA. 1995a. Penetration in vitro of naturally ovulated rat eggs and the development of eggs in a chemically defined medium. J. Mamm. Ova. Res. 12, 35-39.
MIYOSHI, K., L.R. ABEYDEERA, K. OKUDA and K. NIWA. 1995b. Effects of osmolarity and amino acids in a chemically defined medium on development of rat one-cell embryos. J. Reprod. Fertil. 103, 27-32.
PALERMO, G.D., H. JORIS, P. DEVROEY and A.C. VAN STEIRTEGHEM. 1992. Pregnancies after intracytoplasmic injection of single spermatozoa into an oocyte. Lancet 340, 17-18.
PALERMO, G.D., COLOMBERO, L.T. andROSENWAKS, Z. 1997. The human sperm centrosome is responsible for normal syngamy and early embryonic development. Rev. Reprod. 2, 19-27.
PERREAULT, S.D., R.A. WOLF andB.R. ZIRKIN. 1984. The role of disulfide bond reduction during mammalian sperm nuclear decondensation in vivo. Dev. Biol. 101, 160-167.
SAID, S., H. FUNAHASHI andK. NIWA. 1999. DNA stability and thiol-disulphide status of rat sperm nuclei during epididymal amturation and penetration of oocytes. Zygote, 7, 249-254.
SCHLEGEL, P.N. 1999. Debate: is ICSI a genetic time bomb? No: ICSI is sefe and effective [see comments]. J. Androl., 20, 18-22.
SQUIRES, E.L., J.M. WILSON, H. KATO andA. BLASZCZYK. 1996. A pregnancy after intracytoplasmic sperm injection into equine oocytes matured in vitro (abstract). Theriogenology 45, 306.
TOYODA, Y. andM.C. CHANG. 1974. Fertilization of rat eggs in vitro by epididymal spermatozoa and the development of eggs following transfer. J. Reprod. Fertil. 36, 9-22.
UEHARA, T. and R. YANAGIMACHI. 1976. Microsurgical injection of spermatozoa into hamster eggs with subsequent transformation of sperm nuclei into male pronuclei. Biol. Reprod. 15, 467-470.