BAB 2
TINJAUAN PUSTAKA
2.1. Air
Air merupakan sumber daya alam yang sangat penting untuk kehidupan setiap
mahluk hidup di bumi ini. Oleh sebab itu diperlukan sumber air yang mampu
menyediakan air yang baik dari segi kualitas dan kuantitas. Pertumbuhan
penduduk yang begitu pesat, mengakibatkan sumber daya air di dunia menjadi
salah satu kekayaan yang sangat penting. Air merupakan hal pokok bagi konsumsi
dan sanitasi umat manusia, untuk produksi barang industri, serta untuk produksi
makanan, kain dan sebagainya. Namun air tidak tersebar secara merata di atas
permukaan bumi akan tetapi bervariasi (Suripin, M., 2001)
Air di permukaan bumi ini terdiri atas 97% air asin di lautan, 2% masih
berupa es, 0,0009% berupa danau, 0,00009% merupakan air tawar di sungai dan
sisanya merupakan air permukaan yang dapat dimanfaatkan untuk kebutuhan
hiidup manusia, tumbuhan dan hewan yang hidup di daratan. Oleh sebab itu, air
merupakan barang langka yang paling dominan dibutuhkan di permukaan bumi
ini (Nugroho,A., 2006).
Menurut Peraturan Menteri Kesehatan RI No.907/MEN.KES/SK/VII/2002
tanggal 29 Juli 2002 tentang Syarat-Syarat dan Pengawasan Kualitas Air, air
minum adalah air yang melalui proses pengolahan yang memenuhi syarat
kesehatan dan dapat langsung diminum. Persyaratan kesehatan air minum yaitu
2.2. Sumur Gali
Sumur gali adalah satu sarana yang paling umum digunakan oleh masyarakat
kecil untuk mengambil air tanah dangkal dan dipergunakan sebagai sumber air
bersih. Air tanah dangkal adalah air yang paling mudah terkontaminansi oleh
rembesan yang berasal dari sarana pembuangan air kotor, jamban dan kotoran
hewan. Sumur gali umumnya dibuat untuk mengambil air tanah bebas sehingga
sangat dipengaruhi oleh musim (Ompusunggu,H., 2009).
Sumur gali menyediakan air yang berasal dari lapisan tanah yang relatif
dekat dari permukaan tanah, oleh karena itu dengan mudah terkena kontaminasi
melalui rembesan. Umumnya rembesan berasal dari tempat buangan kotoran
manusia kakus/jamban dan hewan, juga dari limbah sumur itu sendiri, baik karena
lantainya maupun saluran air limbahnya yang tidak kedap air (Entjang,I., 2000).
Keadaan konstruksi dan cara pengambilan air sumur pun dapat merupakan
sumber kontaminasi, misalnya sumur dengan konstruksi terbuka dan pengambilan
air dengan timba. Sumur dianggap mempunyai tingkat perlindungan sanitasi yang
baik, bila tidak terdapat kontak langsung antara manusia dengan air di dalam
sumur (Entjang,I., 2000).
Cara pengambilan air tanah yang paling tua dan sederhana adalah dengan
membuat sumur gali dengan kedalaman lebih rendah dari posisi permukaan air
tanah. Jumlah air yang dapat diambil dari sumur gali biasanya terbatas, dan air
yang diambil adalah air dangkal. Untuk pengambilan air yang lebih besar
diperlukan luas dan kedalaman galian yang lebih besar. Kedalaman sumur gali
tergantung lapisan tanah, ketinggian dari permukaan air laut, dan ada tidaknya air
bebas di bawah lapisan tanah. Sumur gali biasanya dibuat dengan kedalaman tidak
lebih dari 5-8 meter di bawah permukaan tanah. Cara ini cocok untuk daerah
pantai dimana air tanah berada di atas air asin (Gabriel,J.F., 2001).
2.3. Logam Besi (Fe)
2.3.1. Sifat-Sifat Logam Besi
Besi (Fe) merupakan logam transisi dan memiliki nomor atom 26. Bilangan
oksidasi Fe adalah +3 dan +2. Fe memiliki berat atom 55,845 g/mol, titik leleh
1.5380 C, dan titik didih 2.8610 C. Fe menempati urutan sepuluh besar sebagai unsur di bumi. Fe menyusun 5-5,6 dari kerak bumi dan menyusun 35 % dari
massa bumi. Konsentrasi tertinggi terdapat pada lapisan dalam dari inti bumi dan
sejumlah kecil terdapat di lapisan terluar kerak bumi. Beberapa tempat di bumi
bisa mengandung Fe mencapai 70%. Logam Fe ditemukan dalam inti bumi berupa
hematit. Fe hampir tidak dapat ditemukan sebagai unsur bebas. Fe diperoleh
dalam bentuk tidak murni sehingga harus melalui reaksi reduksi guna
mendapatkan Fe murni. Fe ditemukan terutama sebagai mineral hematit (Fe2O3);
magnetit (Fe3O4); mineral lain yang merupakan sumber Fe adalah limonit
[FeO(OH)nH2O], siderit (FeCO3), dan takonit (Widowati,W dkk., 2008).
Logam besi memiliki warna putih keperakan, yang kukuh dan liat. Asam
klorida encer atau pekat dan asam sulfat encer dapat melarutkan besi.
Fe(s) + 2HCl(aq)→ Fe2+(aq) + 2Cl-(aq) + H2↑(g)
2Fe(s) + 3H2SO4(aq) + 6H+(aq) → 2Fe3+(aq) + 3SO2↑(g) +6H2O(l)
Dengan asam nitrat encer dingin, terbentuk ion besi (II) dan amonia :
4Fe(s) + 10H+(aq) + NO-3(aq) → 4Fe2+(aq) + NH4+(aq) + 3H2O(l)
Asam nitrat pekat yang panas dapat melarutkan besi dengan membentuk gas
nitrogen oksida dan ion besi (III) :
Fe(s) + HNO3(aq) + 3H+(aq) → Fe3+(aq) + NO↑(g) + 2H2O(l) (Svehla,G.,1979)
2.3.2. Logam Besi Dalam Air
Mineral yang sering berada dalam air dengan jumlah besar adalah kandungan Fe.
Apabila Fe tersebut berada dalam jumlah yang banyak akan muncul berbagai
aktivitas industri. Besi dalam air tanah bisa berbentuk Fe(II) dan Fe(III) terlarut
(Widowati,W dkk., 2008). Pada umumnya, besi yang ada di dalam air dapat
bersifat :
a. terlarut sebagai Fe2+ (ferro) atau Fe3+ (ferri) ;
b. tersuspensi sebagai butir koloidal (diameter < 1 mikrometer) atau lebih
besar ;
c. tergabung dengan zat organis atau zat padat yang inorganis (seperti tanah liat)
(Nainggolan,H., 2011).
Perairan yang mengandung besi tidak diinginkan untuk keperluan rumah
tangga, karena dapat menyebabkan bekas karat pada pakaian, porselin dan
alat-alat lainnya serta menimbulkan rasa yang tidak enak untuk air minum. Besi (II)
sebagai ion berhidrat dapat larut, merupakan jenis besi yang terdapat dalam air
tanah, karena air tanah tidak berhubungan dengan oksigen dari atmosfer,
konsumsi oksigen bahan organik dalam media mikroorganisme akan
menghasilkan keadaan reduksi dalam air tanah. Oleh karena itu, besi dengan
bilangan oksidasi rendah yaitu Fe(II) umumnya ditemukan dalam air tanah
dibandingkan Fe(III). Secara umum Fe(II) terdapat dalam air tanah berkisar antara
1,0-10 mg/L, dalam kondisi tidak ada oksigen air tanah mengandung Fe(II) jernih
tetapi saat mengalami oksidasi oleh oksigen yang berasal dari atmosfer ion ferro
akan berubah menjadi ion ferri (Effendi, 2003).
Kadar besi pada perairan yang mendapat cukup aerasi (aerob) hampir tidak
pernah lebih dari 0,3 mg/l, kadar besi pada perairan alami berkisar 0,05-0,2 mg/l.
Pada air tanah dengan kadar oksigen yang rendah, kadar besi dapat mencapai 10-
100 mg/l. Kadar besi >1,0 mg/l dianggap membahayakan kehidupan organisme
akuatik. Air yang diperuntukkan untuk air minum sebaiknya memiliki kadar besi
2.3.3. Akibat Kelebihan Konsentrasi Besi Terlarut
Apabila kosentrasi besi terlarut dalam air melebihi batas, akan menyebabkan
berbagai masalah, diantaranya :
1. Gangguan teknis
Endapan Fe(OH) bersifat korosif dapat mengendap pada saluran pipa, sehingga
mengakibatkan clogging dan mengotori bak/wastafel/kloset.
2. Gangguan fisik
Gangguan fisik yang ditimbulkan oleh adanya besi terlarut dalam air adalah
timbulnya warna, bau dan rasa. Air akan terasa tidak enak bila konsentrasi besi
terlarutnya > 1,0 mg/L karena dapat menyebabkan air berbau seperti telur busuk.
3. Gangguan kesehatan
Senyawa besi dalam jumlah kecil di dalam tubuh manusia berfungsi sebagai
pembentuk sel-sel darah merah, dimana tubuh memerlukan 7–35 mg/hari yang
sebagian diperoleh dari air.
Namun zat Fe yang berlebih pada tubuh dapat menimbulkan masalah bagi
kesehatan, beberapa diantaranya yaitu :
a. Air minum yang mengandung besi cenderung menimbulkan rasa mual
apabila dikonsumsi.
b. Kadar Fe yang besar dapat merusak dinding usus. Kematian sering kali
disebabkan oleh rusaknya dinding usus ini.
c. Kadar Fe > 1 mg/L akan menyebabkan terjadinya iritasi pada mata dan
kulit.
d. Hemokromatesis primer besi akibat dari penyerapan Fe dalam jumlah
berlebih di dalam tubuh. Feritin berada dalam keadaan jenuh akan besi
sehingga kelebihan mineral ini akan disimpan dalam bentuk kompleks
dengan mineral lain yaitu hemosiderin. Akibatnya terjadilah sirosis hati
dan kerusakan pankreas sehingga menimbulkan diabetes (Widowati,W
2.4. Sel Elektrokimia
Sel elektrokimia adalah sel yang menghasilkan transfer bentuk energi listrik
menjadi energi kimia atau sebaliknya, melalui saling interaksi antara arus listrik
dan reaksi redoks (Hiskia,A.,1992).
Reaksi redoks merupakan akibat dari aliran arus listrik yang diberikan dan
berlangsung pada bagian yang disebut elektroda. Pertemuan antara dua fase
dengan komposisi yang berlainan akan menyebabkan perbedaaan potensial antara
dua fase tersebut, sehingga terjadi pemisahan muatan listrik. Transfortasi muatan
listrik antar fase dapat terjadi pada fase elektrolit dan fase elektroda. Elektroda
adalah fase tempat muatan listrik dibawa oleh gerakan elektron. Sedangkan
elektrolit adalah fase tempat muatan listrik dibawa oleh gerakan ion – ion
(Hiskia,A.,1992).
Secara umum sel elektrokimia didefinisikan sebagai 2 elektroda yang
dipisahkan oleh paling sedikit satu fase elektrolit. Elektroda tempat terjadinya
oksidasi disebut anoda dan elektroda tempat terjadinya reduksi disebut katoda.
Oksidasi yaitu suatu perubahan kimia, jika :
a.Suatu zat memberikan atau melepaskan elektron
b.Suatu unsur mengalami pertambahan bilangan oksidasi atau tingkat oksidasi
c.Terjadi pada anoda atau elektroda positif suatu sel elektrokimia
Reduksi ialah suatu perubahan kimia, jika :
a.Suatu zat menangkap atau menerima elektron
b.Suatu unsur mengalami pengurangan bilangan oksidasi atau tingkat oksidasi
c.Terjadi pada katoda atau elektroda negatif suatu sel elektrokimia
2.5. Potensial Elektroda
Suatu reaksi reduksi dapat menimbulkan potensial listrik tertentu yang disebut
potensial elektroda (E0). Makin mudah suatu unsur mengalami reduksi, makin besar E0 yang ditimbulkannya. Terdapat perbedaan potensial antara dua elektroda pada kondisi ada arus ataupun tidak ada arus. Dengan membuat potensial
elektroda lebih negatif, energi elektron akan meningkat dan akan mencapai tingkat
yang cukup untuk mengisi keadaan kosong pada spesi dalam elektrolit. Dalam hal
ini terjadi aliran elektron dari elektroda ke larutan sehingga menimbulkan arus
reduksi. Sedangkan dengan membuat potensial elektroda lebih positif, energi
elektroda dapat direndahkan. Beberapa titik elektron dalam larutan elektrolit akan
mencari energi yang lebih sesuai pada elektroda dan menyebabkan terjadinya
perpindahan elektron dari larutan elektrolit ke elektroda sehingga menimbulkan
arus oksidasi (Putra,M., 2000).
Harga E0 yang dipakai adalah harga E0 relatif yang dibandingkan terhadap suatu elektroda standar sehingga disebut harga E0 yaitu potensial elektroda standar. Sebagai standar dalam menentukan E0 adalah elektroda hidrogen. Gas hidrogen murni dialirkan pada elektroda platina yang bersentuhan dengan larutan
asam (H+). Pada permukaan platina terdapat kesetimbangan : 2H+ + 2e H2
Harga E0 pada reaksi ini ditetapkan 0 Volt. Harga E0 dari semua reaksi reduksi adalah harga yang dibandingkan terhadap E0 Hidrogen ( Putra,M., 2000).
Berdasarkan harga E0 yang tercantum dalam daftar, disusun suatu deret unsur yang disebut deret potensial logam (deret volta) mulai dari
unsur-unsur yang memiliki E0 terkecil sampai kepada unsur yang memiliki E0 terbesar (Putra,M., 2000).
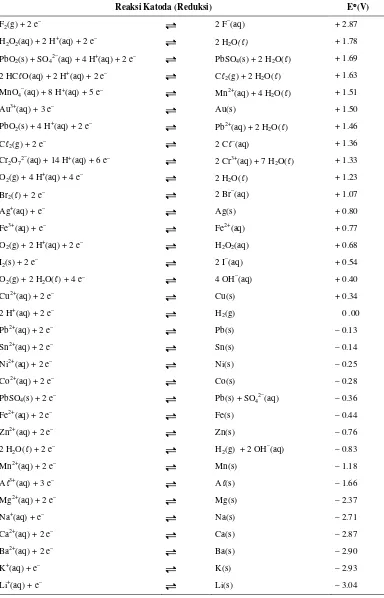
Reaksi katoda atau reduksi ditunjukkan dalam tabel 2.1. Dalam hal ini,
apabila elektroda bertindak sebagai anoda dan menjalani oksidasi, maka reaksinya
Tabel 2.1. Potensial Reduksi Standar (Keenan,C.W., 1999)
Reaksi Katoda (Reduksi) E°(V)
2.6. Elekrokoagulasi
Elektrokoagulasi adalah proses penggumpalan dan pengendapan partikel-partikel
halus dalam air menggunakan energi listrik. Proses elektrokoagulasi dilakukan
pada bejana elektrolisis yang didalamnya terdapat dua penghantar arus listrik
searah yang disebut elektroda, yang tercelup dalam larutan limbah sebagai
elektrolit.
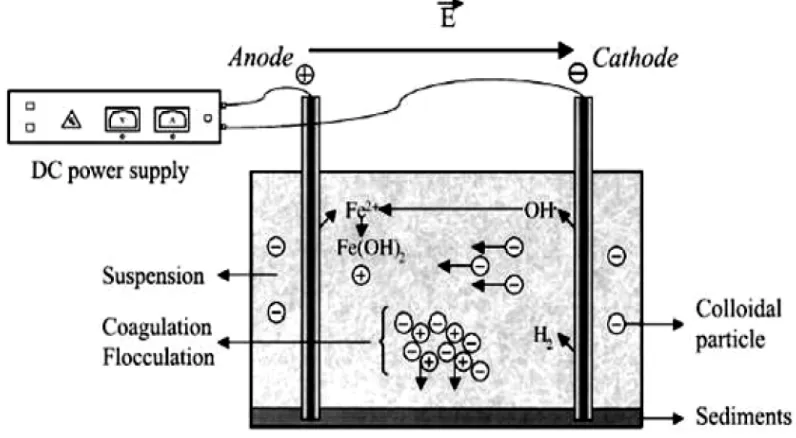
Gambar 2.1 Prinsip dari Proses Elektrokoagulasi (Ni’am,M.F., 2007)
Apabila dalam suatu larutan elektrolit ditempatkan dua elektroda dan
dialiri arus listrik searah, maka akan terjadi peristiwa elektrokimia yaitu gejala
dekomposisi elektrolit, yaitu ion positif (kation) bergerak ke katoda dan menerima
elektron yang di reduksi dan ion negatif (anion) bergerak ke anoda
danmenyerahkan elektron yang dioksidasi. Sehingga membentuk flok yang
mampu mengikat kontaminan dan partikel-partikel dalam limbah (Sutrisno.T.,
1987).
Elektrokoagulasi dikenal juga sebagai elektrolisis gelombang pendek.
air. Itu dapat digunakan menjadi sebuah uji nyata dengan proses yang sangat
efektif untuk pemindahan bahan pengkontaminasi di dalam air. Proses ini dapat
mengurangi lebih dari 99% kation logam berat. Pada dasarnya sebuah elektroda
logam akan teroksidasi dari logam M menjadi kation (M+). Selanjutnya, air akan direduksi menjadi gas hidrogen dan ion hidroksil (OH). Elektrokoagulasi ini
dikenal sebagai reaksi in situ kation logam (Holt,P.K. et al, 2006).
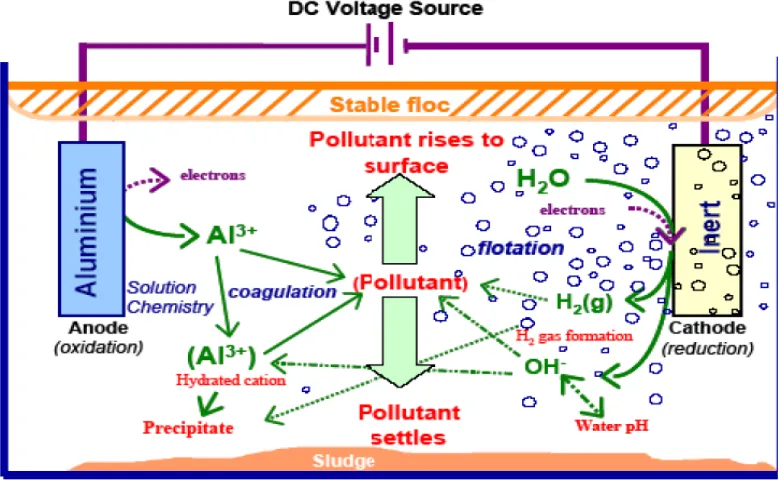
Gambar 2.2. Interaksi Dalam Proses Elektrokoagulasi (Holt,P.K. et al, 2006).
Interaksi yang terjadi dalam larutan :
a. Migrasi menuju muatan elektroda yang berlawanan (elektroporesis) dan
netralisasi muatan.
b. Kation atau ion hidroksil membentuk sebuah endapan dengan pengotor.
c. Interaksi kation logam dengan OH- membentuk sebuah hidroksida, dengan sifat adsorpsi yang tinggi selanjutnya berikatan dengan pollutan (bridge
coagulation).
d. Senyawa hidroksida yang terbentuk membentuk gumpalan (flok) yang lebih
besar .
f. Sesudah flok terjadi, gas H2 membantu Flotasi dengan membawa polutan
kelapisan buih flok di permukaan cairan (Holt,P.K. et al, 2006).
Reaksi yang terjadi pada proses ini adalah :
a. Reaksi pada Katoda
Reaksi pada katoda adalah reduksi terhadap kation, jadi yang diperhatikan hanya
kation saja.
1.Jika larutan mengandung ion- ion logam alkali, ion – ion logam alkali tanah, ion
Al3+ dan ion Mg2+, maka ion – ion logam ini tidak dapat direduksi larutan. Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas hidrogen (H2) pada
katoda. Reaksi yang terjadi di katoda tergantung pada pH air yang diolah. Pada
kondisi netral atau basa, gas hidrogen terjadi dengan reaksi :
2H2O(l) + 2e− → 2OH−(aq) + H2(g) E0 = -0,83 V
Dari daftar E0 diketahui bahwa reduksi terhadap air lebih mudah berlangsung dari pada reduksi terhadap ion – ion diatas.
2.Sedangkan pada kondisi asam, reaksi pembentukan gas hidrogen adalah sebagai
berikut :
2H+(aq) + 2e−→ H2(g) E0 = 0,00 V
3.Jika larutan mengandung ion – ion lain, maka ion – ion logam ini akan direduksi
menjadi masing – masing logamnya dan logam yang terbentuk itu diendapkan
pada permukaan bidang katoda (Holt,P.K. et al, 2006).
Contoh :
Fe2+(aq) + 2e− → Fe(s) E0 = -0,44 V
Mn2+(aq) + 2e− → Mn(s) E0 = -1,18 V
b.Reaksi pada Anoda
Elektroda pada anoda, elektrodanya diketahui dioksidasi (bereaksi) diubah
menjadi ionnya.
Contoh :
Al(s) → Al3+(aq) + 3e− E0 = +1,66 V
Dalam sistem elektrokimia dengan anoda terbuat dari aluminium, beberapa
kemungkinan reaksi elektroda dapat terjadi sebagai berikut :
Anoda :
Al(s) → Al3+(aq) + 3e− E0 = +1,66 V
Katoda :
2H2O(l) + 2e− → 2OH−(aq) + H2(g) E0 = -0,83 V
2H+(aq) + 2e− → H2(g) E0 = 0,00 V
O2(g) + 4H+(aq) + 4e− → 2H2O(l) E0 = +1,23V
(Holt,P.K. et al, 2006).
2.6.1. Flokulasi
Flokulasi adalah penggabungan dari partikel-partikel hasil koagulasi menjadi
partikel yang lebih besar dan mempunyai kecepatan mengendap yang lebih besar,
dengan cara pengadukan lambat. Dalam hal ini proses koagulasi harus diikuti
flokulasi yaitu penggumpalan koloid terkoagulasi sehingga membentuk flok yang
mudah terendapkan atau transportasi partikel tidak stabil, sehingga kontak antar
partikel dapat terjadi (Sutrisno,T., 1987).
Koloid yang tidak stabil cenderung untuk menggumpal, walaupun
kecepatan penggumpalannya sangat lambat. Kecepatan penggumpalan ini
ditentukan oleh banyaknya kontak antar partikel koloid dan efektifitas kontak
yang terjadi karena:
a. Gerak Brown (perikinetik)
b. Gradien kecepatan dalam media suspensi (ortokinetik) yang bergantung pada
temperatur, kecepatan aliran air, jumlah partikel koloid, konsentrasi dan ukuran
2.6.2. Koagulasi
Koagulasi adalah proses destabilisasi partikel – partikel koloid. Partikel – partikel
tersebut membentuk lapisan secara kimia yang kemudian diikuti dengan flokulasi.
Zat – zat kimia yang digunakan untuk mendestabilkan partikel koloid disebut
dengan koagulan. Koagulan yang paling umum dan paling sering digunakan
adalah alum (aluminium sulfat) dan garam – garam besi. Karakteristik dari kation
multivalensi adalah mempunyai kemampuan menarik koagulan ke muatan partikel
koloid (Proste,R.L., 1997).
Pada dasarnya proses koagulasi dapat dilakukan dengan dua cara, yaitu
cara kimia dan cara fisika. Koagulasi cara kimia yaitu proses penjernihan air
dilakukan dengan memberikan penambahan bahan kimia sebagai koagulan
berbentuk garam (aluminium sulfat) untuk mempercepat terjadinya pembentukan
flok yang dapat diendapkan. Sedangkan koagulasi secara fisika yang sering
dinamakan dengan elektrokoagulasi merupakan metode pengolahan air secara
elektrokimia dimana pada anoda terjadi pelepasan koagulan aktif berupa ion
logam (biasanya aluminium atau besi) ke dalam larutan, sedangkan pada katoda
terjadi reaksi elektrolisis berupa pelepasan gas hidrogen (Holt,P.K. et al, 2006).
2.6.3. Kelebihan Elektrokoagulasi
Adapun kelebihan dari elektrokoagulasi yaitu :
a. Elektrokoagulasi memerlukan peralatan sederhana dan mudah untuk
dioperasikan.
b. Elektrokoagulasi lebih cepat mereduksi kandungan partikel-partikel koloid
yang paling kecil, hal ini disebabkan pengaplikasian listrik kedalam air akan
mempercepat pergerakan partikel-partikel koloid didalam air dengan demikian
akan memudahkan proses.
c. Gelembung-gelembung gas yang dihasilkan pada proses elektrokoagulasi ini
d. Dapat memberikan efisiensi proses yang cukup tinggi untuk berbagai kondisi,
dikarenakan tidak dipengaruhi temperatur.
e. Tidak diperlukan pengaturan pH.
f. Tanpa menggunakan bahan kimia tambahan.
g. Endapan yang terbentuk dari proses elektrokoagulasi lebih mudah dipisahkan
dari air.
h. Dapat memindahkan partikel – partikel koloid yang lebih kecil.
I. Dapat diatur arus listriknya (Purwaningsih,I., 2008).
2.6.4. Kekurangan Elektrokoagulasi
Selain kelebihan, elektrokoagulasi juga memiliki beberapa kekurangan yaitu :
a. Tidak dapat digunakan untuk mengolah cairan yang mempunyai sifat elektrolit
kuat dikarenakan akan terjadi hubungan singkat antar elektroda.
b. Besarnya reduksi logam berat dalam cairan dipengaruhi oleh besar kecilnya
arus voltase listrik searah pada elektroda, luas sempitnya bidang kontak
elektroda dan jarak antar elektroda.
c. Elektrodanya dapat terlarut sehingga dapat mengakibatkan terjadinya oksidasi.
d. Penggunaan listrik yang mungkin mahal.
e. Batangan anoda yang mudah mengalami korosi sehingga harus selalu diganti
(Purwaningsih,I., 2008).
2.7. Spektrofotometer Serapan Atom (SSA)
Spektrofotometri Serapan Atom (SSA) adalah spektrofotometri atom yang lebih
melibatkan pada proses penyerapan panjang gelombang yang dipancarkan oleh
suatu unsur atom yang dilewatkan melalui gas pembakar. Dalam beberapa tahun
terakhir ini, SSA telah menjadi salah satu teknik analisis yang banyak digunakan.
Pada kenyataannya, dapat kita katakan bahwa SSA digunakan untuk menganalisa
2.7.1. Prinsip Spektrofotometer Serapan Atom (SSA)
Prinsip dasar spektrofotometer serapan atom dimana jika suatu larutan yang
mengandung suatu senyawa logam dihembuskan kedalam suatu nyala (misalnya
asitilena yang terbakar di udara), dapat terbentuk uap yang mengandung atom –
atom logam itu. Beberapa atom logam dalam gas ini dapat dieksitasi ke tingkat
energi yang lebih tinggi yang cukup tinggi untuk memungkinkan pemancaran
radiasi yang karakteristik dari logam tersebut. Tetapi jumlah jauh lebih besar dari
atom logam bentuk gas itu normalnya tetap berada dalam keadaan tak tereksitasi
atau dengan perkataan lain dalam keadaan dasar. Atom – atom kedaan dasar ini
mampu menyerap energi cahaya yang panjang gelombang resonansinya khas
untuknya, yang pada umumnya adalah panjang gelombang radiasi yang akan
dipancarkan atom – atom itu bila tereksitasi dari keadaan dasar. Jadi jika cahaya
dengan panjang gelombang resonansi itu dilewatkan nyala yang mengandung
atom – atom yang bersangkutan, maka sebagian cahaya itu akan diserap dan jauh
penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang
berada dalam keadaan nyala (Mulja,J.C., 1991) .
2.7.2. Instrumentasi Spektrofotometer Serapan Atom
Sistem peralatan spektrofotometer serapan atom dapat dilihat pada gambar berikut
ini:
1. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga. Lampu ini terdiri
atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. katoda
sendiri berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan
logam tertentu. Tabung logam ini diisi dengan gas mulia (neon atau argon)
dengan tekanan rendah (Rohman,A., 2007).
2. Tempat sampel
Dalam analisis, sampel yang akan dianalisis harus diuraikan menjadi atom-atom
yang masih dalam keadaan atas. Ada beberapa macam alat yang dapat digunakan
untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala dan
tanpa nyala.
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan
menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi
b. Tanpa Nyala (Flameless)
Pengatoman dapat dilakukan dalam tungku dari grafit, kemudian tabung
tersebut dipanaskan dengan system elektris dengan cara melewatkan arus
listrik grafit.. Akibat pemanasan ini, maka zat yang akan dianalisis
berubah menjadi atom-atom netral. (Rohman,A., 2007).
3. Monokromator
Monokromator memisahkan, mengisolasi, dan mengontrol intensitas dari radiasi
energi yang mencapai detector.(Haswell,S.J., 1991).
4. Detektor
Detektor pada spektrofotometer serapan atom berfungsi mengubah intensitas
radiasi yang akan datang menjadi arus listrik. Pada spektrofotometer serapan atom
yang umum dipakai sebagai detektor adalah tabung penggandaan foton
5. Readout
Sistem pencatat yang digunakan pada instrument SSA berfungsi untuk mengubah
sinyal yang diterima melalui bentuk digital, berarti system pencatat menengah
atau mengurangi kesalahan dalam pembacaan skala dan sebagainya, serta
menyeragamkan tampilnya data, yaitu dalam satuan absorbansi (Haswell,S.J.,
1991).
2.7.3. Gangguan Pada SSA dan Cara Mengatasinya
Sampel dalam bentuk molekul karena disosiasi yang tidak sempurna akan
cenderung mengabsorpsi radiasi dari sumber radiasi. Demikian juga terjadinya
ionisasi atom akan menjadi sumber kesalahan pada SSA oleh karena spektrum
radiasi oleh ion jauh berbeda dengan spektrum absorpsi atom netral yang memang
akan ditentukan (Mulja,J.C., 1991).
Ada beberapa cara untuk mengurangi gangguan kimia pada SSA yaitu:
1. Menaikkan temperatur nyala agar mempermudah penguraian untuk itu dipakai
gas pembakar campuran C2H2 + N2O yang memberikan nyala dengan
temperatur yang tinggi.
2. Menambahkan elemen pengikat gugus atom penyangga, sehingga terikat kuat
akan tetapi atom yang ditentukan bebas sebagai atom netral. Misalnya,
penentuan logam yang terikat sebagai garam, dengan penambahan logam, yang
lainnya akan terjadi ikatan lebih kuat dengan anion pengganggu.
3. Pengeluaran unsur pengganggu dari matriks sampel dengan cara eksitasi.