2. TEORI PEMBAKARAN
2.1. PENDAHULUAN
Teori pembakaran merupakan pengetahuan yang penting dalam rangkan memahami proses pembakaran secara benar. Namun sebelum membahas mengenai proses pembakaran terlebih dahulu harus dipahami beberapa definisi dan konsep dasar yang akan ditemui dalam analisis proses pembakaran bahan bakar.
2.1.1. Teori Unsur
Semua benda yang terdapat di alam ini terdiri dari unsur-unsur. Bagian terkecil dari suatu unsur disebut ”Atom”, dimana atom suatu unsur tidak dapat diuraikan lagi secara kimia menjadi partikel yang lebih sederhana tanpa kehilangan sifat unsur aslinya. Contoh unsur-unsur tersebut diantaranya adalah nitrogen, karbon, oksigen, emas, hidrogen, sulfur, dan lain-lain. Sampai saat ini telah ditemukan kurang lebih 111 unsur.
Untuk mempermudah identifikasi, maka tiap-tiap unsur diberi nama. Simbol kimia setiap unsur memakai satu atau dua huruf yang merupakan bagian dari kata dalam bahasa latin. Bila digunakan satu huruf, maka nama unsur ditulis dalam huruf besar. Bila terdiri dari dua huruf, maka huruf pertama huruf besar dan huruf kedua huruf kecil.
Contoh nama unsur dan simbol kimianya : Karbon (carbon) : C.
Hidrogen : H Oksigen : O
Sodium/Natrium : Na Belerang (sulphur) : S
Timah (lead) : Pb = Plumbum
2.1.2. Berat Atom dan Molekul
Atom didefinisikan sebagai pertikel-partikel yang paling kecil yang tidak dapat dibagi lagi. Satu atom tunggal mempunyai diameter kira-kira :
1
cm = 10-8 100.000.000
Atom dari semua elemen terbentuk oleh tiga jenis partikel yang berbeda Elektron, Neutron, dan Proton.
Setiap unsur terdiri dari inti atom dan elektron dimana elektron mengorbit mengelilingi inti atom. Inti atom sendiri terdiri dari neutron dan proton. Atom-atom dari unsur yang berbeda mengandung jumlah neutron, proton, dan elektron yang berbeda. Beberapa jenis unsur seperti besi dan uranium memiliki atom-atom yang mengandung jumlah elektron orbit yang sama dengan jumlah proton dalam inti, tetapi berbeda jumlah neutronnya. Perbedaan semacam ini disebut ’Isotop’.
Karenanya berat atom seperti ini tidak memiliki satuan, sebagai contoh berat atom karbon adalah 12. Ini berarti bahwa atom karbon 12 kali lebih berat dari atom hidrogen. Daftar berat atom unsur-unsur dapat dilihat pada tabel 1.1.
Apabila atom-atom bergabung satu dengan yang lain secara kimia, maka dihasilkan molekul. Atom-atom dari unsur-unsur misalnya hidrogen, oksigen dan nitrogen tidak pernah berdiri sendiri. Atom-atom dari unsur-unsur tersebut selalu bergabung dan membentuk pasangan-pasangan ( H2, O2, N2, ) dan gabungan-gabungan ini juga dinamakan molekul. Apabila molekul bergabung sesuai dengan aturan tertentu maka masing-masing atom atau molekul akan memiliki “ energi gabungan “ dibandingkan atom hidrogen. Energi gabungan tersebut dinamakan valensi.
Jika kita meletakan sejumlah unsur belerang dan karbon kedalam suatu tabung (Container), kemudian dikocok, maka kedua unsur tersebut akan bercampur. Tetapi selama proses pencampuran tersebut, kedua unsur tidak mengalami perubahan sifat dalam arti campuran kedua unsur tersebut masih dapat dipisahkan secara fisik. Dalam istilah kimia, proses seperti ini disebut campuran. Pada campuran, tidak akan terjadi penggabungan atom-atom. Air laut adalah salah satu contoh dari suatu campuran yang terdiri dari garam ( Na Cl ) dengan air (H2 O ). Dalam campuran tersebut kedua macam molekul tidak mengalami perubahan struktur berbeda itu tidak berubah pada campuran.
2.1.3. Komposisi Kimia
Apabila atom-atom atau molekul-molekul unsur bercampur dengan atom-atom atau molekul-molekul unsur lain sehingga membentuk suatu zat baru yang memiliki sifat berbeda dengan unsur-unsur aslinya, maka proses seperti ini disebut sebagai “ reaksi kimia “. Bahan atau zat yang terbentuk sebagai hasil reaksi dinamakan sebagai “komposisi kimia“ atau senyawa ( Chemical Compound ).
Jika kita mereaksikan partikel-partikel karbon dengan oksigen secara sempurna, maka akan dihasilkan gas karbon dioksida ( CO2 ). Kita dapat menyatakan reaksi tersebut sebagai : Carbon plus oksigen menjadi carbon dioksida. Atau secara sederhana :
2.2. ANALISIS BAHAN BAKAR
Bahan bakar adalah senyawa hidrokarbon yang terdiri dari unsur-unsur yang membentuk reaksi pembakaran dengan oksigen. Secara elementer komposisi bahan bakar terdiri dari unsur hidrogen (H), Karbon (C), dan Sulfur (S).
Analisis bahan bakar biasanya dilakukan untuk menentukan macam-macam unsur dalam bahan bakar yang tidak jarang memerlukan waktu.
Bagi keperluan rutin, testing batubara hanya dilakukan untuk menentukan :
• Kandungan embun. • Kandungan abu. • Nilai kalor.
• Kandungan belerang.
Tetapi setiap laboratorium pembangkit listrik juga melakukan pengujian untuk memperoleh data mengenai karakteristik-karakteristik lain batubara yang dianggap penting sesuai dengan kebutuhan unit pembangkitan yang bersangkutan. Ada 2 macam analisis yang lazim dilakukan terhadap batubara yaitu :
(1) Analisis pendekatan (proximate analysis) yang memberikan data tentang kandungan zat terbang, Carbon tetap, abu dan embun. Untuk melengkapi hasil pengujian, biasanya dicantumkan juga data tentang nilai kalor dan kandungan belerang.
(2) Analisis ultimate (ultimate analyisis) yang memberikan data tentang komposisi bahan bakar dalam presentase untuk Nitrogen, Oksigen, Carbon, abu, belerang Chlor dan Hidrogen.
2.2.1. Proximate Analysis.
Merupakan suatu analisis yang dilakukan terhadap sampel batubara untuk menentukan kandungan air (moisture), zat terbang (volatile matter), abu serta Carbon tetap (fixed Carbon).
(i) Kandungan Air (Moisture Content).
Air yang terkandung dalam batubara dapat dibedakan menjadi 3 macam yaitu :
a. Free Moisture.
Semua batubara mengandung free moisture dalam jumlah tertentu. Asalnya mungkin dari air tambang bawah tanah, air yang bergabung dalam proses pembentukan batubara serta semprotan-semprotan air pada proses-proses pencucian maupun berasal dari hujan dan salju.
Pada kebanyakan analisis, free moisture ditetapkan sebagai langkah pertama untuk memeproleh total moisture, termasuk bagian yang menguap ketika sampel dalam proses menuju keseimbangan dengan udara sekitar. Free moisture dinyatakan dalam presentase dan diukur dari berkurangnya berat sampel antara 5 - 15 Kg.
b. Inherent Moisture.
Diukur dengan mengukur kehilangan berat jika 1 Kg sampel dipanaskan dalam oven sampai 105 0C - 110 0C selama 5 - 6 jam dalam aliran udara lambat.
c. Air - Dry Moisture.
Untuk menetapkan kandungan air dari sampel laborat untuk analisis umum, dapat dilakukan dengan 3 cara yaitu : dengan mengeringkan 1 gram sampel dalam sampel dalam suatu oven vakum dengan cara yang sama dan terakhir penimbangan langsung terhadap air yang diserap oleh absorbent (alat penyerap) dari gas Nitrogen kering yang dilewatkan pada batubara yang ditempatkan dalam tabung pemanas.
Jika batubara dipanaskan di udara pada suhu lebih dari 100 0C tetapi dibawah titik nyalanya maka akan terjadi perubahan lain selain hilangnya uap air yang meliputi :
• Kehilangan berat sehubungan dengan evolusi gas-gas serta terurainya batubara. • Bertambahnya berat sehubungan dengan pembentukan peroksida padat. Pemakaian
Nitrogen untuk mengeluarkan Oksigen dapat mencegah terjadinya hal ini.
(ii) Ash Abu.
Ada tiga tipe abu :
a. Inherent ash (abu inherent) - kandungan abu yang tidak dapat dihilangkan dengan metoda pembersihan apapun. Abu inherent boleh dianggap sama seperti unsur-unsur pokok mineral dari bahan tumbuhan dari mana batubara diperoleh, ditambah endapan (lumpur) dimana tumbuhan itu tumbuh.
b. Associated ash (abu campuran) - terdapat pada lapisan betubara sebagai bercak-bercak. Diantaranya terdiri dari semacam zat mineral yang belum terpisahkan dari bingkahan-bungkahan batubara selama penambangan.
c. Adventitous ash - tidak terdapat pada lapisan, tetapi berasal dari lantai atau atap tambang yang tergantung pada kondisi geologis setempat. Adventitous ash mungkin berupa lempung (tanah liat) tahan api atau serpihan Carbon dari tanah liat yang mengendap pada air dangkal dilokasi tambang batubara.
(iii) Zat Terbang (Volatile).
(iv) Fixed Carbon (Karbon Tetap).
Karbon tetap adalah zat yang tidak menguap dan tersisa setelah moisture, volatile
matter (zat terbang) dan kadar abu dihilangkan.
Fixed Carbon = 100 % - % Moisture - % Volatile Matter - % Abu.
Sulfur (belerang) dihitung terpisah, kadang-kadang dihitung sekaliian pada
penentuan nilai kalor.
(v) Nilai Kalor.
Nilai kalor merupakan dasar dan standard bagi penilaian bahan bakar. Nilai kalor adalah ukuran dari energi panas dalam bahan bakar dan merupakan faktor utama dalam penentuan harga batubara. Nilai kalor adalah banyaknya panas yang dapat dilepaskan oleh setiap Kg bahan bakar jika dibakar sempurna. Dalam sistem S.I, nilai kalor dinyatakan dalam satuan KJ/Kg. Ada 4 macam nilai kalor yang berbeda yaitu :
1. Nilai kalor kotor pada volume konstan (Gcv V). 2. Nilai kalor bersih pada volume konstan (Ncv V). 3. Nilai kalor kotor pada tekanan konstan (Gcv P) 4. Nilai kalor bersih pada tekanan konstan (Ncv P)
Bomb calorimeter adalah salah satu alat yang dipakai untuk mengukur nilai kalor kotor pada volume konsstan. Nilai kalor yang lain selanjutnya dapat dihitung jika komposisi bahan bakar diketahui. Kata “Gross (kotor)” menandakan bahwa panas laten penguapan dari air yang terdapat dalam bahan bakar ditambah panas laten dari air yang terbentuk selama pembakaran dimasukkan dalam
Harga Nilai kalor yaitu dengan cara mengembunkannya. Kata “Net (bersih)” menandakan bahwa panas laten untuk membentuk uap air tidak diperhitungkan dalam harga nilai kalor karena panas uap tidak diperhitungkan dalam harga nilai kalor karena panas laten ini terbuang dalam bentuk uap air. Pada prakteknya, panas laten dari uap air ini tidak bisa diperoleh kembali dalam kondisi operasi ketel, sehingga pabrik-pabrik pembuat ketel harus menyatakan harga efisiensi ketel berdasarkan nilai kalor bersih (Ncv). Harga efisiensi ini sekitar 4% lebih tinggi harga efisiensi yang dihitung berdasarkan nilai kalor kotor (Gcv).
Hal ini harus diperhitungkan bila akan membandingkan harga efisiensi ketel yang satu dengan ketel yang lain. Proses pembakaran bahan bakar dalam sebuah bomb calorimeter berbeda dengan proses pembakaran bahan bakar dalam ketel. Proses pembakaran dalam bomb calorimeter berlangsung pada volume konstan sedang proses pembakaran pada ketel berlangsung pada tekanan konstan.
Menentukan Nilai Kalor dengan Menggunakan Bomb Kalori Mater.
Metode penentuan nilai kalor batubara adalah sebagai berikut :
Sejumlah kecil sampel dibakar dalam Oksigen yang ditempatkan didalam cawan yang ditempatkan dalam bejana kalorimeter. Selanjutnya bejana beserta isinya ditempatkan didalam bejana berongga yang lebih besar dimana didalam rongga dinding bejana diisi dengan air untuk membentuk “Jacket”. Ini berfungsi memperkecil transfer panas antara bejana kalorimeter dengan lingkungan.
Kemudian sampel dibakar dengan bantuan penyala listrik. Panas yang dilepaskan dari proses pembakaran sampel tersebut kemudian diukur dengan cara mengukur temperatur air dalam kalorimeter sebelum dan naiknya suhu dikalikan dengan panas jenis air.
Sulfur.
Penetuan sulfur adalah bagian dari analisis ultimate batubara tetapi hal ini dibicarakan secara terpisah karena sangat menentukan harga. Sulfur dalam batubara ditemukan dalam tiga macam bentuk.
(i) Sulfur Sulfat (tak berarti/bisa diabaikan). (ii) Sulfur Organik (rata - rata 0,8%).
(iii) Sulfur Pyritik (rata - rata 0,8%).
Sulfur Sulfat terdapat dalam jumlah kecil Ferrous Sulphate (Fe SO4 7 H20) yang berasal dai oksida pyrite besi (iron pyrites) (FeS) dan batu kapur/gips (Ca SO4 2H2O). Bahan-bahan tersebut terbentuk lapisan tipis dalam batubara ketika larutan telah menguap.
Sulfur organik berkombinasi dengan Carbon dan Nitrogen untuk membentuk batubara. Konsekwensinya bahan tersebut tidak bisa dihilangkan dengan pencucian dan cenderung agak konstan. Pyrites adalah besi belerang (FeS). Bahan ini berbentuk bongkah-bongkah padat dan lapisan yang berbentuk pita (band) tipis. Yang berbentuk partikel padat dihilangkan oleh proses pencucian. Jumlah kandungan pyrite amat bervariasi.
2.2.2. Analisis Ultimat (Ultimate Analysis).
Analisis ultimat adalah suatu analisis yang dilakukan untuk menentukan unsur-unsur yang terkandung dalam bahan bakar termasuk Chlorine, Phospor dan lain sebagainya. Untuk keperluan yang berkaitan dengan teknologi bahan bakar, analisis ultimat terhadap batubara terutama dilakukan untuk mengetahui kandungan Carbon, Hidrogen, Nitrogen dan Sulfur.
Kandungan Oksigen biasanya ditentukan setelah unsur-unsur tersebut diatas diketahui yaitu dengan cara 100 dkurangi jumlah unsur-unsur tersebut dinyatakan dalam persen. Analisis ultimat merupakan sesuatu yang penting terutama dalam aplikasinya untuk keperluan perhitungan dalam bidang teori pembakaran serta neraca panas.
Seperti sudah diketahui bahwa perkiraan nilai kalor - nilai kalor bahan bakar yang dihitung berdasarkan analisis ultimat cukup valid. Hingga saat ini, analisis dasar berdasarkan methode Liebig klasik memerlukan ketrampilan dan pengalaman serta memerlukan waktu yang lama.
Proximate Analisis.
AS RECEIVED
KERING
Moisture
2,82
-
Volatile Matter
32,20
32,12
Fixed Carbon
56,95
58,61
Abu
8,03
8,26
100,00 100,00
Ultimate Analysis.
AS RECEIVED
KERING
CARBON
76,24
78,97
HYDROGEN
4,85
4,99
SULFUR
1,38
1,44
OKSIGEN
4,84
4,98
NITROGGEN
1,34
1,38
ABU
8,03
8,26
MOISTURE
2,82
-
100,00
100,00
Nilai Kalor : 8604 Kcal/Kg - 8854 Kcal/Kg.
2.3. PROSES PEMBAKARAN
2.3.1. Segitiga Api
Pembakaran adalah reaksi kimia yang terjadi jika material mudah terbakar (combustible) berreaksi dengan oksigen sehingga menghasilkan sejumlah panas yang besar. Untuk mendukung terjadinya pembakaran diperlukan tiga kondisi yang harus dipenuhi secara bersamaan, yaitu :
a. Adanya Oksigen
Didalam kimia pembakaran kita memerlukan bercampurnya bahan bakar dengan oksigen. Tanpa oksigen pembakaran tidak akan terjadi. Didalam praktek, oksigen diperoleh dari udara
b. Bahan bakar
Bahan bakar hanya akan menyala apabila temperaturnya naik hingga sesuai dengan temperatur oksigen. Temperatur ini disebut sebagai ”temperatur penyalaan” (ignition temperature). Semua material combustible mempunyai temperatur penyalaan sendiri-sendiri.
c. Sumber penyalaan
Ketiga unsur tersebut biasa disebut dengan segitiga api.
Pada kondisi tertentu bahan bakar dapat terbakar dengan sendirinya tanpa bantuan sumber penyalaan. Pembakaran semacam ini disebut pembakaran spontan. Pembakaran spontan dapat terjadi apabila terdapat oksigen yang kontak langsung dengan bahan bakar serta temperatur bahan bakar disebabkan oleh tekanan atau reaksi kimia yang menghasilkan panas.
Kenaikan temperatur material combustible dapat disebabkan oleh tekanan atau reaksi kimia yang menghasilkan panas. Laju pembakaran dan efisiensi pembakaran tergantung pada :
(i) Waktu (time)
Setiap reaksi kimia memerlukan waktu tertentu untuk terjadinya dan dalam hal pembakaran, bubuk batubara (pf) harus berada dalam zona pembakaran didalam ruang bakar cukup lama agar terbakar semuanya. Kurangnya turbulensi atau ukuran partikel pf yang terlalu besar akan menyebabkan pembakaran masih terjadi di bagian atas ruang bakar dan laluan gas.
(ii) Temperatur
Agar memungkinkan terjadinya pembakaran suatu zat, temperatur zat tersebut harus berada atau diatas tingkat tertentu untuk mendukung terjadinya reaksi pembakaran. Temperatur ini tergantung pada peningkatan kimia zat tersebut atau temperatur penyalaan. Kegagalan mencapai temperatur penyalaan akan menyebabkan masuknya bahan bakar yang bercampur dengan udara di ruang bakar sehingga dapat menimbulkan berbagai masalah nantinya.
(iii) Turbulensi
Oksigen yang dipasok udara ke ruang bakar mungkin melintas langsung tanpa kontak dengan bahan bakar. Turbulensi secara umum mencampur udara dan bahan bakar agar terjadi pembakaran yang sempurna.Pertikel pf yang lebih berat cenderung mengendap didalam pipa menuju burner. Untuk mencegah hal ini, maka aliran campuran udara/pf di pusar (swirled) didalam burner. Selanjutnya turbulensi dilakukan dengan memusar aliran udara sekunder.
2.3.2. Reaksi Kimia C, H, dan S dengan O2
Dalam setiap bahan bakar, unsur yang mudah terbakar adalah Carbon, Hidrogen dan Sulfur. Karena itu, hanya ketiga unsur inilah yang banyak dibahas dalam persamaan rekasi pembakaran.
Carbon (zat arang) :Dalam pembakaran (yaitu penyalaan bahan bakar karena adanya Oksigen), Carbon dan Oksigen bisa menghasilkan dua hasil akhir yang berbeda.
Jika tidak ada cukup Oksigen, maka Carbon tidak akan terbakar seluruhnya. Dua macam persamaan rekasi pembakaran Carbon adalah sebagai berikut :
C + O2 CO2
(untuk Carbon yang terbakar sempurna dan panas yang dihasilkan adalah 8100 Kcal/Kg).
2C + O2 2CO
Reaksi yang kedua menghasilkan produk “Carbon monoksida”.
Mengingat pembakaran tidak sempurna tidak dikehendaki karena tidak esluruh nilai kalor Crabon dilepaskan, maka kita harus memastikan bahwa jumlah Oksigen cukup tersedia untuk membentuk persamaan jumlah reaksi yang pertama. Nanti akan kita lihat bahwa, dalam operasi ketel, kadar Carbonmonoksida didalam gas cerobong dimonitor dengan teliti dan proses pemabakaran dalam ketel diatur sedemikian rupa untuk memperoleh kandungan Carbonmonoksida yang minimum.
HIDROGEN : Hidrogen dalam bahan bakar yang dibakar akan menghasilkan uap air, sesuai dengan reaksi berikut :
2 H2 + O2 2 H2O
Panas yang ditimbulkan sebesar 34.000 Kcal/Kg.
SULFUR : Sulfur yang dibakar akan menghasilkan gas Sulfurdioksida dengan reaksi :
S + O2 SO2
Panas yang ditimbulkan sebesar 2.500 Kcal/Kg.
2.4. KEBUTUHAN UDARA DAN UDARA LEBIH
Dalam pembahasan sebelumnya sudah disebutkan bahwa proses pembakaran membutuhkan bahan bakar dan oksigen, tetapi untuk menggunakan oksigen murni pada ketel merupakan suatu yang sangat mahal. Selain itu juga akan mengakibatkan suhu lokal yang tinggi didalam ruang bakar ketel sehingga dapat merusak pipa-pipa dan logam pembungkus ketel.
Didalam praktek kita menggunakan oksigen yang paling murah dan banyak tersedia yaitu udara. Jika kita mengabaikan kandungan kecil dari gas-gas mulia yang ada dalam udara seperti neon, xenon dan lain sebagainya, maka dapat dianggap bahwa udara kering sebagai campuran dari gas Nitrogen dan Oksigen.
Proporsi Oksigen dan Nitrogen dalam udara baik dalam satuan volume maupun dalam satuan berat berdasarkan persentasenya adalah :
Berdasarkan berat : Oksigen = 23,2%; Nitrogen = 76,8%. Berdasarkan volume : Oksigen = 21% ; Nitrogen = 79 %.
Perbedaan persentase dalam satuan berat dan satuan volume disebabkan oleh kenyataan bahwa jika kita menimbang 21% Oksigen dalam satuan volme 79% untuk sejumlah sampel udara, maka perbedaan berat antara molekul Oksigen dan Nitrogen (Oksigen 16 dan berat Nitrogen 14) membuat analisis tersebut berat sebelah/meragukan berdasarkan berat sehubungan dengan atom-atom Oksigen yang sedikit lebih berat.
2.4.1. Kebutuhan Udara Teoritis.
Analisis pembakaran untuk menghitung kebutuhan udara teoritis dapat dilakukan dengan dua cara :
(1) Berdasarkan pada satuan berat. (2) Berdasarkan pada satuan volume.
Pada analisis pembakaran selalu diperlukan data-data berat molekul dan berat atom dari unsur-unsur yang terkandung dalam bahan bakar. Contoh Berat Atom dan Molekul zat-zat dalam bahan bakar dapat dilihat pada tabel 1.
Analis Pembakaran Berdasarkan Berat
Untuk menghitung kebutuhan teoritis yang diperlukan untuk membaka sempurna sejumlah bahan bakar tertentu, maka analisis ultimat terhadap bahan bakar harus dilaksanakan. Persamaan pembakaran untuk Carbon seprti sudah dijelaskan sebelumnya adalah :
Carbon + Oksigen Karbondioksida
C + O2 CO2
Karena itu, dari tabel berat atom dan berat molekul diatas dapat dilihat bahwa :
12 Kg + 32 Kg 44 Kg
Carbon + Oksigen Karbondioksida
Ini berarti bahwa setiap kg Karbon memerlukan 2,66 Kg Oksigen secara teoritis untuk membakar sempurna Carbon menjadi Carbondioksida.
Demikian pula persamaan untuk Hidrogen adalah :
Hidrogen + Oksigen Air
2H2 + O2 2 H2O
Ini berarti,
4 Kg + 32 Kg 36 Kg
Hidrogen + Oksigen Air
Karena itu,
1 Kg + 8 Kg 9 Kg
Hidrogen + Oksigen Air
Jadi untuk tiap kg hidrogen memerlukan 8 kg oksigen untuk pembakaran sempurna menjadi air. Demikian pula untuk Sulfur, persamaan pembakaran adalah :
Sulfur + Oksigen Sulfurdioksida
S + O2 SO2
Oleh karena itu,
32 Kg + 32 Kg 64 Kg
Sulfur + Oksigen Sulfurdioksida
atau
1 Kg + 1 Kg 2 Kg
Sulfur + Oksigen Sulfurdioksida
Ini berarti untuk tiap kg Sulfur memerlukan 1 kg Oksigen untuk membakar sempurna Sulfur menjadi Sulfurdioksida. Jika Oksigen yang diperlukan untuk membakar masing-masing unsur pokok dalam batubara dihitung dan kemudian dijumlahkan, maka akan ditemukan kebutuhan Oksigen teoritis yang diperlukan untuk membakar sempurna seluruh bahan bakar tersebut.
Tetapi mengingat batubara sendiri biasanya mengandung Oksigen, maka Oksigen ini akan dilepaskan selama proses pembakaran berlangsung dan akan beraksi dengan unsur-unsur yang dapat terbakar didalam bahan bakar.
Oleh karena itu, untuk memeproleh harga kebutuhan Oksigen teoritis yang sebenarnya, maka kebutuhan Oksigen yang telah dihitung berdasarkan persamaan rekasi pembakaran seperti diatas harus dikurangi dengan kandungan Oksigen dalam bahan bakar. Karena bila menggunakan udara untuk proses pembakaran dalam ketel-ketel, maka udara teoritis yang dibutuhkan untuk membakar sempurna 1 kg bahan bakar yang digunakan adalah :
100 Kebutuhan Oksigen teoritis x
23,2
Karena 23,2% udara mengandung Oksigen. Rumus untuk menghitung kebutuhan udara teoritis adalah :
Kebutuhan udara teoritis = 100/23,2 [ O2 yang diperlukan oleh Karbon + O2 yang diperlukan oleh Hidrogen + O2 yang diperlukan oleh Sulfur - O2 dalam batubara]
Secara sistematis ini biasa dinyatakan sebagai : udara teoritis = 100/23,2 [O2 yang
diperlukan olah C + O2 yang diperlukan oleh H2 + O2 yang diperlukan oleh S - O2 dalam bahan bakar] .
Udara teoritis = 4,31 [2,66 C + 8 (H - O/8) + S] Kg/100 Kg.
Dimana C = % Carbon/Kg bahan bakar H = % Hidrogen/Kg bahan bakar O = % Oksigen/Kg bahan bakar S = % Sulfur /Kg bahan bakar
Karena 100 Kg udara mengandung 23,2 Kg Oksigen. Dengan demikian 1 Kg dikandung dalam :
100
Contoh :
Analisis ultimate sejenis batubara adalah :
Carbon ( C ) 56,8% Hidrogen (H) 3,7% Nitrogen (N) 1,3% Sulfur (S) 2,0% Oksigen 7,0% Abu (ash) 16,7% Moisture 12,5%
100,0%
Hitung kebutuhan udara teroitis :
Oksigen Minimal yang diperlukan untuk Carbon : Carbon yang ada dalam 1 Kg bahan bakar = 0,568 Kg. Jika 1 Kg Karbon memerlukan 2,66 Kg Oksigen, maka : 0,568 Kg Carbon memerlukan :
2,66 x 0,568 = 1,515 Kg
Oksigen Minimal yang diperlukan untuk Hidrogen :
Hidrogen yang terdapat dalam 1 Kg bahan bakar = 0,037 Kg. Jika 1 Kg Hidrogen memerlukan S Kg Oksigen, maka : 0,037 Kg Hidrogen memerlukan :
8 x 0,037 = 0,296 Kg.
Okigen Minimal yang diperlukan untuk Sulfur : Sulfur yang ada dalam 1 Kg bahan bakar = 0,02 Kg. Jika 1 Kg Sulfur memerlukan 1 Kg Oksigen, maka : 0,02 Kg Sulfur memerluka :
1 x 0,02 = 0,02 Kg.
Nitrogen dan abu bukan merupakan unsur-unsur yang dapat terbakar sehingga tidak memerlukan Oksigen. Oksigen yang terdapat dalam 1 Kg bahan bakar adalah 0,07 Kg. Oleh karena itu, dari persamaan ;
Udara teoritis = 100/23,2 [O2 yang diperlukan oleh C + O2 yang diperlukan oleh H2 + O2 yang diperlukan oleh S - O2 dalam bahan bakar].
Maka udara teoritis (UT) = 100/23,2 [1,515 + 0,296 + 0,02 - 0,07] 100/23,2 [1,831 - 0,07]
4,31 x 1,761
7,59 kg udara per 1 kg bahan bakar.
Analisis Pembakaran Berdasarkan Volume.
Untuk menentukan udara teoritis yang diperlukan, maka kita harus mengerti hukum dasar yang diperkenalkan seorang ilmuwan yang bernama “Avogadro” dan disebut hukum Avogadro. Hukum ini menyatakan : “Gas-gas dengan volume yang sama pada suhu dan tekanan standard (00C dan tekanan sebesar 1 bar) berisikan molekul-molekul dalam jumlah yang sama”.
Dari hukum ini dapat ditarik kesimpulan bahwa proporsi yang dinyatakan dengan jumlah molekul adalah juga proporsi berdasarkan volume. Oleh karena itu, jika suatu gas memiliki jumlah molekul 2 kali lebih banyak dibanding jumlah molekul pada gas lain, maka gas yang pertama akan mempunyai volume 2 kali besar dari gas yang kedua.
Jika kita menyatakan berat gas dengan “Gram Molekul”, yaitu berat molekul gas tersebut dikalikan satu gram, maka akan ditemukan bahwa berat gram molekul dari gas apa saja akan mengisi volume yang sama pada suhu dan tekanan yang standard. Volume ini adalah 22,4 liter. Dengan mengacu pada tabel 3.1, maka molekul dari suatu gas adalah
2 gram Hidrogen akan mengisi 22,4 liter. 32 gram Oksigen akan mengisi 22,4 liter.
28 gram Nitrogen akan mengisi 22,4 liter, dan seterusnya untuk gas-gas lain.
Berikut dibawah ini menyatakan persamaan reaksi pembakaran berdasarkan volume.
Untuk Hidrogen :
Hidrogen + Oksigen Air
2 H2O + O2 2 H2O
2 volume + 1 volume 2 volume.
Yaitu :
2 liter + 1 liter 2 liter
Hidrogen + Oksigen Air
Atau :
1 liter + ½ liter 1 liter
Hidrogen + Oksigen Air.
Untuk Methane (CH4)
Methane + Oksigen Karbondioksida + Uap air
CH4 + 2 O2 CO2 + 2 H2O
1 volume + 2 volume 1 volume + 2 volume 1 liter + 2 liter 1 liter + 2 liter
Methane + Oksigen Karbon monoksida + Uap air
Untuk Carbon Monoksida
Karbon monoksida + Oksigen Karbon dioksida
2 CO + O2 2 CO2
2 liter + 1 liter 2 liter
atau,
1 liter + ½ liter 1 liter
Karbon monoksida + Oksigen Karbon dioksida
Berikut ini jika sampel gas alam mempunyai analisis volume sebagai berikut :
Hidrogen 15%
Methane 2%
Carbonmonoksida 21% Carbondioksida 6%
Nitrogen 54%
Oksigen 2%
Udara minimal (atau udara teoritis) yang diperlukan untuk pembakaran sempurna bisa dikalkulasikan/dihitung berdasar rumus berikut :
Udara teoritis = 100/21 [O2 yang diperlukan oleh H2 + O2 yangdiperlukan oleh CH4 + O2 yang diperlukan oleh CO - O2 dalam bahan bakar].
Udara yang mengandung 21% Oksigen berdasar volume. Untuk 1 liter bahan bakar.
Oksigen Teoritis yang diperlukan untuk Hidrogen
Hidrogen yang terdapat dalam 1 liter bahan bakar = 0,15 liter. Karena itu, jika 1 liter H2 memerlukan 0,5 liter O2 maka 0,15 liter memerlukan = 0,5 x 0,15 = 0,075 liter Oksigen.
Oksigen Teoritis yang diperlukan untuk Carbon monoksida.
Carbon monoksida yang terdapat dalam 1 liter bahan bakar = 0,21 liter. Karena itu, jika 1 liter Carbon monoksida memerlukan0,5 liter Oksigen maka 0,21 liter memerlukan 0,5 liter Oksigen maka 0,21 liter memerlukan = 0,5 x 0,21 = 0,105 liter Oksigen. Carbon dioksida dan Nitrogen tidak bisa terbakar dan tidak memerlukan Oksigen.
Oksigen yang tedapat dalam bahan bakar 0,02 liter. Karena itu :
Udara teoritis = 100/21 [O2 yang diperlukan H2 + O2 yang diperlukan oleh CH4 + O2 yang diperlukan oleh CO - O2 dalam bahan bakar].
Udara teoritis = 100/21[0,075 + 0,04 + 0,015 - 0,02] = 100/21 x 0,218
= 1,04 liter udara.
Kini sudah dapat diketahui bahwa kebutuhan udara minimal atau teoritis untuk
pembakaran sempurna dapat dihitung baik dalam satuan berat maupun dalam satuan volume.
2.4.2. Pembakaran Sempurna.
Tetapi mengingat udara lebih akan membawa panas keluar cerobong, maka jumlah udara harus merupakan kompromi antara bertujuan untuk menciptakan pembakaran sempurna serta usaha untuk mengurangi kerugian panas ke cerobong sekecil mungkin.
Jumlah udara lebih yang diperlukan tergantung pada tipe ketel dan komposisi bahan bakar yang sedang dibakar serta jenis bahan bakar seperti batubara, minyak atau gas. Secara umum, udara lebih pada ketel modern berkisar antara 19% - 35%.
Udara lebih dapat diketahui dengan rumus :
Udara sebenarnya - udara teoritis
% kelebihan udara = x 100%
udara teoritis
Dibawah ini dapat dilihat banyaknya gas CO2 yang keluar dicerobong dan udara lebih (Excess air) yang dibutuhkan.
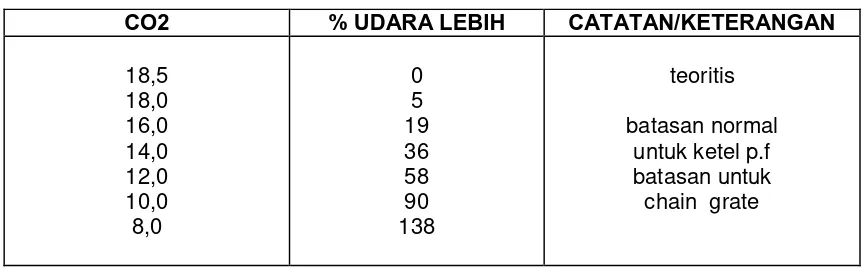
Tabel 4. Hubungan Gas CO2 dan Udara Lebih.
CO2 % UDARA LEBIH CATATAN/KETERANGAN
18,5
CO2 teoritis
% udara lebih = ( - 1) x 100 CO2 aktual
Secara umum, harga % CO2 teoritis untuk bahan bakar adalah sebagai berikut :
BAHAN BAKAR % CO2
Bahan bakar minyak
Batubara - batubara Bituminous Gas alam
15,3 18,5 11,7
Pemantauan terus-menerus terhadap jumlah udara lebih yang disuplai ke ketel dapat dilakukan dengan cara mengukur persentase Carbondioksida. Hal ini disebabkan karena makin banyak udara lebih ditambahkan kedalam ketel, maka persentase Carbondioksida dalam gas asap akan turun sebagai akibat dari bertambahnya jumlah total udara yang dipakai. Dengan kata lain, udara lebih akan menipiskan (dilute) Carbondioksida.
Menentukan udara lebih dengan berdasarkan jumlah gas O2 keluar cerobong.
Udara lebih pada ketel bisa ditentukan dari jumlah O2 dalam gas asap dengan persamaan :
O2 % x 100 Udara lebih =
21 - O2 %
Dengan mensubtitusikan harga O2 kedalam rumus diatas, maka akan kita ketahui % udara lebih seperti contoh berikut :
% O2 0 2 4 6 8 10
10,5
% Udara lebih 0 11 24 40 62 91 100
Menentukan udara lebih dengan berdasarkan jumlah gas CO2 keluar cerobong.
Selain itu, udara lebih juga bisa ditentukan dari % CO2 bila CO2 maksimal teoritis untuk bahan bakar yang digunakan diketahui. Seperti sudah diperlihatkan sebelumnya bahwa presentase CO2 ini adalah sekitar 18,5 % untuk batubara Bituminous.
% CO2 teoritis Udara lebih =
% CO2 yang aktual
Bila disubtitusikan harga CO2 aktual kedalam rumus diatas, maka akan kita peroleh % udara lebih seperti pada contoh dibawah.
% CO2 18,5 16,0 14,0 10,0 8,0 6,0
Untuk bahan bakar minyak % CO2 teoritis adalah 15,3%.
Dengan cara yang sama akan diperoleh % udara lebih sebagai berikut :
% CO2 15,3 14,0 12,0 10,0 8,0
6,0
% Udara Lebih 0 9,3 27,5 53,0 91,8 155
2.4.3. Pengaruh Udara Lebih (excess air)
Seperti telah diuraikan diatas bahwa tanpa udara lebih sulit memperoleh pembakaran yang sempurna. Karena itu, dalam proses pembakaran selalu diperlukan udara lebih. Besarnya udara lebih yang diperlukan untuk bahan bakar batubara tidak sama dengan yang diperlukan oleh banah bakar minyak. Besarnya udara lebih harus tepat karena sebenarnya udara lebih ini akan membawa sejumlah panas keluar ke cerobong. Jadi sebenarnya udara lebih ini merupakan suatu kerugian bila ditinjau dari segi efisiensi. Sekalipun demikian, tanpa udara lebih juga merupakan kerugian bila ditinjau efisiensi. Karena itu jumlah udara lebih harus tepat dan ini merupakan kompromi antara besarnya kerugian karena udara lebih dengan kerugian karena pembakaran tak sempurna. Dengan kata lain, jumlah udara lebih harus dibuat pada suatu harga tertentu dimana pada harga tersebut besarnya kerugian yang diakibatkan berada pada tingkat minimum. Dibawah ini dapat dilihat gambar ilustrasi proses pembakaran dengan variasi Excess Air.
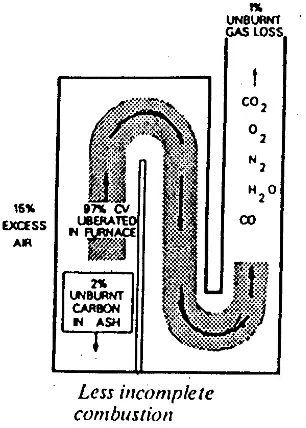
Pada gambar 1a terlihat bahwa tanpa udara lebih, kerugian karena pembakaran tak sempurna mencapai sekitar 25% yang terdiri dari 15% kerugian pada gas asap sedang 10% pada abu dan debu. Dengan 15% udara lebih seperti gambar 1b kerugian karena pembakaran tak sempurna akan berkurang menjadi sekitar 3 % tetapi kerugian gas asap bertambah besar.
Gambar 2. Kondisi gas buang dengan excess Air 100%.
Pada gambar 1a terlihat bahwa tanpa udara lebih, kerugian karena pembakaran tak sempurna mencapai sekitar 25% yang terdiri dari 15% kerugian pada gas asap sedang 10% pada abu dan debu. Dengan 15% udara lebih seperti gambar 1b kerugian karena pembakaran tak sempurna akan berkurang menjadi sekitar 3 % tetapi kerugian gas asap bertambah besar.
Pada gambar 2 dengan 100% udara lebih, kerugian karena pembakaran tak sempurna turun menjadi sekitar 0,5% tetapi kerugian gas asap menjadi besar. Jadi dengan naikanya udara lebih, kerugian karena pembakaran tak sempurna turun tetapi kerugian karena panas yang dibawa oleh gas keluar cerobong bertambah.
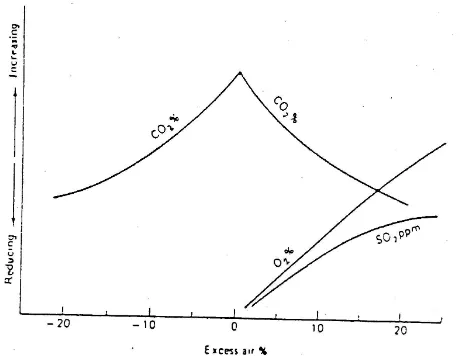
Kurva besarnya kedua kerugian tersebut dapat dilihat pada gambar 3, yaitu kurva menunjukkan hubungan antara jumlah Excess Air yang dipakai dan Heat Loss (kehilangan panas) pada ketel.
Pada gambar 3, terlihat bahwa kerugian minimum (heat loss terendah) terjadi pada harga Excess Air sekitar 22%. Untuk pengoperasian yang efisien, maka ketel harus dioperasikan dengan jumlah udara lebih dimana harga kerugian minimum. Karena itu, memonitor udara lebih menjadi hal yang cukup penting. Pada Pembangkit PLTU untuk memonitor banyaknya Excess Air dengan mengukur % gas CO2 atau % gas O2 pada gas buang.
2.5. PENGARUH SUHU PADA PEMBAKARAN
Proses pembakaran suatu zat (bahan bakar) dapat terjadi, bilamana temperatur dari zat tersebut berada pada suatu harga tertentu yang cukup untuk memulai terjadinya reaksi pembakaran. Harga temperatur ini tergantung pada komposisi kimia dari masing-masing zat dan temperatur ini disebut sebagai “Temperatur Penyalaan”. Oleh karena itu temperatur ruang bakar harus cukup tinggi untuk menjamin bahwa campuran bahan bakar dan udara akan mencapai temperatur penyalaannya pada zona pembakaran. Dibawah ini table temperatur penyalaan untuk berbagai unsur persenyawaan.
Tabel 4. Temperatur Penyaaan Berbagai Unsur Persenyawaan.
JENIS BAHAN ZAT
SIMBOL KIMIA TEMPERATUR PENYALAAN
C F
Salah satu unsur yang terkandung dalam bahan bakar adalah Sulfur. Sulfur bila dibakar akan menghasilkan panas. Dengan demikian Sulfur juga memberikan kontribusi terhadap nilai kalor bahan bakar. Meskipun demikian, adanya Sulfur didalam bahan bakar akan meningkatkan potensi pembentukan Asam Sulfat yang sangat korosif terhadap logam.
a. Produksi Asam.
Reaksi pembakaran belerang dan pembentukan Asam Sulfat adalah sebagai berikut :
S + O2 SO2
Dalam pembakaran Belerang (S) akan bereaksi dengan Oksigen menjadi Belerang dioksida (SO2). Selanjutnya dengan adanya Oksigen berlebih akan membentuk Belerang trioksidda (SO3) dan yang terakhir ini akan bereaksi dengan air (H2O) akan membentuk Asam Sulfat (H2SO4) yang korosif.
Korosi dan Deposit.
Bilamana temperatur gas buang pada cerobong lebih rendah dari titik embun gas Asam Sulfat maka Asam Sulfat akan membentuk deposit dan akan menempel pada logam-logam yang dilalui gas asap. Hal ini akan mengakibatkan berlangsungnya proses korosi suhu rendah oleh Asam Sulfat terhadap logam-logam tersebut.
Komponen ketel yang paling sering terkena korosi Asam Sulfat adalah elemen sisi dingin Pemanas Udara (Air Heater). Salah satu cara untuk mengurangi resiko terhadap korosi Asam Sulfat adalah mencegah pengembunan Asam Sulfat. Hal ini dapat dicapai dengan mengusahakan agar temperatur didaerah elemen sisi dingin Air Heater selalu lebih tinggi dari titik embunnya. Titik embun ini tergantung pada kandungan Sulfur dalam bahan bakar serta % udara lebih.
Gambar 4a, korelasi antara titik embun terhadap % udara lebih untuk bahan bakar dengan kandungan Sulfur 3%.
2.5.2. Pengaruh Kadar Abu
Bahan bakar yang banyak mengandung abu adalah betubara. Sedangkan bahan bakar minyak sangat sedikit mengandung abu. Unsur-unsur dalam abu yang menimbulkan masalah korosi dan penggerakan adalah Natrium, Vanadium. Pengaruh unsur-unsur tersebut adalah sebagai berikut :
• Memakan permukaan batu tahan api, menyebabkan korosi dan erosi sehingga bisa bersih.
• Mengurangi availability karena pembentukan kerak boiler tubes, ekonomiser dan air heater.
• Menyebabkan korosi pada pipa superheater karena pemebntukan kerak Natrium Vanadet yang mempunyai titik leleh yang rendah (600 - 900 0C).
Kandungan abu yang tinggi dalam batubara akan mempengaruhi kapasitas peralatan untuk fuel dan ash handling. Bila kandungan abu naik dari 5% menjadi 10%, maka batubara yang dibutuhkan akan naik sebesar 5% dan abu yang ditangani akan menjadi dua kali lipat. Kandungan abu yang tinggi juga akan menaikkan biaya pulverizer. Dengan demikian biaya operasi akan dipengaruhi oleh kandungan abu. Yang lebih penting lagi adalah komposisi abu, yaitu senyawa-senyawa yang terdapat dalam abu serta titik lelehnya. Semua itu merupakan faktor penting bagi desain boiler.
Titik leleh akan menentukan furnance combustion rate dan pendinginan yang diperlukan bagi gas buang sebelum masuk daerah konveksi. Senyawa-senyawa tersebut juga akan mempengaruhi terjadinya slagging, fouling dan korosi dalam furnance dan peralatan akan menentukan kebutuhan sootblower. Natrium adalah salah satu unsur yang menyebabkan fouling didaerah konveksi.
Senyawa dalam abu umumnya dikelompokkan menjadi dua, yaitu senyawa asam terdiri dari Oksida silika (SiO2), Alumina (Al2O3) dan Titanium (TiO2) dan yang kedua adalah senyawa bata yang terdiri dari Oksida besi (Fe2O3), Kalsium (CaO), Magnesium (MgO), Natrium (NaO) dan Kalium(K2O).
2.6. GAS BUANG
2.6.1. Asap.
Gas bekas adalah merupakan material tak terlihat yang disebarkan melalui cerobong. Secara umum, gas asap berwarna hitam yang keluar dari cerobong menunjukkan bahwa proses pembakaran didalam ketel yang berlangsung secara kurang sempurna. Penyebab terbentuknya asap yang berwarna hitam ada beberapa faktor seperti :
a. Terbawanya debu dengan jumlah yang cukup banyak dalam gas asap.
b. Terdapat Carbon yang tak terbakar pada gas asap dalam bentuk jelaga (soot).
c. Adanya gas-gas berwarna seperti SO2, Nox terutama pada saat pembakaran minyak. d. Adanya uap volatile matter.
Tetapi gas asap yang keluar dari cerobong juga dapat berwarna hitam meskipun hanya mengandung sedikit Carbon yang takk terbakar yang bila ditinjau dari segi efisiensi, hal ini sebenarnya dapat diabaikan. Sebaliknya, asap yang berwarna jernih secara umum menyatakan bahwa proses pembakaran berlangsung secara sempurna. Terutama pada proses pembakaran minyak.
Asap yang jernih biasanya dapat diperoleh dengan cara menurunkan % CO2 pada suatu harga tertentu dimana udara lebih berada sedikit diatas harga optimum.
Selain berkaitan dengan masalah efisiensi, kepekatan gas asap juga berkaitan dengan masalah lingkungan. Asap yang pekat akan mencemari lingkungan dengan kadar pencemaran yang lebih besar. Oleh sebab itu, pengukuran kepekatan gas asap menjadi faktor yang perlu diperhatikan oleh pengelola PLTU mengenai lingkungan hidup yang ketat.
Pengukuran kepekatan gas asap dapat dilakukan dengan menggunakan kartu “Ringelmann” atau dengan menggunakan meter asap tipe photo cell.
6.2. Persentase CO2 dan O2.
Banyaknya persentase CO2 dan O2 dalam gas buang sangat mempengaruhi efisiensi dari pembakaran. Dengan menggunakan segitiga Ostwald, kita dapat menganalisa apakah pembakaran berlangsung secara sempurna atau tidak.
CO2 A max
P
CO2
O O2 B 21% O2 (dalam udara)
Gambar.5 Diagram Segitiga Ostwald.
Dari segitiga Ostwald :
CO2 n =
CO max
0,21 n =
0,21 - 0
O2 U’ - U’min =
0,21 U’
CO2 dan O2 prosen volume gas sisa pembakaran. Dari diagram dapat dijelaskan sebagai berikut :
• Gas CO2 dan O2 diukur dari gas sisa pembakaran dalam prosen volume sisa pembakaran.
• CO2 max adalah angka teoritis maksimum yang dapat dicapai oleh jenis bahan bakar yang dipakai dan ditentukan oleh komposisi bahan bakar. Dari rumus didapat :
1,866 . C
CO max = x 100%
G’min
• Sumbu horizontal menunjukkan bahwa dalam udara pembakaran terdapat 21% volume gas Oksigen.
• Garis AB menunjukkan dimana terjadi pembakaran sempurna.
6.3. Pengendalian Gas Buang.
Salah satu masalah dari suatu PLTU berbahan bakar fosil adalah dispersi (sebaran) sebagai sisa pembakaran yang berupa abu terbang (debu), smoke (asap), SO2 dan Nox yang keluar cerobong. Beberapa hasil sisa pembakaran dianggap sebagai pollutant (zat pencemar). Dispersi buangan sisa pembakaran ini diusahakan kadarnya serendah mungkin, dengan meninggikan cerobong sehingga sampai kepermukaan tanah pada batas kadar yang dapat diterima (diijinkan).
a. Penangkap Abu.
Abu terbang (debu) yang terbawa oleh gas sisa pembakaran merupakan salah satu zat pencemar utama PLTU berbahan bakar batubara. Seperti yang diketahui bahwa 80% kandungan abu batubara, pada proses pembakaran akan menjadi abu terbang dan dibuang lewat cerobong. Untuk mengontrol abu terbang dilakukan dengan cara sebagai berikut :
1. Menggunakan penyaring kain (baghouse).
2. Menggunakan pengendap abu elektrostatik (Electrostatic Precipitator).
Pengendapan abu elektrostatik dianggap salah satu cara yang paling berhasil untuk menurunkan kadar emisi abu terbang. Efisiensi pengumpulam abu tergantung dari daya hantar listrik abu terbang, sedang daya hantar listrik abu erbang tergantung dari luas permukaan penyerapan air, garam-garam dan kadar asam belerang (H2SO4).
b. Desulfurisasi (De SO x).
Belerang (S) yang terkandung dalam bahan bakar adalah salah satu sumber pencemaran udara. Kadar total belerang dalam bahan bakar dapat bervariasi antara : < 1 - 10%. Sebagian besar belerang dioksida (SO2). Gas SO2 ini akan teremisikan ke atmosfir dan merupakan salah satu penyebab timbulnya hujan asam. Beberapa cara untuk mengontrol emisi SO2.
1. Mempergunakan bahan bakar yang berkadar belerang rendah. 2. Memasang alat gas Desulphurization Plant.
3. Mempergunakan sistem pembakaran dengan metode Fluidized - bed untuk PLTU berbahan bakar batubara.
c. Denitrogenisasi (De NOx).
Nitrogen oksida (NOx) terbentuk pada sistem suhu tinggi selama pembakaran, dari oksidasi Nitrogen dalam bahan bakar dan bisa juga dari Nitrogen yang berasal dari udara pembakaran. Emisi NOx ini merupakan salah satu penyebab timbulnya hujan asam. Terbentuknya emisi NOx tergantung pada :
1. % N2 dalam bahan bakar. 2. O2 dalam zona pembakaran.
3. Reaktifitas berbagai macam senyawa N2 dalam bahan bakar.
Beberapa metode untuk mengurangi emisi NO x :
1. Suhu pembakaran tidak melebihi 1650 0C. 2. Pembakaran 2 tingkat :
Tingkat pertama dilingkungan yang kaya bahan bakar (fuel rich).
Tingkat kedua sisa udara diteruskan lebih lanjut ketengah sampai pembakaran sempurna.