OPTIMASI PROSES SAPONIFIKASI KULIT JERUK DENGAN
Ca(OH)
2DAN DI AKTIVASI ZIRKONIUM UNTUK
ADSORBEN ION ARSENIK DAN FOSFOR
Riana Buchari, Yusuf Toha
Jurusan Teknik Kimia Fakultas Teknik Universitas Sriwijaya
ABSTRAK
Pada percobaan ini, dibuat bio – adsorbent ramah lingkungan, murah, efisien dari kulit jeruk yang disaponifikasi dengan kalsium hidroksida dan diaktivasi dengan zirkonium. Selain itu, ingin diketahuinya bagaimana pengaruh pH, waktu, dan jumlah adsorbent terhadap kemampuan menghilangkan ion arsenik dan fosfor didalam air. Langmuir dan Freundlich isotherm digunakan untuk model persamaan kesetimbangan adsorpsi. Orde satu, orde dua, dan modifikasi orde satu digunakan untuk menentukan model kinetis. Hasil menunjukkan ion arsenik dan fosfor berkurang dengan penambahan dosis adsorbent, waktu kontak, dan penurunan pH. Hasil penelitian menunjukkan reaksi dapat diwakili dengan model persamaan kesetimbanhan adsorpsi langmuir dengan koefisien korelasi r2>0.993 untuk arsenik dan r2>0.986 untuk fosfor. Dan model kintetis menunjukkan orde satu mewakili adsorpsi saponifikasi kulit jeruk dengan kalsium hidroksida yang diaktivasi dengan zirkonium (r2>0.993 untuk arsenik dan r2>0.999 untuk fosfor).
Kata Kunci : Adsorbent, Kulit Jeruk, Saponifikasi, Zirkonium, Studi Kinetis, Isotherm.
ABSTRACT
In this work, we prepared a cheap, efficient and environmentally bio-adsorbents from orange peel by saponification process by calcium hydroxide and chemical activation of Zirconium. In addition we have investigated effect of various parameters such as pH, contact time, adsorbent dosage on Arsenic and Phosphorus removal. Langmuir and Freundlich isotherm models have been investigated. Pseudo-first order, pseudo-second order and modified pseudo-first order kinetic models have been used for experimental data. The results showed that removal arsenic and phosphorus efficiency was increased with increasing of adsorbent dosage, contact time and decreasing of pH. Adsorption isotherm models showed that Langmuir isotherm model was best fitted onto collected data r2>0.993 for arsenic removal and r2>0.986 for phosphorus removal. In addition, kinetic models showed that sorption of saponification orange peel with calcium hydroxide and activated by zirconium follows the pseudo-second order model (r2>0.993 for arsenic removal and r2>0.999 for phosphorus removal).
Keywords: Adsorbent, Orange Peel, Saponification, Zirconium, Kinetics study, Isotherm.
I. PENDAHULUAN
Kandungan arsenik dan fosfor dalam air khususnya air minum menjadi permasalahan yang sangat serius. Arsenic pada kondisi diatas ambang batas dapat menyebabkan resiko kanker paru-paru,penyakit kulit, darah, liver, ginjal dan prostate atau bahkan kematian yang terjadi dibeberapa Negara di dunia dan Indonesia salah satunya. Phosphor selain digunakan untuk
pesat akibat ketersediaan fosfat yang berlebihan. Kualitas air di ekosistem air menjadi menurun. Rendahnya konsentrasi oksigen terlarut, bahkan sampai batas nol, menyebabkan makhluk hidup air seperti ikan dan spesies lainnya tidak bisa tumbuh dengan baik sehingga akhirnya mati. Hilangnya ikan dan hewan lainnya dalam mata rantai ekosistem air menyebabkan terganggunya keseimbangan ekosistem air.
Pektin adalah komponen utama untuk menghilangkan limbah arsenik dan fosfor karena diketahui mampu bereaksi dengan kuat dengan berbagai macam limbah metal berbahaya. (Dhaka. Et. Al. 2005a).
Dalam penelitian ini ada beberapa masalah yang timbul yaitu ; Bagaimana cara membuat adsorbent biaya rendah dan efektif dengan menggunakan limbah kulit jeruk ; Uji kinetic, Bagaimana pengaruh penambahan Solid / liquid Ratio dan Berapa perbandingan Solid Liquid Ratio optimum adsorbent untuk menghilangkan ion arsenic dan phosphor ;Bagaimana Pengaruh pH terhadap penghilangan ion Arsenik dan Fosfor dan Berapa pH optimum untuk menadsorbsi ion arsenic dan phosphor menggunankan adsorbent Saponifikasi Gel Kulit Jeruk Ca(OH)2 yang diaktivasi Zirkonium; Bagaimana pengaruh waktu terhadap % adsorpsi dan jumlah ion arsenik & fosfor yang diserap; Berapa waktu optimum untuk menghilangkan Arsenik dan Fosfor menggunakan adsorbent Saponifikasi Gel Kulit Jeruk Ca(OH)2 yang diaktivasi Zirkonium.
Tujuan penelitian ini adalah untuk Mengetahui bagaimana cara membuat adsorbent murah dan efektif dengan memanfaatkan limbah kulit jeruk, Untuk Mengetahui Perbandingan Solid Liquid Optimum adsorbent untuk menghilangkan ion arsenic dan phosphor, Mengetahui bagaimana Pengaruh pH terhadap adsorbsi ion Arsen dan Fosfor menggunakan adsorbent Saponifikasi Gel Kulit Jeruk Ca(OH)2 yang diaktivasi Zirkonium, dan mengetahui kondisi pH optimum untuk menadsorbsi ion arsenic dan phosphor menggunankan adsorbent Saponifikasi Gel Kulit Jeruk Ca(OH)2 yang diaktivasi Zirkonium, Mengetahui Waktu Optimum yang dibutuhkan untuk menghilangkan Arsenik dan Fosfor menggunakan adsorbent Saponifikasi Gel Kulit Jeruk Ca(OH)2 yang diaktivasi Zirkonium
Manfaat yang diperoleh dari penelitian ini yaitu Menambah wawasan khususnya mahasiswa teknik kimia tentang Adsorbsi efektif dan murah dengan metode baru adsorbent Saponifikasi Gel Kulit Jeruk dengan Ca(OH)2
yang diaktivasi Zirkonium, Ikut kontribusi dalam pemeliharan lingkungan dan meningkatkan kesehatan manusia
Variabel – variable yang ingin diketahui dalam penelitian ini adalah sebagai berikut ;
1. Konsentrasi Arsenik dan fosfor yang digunakan 10 mg/L dan Konsentrasi Fosfor dengan perbandingan S/L bervariasi.
2. pH 1- 14 dengan menggunakan HCl dan NaOH
3. Waktu analisa adalah 75, 150, 300, 600, 900, 1200, 1500 menit.
II. FUNDAMENTAL
Jeruk dan bagian lainnya diketahui memiliki kandungan hemiselulosa, selulosa, pectin dan lainnya.
Tabel.1. Kandungan Jeruk
Pectin Cellulose Hemiselulosa Lainnya
Peel 55.4 31.2 8.7 4.9
Pulp 68.0 25.1 6.8 0.1
Juice 88.7 - 11.3 0
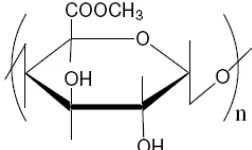
Pektin adalah komponen utama untuk menghilangkan limbah arsenik dan fosfor karena diketahui mampu bereaksi dengan kuat dengan berbagai macam limbah metal berbahaya. (Dhaka. Et. Al. 2005a). Pektin merupakan polisakarida yang terdiri dari asam galakturinik acid yang terikat pada ikatan 1,4 glikosidik. Pectin memiliki dua gugus yaitu gugus karboksil dan gugus metil.
Gambar.1. Struktur Kimia Pektin
Gambar 3. Struktur Kimia Gugus Metil Pkctin
Agar dapat menyerap ion berbahaya dalam air khususnya arsen dan fosfor maka pectin harus disaponifikasi terlebih dahulu dengan kalsium hidroksida.
Gambar 4. Reaksi Saponifikasi Gugus Karboksil dengan Kalsium Hidroksida
Gambar 5. Reaksi Saponifikasi Gugus Metil dengan Kalsium Hidroksida.
Gambar 6. Reaksi Aktivasi dengan Zirconium Terhadap Pectin yang Telah Disaponifikasi
dengan Kalsium Hidroksida.
Kurva isoterm untuk adsorpsi logam dalam sistem cair-padat didasarkan pada pengukuran konsentrasi logam di fase cair pada kesetimbangan, sedangkan konsentrasi logam pada fase padat diperoleh dari neraca massa menggunakan larutan pada saat awal dan akhir waktu percobaan dengan persamaan berikut. qe= (Co – Ce)v/m (1)
qe = Jumlah adsorbat terserap per massa padatan pada kesetimbangan, Mek/g Co = Konsentrasi awal larutan, Mek/L
Ce = Konsentrasi larutan pada kesetimbangan, Mek/L m = Massa Zeolit, g
v = Volume larutan pada percobaan, L
Dalam penelitian ini akan digunakan 2 model kesetimbangan sebagai pendekatan untuk menggambarkan perilaku kesetimbangan adsorpsi Langmuir dan Freundlich.
III. METODOLOGI
1) Tahap persiapan Adsorben
a) Persiapan Saponified Orange Peel Residu (SOJR)
Limbah kulit jeruk didapatkan dari pasar Indralaya. Limbah kulit jeruk dikeringkan dengan oven terlebih dahulu. 100 gram kulut jeruk yang telah kering dicampur dengan 8 gr Ca(OH)2 yang berwujud kristal dan tidak berwarna, kemudian di gerus menjadi partikel kecil menggunakan blender kira – kira 15 menit. Lalu ditambahankan aquadest dan diaduk menggunakan magnetic strirred selama 24 jam dengan laju putaran 200 rpm.
Setelah diaduk selama 24 jam, disaring, hasil saringan dicuci berkali – kali dengan aquadest hingga pH netral. Hasil saringan dikeringkan kembali dengan menggunakan oven selama 48 jam dengan suhu 70oC, dengan hal akhir berupa gel. Gel ini, di buat menjadi partikel yang lebih kecil untuk memaksimalkan proses adsorbsi dengan menggunakan ayakan.
b) Persiapan Zirconium-Saponified Saponified Orange Peel Residue (Zr-SOJR)
Tiga gram gel jeruk dicampur dengan Zirkonium dengan volume 500 ml dan konsentrasi 0.1 M dengan pH asam. Setelah dicampur, diaduk menggunakan magnetic stirred selama 24 jam, dicuci berkali – kali dengan aquadest hingga pH netral kemudian disaring. Hasil saringan untuk menghasilkan Gel Zirkonium Limbah Jeruk, dikeringkan kembali menggunakan oven, dan dibuat menjadi partikel yang lebih kecil menggunakan ayakan.
2) Variable
mengambil 4 variable dengan metode batch mode adsorption experiment.
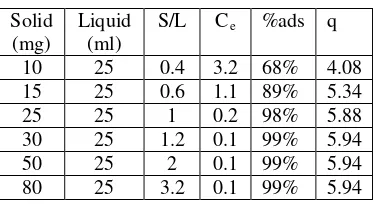
a) Analisa Solid – Liquid Ratio Arsenik / Phosphor
Tujuan analisa ini untuk mengetahui efek dari Solid – Liquid Ratio, dengan mencampurkan sejumlah Zr-SOJR tertentu yang berbeda – beda dan menjaga konsentrasi arsenik dan phosphor constant.
1) Buat Larutan Arsenik / Phosphor dengan konsentrasi 10 mg/L
2) Masukkan kedalam 6 botol ml berbeda
3) Masing – masing botol diisi dengan larutan Arsenik / phosphor dengan Konsentrasi 10 mg/L dan Volume 15 ml, lalu dicampurkan dengan Zr-SOJR sebanyak 10, 15, 25, 30, 50, 80 mg.
4) Larutan diendapkan hingga 24 jam. Setelah diendapkan selama 24 jam, di saring, kemudian di analisa konsentrasi akhirnya.
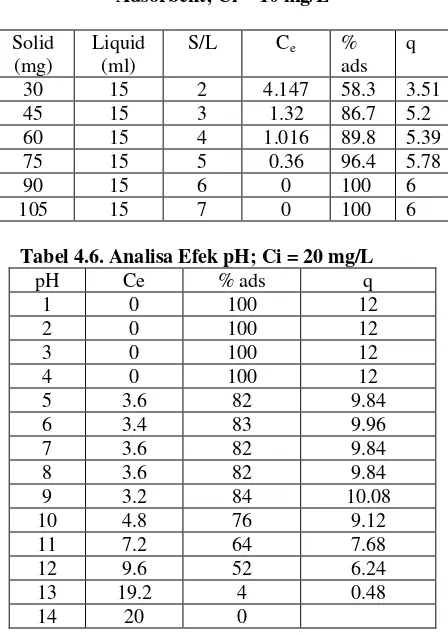
b) Efek pH terhadap Anion Adsorpsi Arsenik dan Phosphate
Metode yang digunakan adalah Batch. Analisis pH optimum adsorpsi ion Arsenik dan Phosphor ditentukan dengan menggunakan variasi pH 1 – 14. 1) Buat larutan campuran 25 mg Gel Zr
– SOJR dan Larutan Arsenik / Phosphor dengan konsentrasi 10 mg/L dan Volume 15 ml.
2) Masing – masing botol dicampur dengan HCl atau NaOH untuk memvariasikan pH.
3) Diendapkan hingga 24 jam 4) Analisa konsentrasi akhir arsenik. 5) Hitung % adsorbsi dengan
menggunakan rumus :
c) Analisa exchangeable Protons
Hasil yang didapat dari konsentrasi di atas dianalisa kemapuan untuk menukar ion proton Zr – SOJR dengan menggunakan rumus :
d) Studi Kinetis
Melalui Studi kinetis, diharapkan diketahui kapasitas adsorpsi
maksimum gel Limbah Jeruk untuk menghilangkan ion Arsenik dan phosphor dengan melakukan variasi konsentrasi dan waktu terhadap gel limbah jeruk.
1) Dengan Konsentrasi 10 mg/L Arsenik / phosphor sebanyak 15 ml, dicampur dengan 25 mg Zr – SOJR.
2) Ditunggu hingga 75, 150, 300, 600, 900, 1200, 1500 menit dan analisa konsentrasi akhirnya.
IV. HASIL DAN PEMBAHASAN
4.1. Arsenik
Tabel 4.3. Analisa Study Kinetis, Ci= 50 mg/L
Tabel 4.4. Analisa Study kinetis, Ci = 75 mg/L
t Ci
Tabel. 4.5. Analisa Solid / Liquid Ratio Adsorbent; Ci = 10 mg/L
Tabel. 4.7. Analisa Study Kinetis; Ci = 260 mg/L
Tabel 4.8. Analisa Study Kinetis Ci = 100 mg/L
t Ci
Efek Solid – Liquid Ratio
Grafik.4.1. Efek Solid Liquid Ratio
bagian aktif seiring dengan penambahan adsorbent gel. Namun, pada jumlah tertentu, tidak terjadi penambahan jumlah persentase adsorpsi. Ini terjadi dikarenakan jumlah adsorbsi yang telah ditambahkan berlebih dari jumlah konsentrasi ion arsen yang diserap sehingga tidak terjadi pertukaran ion.
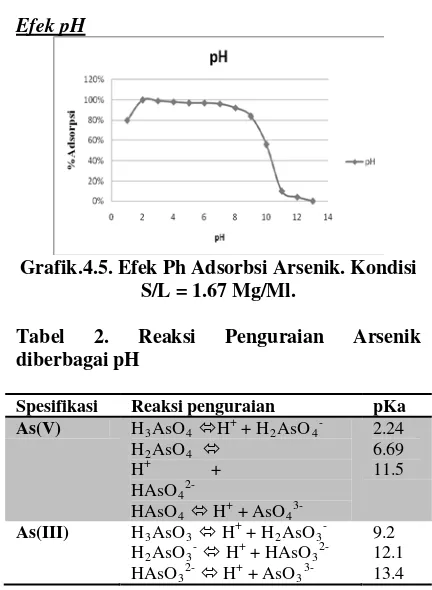
Efek pH
Grafik.4.5. Efek Ph Adsorbsi Arsenik. Kondisi S/L = 1.67 Mg/Ml.
Tabel 2. Reaksi Penguraian Arsenik diberbagai pH
Spesifikasi Reaksi penguraian pKa
As(V) H3AsO4 H+ + H2AsO4-
H2AsO4
H+ +
HAsO4
2-
HAsO4 H+ + AsO43-
2.24 6.69 11.5
As(III) H3AsO3 H
+
+ H2AsO3 -
H2AsO3- H+ + HAsO32-
HAsO3
2- H+
+ AsO3
3-9.2 12.1 13.4
pH yang paling baik untuk menyerap arsenic adalah pH 2-3 dengan 5 adsorpsi mencapai 100%. Seiiring dengan penambahan pH, % adsorpsi akan menurun.
Seperti yang telah di jelaskan diatas mengenai penguraian ion arsenic, Gugus arsenic dapat dibagi menjadi ionic berbeda, yaitu monovalent H2AsO4-, divalent HAsO42-, dan trivalent AsO43-. Pada pH 2.24 maka arsen akan membentuk monovalent. Pada saat ini jumlah ion hidroksil lebih banyak jika dibandingkan pada pH 6.69 (divalent). Sedangkan pada pH 11.5 arsenik akan membentuk gugus trivalent tanpa gugus hidroksil yang menyebabkan menurunnya jumlah adsorpsi ion arsen. Jumlah ion hidroksil sangat menentukan persentase jumlah adsorbsi.
Diketahui juga bahwa pada pH dibawah 7 adsorbsi lebih mudah mengikat ion arsen jika dibandingkan diatas 7.
Efek Kontak Waktu
Grafik.4.7. Efek Waktu Terhadap Konsentrasi Arsenik
Pada gambar diatas adalah grafik pengaruh efek waktu terhadap konsentrasi arsenic. Jumlah adsorpsi arsenic meningkat seiiring dengan lamanya waktu kontak. Waktu optimum dimana tidak terjadi kenaikan jumlah yang teradsobsi yaitu pada waktu 1440 s = 24 jam
Adsorpsi Isotherm
Freundlich equation
Dengan Kf dan n adalah suatu tetapan. Persamaan ini dikenal dengan persamaan isotherm adsorpsi Freundlich. Perhitungan tetapan Kf dan n dapat diperoleh dari logaritmiknya berupa, Log qe = log Kf + n Log Ce..
Konstatnta Freundlich dapat diketahui dengan memplotkan log, Ce dan Log, qe, dan didapat nilai Slop dan Intercept.
Grafik. 4.3.Freundlich Isoterm Model. (V = 25 ml; w = 15 gr, Ci = 10 mg/L )
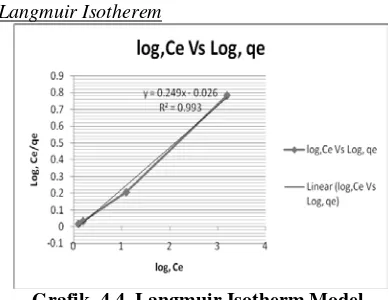
Langmuir Isotherem
Grafik. 4.4. Langmuir Isotherm Model.
Dari slope& Intercept q = 4.01 dan kf = 9.57.
Table 3. Parameters of Freundlich and Langmuir Isotherm model
qm,mg/g kf n R2
Freundlich - 3.908 0.309 0.987
Langmuir 4.016064 9.57692308 - 0.993
Langmuir dapat mewakili reaksi yang terjadi pada adsorpsi ion arsenic dan fosfor menggunakan adsorbent kulit jeruk.
Kinetic Models
Ci = 45 mg/L
Pseudo-first order kinetic
Grafik 4.8. Grafik Pseudo – First Order Kinetic
Grafik. 4.9. Grafik Pseudo – Second Order Kinetic
Grafik.4.10. Grafik Modified Pseudo – First Order
Tabel.4. Orde Reaksi
Model k1 k2 km qe R2
Pseudo – First order
Model
0.0006 314
- - 28 0.772
Pseudo – Second
Order Model
- 0.000
2976
- 31.25 0.993
Modified Pseudo – First Order
- - 0.00
015
28 0.797
Dari Tabel diatas nilai yang mendekati 1 adalah orde reaksi dua. Sehingga dapat disimpulkan model kinetis adalah orde reaksi 2.
Grafik. 4.11. Pseudo-Second Order pada Konsentrasi C = 70 Mg / L, V = 25 Ml, W = 15
Mg/L.
Tabel 5. Daya Serap Zirkonium Terhadap Arsenik
Cin(mg /L)
qe,exp(m
g/g)
k(g/mg. min)
R2 qe,cal(m
g/g)
50 28 2.98 x
10-3
0.9 93
31.25
75 40 2.49 x
10-3
0.9 98
43.4782
FOSFOR Efek Solid Ratio
Grafik.4.12. Efek Solid/Liquid Ratio
Dari grafik diatas dapat disimpulkan terjadi peningkatan jumlah penyerapan ion arsenic dengan penambahan jumlah solid adsorbent. Ini terjadi karena dengan adanya penambahan jumlah adsorbent makan akan terjadi penambahan bagian aktif seiring dengan penambahan adsorbent gel. Namun, pada jumlah tertentu, tidak terjadi penambahan jumlah persentase adsorpsi. Ini terjadi dikarenakan jumlah adsorbsi yang telah ditambahkan berlebih dari jumlah konsentrasi ion arsen sehingga tidak terjadi pertukaran ion.
Freundlich Equation
Grafik. .4.14. Freundlich Isoterm Model. (V = 25 ml; w = 15 gr, Ci = 10 mg/L )
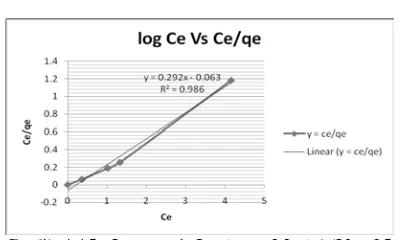
Langmuir Equation
Grafik.4.15. Langmuir Isotherm Model.(V = 25 ml; w = 15 gt; Ci = 10 mg/L)
Dari Slope & Inercept qm = 3.42 & b = 4.63
Tabel. 6. Parameters Of Freundlich And Langmuir Isotherm Model.
qm,mg/g b, L/mg kf n R2
Freundlich - - 0.623 0.704 0.847
Langmuir 3.42465753 4.63492 - - 0.986
Langmuir dapat mewakili reaksi yang terjadi pada proses Adsorbsi Fosfor dengan menggunakan adsorbent kulit jeruk yang diaktivasi Zirkonium.
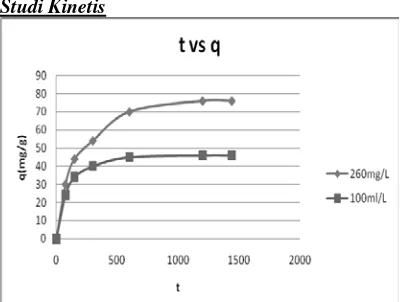
Studi Kinetis
Grafik. 4.16. Laju Adsorbsi Terhadap Waktu
Grafik. 4.17. Pseudo-First Order Kinetic
Grafik. 4.18. Pseudo-Second Order Kinetic
Grafik. 4.19. Modified Pseudo-First Order
Tabel.4.15. Parameter Kinetis Adsorbsi Fosfor
Model k1 k2 km qe R2
Pseudo – First order
Model 0.0 002 56
- - 46 0.996
Pseudo – Second
Order Model
- 0.0 00 30 58
- 50 0.999
Modified Pseudo – First Order
- - 0. 00 01
46 0.993
Dari Tabel diatas nilai yang mendekati 1 adalah orde reaksi dua. Sehingga dapat disimpulkan model kinetis adalah orde reaksi 2.
Untuk konsentrasi 260 mg/L
Grafik. 4.20. Pseudo-second order kinetic. Table.4.16. Parameter Kinetis Adsorbsi Fosfor
yang diaktivasi Zirkonium.
Tabel 7. Daya Serap adsorbent terhadap Fosfor
Cin(mg/L) qe,exp(mg/g) k(g/mg.min) R2 qe,cal(mg/g)
100 46 3.06 x 10-4 0.993 50
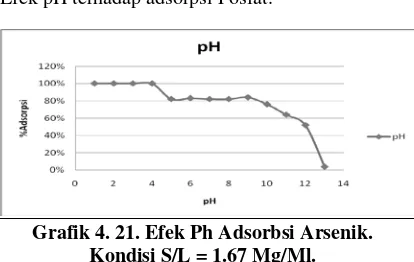
Efek pH terhadap adsorpsi Fosfat.
Grafik 4. 21. Efek Ph Adsorbsi Arsenik. Kondisi S/L = 1.67 Mg/Ml.
pH 1 – 4 merupakan pH maksimum untuk adsorbsi menggunakan adsorbent saponified orange peel. Terjadi penurunan nilai adsorbsi pada pH 5 – 9, dan penurunan adsorpsi sangat menurun pada pH 10 – 14. Hal ini dapat terjadi karena berdasarkan literatur mengenai penguraian fosfat dalam air, dalam berbagai pH.
Pada pH 1 – 4, banyak mengandung ion hidroksil, yang memungkinkan terjadinya Ligand exchange. Semakin pH meningkat,jumlah ion hidroksil semakin menurun yang menyebabkan juga berkurangnya kemampuan ligand exchange yang berarti juga menurunnya kemampuan untuk menyerap ion fosfat.
V. PENUTUP
Kesimpulan
Dari hasil percobaan ini didapatkan beberapa kesimpulan;
1) Adsorbent saponifikasi kulit jeruk dengan kalsium hidroksida dan diaktivasi zirconium terbukti merupakan adsorbent murah, efektif dan efisien dalam mengurangi konsentrasi arsenic dan fosfor dalam air.
2) Dari hasil percobaan bagaimana pengaruh jumlah adsorbent terhadap % adsorpsi dalam percobaan solid/liquid ratio, diketahui : a) Arsenik : 2
b) Fosfor : 6
3) Dari sample buatan bagaimana pengaruh pH terhadap pengurangan konsentrasi arsenic dan fosfor diketahui, semakin tinggi pH semakin kecil % adsorpsi dan daya serap adsorbent. pH yang paling baik untuk adsorpsi adalah pH 2 – 3 untuk Arsenik, dan pH 1 – 4 untuk Fosfor. Namun pada literature pH 2 – 3 adalah pH yang paling baik untuk menghilangkan konsentrasi arsenic pada air. 4) Semakin lama waktu kontak, semakin besar
%adsorpsi dan jumlah ion yang diserap. Hingga mencapai waktu optimum, dimana adsorbent tidak mampu untuk menyerap ion
arsenic atau fosfor. Ditetapkan waktu 1440 menit sebagai waktu optimum.
5) Dalam menentukan Adsorpsi Isotherm, Langmuir dapat mewakili reaksi yang terjadi pada adsorpsi ion arsenic dan fosfor menggunakan adsorbent kulit jeruk.
6) Orde reaksi yang mewakili adsorpsi adalah orde raksi 2.
7) Maksimum kapasitas adsorpsi adsorbent dari kulit jeruk yang disaponifikasi dengan kalsium hidroksida dan diaktivasi zirconium, q = 43.47 mg/g untuk arsenic, q = 90.9 mg.
Saran
1) Perlu ditambahkan lebih banyak sample, atau variable yang lain misalnya bagaimana pengaruh suhu pemanasan terhadap % adsorpsi serta jumlah konsentrasi ion arsenic dan fosfor yang diserap.
2) Perlu diteliti jenis metal – loaded lainnya atau jenis pengaktivasi dan dibandingkan dengan kemampuan jumlah adsorbsi dengan zirconium, untuk bisa memaksimalkan pemanfaatan limbah kulit jeruk.
3) Perlu diteliti bagaimana jika sumber pectin diganti yang lain misalnya limbah atau ampas apel terhadap kemampuan adsorpsi.
VI. DAFTAR PUSTAKA
Ghimire, K. 2006. Adsorptive Treatment of Toxic environmental pollutants by biomass waste. 32nd COE Seminar Hiroshima University, Saga University. Japan.
Inoue, K. 2004. Optimization of Saponification Process for Orange and Apple wastes. Saga University. Japan.
Inoue, K. 2002. Effective Use of Orange Juice Residue for Removing Heavy and Radioactive Metals from Environments. Saga University. Japan.
Kundari, N. 2008, “Tinjauan Kesetimbangan Adsorpsi Tembaga nDalam Limbah Pencuci PCB dengan Zeolit“ Seminar
Spesifikasi Reaksi penguraian pKa
Nasional IV, SDM Teknologi Nuklir , Yogyakarta.
Masqudi, A. 2004. Penurunan Senyawa Fosfat Dalam Air Limbah Buatan Dengan Proses Adsorpsi Menggunakan Tanah Halosit. Majalah IPTEK. Jakarta.
Muchtar, M. 2002. Konsentrasi Fosfat di Beberapa Perairan di Indonesia. Balitbang Oseanografi, Puslitbang, LIPI. Jakarta.
Rybicky, S. 2004. World Wide Web Publications. New Technologies of Phosphorus Removal From Wastewater. Online. (http://e-journals.net, diakses 12 maret 2010).
Sulistio, H. 2004. Ekstraksi Pektin dari Limbah Kulit Jeruk Manis (Citrus Sinesis (L) Osbeck) Untuk Pembuatan Jelly GradeSebagai Penurun Kadar Kolesterol dalam Tubuh. Universitas Negri Malang. Malang.
Triani, L. 2004. Desorpsi Ion Logam Tembaga (II) dari biomassa Chlorella sp yang terimobilisasi dalam Silika Gel. Universitas Negeri Semarang. Semarang.
Vatanpoor, V. 2010. World Wide Web Publications. Adsorption of Acid Red 18 (AR18) by Activated Carbon from Poplar Wood – A kinetic and Equilibrium Study. (Online). (http://e-journals.net, diakses 12 Maret 2010).
Wikipedia. 2010. Zirconium. (online). (http://www.wikipedia.org, diakses 28 maret 2010).
Wikipedia. 2010. Arsenic. (online). (http://www.wikipedia.org, diakses 27 meret 2010).
Wikipedia. 2010. Phosphorus. (online). (http://www.wikipedia.org, diakses 27 maret 2010).