TINJAUAN PUSTAKA
Struktur Xilan
Xilan adalah hemiselulosa yang merupakan polimer dari pentosa atau xilosa dengan ikatan ß-1,4 yang jumlah monomernya berkisar 150-200 unit (Sunna dan Antranikan. 1997). Hemiselulosa sendiri merupakan polimer dari monomer gula (gula-gula anhidro) yang dapat dikelompokkan menurut penyusunnya yaitu heksosa (glukosa, manosa dan galaktosa), pentosa (xilosa, arabinopiranosa, arabinofuranosa), asam heksuronat (glukoronat, metilglukoronat dan galakturonat) dan deoksi heksosa (rhamnosa dan fruktosa). Rantai utama hemiselulosa dapat hanya terdiri atas satu macam monomer saja (homopolimer), misalnya xilan, atau dapat terdiri dua atau lebih monomer (heteropolimer), misalnya glukomanan (Kulkarni et al. 1999).
Rantai xilan bercabang dan strukturnya tidak berbentuk kristal sehingga lebih mudah dimasuki pelarut dibanding selulosa. Sebagian besar xilan terdiri atas 2-4 heteroglikan. Heteroglikan yang umum dijumpai adalah arabino-D-xilan, L-arabino-D-glukorono-D-xilan, 4-o-metil- D-glukorono -D-xilan, L-arabino-D-xilan, D- gluko-D-mannan, D- galakto -D-gluko-D- gluko-D-mannan, dan L-arabino -D-galaktan.
Xilan mempunyai substituen yang berada di sekitar cincin dari struktur inti xilan. Pada umumnya substituen yang ditemukan dicincin belakang adalah cincin asetil, arabinosil dan glukoronosil. Berdasarkan strukturnya hemiselulosa terutama xilan dapat dilihat dari tanaman yang berbiji terbuka (gymnospermae) dan tanaman berbiji tertutup (angiospermae). Xilan dari angio spermae merupakan O-asetil-4-O-metilglukoronoxilan. Polisakarida ini terdiri atas >70-β-xilopiranosa yang membentuk ikatan dengan β -1,4-glikosida. Setiap 10 xilosa membawa sebuah 4-O-asam metilglukoronat yang berada di dua posisi xilosa (Gambar 1.). Sedangkan komposisi xilan dari gymnospermae memiliki lebih banyak 4-O-metilglukoronoxilan, 4-O-asam metilglukoronat ditempatkan pada dua rantai karbon (Sunna dan Antranikian, 1997). Contoh gymnospermae yang mengandung xilan adalah pinus, sedangkan angiospermae adalah padi, jagung, dan serealia lainnya (Soltes, 1983).
Gambar 1 Struktur xilan (Sunna dan Antranikian, 1997).
Diantara limbah angiospermae tersebut paling tinggi kandungan xilannya adalah jagung (hasil analisis di Laboratorium Biokimia dan Enzimatis Balai Penelitian Bioteknologi, Badan Penelitian dan Pengembangan Pertanian). Demikian juga menurut Paturau (1969) gula xilosa yang dibuat dari beberapa limbah pertanian ternyata paling tinggi adalah jagung (Tabel 1.).
Tabel 1 Kadar (%) xilan dari beberapa limbah hasil pertanian
Bahan Xilan a Xilan b
Bagase tebu 9,6
oat hulls 12,3
Tongkol jagung 12,9 12,4
Sekam 6,3 12,1
Kulit kacang 6,3
kulit biji kapas 10,2
Ampas garut 8,2
Bekatul 6,12
Onggok 5,8
Sumber : a Paturau (1969).
b Hasil analisis di Laboratorium Biokimia dan Enzimatis Balai Penelitian Bioteknologi, Badan Penelitian dan Pengembangan Pertanian (1999)
Berdasarkan pertimbangan tersebut maka tongkol jagung berpotensi untuk dimanfaatkan sebagai sumber xilan.
Potensi Limbah Jagung Sebagai Sumber Xilan
Dalam dua dasawarsa terakhir, produksi jagung mengalami peningkatan yang cukup tinggi meskipun agak berfluktuasi. Pada tahun 1989-1993) produksi jagung mencapai 6,7 juta ton/thn dengan produktivitas 2,2 ton/ha (Subandi et al., 1998). Kemudian pada tahun 2003 mencapai 9,66 juta ton/th meningkat sebesar 1,42% diband ing 2002 sebesar 9,53 juta ton/th. Dan di tahun 2004 produksi jagung mencapai 11,75 juta ton/th dengan produktivitas 3,8 ton/ha (Harisno, 2005)
Selain untuk pangan jagung juga banyak digunakan untuk pakan dan bahan industri. Sampai saat ini kebutuhan dan permintaan jagung semakin meningkat. Peningkatan kebutuhan jagung di dalam negeri berkaitan erat dengan pesatnya perkembangan industri pangan dan pakan. Pada tahun 1990, kebutuhan jagung untuk pakan unggas baru sekitar 1,7 juta ton. Tahun 1998 angka itu melonjak lebih dari dua kali lipat yaitu 3,5 juta ton (BP Bimas 1999). Peningkatan produksi dan kebutuhan jagung berarti pula peningkatan limbah baik berupa jerami maupun tongkol jagung. Penggunaan jerami jagung semakin populer untuk makanan ternak. Sedangkan untuk tongkol jagung belum ada pemanfaatan yang lebih bernilai guna dan ekonomis.
Tongkol jagung merupakan bagian terbesar dari limbah jagung yang diperkirakan 50 sampai 60 % (dihitung dari jagung bertongkol) tergantung dari varietasnya. Oleh karena itu dapat diperkirakan untuk produksi jagung 11,75 juta ton/th akan dihasilkan limbah tongkol jagung sekitar 12 juta ton/th. Berdasarkan hal tersebut perlu adanya perhatian dan penanganan untuk pemanfaatannya sehingga lebih bernilai guna dan ekonomis.
Xilanase
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa (xilan) menjadi xilosa dan xilo-oligosakarida dan dapat diklasifikasikan
berdasarkan substrat yang terhidrolisis (Gambar 2.) Enzim xilanase digolongkan atas tiga kelompok yaitu β-xilosidase, eksoxilanase dan endoxilanase.
a. β-xilosidase
Enzim β-xilosidase selain memiliki kemampuan menghidrolisis xilooligosakarida rantai pendek menjadi xilosa, juga dapat menghidrolisis aril-β-D-xilopiranosida, alkil-β -D-xilopiranosida, aril-β-L-arabinoglukosida, aril-β-D-glukopiranosida, xilobitol dan xilotriol. Aktivitas enzim ini akan menurun dengan meningkatnya ranta i xilooligosakarida (Reilly, 1991; Dekker, 1983).
Gambar 2 Struktur xilan dan enzim yang terlibat dalam hidrolisisnya (Beg et al. 2001)
Ikatan oksigen glikosil dari substrat dapat diputus secara heterolisis. Pemutusan terjadi karena bagian elektrofil dan nukleofil dari enzim dapat menyerang atom anomer dan atom C-1 nonreduksi dari rantai oligosakarida. Reaksi pemutusan ini akan menghasilkan gula yang tidak mengalami perubahan konfigurasi.
Reilly (1991) menambahkan bahwa xilosa selain merupakan hasil hidrolisis juga merupakan inhibitor bagi enzim β-xilosidase. Sebagian besar enzim β-xilosidase yang telah berhasil dimurnikan masih menunjukkan adanya aktivitas transferase, yang menyebabkan enzim ini kurang dapat digunakan dalam industri penghasil xilosa.
b. Eksoxilanase
Enzim eksoxilanase memutus rantai polimer pada ujung reduksi seperti pada enzim eksoselulase. Enzim eksoxilanase yang dihasilkan oleh Bacillus pumilus dan
ß-Xylosidase
Arafinosa Arafinosa
Malbranchea pulchella dapat menghidrolisis xilan, menghasilkan xilosa sebagai produk utama dan sejumlah kecil oligosakarida-oligosakarida rantai pendek. Berbeda dengan β -xilosidase, hidrolisis oleh enzim ini dapat merubah konfigurasi gula yang dihasilkan. Enzim ini mempunyai aktivitas transferase yang sangat rendah sehingga menyebabkan enzim ini potensial dalam industri penghasil xilosa.
c. Endoxilanase
Enzim-enzim yang termasuk dalam kelompok endoxilanase adalah enzim yang memutuskan ikatan- ikatan β-1-4 pada bagian dalam dari rantai xilan secara teratur. Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada atau tidaknya gugus substitusi dan pola pemutusan dari enzim hidrolase tersebut.
M ikroba Penghasil Xilanase
Beberapa mikroba diketahui mampu menghasilkan xilanase secara ekstraseluler. Beberapa penelitian yang telah dilaporkan antara lain xilanase dari bakteri (Gilbert dan Hazlewood 1993, Sunna dan Antranikan 1997), kapang (Sunna dan Antranikan, 1997), Actinomycetes (Ball and Mc Carthy. 1989, Beg et al. 2001), dan khamir (Hrmova et al. 1984, Liu et al. 1998, 1999). Contoh beberapa mikroba penghasil endoxilanase disajikan pada Tabel 2. Xilanase umumnya merupakan protein kecil dengan beral molekul antara 15 000 - 30 000 Dalton, aktif pada suhu 550C dengan pH 9 (Yang, et al., 1988 dan Yu et al., 1991). Pada suhu 600C dengan pH normal xilanase diketahui lebih stabil (Tsujibo, et al., 1992 ; Cho et al., 1996). Untuk pemutih kertas dapat digunakan xilanase jenis xilosidase dan endoxilanase.
Xilanase dari Clostridium acetobutylicum telah diteliti oleh Lee et al. (1985), yaitu dari 20 galur Clostridium sp ternyata C. acetobutylicum NRRL B527 dan ATCC 824 terbanyak menghasilkan xilanase. Galur NRRL B527 menghasilkan xilanase pada pH 5,2 sedangkan galur ATCC 824 menghasilkan xilanase, xilopiranosidase dan arabinofuranosidase pada kultur anaerob.
Isolat Bacillus sp penghasil xilanase yang bersifat alkalofilik telah diteliti oleh Park et al. (1992) yaitu Bacillus sp YC 335 dan oleh Nakamura et al. (1993) yaitu Bacillus sp 41M-1, dan Bacillus sp TAR-1 yang juga bersifat termofilik oleh Nakamura et al. (1994).
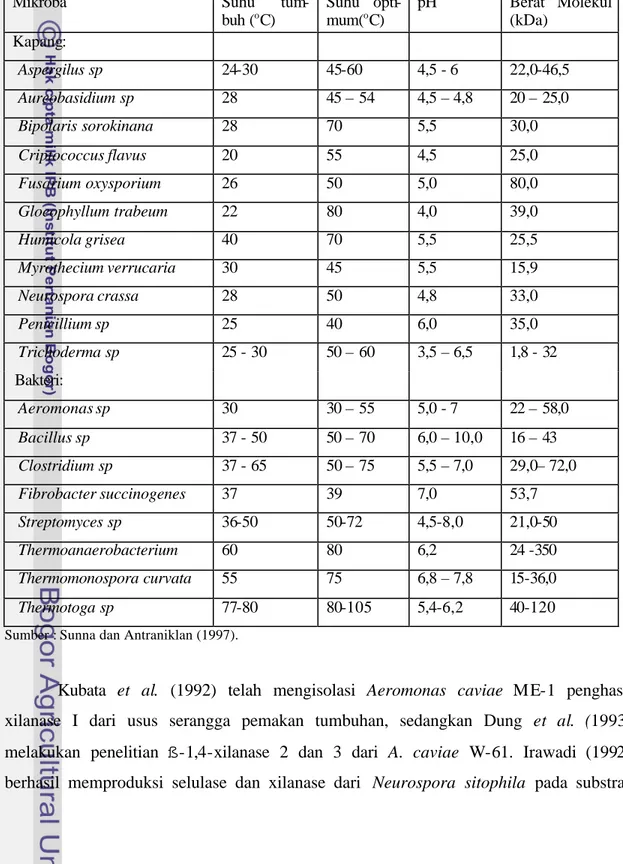
Tabel 2 Beberapa mikroba penghasil endoxilanase
Mikroba Suhu tum-
buh (oC) Suhu opti- mum(oC) pH Berat Molekul (kDa) Kapang: Aspergilus sp 24-30 45-60 4,5 - 6 22,0-46,5 Aureobasidium sp 28 45 – 54 4,5 – 4,8 20 – 25,0 Bipolaris sorokinana 28 70 5,5 30,0 Criptococcus flavus 20 55 4,5 25,0 Fusarium oxysporium 26 50 5,0 80,0 Gloeophyllum trabeum 22 80 4,0 39,0 Humicola grisea 40 70 5,5 25,5 Myrothecium verrucaria 30 45 5,5 15,9 Neurospora crassa 28 50 4,8 33,0 Penicillium sp 25 40 6,0 35,0 Trichoderma sp 25 - 30 50 – 60 3,5 – 6,5 1,8 - 32 Bakteri: Aeromonas sp 30 30 – 55 5,0 - 7 22 – 58,0 Bacillus sp 37 - 50 50 – 70 6,0 – 10,0 16 – 43 Clostridium sp 37 - 65 50 – 75 5,5 – 7,0 29,0– 72,0 Fibrobacter succinogenes 37 39 7,0 53,7 Streptomyces sp 36-50 50-72 4,5-8,0 21,0-50 Thermoanaerobacterium 60 80 6,2 24 -350 Thermomonospora curvata 55 75 6,8 – 7,8 15-36,0 Thermotoga sp 77-80 80-105 5,4-6,2 40-120
Sumber : Sunna dan Antraniklan (1997).
Kubata et al. (1992) telah mengisolasi Aeromonas caviae ME-1 penghasil xilanase I dari usus serangga pemakan tumbuhan, sedangkan Dung et al. (1993) melakukan penelitian ß-1,4-xilanase 2 dan 3 dari A. caviae W-61. Irawadi (1992) berhasil memproduksi selulase dan xilanase dari Neurospora sitophila pada substrat
padat limbah kelapa sawit. Kemudian telah dicoba untuk menghidrolisis limbah lignoselulosa lain diantaranya adalah tongkol jagung (Irawadi. 1995).
Demikian juga Winterhalter dan Liebl (1995) dari hasil penelitiannya telah melakukan produksi xilanase thermostabil dari bakteri Thermotoga maritima MSB8, sedangkan Ruiz-Arribas et al. (1995) telah mendapatkan Streptomyces halstedii JM8 penghasil xilanase (xys I) yang diisolasi dari jerami. Lin et al (1999) melakukan pemurnian dan karakterisasi biokimia xilanase dari fungi termofilik Thermomyces lanuginosus-SSBP.
Media Pertumbuhan Mikroba Penghasil Xilanase
Komposisi media kultivasi dapat sederhana atau kompleks tergantung jenis mikroba dan kondisi kultivasinya. Baik media sederhana maupun kompleks dapat merupakan media sintetik atau media kasar (crude). Media sintetik cocok untuk skala laboratorium dan industri kecil karena mempunyai beberapa keuntungan antara lain setiap kompo nen dapat dengan mudah dikurangi, dihilangkan atau ditambahkan. Disamping itu pada media sintetik biasanya media kultivasi tidak membentuk buih selama proses berlangsung, dan kesalahan atau kelainan yang mungkin terjadi selama kultivasi akibat komposisi yang kurang tepat dapat dicegah. Pada industri skala besar media sintetik tidak sesuai digunakan.
Kriteria sumber nutrisi untuk skala besar (Rachman, 1989) adalah:
1. Dapat memproduksi biomassa dengan hasil maksimal untuk tiap gram substrat yang digunakan
2. Memungkinkan pembentukan produk kultivasi dengan laju maksimal.
3. Dapat menekan pembentukan produk yang tidak diinginkan sampai serendah mungkin.
4. Mutu konstan, murah dan tersedia sepanjang tahun.
5. Tidak menimbulkan masalah terhadap aerasi, agitasi, ekstraksi dan pemurnian hasil serta perlakuan limbah.
Substrat yang digunakan dalam proses kultivasi berpengaruh terhadap aktivitas dan produktivitas enzim. Adanya substrat tertentu di dalam medium produksi dapat memacu mikroba untuk mensekresi metabolit selnya (Boing, 1982).
Zat gizi utama bagi pertumbuhan mikroba adalah karbon, nitrogen dan komponen mineral terutama fosfat. Formulasi media dalam pertumbuhan dan produksi hasil kultivasi merupakan suatu tahap penting dalam mendesain percobaan dalam skala kerja (Stanbury dan Whitaker, 1984).
1. Sumber Karbon
Beberapa sumber karbon yang sering digunakan adalah molases, serealia, pati, glukosa, sukrosa, xilan dan laktosa. Produksi xilanase menggunakan xilan sebagai sumber karbon. Pada skala laboratorium xilan yang digunakan adalah spelt oat xylan dari SIGMA, sedangkan untuk skala besar penggunaan xilan tersebut terlalu mahal. Park et al. (1992) telah melakukan penelitian alternatif sumber karbon selain xilan yaitu jerami padi. Jerami kering dipotong sepanjang 10 mm, kemudian dipanaskan 121oC selama 1 jam. Sesudah penyaringan xilan kasar diendapkan dengan etanol 99% dan diinkubasi selama 24 jam. Hasil endapan adalah xilan kasar.
Yoshida et al.(1994) memanfaatkan ampas/limbah ekstrak minyak biji kapas untuk pengganti xilan. Mula- mula ampas biji kapas tersebut direndam dengan klor pada suhu kamar selama 5 jam untuk menghilangkan lignin dan warna bahan. Kemudian dikeringkan, terus direndam kembali dengan larutan 10% NaOH pada suhu kamar selama 24 jam. Filtrat adalah xilan kasar yang diendapkan dengan 2 kali volume etanol 99%. 2. Sumber nitrogen
Sebagai sumber nitrogen biasanya digunakan garam amonium, urea, ekstrak khamir dan pepton. Ekstrak khamir mengandung asam amino, peptida, vitamin dan karbohidrat. Komposisi penggunaan ekstrak khamir yang tepat sangat diperlukan dalam proses kultivasi. Hal tersebut disebabkan penggunaan jumlah ekstrak khamir yang cukup tinggi akan menyebabkan timbulnya buih pada media kultivasi jika diaduk, karena pengadukan akan menyebabkan protein dala m media kontak dengan udara (Suhartono, 1989).
Pepton (hidrolisat protein) sering digunakan untuk pertumbuhan mikroba tetapi relatif mahal untuk diaplikasikan di industri. Sumber pepton diantaranya adalah daging, kasein, gelatin, kreatin, dan biji-bijian. Komposisi pepton bervariasi tergantung dari asalnya. Pepton dan gelatin kaya akan prolin dan hidroprolin, tetapi hampir tidak ada
asam amino mengandung belerang. Sedangkan pepton dari kreatin kaya akan prolin dan sistein tetapi kurang lisin (Crueger dan Crueger. 1984).
3. Koenzim
Mikroba membutuhkan vitamin B untuk pertumbuhannya seperti vitamin B1 (tiamin), B2 (riboflavin), B6 (piridoxin) dan vitamin B12 (kobalamin) yang diantaranya berasal dari sumber kaya vitamin B seperti ekstrak khamir. Vitamin B ini digunakan dalam proses pembentukan koenzim yang akan berikatan dengan enzim dengan ikatan yang tidak begitu kuat. Satu koenzim dapat berikatan dengan beberapa enzim pada kurun waktu yang berlainan selama pertumbuhan sel bakteri. Koenzim dapat dianggap sebagai substrat khusus karena akan diubah oleh daya kerja apoenzim (bagian protein dari enzim) secara kimia, namun kemudian akan diubah kembali pada bentuk semula pada akhir reaksi. Fenomena ini menjadikan koenzim berperan sebagai penghubung berbagai apoenzim yang menggabungkan beberapa reaksi kimia yang berbeda.
Koenzim dapat memindahkan satu molekul dari suatu enzim ke enzim lainnya karena sifatnya tidak khusus dan dapat mengikat diri ke beberapa enzim. Namun demikian setiap koenzim dapat memindahkan hanya satu jenis molekul yang kecil. Berdasarkan proses demikian maka reaksi enzimatis pembentukan produk dari substratnya tidak dapat berlangsung bila tidak ada koenzim walaupun ada apoenzimnya. Menurut Lay dan Hastowo (1992), kekurangan vitamin sebagai koenzim menyebabkan enzim tidak dapat berfungsi semestinya.
4. Garam-garam M ineral
Unsur-unsur mineral seperti magnesium, fosfor, kalium, kalsium, sulfur dan klor, ditambahkan dalam bentuk garam dengan konsentrasi yang tepat (Stanbury dan Whitaker, 1984). Komposisi media untuk produksi xilanase, masing- masing pada media termofilik alkalofilik dan netral disajikan pada Tabel 3.
Seperti halnya sumber karbon, garam-garam nutrien akan menghambat laju pertumbuhan pada konsentrasi tertentu. Bila yang digunakan garam amonium sebagai sumber nitrogen, penghambatan dimulai pada konsentrasi 10 g/l. Penggunaan garam nutrien dari amonium, fosfat dan nitrat masing- masing 9 g/l, 10 g/l, 5 g/l (Wang et al., 1997).
Tabel 3 Media pertumbuhan bakteri penghasil xilanase
No Bahan Komposisi (g/100 l media)
Media alkali a) Media netral b)
1. Polipepton 0,5 -
2. Ekstrak khamir 0,1 0,2
3. K
2PO4 0,1 1,5
4. MgSO4. 7 H2O 0,02 0,025
5. Xilan (sumber karbon) 0,5 0,7
6. NaCl - 0,25
7. NH4Cl - 0,5
8. Na2HPO4 - 5,0
Sumber : a) Nakamura (1993) b) Dung et al (1993)
Kultivasi Mikroba Penghasil Xilanase
Kultivasi isolat mikroba penghasil xilanase dapat dilakukan dengan cara media padat dan cair. Untuk beberapa produk seperti enzim, kultur media cair akan lebih menguntungkan dibanding kultur media padat dan telah secara luas digunakan dalam produksi enzim. Beberapa keuntungan yang dapat diperoleh melalui kultur media cair adalah komposisi dan komponen media dapat diatur dengan mudah, dapat memberikan kondisi yang optimal bagi pertumbuhan, penggunaan substrat lebih efisien, aerasi dapat disesuaikan, laju pertumbuhan mikroba dapat diatur dan resiko kontaminan kecil (Blevin dan Davis, 1979). Sementara menurut Scragg (1994), kultivasi dengan metode kultur media cair membutuhkan penguasaan bioreaktor untuk memperoleh produksi yang tinggi. Melalui mekanisme pengadukan maka suhu, pH, oksigen, nutrien dan faktor lingkungan lainnya dapat tersebar lebih merata di dalam bejana kultivasi.
1. Kondisi Suhu
Enzim dapat mempercepat reaksi kimiawi dengan sempurna bila berada dalam suhu optimumnya, namun bila suhu operasi menyimpang dari suhu optimum maka aktivitas enzim akan menurun. Efek dari suhu yang ekstrim pada pertumbuhan secara umum didasarkan pada inaktivasi enzim atau struktur fungsi sel lainnya. Setiap bakteri
mempunyai suhu optimum dimana pertumbuhannya berlangsung dengan cepat. Di luar kisaran suhu optimum pertumbuhan bakteri menjadi lambat bahkan tidak ada pertumbuhan. Kisaran suhu untuk aktivitas enzim menentukan sifat pertumbuhan mikroba. Suhu tertinggi di mana mikroba masih dapat tumbuh disebut suhu maksimum, sedangkan suhu minimum adalah suhu terendah dimana mikroba masih dapat tumbuh.
Beberapa spesies bakteri indigenous pada tanah, air atau tubuh binatang dapat tumbuh pada kisaran suhu 20–45oC (suhu tubuh manusia adalah 37oC). Spesies yang tumbuh baik pada suhu seperti itu disebut mesofilik (secara harfiah meso artinya medium atau menengah, filik artinya menyenangi). Suhu optimum pertumbuhannya adalah pada kisaran 25-39oC dan sangat beragam tergantung spesiesnya (Frobisher, 1962).
Menurut Frobisher (1962), berdasarkan suhu pertumbuhan optimum dan aktivitas hidrolitik enzim mikroba dapat digolongkan ke dalam empat kelompok, yaitu psikrofilik, psikrofilik fakultatif, mesofilik dan termofilik. Kelompok psikrofilik adalah kelompok mikroba yang maksimum pertumbuhannya pada kondisi lingkungan dingin yaitu pada suhu sekitar 7oC. Spesies yang mempunyai kemampuan tumbuh pada suhu sekitar 20oC disebut psikrofil fakultatif. Mesofilik adalah kelompok mikroba yang pertumbuhan optimumnya terjadi pada suhu sekitar 37OC, namun demikian terdapat pula mikroba kelompok ini yang mempunyai efektivitas kerja diatas 37oC tetapi sangat terbatas. Termofilik adalah kelompok mikroba yang pertumbuhan optimumnya terjadi pada suhu di atas 50oC.
Kisaran suhu tidak saja mempengaruhi aktivitas enzim, namun juga mempengaruhi sifat fisik membran sel. Permeabilitas membran sel tergantung pada kandungan dan jenis lipida. Peningkatan 5-10oC di atas suhu optimum dapat menyebabkan proses lisis dan kematian sel mikroba (Lay, 1994).
2. Kondisi pH
Menurut Lay (1994), mikroba tumbuh dan memiliki enzim yang berfungsi sempurna pada kisaran pH optimum tertentu. Penyimpangan pH medium menimbulkan pertumbuhan dan metabolisme mikroba terhenti yang dikarenakan protein dalam struktur enzim dan sistem transpot yang terdapat pada membran sel berubah. Pada umumnya mikroba tumbuh pada kisaran pH netral, walaupun beberapa spesies mampu bertahan pada pH ekstrim yaitu pada pH 2 dan 10.
Beberapa mikroba melakukan kultivasi menghasilkan asam sehingga pH media turun menjadi 3,5. Namun saat metabolisme protein dan asam amino berlangsung ion amonium akan dilepas sehingga pH media menjadi basa (Lay, 1994).
Upaya mencegah perubahan pH yang berjalan dengan cepat pada sistem tertutup adalah dengan penambahan buffer ke dalam media seperti K2HPO4 atau KH2PO4 untuk menjaga agar kondisi pH tetap mendekati pH optimum. Kedua macam garam ini dapat mengikat H+ dari asam atau OH- dari basa (Lay dan Hastowo, 1992).
Sumber nitrogen dapat merubah nilai pH, seperti amonia di dalam larutan ber-pH 9 amonia sebagai NH4+ yang oleh mikroba digabungkan ke dalam sel dengan kerangka karbon R menjadi R-NH3+ sehingga akan menurunkan nilai pH. Apabila nitrat sebagai sumber nitrogen, ion hidrogen akan disingkirkan dari medium untuk mereduksi NO3 -menjadi R-NO3+ dan pH cenderung meningkat. Bila sumber nitrogen adalah bahan organik, maka bahan tersebut akan terdeaminasi sehingga meningkatkan nilai pH (Wang et al, 1979). Menurut Crueger and Crueger (1984) bakteri mempunyai kisaran nilai pH minimum 3-5, kisaran pH optimum 6,5-7,5 dan kisaran pH maksimum 8-10.
Penggunaan enzim yang stabil pada kondisi ekstrem, yang terjadi pada kebanyakan proses industri, akhir-akhir ini meningkat pesat, karena proses pada kondisi ekstrem dapat mengurangi resiko kontaminasi. Oleh karena itu untuk mendapatkan xilanase yang sesuai dengan kebutuhan industri adalah dengan menggunakan enzim yang dihasilkan oleh mikroba ekstremofil (alkalofilik, termofilik).
Mikroba alkalofilik adalah mikroba yang mempunyai pertumbuhan optimal + pH 10. Pada umumnya dalam pertumbuhan mikroba, pH plasma sel internal sama dengan pH optimal enzim intraseluler. Namun ada kalanya internal dan eksternal sel mempunyai pH yang berlainan, pH didalam sel + 8, meski pH luar mencapai 8-11. Seperti halnya protoplas dari galur Bacillus alkalofilik akan kehilangan stabilitasnya pada lingkungan alkalis, sehingga diduga dinding sel berperan melindungi sel dari lingkungan alkalis.
Dind ing sel mengandung polimer asam (asam galakturonat, glukonat, glutamat, asam aspartat, dan asam fosfat), dan peptidoglikan (dalam hidrolisatnya ditemukan glukosamin, asam muronat, D- dan L-alanin, D-asam glutamat, asam miso-diaminpimelat dan asam asetat). Muatan negatif pada komponen tersebut menyebabkan dinding sel
mampu untuk menyerap ion Na+ dan H+ dan menolak ion OH dan membantu dinding sel tumbuh pada lingkungan alkalis.
Menurut teori kimia osmotik kekuatan gerak proton dalam sel dibentuk oleh rantai transfer elektron atau dengan mengeluarkan H+ diturunkan dari metabolisme ATP oleh ATPase. Selanjutnya H+ diganti Na+ oleh sistem antiporter Na+ /H+ menghasilkan kekuatan gerak Na+ untuk berikatan dengan substrat di dalam sel, yang akan berpengaruh terhadap peningkatan pH. Daya ikatan Na+ dan substrat akan meningkat dua kali bila pH bergeser dari 7 ke 9 (Horikoshi dan Atsukawa. 1973).
Xilanase yang berasal dari mikroba alkalofilik menjadi penting karena kegunaannnya untuk pengembangan teknologi yang rama h lingkungan dalam industri kertas dan pulp. Xilanase dapat menghidrolisis xilan dengan lebih mudah karena polimer ini larut dalam kondisi alkalis.
Xilanase yang berasal dari bakteri alkalofilik pertama kali dilaporkan oleh Horikoshi dan Atsukawa pada tahun 1973 yaitu enzim murni dari Bacillus sp. dan Aeromonas sp. yang mempunyai pertumbuhan optimum pada pH 9-10 tetapi tidak aktif pada pH dibawah 8,0. Telah dilaporkan pada satu isolat Bacillus alkalofilik termofilik yang menghasilkan dua jenis xilanase yang mempunyai pH optimum 10,0 dan suhu 50oC. Dey et al. (1992) mengisolasi Bacillus NCIM 59 yang bersifat alkali termofilik yang menghasilkan dua tipe xilanase bebas selulase. Khasin et al. ( 1993 ) melaporkan bahwa alkalofilik B. stearothermophilus T-6 menghasilkan xilanase pH 9 dan suhu 65oC. Blanco et al. (1995) melaporkan bahwa enzim dan Bacillus sp BP-23 dalam proses bleaching mampu mensubstitusi khlorin sampai 38%. Kemudian Garg et al. (1996, 1998) melaporkan penggunaan xilanase dari Streptomyces thermoviolaceus pada proses biobleaching untuk pulp kraft birchwood dengan suhu aktivitas 65oC.
3. Aerasi dan Agitasi
Produksi biomass dapat dicapai dengan mempertahankan kadar O2 yang lebih besar dari konsentrasi kritis. Jika konsentrasi O2 kurang dari konsentrasi kritis, metabolisme sel akan terganggu. Kebutuhan O2 untuk memproduksi hasil metabolit kultivasi secara optimal mungkin berbeda dengan yang kebutuhan untuk memproduksi biomass (Rachman, 1989).
Laju konsumsi O2 oleh mikroba aerobik cukup tinggi. Oksigen yang tidak mencukupi menyebabkan berkurangnya hasil dari produk mikroba seperti asam organik, enzim, atau antibiotik. Tingkat aerasi dan mixing mempengaruhi kecepatan konsumsi oksigen dan ketersediaannya selama proses kultivasi berlangsung (Sikyta, 1983).
Dalam proses-proses kultivasi aerobik, aerasi dan agitasi merupakan faktor yang sangat penting. Fungsi utamanya adalah untuk mensuplai kebutuhan oksigen bagi aktivitas metabolik mikroba, juga untuk mengaduk mikroba supaya tersuspensi secara homogen dalam bioreaktor (Scragg, 1991).
Menurut Wang et.al. (1979), fungsi aerasi dan agitasi adalah untuk mensuplai kebutuhan oksigen mikroba menurut tingkat aktivitas metabolik yang tepat. Oleh Suhartono (1989) ditambahkan bahwa adanya mekanisme pengadukan (agit asi), maka oksigen, pH, nutrien dan faktor-faktor lain yang terdapat dalam lingkungan dapat tersebar lebih merata di dalam bejana.
Kebutuhan oksigen bagi pertumbuhan mikroba tergantung pada jenis sumber karbon dan efisiensi penggunaannya oleh mikroba tersebut. Peningkatan konsentrasi oksigen terlarut dalam medium dapat dilakukan dengan cara meningkatkan laju aliran udara atau menambah kecepatan pengadukan (Standbury dan Whitaker, 1984).
Lin et al. (1999) telah memproduksi enzim xilanase pada kultivasi media cair dalam bioreaktor kondisi pH 6,0, suhu 50oC, kecepatan agitasi 150 rpm, dan laju aliran udara 1 vvm. Hasil enzim yang diperoleh adalah β-D-xilanase.
Kinetik Produksi Enzim Xilanase
Kinetik kultivasi mikrobia secara umum dikaji berdasarkan laju penggunaan substrat, laju pertumbuhan biomass dan laju pembentukan produk (Judoamidjojo, et.al., 1992). Menurut Monod (1949), untuk menentukan laju pertumbuhan biomass, digunakan persamaan sebagai berikut :
dX = µ X ... (1) dt
Integral dari persamaan (1) akan memberikan hasil sebagaimana diilustrasikan dalam persamaan (2), yaitu :
Ln Xt = µΛt ... (2) Xo
Maka plot linear antara ln X dengan t akan menghasilkan slope yang nilainya sama dengan nilai µ yang dicari. Sedangkan waktu penggandaan (td) dapat ditentukan menggunakan persamaan (3) yaitu :
td= Ln 2 = 0,693 ... (3) µ µ
Berdasarkan keseimbangan (1) pertumbuhan sel mikroba akan berlangsung dengan mengkonsumsi nutrient sekaligus mengeluarkan (sekresi) produk-produk metabolisme yang terbentuk. Setelah waktu tertentu laju pertumbuhan akan menurun dan akhirnya pertumbuhan berhenti sama sekali. Berhentinya pertumbuhan dapat pula disebabkan karena berkurangnya beberapa nutrient esensial dalam media, atau kombinasi keduanya (Rachman, 1989).
Menurut Monod (1949), laju pertumbuhan spesifik yang maksimal (µ maks) dapat ditentukan dengan persamaan :
S
µ = µmax --- ... (4) Ks + S
Modifikasi dari persamaan (4) memberikan persamaan : 1 Ks 1 1
--- = --- --- + --- ...(5) µ µmax S µmax
Sehingga plot linear antara 1/µ dengan 1/S memberikan garis lurus dengan intersep sebagai nilai 1/µmax dan slope garis tersebut merupakan nilai dari Ks/µ max, dengan operasi aljabar biasa maka nilai- nilai dari Ks (kons tanta yang sebanding pada konsentrasi substrat bila µ = 0,5 µmax) dan µmax dapat ditentukan.
Nilai dari koefisien hasil biomasa persatuan massa nutrien yang dikonsumsi (Yx/s) dapat ditentukan menggunakan persamaan (6) yaitu
- dS = - µ X - ms X ... (6)
dt Y x/s
Modifikasi dari persamaan (6) dengan substitusi bahwa µX = dX/dt, dan semua ruas dibagi dengan X maka akan memberikan hasil :
dS/dt 1 dX/dt
--- = --- --- + ms ... (7) X Y x/s X
Dari persamaan (7) tersebut maka plot linear antara (dS/dt)/X dengan (dX/dt)/X akan memberikan garis lurus dengan intersep yang akan memberikan nilai ‘m’ (koefisien pemeliharaan) dan slope garis tersebut akan memberikan nilai 1/Yx/s.
Koefisien hasil produk per unit massa nutrien yang dikonsumsi (Yp/s) dapat ditentukan dengan sederhana yaitu mengikuti persamaan (8)
dP/dt = Yp/s dS/dt ... (8)
Sehingga plot linier dari dP/dt dengan dS/dt akan memberikan garis lurus dengan kemiringan merupakan nilai Yp/s .
Pada umumnya produk suatu proses merupakan hasil langsung suatu jalur katabolik atau metabolik primer. Dalam pola ini laju pembentukan produk berbanding secara proposional dengan laju pertumbuhan.
Sifat Reologi Cairan Kultivasi
Secara umum bioreaktor dilengkapi dengan system agitasi (pengadukan) yang merupakan batang agitator (shaft). Beberapa tipe pengaduk yang sering digunakan pada beberapa kondisi proses yaitu turbin, impeller, bilah dan model jangkar (Doran, 1995). Pada bioreaktor sering dilengkapi dengan baffle atau sekat penghambat, untuk menyempurnakan pengadukan.
Reologi atau sifat dan perilaku aliran media kultivasi akan sangat bermanfaat bagi perancangan dasar bioreaktor untuk skala yang lebih besar. Sifat aliran fluida dalam bioreaktor diperlukan untuk mengetahui tingkat homogenitas komponen dalam proses kultivasi. Sifat aliran kekentalan fluida berpengaruh nyata dalam transfer komponen-komponen media ke sel atau sebaliknya. Berbagai informasi yang didapatkan akan sangat berguna terutama dalam penggandaan skala berdasarkan peubah-peubah yang telah ditentukan pada skala yang lebih kecil. Penggandaan skala dilakukan dengan mempertahankan kesamaan geometrik bioreaktor pada berbagai skala, namun demikian kondisi lingkungan yang ideal tetap diperhatikan. Nilai pH, suhu dan kelarutan oksigen optimum diperoleh dari proses optimasi, maka perilaku terpenting cairan dalam
bioreaktor berpengaduk adalah tenaga (P) dan kecepatan pengadukan (N) (Wang et al. 1979).
Tenaga pengadukan sangat dipengaruhi oleh jenis pengaduk yang digunakan dan sifat reologi cairan kultivasi. Sifat aliran seperti turbulensi dapat ditetapkan berdasarkan nilai bilangan Reynolds. Aliran dalam tanki dikatakan laminar apabila bilangan Reynolds lebih kecil dari 10, jenis aliran tangki disebut peralihan atau transisi jika mempunyai bilangan Reynolds 10-10000 dan turbulen bila lebih besar dari 10000. Bilangan Reynolds ini sangat dipengaruhi oleh sifat kekentalan larutan. Kekentalan merupakan ketahanan cairan menahan gaya yang diberikan untuk menjaga agar bidang tetap tidak bergerak pada laju setara gaya tersebut. Gaya kekentalan secara umum dinyatakan per satuan luas yang disebut tegangan geser (shear stress =t ). Tegangan geser suatu cairan kultivasi berbanding dengan perbedaan laju dalam cairan kultivasi yang disebut laju geser (shear rate = ?). Menurut Wang et al. (1979), hubungan antara tegangan geser dan laju geser cairan Newtonian dan bukan-Newtonian ditentukan persamaan:
t = t y + k?n ………. (9) Keterangan : t : tegangan geser (g /cmdet2)
t y : yield stress (g/cmdet2)
k : indeks konsistensi (g/cmdet n+2) ? : laju geser (/det)
n : indeks perilaku cairan µ : viskositas (g/cmdet)
Pada cairan kultivasi non -Newtonian nilai t y : 0, kekentalan (viskositas= µ) tergantung pada laju geser (?), sehingga persamaan menjadi
t = k?n ……….. (10) dan µ = k?n-1 ... (11)
Nilai k dan n tersebut sangat penting diketahui untuk pengkajian masalah pencampuran. Bila 0<n<1 dan k>0, maka cairan kultivasi adalah pseudoplastik, dan jika n>1 dan k>0, maka cairan kultivasi tersebut adalah dilatan.
Menurut Doran (1995), penentuan bilangan Reynolds pada cairan non-Newtonian dalam memperkirakan kebutuhan tenaga pengadukan jenis impeller adalah sebagai berikut:
Di2 N2-n ?
NRe = --- ... (12) K(ks)n-1
Keterangan : NRe : bilangan Reynolds N: kecepatan putaran agitasi ? : densitas cairan kultivasi Di : garis tengah agitator
ks : konstanta untuk six bladed disc turbine yang besarnya 11,5
Konsumsi tenaga (P) yang dibutuhkan untuk menggerakkan agitator mengikuti persamaan sebagai berikut:
Np Di5 N3 ?
P = --- ... (13) gc
Keterangan : Np = bilangan tenaga
P : tenaga yang terserap oleh agitator gc = faktor konversi (9,81 kg m/kg det2)
Aplikasi Xila nase
Selama dekade terakhir ini, potensi bioteknologi dari aplikasi xilanase telah menjadi perhatian utama para peneliti, karena xilanase berpotensi digunakan bermacam-macam industri antara lain untuk industri pangan, pakan serta pulp dan kertas (Beg et al. 2001).
1. Pemanfaatan Xilanase Untuk Proses Pembuatan Kertas.
Pada pembuatan kertas, xilanase digunakan untuk menghilangkan hemiselulosa dalam proses bleaching. Pengembangan aplikasi xilanase untuk biobleaching pada mulanya ditemukan oleh Viikari et al. (1986). Enzim ini sebagai pengganti cara kimia sehingga pencemaran racun limbah kimia akan dihindari dan lebih murah (Ruiz- Arribas et al. 1995, Viikari et al., 1994). Bahan baku kayu pembuat kertas setelah melalui proses digester dan pencucian, sebenarnya masih dalam keadaan kotor (derajat putihnya rendah). Untuk menghasilkan kertas yang bermutu tinggi perlu dilakukan proses pemutihan. Proses pemutihan bertujuan untuk menghilangkan lignin, hemiselulosa penyebab warna coklat, dan zat ekstraktif yang dikandung dari hasil pencucian dan penyaringan. Proses pemutihan biasanya dilakukan bertahap, karena mempunyai kelebihan diantaranya adalah nilai derajat putihnya tinggi. Proses bertahap ini terdiri atas tahap klorinasi, ekstraksi, dan penambahan klorin dioksida. Klor adalah bahan beracun,
sehingga klor sisa proses yang dibuang ke perairan sungai akan membuat polusi yang tinggi. Polusi terbesar di Indonesia berasal dari pabrik kertas. Jumlah pabrik kertas yang sudah beroperasi di Indonesia saat ini lebih dari 14 perusahaan, dan belum satupun menggunakan proses enzimatis dalam proses pemutihan. Dengan demikian untuk mendukung pelestarian lingkungan maka perlu segera diaplikasikan proses ramah lingkungan (clean processing) tersebut di Indonesia. Penggantian penggunaan klor untuk pemutihan kertas, telah memberikan peluang untuk aplikasi bioteknologi. Untuk proses pembuatan kertas diharapkan xilanase yang digunakan adalah termostabil dan tahan pada pH tinggi (Nakamura et al. 1993), dan jenis enzimnya adalah endoxilanase (Kantelinen et al. 1988, Paice et al. 1988, Viikari et al. 1994), serta diharapkan free celulase (Garg et al. 1996, 1998). Namun demikian kombinasi xilosidase atau xilanolitik lain dan hemiselulolitik dengan endoxilanase telah menunjukkan efektif pada perbaikan mutu kertas (Kantelinen et al. 1993, Clark et al. 1990). Penggunaan xilanase dan enzim-enzim sejenisnya pada proses pemutihan kertas membantu pengurangan jumlah kappa dan meningkatkan derajat putih kertas (Viikari et al 1994, Yang et al. 1995). Sejumlah kajian pengaruh xilanase pada pemutihan kertas yang dilakukan dengan enzim berasal dari Trichoderma sp, ternyata pengurangan penggunaan klor mencapai 20-30% (Viikari et al. 1994).
Xilanase termostabil dari bakteri anaerobik termofilik Dictyoglomus sp. telah diuji kemampuannya dalam proses pemutihan pulp. Perlakuan xilanase pada suhu 80oC dan pH 6-8 menghasilkan peningkatan derajad pemutihan sebanyak 2 satuan ISO dalam satu tahap proses delignifikasi dengan peroksida. Xilanase komersial untuk proses pemutihan pulp pertama kali dipasarkan oleh Novo Nordisk A/s dengan nama Pulpzyme HA, yang berasal dari T. reesei. Setelah itu bermunculan nama-nama lain seperti Cartazyme HS dari Sandoz Chemicals, Irgazyme 40 yang dihasilkan dari T.longibrachiatum dan T. harzianum E 58, Ecopulp (Alko-ICI), Cartazyme-NS-10 (Clariant) dan Pulpzyme HC (Novo Nordisk) yang semuanya telah dicoba dalam proses pemutihan pulp dan hasilnya menunjukkan penurunan yang nyata terhadap penggunaan ClO2 dan H2O2. Namun demikian semua enzim komersial ini masih belum memenuhi kriteria ideal yang dibutuhkan untuk aktivitas enzimatik yang diperlukan yaitu aktivitas optimum pada pH 10 dan suhu lebih dari 90oC (Kulkarni et al., 1999).
2. Pemanfaatan Xilanase Untuk Gula Xilosa.
Xilanase juga dapat digunakan untuk menghidrolisis xilan (hemiselulosa) menjadi gula xilosa. Gula xilosa dihidrogenasi menjadi xilitol banyak digunakan untuk konsumsi penderita diabetes. Disamping itu di Malaysia saat ini gula xilitol banyak digunakan untuk campuran pasta gigi karena dapat berfungsi memperkuat gusi. Dengan beragamnya kegunaan gula xilitol maka perlu adanya inovasi kearah produksi xilosa tersebut. Inovasi tersebut muncul diantaranya apabila enzim penghidrolisis lignoselulosa tersebut sudah tersedia. Disamping itu perlu pengembangan proses yang efisien untuk hidrolisis enzimatis untuk bahan berhemiselulosa tinggi.
3. Pemanfaatan Xilanase Untuk Makanan Ternak
Van-Paridon et al. (1992) telah melakukan penelitian pemanfaatan xilanase untuk campuran makanan ayam boiler, dengan melihat pengaruhnya terhadap berat yang dicapai dan efisiensi konversi makanan serta hubungannya dengan nilai cernak. Hal yang sama juga dilakukan oleh Bedford dan Classen (1992), yang melaporkan campuran makanan ayam boiler dengan xilanase yang berasal dari T. longibrachiatum ternyata mampu meningkatkan nilai cerna , sehingga meningkatkan efisiensi konversi makanan dan berdampak pada peningkatan berat ayam.
4. Pemanfaatan Xilanase Untuk Meningkatkan Kualitas Roti
Efisiensi xilanase dalam perbaikan kualitas roti yang telah dilakukan yaitu xilanase berasal dari Aspergillus niger var awamori yang ditambahkan ke dalam adonan roti menghasilkan kenaikan volume spesifik roti. Dan untuk lebih meningkatkan kualitas rerotian maka perlu dilakukan kombinasi penambahan amilase dan xilanase (Maat et al. 1992).
5. Pemanfaatan Xilanase Untuk M inuman
Xilanase dapat juga untuk menjernihkan juice, untuk ekstraksi kopi, minyak nabati dan pati (Wong dan Sadler, 1992). Kombinasi dengan selulase dan pektinase dapat untuk penjernihan juice dan likuifikasi pada buah.
Aspek Finansial Dan Ekonomi
Penilaian kelayakan finansial industri pengolahan enzim xilananse dari tongkol jagung maupun ekstrak xilannya menggunakan kriteria harga pokok dan pengembalian modal dan Break Event Point (BEP) atau titik impas atau pulang modal.
a. Modal investasi, digunakan untuk pembelian tanah, biaya bangunan dan perlengkapan kantor, alat dan mesin dan biaya pra operasional.
b. Biaya tetap, meliputi biaya penyusustan, bunga modal, pajak dan asuransi.
c. Biaya tidak tetap, meliputi biaya pembelian bahan baku dan bahan penolong, bahan bakar dan listrik, perbaikan dan pemeliharaan upah karyawan.
d. Pendapatan, dihitung berdasarkan harga jual xilan atau xilanase di tahun 2005 dikalikan dengan jumlah produk yang dihasilkan.
e. Keuntungan, dihitung berdasarkan pendapatan dikurangi biaya total.
f. Waktu pengembalian modal, digunakan untuk mengetahui berapa lama modal awal tertanam dalam proyek. Waktu pengembalian modal dihitung berdasarkan investasi yang tertanam dibagi dengan keuntungan bersih tahunan dan penyusutan.
g. Titik Pulang Pokok (Break Event Point), digunakan untuk mengetahui jumlah minimum penjualan produk dengan tujuan perusahaan tidak mengalami kerugian dan juga tidak mendapatkan keuntungan. Rumus titik pulang pokok adalah sebagai berikut:
BEP = (FC) / (H-VC)
Dengan BEP = Jumlah penjualan pada titik pulang pokok FC = Biaya tetap
H = Harga jual /unit