115 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
SUBKLONING GEN ANTIGEN TUBERKULOSIS 85B DENGAN MENGGUNAKAN
SIGNAL PEPTIDE AQ1 ENDOXILANASE
Reny Guspratiwi1*, Is Helianti2, Abinawanto1, Astutiati Nurhasanah2 1Departemen Biologi, FMIPA UI, Kampus UI Depok 16424
2 Pusat Teknologi Bioindustri (BPPT), Gedung 611, LAPTIAB-PUSPIPTEK Serpong, Tangerang, Banten
*[email protected] ABSTRAK
Penanggulangan penyakit Tuberkulosis dengan lebih efektif saat ini dilakukan melalui pengembangan vaksin kombinasi yang merupakan kombinasi dari vaksin BCG dengan protein antigen yang berasal dari Mycobacterium tuberculosis. Salah satu protein antigen yang tengah diteliti adalah ag85B. Pada penelitian ini telah dilakukan kloning gen antigen Tuberkulosis ag85B di Eschericia coli yang digabungkan dengan signal peptid dari gen Bacillus subtilis AQ1 endoxilanase. Gen antigen 85B yang berukuran 991 pb diklona ke dalam vektor pUC57 yang mengandung promoter dan signal peptid AQ1 endoxilanase (pUC57 fragmen 2). Vektor pUC57 fragmen 2 berukuran sekitar 2500 pb. Oleh karena itu menghasilkan plasmid rekombinan yang berukuran sekitar 3500 pb. Hasil ekspresi dari plasmid rekombinan diuji dengan SDS-PAGE. Hasil penelitian menunjukkan gen antigen 85B berhasil diklona ke dalam vektor pUC57 fragmen 2 akan tetapi uji ekspresi dengan SDS-PAGE menunjukkan gen ag85B tersebut belum dapat diekspresikan.
ABSTRACT
More effective prevention of Tuberculosis is now done through the development of vaccines combination, which is combined BCG vaccine with antigen from Mycobacterium tuberculosis. One of the antigen proteins under investigation is Ag85B. Cloning of Tuberculosis antigen Ag85B with signal peptide AQ1 endoxylanase from Bacillus subtilis gene in Escherichia coli DH5α was done in this research. Antigen 85B’s gene sized 991 bp was cloned into 2500 bp of pUC57 vector containing promoter and signal peptide AQ1 endoxylanase (fragment 2 of pUC57). It therefore produced a recombinant plasmid around 3500 bp. The expression of recombinant plasmid was tested by SDS-PAGE. The Result of this research showed that antigen 85B’s gene was successfully cloned into fragment 2 of pUC57 vector, but the expression was tested by SDS-PAGE showed that antigen 85B’s gene has not yet been expressed.
Keyword : Antigen 85B, E. coli DH5 α, pUC57 fragmen2, signal peptide
PENDAHULUAN
Tuberkulosis (TB) merupakan penyakit menular yang disebabkan oleh Mycobacterium tuberculosis. Penyakit tersebut menyerang
perempuan dan laki-laki, dewasa maupun anak-anak. World Health Organization (WHO) menyatakan bahwa penyakit TB merupakan penyebab kematian tertinggi setelah
Acquired Immune Deficiency
Syndrome (AIDS) dan sebagai
masalah kesehatan global pada tahun 1993 [1].
Penyebaran penyakit tuberkulosis dapat dicegah dengan pemberian vaksin Bacille Calmette Guerin (BCG). Vaksin tersebut telah digunakan sebagai pencegah TB sejak ditemukan oleh Calmette dan Guerin pada tahun 1921. Vaksin BCG yang digunakan merupakan strain Mycobacterium bovis yang telah dilemahkan [2]. Akan tetapi, keefektifan vaksin tersebut menurun sejak diketahui meninggalnya 73 dari 250 bayi yang telah divaksin pada tahun 1930 [3]. Hal tersebut disebabkan oleh Mycobacterium tuberculosis yang resisten terhadap vaksin BCG. Sejak saat itu, penelitian dilakukan untuk mengembangkan vaksin kombinasi yang mampu meningkatkan kinerja vaksin BCG [4]. Salah satu vaksin kombinasi yang pernah diuji coba pada tahun 2002 adalah MVA85A. Vaksin tersebut berasal dari antigen tuberkulosis 85A. Akan tetapi, vaksin tersebut kurang baik dalam mencegah infeksi TB dan gagal menginduksi respon imun [5]. Vaksin kombinasi terus dikembangkan dengan menggunakan antigen M. tuberculosis lainnya, seperti Antigen 85B, Mtb72, Mtb39, dan Mtb32. Hasil
uji setiap vaksin kombinasi tersebut berhenti pada uji praklinis fase 2, yang menunjukkan bahwa vaksin tersebut gagal dalam melindungi hewan uji dari pajanan M. tuberculosis [6].
Penelitian untuk mendapatkan vaksin kombinasi yang lebih efektif terus dilakukan. Salah satunya,
dikembangkan dengan
menggunakan antigen tuberkulosis 85B. Hal tersebut disebabkan karena antigen 85B (Ag 85B) merupakan protein (30 kDa) yang paling banyak dihasilkan oleh M. tuberculosis dibandingkan dengan antigen lainnya. Antigen tersebut dapat menginduksi perbanyakan sel T dan sekresi IFN-γ pada individu terinfeksi M. tuberculosis [7; 8; 9]. Hal tersebut telah dibuktikan dari penelitian Horwitz dkk. [10] bahwa antigen 85B terbukti dapat meningkatkan imunitas hewan uji melawan pajanan dari M. tuberculosis. Oleh karena itu, Ag 85B diharapkan dapat menjadi kandidat vaksin tuberkulosis kombinasi yang baru.
Ekspresi antigen 85B perlu diketahui untuk mempermudah proses mendapatkan vaksin tuberkulosis yang baru [11]. Selain itu, antigen yang diekspresikan oleh plasmid DNA berguna untuk menginduksi sel T [12]. Penelitian tentang kloning dan ekspresi gen
117 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
Antigen 85B telah dilakukan oleh beberapa peneliti sebelumnya. Matsuo dkk. [13] berhasil mengkloning gen Ag 85B ke dalam vektor pUC18, namun ukuran antigen 85B yang dihasilkan tidak berukuran 30 kDa. Zarif dkk. [11] juga berhasil melakukan kloning gen Ag 85B, namun menggunakan vektor pET101 yang ditransformasi ke dalam E. coli. Ekspresi Ag 85B yang dihasilkan juga belum efektif karena adanya endotoksin yang dikeluarkan oleh E.coli. Oleh karena itu, untuk mendapatkan hasil ekspresi yang lebih optimal, penelitian dilakukan menggunakan signal peptide AQ1 endoxilanase dengan vektor pengklonaan berupa pUC57 fragmen 2 yang telah dimodifikasi.
Penelitian yang dilakukan oleh Helianti dkk. [14] menemukan bahwa
gen endoxilanase yang
mengandung promoter B. subtilis AQ1 dan signal peptide-nya dikenali dan berfungsi di dalam E. coli sehingga menghasilkan endoxilanase yang dikeluarkan ke supernatan. Hal tersebut mendasari penelitian yang dilakukan menggunakan signal peptide AQ1 endoxilanase yang dilihat pengaruhnya terhadap ekspresi antigen 85B yang dihasilkan. Pengaruh signal peptide AQ1 endoxilanase tersebut dibandingkan dengan pengaruh signal peptide
original yang terdapat pada gen Ag 85B. Namun, belum diketahui apakah gen Ag 85B dengan signal peptide AQ1 endoxinalase yang diklona ke dalam vektor pUC57 fragmen 2 dapat diekspresikan secara ekstraselular pada sel inang E. coli DH5α.
Vektor pengklonaan yang digunakan pada penelitian adalah pUC57 fragmen 2 yang telah dimodifikasi. Vektor tersebut akan disisipi oleh gen Ag 85B dengan signal
peptide AQ1 endoxilanase.
Penelitian diharapkan dapat menghasilkan suatu plasmid rekombinan yang mengekspresikan enzim lebih banyak dan efektif. Plasmid rekombinan tersebut akan ditransformasikan ke dalam E. coli DH5α sebelum ditransformasikan ke dalam B. subtilis pada penelitian selanjutnya.
Penelitian yang dilakukan bertujuan untuk mengklona gen yang mengandung antigen 85B dengan signal peptide AQ1 endoxilanase ke dalam vektor pUC57 yang mengandung promoter endoxilanase dan signal peptide AQ1 (pUC57 fragmen 2) dan melihat ekspresi antigen yang dihasilkan oleh signal
peptide tersebut. Sebagai
pembanding dilakukan pula subkloning antigen 85B dengan signal peptide aslinya.
METODE PENELITIAN
Isolasi Puc57 Fragmen 2 dan Gen Antigen 85B
Plasmid pUC57 fragmen 2 dan gen antigen 85B yang terdapat dalam pUC57 fragmen 3 diisolasi menggunakan dan mengikuti protokol dari Gene JET plasmid miniprep kit [15].
Amplifikasi Gen Antigen 85B
Gen antigen 85B diamplifikasi dengan primer forward (5- CAA GGC TTT AGC CGC CCG GGC CTG CCG GTG GAA TAT -3) dan primer reverse (5- GAA GAT CTT TAG CCC GCG CCC AGG CTG CTC -3) yang spesifik untuk signal peptide endoxilanase AQ1. Sedangkan untuk signal peptide asli menggunakan primer forward (5- CCT TAA CCA TAT GAC CGA TGT GAG CCG CAA AAT TCG -3) dan primer reverse (5- CAT AAG CTT TTA GCC CGC GCC CAG GCT GCT C -3). Komposisi larutan PCR yang digunakan ialah ddH2O, 5x GC Buffer, 10 mM dNTP mixed, DMSO, primer forward signal peptide AQ1 endoxilanase, primer reverse signal peptide AQ1 endoxilanase, dan DNA polimerase [15]. Amplifikasi dilakukan sebanyak 25 siklus diawali dengan suhu 98oC selama 30 detik untuk denaturasi awal, kemudian memasuki siklus PCR dengan suhu 98oC selama sepuluh detik untuk
proses denaturasi, dilanjutkan dengan suhu 65oC selama 15 detik untuk annealing, dan elongasi pada suhu 72oC selama 30 detik. Proses amplifikasi diakhiri dengan proses elongasi tambahan pada suhu 72oC selama lima menit dan hold pada suhu 20oC.
Digesti pUC57 Fragmen 2 dan Gen Antigen 85B
Plasmid pUC57 dan gen antigen 85B didigesti dengan enzim restriksi yang sama yaitu enzim BglII dan NarI [16]. Komposisi digesti dengan total reaksi 40 µL adalah 25 µL plasmid, 8 µL ddH2O, 4 µL 10x buffer 3, 1,5µL NarI, dan 1,5 µL BglII. Sedangkan digesti gen antigen 85B dengan signal peptide asli dilakukan dengan enzim restriksi NdeI dan HindIII. Campuran larutan digesti diinkubasi selama lima jam pada suhu 37°C agar plasmid terpotong dengan sempurna.
Purifikasi Hasil Digesti
Purifikasi plasmid hasil digesti dilakukan menggunakan Gel/PCR DNA fragment extraction kit [17].
Ligasi Vektor pUC57 Fragmen 2 dengan Gen Antigen 85B
Ligasi sampel dilakukan dengan menggunakan enzim dan buffer ligasi dari produk PROMEGA. Komposisi dengan total reaksi sebanyak 20 µL ialah 2 µL vektor (pUC57 fragmen 2),
119 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
4 µL gen Ag 85B, 1 µL T4 DNA ligase, 2 µL buffer T4 DNA ligase, dan 11 µL ddH2O. Campuran larutan ligasi tersebut diinkubasi selama tiga jam pada suhu 22oC. Heat inactivation selama 70oC selama lima menit dilakukan untuk menghentikan reaksi enzim.
Transformasi ke dalam Sel Inang E.
coli DH5α
Proses transformasi dilakukan dengan metode heat shock [18]. Sampel plasmid hasil ligasi sebanyak 5 µL dimasukkan ke dalam 50 µL E.coli DH5α dan divorteks hingga homogen. Campuran diinkubasi di dalam es selama 30 menit, kemudian diinkubasi pada suhu 42°C selama 60 detik lalu diinkubasi kembali di dalam es selama dua menit. Sebanyak 250 µL media SOC dimasukkan ke dalam campuran dan dilakukan
pengocokan menggunakan
inkubator suhu 37°C dengan kecepatan 150 ×g selama satu jam.
Campuran yang telah
dihomogenkan selama satu jam selanjutnya disebar merata pada cawan LB + ampicillin agar. Sampel hasil transformasi kemudian diinkubasi pada suhu 37oC selama 16 jam. Koloni yang tumbuh pada medium tersebut merupakan koloni yang diduga positif.
Isolasi Plasmid Rekombinan
Plasmid rekombinan diisolasi mengikuti prosedur Sambrook & Russell [18] dengan menggunakan Gene JET plasmid miniprep kit [15].
Konfirmasi Plasmid Rekombinan
dengan Digesti
Plasmid rekombinan dengan signal peptide AQ1 endoxylanase yang telah diisolasi, didigesti kembali menggunakan enzim restriksi BglII dan NarI. Sedangkan plasmid rekombinan dengan signal peptide asli didigesti kembali menggunakan enzim restriksi NdeI dan HindIII. Campuran larutan sampel digesti diinkubasi selama 3 jam.
Sekuensing dan Analisis Data
Sekuensing dilakukan
menggunakan jasa Laboratorium Genetika Science 1st Base. Proses sekuensing plasmid rekombinan menggunakan primer forward M13F (-20) dan reverse M12R pUC (-26). Hasil sekuensing yang diperoleh dianalisis dengan menggunakan program BLASTX menggunakan pada http://blast.ncbi.nlm.nih.gov/Blast.cgi. Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis
Proses Sodium Dodecyl Sulphate Polyacrilamide Gel Electrophoresis (SDS PAGE) dilakukan berdasarkan Sambrook & Russell [18]. Prosedur SDS
PAGE dilakukan dengan menyiapkan resolving gel terlebih dahulu. Larutan gel dibuat dengan mencampurkan Tris HCl, SDS 10%, akrilamid, APS 10%, TEMED, dan ddH2O. Larutan yang sudah jadi dituangkan di antara dua plate sebanyak 2/3 tinggi plate. Permukaan resolving gel diratakan dengan ddH2O dan dibuang jika permukaan resolving gel sudah rata. Larutan stacking gel dibuat dengan bahan-bahan yang sama dengan resolving gel, akan tetapi dengan jumlah bahan-bahan yang berbeda. Larutan stacking gel dituang ke atas resolving gel yang sudah mengeras dan cetakan comb untuk memasukkan sampel diletakkan di atas stacking gel tersebut. Comb diangkat perlahan-lahan ketika gel sudah mengeras dan running buffer dimasukkan ke dalam tangki elektroforesis.
Plasmid rekombinan yang telah ditransformasikan ke dalam E. coli DH5α ditumbuhkan pada medium LB cair + ampicillin selama 18 dan 24 jam pada suhu 37oC dan kecepatan 150 ×g. Kultur sel yang telah diinkubasi dipisahkan antara supernatan dan pelet sel. Sampel yang dianalisis dengan SDS PAGE terdiri atas sampel ekstraseluler yang berasal dari supernatan dan sampel intraseluler yang berasal dari pelet sel. Sampel intraseluler didapat
dengan menghancurkan sel secara mekanik dengan sonikator.
Kedua sampel yang dimasukkan ke dalam sumur gel harus didenaturasi terlebih dahulu. Proses tersebut dilakukan dengan memasukkan 3 µL sampel ke dalam 12 µL loading buffer SDS gel dan dipanaskan pada suhu 100oC selama satu menit. Sampel sebanyak 15 µL dimasukkan ke dalam sumur yang sudah terbentuk pada stacking gel. Satu sumur yang tidak digunakan, diisi dengan 5 µL marker. Perangkat elektroforesis dinyalakan dan diatur pada tegangan 8 V/cm hingga sampel terlihat mencapai permukaan resolving gel, kemudian tegangan dinaikkan menjadi 15 V/cm. Perangkat elektroforesis dimatikan ketika sampel terlihat telah mencapai bagian bawah resolving gel.
Gel dipisahkan dari perangkat elektroforesis dan dipanaskan satu menit. Gel yang sudah dipanaskan, diwarnai dengan PageBluetm (Fermentas) selama 30 detik sambil dipanaskan, kemudian diletakkan di atas shaker dengan kecepatan 150 ×g selama 30 menit. Proses pencucian gel setelah diwarnai dilakuan menggunakan air selama 3 jam di atas shaker dengan kecepatan 150 ×g. Gel yang telah selesai dicuci, divisualisasikan
121 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
menggunakan gel doc atau disimpan di dalam kantong plastik yang berisi H2O.
HASIL DAN PEMBAHASAN Isolasi plasmid
Isolasi pUC57 fragmen 2 dan gen Ag 85B berhasil dilakukan dengan mendapatkan pita DNA sesuai dengan yang diinginkan [19] yaitu 3000 pb untuk pUC57 fragmen 2 dan 991 pb untuk gen Ag 85B.
Amplifikasi gen Ag 85B
Hasil amplifikasi gen Ag 85B dengan signal peptide AQ1 endoxylanase memiliki ukuran kurang lebih 1000 pb. Hasil tersebut disebabkan oleh ukuran DNA yang dijadikan sebagai cetakan berukuran kurang lebih sama (991 pb) [19; 20].
Digesti pUC57 Fragmen 2 dan Gen Antigen 85B
Hasil digesti pUC57 fragmen 2 (gambar 3.3) menunjukkan dua pita DNA yang telah dipisahkan melalui proses elektroforesis gel agarosa 1%. Hasil digesti tersebut sesuai dengan simulasi digesti pUC57 fragmen 2 dengan enzim restriksi BglII dan NarI pada perangkat lunak pDRAW. Hasil digesti gen Ag 85B menunjukkan ukuran pita DNA yang kurang lebih
sama dengan hasil amplifikasi. Hal tersebut disebabkan oleh proses amplifikasi yang menambahkan ujung plasmid sehingga memiliki ujung yang sama dengan plasmid vektor.
Purifikasi gel pUC57 fragmen 2
Plasmid pUC57 fragmen 2 yang telah didigesti, kemudian dilakukan purifikasi gel untuk memisahkan pita DNA yang berukuran 2500 pb dengan 500 pb. Pita DNA yang diinginkan sebagai vektor pengklonaan adalah pita DNA yang berukuran 2500 pb. Plasmid hasil purifikasi merupakan plasmid murni yang telah terpisah dari pengotor lainnya.
Gambar 3.4 Hasil purifikasi
[Sumber : Dokumentasi pribadi]
Keterangan
M : Marka DNA 1 kb Lajur 1 : pUC57 fragmen 2 Gel agarosa 1%, 100 V, 25 menit
1 M
± 2500 pb
Ligasi dan Isolasi Plasmid Rekombinan
Hasil ligasi vektor pUC57 fragmen 2 dengan gen Ag 85B signal peptide AQ1 endoxylanase yang telah diisolasi, divisualisasikan dengan gel agarosa 1% (gambar 3.5). Pita DNA yang terlihat pada plasmid rekombinan berukuran sekitar 3500 pb. Ukuran tersebut merupakan ukuran gabungan antara gen donor Ag 85B (1000 pb) dan vektor pUC57 fragmen 2 (2500 pb) dan sesuai dengan hasil simulasi dengan perangkat lunak pDRAW. Berdasarkan ukuran tersebut, dapat diketahui bahwa proses ligasi telah berhasil dilakukan.
Gambar 3.5
Hasil isolasi plasmid rekombinan [Sumber: Dokumentasi pribadi]
Konfirmasi Plasmid Rekombinan
dengan Digesti
Hasil konfirmasi plasmid rekombinan dengan signal peptide AQ1 endoxylanase (gambar 3.6) memiliki ukuran pita DNA 2500 pb dan sekitar 1000 pb. Ukuran pitan DNA tersebut merupakan ukuran yang sama dengan vektor pUC57 fragmen 2 dan gen Ag 85B. Pita DNA yang terlihat berukuran sekitar 3500 pb merupakan sisa plasmid rekombinan yang belum terdigesti sempurna [21].
Gambar 3.6
Hasil konfirmasi dengan digesti [Sumber : Dokumentasi pribadi]
Keterangan
M : Marka DNA 1 kb Lajur 1-5 : Plasmid rekombinan SP
AQ1 endoxylanase Gel agarosa 1%, 100 V, 25 menit
M
5
2
1
4
4000 pb 3500 pb3
3000 pb Keterangan M : Marka DNA 1 kbLajur 1-5 : Hasil digesti plasmid rekombinan Gel agarosa 1%, 100 V, 27 menit
3
2500 pb 1000 pb 2500 pb ±1000 pb2
M 1
4
5
123 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
Sekuensing dan Analisis Hasil
Sekuensing
Hasil sekuensing telah divisualisasikan berupa gambar elektroferogram menggunakan perangkat lunak Chromas Lite versi 2.01.
Elektroferogram memperlihatkan puncak sinyal yang cukup baik. Hal tersebut merupakan salah satu indikasi hasil elektroferogram yang baik, yaitu tidak ada puncak sinyal yang bertumpuk [22]. Hasil sekuensing dengan puncak sinyal yang baik hanya terdapat pada hasil sekuensing dengan primer reverse M12R pUC (-26), sedangkan hasil sekuensing dengan primer forward M13F (-20) menunjukkan puncak sinyal yang bertumpuk. Analisis hanya bisa dilakukan pada hasil sekuensing dengan primer reverse sehingga tidak bisa dilakukan analisis BLASTX untuk sekuen yang utuh.
Hasil sekuensing yang telah dianalisis menggunakan program
BLASTX pada situs
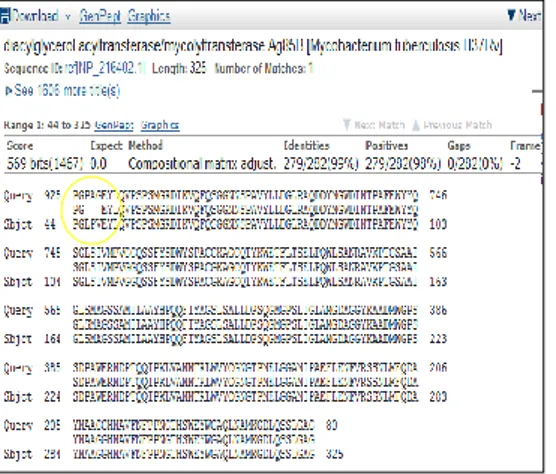
http://blast.ncbi.nlm.nih.gov/Blast.cgi. Hasil BLASTX plasmid rekombinan Ag 85B dengan signal peptide AQ1 endoxylanase menunjukkan max
ident 99% dengan protein
mycolyltransferase Ag 85B Mycobacterium tuberculosis H37Rv. Max ident sebesar 99% menunjukkan protein sampel identik dengan
protein mycolyltransferase Ag 85B Mycobacterium tuberculosis H37Rv. Hasil BLASTX memiliki nilai E atau nilai yang diharapkan sebesar 0,0 yang menunjukkan bahwa sekuen protein sampel memiliki kesamaan yang
tinggi dengan protein
mycolyltransferase Ag 85B Mycobacterium tuberculosis H37Rv. Hasil alignment (gambar 3.7) sampel dengan database menghasilkan celah protein yang tidak dimiliki oleh sampel. Celah yang terbentuk merupakan sisa basa yang tidak ter-alignment dan dapat diabaikan [23]. Meskipun demikian, hasil BLASTX yang tidak utuh menyebabkan kemungkinan ada asam amino yang hilang.
Sekuensing dilakukan sebagai verifikasi lanjutan untuk memastikan gen Ag 85B telah berhasil terklon ke dalam vektor pUC57 fragmen 2. Verifikasi dengan teknik sekuensing bertujuan untuk mengetahui sekuen gen yang belum diidentifikasi. Hal tersebut berguna dalam menentukan terjadinya proses mutasi pada sekuen [24]. Hasil konfirmasi Ag 85B dengan protein pada database genebank dapat dipercaya karena memiliki nilai kesamaan 99% dan 100%. Berdasarkan hasil tersebut, telah dapat dipastikan bahwa gen Ag 85B telah berhasil diklon ke dalam vektor pUC57 fragmen 2.
Gambar 3.7 Hasil alignment
[Sumber : Dokumentasi pribadi] Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis
Hasil SDS PAGE pada gambar 3.8 memperlihatkan pita protein yang hanya terlihat pada lajur K hingga lajur AQ124 yang merupakan protein dari intraseluler. Kultur ekstraseluler atau supernatan tidak menunjukkan pita sama sekali (lajur 1). Hal tersebut menunjukkan bahwa kultur E. coli hanya mengekspresikan protein secara intraseluler. Bakteri E. coli tidak memiliki sinyal yang dapat mengeluarkan protein ke medium pertumbuhan [25]. Oleh karena itu, digunakan signal peptide AQ1 endoxylanase untuk mendapatkan ekspresi protein secara ekstraseluler. Ekspresi protein yang hanya terlihat secara intraseluler menunjukkan kemungkinan bahwa signal peptide AQ1 endoxylanase yang diharapkan
dapat mengekspresikan protein secara ekstraseluler belum bekerja dengan baik [26].
Ketebalan pita kurang lebih sama antara kultur sel kontrol dan kultur sel signal peptide AQ1 endoxylanase. Perbedaan ketebalan pita juga tidak terlihat signifikan antara kultur 18 jam dan kultur 24 jam. Ukuran pita protein terlihat sekitar 55 kDa, namun ukuran tersebut tidak sesuai dengan ukuran protein dari gen antigen 85B, yaitu 30 kDa [27].
Hasil yang didapatkan menunjukkan bahwa gen antigen 85B belum berhasil diekspresikan dengan baik pada sel inang E. coli DH5α. Hal tersebut kemungkinan disebabkan oleh salah satu dari tiga hal yang memengaruhi sekresi protein, yaitu strain sel inang, sekuen signal peptide, dan tipe protein yang dihasilkan. Sekresi protein pada sel inang E. coli memiliki beberapa permasalahan, antara lain signal peptide yang tidak lengkap dan protein rekombinan yang dihasilkan dalam jumlah yang sedikit, sehingga ekspresi tidak terlihat secara spesifik [26]. Ekspresi antigen 85B yang lebih spesifik dapat dilihat menggunakan prosedur western blot pada penelitian selanjutnya [9].
125 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
Gambar 3.8 Hasil SDS PAGE [Sumber : Dokumentasi pribadi]
KESIMPULAN
Gen antigen 85B dengan signal peptide AQ1 endoxylanase berhasil diklona ke dalam vektor pUC57 fragmen 2. Namun, ekspresi antigen 85B dengan signal peptide AQ1 endoxylanase belum berhasil diekspresikan.
DAFTAR PUSTAKA
[1] WHO (World Health Organization). 2013. Global Tuberculosis report 2013. WHO Press, Perancis: xi + 91 hlm.
[2] Kaufmann, S.E., G. Hussey, & P. H. Lambert. 2010. New vaccines for tuberculosis. Departement of Immunology, Max Planck Institute for Infection Biology, Berlin 375: 2110—2119.
[3] Luca, S. & T. Mihaescu. 2013. History of BCG vaccine. A Journal of Clinical Medicine 8(1): 53--58. [4] WHO (World Health Organization).
2012. Tuberculosis control in the
South-East Asia region. WHO Press, India: ix + 141 hlm.
[5] Rowland, R. A.A. Pathan, I. Satti, I.D. Poulton, M.M Matsumiya, M. Wittaker, A.M. Minassian, G.A. O’Hara, M. Hamill, J.T. Scott, S.A. Harris, H.C. Poyntz, C. Bateman, J. Meyer, N. Williams, S.C. Gilbert, A.M. Lawrie, A.V. Hill, H. McShane. 2013. Safety and immunogenicity of an FP9-vectored candidate tuberculosis vaccine (FP85A), alone and with candidate vaccine MVA85A in BCG-vaccinated healthy adult: a phase I clinical trial. Human vaccine & immunotherapeutics
9(1): 50--62.
[6] Montagni, C., E. Chiappini, L. Galli, & M. de Martino. 2014. Vaccine against tuberculosis: what’s new?. BMC Infectious Diseases
14(1): 1--9.
[7] Andersen, P. & I. Heron. 1993. Specificity of a protective memory immune respons against
Mycobacterium tuberculosis.
Infection and Immunity 61(4): 844--851.
[8] Daffe, M. 2000. The Microbial antigen 85 complex-from structure to function and
Keterangan:
M : Marker LMW 97,0 kDa Lajur 1 : protein dari supernatant K : Kontrol 18 : kultur 18 jam 24 : kultur 24 jam 18 24 M Lajur 1 K ±55 kDa
beyond. Trends in Microbiology
8(10): 438--440.
[9] Hyun-Jeong Ko, Sung-Youl Ko, Yeon-Jeong Kim, EUN-Gae Lee, SANG-Nae Cho, & Chan-Yull Kang. 2005. Optimization of codon usage enhance the immunogenicity of a DNA
vaccine encoding
Mycobacterial antigen Ag85B. Infection and Immunity 73(9): 5666--5674.
[10] Horwitz, M.A., Byong-Wha Esther Lee, B.J. Dillon, & G. Harth. 1995. Protective immunity against tuberculosis induced by vaccination eith major extracellular proteins of Mycobacterium tuberculosis. Proceeding of The National Academy of Sciences 92: 1530--1534.
[11] Zarif, R., M. Sankian, A. Gholubi, Z. Farshadzadeh, S. Soleimanpour, F. Youssefi, M.K. Karamoddini, K. Ghazvini, & A.R. Varasteh. 2013. Cloning and expression of
Mycobacterium tuberculosis
major secreted protein antigen 85B (AG85B) in Escherichia coli.
Jundishapur Journal of
Microbiology 6(2): 112--116. [12] Rush, C., T. Mitchell, & P. Garside.
2002. Efficient priming of CD4+ and CD8+ T cells by DNA vaccination depends on appropriate targeting of sufficient levels of immunologinally relevant antigen to appropriate processing pathways. The Journal of Immunology 169: 4951--4960. [13] Matsuo, K., R. Yamaguchi, A.
Yamazaki, H. Tasaka, & T. Yamada. 1988. Cloning and expression of the Mycobacterium bovic BCG gene for extracellular α antigen. Journal of Bacteriology 170(9): 3847--3854. [14] Helianti, I., N. Nurhayati, M. Ulfah,
B. Wahyuntari, & S. Setyahadi. 2010. Constitutive high level expression of an endoxylanase
gene from the newly isolated Bacillus subtilis AQ1 in Escherichia coli. Journal of Biomedicine and Biotechnology 2010: 1--12. [15] Thermo scientific. 2013. GeneJET
plasmid miniprep kit. Thermo fisher scientific, Inc: 8 hlm.
[16] NEB (New England Biolabs). 2014. Alkaline phosphatase. 2 hlm. https://www.neb.com/products/ m0290-alkaline-phosphatase-calf-intestinal-cip. 10 Mei 2014, pk.16.13. [17] Geneaid. 2013. Instruction manual ver.06.07.13. Geneaid Biotech Ltd.: 10 hlm.
[18] Sambrook, J. & D.W. Russell. 2001. Molecular cloning: A laboratory
manual, vol 1. 3rd ed. Cold Spring
Harbor Laboratory Press, New York: xxvii + 1.1--7.94 hlm.
[19] GenScript. 2013. Certificate of analysis. Genscript Inc., USA: 2 hlm.
[20] Robinson, R. 2002. Biology. Macmillan Reference, New York: xxiv + 293 hlm.
[21] Nicholl, D.S.T. 2008. An
introduction to genetic
engineering. Cambridge
University Press, New York: xi + 303 hlm.
[22] Applied Biosystems. 2002. Automated DNA sequencing:
chemistry guide. Applied
Biosystems: iii + 1--7-62 + A-15 + B-1 + C-B-1 + D-3 + E-B-10 hlm.
[23] Claverie, J.M. & C. Notredame. 2007. Bioinformatics for dummies, 2nd ed. Wiley Publishing, Inc., Canada: x + 417 hlm.
[24] Raven, P. & G. Johnson. 2002. Biology 6th eds. The McGraw Hill
Companies, New York: 872 hlm. [25] Lee, C.C., D.W.S. Wong, & G.H.
Robertson. 2001. An E. coli expression system for the extracellular secretion of barley α-amylase. Journal of Protein Chemistry 20(3): 233--237.
[26] Choi, J.H. & S.Y. Lee. 2004. Secretory and extracellular production of recombinant
127 Jurnal Cakrawala Kesehatan, Vol. X, No.02, Agustus 2019
proteins using Escherichia coli. Applied Microbiol Biotechnology
64: 625--635.
[27] Meagley, K. & S. Rohrback. 2011. M. tuberculosis antigen 85B. http://biology.kenyon.edu/BMB/J mol2009/KatandSuzanne/index.h tm. 25 September 2013, pk 12:39 WIB.
![Gambar 3.8 Hasil SDS PAGE [Sumber : Dokumentasi pribadi]](https://thumb-ap.123doks.com/thumbv2/123dok/4244282.2875303/11.892.301.647.159.457/gambar-hasil-sds-page-sumber-dokumentasi-pribadi.webp)