PENGKLONAAN GEN Cd40 ligand (Cd40l) Mus musculus KE DALAM
Escherichia coli TOP10
Puji Rahayu
11Departemen Biologi, FMIPA UI, Kampus UI Depok 16424 puji.rahayu@sci.ui.ac.id; rhypuji@gmail.com
Abstrak
Telah dilakukan pengklonaan gen Cd40 ligand (Cd40l) dari Mus musculus ke dalam sel inang
Escherichia coli TOP10. Gen Cd40l adalah gen pengkode protein CD40L, anggota dari tumor necrosis factor (TNF) superfamily (TNFSF). CD40L merupakan salah satu kandidat adjuvan karena
diketahui sebagai salah satu immunoagent paling efektif dari keluarga TNFSF. CD40L berikatan dengan reseptornya pada sel makrofag, sel T dan sel B yang teraktivasi berfungsi menginduksi aktivasi sel APC dan sel B. Penelitian bertujuan mengklona gen Cd40l ke dalam sel inang
Escherichia coli TOP10 dengan perantara vektor pcDNA 3.1(+). Fragmen gen Cd40l tanpa
mengandung start codon (ATG) dengan panjang 644 pasang basa, diamplifikasi melalui transkripsi balik dengan RNA sel PMBC mencit sebagai pola cetaknya. Gen Cd40l telah berhasil diklona ke dalam E.coli TOP10. Hasil analisis menunjukkan sekuen hasil klona memiliki similaritas 100% terhadap sekuen acuan pada database GeneBank yaitu Mus musculus CD40 ligand (Cd40lg), mRNA,
coding sequence dengan accession number NM_011616.2
Kata kunci: adjuvan, Escherichia coli TOP10, gen Cd40l, pcDNA 3.1(+), pengklonaan
Abstract
Cloning of Cd40 ligand (Cd40l) gene from Mus musculus into Escherichia coli TOP10 had been conducted. Cd40l gene encodes CD40L protein which is a member of the tumor necrosis factor super family (TNFSF). CD40L is one of candidate adjuvant as known as one of most effective immunoagent. Binding of CD40L to its receptor on the surface of macrophage, activated T cell, and activated B cell induces activation of APC and B cell. The aim of research is to clone Cd40l gene into E.coli TOP10 using pcDNA 3.1(+) vector. 644 base pairs of Cd40l fragment without start codon (ATG) was amplified from RNA PMBC cell with RT-PCR. Cd40l gene was successfully cloned to
E.coli TOP10. The analysis showed 100% similarity between Cd40l clone and GeneBank database, Mus musculus CD40 ligand (Cd40lg), mRNA, coding sequence with accession number
NM_011616.2
Keywords : adjuvant, Cd40l gene, cloning, Escherichia coli TOP10, pcDNA 3.1(+)
1. PENDAHULUAN
Vaksinasi adalah pemberian substansi imunogenik untuk menstimulasi respon imun adaptif terhadap suatu penyakit. Vaksinasi dilakukan sebagai upaya untuk mengurangi kejadian penyakit infeksi. Edward Jenner pada tahun 1796 mengawali keberhasilan vaksinasi dengan membuktikan bahwa vaksin dapat menginduksi kekebalan tubuh manusia terhadap smallpox. Berbagai tipe vaksin telah banyak dikembangkan oleh para peneliti diantaranya
conjugate vaccine, live attenuated viruses, synthetic vaccine, viral vector, dan DNA vaccine [1].
Pengembangan vaksin dewasa ini lebih banyak mengarah pada vaksin generasi ketiga yaitu vaksin DNA. Vaksin DNA menggunakan plasmid yang mengkode antigen terbukti meningkatkan baik respon imun selular maupun respon imun humoral dalam jangka waktu yang lama [1]. Keberhasilan vaksinasi tidak hanya ditentukan oleh teknologi
rekayasa vaksin semata, tetapi juga faktor lain seperti metode, rute, dosis vaksinasi, serta adjuvan yang meningkatkan imunogenitas vaksin. Sebagai contoh, vaksin HIV-1 telah banyak dikembangkan dan diuji pada hewan coba. Hasilnya, pengembangan vaksin DNA HIV-1 mutlak memerlukan adjuvan molekular untuk meningkatkan efikasi vaksin [1].
Pengembangan vaksin DNA kini mengarah pada penggunaan adjuvan molekular atau adjuvan gen. Adjuvan gen memiliki aktivitas biologik yang mampu menginduksi sistem imun sehingga berfungsi dalam membantu meningkatkan efikasi vaksin. Inisiasi T cell-dependent immune response dalam melawan antigen membutuhkan antigen yang diadministrasikan bersama dengan adjuvan. Adjuvan yang sudah banyak dikenal contohnya Freud’s adjuvan baik complete maupun incomplete (CFA atau IFA), akan tetapi penggunaanya dilarang untuk manusia karena bersifat toksik. Adjuvan tersebut juga memperlihatkan kerusakan pada hewan coba seperti pemberian CFA secara intradermal yang menyebabkan ulserasi dan nekrosis kulit. Para peneliti mencoba mengatasi permasalahan tersebut yaitu dengan mengembangkan berbagai adjuvan alternatif untuk meningkatkan efikasi vaksin, salah satunya adjuvan yang berbasis gen (adjuvan gen) [1]. Adjuvan dapat berupa molekul sitokin, kemokin, dan kostimulator [2]. CD40 ligand (Cd40l) merupakan salah satu kandidat adjuvan kostimulator dengan target besarnya yaitu aktivasi sel antigen presenting
cell (APC) sebagai barrier pertama pengenalan
antigen secara spesifik dan aktivasi sel B dalam membentuk antibodi. CD40L atau dikenal juga sebagai CD154 adalah anggota dari tumor necrosis
factor super family (TNFSF) yang terekspresi
terutama pada sel T CD4+ aktif. Pemberian adjuvan CD40L dalam bentuk soluble bersama dengan vaksin berfungsi mengaktifkan sel APC dan sel B karena interaksinya dengan CD40 yang terdapat pada permukaan sel APC dan sel B [3]. Adjuvan CD40L
diharapkan meningkatkan respon imun selular oleh sel T CD8+, meningkatkan aktivitas sel T CD4+ , dan meningkatkan respon imun humoral melalui aktivasi sel B [1][2]. Formasi > 2-trimer CD40L merupakan adjuvan yang efektif bagi sel T CD8+. Penelitian tersebut mencoba 3 jenis formasi CD40L yaitu 1-trimer (bentuk asli CD40L), 2-trimer, dan 4-trimer. Hasilnya, efektivitas bentuk soluble CD40L meningkat sesuai dengan valensinya (1< 2< 4). Ketersediaan bentuk 4-trimer CD40L akan sangat bermanfaat dalam upaya pengembangan vaksin DNA baik vaksin antivirus maupun vaksin antitumor [4].
Berdasarkan penelitian-penelitian yang telah dilakukan, Laboratorium Institue Human Virology
and cancer Biology Universitas Indonesia
(IHVCB-UI), saat ini sedang berusaha melakukan pengembangan prototipe vaksin H5N1 dengan CD40L sebagai adjuvannya. Oleh karena itu, pengklonaan atau perbanyakan gen pengkode protein CD40L perlu dilakukan sebagai tahap awal untuk aplikasi selanjutnya. Gen Cd40l yang akan diklona tidak akan mengandung sekuen start codon (ATG), karena akan difusikan dengan gen HA sebagai kandidat vaksin H5N1 pada penelitian selanjutnya. Gen Cd40l tanpa start codon (ATG) didapat dari hasil transkripsi balik (RT-PCR) mRNA yang diekstraksi dari sel PMBC mencit (Mus musculus). Pengklonaan memerlukan sel inang yang mampu menerima vektor dan melakukan sekresi protein dari hasil ekspresi protein pada gen asing, yaitu sel inang Escherichia coli TOP10 yang dapat memberikan efisiensi transformasi hingga mencapai 107 CFU/ml.
Pengklonaan gen juga memerlukan suatu vektor untuk melakukan transformasi dan perbanyakan gen di dalam sel inang. Vektor yang akan digunakan yaitu pcDNA 3.1 (+) karena merupakan vektor yang memiliki sifat high copy number. Penelitian bertujuan untuk mengklona gen Cd40 ligand (Cd40l) yang tidak mengandung sekuen start codon (ATG) dari Mus musculus ke dalam E.coli TOP10
menggunakan vektor pcDNA 3.1 (+). Hipotesis penelitian adalah gen CD40 Ligand (Cd40l) yang tidak mengandung sekuen start codon (ATG) dari
Mus musculus dapat diklona ke dalamE.coli TOP10
menggunakan vektor pcDNA 3.1 (+).
2. METODOLOGI PENELITIAN
Amplifikasi dan Purifikasi Fragmen Gen Cd40l dengan Teknik RT-PCR
Sintesis DNA sisipan Cd40l yang menyandi protein CD40L dilakukan melalui proses amplifikasi polymerase chain reactor reverse
transcriptase (RT-PCR) menggunakan RNA yang
diekstraksi dari sel PMBC mencit sebagai materi genetik pola cetaknya. Amplifikasi DNA penyandi protein CD40L menggunakan reagen One Step
RT-PCR Superscript III/Taq Platinum dan pasangan
primer MSCD40L_F1 dan CD40L_F2 (Tabel 1). Campuran reaksi RT-PCR terdiri atas 25 μl 2x
reaction mix, 1 μl primer MSCD40L_F1 10 mM, 1
μl primer MSCD40L_F1 10 mM, 1 μl enzim
Superscript III RT/Taq mix, 5 μl RNA , 17 μl
ddH2O. Campuran reaksi dibuat untuk 1 kali reaksi dengan total volume reaksi yaitu 50 μl. Campuran reaksi ditempatkan pada tabung microtube 0,2 ml
Tabung microtube 0,2 ml yang berisi campuran reaksi dimasukkan ke dalam thermal
cycler engine, kemudian dilakukan pengaturan suhu
optimum berdasarkan protokol superscript III/Taq
mix RT-PCR. Reaksi dilakukan sebanyak 35
siklus. Tahapan sintesis cDNA dilakukan pada suhu 55 oC selama 30 menit, denaturasi awal dilakukan pada suhu 94oC selama 2 menit. Tahap denaturasi dilakukan pada suhu 94oC selama 15 detik, tahap
annealing pada suhu 55oC selama 30 detik, dan tahap polimerisasi pada suhu 68oC selama 1 menit. Polimerisasi akhir pada suhu 68 oC selama 5 menit
Tabel 1. Pasangan primer dalam amplifikasi
Primer Sekuen
MSCD40L_F1 5’-AATT AAGCTT-GGA GGA AGT-CATAGAAGATTGGATAAGGTC G-3’ CD40L_R2 5’-CCCC GAATTC ACTAGT-TCAGAGTTTGAGTAAGCCAAA AG-3’
Purifikasi amplikon dilakukan menggunakan Qiagen PCR Purification Kit [5]. Amplikon gen Cd40l hasil purifikasi kemudian divisualisasikan dengan elektroforesis gel agarosa 0,8 % pada tegangan 100 V selama 30 menit.
Isolasi Vektor pcDNA 3.1 (+)
Isolasi pcDNA 3.1(+) dilakukan dengan metode dari QIAGEN [6]. pcDNA 3.1(+) diambil dari replica plate yang ada di IHVCB-UI, diinokulasikan ke dalam 50 ml medium LB cair yang telah ditambahkan dengan ampisilin sebanyak 50 μl. Kultur tersebut kemudian diinkubasi pada suhu 37° C selama 16 jam. Kultur dipindahkan ke dalam tabung Falcon 50 ml dan disentrifugasi pada kecepatan 3.500 rpm selama 10 menit. Supernatan yang terbentuk kemudian dibuang secara perlahan-lahan. Pelet kemudian dilarutkan dengan larutan P1 (+RNAse) sebanyak 2,5 ml dan campuran dihomogenkan dengan vorteks. Campuran tersebut kemudian ditambahkan dengan larutan P2 sebanyak 2,5 ml dan dihomogenkan dengan cara tabung dibolak-balik sebanyak 6 kali. Sebanyak 3,5 ml larutan N3 ditambahkan ke dalam campuran, dan dihomogenkan dengan cara dibolak-balik lagi sebanyak 6 kali, kemudian diinkubasi dalam lemari pendingin selama 10 menit 4°C. Campuran
kemudian disentrifugasi pada kecepatan 12.000 rpm selama 10 menit dengan suhu 4°C. Supernatan pada falcon yang dihasilkan dipindahkan ke dalam
QIAprep Spin Column (QSC) yang pada bagian
bawahnya telah diletakkan sebanyak 850 μl ke tabung koleksi, kemudian disentrifugasi selama 1 menit dengan kecepatan 12.000 rpm. Filtrat yang ada pada tabung koleksi dibuang dan sebanyak 500 μl buffer PB ditambahkan ke dalam QSC, kemudian disentrifugasi kembali pada kecepatan 12.000 rpm selama 1 menit. Filtrat yang tertampung di dalam tabung koleksi dibuang dan sebanyak 750 μl buffer PE (+ etanol) ditambahkan ke dalam QSC, lalu tabung disentrifugasi kembali pada kecepatan 12.000 rpm selama 1 menit. Filtrat yang ada pada tabung koleksi dibuang dan tabung disentrifugasi kembali pada kecepatan 12.000 rpm selama 1 menit. QIAprep Spin Column (QSC) kemudian diletakkan di atas tabung microtube 1,5 ml yang steril dan ditambahkan sebanyak 20 μl buffer EB, kemudian didiamkan pada suhu 25oC 1 menit. Campuran kemudian disentrifugasi pada kecepatan 12.000 rpm selama 1 menit. Supernatan pada falcon dipindahkan kembali sebanyak 850 μl dan dilakukan langkah yang sama hingga elusi dengan
buffer EB sampai supernatant habis. Filtrat yang
tertampung pada tabung microtube 1,5 ml merupakan hasil dari proses isolasi vektor pcDNA 3.1(+). Hasil isolasi sebanyak 3 μl tersebut kemudian divisualisasikan pada elektroforesis gel agarosa 0,8% pada tegangan 100 V selama 30 menit.
Digesti gen Cd40l dan DNA Vektor pcDNA 3.1(+) dengan Enzim HindIII dan EcoRI
Vektor pcDNA 3.1(+) dan gen Cd40l yang telah dipurifikasi kemudian didigesti dengan menggunakan enzim restriksi endonuklease HindIII dan EcoRI secara sekuensial. Proses pembuatan
campuran reaksi digesti dilakukan dalam pada suhu 4oC. Campuran dibuat untuk 2x reaksi. Reaksi digesti pertama menggunakan enzim HindIII. Campuran reaksi digesti yang digunakan untuk digunakan setiap 1x reaksi adalah sebanyak 10 μl 10X BSA, 10 μl NEB buffer 2, dan 55 μl ddH2O dimasukkan ke dalam tabung microtube 1,5 ml. Campuran dihomogenasikan dan dispin selama 30 detik. Campuran di aliquot ke dalam dua tabung
microtube 1,5 ml. Sebanyak 20 μl pcDNA 3.1(+)
hasil isolasi dimasukkan ke dalam satu tabung
microtube 1,5 ml pertama dan 20 μl gen Cd40l
dimasukkan ke tabung microtube 1,5 ml kedua. Enzim HindIII sebanyak 5 μl dimasukkan ke dalam setiap campuran reaksi digesti. Campuran kemudian dihomogenisasi dan dispin. Reaksi digesti dilakukan selama 16 jam pada suhu 37°C untuk vektor dan 1 jam pada suhu 37°C untuk DNA
Cd40l. Hasil restriksi sebanyak 3 μl kemudian
divisualisasikan pada elektroforesis gel agarosa 0,8% pada tegangan 100 V selama 30 menit. Hasil digesti pertama dengan enzim HindIII, dipurifikasi dengan QIAquick Spin Column. Digesti kedua menggunakan enzim EcoRI, dengan cara yang sama seperti pada enzim HindIII. Namun, buffer yang dibutuhkan merupakan buffer khusus EcoRI. pcDNA 3.1 dan gen Cd40l yang didigesti dengan
EcoRI merupakan DNA yang telah didigesti dengan HindIII sebelumnya.
Purifikasi Hasil Digesti pcDNA 3.1(+) dan Gen
Cd40l dengan QIAquick Spin Column
Purifikasi hasil digesti dilakukan berdasarkan QIAGEN [7]. Sebanyak 95 μl vektor pcDNA 3.1(+) dan gen Cd40l hasil digesti
di-running pada low melting agar (LMA) 1%.
Sebelumnya agar LMA 1% disiapkan yaitu 1 gr LMA powder dilarutkan dalam 100 buffer TAE 1x sampai volume 100 ml, kemudian dihomogenkan.
Sebanyak 80 μl crystal violet ditambahkan ke dalam larutan LMA. Larutan dituang ke dalam cetakan gel yang telah diberi sisir setelah mendingin. Gel LMA yang telah mengeras kemudian dimasukkan ke dalam tangki elekroforesis yang telah diisi buffer TAE 1x. Kertas parafilm disiapkan sebagai tempat untuk mencampur DNA dengan loading buffer crystal
violet 6x. Sebanyak 6 μl loading buffer 6x
ditambahkan dengan 100 μl DNA. Campuran kemudian dimasukkan ke dalam sumur pada gel. Gel LMA yang mengandung DNA dipotong kemudian dimasukkan dalam eppendorf 1,5 ml dan ditimbang.
Potongan gel ditambahkan QXI dengan volume sebanyak 3x berat gel, 10 μl natrium asetat, dan 10 μl QIAEXII. Campuran dihomogenkan dengan cara divorteks, kemudian diinkubasi pada suhu 50oC selama 30 menit. Selama proses inkubasi campuran dibolak balik 6--7 kali setiap 2 menit. Campuran kemudian disentrifugasi 12.000 rpm selama 1 menit, supernatan yang terbentuk dibuang. Pelet selanjtnya dicuci menggunakan PE (+Etanol) sebanyak 500 μl. Campuran disentrifugasi kembali dengan kecepatan 12.000 rpm selama 1 menit, supernatan dibuang. Pelet dilarutkan kembali dengan 500 μl PE (+Etanol), sentrifugasi 12.000 rpm, 1 menit, supernatan dibuang. Elusi dilakukan dengan menambah buffer EB sebanyak 20 μl ke dalam microtube yang berisi pelet, homogenisasi dengan vorteks, kemudian diinkubasi selama 1 menit pada suhu 25oC. Campuran disentrifugasi pada kecepatan 12.000 rpm selama 1 menit, supernatan dipindahkan ke dalam microtube 1,5 ml steril. Pelet ditambahkan kembali dengan buffer EB 20 μl, homogenisasi dengan vorteks, kemudian inkubasi pada suhu 25oC selama 5 menit. Campuran disentrifugasi pada kecepatan 12.000 rpm selama 1 menit. Supernatan dipindahkan lagi ke microtube 1,5 ml. Supernatan
yang terdapat pada microtube 1,5 ml ditutup dengan alumunium foil dengan posisi agak terbuka dan diinkubasi pada heatblock pada suhu 50oC selama 30 menit. Hasil purifikasi divisualisasi pada gel agarosa 0,8% pada tegangan 100 V selama 30 menit. Konsentrasi DNA diukur menggunakan alat spektrofotometer ThermoScientific Nanodrop 2000 Spectrophotometer.
Ligasi Gen Cd40l ke dalam Vektor pcDNA 3.1(+)
Reaksi ligasi gen Cd40l ke dalam vektor pcDNA 3.1(+) dilakukan berdasarkan Sambrook & Russel [8]. Perbandingan molar antara pcDNA 3.1(+) dan gen Cd40l adalah 1:3. Proses pembuatan campuran reaksi ligasi dilakukan di es, pada suhu 4oC. Campuran reaksi terdiri atas 15,1 μl ddH2O, 1 μl DNA vektor, 0,9 μl DNA target, 2 μl 10x buffer ligasi, dan 1 μl enzim T4 ligase. Kontrol ligasi dibuat dengan campuran yang sama, akan tetapi tidak ditambahkan DNA sisipan. Campuran reaksi ligasi tersebut kemudian diinkubasi selama 16 jam pada suhu 16°C. Hasil reaksi ligasi kemudian ditransformasikan ke dalam
E. coli TOP10 yang telah dijadikan kompeten
terlebih dahulu.
Pembuatan Sel Kompeten dan Transformasi ke dalam E. coli TOP10
Sel kompeten dibuat berdasarkan metode Ausubel dkk. [9]. Sebanyak 100 μl kultur E. coli TOP10 yang telah diinkubasi selama 16 jam diinokulasikan ke dalam 20 ml medium LB cair steril. Kultur diinkubasi dalam shaker incubator pada suhu 37°C selama 2,5 jam. Kultur kemudian diinkubasi di dalam es selama 15 menit. Hasil inkubasi selanjutnya disentrifugasi dengan kecepatan 3.500 rpm selama 10 menit pada suhu 4°C. Supernatan dibuang dan pelet diresuspensi
dengan 4 ml 0,1 M MgCl2 dingin. Hasil resuspensi kembali diinkubasi di dalam es selama 15 menit, kemudian disentrifugasi pada suhu 4°C dengan kecepatan 3.500 rpm selama 10 menit. Supernatan hasil sentrifugasi kembali dibuang dan pelet diresuspensi dengan 400 μl 0,1 M CaCl2 dingin. Hasil resuspensi diinkubasi di dalam es selama 1 jam, kemudian disentrifugasi pada suhu 4°C dengan kecepatan 3.500 rpm selama 10 menit. Supernatan kembali dibuang dan pelet diresuspensi dengan 200 μl CaCl2 dingin.
Proses transformasi dilakukan berdasarkan Sambrook & Russel [8]. sebanyak 4 tabung
microtube 1,5 ml steril disiapkan terlebih dahulu,
kemudian tiap microtube ditambahkan 50 μl sel kompeten TOP10. Sebanyak 5 μl DNA rekombinan dimasukkan ke dalam tabung
microtube (tabung 1). Sebanyak 5 μl kontrol ligasi
dimasukkan ke dalam tabung 2 dan sebanyak 1 μl vektor pcDNA 3.1(+) wild type dimasukkan ke dalam tabung 3. Kontrol negatif terhadap proses transformasi menggunakan sel kompeten TOP10 saja tanpa dicampur dengan pcDNA 3.1(+) (tabung 4). Keempat tabung microtube tersebut diinkubasi di es selama 1 jam lalu dikejutpanaskan dalam air hangat 38° C selama 90 detik, kemudian dimasukkan kembali ke dalam es selama 60 detik, dan diletakkan pada suhu ruang 25oC. Medium SOC yang sudah dicairkan pada suhu 37°C ditambahkan ke dalam keempat tabung tersebut sebanyak 200 μl. Kultur kemudian diinkubasi dalam shaker incubator dengan kecepatan 120 rpm pada suhu 37°C selama 1 jam. Masing-masing kultur kemudian diinokulasikan ke dalam medium LB padat yang mengandung ampisilin. Kultur kemudian diinkubasi pada suhu 37°C selama 16 jam.
Isolasi DNA Rekombinan pcDNA 3.1(+) - Cd40l
Isolasi DNA rekombinan dilakukan dengan menggunakan QIAprep spin Miniprep kit berdasarkan QIAGEN [6]. Hasil isolasi divisualisasi menggunakan gel agarosa 0,8%.
Verifikasi DNA rekombinan dengan teknik PCR
Koloni rekombinan yang menunjukkan hasil positif pada PCR koloni kemudian yang tumbuh dari hasil transformasi diverifikasi dengan teknik PCR. Verifikasi PCR menggunakan primer dari pcDNA 3.1(+) yaitu CMV_F dan BHG_R. Campuran reaksi untuk satu koloni yaitu 1 μl buffer
dream taq 10x, 0,4 μl MgCl 50mM, 0,05 μl primer
CMV_F 20 μM, 0,05 μl primer BHG_R 20 μM, 0,2 μl dNTPs 10 mM, 1 μl enzim dream taq, 7,3 μl ddH2O, dan DNA template yang diambil dari plate hasil transformasi. Reaksi PCR dilakukan sebanyak 30 siklus dengan kondisi sebagai berikut: tahap denaturasi awal dilakukan pada suhu 95oC selama 5 menit kemudian dilanjutkan dengan tahap denaturasi pada suhu 95oC selama 15 detik. Tahap
annealing dilakukan pada suhu 55oC selama 30 detik, kemudian tahap polimerisasi awal pada suhu 72oC selama 1 menit, ditambahkan tahap polimerisasi akhir pada suhu 72oC selama 5 menit. Hasil PCR divisualisasi dengan gel agarosa 0,8% 100 V selama 30 menit.
Verifikasi DNA Rekombinan Dengan Teknik Digesti Menggunakan Enzim HindIII
DNA rekombinan yang menunjukkan hasil positif pada PCR koloni selanjutnya diisolasi dengan QIAminiprep kit dari QIAGEN. Hasil isolasi selanjutnya diverifikasi dengan teknik digesti (linearisasi) menggunakan enzim HindIII. Alat-alat yang akan digunakan disiapkan dalam
keadaan steril dan penyiapan bahan-bahan dilakukan dalam keadaan dingin. Kemudian bahan-bahan tersebut dimasukkan ke tabung microtube 1,5 ml, masing-masing berurutan NEB2 1 μl, 10X BSA 1 μl, dan ddH2O 4,7 μl, lalu ditambahkan juga enzim HindIII sebanyak 0,3 μl. Campuran reaksi digesti ditambahkan 3 μl DNA rekombinan ke dalam masing campuran, kemudian dilakukan spin. Selanjutnya, campuran diinkubasi pada suhu 37oC selama 1 jam. Visualisasi dilakukan menggunakan elektroforesis gel agarosa 0,8% pada tegangan 100 V selama 30 menit. pcDNA 3.1(+) wildtype juga didigesti sebagai kontrol.
Sekuensing DNA Rekombinan dan Analisis Hasil Sekuen
Sekuensing dilakukan menggunakan alat dari Applied Biosystem Hitachi. Pengerjaan sekuensing tersebut dilakukan oleh staff peneliti di IHVCB-UI, Salemba. Hasil sekuensing berupa elektroferogram selanjutnya diubah dalam format fasta untuk kemudian dilakukan nucleotide BLAST (BLASTN) dan BLASTX pada situs http://www.ncbi.nlm.nih.gov/blast dan mengacu pada petunjuk manual dalam situs tersebut.
3. HASIL DAN PEMBAHASAN
Sintesis DNA sisipan penyandi protein CD40L atau gen Cd40l dilakukan melalui proses amplifikasi polymerase chain reactor reverse
transcriptase (RT-PCR) menggunakan RNA yang
diekstraksi dari sel PBMC mencit sebagai materi genetik pola cetaknya. Amplifikasi DNA penyandi protein CD40L menggunakan reagen One Step
RT-PCR Superscript III/Taq Platinum dan pasangan
primer MSCD40L_F1 dan CD40L_F2, serta dilakukan pada suhu annealing 55°C.
Produk amplifikasi dipurifikasi atau dimurnikan dari kontaminan dan dianalisis pada elektroforesis gel agarosa 0,8% menggunakan marka DNA mix ladder memperlihatkan adanya pita DNA yang cukup tebal yang bermigrasi antara 600-700 pb, sesuai dengan panjang pita DNA
Cd40l dari Mus musculus yang diharapkan, yaitu
sebesar 644 pb. Ukuran tersebut berdasarkan pada data GeneBank dengan accession number
NM_011616.2 (Mus musculus CD40 ligand
(Cd40lg), mRNA), coding sequence dan tempat
pelekatan primer yaitu terletak pada basa ke 151--795 bp (644 bp). Hasil analisis produk Purifikasi amplifikasi gen Cd40l dapat dilihat pada Gambar1.
Gambar 1. Hasil purifikasi PCR DNA Cd40l
DNA sisipan Cd40l yang telah dipurifikasi kemudian didigesti dengan enzim restriksi HindIII dan EcoRI secara sekuensial. Enzim restriksi ditambahkan pada ujung 5’ primer pada tahap awal desain primer karena tidak akan memotong fragmen gen yang akan diklona ke dalam vektor dan fragmen yang telah diamplifikasi dapat disisipkan ke dalam Multiple Cloning Site (MCS) pada vektor pcDNA 3.1 (+) untuk proses pengklonaan. Enzim HindIII dengan situs
pemotongan A|AGCTT dan Enzim EcoRI dengan situs pemotongan G|AATTC sama-sama menghasilkan ujung tidak rata (Gambar 2).
Hasil digesti kemudian dipurifikasi dari gel dengan menggunakan QIAEX purification kit dari QIAGEN. Purifikasi gel LMA dengan penggunaan crystal violet memberikan keuntungan antara lain mencegah kerusakan DNA (DNA
damage) yang disebabkan paparan UV apabila
tidak menggunakan crystal violet. Penggunaan
crystal violet memungkinkan visualisasi migrasi
DNA tanpa menggunakan UV. Purifikasi gel LMA bertujuan untuk memastikan pengotor berupa enzim dan garam yang akan mengganggu dalam proses kloning dapat dihilangkan [7][10]. Visualisasi pada gel agarose 0,8% menunjukkan terbentuknya pita tunggal bermigrasi pada ukuran yang diinginkan (644 bp) (Gambar 3). Konsentrasi DNA hasil purifikasi gel DNA Cd40l - HindIII- EcoRI yaitu sebesar 40,3 ng/μl dengan kemurnian pada panjang gelombang A260/A280 yaitu 1,9.
Gambar 2. Skema pemotongan fragmen gen Cd40l
Gambar 3. Hasil LMA Digesti gen Cd40l dengan HindIII dan EcoRI
Vektor plasmid pcDNA 3.1(+) digunakan dalam penelitian karena bersifat high copy number [8]. Visualisasi hasil isolasi vektor pcDNA 3.1(+) pada gel agarosa 0,8% memperlihatkan tiga topologi yang berbeda berdasarkan kecepatan migrasinya (Gambar 4) [11]. Berdasarkan topologinya, bentuk supercoiled paling cepat sehingga berada pada bagian paling bawah pada gel (huruf C), diikuti bentuk linear (huruf B) dan
nicked circle (huruf A). Pengukuran konsentrasi
hasil isolasi vektor pcDNA 3.1(+) dilakukan menggunakan nanodrop. Konsentrasi vektor yang dihasilkan yaitu 1032,8 ng/μl dengan kemurnian A260/A280 sebesar 1,88.
Gambar 4. Isolasi vektor pcDNA 3.1 (+)
Vektor hasil isolasi didigesti menggunakan
HindIII dan EcoRI. Analisis pada gel agarosa 0,8%
dengan marka DNA mix ladder dan pcDNA 3.1(+)
wild type sebagai kontrolnya menunjukkan terbentuknya pita tunggal DNA yang bermigrasi lebih lambat dibandingkan wild type berukuran 5.428 pb (gambar 5; lajur 3) menunjukkan plasmid yang terlinearisasi. Konsentrasi hasil purifikasi gel LMA digesti plasmid pcDNA 3.1(+) dengan enzim
HindIII dan EcoRI yaitu sebsar 100,4 ng/μl dengan
Gambar 5. Digesti dan hasil purifikasi digesti vektor pcDNA 3.1(+)
DNA Cd40l dan vektor pcDNA 3.1(+) yang telah didigesti dan dipurifikasi selanjutnya diligasi dengan menggunakan enzim T4 DNA
ligase. Nilai rasio molar antara DNA vektor dengan
DNA sisipan yang digunakan dalam penelitian yaitu 1:3. Jumlah molekul DNA sisipan yang lebih banyak dibandingkan dengan DNA vektor akan meningkatkan frekuensi atau peluang ligasi DNA sisipan ke dalam vektor [12]. Kontrol ligasi digunakan dalam penelitian untuk mengetahui adanya DNA vektor yang mengalami resirkulasi. Kontrol negatif ligasi merupakan vektor pcDNA 3.1 (+) linear yang direaksikan dengan enzim T4
DNA ligase tanpa penambahan DNA sisipan. Hasil
ligasi DNA Cd40l ke dalam pcDNA 3.1 (+) akan menghasilkan DNA rekombinan sebesar 6072 pb, gabungan antara DNA vektor sebesar 5428 pb dan DNA sisipan 644 pb. Hasil ligasi dan kontrol negatif ligasi kemudian sama-sama ditransformasi ke dalam sel inang.
Transformasi yang dilakukan meliputi hasil ligasi pcDNA3.1(+)- Cd40l, kontrol negatif ligasi, kontrol positif yaitu vektor pcDNA 3.1 (+)
wild type dengan konsentrasi 10 ng/μl, dan kontrol
negatif transformasi yaitu hanya berisi sel kompeten. Metode heat shock dapat menghasilkan nilai efisiensi sebesar 105--106 cfu/μg DNA (Sambrook & Russel 2001: 1.24). Efisiensi transformasi dapat dihitung dari jumlah colony
forming unit per μg DNA yang ditambahkan [13].
Hasil perhitungan efisiensi transformasi menunjukkan efisiensi yang tinggi yaitu sebesar 8,25 x 105 cfu/μg.
Pertumbuhan bakteri terlihat berupa koloni putih pada plate sebaran hasil ligasi pcDNA 3.1(+)-
Cd40l, menunjukkan keberhasilan ligasi. Namun
demikian, perlu verikasi lebih lanjut apakah koloni yang tumbuh membawa DNA sisipan Cd40l. Koloni putih juga tumbuh pada kontrol positif transformasi, yaitu pcDNA 3.1(+) wildtype (10 ng/μl). Kontrol negatif transformasi yang hanya berisi sel kompeten E. coli TOP10 tidak menunjukkan pertumbuhan sama sekali. Hasil tersebut menandakan tidak terjadi kontaminasi selama proses transformasi [8]. Hasil transformasi dapat dilihat pada gambar 6, sedangkan
perhitungan koloni yang tumbuh dapat dilihat pada tabel 1.
Tabel 1. Perhitungan hasil transformasi
Gambar 6. Hasil transformasi pcDNA 3.1(+)-Cd40l ke dalam E.coli TOP10
Verifikasi koloni hasil transformasi dilakukan dengan teknik PCR dengan menggunakan enzim Dream Taq polymerase untuk membuktikan apakah vektor pcDNA 3.1(+) membawa DNA sisipan merupakan Cd40l atau lainnya. Amplifikasi menggunakan pasangan primer vektor yaitu CMV_F dan BHG_R, sehingga akan mengapit daerah vektor yang membawa DNA sisipan. Skema amplifikasi verifikasi rekombinan dapat dilihat pada gambar 7.
Berdasarkan skema letak DNA sisipan
Cd40l, koloni yang membawa sisipan akan
berukuran 915 pb, hasil dari amplifikasi daerah vektor sebesar 271 pb dan DNA sisipan Cd40l yang
terletak antara situs restriksi HindIII dan EcoRI sebesar 644 pb. Hasil analisis pada gel agarosa 0,8% menggunakan marka DNA mix ladder menunjukkan adanya pita DNA pada lajur 1--3, 6, dan 12 yang bermigrasi pada ukuran sekitar 900 pb. Hasil tersebut sesuai dengan ukuran yang diharapkan yaitu sebesar 915 pb. Visualisasi agarosa 0,8% hasil amplifikasi PCR koloni rekombinan dapat dilihat pada gambar 8. Hasil positif verifikasi PCR, menunjukkan adanya kandidat plasmid yang membawa DNA sisipan
Gambar 7. Skema amplifikasi koloni rekombinan pcDNA 3.1 (+)-Cd40l
Gambar 8. PCR koloni pcDNA 3.1(+)-Cd40l
Koloni rekombinan no. 1 dan 2 yang menunjukkan hasil positif pada PCR koloni selanjutnya diisolasi menggunakan QIAminiprep kit dari QIAGEN. Hasil isolasi diverifikasi dengan cara dilinearisasi menggunakan enzim HindIII untuk mengetahui ukuran plasmid rekombinan. Visualisasi gel agarosa 0,8% hasil isolasi dan digesti plasmid rekombinan dapat dilihat pada gambar 9. Analisis pada gel agarosa 0,8% dengan marka DNA mix ladder menunjukkan adanya migrasi yang lebih lambat pada hasil isolasi plasmid rekombinan koloni no. 1 dan 2 dibandingkan plasmid pcDNA 3.1(+) wildtype. Hal tersebut menunjukkan ukuran plasmid rekombinan koloni no.1 dan 2 lebih besar dibandingkan
wildtype dan membawa DNA sisipan (gambar 4.11;
lajur 1 dan 2). Panjang basa yang diharapkan dari
hasil digesti yaitu sebesar 6072 pb, hasil jumlah dari ukuran plasmid pcDNA 3.1(+) sebesar 5428 pb dan DNA sisipan Cd40l sebesar 644 pb. Hasil digesti rekombinan bermigrasi diantara marka DNA berukuran sekitar 6000 pb, sesuai dengan ukuran plasmid rekombinan yang diharapkan yaitu 6072 pb. Hasil tersebut menunjukkan ukuran plasmid rekombinan yang lebih besar dan membawa DNA sisipan yaitu Cd40l.
Gambar 9. Isolasi dan verifikasi digesti plasmid rekombinan pcDNA 3.1(+)-Cd40l
Plasmid rekombinan pcDNA 3.1(+) koloni 2 yang memberikan hasil positif pada verifikasi PCR dan digesti, selanjutnya diverifikasi dengan metode sekuensing. Sekuensing bertujuan untuk mengetahui urutan nukleotida rekombinan. Selama proses amplifikasi ataupun pengklonaan fragmen DNA Cd40l memungkinkan terjadinya perubahan basa atau mutasi, sehingga diperlukan analisis lebih lanjut melalui sekuensing. Primer yang digunakan adalah pasangan primer dari vektor pcDNA 3.1(+), yaitu CMV_F dan BHG_R.
Hasil sekuensing berupa elektroferogram, yaitu hasil analisis yang menampilkan grafik peak yang mewakili basa nukleotida hasil pembacaan mesin
basa-basa nitrogen untuk memudahkan analisis sekuen dengan program BLASTN.
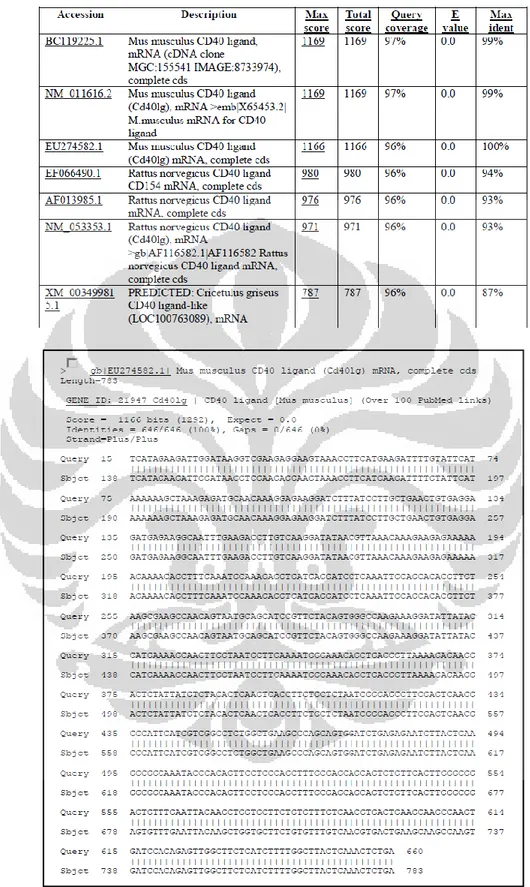
Hasil elektroferogram memperlihatkan 916 basa yang terbaca. Sekuen Cd40l terbaca pada elektroferogram, yaitu pada basa ke 200 sampai basa ke 844. Hasil tersebut kemudian digunakan dalam analisis alignment menggunakan software bioedit. Aligment dilakukan untuk membandingkan dan mengetahui similaritas sekuen hasil kloning dengan sekuen acuan yang telah diunduh dari GeneBank dengan nomor akses GeneBank NM_011616.2 (Mus musculus CD40 ligand
(Cd40lg), mRNA) . Hasil alignment menunjukkan
hasil kloning homolog dengan sekuen acuan. Primer Cd40l yang mengandung enzim restriksi
HindIII dan EcoRI terlihat pada hasil sekuensing,
menunjukkan DNA sisipan yang berhasil diklona ke dalam pcDNA 3.1(+) (Gambar 10).
Hasil sekuensing juga dianalisis melalui
program BLASTN pada situs
http://www.ncbi.nlm.nih.gov/blast. program BLASTN membandingkan sekuen nukleotida yang di-upload ke situs GeneBank (query) dengan sekuen pada database [14]. Hasil alignment sekuen klona dengan data pada gene bank ditunjukkan pada gambar 11. Analisis BLASTN menunjukkan bahwa sekuen Cd40l yang diklona ke dalam pcDNA 3.1(+) memiliki persentase kemiripan (maximum identity) sebesar 100% dengan sekuen acuan Mus musculus CD40 ligand (Cd40lg) mRNA,
complete cds. (Tabel 2). Menurut Hall [15],
semakin besar persentase identity suatu sekuen dengan sekuen lain menunjukkan bahwa sekuen tersebut memiliki kemiripan yang tinggi. Presentasi identity sebesar 100% menunjukkan semua basa hasil klona identik dengan sekuen acuan.
Tabel 2. Hasil analisis BLAST-N
4. KESIMPULAN
Gen Cd40l dari sel PMBC mencit telah berhasil diklona ke dalam sel inang Escherichia
coli TOP10 menggunakan vektor ekspresi pcDNA
3.1 (+). Gen hasil klona Cd40l tidak mengandung sekuen start codon (ATG), memiliki similaritas sebesar 100% dengan sekuen acuan pada GeneBank yaitu Mus musculus CD40 ligand
(Cd40lg), mRNA, coding sequence dengan accession number NM_011616.2
UCAPAN TERIMA KASIH
Terima kasih diberikan kepada Dr. dr. Budiman Bela, Sp.MK dan DR. Abinawanto atas bimbingannya. Terlebih kepada Institute Human Virology and Cancer Biology University of Indonesia (IHVCB-UI) selaku lembaga pemegang proyek, penyediaan tempat, alat, dan bahan bagi berlagsungnya penelitian ini. Kepada dr. Fera Ibrahim, M.Sc, Ph.D. selaku kepala laboratorium IHVCB-UI, serta seluruh jajaran dosen Biologi FMIPA UI atas masukan dan pembelajaran sehingga penelitian ini menjadi lebih baik lagi.
DAFTAR ACUAN
[1] Murphy, K., P. Travers, & M. Walport. 2008.
Immunobiology. 7th ed. Garland
Science, New York: 494 hlm.
[2] Pietravalle, F., S.L. Henchoz, H. Blasey, J.P. Aubry, G. Elson, M.D. Edgerton, J.Y. Bonnefoy, & J.F. Gauchat. 1996. Human native soluble CD40L is a
biologically active trimer, processed inside microsomes. The Journal of Biological
Chemistry 271(11): 5965-5967.
[3] Maria, G.H., L. Shen, & K.L. Rock. 2007. CD40-CD40L ligand interaction
between dendritic cells and CD8+ T cells
is needed to stimulate maximal T cell responses in the absence of CD4+ T cell help. The Journal of Immunology 178: 2844-52.
[4] Stone, G.W., S. Barzee, V. Snarsky, K. Kee, C.A. Spina, X.F. Yu, & R.S. Kornbluth. 2006. Multimeric soluble CD40 ligand and GITR ligand as adjuvants for human immunodeficiency virus DNA vaccines.
Journal of Virology 80(4): 1762-72.
[5] QIAGEN. 2002. QIAquick® Spin Handbook. QIAGEN Distributor, Singapura: 36 hlm. [6] QIAGEN. 2006. QIAprep® Miniprep
Handbook: For purification of molecular biology grade DNA. QIAGEN Distributor,
Indonesia: 54 hlm.
[7] QIAGEN. 2008b. QIAEX® Handbook: For
DNA extraction from agarose and polyacrilamide gels and for desalting and concentrating DNA from solution.
QIAGEN Distributor, Australia: 24 hlm. [8] Sambrook, J. & D.W. Russell. 2001. Molecular
cloning: A laboratory manual, vol 1. 3rd
ed. Cold Spring Harbor Laboratory Press, New York: xxvii + 1.1--7.94 hlm. [9] Ausubel, M., R. Brent, R.E. Kingston, D.D.
Moore, J.G. seidman, J.A. Smith & K. Struhl. 2003. Current protocols in
molecular biology. John Wiley &
Sons, Inc., New York: xii + xiii + 29B.1.17 + A.1K.26 hlm.
[10] Invitrogen. 2012. S.N.A.P UV gel purification kit. www.invitrogen.com/1/1/10556-s-n-a-p--uv-gel-purification-kit.html. 18 November 2012. pk. 14.15.
[11] Dellis, S. 2004. Understanding plasmid DNA. 5 hlm. http://www.cofc.edu/~delliss/ virtuallabbook/ PreLabReadings/Ex6.html. 20 . September 2010, pk.19.30.
blunt-end pfu DNA polymerase generated PCR fragment into pGEM-T vector system. Promega Notes 71: 10--14.
[13] Dower, W.J.F., F. Miller & C.W. Ragsdale. 1988. High efficiency transformation of E.coli by high voltage electroporation.
Nucleic Acids Research 16(13): 6127--
6145.
[14] Hughes, A.E. 1993. Sequence database and the internet. Method in Molecular Biology 167: 215--223.
[15] Hall, B.E. 2001. Phylogenetic trees made easy:
A how to manual for molecular biologists. Sinauer Associates, Inc.,