SINTESIS SILIKA TERMODIFIKASI AMIN DAN
APLIKASINYA SEBAGAI ADSORBEN ION TEMBAGA (II)
Ngatijo
Jurusan Kimia , Fakultas Sains dan Teknologi, Universitas Jambi. Jalan Raya Jambi-Muara Bulian Km 15 Mendalo, Jambi
email : [email protected]
Abstrak. Silika gel termodifikasi amin (STA) telah disintesis melalui proses sol-gel,
menggunakan abu sekam padi sebagai sumber silika. Produk STA dikarakterisasi dengan spektroskopi infra merah dan difraksi sinar-X(XRD). Luas permukaan dan diameter pori ditentukan dengan metode BET dan morfologi permukaan dan komposisi unsur dalam STA ditentukan dengan SEM-EDX. Material adsorben STA telah berhasil disintesis ditunjukkan dengan karakteristik gugus fungsional silanol (Si-OH), siloksan (Si-O-Si) dan gugus amin (-Nh2). Berdasarkan data XRD material adsorben STA amorp pada puncak difraktogram khas
pada 2Θ = 16-23ο . Luas permukaan dan diameter pori berturut-turut 93,410 m2
g-1 dan 16.798 mm. Adsorpsi ion Cu(II) diperoleh pada pH optimum 5 dan waktu kontak 60 menit.
Kata Kunci : sintesis, silika termodifikasi amin, ion tembaga (II)
PENDAHULUAN
Sebagai negara agraris, Indonesia memiliki potensi limbah aktivitas pertanian berupa sekam padi. Sekam padi dapat diubah menjadi abu sekam padi (ASP) sebagai sumber silika yang dapat diubah menjadi adsorben. ASP mengandung >90% silika yang dapat diubah nilai ekonomisnya menjadi sumber material natrium silikat dan silika gel. Adsorben dibuat dari ASP melalui proses pembakaran. Pemanfaatan ASP menjadi silika gel memiliki keunggulan dari pada kuarsa, karena kristalinitas dan stabilitas yang tinggi sehingga untuk mendestruksi diperlukan temperatur yang tinggi {1,2}.
Silika adalah material yang menarik tetapi tidak baik kalau langsung diaplikasikan, walaupun memiliki kekuatan mekanikdan stabilitas termal yang tinggi. Silika-gel mengandung silanol (Si-OH) dan siloksan (Si-O-Si) yang sangat responsip terhadap proses adsorpsi. Silika-gel dapat disintesis melalui proses sol-gel oleh kondensasi Na2SiO3 dengan penambahan
larutan HCI. Disamping itu kapasitas silika dalam adsorpsi sangat terbatas. Oleh karena
itu Silika direaksikan dengan organosilan dan dapat memiliki kegunaan yang sangat luas dan aplikasi dalam berbagai teknologi. Silika ini, kandungan natrium, karbon dan oksigen dari xerogel bergantung pada pH dan jenis asam yang digunakan dalam pembuatan silika-gel [3]. Logam-logam berat seperti Ni(II), Pb(II), Cd(II) dan Cr(III) telah dilaporkan sebagai adsorben yang baik berupa clipnoptililite dan glisin yang dimodifikasi secara sambung silang dengan resin kitosan yang sangat efisien sebagai adsorben untuk ion-ion (Cu(II), Pt(IV) dan Pd(II) [4,5]. Amaria dkk (2010) melaporkan bahwa adsorpsi maksimum (98,19%) ion Au(III) dengan Sacharomyces cereviceae terjadi pada pH 4 [60. Adsorben dikarakterisasi menggunakan spektroskopi IR, SEM dan EDX. Analisis menggunakan EDX untuk menunjukkan spektroskopi unsur-unsur. Pengaruh dari pelarut diobservasi dengan perhitungan konsentrasi misel kritis dari adsorben.
Studi adsorpsi untuk pemisahan senyawa belerang dari emas terhadap pembentukan adsorben self assembled monolayers (SAM) juga dilaporkan. Penelitian Sistamin yang mengadsorpsi emas dengan gugus
deformasi-NH terjadi pada 1580 cm-1 dan pita serapan lemah √ CH pada bilangan gelombang 2920 cm-1 [9].Beberapa ligan yang direkomendasikan untuk ekstraksi emas dari bijihnya yang dapat mencemari lingkungan dan pernah digunakan sianida, berpotensi lebih cepat dari sianida untuk pelepasan emas pada mesia asam. Investigasi selanjutnya penggunaan 5 model adsorpsi emas dengan karbon dan dipilih model Fleming yang terbaik untuk hasil adsorpsi emas.
Penelitian ini telah dilakukan modifikasi silika dengan 3-APTMS dan reaksi metilasi terhadap material dengan refluks selama 4 jam. Material adssorben STA yang dilanjutkan dengan aplikasi adsorpsi ion tembaga(II) dalam larutan.
METODOLOGI
Preparasi larutan Na2SiO3. Sampel ASP
dihaluskan dan diayak sehingga diperoleh serbuk homogen dengan ukuran 200 mesh. ASP 60g dicuci dengan 500 mL larutan HCl 4M dan dicuci kembali dengan akuademineralisasi. Hasilnya dikeringkan dalam oven. ASP sebanyak 50 g didestruksi dengan 500 mL larutan NaOH 4M dididihkan dan distirer selama 4 jam. Setelah dikeringkan dimasukkan ke dalam cawan porselin dan dipanaskan pada suhu 80οC selama 30 menit. Residu dilarutkan ke dalam 500 mL akuades dibiarkan selama 24 jam dan disaring menggunakan corong Buchner dan kertas Whatman 41. Filtratnya adalah larutan Na2SiO3 digunakan sebagai material prekursor.
Modifikasi silika dengan gugus amin. Larutan Na2SiO3 sebanyak 50 mL
dimasukkan ke dalam plastic dan dituangkan 10 mL larutan 3-APTMS. Campuran ditambahkan larutan HCl 4M secara bertahap dan distirer dengan pengaduk magnet dan pH menjadi 7. Untuk pembentukan gel, didiamkan selama 24 jam, dicuci dengan akua demineralisasi dan dikeringkan pada temperatur 80οC. Setelah
dikeringkan serbuk diayak dengan ukuran 200 mesh. Material yang terbentuk disebut STA.
Identifikasi terhadap gugus fungsional. Satu milligram STA sebelum dan sesudah diinteraksikan dengan ion Cu(II) dicampur dengan kalium bromida (KBr) dan dibentuk pelet. Kemudian dianalisis dengan spektrofotometer FTIR.
Uji terhadap adsorpsi. Adsorben STA (100 mg) diinteraksikan dengan 100 mg/L ion Cu(II) dalam variasi pH 3, 4, 5, 6, 7 dan 8. Media pH dibuat dengan penambahan larutan NaOH 0,1N atau larutan HCl 0,1N. Pengaruh waktu kontak, konsentrasi ion emas(III), pH larutan dan massa adsorben STA ditentukan dengan metode adsorpsi sitem bath.
Penentuan kapasitas sorpsi. Lima puluh mg STA diinteraksikan degan 10 mL larutan yang mengandung berbagai variasi konsentrasi 10, 25, 75, 100, 200 dan 300 mg/L Cu(II) pada pH optimum seperti hasil penentuan PH seperti di atas. Filtrat dianalisis dengan AAS untuk menentukan konsentrasi Cu(II).
Penentuan tipe sorpsi. Adsorben STA (250 mg) diinteraksikan dengan 50 mL larutan Cu(II) 500 mg/L pada pH optimum dan distirer selama 2 jam. Setelah didiamkan selama 1 jam kemudian disentrifuge 10 menit. Filtrat dianalisis dengan AAS untuk menentukan konsentrasi Cu(II).
HASIL DAN PEMBAHASAN
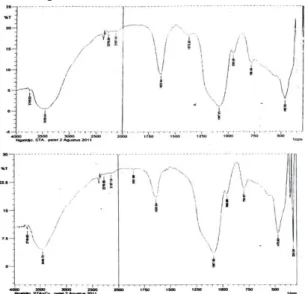
Karakterisasi STA. Hasil rekam alat FTIR pada daerah 300 – 4000 cm-1 terhadap STA sebelum dan sesudah diinteraksikan dengan Cu(II) disajikan pada gambar 1A dan 1B. Spektra STAK sebelum (A) dan sesudah(B) adsorpsi Cu(II) ditentukan gugus fungsionalnya. Pita adsorpsi pada 3425,58 cm-1 menunjukkan vibrasi ulur O-H dari Si-OO-H. Vibrasi kuat terjadi pada bilangan gelombang 563,21 cm-1 menunjukkan adanya ikatan dengan logam.
Gugus funsional amin (-NH2) dan metilen
(-CH2) terjadi pada 1627,92 cm-1 dan
2939,52 cm-1 serta overtone pada bilangan gelombang 3425,58 cm-1 . Vibrasi tekuk -CH2 pada 1512,19 cm-1[13]. Vibrasi
rentang simetri Si-O dari Si-O-Si terjadi pada bilangan gelombang 1067,85 cm-1. Vibrasi tekuk C-H asimetri terjadi pada 1458,28 cm-1[14].
Spektra STA setelah diinteraksikan dengan Cu(II) (gambar IB) menunjukkan pergeseran bilangan gelombang, diantaranya bilangan gelombang 1651,66 cm-1 menjadi 1874,81 cm-1 dan 462,92 cm
-1
menjadi 956,69 cm-1. Berdasarkan identifikasi di atas menunjukkan bahwa telah terjadi proses sorpsi Cu(II) oleh gugus -NH2. Menurut teori Hard Soft Acid Base
(HSAB) dari Perason, terjadi interaksi antara -Nh2 basa lunak dengan ion Cu(II)
segabai asam lunak. Ligan mengikat ion Cu(II) ditunjukkan pada bilangan gelombang 1111,00 cm-1 [16]. Vibrasi ulur gugus metilen (-Ch2) mengikat 3-APTMS
terhadap silika.
Gambar 1. Spektra STA sebelum (A) dan sesudah (B) diinteraksikan dengan Cu (II)
Karakterisasi STA
ASP didestruksi dengan NaOH dan diperoleh larutan Na2SiO3 yang berwarna
merah. Proses sol-gel diperoleh STA. Reaksi metilasi STA diperoleh STAK. Hasil sorpsi ion Cu(III) oleh STA pada pH
Gambar 2. Reaksi pembentukan STAK (Campos, 2001)
3,4,5,6,7 dan 8 disajikan pada Tabel 3. Pada pH>7 terjadi endapan Cu(OH)2 [6].
Adsorpsi sistem bath bahwa adsorpsi bergantung pada waktu kontak dan konsentrasi. Ekstraktan 8-methylxantine dapat mengisolasi Cu(II) dari concentrate tembaga. Struktur senyawa yang diperoleh diprediksi senyawa kompleks inti ganda [14]. Kristal senyawa kompleks Na2[Zr2(dhpta2].7H2O dalam C2H5OH
diperoleh pada pH 3.
Penentuan tipe sorpsi
Hasil data dari sorpsi Cu(II) oleh STA disajikan pada Tabel 4. Metode desorpsi ini digunakan untuk menentukan tipe sorpsi dari ion logam pada permukaan silika yang dimodifikasi dengan ammonium kuaterner. Adsorben yang dikembangkan dengan imprinted pada eksktraksi fasa padat Zr(IV) dari larutan. Hasil yang diperoleh limit deteksi dan standar deviasi berturut-turut 0,14 ng/mL dan 1,49 % [19].
Menurut teori HSAB dari Pearson asam lemah dengan basa lemah akan membentuk ikatan yang kuat, dmikian juda spesies intermediate. Spesies kuat memiliki jarak yang besar pada HOMO-LUMO, sedangkan lunak jaraknya kecil [20].
Isoterm adsorpsi
Proses adsorpsi system cair-padat, rasio distribusi zat yang terlarut (solute) antara fasa cair dengan padat diukur pada saat terjadi kesetimbangan. Bentuk distribusi sebagai jumlah qe sebagai fungsi Ce pada temperature tetap, jumlah qe adalah solute yang teradsorpsi per unit berat adsorben dan Ce konsentrasi solute dalam kesetimbangan. Proses ini adalah tipe isotherm adsorpsi.
Konsentrasi ion Cu(II) yang diserap oleh adsorben pada kesetimbangan dapat dihitung dengan persamaan (1).
Dimana Cο dan Ce konsentrasi awal dan
kesetimbangan, mg/L. Notasi V adalah volume larutan, L(liter) dan W berat adsorben, g.
Model dari Isoterm Langmuir dipilih untuk menentukan sorpsi Cu(II), dirumuskan pada persamaan (2) [6,22]
Dimana qe adalah kapasitas adsorpsi konsentrasi solute pada kesetimbangan Ce
(mg/g). Ce konsentrasi adsorbat dalam
larutan (mg/L). Qο kapasitas adsorpsi maksimum (mg/g). KL adalah tetapan Langmuir yang berhubungan dengan sfinitas pada setiap unit (L/mg).
Persamaan linier diperoleh dengan plotting Ce/qe versus Ce untuk menentukan
tetapan kesetimbangan KL dan kapasitas adsorpsi (Qο). Nilai ini dapat ditentukan dari intercept (Q οKL ) dan slope (1/Qο).
Energi total sorpsi per mol dapat ditentukan dari tetapan kesetimbangan dengan persamaan E = -∆Gο = RT ln K.
KESIMPULAN
Material STA telah sukses disintesis dari ASP dengan prsoes sol-gel. Porositas STAK > STA dan karakterisasi dengan FTIR telah menunjukkan adanya gugus siloksan, silanol, amin dan metilen. Adsorpsi ion Cu(II) oleh adsorben STA optimum pada pH 5.
DAFTAR PUSTAKA
Amaria, Suyono, Eko Sugiharto and Rohmah, A.N, 2010. Sorption of Au(III) by Sacccharomyces cereviciae Biomass, Indo. J. Chem., vol. 10(2) p. 1777-183. Buhani, Narsito, Nuryono and Kunarti,
E.S.2010.Production of metal ion
imprinted polymer from marcapto-silica through sol-gel process as selective adsorbent of cadmium, Desalination 251 p. 83-99.
Campos, E.A., Silfa Alfaya., A.A., Ferrari, R.T., Costa, C.M.M, 2001. Quarternary Ammonium Salts Immobilized on Silica Gel: Exchange Properties and Application as Potentiometric Sensor for Perchlorate Ions J. Colloid Interface Sci. 240, 97-104.
Kalapathy, U., Proctor, A, and Shultz, J., 2002. An Improve method for production of silica from rice hull ash, Biores.Technol. 85, 285-289.
Kalapathy, U., Proctor, A., and Schultz, J., 2000. A simple method for production of pure silica from rice hull ash. Biores. Technol. 73, 257-262.
Merland, F.T., Méthivier,C., Pasquinet, E., Hairault, L., and Pradier, C.M, 2006. Adsorption of funcsionalised thiols surfaces : How to build a sensitive and selective sensor for a nitroaromaic compound. Sens.Actuators B, 114, 223-228.
Navarro, P., Vargas, C., Alonso, M. and Alguasil, F.J. 2007. Towards a more environmentally friendly process for gold : models on gold adsorption onto activated carbon from ammoniacal thiosulfate solutions. Desalination, 211, 58-63.
Nazem, Z, Najafi, P.Tabatabaei, S.H and Hajrasuliha, S.H. 2011.Adsorption of heavy metals in the compost leachate in a soil column enrichted by Clinoptilolite. Res.J. Chem. Environ, Vol. 15(2) p. 1-6. Nuryono and Narsito, 2005, Effect of Acid
Concentration on Characters of Silica-Gel Synthesized from Sodium Silicate, Indo.J. Chem., 5(1), 23-30.
Ramesh. A, Hasegawa. H, Sugimoto. W, Maki. T and Ueda. K. Adsorption of Gold(III), platinum(IV) and palladium
(II) onto glycine modified crosslinked chitosan resin, Biosur.Technol. 99 p. 3801-3809.
Rusdi. M and Ngatijo, 2007., Interacting Hydrophobic Sodium Dodecil Sulphate in the process and micellation and adsorption on sulphuric acid solvent, ICCSst UGM, Yogyakarta.
Rusdiarso, B., 2007. Study on Solvent Extraction of Au(III) in Cu-Concentrate Slution at PT Freeport by using 8-Methylxantine.Berkala MIPA, 17(2), 15-21.
Schubert, U and Hϋsing, N. 2 ., Synthesis of Inorganic MaterialsWilley VCH. Verlag. GmbH, Weinheim.
Taimur, K and Malay C,..,2011. Adsorption of capacity of Coconut Coir Activated carbon in The Removal of Disperse and Direct dyes from Aqueous Solution. Res. J. Environ. Vol. 15(2) p. 1-5
Taimur, K and Malay C,..,2011. Adsorption of capacity of Coconut Coir Activated carbon in The Removal of Disperse and Direct dyes from Aqueous Solution. Res. J. Environ. Vol. 15(2) p. 1-5