PENERAPAN TEKNIK IMOTILISASI MENGGUNAKAN
ACEPROMAZINE DALAM TRANSPORTASI KERING IKAN
NILA (Oreochromis niloticus) DENGAN PEMBEDAAN JENIS
KELAMIN
Oleh:
Rio S. S. M. Tampubolon C34060168
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
RIO S. S. M. TAMPUBOLON. C34060168. Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering Ikan Nila (Oreochromis niloticus) dengan Pembedaan Jenis Kelamin. Dibimbing oleh: RUDDY SUWANDI dan AGOES M. JACOEB
Transportasi ikan hidup adalah menempatkan ikan dalam lingkungan baru yang terbatas dengan lingkungan asalnya disertai perubahan-perubahan sifat lingkungan yang sangat mendadak. Salah satu cara yang dapat digunakan dalam proses transportasi ikan hidup adalah sistem transportasi tanpa media air dengan cara imotilisasi. Penggunaan bahan pemingsan (anestetik) ini ditujukan untuk mencegah atau mengurangi terjadinya stres yang berujung kematian pada ikan selama proses transportasi. Permasalahan yang terjadi pada transportasi kering dengan teknik imotilisasi yaitu bahan anestetiknya yang susah didapatkan dan harganya terlampau mahal. Bahan anestetik yang umum digunakan yaitu tricaine atau MS-222, bahan ini susah didapatkan dan harganya pun mahal sehingga perlu dicari bahan kimia lain yang dapat digunakan sebagai anestetikum, salah satunya adalah dengan menggunakan acepromazine (ACP).
Penelitian ini bertujuan untuk mengetahui pengaruh perbedaan jenis kelamin antara ikan jantan dengan ikan betina selama proses pemingsanan dengan menggunakan acepromazine. Penelitian dilakukan dengan memasukkan 5 ekor ikan pada tiap perlakuan ke dalam larutan anestetikum yang telah dibuat. Setelah ikan teranestesi, kemudian ikan dipindahkan ke dalam wadah yang berisi air bersih untuk menyadarkan ikan kembali. Parameter yang diamati selama proses tersebut antara lain tingkah laku ikan selama proses pemingsanan, waktu onset, waktu pulih sadar, serta tingkat kelulusan hidup (survival rate) ikan. Tahapan ini dilakukan sebanyak tiga kali ulangan. Perubahan kualitas air juga diukur pada saat ikan dimasukkan ke dalam larutan anestetik dan setelah ikan pingsan.
Perlakuan perbedaan jenis kelamin dan perbedaan konsentrasi acepromazine yang diberikan dalam proses pemingsanan ikan nila memberikan pengaruh yang berbeda nyata terhadap waktu onset dan waktu pulih sadar ikan nila. Pada parameter tingkat kelulusan hidup, hanya perlakuan penambahan acepromazine dengan berbagai konsentrasi yang memberi pengaruh berbeda nyata. Interaksi antara kedua perlakuan tersebut tidak memberi pengaruh yang nyata terhadap parameter yang diujikan.
Ikan nila jantan memiliki waktu onset yang lebih lama dibandingkan ikan nila betina, sedangkan ikan nila betina memiliki waktu pulih yang lebih lama dibandingkan ikan nila jantan. Hal ini disebabkan oleh kandungan lemak yang dimiliki ikan nila betina lebih tinggi dibandingkan ikan nila jantan, sehingga ikan nila betina lebih cepat pingsan namun membutuhkan waktu yang lebih lama untuk kembali ke kondisi normal. Konsentrasi acepromazine yang optimal sebagai zat anestesi ikan nila adalah 50 ppm dengan tingkat kelulusan hidup rata-rata 95,55%; waktu onset rata-rata 57,11 menit; dan waktu pulih sadar rata-rata 61,44 menit.
Berdasarkan hasil penelitian ini, dapat direkomendasikan bahwa pembedaan jenis kelamin antara ikan jantan dan ikan betina diperlukan pada saat akan dilakukan proses transportasi ikan dalam keadaan teranestesi.
PENERAPAN TEKNIK IMOTILISASI MENGGUNAKAN
ACEPROMAZINE DALAM TRANSPORTASI KERING IKAN
NILA (Oreochromis niloticus) DENGAN PEMBEDAAN JENIS
KELAMIN
Oleh:
Rio S. S. M. Tampubolon C34060168
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu
Kelautan, Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul : Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering Ikan Nila (Oreochromis niloticus) dengan Pembedaan Jenis Kelamin
Nama : Rio Septiadi S. S. M. Tampubolon
NRP : C34060168
Menyetujui:
Pembimbing I Pembimbing II
(Dr. Ir. Ruddy Suwandi, MS, MPhil) (Dr. Ir. Agoes M. Jacoeb, Dipl.-Biol.) NIP: 19580511 198503 1 002 NIP: 19591127 198601 1 005
Mengetahui:
Ketua Departemen Teknologi Hasil Perairan
(Dr. Ir. Ruddy Suwandi, MS, MPhil) NIP: 19580511 198503 1 002
iv
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering Ikan Nila (Oreochromis niloticus) Hidup dengan Pembedaan Jenis Kelamin” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tiggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 9 Maret 2012
Rio S. S. M. Tampubolon C34060168
RIWAYAT HIDUP
Penulis dilahirkan di Balimbingan, Sumatera Utara pada tanggal 30 September 1988 sebagai anak kedua dari lima bersaudara dari pasangan (Alm) Ramlan Tampubolon dan Lince br. Gultom. Penulis lulus dari SDN 095203 pada tahun 2000, kemudian pada tahun 2003 lulus dari SLTPN 1 Tanah Jawa, Kecamatan Tanah Jawa, Kabupaten Simalungun. Pada tahun 2006, penulis lulus dari SMAN 4 Pematang Siantar dan pada tahun yang sama, penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama menempuh pendidikan di IPB, penulis aktif di Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen (PMK) Komisi Pelayanan Anak, anggota Divisi Sosial Kemasyarakatan Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) periode 2008-2009, dan anggota Divisi Pengembangan Sumberdaya Manusia Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) periode 2009-2010. Penulis juga aktif di beberapa kepanitiaan, diantaranya ketua Divisi Keamanan di kepanitiaan SANITASI 2009, kepanitiaan up grading kepengurusan HIMASILKAN 2009-2010, dan jendral kontingen mahasiswa Teknologi Hasil Perairan pada kegiatan Pekan Olahraga dan Kesenian Perikanan (PORIKAN) 2009.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penulis melakukan penelitian yang berjudul “Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering
Ikan Nila (Oreochromis niloticus) Hidup dengan Pembedaan Jenis Kelamin” di bawah bimbingan Dr. Ir. Ruddy Suwandy, MS, M.Phil dan Dr. Ir. Agoes M.
KATA PENGANTAR
Puji syukur kita panjatkan ke hadirat Tuhan Yang Maha Esa atas kasih karunia dan anugerah-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi ini berjudul “Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering Ikan Nila (Oreochromis niloticus) Hidup dengan Pembedaan Jenis Kelamin” dan merupakan salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor
Penyelesaian penulisan skripsi ini tidak lepas dari bantuan dan partisipasi berbagai pihak. Pada kesempatan ini, penulis menyampaikan terima kasih kepada semua pihak yang telah memberikan bantuan dan partisipasi dalam penulisan skripsi ini, yaitu kepada:
1. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan sekaligus pembimbing pertama penulis.
2. Dr. Ir. Agoes M. Jacoeb, Dipl-Biol selaku Ketua Program Studi Departemen Teknologi Hasil Perairan sekaligus pembimbing kedua penulis.
3. Dr. Tati Nurhayati, S.Pi, M.Si selaku pembimbing akademis penulis. 4. Dr. Dra. Pipih Suptijah, MBA selaku dosen penguji akhir penulis.
5. Dosen-dosen pengajar dan staf administrasi Departemen Teknologi Hasil Perairan.
6. Kedua orang tua tercinta, (Alm) R. Tampubolon dan L. br. Gultom, kakak (Hanna), serta adik-adik (Roy, Rizky dan Heny) atas doa, kasih sayang, dan dukungannya.
7. Sahabat-sahabat (Vickar, Rudi, Hendra, Trias, Idris, Fauzi dan yang lainnya) terima kasih atas kebersamaan yang telah terjalin selama ini.
8. Teman-teman THP 43 yang telah mendukung dan memberikan semangat kepada penulis.
9. Kakak-kakak kelas THP angkatan 40, 41, dan 42 (Erlangga, Bobby, Deden, Tommy, Marglory, Fuad) atas pengalaman hidup yang telah dibagikan.
10. Adik-adik kelas THP (Fitrie, Afif, Helmi, Rico dan yang lainnya) yang turut membantu dan memberi semangat kepada penulis.
vii
11. Penghuni dan mantan penghuni Pondok Malea Putra (Juan, Rudi, Rano, Paul, Ando, Bang Mario, Bang Christian, Bang Agus, Bang Theo, Bang Jhon, Bang Tumpal) terima kasih atas kebersamaan selama ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan oleh penulis. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, 9 Maret 2012
viii DAFTAR ISI DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2 TINJAUAN PUSTAKA ... 4
2.1 Deskripsi dan Klasifikasi Ikan Nila (Oreochromis niloticus)... 4
2.2 Anestesi ... 6
2.3 Kegunaan Anestesi dalam Menanggulangi Stres pada Ikan ... 9
2.4 Acepromazine ... 11
3 METODOLOGI ... 13
3.1 Waktu dan Tempat ... 13
3.2 Bahan dan Alat ... 13
3.3 Metode Penelitian ... 13
3.3.1 Aklimatisasi ikan... 13
3.3.2 Pembuatan media pemingsanan ... 13
4 HASIL DAN PEMBAHASAN ... 18
4.1 Pengamatan Tingkah Laku Ikan Selama Proses Pemingsanan ... 18
4.2 Waktu Onset Pemingsanan ... 21
4.3 Waktu Pulih Sadar ... 24
4.4 Tingkat Kelulusan Hidup (Survival Rate) Ikan ... 25
4.5 Analisis Kualitas Air ... 27
5 KESIMPULAN DAN SARAN ... 29
5.1 Kesimpulan ... 29
5.2 Saran ... 29
ix
DAFTAR TABEL
Nomor Teks Halaman
1 Tahapan anestesi ikan ... 7
2 Pengaruh perubahan pH terhadap ikan ... 14
3 Kisaran nilai konsentrasi DO dan pengaruhnya pada ikan ... 15
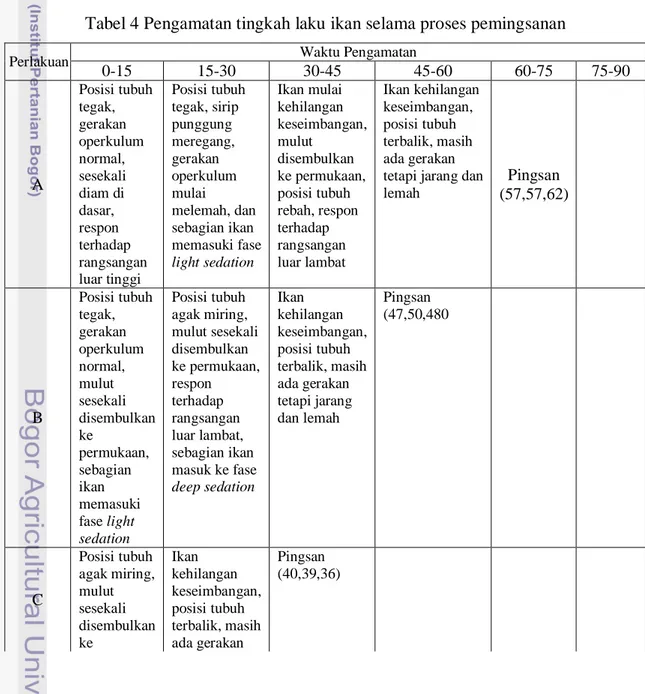
4 Pengamatan tingkah laku ikan selama proses pemingsanan ... 18
x
DAFTAR GAMBAR
Nomor Teks Halaman
1 Ikan nila (Oreochromis niloticus) ... 4
2 Ikan nila jantan dan ikan nila betina ... 5
3 Grafik pengaruh perlakuan terhadap waktu onset ... 22
4 Grafik pengaruh perlakuan terhadap waktu pulih sadar ... 24
xi
DAFTAR LAMPIRAN
Nomor Halaman
1 Analisis nilai waktu onset... 34
2 Analisis nilai waktu pulih sadar ... 35
3 Analisis nilai survival rate (SR) ... 36
4 Dokumentasi peralatan dan bahan yang digunakan dalam penelitian ... 37
1 PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara kepulauan yang memiliki wilayah perairan yang sangat luas. Wilayah perairan yang luas ini merupakan indikator bahwa Indonesia mempunyai potensi kelautan yang sangat besar, baik potensi fisik maupun potensi sumber daya. Potensi fisik, yaitu 17.508 pulau, garis pantai sepanjang 81.000 km. Potensi perikanan Indonesia mencapai 6,6 juta ton/tahun, namun yang dimanfaatkan hanya sekitar 1,4 juta ton/tahun (BPS 2009).
Permintaan konsumen terhadap komoditas perikanan dalam bentuk hidup semakin besar dan berkembang, terutama untuk jenis-jenis ikan yang mempunyai nilai ekonomis tinggi dan beberapa jenis ikan air tawar dan ikan hias. Peningkatan permintaan konsumen didasari oleh keinginan terhadap suatu komoditi perikanan yang bermutu tinggi, spesifik, dan resiko terhadap kesehatan yang kecil. Penanganan dalam sistem transportasi diperlukan untuk menjaga tingkat kelulusan hidup ikan tetap tinggi sampai tempat tujuan. Stres dan aktivitas fisik selama proses transportasi ikan dapat menyebabkan hilangnya kualitas produk, seperti mengurangi kesegaran ikan, pelunakan tekstur otot dan menurunkan kualitas hasil fillet. Akibat yang dapat ditimbulkan dari stres ikan ini akan berdampak ekonomis pada budidaya ikan (Dobsikova et al. 2009).
Transportasi ikan hidup adalah menempatkan ikan dalam lingkungan baru yang terbatas dengan lingkungan asalnya disertai perubahan-perubahan sifat lingkungan yang sangat mendadak. Transportasi ikan hidup dibagi menjadi dua cara, yaitu sistem basah dan sistem kering. Transportasi sistem basah menuntut media yang sama dengan tempat hidup ikan sebelumnya yaitu, air, oksigen, dan cahaya. Pengangkutan sistem basah dapat dilakukan dengan cara tertutup dan terbuka. Pada cara tertutup ikan diangkut dalam wadah tertutup dengan semua kebutuhan hidup ikan berada dalam kemasan pengangkutan. Wadah yang dipergunakan dapat berupa kantong plastik atau kemasan lain yang tertutup rapat. Pada cara terbuka ikan diangkut dalam wadah terbuka dan suplai oksigen diberikan secara terus-menerus (Muljanah et al. 1994). Transportasi sistem kering pada umumnya dilakukan di mana ikan dibuat dalam kondisi pingsan (imotil)
2
dengan menggunakan bahan pemingsan untuk mengurangi proses metabolisme yang dilakukan oleh ikan.
Penggunaan bahan pemingsan (anestetikum) ini ditujukan untuk mencegah atau mengurangi terjadinya stres yang berujung kematian pada ikan selama proses transportasi. Bahan anestetik kimia seperti tricaine (MS-22) biasa digunakan sebagai zat pembius dalam transportasi induk ikan, benih dan ikan hias agar tingkat kelulusan hidup ikan setinggi-tingginya sampai tempat tujuan. Akan tetapi bila digunakan untuk pembiusan ikan konsumsi, seperti kerapu meninggalkan residu yang membahayakan terhadap keamanan produk (Subasinghe 1997 diacu dalam Sukarsa 2005). Permasalahan lainnya adalah MS-222 (tricaine) harganya relatif mahal dan susah untuk didapatkan, sehingga perlu dicari bahan kimia lain yang dapat digunakan sebagai anestetikum, salah satunya adalah dengan menggunakan acepromazine.
Acepromazine biasanya digunakan sebagai tranquilizer pada anjing dan kucing. Termasuk golongan phenotiazine, cara kerjanya dengan mendepresi dopamin, metabolisme di hati dan diekskresikan melalui urin (Forney 2004). Menurut Mckelvey dan Hollingshead (2003), acepromazine dapat digunakan sebagai sedasi ketika transportasi hewan sehingga hewan merasa nyaman dan seperti tertidur.
Daya serap ikan terhadap anestetikum yang menyebabkan ikan dapat pingsan sangat dipengaruhi oleh kondisi biologis ikan tersebut, salah satunya adalah perbedaan jenis kelamin antara ikan jantan dan ikan betina. Ikan betina pada umumnya memiliki kandungan lemak yang lebih tinggi dibandingkan dengan ikan jantan, terutama pada saat ikan betina matang gonad. Acepromazine memiliki sifat mudah terlarut atau terabsorbsi pada lemak (Crowell-Davis dan Murray 2005), sehingga akan menyebabkan ikan yang mempunyai kandungan lemak yang banyak akan lebih mudah teranestesi.
1.2 Tujuan
Penelitian mengenai “Penerapan Teknik Imotilisasi Menggunakan Acepromazine dalam Transportasi Kering Ikan Nila (Oreochromis niloticus) Hidup dengan Pembedaan Jenis Kelamin” ini bertujuan untuk mengetahui
3
pengaruh perbedaan jenis kelamin antara ikan jantan dengan ikan betina selama proses pemingsanan dengan menggunakan acepromazine.
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Nila (Oreochromis niloticus)
Ikan nila berasal dari Afrika bagian timur. Ikan nila memiliki bentuk tubuh yang pipih ke arah vertikal (compress). Posisi mulutnya terletak di ujung hidung (terminal) dan dapat disembulkan (Suyanto 2003). Morfologi ikan nila dapat dilihat pada Gambar 1.
Gambar 1 Ikan nila (Oreochromis niloticus) (Lim dan Webster 2006)
Menurut Saanin (1984), ikan nila (Oreochromis niloticus) mempunyai klasifikasi sebagai berikut:
Filum : Chordata Subfilum : Vertebrata Kelas : Osteichtyes Subkelas : Acanthopterygii Ordo : Percomorphi Subordo : Percoidea Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus
Ikan nila memiliki ciri morfologis yaitu berjari-jari keras, sirip perut torasik, letak mulut subterminal dan berbentuk meruncing. Selain itu, tanda lainnya yang dapat dilihat dari ikan nila adalah warna tubuhnya hitam dan agak keputihan.
5
Bagian tutup insang berwarna putih, sedangkan pada nila lokal putih agak kehitaman bahkan kuning. Sisik ikan nila berukuran besar, kasar dan tersusun rapi. Sepertiga sisik belakang menutupi sisi bagian depan. Tubuhnya memiliki garis linea lateralis yang terputus antara bagian atas dan bawahnya. Linea lateralis bagian atas memanjang mulai dari tutup insang hingga belakang sirip punggung sampai pangkal sirip ekor. Ukuran kepala relatif kecil dengan mulut berada di ujung kepala serta mempunyai mata yang besar (Kottelat et al. 1993). Ikan nila memiliki kemampuan menyesuaikan diri yang baik dengan lingkungan sekitarnya. Ikan ini memiliki toleransi yang tinggi terhadap lingkungan hidupnya, sehingga bisa dipelihara di dataran rendah yang berair payau maupun dataran yang tinggi dengan suhu yang rendah (Trewavas 1982). Ikan nila mampu hidup pada suhu 14-38 oC dengan suhu terbaik adalah 25-30 oC dan dengan nilai pH air antara 6-8,5 (Suyanto 2003).
Perbedaan antara ikan jantan dan betina dapat dilihat pada lubang genitalnya dan juga ciri-ciri kelamin sekundernya. Pada ikan jantan, di samping lubang anus terdapat lubang genital yang berupa tonjolan kecil meruncing sebagai saluran pengeluaran kencing dan sperma. Tubuh ikan jantan juga berwarna lebih gelap, dengan tulang rahang melebar ke belakang yang memberi kesan kokoh.sedangkan yang betina biasanya pada bagian perutnya besar (Suyanto 2003). Perbedaan ciri morfologis antara ikan nila jantan dengan ikan nila betina dapat dilihat pada Gambar 2.
Gambar 2 Ikan nila jantan dan ikan nila betina (Suyanto 2003)
6
2.2 Anestesi
Anestesi berarti pembiusan, berasal dari bahasa Yunani, yaitu “an-" yang berarti tidak, dan “aesthētos " yang berarti kemampuan untuk merasa. Secara umum berarti suatu tindakan menghilangkan rasa sakit ketika melakukan pembedahan dan berbagai prosedur lainnya yang menimbulkan rasa sakit pada tubuh. Penggunaan istilah anestesi pertama kali digunakan oleh Oliver Wendel Holmes Sr pada tahun 1846. Obat untuk menghilangkan nyeri terbagi dalam 2 kelompok, yaitu analgetik dan anestesi. Analgetik adalah obat pereda nyeri tanpa disertai hilangnya perasaan secara total. Seseorang yang mengkonsumsi analgetik tetap berada dalam keadaan sadar. Analgetik tidak selalu menghilangkan seluruh rasa nyeri, tetapi selalu meringankan rasa nyeri. Beberapa jenis anestesi menyebabkan hilangnya kesadaran, sedangkan jenis yang lainnya hanya menghilangkan nyeri dari bagian tubuh tertentu dan pemakainya tetap sadar (Suryanto 1998).
Anestesi menurut Mckelvey dan Hollingshead (2003) ada 4 tahapan, tahap pertama atau sering disebut stadium analgesia, hewan masih sadar tetapi disorientasi dan menunjukkan sensitivitas terhadap rasa sakit berkurang, respirasi dan denyut jantung normal atau meningkat, semua reflek masih ada, hewan masih bangun dan dapat juga urinasi, defekasi. Tahap kedua yaitu kesadaran mulai hilang namun refleks masih ada, pupil membesar (dilatasi) tetapi akan menyempit (konstriksi) ketika ada cahaya masuk. Tahap kedua atau stadium eksitasi berakhir ketika hewan menunjukkan tanda-tanda otot relaksasi, respirasi menurun dan refleks juga menurun. Tahap ketiga atau stadium anestesi, pada stadium ini biasanya dilakukan operasi. Hewan kehilangan kesadaran, pupil mengalami konstriksi dan tidak merespon cahaya yang masuk, refleks hilang (refleks palpebrae). Tahapan keempat adalah pernafasan dan jantung terhenti, dan hewan mati. Indikator tahapan anestesi antara lain aktivitas refleks (refleks palpebrae, pedal refleks, cornea refleks, refleks laring, refleks menelan), relaksasi otot, posisi mata dan ukuran pupil, sekresi saliva dan air mata, respirasi dan denyut jantung.
Stadium anestesi dan gejalanya pada ikan menurut Scott et al. (2009) yaitu stadium eksitasi ditandai dengan peningkatan gerakan opercular atau aktivitas. Setelah beberapa menit gerakan ikan melambat, menjadi ataksia, berenang tidak
7
seimbang dan mulai memutar ke samping. Kadang-kadang posisi ikan menjadi dorsal recumbency, depresi, ikan menjadi berada di dasar kolam dan respirasi meningkat. Tahapan anestesi pada ikan (Bowser 2001) dapat dilihat pada Tabel 1.
Tabel 1 Tahapan anestesi ikan (Bowser 2001)
Tahapan Deskripsi Gejala
0 Normal Kesadaran ada; opercular rate dan otot normal 1 Awal Sedasi Mulai kehilangan kesadaran; opercular rate
sedikit menurun; keseimbangan normal
2 Sedasi total Kehilangan kesadaran total; penurunan opercular rate; keseimbangan menurun
3
Kehilangan sebagian keseimbangan
Sebagian Otot mulai relaksasi; berenang tidak teratur; peningkatan opercular rate; bereaksi hanya ketika ada tactile yang kuat dan rangsangan getaran
4 Kehilangan
keseimbangan total
Kehilangan keseimbangan dan otot secara total; lambat tetapi teratur opercular rate; kehilangan refleks spinal
5 Kehilangan refleks
Kehilangan kesadaran total; opercular lambat dan tidak teratur; denyut jantung sangat lambat; kehilangan refleks
6 Medulla kolaps (stadium asphyxia)
Opercular berhenti bergerak; jantung menahan biasanya diikuti dengan gerakan cepat.
Menurut Harms (1998), anestesi pada ikan dilakukan untuk pemeriksaan, transportasi, diagnostik dan operasi. Prosedurnya yaitu menyiapkan air, memeriksa kondisi ikan, mengistirahatkan ikan. Penggunaan anestesi yang berlebihan atau overdosis digunakan untuk euthanasia. Anestesi untuk ikan biasanya penggunaannya melalui air (perendaman), dan bisa juga dengan cara anestesi inhalasi (seperti anestesi gas pada mamalia). Anestesi melalui injeksi efektif digunakan pada mamalia dan tidak efektif pada ikan.
Faktor-faktor yang mempengaruhi respon penggunaan anestetikum antara lain spesies, kualitas air dan status kesehatan ikan. Berbeda spesies berbeda juga responnya, spesies dengan berat badan yang berbeda akan menimbulkan respon yang berbeda pula. Ikan dengan berat badan yang lebih besar akan menimbulkan respon yang lebih efektif. Ikan dengan lapisan lemak yang tinggi, ikan yang berumur tua, dan ikan betina gravid (berproduksi) akan memperpanjang durasi dan recovery akan semakin lama apabila menggunakan anestetikum yang mudah
8
larut seperti MS-222 atau benzocaine. Kualitas air seperti temperatur sangat mempengaruhi tetapi polanya tidak dapat dipercaya, misalnya MS-222 dan benzocaine memerlukan suhu tinggi untuk dosis yang tinggi. Keasaman juga mempunyai efek terhadap respon anestetikum, contohnya sebagian besar anestetikum bekerja pada air laut tetapi barbiturat bersifat antagonis terhadap ion Ca2+. Nilai pH juga mempengaruhi ionisasi obat sehingga efek obat menjadi meningkat. Ikan yang sakit akan menjadi subjek yang jelek pada proses anestesi (Ferguson 1988).
Ferguson (1988) menyatakan bahwa tipe anestesi dan anestetikum yang biasa digunakan antara lain anestesi irigasi atau perendaman, jenis anestetikumnya yaitu MS-222, 2-phenoxyethanol dan benzocaine. Anestesi parenteral contoh sediaan anestetikumnya adalah alphaxolone (saffan), propanidid (epontol), sodium pentobarbitone (Nembutal), ketamin hydrochloride (ketalar). Tipe anestesi yang lainnya yaitu dengan elektrik anestesi.
Anestetikum yang digunakan pada ikan banyak jenisnya, misalnya ethanol, diethyl ether, halothane, lidocaine, tricaine methanesulfonate (MS-222), eugenol, ketamin, metomidate, propofol, and carbon dioxide. Dua diantaranya yang sering digunakan sekarang adalah tricaine methanesulfonate (MS-222) dan eugenol. Isofluran digunakan sebagai anestesi inhalasi pada mamalia dan burung, dapat juga untuk ikan dengan cara dicampurkan ke dalam air meskipun ada juga efek sampingnya (Harms 1998).
Tricaine nama kimianya yaitu 3-aminobenzoic acid ethyl ester methanesulfonate, ethyl m-aminobenzoate methadesulfonate, methadesulfonate salt of alkyl aminobenzoate, and methandesulfonate salt of ethyl meta-aminobenzoate. Nama dagangnya adalah tricaine methanesulfonate (MS-222), Tricaine-Stm and Meta-caine. Finqueltm and Tricaine-Stm yang biasa digunakan pada ikan. Ikan yang telah diberi anestesikum Finqueltm and Tricaine-Stm tidak boleh dimakan sebelum 21 hari setelah pemberian. Komposisinya larut air dan juga larut dalam lemak. Konsentrasi tricaine 15-330 mg/L. Dosis yang digunakan disesuaikan dengan jenis anestesi, ukuran, spesies, temperatur air dan tekanan air. Tricaine lebih baik digunakan dalam air hangat dan tekanan air yang rendah
9
(Bowser 2001). Cara kerja tricaine menurut Lewbart (2001) adalah dengan cara memblokir saluran sodium dan penggunaanya melalui pakan ikan.
Sediaan sedatif tertentu dalam dosis tinggi akan mendepresi sistem saraf pusat hingga tingkat tertentu yang dikenal sebagai tahap III dari anestesi umum. Akan tetapi kecocokan suatu senyawa tertentu sebagai senyawa pembantu dalam anestesi sangat bergantung pada sifat fisikokimia yang menentukan kecepatan mulai kerja dan lama kerja dari efek obat. Redistribusi dalam jaringan yang sangat cepat menentukan lama kerja yang singkat dari obat-obat tersebut, yang sangat berguna di dalam praktik anestesi (Katzung 2001).
2.3 Kegunaan Anestesi dalam Menanggulangi Stres pada Ikan
Stres adalah suatu keadaan yang ditimbulkan oleh faktor-faktor lingkungan atau faktor-faktor lainnya yang mempengaruhi daya penyesuaian diri dari seekor hewan melebihi batas-batas daya normalnya, atau mengganggu fungsi-fungsi normal hewan hingga ke batas harapan untuk dapat bertahan secara jelas-jelas berkurang. Lingkungan perairan dan ketidakmampuan ikan sebagai hewan poikilotermik (yang suhunya bergantung pada suhu lingkungan, ini sedikit di atas atau di bawah) untuk mengatur suhu badannya, telah merubah dan menyesuaikan anatomi dan fisiologi dari ikan. Rantai kejadian sebagai akibat dari setiap perubahan patologis, seperti infeksi oleh mikroba, kerusakan-kerusakan oleh trauma atau defisiensi nutrisipun sangat dipengaruhi oleh kedua faktor di atas. Pengaruh faktor-faktor stres lebih jelas terlihat pada penyakit ikan dari pada penyakit-penyakit pada spesies hewan lainnya (Nabib dan Pasaribu 1989).
Tanda-tanda penyesuaian umum (General Adaptation Syndrome = GAS) yang terjadi tidaklah spesifik secara fisiologik dan biokemik, serta umumnya berjalan dalam tiga fase yaitu reaksi permulaan (alarm reaction), masa bertahan (stage of resistance), dimana hewan berusaha menyesuaikan diri untuk tetap mempertahankan keseimbangan fisiologis (homeostatis) di dalam keadaan-keadaan lingkungan yang berubah, dan masa kehabisan daya (exhaution), dimana usaha-usaha adaptasi terhenti dan homeostatispun tidak tercapai (Nabib dan Pasaribu 1989).
Kejadian-kejadian yang timbul pada GAS dikendalikan oleh sistem hormonal dan syaraf. Pengeluaran dari hormon-hormon adenocorticotropic
10
(ACTH) dan corticostreroid menyebabkan retensi ion Na+ dan Cl– sedang ion K+ dikeluarkan, maka ada penambahan dalam kadar glukosa darah dan metabolisme nitrogen, sedang kelenjar thyroid distimulasi dan pengeluaran thyroxinnya bertambah, dalam darah terjadi lymphocitemia dan neurophilia. Kemudian sistem syaraf simpatik bereaksi secara berlebihan, yang menyebabkan kontraksi limpa, meningkatkan pernafasan dan kenaikan tekanan darah. Sebagian besar dari efek-efek ini telah dilaporkan juga pada ikan, meskipun mekanisme pengaturannya belum diketahui benar (Nabib dan Pasaribu 1989).
Stres yang terjadi pada ikan berkaitan dengan timbulnya penyakit pada ikan tersebut. Biasanya stres pada ikan diakibatkan perubahan lingkungan akibat beberapa hal atau perlakuan misalnya akibat pengangkutan atau transportasi ikan-ikan yang dimasukkan ke dalam jaring apung di laut dari tempat pengangkutan biasanya akan mengalami shock, berhenti makan dan mengalami perlemahan daya tahan terhadap penyakit. Kepadatan ikan yang melibihi daya dukung perairan (carrying capacity) akan menimbulkan persaingan antar ikan tinggi, oksigen terlarut menjadi rendah dan sisa metabolisme seperti amonia akan meningkat sehingga dapat menimbulkan stres dan merupakan penyebab timbulnya serangan penyakit (Nabib dan Pasaribu 1989).
Tingkat stres yang terjadi pada ikan juga berbeda-beda. Kajian yang lebih mendalam menunjukkan tingkatan stres yang terjadi pada ikan dapat ditelusuri dengan kandungan kortisol. Banyak hal berkenaan dengan kortisol selama proses metabolisme, misalnya saat starvasi (puasa), osmoregulasi, pengerahan simpanan energi untuk migrasi, proses pematangan gonad, pemijahan dan selama stress yang dialami oleh ikan itu sendiri (Van Ginneken et al. 1997).
Pada saat ditransportasikan, ikan harus dikondisikan dalam keadaan aktivitas biologis rendah sehingga konsumsi energi dan oksigen juga rendah sehingga kemungkinan terjadinya stress pada ikan dapat dicegah. Penggunaan transportasi sistem kering merupakan salah satu cara yang efektif untuk untuk mengkondisikan ikan dalam keadaan aktivitas biologis yang rendah. Untuk menurunkan aktivitas biologis ikan dapat dilakukan dengan menggunakan suhu rendah dan menggunakan bahan metabolik atau anestetikum (Wibowo 2001).
11
Anestesi diperlukan untuk ikan dalam sistem transportasi, kegiatan penelitian, diagnosa penyakit, penandaan ikan pada bagian kulit atau insang, pengambilan sampel darah dan proses pembedahan. Pada kegiatan penelitian, anestesi bertujuan untuk menurunkan seluruh aktivitas ikan untuk menghindari stress. Ikan dapat menyerap bahan anestesi melalui jaringan otot, saluran pencernaan dengan cara injeksi atau melalui insang. Anestesi melalui insang adalah cara yang ideal karena konsentrasi bahan anestesi yang digunakan dapat dikontrol dan stress dapat diminimalkan. Salinitas, suhu, pH, dan oksigen harus diperhitungkan dalam penggunaan bahan anestesi karena faktor-faktor ini dapat mempengaruhi aktivitas bahan anestesi, kecepatan metabolisme ikan, dan kemampuan ikan untuk menyerap bahan anestesi (Gunn 2000).
2.4 Acepromazine
Acepromazine tergolong phenothiazine yang berwarna kuning, tidak berbau, rasanya pahit dan berbentuk bubuk dan cair (Plumb 2008). Menurut Mckelvey dan Wayne (2003) ada tiga macam kelas sedasi (tranquilizer) yang umum digunakan dalam kedokteran hewan yaitu phenothiazine, benzodiazepine dan alpha-2 agonist. Golongan ini bekerja pada susunan syaraf pusat dan menghasilkan efek penenang pada hewan. Obat-obat ini dapat juga menyebabkan ataksia, dan prolapsus membran niktitan. Hanya alpha-2 agonist yang mempunyai efek analgesik, sedangkan yang lainnya tidak punya. Efektif pada berbagai spesies hewan dan dapat dikombinasikan dengan obat lainnya, misalnya atropin, opoid dan ketamin. Pemberian phenothiazine dapat melalui oral, intra muscular, intra vena dan sub kutan. Efek yang ditimbulkan golongan phenothiazine antara lain sedasi, antiemetik, antiaritmia, antihistamin, vasodilatasi pembuluh darah, perubahan perilaku dan prolapsus penis pada kuda. Efek samping acepromazine yaitu hipotensi, anemia dan dehidrasi. Pada kuda dan anjing ras boxer penggunaan acepromazine sebaiknya dihindari.
Acepromazine digunakan sebagai tranquilizer pada anjing, kucing dan kuda. Acepromazine bersifat anti-kholinergik, anti-emetik, antispasmodik, antihistamin, dan memblok alpha-adrenergik. Acepromazine menyebabkan hipotensi dan menurunkan vasomotorik. Dapat juga berpengaruh terhadap respirasi, denyut jantung dan suhu tubuh (Forney 2004).
12
Acepromazine adalah golongan phenothiazine neuroleptik yang mempunyai potensi untuk memblok post-sinapsis reseptor. Acepromazine mendepresi susunan syaraf pusat (CNS) sehingga menghasilkan efek sedasi, relaksasi otot, dan menurunkan aktifitas refleks. Selain itu efek lainnya adalah anti kholinergik, antihistamin dan memblok alpha-adrenergik. Acepromazine seperti golongan phenothiazine lainnya dimetabolisme di hati dan ekresinya melalui urin. Acepromazine digunakan sebagai agen preanestesi, sebagai pengontrol satwa liar, antiemetik pada anjing dan kucing dan sebagai tranquilizer pada kuda. Acepromazine akan lebih efektif apabila dikombinasikan dengan tranquilizer lainnya dan dengan senyawa yang mempunyai potensi sebagai anestesi general. Tranquilizer harus diberikan dalam dosis yang kecil selama anestesi general dan hewan yang lemah, hewan dengan penyakit jantung, hypovolemik atau shock. Acepromazine jangan digunakan pada hewan yang lemah, betina bunting, breed giant, greyhound, dan boxer. Hasil penelitian menyatakan pada hewan pengerat acepromazine menyebabkan embryotoxycity. Phenothiazine tidak boleh digunakan pada hewan yang mempunyai depresi tulang belakang (Crowell-Davis dan Murray 2005).
Crowell-Davis dan Murray (2005) menyatakan bahwa phenothiazine mendepresi sistem reticular aktif dan bagian otak yang mengontrol pergerakan tonus otot, tingkat metabolisme basal, dan keseimbangan hormonal. Efek samping pada cardiovascular adalah hipotensi, bradicardia, pembuluh darah kolaps, dan tachicardya. Acepromazine memiliki waktu onset 15 sampai dengan 60 menit setelah pemberian dan durasinya antara 3 sampai dengan 7 jam pada anjing dan kucing.
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Oktober 2011 sampai dengan Desember 2011. Tempat penelitian dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan, dan Laboratorium Lingkungan, Departemen Budidaya Perikanan, Institut Pertanian Bogor
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah ikan nila jantan, ikan nila betina, air dan acepromazine. Ikan yang digunakan pada penelitian ini berukuran kurang lebih 20-25 cm dengan bobot tubuh kurang lebih 200 gram. Alat yang digunakan adalah aquarium, 1 buah termometer, 1 unit pH meter, alat tulis, 1 unit spektrofotometer, DO meter, dan alat-alat gelas.
3.3 Metode Penelitian
Penelitian ini dibagi menjadi tiga tahap yaitu aklimatisasi ikan, pembuatan media pemingsanan, dan tahap pemingsanan ikan.
3.3.1 Aklimatisasi ikan
Aklimatisasi ikan dilakukan selama 1 minggu dengan menempatkan ikan-ikan tersebut pada akuarium yang bersuhu 26 sampai dengan 28 oC. Aklimatisasi ini dilakukan agar ikan-ikan nila percobaan dapat menyesuaikan dengan kondisi air yang digunakan dalam penelitian dan meminimalkan kesalahan yang disebabkan oleh faktor lingkungan.
3.3.2 Pembuatan media pemingsanan
Tahap selanjutnya yang dilakukan pada penelitian ini adalah pembuatan media pemingsanan. Konsentrasi acepromazine yang digunakan dalam penelitian ini yaitu 40 ppm dan 50 ppm dari volume air yang digunakan sebanyak 20 liter. Jumlah acepromazine yang digunakan untuk setiap perlakuannya dapat dihitung dengan rumus sebagai berikut :
14
Keterangan : X = jumlah acepromazine yang dipakai (mL) a = besar konsentrasi
Setelah jumlah acepromazine yang akan dipakai telah diperoleh, kemudian dilarutkan ke dalam 20 Liter air yang telah dipersiapkan di dalam akuarium yang akan digunakan dalam proses pemingsanan ikan.
3.3.3 Pemingsanan ikan
Sebanyak 5 ekor ikan pada tiap perlakuan dimasukkan ke dalam larutan anestetikum yang telah dibuat. Parameter yang diamati selama proses tersebut antara lain tingkah laku ikan, perubahan kualitas air yang diukur sewaktu ikan baru dimasukkan dan sesudah ikan pingsan, waktu onset (waktu yang dibutuhkan ikan hingga pingsan), waktu pulih sadar (waktu yang dibutuhkan ikan untuk sadar kembali), serta tingkat kelulusan hidup (survival rate) ikan. Tahapan ini dilakukan sebanyak tiga kali ulangan.
Parameter kualitas air yang diamati meliputi derajat keasaman (pH), oksigen terlarut (DO), dan kadar total amoniak nitrogen (TAN).
a) Derajat keasaman (pH) (Rand et al. 1975)
Perubahan pH pada suatu perairan dapat menyebabkan stres pada ikan. Kemampuan air menahan perubahan pH yang terjadi sangatlah penting bagi kelangsungan hidup ikan. Kemampuan kapasitas buffer perairan ini berhubungan dengan adanya karbonat, bikarbonat, dan hidroksida. Air dengan kesadahan rendah memiliki kemampuan yang rendah dalam menahan keasaman (Shepherd 1992). Pengaruh pH terhadap ikan disajikan dalam Tabel 2.
Tabel 2 Pengaruh perubahan pH terhadap ikan Kisaran pH Pengaruh terhadap ikan
< 4,0 Titik mati asam 4,0 – 5,0 Tidak ada reproduksi 5,0 – 6,5 Pertumbuhan lambat
6,5 – 9,0 Kisaran yang layak untuk reproduksi > 9,0 Titik mati basa
15
Derajat keasaman (pH) air diukur dengan melakukan pembacaan skala mengunakan pH meter.
b) Oksigen terlarut (DO) (Rand et al. 1975)
Konsentrasi DO merupakan salah satu parameter kualitas air yang penting bagi kelangsungan hidup lobster air tawar. Penurunan kadar oksigen dalam air merupakan penyebab kematian kematian ikan secara mendadak dalam jumlah besar. Rust (2000) menyatakan bahwa oksigen dibutuhkan untuk mempertahankan kesehatan ikan dan sebagai fasilitator proses oksidatif kimiawi. Jika konsentrasi DO yang sesua tidak dipertahankan, ikan akan mengalami stres dan mati. Kisaran nilai konsentrasi DO dan pengaruhnya terhadap kehidupan ikan disajikan dalam Tabel 3.
Tabel 3 Kisaran nilai konsentrasi DO dan pengaruhnya pada ikan Kisaran DO (mg/L) Kondisi ikan
0,0 – 0,3 Ikan kecil hidup untuk beberapa saat 0,3 – 1,0 Mematikan dalam jangka waktu yang lama 1,0 – 5,0 Ikan hidup tapi pertumbuhan lambat bila terjadi
dalam jangka waktu yang lama > 5,0 Baik untuk pertumbuhan
Sumber: Swingle (1969) dalam Boyd (1990)
Oksigen terlarut (DO) diukur menggunakan DO meter. Nilai DO yang terukur dari sampel air uji dapat diketahui melalui pembacaan skala. Metode pengukuran oksigen terlarut dengan menggunakan DO meter adalah sebagai berikut: DO meter dikalibrasi terlebih dahulu dengan air dari hasil analisis metode Winkler, kemudian DO-meter nilainya dibuat nol. Air uji sebanayak 100 ml dimasukkan ke dalam gelas piala 125 ml, ke dalam gelas piala ditambahkan stirer magnetik, gelas piala tersebut selanjutnya diletakkan di atas stirer. Stik/batang DO meter dicelupkan ke dalam air uji tersebut. Stirer dan DO meter kemudian dinyalakan secara bersamaan untuk mengetahui kadar DO pada air uji.
c) Amonia (Rand et al. 1975)
Sumber utama amonia di lingkungan perairan adalah metabolisme ikan, eksresi ikan, pemupukan dan dekomposisi mikrobial dari komponen nitrogen (Boyd 1990). Ketika amonia memasuki perairan, ion hidrogen
16
langsung bereaksi kemudian mengubah amonia ke dalam suatu kondisi kesetimbangan antara ion amonium yang tidak beracun (NH4+) dan amonia
tidak terionisasi (NH3) yang beracun. Total amoniak nitrogen (TAN) diukur
menggunakan alat spektrofotometer dengan metode sebagai berikut: air uji dipipet sebanyak 25 ml dan dimasukkan ke dalam gelas beker 100 ml. Larutan standar NH4Cl sebanyak 25 ml disiapkan dari larutan standar
amoniak. Blanko dibuat dengan menggunakan 25 ml akuades. Satu tetes MnSO4, 0,5 ml chlorox, dan 0,6 ml reagen fenat ditambahkan ke dalam
larutan standar, air uji, dan blanko sampai warna biru kehijauan kemudian dibiarkan sampai 15 menit. Spektrofotometer diatur pada absorbansi 0 dan panjang gelombang 630 nm menggunakan larutan blanko. Konsentrasi amoniak (TAN) pada air uji dihitung menggunakan rumus:
Mg NH3/L
Keterangan:
C : konsentrasi larutan standar (0,30 mg/L) Abs sampel : nilai absorbance larutan sampel
Abs standar : nilai absorbance larutan standar
3.4 Analisis Data
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak kelompok faktorial. Percobaan menggunakan software SPSS. Rancangan acak kelompok faktorial pada penelitian ini memiliki dua jenis perlakuan, yaitu pembedaan jenis kelamin (jantan, betina, dan campuran) dan pemberian acepromazine dengan konsentrasi berbeda (40 ppm, 50 ppm, dan 60 ppm) dimana masing-masing perlakuan terdiri dari tiga kali ulangan.
Model matematika rancangan acak kelompok faktorial tersebut adalah.
yijk = µ + Xi +Z j + (XZ) ij + εijk Keterangan :
yijk = respon pengaruh konsentrasi ke-i, jenis kelamin ke-j, dan ulangan ke-k
µ = nilai rata-rata umum
17
Zj = pengaruh konsentrasi ke -j
(XZ)ij = pengaruh interaksi antara jenis kelamin dan konsentrasi εijk = pengaruh galat percobaan
Apabila hasil analisis menunjukkan pengaruh yang nyata maka akan dilakukan uji lanjutan dengan menggunakan uji lanjut Tukey.
Bentuk hipotesis yang diuji sebagai berikut :
• Pengaruh pembedaan jenis kelamin terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup.
H0 : Jenis kelamin tidak mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan.
H1 : Jenis kelamin mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan.
• Pengaruh konsentrasi acepromazine terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup.
H0 : Perbedaan konsentrasi tidak mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan.
H1 : Perbedaan konsentrasi mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan. • Pengaruh interaksi pembedaan jenis kelamin dan konsentrasi acepromazine
terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup
H0 : Interaksi antara pembedaan jenis kelamin dan konsentrasi tidak mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan.
H1 : Interaksi antara pembedaan jenis kelamin dan konsentrasi mempunyai pengaruh signifikan terhadap waktu onset, waktu pulih sadar, dan tingkat kelulusan hidup ikan.
4 HASIL DAN PEMBAHASAN
4.1 Pengamatan Tingkah Laku Ikan Selama Proses Pemingsanan
Pengamatan terhadap perubahan tingkah laku ikan selama proses pemingsanan dilakukan setiap 15 menit dengan percobaan trial and run yang dimulai dari menit ke-0 sampai ikan tidak sadar (pingsan). Deret perlakuan yang dilakukan adalah ikan nila jantan pada konsentrasi acepromazine 40 ppm, 50 ppm, dan 60 ppm; ikan nila betina pada konsentrasi acepromazine 40 ppm, 50 ppm, dan 60 ppm; serta campuran ikan nila jantan dan ikan nila betina pada konsentrasi 40 ppm, 50 ppm, dan 60 ppm. Hasil pengamatan terhadap perubahan tingkah laku ikan pada tiap-tiap perlakuan dapat dilihat pada Tabel 4.
Tabel 4 Pengamatan tingkah laku ikan selama proses pemingsanan
Perlakuan Waktu Pengamatan
0-15 15-30 30-45 45-60 60-75 75-90 A Posisi tubuh tegak, gerakan operkulum normal, sesekali diam di dasar, respon terhadap rangsangan luar tinggi Posisi tubuh tegak, sirip punggung meregang, gerakan operkulum mulai melemah, dan sebagian ikan memasuki fase light sedation Ikan mulai kehilangan keseimbangan, mulut disembulkan ke permukaan, posisi tubuh rebah, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (57,57,62) B Posisi tubuh tegak, gerakan operkulum normal, mulut sesekali disembulkan ke permukaan, sebagian ikan memasuki fase light sedation Posisi tubuh agak miring, mulut sesekali disembulkan ke permukaan, respon terhadap rangsangan luar lambat, sebagian ikan masuk ke fase deep sedation Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (47,50,480 C Posisi tubuh agak miring, mulut sesekali disembulkan ke Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan Pingsan (40,39,36)
19
Tabel 4 Pengamatan tingkah laku ikan selama proses pemingsanan (lanjutan) permukaan, sebagian ikan memasuki fase deep sedation tetapi jarang dan lemah Pingsan (40,39,36) D Posisi tubuh tegak, gerakan operkulum normal, sesekali diam di dasar, respon terhadap rangsangan luar tinggi Posisi tubuh agak miring, sirip punggung meregang, gerakan operkulum melemah dan sebagian ikan memasuki fase light sedation Ikan mulai kehilangan keseimbangan, mulut disembulkan ke permukaan, posisi tubuh rebah, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (73,74) Pingsan (u1=76) E Posisi tubuh tegak, gerakan operkulum normal, sesekali diamdi dasar, respon terhadap rangsangan luar tinggi Posisi tubuh agak miring, sirip punggung meregang, gerakan operkulum melemah dan sebagian ikan memasuki fase light sedation Ikan mulai kehilangan keseimbangan, mulut disembulkan ke permukaan, posisi tubuh rebah, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (67,68,64) F Posisi tubuh agak miring, sirip punggung meregang, gerakan operkulum melemah dan sebagian ikan memasuki fase light sedation Posisi tubuh miring, mulut sesekali disembulkan ke permukaan, respon terhadap rangsangan luar lambat, sebagian ikan masuk ke fase deep sedation Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (54,57,55) G Posisi tubuh tegak, gerakan operkulum normal, sesekali diam di dasar, respon terhadap rangsangan luar tinggi Posisi tubuh agak miring, sirip punggung meregang, gerakan operkulum melemah dan sebagian ikan memasuki fase light sedation Ikan mulai kehilangan keseimbangan, mulut disembulkan ke permukaan, posisi tubuh rebah, respon terhadap rangsangan luar lambat Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah
Pingsan (63,68,72)
20
Tabel 4 Pengamatan tingkah laku ikan selama proses pemingsanan (lanjutan)
H Posisi tubuh agak miring, gerakan operkulum normal, mulut sesekali disembulkan ke permukaan, sebagian ikan memasuki fase light sedation Posisi tubuh miring, mulut sesekali disembulkan ke permukaan, respon terhadap rangsangan luar lambat, sebagian ikan masuk ke fase deep sedation
Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi jarang dan lemah Pingsan (57,55,58) I Posisi tubuh miring, mulut sesekali disembulkan ke permukaan, respon terhadap rangsangan luar lambat, sebagian ikan masuk ke fase deep sedation Ikan kehilangan keseimbangan, posisi tubuh terbalik, masih ada gerakan tetapi
jarang dan lemah Pingsan (u3=42)
Pingsan (u1=47,u2=54)
Keterangan :
A = Ikan nila betina dengan pemberian acepromazine 40 ppm B = Ikan nila betina dengan pemberian acepromazine 50 ppm C = Ikan nila betina dengan pemberian acepromazine 60 ppm D = Ikan nila jantan dengan pemberian acepromazine 40 ppm E = Ikan nila jantan dengan pemberian acepromazine 50 ppm F = Ikan nila jantan dengan pemberian acepromazine 60 ppm
G = Campuran ikan nila jantan dan betina dengan pemberian acepromazine 40 ppm H = Campuran ikan nila jantan dan betina dengan pemberian acepromazine 50 ppm I = Campuran ikan nila jantan dan betina dengan pemberian acepromazine 60 ppm
Hasil pengamatan pada Tabel 4 menunjukkan pemberian konsentrasi uji 40 ppm memberikan pengaruh yang lambat terhadap aktivitas ikan uji. Hal ini dapat terlihat dari lamanya waktu yang dibutuhkan oleh ikan uji hingga mencapai tahap pingsan. Perubahan aktivitas ikan uji mulai terlihat pada menit ke-30 hingga menit ke-45. Pada rentang waktu ini ikan uji mulai kehilangan keseimbangan, mulut sering disembulkan ke permukaan, posisi tubuh mulai rebah dan kurang responsif terhadap rangsangan dari luar. Pada penggunaan konsentrasi uji 40 ppm ikan uji tanpa pembedaan jenis kelamin memasuki tahap pingsan masing-masing pada menit ke-63, 68, dan 72. Ikan uji betina memasuki tahap pingsan masing-masing untuk tiap ulangan adalah pada menit ke-57, 57, dan 62, sedangkan ikan uji jantan memasuki tahap pingsan masing-masing pada menit ke-76, 73 , dan 74.
21
Pengujian dengan konsentrasi 50 ppm mulai memberikan pengaruh terhadap ikan uji pada menit ke-30. Pengaruh yang diberikan tersebut dilihat dari gerakan operkulum yang mulai melemah, sirip punggung yang meregang, sesekali mulut disembulkan ke permukaan serta sebagian ikan memasuki fase light sedation dan deep sedation. Pada penggunaan konsentrasi uji 50 ppm ikan uji tanpa pembedaan jenis kelamin memasuki tahap pingsan masing-masing pada menit ke-57, 55, dan 58. Ikan uji betina memasuki tahap pingsan masing-masing untuk tiap ulangan adalah pada menit ke-47, 50, dan 48, sedangkan ikan uji jantan memasuki tahap pingsan masing-masing pada menit ke-67, 68 , dan 64.
Pengujian dengan konsentrasi 60 ppm mulai memberikan pengaruh terhadap ikan uji pada menit ke- 15. Pengaruh yang diberikan tersebut dilihat dari gerakan operkulum yang mulai melemah, sirip punggung yang meregang, sesekali mulut disembulkan ke permukaan serta sebagian ikan memasuki fase light sedation dan deep sedation. Pada penggunaan konsentrasi uji 60 ppm ikan uji tanpa pembedaan jenis kelamin memasuki tahap pingsan masing-masing pada menit ke-47, 54, dan 42. Ikan uji betina memasuki tahap pingsan masing-masing untuk tiap ulangan adalah pada menit ke-40, 39, dan 36, sedangkan ikan uji jantan memasuki tahap pingsan masing-masing pada menit ke-54, 57 , dan 55.
4.2 Waktu Onset Pemingsanan
Waktu onset adalah waktu yang dibutuhkan untuk mencapai suatu keadaan dimana status hewan uji kehilangan kesadaran (Mckelvey dan Hollingshead 2003). Pencatatan waktu onset pemingsanan ikan nila dilakukan mulai dari kondisi normal sampai kondisi pingsan. Pencatatan ini bertujuan untuk melihat pengaruh penambahan acepromazine terhadap waktu yang dibutuhkan ikan nilai hingga pingsan.
Hipotesis awal pada parameter ini adalah bahwa pemberian berbedaan konsentrasi acepromazine tidak berpengaruh terhadap waktu onset yang dibutuhkan oleh ikan nila hingga pingsan. Sebaliknya, hipotesis pembandingnya adalah perbedaan konsentrasi acepromazine memberikan pengaruh terhadap waktu onset pemingsanan. Hasil pengamatan terhadap waktu onset pada penelitian ini dapat dilihat pada Gambar 3.
22
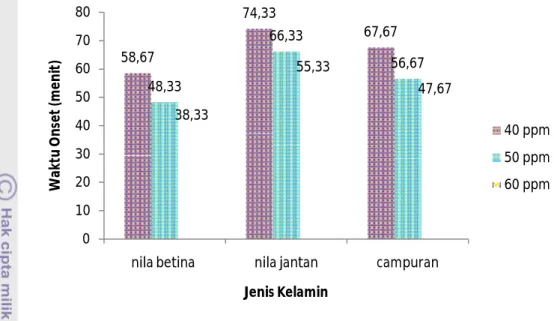
Gambar 3 Grafik pengaruh perlakuan terhadap waktu onset
Grafik di atas menunjukkan bahwa pembedaan jenis kelamin ikan uji dan perbedaan konsentrasi acepromazine yang digunakan menyebabkan waktu onset yang berbeda-beda. Namun, interaksi antara pembedaan jenis kelamin dan perbedaan konsentrasi acepromazine tidak memberikan pengaruh yang berbeda nyata terhadap waktu onset ikan uji. Waktu onset paling cepat ditunjukkan oleh ikan nila betina dengan pemberian acepromazine sebesar 60 ppm, yaitu selama 38,33 menit. Waktu onset paling lama ditunjukkan oleh ikan nila jantan dengan pemberian acepromazine sebesar 40 ppm, yaitu sebesar 74,33 menit.
Waktu onset yang didapatkan selanjutnya dianalisis dengan menggunakan metode Rancangan Acak Faktorial (RAF). Berdasarkan analisis data dengan menggunakan metode RAF, pada selang kepercayaan 95% menunjukkan bahwa pembedaan jenis kelamin dan perbedaan konsentrasi acepromazine memberikan pengaruh yang nyata terhadap waktu onset ikan uji. Hasil analisis ini selanjutnya diuji lebih lanjut dengan menggunakan metode Tukey, yang hasilnya disajikan pada Lampiran 1.
Berdasarkan uji lanjut dengan menggunakan metode Tukey (α =0,05) dapat dilihat bahwa pembedaan jenis kelamin memberikan pengaruh yang berbeda nyata terhadap waktu onset ikan uji. Hal ini dapat dilihat dari perbedaan waktu onset yang tercatat antara ikan nila jantan dan ikan nila betina, dimana ikan jantan memiliki waktu onset yang lebih lama dibandingkan dengan ikan betina. Hal ini
58,67 74,33 67,67 48,33 66,33 56,67 38,33 55,33 47,67 0 10 20 30 40 50 60 70 80
nila betina nila jantan campuran
W ak tu O n se t (m e n it ) Jenis Kelamin 40 ppm 50 ppm 60 ppm
23
diduga berkaitan dengan berkaitan dengan sifat dari acepromazine yang mudah terlarut atau terabsorbsi pada lemak (Crowell-Davis dan Murray 2005), sehingga ikan yang mempunyai kandungan lemak yang tinggi akan lebih mudah teranestesi. Sebagaimana diketahui, pada umumnya ikan betina memiliki kandungan lemak yang lebih tinggi karena mengandung telur di dalam perutnya. Secara substansial, telur ikan terdiri atas tiga bentuk yaitu : kantung kuning telur (yolk vesicle), butiran kuning telur (yolk globule) dan tetesan minyak (oil droplet). Kantung kuning telur berisi glikoprotein dan pada perkembangan selanjutnya, menjadi kortikal alveoli. Butir-butir kuning telur terdiri atas lipoprotein, karbohidrat dan karoten. Oil droplet secara umum terdiri atas gliserol dan sejumlah kecil kolesterol (Sunarma et al. 2002). Ikan betina yang digunakan pada penelitian ini dapat diperkirakan memiliki kandungan lemak yang lebih tinggi karena sedang mengandung telur di dalam perutnya.
Pemberian konsentrasi yang berbeda juga memberikan pengaruh yang berbeda nyata terhadap waktu onset ikan uji. Semakin besar konsentrasi uji yang diberikan maka semakin cepat waktu onset ikan uji. Secara berurutan dari waktu onset yang paling cepat hingga paling lama adalah konsentrasi uji 60 ppm, 50 ppm, dan 40 ppm. Acepromazine adalah golongan phenothiazine neuroleptik yang mempunyai potensi untuk memblok post-sinapsis reseptor. Acepromazine mendepresi susunan syaraf pusat (CNS) sehingga menghasilkan efek sedasi, relaksasi otot, dan menurunkan aktifitas refleks.
Pengujian terhadap waktu onset akibat pemberian acepromazine pada penelitian ini dapat disimpulkan kurang memuaskan karena waktu onset yang dibutuhkan ikan hingga pingsan cukup lama. Menurut Gunn (2000), anestesi yang ideal adalah anestesi yang mampu memingsankan ikan kurang dari tiga menit. Lamanya waktu yang dibutuhkan konsentrasi uji untuk memberikan pengaruh terhadap aktivitas ikan uji diduga karena konsentrasi uji yang diberikan belum cukup untuk mempengaruhi keseimbangan fungsi saraf dan jaringan otak ikan uji. Di samping itu, ikan nila termasuk ikan air tawar yang memiliki kisaran toleransi yang cukup tinggi terhadap perubahan lingkungan perairannya, yakni pH air yang sangat rendah, kadar salinitas yang tinggi, dan kandungan oksigen perairan yang rendah (Arie 2000).
24
4.3 Waktu Pulih Sadar
Waktu pulih sadar ditentukan untuk mengetahui lamanya waktu yang dibutuhkan ikan uji untuk kembali ke dalam kondisi normal setelah proses pemingsanan. Penentuan waktu pulih sadar dilakukan mulai dari ikan uji yang pingsan dimasukkan ke dalam wadah yang berisi air mengalir atau air bersih yang diberi aerasi hingga ikan sadar dan kembali ke kondisi normal. Pengamatan terhadap waktu pulih sadar ikan uji dapat dilihat pada Gambar 4.
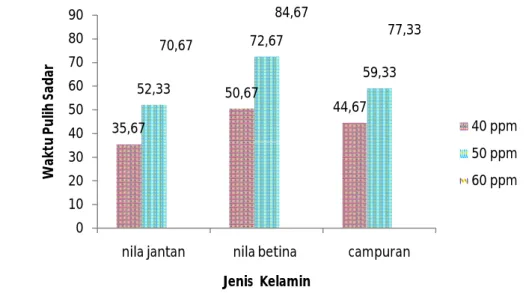
Gambar 4 Grafik pengaruh perlakuan terhadap waktu pulih sadar
Grafik di atas menunjukkan bahwa pembedaan jenis kelamin ikan uji dan perbedaan konsentrasi acepromazine yang digunakan menyebabkan waktu pulih sadar yang berbeda-beda. Namun, interaksi antara pembedaan jenis kelamin dan perbedaan konsentrasi acepromazine tidak memberikan pengaruh yang berbeda nyata terhadap waktu pulih sadar ikan uji. Waktu pulih sadar paling lama ditunjukkan oleh ikan nila betina dengan pemberian acepromazine sebesar 60 ppm, yaitu selama 84,67 menit. Waktu pulih sadar paling cepat ditunjukkan oleh ikan nila jantan dengan pemberian acepromazine sebesar 40 ppm, yaitu sebesar 35,67 menit.
Waktu pulih sadar yang didapatkan selanjutnya dianalisis dengan menggunakan metode Rancangan Acak Faktorial (RAF). Berdasarkan analisis data dengan menggunakan metode RAF, pada selang kepercayaan 95% menunjukkan bahwa pembedaan jenis kelamin dan perbedaan konsentrasi
35,67 50,67 44,67 52,33 72,67 59,33 70,67 84,67 77,33 0 10 20 30 40 50 60 70 80 90
nila jantan nila betina campuran
W ak tu P u lih S ad ar Jenis Kelamin 40 ppm 50 ppm 60 ppm
25
acepromazine memberikan pengaruh yang nyata terhadap waktu pulih sadar ikan uji. Hasil analisis ini selanjutnya diuji lebih lanjut dengan menggunakan metode Tukey, yang hasilnya disajikan pada Lampiran 2.
Berdasarkan uji lanjut dengan menggunakan metode Tukey (α =0,05) dapat dilihat bahwa pembedaan jenis kelamin memberikan pengaruh yang berbeda nyata terhadap waktu pulih sadar ikan uji, dimana ikan betina memiliki waktu pulih sadar yang lebih lama dibandingkan dengan ikan jantan. Kandungan lemak yang terkandung dalam tubuh ikan uji diduga mempengaruhi waktu pulih sadar yang dibutuhkan untuk kembali ke kondisi normal. Hal ini berkaitan dengan berkaitan dengan sifat dari acepromazine yang mudah terlarut atau terabsorbsi pada lemak (Crowell-Davis dan Murray 2005). Sebagaimana yang telah dibahas sebelumnya, ikan betina yang digunakan pada penelitian ini memiliki kandungan lemak yang lebih tinggi dibandingkan ikan jantan, sehingga ikan betina akan lebih banyak mengakumulasi acepromazine yang diberikan di dalam tubuhnya. Dengan demikian, ikan betina akan membutuhkan waktu yang lebih lama untuk kembali ke kondisi normal karena jumlah bahan anestesi yang berada di dalam sistem peredaran darahnya lebih banyak.
Pemberian konsentrasi yang berbeda juga memberikan pengaruh yang berbeda nyata terhadap waktu pulih sadar ikan uji. Semakin besar konsentrasi acepromazine yang diberikan maka semakin lama waktu pulih sadar ikan uji, karena semakin besar konsentrasi yang diberikan maka akan semakin besar jumlah bahan aktif yang berada pada sistem peredaran darah sehingga membutuhkan waktu yang lebih lama untuk bisa kembali ke kondisi normal.
4.4 Tingkat Kelulusan Hidup (Survival Rate) Ikan
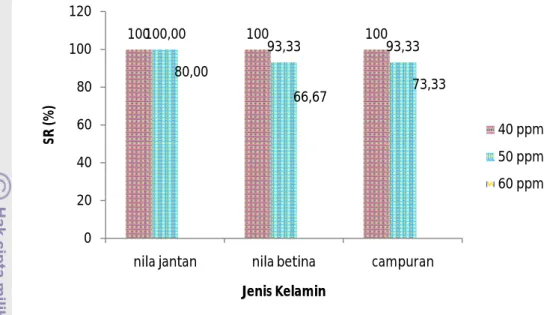
Pengujian terhadap tingkat kelulusan hidup atau survival rate (SR) pada penelitian ini dilakukan dengan tujuan untuk mengetahui efektifitas dari penggunaan acepromazine sebagai bahan anestesi dan mengetahui konsentrasi optimum yang sebaiknya digunakan pada proses imotilisasi ikan untuk kemudian diterapkan pada sistem transportasi ikan. Pengujian terhadap tingkat kelulusan hidup juga penting dilakukan untuk mengetahui konsentrasi uji mana yang menyebabkan tingginya kematian pada ikan uji. Pengujian terhadap nilai SR dapat dilihat pada Gambar 5.
26
Gambar 5 Grafik pengaruh perlakuan terhadap nilai SR
Berdasarkan pengujian dengan menggunakan metode RAF (Lampiran 3), pada selang kepercayaan 95%, pengaruh yang berbeda nyata terhadap nilai SR dihasilkan oleh pemberian acepromazine dengan konsentrasi yang berbeda sehingga dilakukan uji lanjut dengan menggunakan metode Tukey (Lampiran 3). Pembedaan jenis kelamin dan interaksi antara pembedaan jenis kelamin dengan perbedaan konsentrasi acepromazine tidak memberikan pengaruh yang berbeda nyata terhadap nilai SR ikan uji, sehingga tidak perlu dilakukan uji lanjut.
Hasil pengujian dengan metode Tukey menunjukkan bahwa pengaruh berbeda nyata ditunjukkan antara konsentrasi 60 ppm dengan 50 ppm, serta antara 60 ppm dengan 40 ppm. Sedangkan pemberian acepromazine dengan konsentrasi 40 ppm dan 50 ppm tidak memberikan pengaruh berbeda nyata terhadap nilai SR ikan uji. Tingkat kematian yang tinggi pada pemberian acepromazine dengan konsentrasi 60 ppm diduga bahwa ikan uji tidak mampu lagi mentolerir banyaknya zat anestesi yang masuk ke dalam tubuhnya pada konsentrasi tersebut. Menurut Mckelvey dan Hollingshead (2003), efek samping dari penggunaan acepromazine yang berlebihan yaitu hipotensi, anemia dan dehidrasi. Acepromazine juga dapat berpengaruh terhadap respirasi, denyut jantung dan suhu tubuh (Forney 2004). Besar kemungkinan jika berbagai efek samping tersebut tidak segera ditangani akan menimbulkan kematian pada hewan uji.
100100,00 100 100 93,33 93,33 80,00 66,67 73,33 0 20 40 60 80 100 120
nila jantan nila betina campuran
SR (% ) Jenis Kelamin 40 ppm 50 ppm 60 ppm
27
4.5 Analisis Kualitas Air
Proses transportasi ikan hidup berbeda dari ternak teresterial, dimana untuk ikan harus disediakan sistem pendukung kehidupan selama proses transportasi tersebut dilakukan. Dalam hal ini, pengelolaan kualitas air yang digunakan sangat penting dilakukan untuk membatasi terjadinya akumilasi metabolit yang berbahaya (King 2009). Peningkatan kadar CO2 selama proses transportasi akan meningkatkan kadar asam karbonat yang kemudian akan menurunkan nilai pH air (Ali et al. 1989). Pengujian kualitas air yang dilakukan pada penelitian ini bertujuan untuk mengetahui karakteristik kimia fisik air baik sebelum maupun setelah proses pemingsanan. Parameter kualitas air yang diuji pada penelitian ini adalah oksigen terlarut (DO), pH, dan total amoniak nitrogern (TAN). Hasil pengujian kualitas air pada penelitian ini dapat dilihat pada Tabel 5.
Tabel 5 Hasil pengujian kualitas air
Perlakuan
Parameter Uji
DO pH TAN
Sebelum Sesudah Sebelum Sesudah Sebelum Sesudah 40 ppm Jantan 5,21±0,02 5,17±0,011 7,16±0,032 7,09±0,01 0,217±0,017 0,276±0,02 Betina 5,21±0,02 5,16±0,043 7,16±0,032 7,08±0,017 0,217±0,017 0,274±0,032 Campuran 5,21±0,02 5,16±0,026 7,16±0,032 7,09±0,032 0,217±0,017 0,276±0,032 50 ppm Jantan 5,19±0,02 5,12±0,043 7,13±0,02 7,07±0,043 0,219±0,032 0,275±0,026 Betina 5,19±0,02 5,14±0,02 7,13±0,02 7,07±0,043 0,219±0,032 0,272±0,01 Campuran 5,19±0,02 5,11±0,026 7,13±0,02 7,06±0,02 0,219±0,032 0,273±0,017 60 ppm Jantan 5,18±0,032 5,06±0,036 7,11±0,043 7,02±0,026 0,215±0,026 0,274±0,032 Betina 5,18±0,032 5,04±0,01 7,11±0,043 7,04±-,026 0,215±0,026 0,271±0,043 Campuran 5,18±0,032 5,03±0,017 7,11±0,043 7,04±0,01 0,215±0,026 0,273±0,043
Pada Tabel 5 di atas, dapat dilihat perubahan kualitas air sebelum dan sesudah dilakukan pemingsanan. Sebelum dilakukan pemingsanan, kadar DO air terukur pada kisaran 5,18-5,21; pH 7,11-7,18; dan kadar TAN 0,215-0,217. Sesudah dilakukan pemingsanan, kadar air terukur pada kisaran 5,03-5,17; pH 7,04-7,09; dan TAN 0,276-0,327. Kisaran perubahan kualitas air tersebut masih dalam ambang batas yang layak untuk kelangsungan hidup ikan nila. Menurut Arie (2000), kualitas perairan yang baik bagi ikan nila untuk dapat hidup secara alami adalah kadar DO minimal 4 mg/L air, pH 4-11, dan kadar TAN 0,23-1,04
28
ppm. Perubahan kualitas air yang tidak signifikan ini juga menunjukkan bahwa penyebab ikan nila pingsan adalah penambahan acepromazine sebagai zat anestesi, bukan diakibatkan oleh perubahan kualitas air.
Perubahan kualitas air yang signifikan pada proses transportasi dapat ditekan dengan memuasakan ikan terlebih dahulu. Ikan yang dipuasakan akan tidak akan banyak melakukan metabolisme dan mengeluarkan kotoran dalam jumlah yang sedikit. Kadar amonia dalam air selama proses transportasi dapat dikurangi dengan cara menggunakan air dengan kadar pH dan suhu yang rendah (Colt dan Tchobanoglosus 1976).
5 KESIMPULAN DAN SARAN
5.1 Kesimpulan
Perlakuan pembedaan jenis kelamin dan perbedaan konsentrasi acepromazine yang diberikan dalam proses pemingsanan ikan nila memberikan pengaruh yang berbeda nyata terhadap waktu onset dan waktu pulih sadar ikan nila. Pada parameter tingkat kelulusan hidup, hanya perlakuan penambahan acepromazine dengan berbagai konsentrasi yang memberi pengaruh yang berbeda nyata. Interaksi antara kedua perlakuan tersebut tidak memberi pengaruh yang nyata terhadap parameter yang diujikan.
Ikan nila jantan memiliki waktu onset yang lebih lama dibandingkan ikan nila betina, sedangkan ikan nila betina memiliki waktu pulih sadar yang lebih lama dibandingkan ikan nila jantan. Hal ini diduga disebabkan oleh kandungan lemak yang dimiliki ikan nila betina lebih tinggi dibandingkan ikan nila jantan, sehingga ikan nila betina lebih cepat pingsan namun membutuhkan waktu yang lebih lama untuk kembali ke kondisi normal.
Konsentrasi acepromazine yang optimal yang dapat digunakan sebagai zat anestesi ikan nila adalah 50 ppm dengan tingkat kelulusan hidup rata-rata 95,55%; waktu onset rata-rata 57,11 menit; dan waktu pulih sadar rata-rata 61,44 menit.
Berdasarkan hasil penelitian ini, dapat direkomendasikan bahwa pembedaan jenis kelamin antara ikan jantan dan ikan betina diperlukan pada saat akan dilakukan proses transportasi sistem kering dimana ikan dalam kondisi pingsan (teranestesi).
5.2 Saran
Perlu dilakukan penelitian lebih lanjut berupa simulasi transportasi sistem kering untuk mengkaji lebih dalam lagi mengenai efektifitas penggunaan acepromazine sebagai zat anestesi. Selain itu, perlu juga dilakukan pengujian mengenai ketahanan ikan terhadap acepromazine dan kemungkinan adanya residu acepromazine yang terkandung di dalam daging ikan uji berkaitan dengan rasa pahit dari acepromazine.