SELEKSI SOYBEAN MOSAIC VIRUS ISOLAT LEMAH
PADA TANAMAN KEDELAI
Wuye Ria Andayanie
Fakultas Pertanian, Universitas Merdeka Madiun, Jln. Serayu Madiun. Telp (0351)-495551 ABSTRAK
Soybean mosaic virus (SMV) merupakan salah satu genus dari famili Potyviridae yang menimbulkan kerusakan pada tanaman kedelai di Indonesia. Penelitian ini bertujuan untuk memperoleh isolat lemah SMV dari tanaman kedelai. Pencarian isolat lemah dilakukan dengan mencari tanaman kedelai bergejala ringan atau tidak bergejala sama sekali dari lahan dengan intensitas penyakit mosaik yang tinggi. Tanaman selanjutnya diuji dengan Indirect ELISA (I-ELISA), PCR menggunakan pasangan primer Cylindrical Inclusion (CI), dan pengamatan mikroskop elektron. Dari hasil penelitian didapatkan dua isolat lemah SMV. Ketahanan yang terimbas terhadap strain SMV virulen berkembang pada tanaman melalui infeksi sistemik isolat lemah SMV.
Kata kunci: Soybean mosaic virus (SMV), isolat lemah, kedelai
ABSTRACT
The selection of mild isolates of soybean mosaic virus on soybean. Soybean
mosaic virus (SMV) is a genus from Potyviridae family causing serious damage on soybean plants in Indonesia. The aim of this research was to obtain mild isolates of SMV from soybean plants. The investigation of mild isolates was carried out by examination of soybean plants with either slight symptoms or no mosaic symptoms from areas with high intensity of mosaic diseases. The plants were then tested with Indirect ELISA (I-ELISA), PCR with primer pairs of Cylindrical Inclusion (CI), and electron microscopy observation. The result showed that two mild isolates of SMV were obtained. This study suggested that induced resistance against virulence SMV developed in plants through systemic infection of the mild SMV isolates.
Keywords: Soybean mosaic virus (SMV), mild isolate, soybean
PENDAHULUAN
Penyakit mosaik merupakan salah satu kendala bagi peningkatan produksi kedelai. Penyakit ini disebabkan oleh Soybean mosaic virus (SMV) dan Cowpea mild mottle virus (CMMV). Intensitas penyakit mosaik yang bervariasi 13,4−35,3% pada 3−6 MST di Kabupaten Ngawi, Magetan, Ponorogo, dan Madiun disebabkan oleh perbedaan intensitas penyakit awal (X0). Penyakit mosaik kedelai yang terbawa benih di lokasi tersebut adalah
SMV (Andayanie et al. 2011). Penyakit CMMV ditemukan pada kulit biji (Horn et al. 1991). Pengujian dengan DAS ELISA menunjukkan 800 biji dari tanaman terinfeksi CMMV bereaksi negatif dan tidak menghasilkan gejala pada tanaman setelah biji ditanam, bergantung pada strain virus tersebut (Tavasoli et al. 2009). Salah satu usaha mendapatkan tanaman kedelai yang tahan terhadap SMV adalah dengan strain lemah SMV (Andayanie 2012b). Strain lemah SMV juga diteliti untuk perlindungan silang (cross
protection) terhadap SMV strain ganas di Jepang (Kosaka & Fukunishi 1993). Strain lemah ini menyebabkan gejala ringan atau tidak bergejala di antara tanaman bergejala
daun yang paling muda dengan warna hijau gelap di sepanjang tulang, daun melepuh dengan warna hijau tua dan melengkung ke dalam dan ke luar, pemucatan tulang daun, mosaik sepanjang tulang daun (Andayanie 2012a). Di Indonesia sampai saat ini belum ada
varietas kedelai yang tahan terhadap SMV.
Penelitian ini bertujuan untuk memperoleh isolat lemah SMV dari tanaman kedelai. Isolat tersebut akan sangat berguna untuk merakit varietas kedelai yang tahan terhadap SMV strain ganas dengan perlindungan silang.
BAHAN DAN METODE
Penelitian lapangan dilakukan dengan cara survei di Desa Jenggrik, Kecamatan Ke-dunggalar, Kabupaten Ngawi, Jawa Timur. Daerah tersebut banyak ditemukan tanaman bergejala mosaik yang parah. Penelitian laboratorium dilakukan di laboratorium Genetika Fakultas Pertanian Universitas Gadjah Mada (UGM), Yogyakarta, dan laboratorium mikroskop elektron Unvesitas Airlangga (UNAIR), Surabaya. Bahan yang digunakan ada-lah tanaman kedelai dengan gejala ringan atau tidak bergejala.
1. Pengamatan Gejala pada Tanaman Tahan
Tanaman yang digunakan untuk seleksi isolat lemah adalah kedelai berumur 4 minggu dengan gejala penyakit mosaik yang ringan dan tidak bergejala. Tanaman tersebut diperoleh dari lahan dengan intensitas serangan penyakit mosaik yang tinggi (Andayanie 2011). Pengambilan tanaman dilakukan dengan hati-hati agar akar tidak rusak dan diusahakan tanah tetap menempel di akar. Tanaman tersebut ditanam di pot dan diletakkan di kotak kasa. Daun yang baru tumbuh diamati secara visual sampai umur 8 minggu setelah tanam. Sampel daun yang tidak bergejala didiagnosis secara serologi dan diamati dengan mikroskop elektron serta dianalisis secara molekuler, sehingga diketahui keberadaan SMV isolat lemah.
2. Uji Serologi
Uji serologi menggunakan Metode Indirect-Enzyme Linked Immunosorbent Assay (I-ELISA) tanpa pelapisan (nonprecoating) (Koenig 1981) dan pelacak antibodi poliklonal terhadap SMV dengan pengenceran 10-3. Pengujian dilakukan dengan polystyrene
microtitre plate (Nunc-immuno plate, InterMed). Daun kedelai yang tidak bergejala dan baru tumbuh berdasarkan pengamatan gejala diekstraksi dengan bufer Na-karbonat pH 9,6. Ekstrak tersebut disiapkan dengan seri pengenceran 10-2 untuk memperoleh antigen.
Antigen dimasukkan ke lubang sumuran ELISA plate sebanyak 150 μl dan diinkubasi pada suhu kamar selama dua jam. Sap dibuang dan microtitre plate dicuci dengan PBST sebanyak tiga kali, kemudian dimasukkan 100 μl Bovine serum albumin (BSA) 2% dan diinkubasi selama dua jam pada suhu ruang. Plate dicuci dengan Phosphate buffer saline tween (PBST) tiga kali, lalu dimasukkan 100 μl antiserum (diencerkan 10-3) dan diiinkubasi
pada suhu 37oC selama dua jam. Plate dicuci tiga kali dengan larutan PBST, selanjutnya
ke dalam masing-masing sumuran dimasukkan atau bloking dengan substrat yang terdiri atas p-nitrophenil phosphate 1 mg/ml dalam 10% diethanolamine pH 9,8 sebanyak 100 μl dan diinkubasi selama 1,5 jam pada suhu 27 oC. Reaksi yang terjadi diamati dengan
ELISA reader pada panjang gelombang 405 nm. Reaksi dihentikan dengan cara menambah larutan NaOH ke dalam masing-masing sumuran.
3. Uji Molekuler
Uji molekuler dilakukan untuk memperkuat diagnosis secara visual dan serologi. Tahapan yang dilakukan yaitu: ekstraksi Ribo nucleic acid (RNA), Reverse-transcriptase polymerase chain reaction (RT-PCR), dan Polymerase chain reaction (PCR). RNA total diekstraksi dari sampel daun yang paling muda, dan nampak sehat serta bergejala mosaik ringan pada umur 8 minggu setelah tanam, yaitu pada akhir pengamatan secara visual. RNA total diperoleh dengan RNA Easy Extraction Kit dan direkomendasi oleh perusahaan (Qiagen) sebagai berikut: (1) jaringan tanaman ditimbang (0,1 g) dan ditambahkan nitrogen cair (2000 μl) kemudian dilakukan penggerusan; (2) bubuk jaringan tanaman dimasukkan ke tabung ependorf dan ditambahkan bufer RNeasy lysis tissue (RLT) (450 μl), serta ditambahkan Mercaptoethanol (4,5 μl), kemudian dilakukan pipeting dan vortex; (3) larutan dipindahkan ke spin column warna lila dan disentrifugasi 14.000 rpm selama dua menit, selanjutnya ditambahkan etanol (96–100%) setengah dari volume total. Larutan dicampur segera dengan pipeting; (4) larutan dipindahkan ke spin column yang merah muda, kemudian disentrifugasi l2.000 rpm selama 50 detik dengan suhu 22oC,
selanjutnya supernatan dibuang; (5) pelet ditambahkan dengan bufer RNA wash (RW1) (700 μl) dan disentrifugasi 12.000 rpm selama 50 detik dengan suhu 22 oC, supernatan
dibuang; (6) pelet ditambahkan dengan bufer Rate of perceived exertion (RPE) (500 μl) dan disentrifugasi 12.000 rpm selama 15 detik, supernatan dibuang dan diulangi tetapi dengan waktu dua menit, supernatan dibuang; (7) Spin column warna merah muda ditempatkan di tabung dan ditambahkan RNase free water (50 μl), kemudian disentrifugasi 12.000 rpm selama satu menit. Cairan yang ada di tabung selanjutnya digunakan sebagai RNA templet untuk keperluan reaksi RT- PCR.
Hasil ekstraksi RNA total sebagai RNA cetakan dalam RT-PCR menggunakan First Strand cDNA Synthesis kit (Fermentas) dengan cara sebagai berikut: (1) semua bahan yang dicampur terdiri atas: RNA se free water: 5μl; dNTP mix: 1μl; primer poly d (T): 1μl; RNA template: 3 μl,sehingga total volume 10 μl; (2) semua larutan dimasukkan ke mesin thermocycler, dan diprogram sebagai berikut: 65 oC selama lima detik, selanjutnya
dima-sukkan pada kotak es; (3) bahan tersebut dicampur dengan RNase free water 4,5μl; Bufer 5 x prime script 4 μl; RNAse inhibitor 0,5 μl; RT ensim 1 μl, sehingga total volume 20 μl; (4) semua larutan dimasukkan ke mesin thermocycler, dan diprogram 42 oC selama 60
menit, 95 oC selama lima menit, 4 oC tidak terhingga.
Hasil RT sebagai cDNA complementary pada reaksi PCR menggunakan MaximaTM Hot
Start Taq DNA Polymerase (Fermentas) dan primer Forward, C15’ dan primer Reverse, C13’ dengan cara sebagai berikut: (1) Semua bahan yang terdiri atas water nuclease free (8,5 μl ); bufer 10 x Hot Start PCR (5 μl ); 25 mM MgCl2 (4 μl), dNTP mix, 2 mm (2,5 μl);
Hot Start Taq DNA Polymerase; Primer CI F (1,5 μl), Primer CI R (1,5 μl); DNA templet (2 μl) dicampur dengan spindown; (2) semua larutan dimasukkan ke mesin thermocycler yang diprogram sebagai berikut: denaturasi awal pada 95 oC selama dua menit, denaturasi
95 oC selama satu menit dan annealing (penempelan primer) 68 oC selama satu menit
serta ekstensi pada 72 oC selama satu menit untuk amplification (pelipatgandaan)
seba-nyak 40 siklus, ekstensi terakhir 72 oC selama 10 menit dan 4 oC selama tidak terhingga.
Hasil amplifikasi PCR dielektroforesis dengan PAGE (Poly Acrylamide Gel Electro-phoresis) dengan cara: (1) larutan untuk Polyacrilamide Gel Electrophoresis terdiri dari:
jumlah sampel; (3) sisir diambil dan plate dimasukkan pada kotak yang telah diberi TBE 1x, kemudian dilakukan loading dengan jumlah sampel (3 μl) dan pewarna (2 μl), serta marker (1 kb) yang digunakan sebagai penanda DNA; (4) listrik dipasang dengan 10 mA selama 15 menit, setelah itu di rubah menjadi 24 mA selama 35 menit, kemudian dilakukan pengamatan di bawah transluminator.
4. Pengamatan Mikroskop Elektron
Pengamatan ini bertujuan untuk mengamati morfologi nukleoprotein atau virus. Materi yang digunakan adalah dari sampel daun kedelai yang tidak bergejala, secara serologi, dan molekuler bereaksi positif. Pengecatan menggunakan 2% Phosphotungtic acid (PTA), pH 6,5. Virus pada grid diamati dengan mikroskop elektron (Dijkstra 1998).
HASIL DAN PEMBAHASAN
Tanaman di pot mempunyai gejala ringan atau tidak bergejala, daun yang baru muncul juga mempunyai gejala ringan atau tidak bergejala. Tanaman ini secara visual mengandung isolat lemah dari penyebab penyakit mosaik kedelai. Apabila pada perkem-bangan tanaman tersebut menunjukkan gejala mosaik, maka tanaman tersebut terinfeksi oleh penyebab penyakit tersebut. Perkembangan tanaman kedelai menghasilkan 8 dari 15 sampel tanaman uji yang terdiri atas lima tanaman terlihat sehat dan tiga tanaman bergejala mosaik ringan, serta tujuh tanaman bergejala mosaik. Gejala mosaik dapat disebabkan oleh infeksi virus lain yang bukan SMV. Kejadian gejala mosaik di daerah tersebut disebabkan oleh SMV dan CMMV (Andayanie et al. 2011). Tanaman kedelai yang terlihat sehat (lima tanaman) dan bergejala mosaik ringan (tiga tanaman) ini dibuktikan penyebab penyakit mosaik dengan uji ELISA, pengamatan mikroskop elektron dan molekuler.
Hasil pengujian dengan metode I-ELISA ditemukan enam tanaman bereaksi positif dan dua tanaman bereaksi negatif terhadap antibodi poliklonal terhadap SMV (Tabel 1).
Tabel 1. Deteksi tanaman yang terlihat sehat (lima tanaman) dan bergejala mosaik ringan (tiga tanaman) dengan I-ELISA.
Gejala Rata-rata nilai absorbansi (A 405 nm)* Keterangan
Tanaman terlihat sehat 0,861 +
Tanaman bergejala mosaik ringan 0,152 −
Tanaman terlihat sehat 0,547 +
Tanaman bergejala mosaik ringan 0,183 −
Tanaman bergejala mosaik ringan 0,832 +
Tanaman terlihat sehat 0,175 −
Tanaman terlihat sehat 0,139 −
Tanaman terlihat sehat 0,148 −
Tanaman sehat 0,133 −
Tanaman bergejala mosaik 0,987 +
Bufer 0,093 Nilai negatif ≤0,186 (dua kali nisbah bufer).
Tanaman yang terlihat sehat tidak mempunyai jaminan bereaksi negatif dengan antibodi poliklonal terhadap SMV. Ekstrak tanaman yang terlihat sehat berekasi positif
pada visible panjang gelombang 405 nm untuk reaksi antigen dan antibodi. Hal ini disebabkan oleh protein virus pada tanaman sehat bereaksi dengan antibodi poliklonal terhadap SMV. Deteksi virus secara serologi terutama pada tanaman yang menyebabkan bereaksi positif ini agar lebih akurat diuji lebih lanjut secara molekuler.
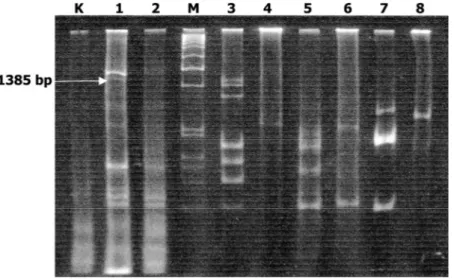
Uji molekuler dengan ekstrak daun kedelai yang baru tumbuh dan nampak terlihat sehat serta bergejala ringan menunjukkan fragmen DNA hasil amplifikasi RT-PCR dengan primer CI 5560R dan CI 4176F (Gambar 1).
Gambar 1. Fragmen DNA hasil amplifikasi RT-PCR menggunakan primer CI 5560 R dan 4176 F. Lajur 1. Tanaman sehat; 2. Tanaman bergejala mosaik ringan; 3. Tanaman nampak sehat; 4. Tanaman bergejala mosaik ringan; 5. Tanaman bergejala mosaik ringan; 6. Tanaman nampak sehat; 7. Tanaman nampak sehat; 8. Tanaman nampak terlihat sehat; M=DNA Ladder 1 Kb sebagai marker (Fermentas).
Perbedaan data antara pengujian dengan ELISA dan PCR pada tanaman yang terlihat sehat karena tingkat kemurnian virus untuk memperoleh antiserumnya dan tingkat immunogenisitas yang rendah. Dua sampel tanaman yang terlihat sehat tersebut (sampel nomer 1 dan 2) menunjukkan positif teramplifikasi dengan primer CI 5560R dan CI 4176F serta menghasilkan pita DNA berukuran sekitar 1385 bp. Primer tersebut juga digunakan untuk mengidentifikasi gejala mosaik parah pada varietas Wilis di kabupaten Ngawi (Andayanie et al. 2011). Selain itu di Korea, reaksi RT-PCR dengan primer tersebut digunakan untuk membedakan beberapa strain SMV (Kim et al. 2004). Reaksi positif ini disebabkan oleh strain SMV pada tanaman kedelai terdiagnosis secara visual nampak sehat berbeda dengan strain SMV yang menghasilkan gejala mosaik parah. Hal ini yang menyebabkan tanaman tersebut nampak sehat di sekeliling tanaman yang bergejala nampak mosaik parah. Meskipun tanaman yang nampak terlihat sehat dan bergejala mosaik ringan juga ditemukan tidak teramplifikasi dengan primer tersebut ( sampel nomer 3, 4, 5, 6, 7, dan 8). Di lokasi tersebut, gejala mosaik pada tanaman kedelai disebabkan oleh SMV dan CMMV (Andayanie et al. 2011).
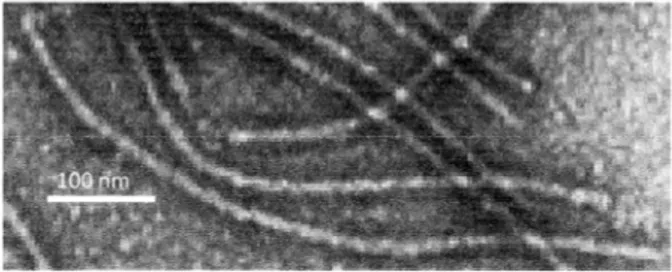
Gambar 2. Partikel nukleoprotein dari isolat lemah SMV. Bar dalam micrograph 100 nm
Bentuk partikel dengan ukuran tersebut merupakan salah satu ciri dari SMV. Hasil tersebut dapat diketahui bahwa SMV strain lemah menginfeksi tanaman kedelai dan tidak menghasilkan gejala atau tanaman nampak sehat di sekeliling tanaman bergejala mosaik parah. Oleh karena itu perlu dilakukan kajian yang lebih dalam untuk mengetahui karakterisasi molekuler dari SMV strain lemah yang tidak menghasilkan gejala dan strain SMV yang menghasilkan gejala mosaik yang parah.
KESIMPULAN
Dua isolat lemah ditemukan di antara tanaman kedelai bergejala mosaik yang parah di lapangan. Isolat tersebut menyebabkan tanaman nampak terlihat sehat atau tanaman tidak bergejala sama sekali.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada Direktorat Jendereal Pendidikan Tinggi Departemen Pendidikan Nasional Nomor: 0084/SP2H/PP/K7/KL/IV/2011 atas dana Hibah Bersaing tahun III. Penulis juga menyampaikan terima kasih kepada ketua LPPM dan Puslit Universitas Merdeka Madiun yang memberi kelancaran penulis untuk menyelesaikan penelitian dan makalah ini.
DAFTAR PUSTAKA
Andayanie, W.R., Y.B. Sumardiyono, S.Hartono and Yudono, P. 2011. Incidence of soybean mosaic disease in East Java Province. J. Agrivita Science. 33 (1): 15−22 p.
Andayanie, W.R. 2012a. Evaluation of low temperature treatment induced mutant of Soybean mosaic virus (SMV) for cross protection in soybean. J. Australasian Plant Pathology. Submitted.
Andayanie, W.R. 2012b. Identifikasi dan pengelolaan Soybean mosaic virus terbawa benih kedelai. J. Hama dan Penyakit Tumbuhan. Submitted.
Dijkstra J. Cees P.Jager. 1998. Practical plant virology. Protocols and Exercises. Springer, p: 293−294 .
Horn, N.M., N. Saleh & Y. Baliadi. 1991. Cowpea mild mottle virus could not be detected by ELISA in soybean and groundnut seeds in Indonesia. Neth. J. Pl. Path. (1991): 125−127. Kim, Y.H., O.S. Kim, J.H. Roh, J.K. Moon, S.I. Sohn , C. Lee & J.Y. Lee. 2004. Identification
of Soybean mosaic virus strains by RT-PCR analysis of Cylindrical Inclusion coding region. Publication No. D-2004-0322-02R. 2004. The American Phytopathological Society. Plant Disease 88:641−645.
Koenig, R. 1981. Indirect ELISA Methods for the Broad Specificity Detection of Plant Viruses. Journal of Gen Virol. 55: 53−62 .
Kosaka, Y. & T. Fukunishi. 1993. Attenuated isolates of Soybean mosaic virus derived at a low temperature. J. Plant Dis.77: 882−886 p.
Tavasoli M., N. Shahraeen & S.H. Ghorbani. 2009. Serological and RT-PCR detection of Cowpea mild mottle Carla Virus infecting soybean. Journal of General and Molecular Virology 1 (1): 7−9 p.
DISKUSI Wedanimbi Tengkano
Pertanyaan : Isolat lemah apakah disebabkan oleh faktor isolat itu sendiri atau disebabkan oleh faktor luar / tanaman inang?
Jawaban : Virus itu tidak berasal dari tanaman inang tetapi bawaan dari benih Sri Wahyuni Indiati
Pertanyaan : Bagaimana cara menseleksi serangan yang ada di lapang
Jawaban : Menggunakan teknologi yang tinggi, serologi lebih bagus dari pada visual. Nasir Saleh
Pertanyaan : Apakah ada pengaruh tanaman yang terserang mosaic virus dengan hasil produksi?
Jawaban : Terhadap produksi hasilnya tidak nampak jauh dengan yang sehat Mudji Rahayu
Pertanyaan : Bagaimana mengembangbiakkan isolate ini? Jawaban : Menggunakan antibody Polyclonal
Yusmani Prayoga
Pertanyaan : Mengapa penelitian ini mencabut tanaman kedelai beserta tanahnya. Apa manfaat tanah bagi virus. virus tidak ditularkan lewat tanah.
Jawaban : Betul. Virus tidak ditularkan melalui tanah karena obligat parasit. Fungsi tanah digunakan sebagai upaya tanaman kedelai yang tidak bergejala dari daerah endemis tersebut tetap hidup jika dipindahkan ke pot
Pertanyaan : Selanjutnya Tanaman tersebut dimasukkan di kotak kasa supaya steril dari infeksi aphis serta dilakukan pengamatan
Jawaban : Benih yang terserang SMV belum tentu menampakkan bercak Juniawan
Pertanyaan : Gejala mosaik pada tanaman dan biji karena Soybean mosaic virus tidak jaminan tanaman dan bii terinfeksi virus tersebut. Bagaimana cara mengetahui gejala di lapangan selain dengan alat yang canggih.
Jawaban : Uji infektivitas pada tanaman Chenopodium amaranticolor dengan kondisi rumah kaca yang tidak terlalu gelap dan panas akan menghasilkan gejala becak lokal. Meskipun gejala tersebut dapat juga dihasilkan oleh infeksi virus lain, misalnya Soybean stunt virus, Cowpea mild mottle virus. Growing on test dapat digunakan untuk meguji keberadaan virus dalam biji.
Pertanyaan : Apakah munculnya virus lemah di lapang berhubungan dengan mekanisme sel inang yang tidak bekerja dengan normal ?.
Jawaban : Virus selalu berhubungan dengan inang karena parasit obligat. asosiasi satelit RNA dengan virus penolong (helper virus) akan menghasilkan virus
Jawaban : Betul. Tetapi penelitian ini faktor luar dan varietas yang digunakan sama, karena dalam lokasi yang sama.
Pertanyaan : Bagaimana dampaknya penggunaan strain lemah dibandingkan dengan tanaman yang nampak sehat ?
Jawaban : Makalah ini hanya mengemukakan seleksi isolat lemah di lapang. Meskipun demikian dari penelitian yang belum dipublikasi dengan judul”Evaluation of low temperature treatment induced mutant of Soybean mosaic virus for cross protection in soybean” menunjukkan penggunaan isolat lemah lebih rendah dan tidak berbeda nyata produksinya dibandingkan tanaman sehat.