PEMANFAATAN CANGKANG KELAPA SAWIT SEBAGAI PENYANGGA PADA KATALIS Cu/Zn/KARBON AKTIF UNTUK
KONVERSI SYNGAS (H2/CO) MENJADI METANOL
SKRIPSI
DESTA VANTYCA
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
PEMANFAATAN CANGKANG KELAPA SAWIT SEBAGAI PENYANGGA PADA KATALIS Cu/Zn/KARBON AKTIF UNTUK
KONVERSI SYNGAS (H2/CO) MENJADI METANOL
Skripsi
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
DESTA VANTYCA 1113096000064
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
ABSTRAK
DESTA VANTYCA. “Pemanfaatan Cangkang Kelapa Sawit sebagai Penyangga pada Katalis Cu/Zn/Karbon Aktif untuk Konversi Syngas (H2/CO) menjadi
Metanol”. Dibimbing oleh TRISAKSONO BAGUS PRIAMBODO dan ISALMI AZIZ.
Limbah cangkang kelapa sawit dapat digunakan sebagai penyangga katalis, karena mengandung 65-80% unsur karbon. Aktivitas katalis dapat ditingkatkan dengan menambahkan logam Cu dan Zn pada karbon aktif. Tujuan penelitian ini adalah untuk memanfaatkan limbah cangkang kelapa sawit sebagai penyangga katalis, menentukan karakteristik katalis Cu/Zn/karbon aktif, dan menentukan rasio katalis Cu/Zn/karbon aktif terbaik terhadap reaksi syngas menjadi metanol. Pembuatan katalis dilakukan dengan metode impregnasi basah dengan rasio Cu/Zn/karbon aktif sebesar 10/10/80 (%wt), 15/5/80 (%wt), dan 5/15/80 (%wt). Karakterisasi katalis, meliputi BET, XRD, FTIR, SEM EDX, dan CHN analyzer. Uji aktivitas katalis Cu/Zn/karbon aktif dalam microactivity PID reactor dengan laju alir umpan gas H2:CO, yaitu 2:1 mL/menit, tekanan 12 bar, suhu reaksi
200-260℃, konsentrasi katalis 20%, dan waktu reaksi 30 menit. Hasil uji aktivitas katalis dianalisis menggunakan GC-TCD (%CO) dan GC-FID (%CH3OH). Hasil
penelitian ini, menunjukan bahwa analisis proksimat karbon aktif, yaitu kadar air 2,356%, kadar zat menguap 38,594%, kadar abu 3,672%, kadar karbon terikat 55,378 % dan analisis ultimate menunjukan kadar C 74,8%, kadar H 3,31%, kadar N 0,56%, kadar S 0,35%, dan kadar O 20,98%. Hasil analisis BET menunjukan bahwa luas permukaan karbon aktif sebelum diaktivasi sebesar 1,292 m2/g, dan setelah diaktivasi 148,783 m2/g. Katalis Cu/Zn/karbon aktif 10/10/80 (%wt)
177,630 m2/g, 15/5/80 (%wt) 228,695 m2/g, dan 5/15/80 (%wt) 207,607 m2/g. Analisis XRD menunjukan bahwa adanya pola difraksi CuO, ZnO, dan C (grafit). Analisis FTIR menunjukan adanya gugus fungsi, yaitu C=C aromatik, O-H, dan C=O karbonil. Analisis SEM-EDX menunjukan adanya unsur penyusun katalis, seperti unsur C, O, Na, Si, C, Cu, Zn, dan Al. Analisis produk terbaik menunjukan bahwa konversi CO dan yield metanol terbesar, yaitu 8,017% dan 3,207% dengan selektivitas 40,002% dihasilkan dari katalis Cu/Zn/karbon aktif 10/10/80 (%wt) pada suhu 260℃.
ABSTRACT
DESTA VANTYCA. “Utilization of Palm Oil Shells as Support of Cu/Zn/Activated Carbon Catalyst for Syngas Conversion (H2/CO) to Methanol”.
Guided by TRISAKSONO BAGUS PRIAMBODO dan ISALMI AZIZ.
Palm oil shell waste can be used as a catalyst support, as it contains 65-80% carbon. The activity of catalyst can be increased by adding Cu and Zn metals to activated carbon. The objective of this study was to utilize palm shell waste as catalyst support, determine the characteristics of catalyst Cu/Zn/actived carbon, and determine the best ratio of catalyst Cu/Zn/actived carbon in syngas reaction to methanol. The catalyst preparation was carried out by wet impregnation method with the ratio of Cu/Zn/activated carbon of 10/10/80 (%wt), 15/5/80 (%wt), and 5/15/80 (%wt). Characterization of the catalyst, including BET, XRD, FTIR, SEM EDX, and CHN analyzer. The activity test of catalyst Cu/Zn/activated carbon in microactivity PID reactor using feed gas H2: CO with flow rate of 2:1 mL/minute,
pressure of 12 bar, reaction temperature of 200-260℃, catalyst concentration of 20%, and reaction time of 30 min. The results of catalyst activity test were analyzed using GC-TCD (%CO) and GC-FID (%CH3OH). The results of this
study showed that the proximate analysis of activated carbon, ie water content of 2.356%, vapor content of 38.594%, ash content of 3,672%, carbon content bound of 55,378% and ultimate analysis of C 74,8%, H 3,31% , N 0.56%, S 0.35%, and O 20.98%. The result of BET analysis showed that the surface area of activated carbon before was activated 1,292 m2/g, and after was activated 148,783 m2/g. Catalyst of Cu/Zn/activated carbon 10/10/80 (%wt) 177,630 m2/g, 15/5/80 (%wt) 228,695 m2/g, and 5/15/80 (%wt) 207,607 m2/g. XRD analysis showed that the
diffraction pattern of CuO, ZnO, and C (graphite). FTIR analysis showed the presence of functional groups, such as C=C aromatic, O-H, and C=O carbonyl. The SEM-EDX analysis showed the presence of catalyst elements, such as C, O, Na, Si, C, Cu, Zn, and Al. The best product analysis showed that conversion of CO and the highest yield of methanol, 8.017% and 3.207% with selectivity 40,002% were produced from catalyst of Cu/Zn/actived carbon 10/10/80 (%wt) at 260℃.
viii
KATA PENGANTAR
Bismillahirrahmanirrahim
Assalamu’alaikum warahmatullahi wabarakatuh
Alhamdulillahi rabbil ‘alamin, puji serta syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia yang telah dilimpahkan-Nya, penulis dapat menyelesaikan penelitian yang berjudul “Pemanfaatan Cangkang Kelapa Sawit sebagai Penyangga pada Katalis Cu/Zn/Karbon Aktif untuk Konversi Syngas (H2/CO) menjadi Metanol”. Shalawat serta salam tak lupa tercurah kepada
Rasulullah Muhammad SAW beserta keluarga dan sahabatnya, serta pengikutnya yang memperjuangkan islam hingga akhir zaman.
Penulisan skripsi dapat terselesaikan berkat bantuan dan bimbingan dari berbagai pihak, dimulai dari proses perkuliahan sampai penyusunan skripsi ini selesai. Untuk itu, penulis memohon maaf yang sebesar-besarnya kepada berbagai pihak yang terlibat atas segala kesalahan penulis, dan mengucapkan terima kasih kepada:
1. Ir. Trisaksono Bagus Priambodo, M.Eng selaku Pembimbing I yang telah memberikan bimbingan dan arahan selama penelitian dan penyusunan skripsi ini.
2. Isalmi Aziz, M.T. selaku Pembimbing II yang telah memberikan bimbingan dan arahan selama penulisan skripsi penelitian ini.
3. Nanda Saridewi, M.Si selaku Penguji I yang telah memberikan saran dan masukan terhadap penulis dalam penulisan skripsi penelitian.
4. Nurmaya Arofah, M.Eng selaku Penguji II yang telah memberikan saran dan masukan terhadap penulis dalam penulisan skripsi penelitian.
5. Drs. Dede Sukandar, M.Si selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
6. Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
7. Dr. Sri Yadial Chalid, M.Si selaku Pembimbing Akademik dari penulis yang telah memberikan masukan kepada penulis.
ix
8. Bapak dan Ibu Dosen Program Studi Kimia FST UIN Syarif Hidayatullah Jakarta yang telah memberikan ilmunya dengan sabar dan ikhlas selama masa perkuliahan.
9. Fusia Mirdayanti, M.Si selaku Pembimbing Lapangan yang telah memberikan bimbingan dan arahan selama penulisan skripsi penelitian ini. Serta, seluruh pegawai kerja PTSEIK BPPT klaster energi, yaitu Mba Astri, Mas Tutur, Kak Tyas, Kak Atti, Kak Agung, Pak Darudin, dan Pak Dwi yang telah membantu dalam proses penelitian.
10. Keluarga tercinta, terutama untuk mama tercinta, yaitu Toipah yang selalu mendoakan, melimpahkan kasih sayang, memberikan dukungan moril, dan materil; saudara-saudari penulis, yaitu Ivan Indrawan, Nikmah, Vivi Varlina, M. Syaddrah, Imelda Safitri, dan Sunaryadi; serta para ponakan, yaitu Farraz, Dinda, Qarirah, dan Alvaro yang telah memberikan do’a dan motivasi agar penulis tetap semangat untuk menyelesaikan penelitian ini. 11. Teman-Teman Kimia angkatan tahun 2013 yang telah banyak memberikan
keceriaan, tawa, haru, motivasi, dan semangat, serta telah menjadi keluarga selama 4 tahun bersama; teman-teman penelitian; dan sahabat-sahabat Heptana; serta seluruh keluarga besar Himka (Himpunan Mahasiswa Kimia) atas pertemanan, dukungan, dan bantuannya selama ini.
12. Seluruh pihak yang telah memberikan dukungan baik secara langsung, moral, maupun do’a, sehingga dapat terselesaikannya proses penyusunan skripsi ini.
Penulis menyadari masih banyak kekurangan dalam skripsi ini. Oleh karena itu, kritik dan saran yang membangun sangat penulis harapkan. Semoga laporan ini bermanfaat bagi kemajuan ilmu pengetahuan.
Wassalamualaikum warahmatullahi wabarakatuh
Jakarta, September 2017
x DAFTAR ISI
Halaman
KATA PENGANTAR... viii
DAFTAR ISI... x
DAFTAR GAMBAR... xii
DAFTAR TABEL... xvii
DAFTAR LAMPIRAN... xix
BAB I PENDAHULUAN... 1 1.1 Latar Belakang... 1 1.2 Rumusan Masalah... 6 1.3 Hipotesis... 6 1.4 Tujuan Penelitian... 6 1.5 Manfaat Penelitian... 7
BAB II TINJAUAN PUSTAKA... 8
2.1 Cangkang Kelapa Sawit... 8
2.2 Karbon Aktif... 8 2.3 Katalis... 14 2.3.1 Komponen Katalis... 15 2.3.2 Penggolongan Katalis... 16 2.3.3 Impregnasi Katalis... 17 2.4 Fischer-Tropsch... 18 2.5 Karakterisasi Katalis... 19
2.5.1 BET (Bruneur-Emmet Teller)... 19
2.5.2 XRD (X-Ray Diffraction)... 21
2.5.3 FTIR (Fourier Transform Inframerah)... 22
2.5.4 SEM-EDX (Scanning Eletron Microscopy- Energy Dispersed X-ray Spectroscopy)...24
xi
2.5.6 Gas Chromatograph (GC)... 27
BAB III METODE PENELITIAN... 30
3.1 Waktu dan Tempat... 30
3.2 Alat dan Bahan... 30
3.2.1 Alat... 30
3.2.2 Bahan... 30
3.3 Prosedur Kerja... 31
3.3.1 Karbonisasi Cangkang Kelapa Sawit... 31
3.3.2 Impregnasi Penyangga Katalis... 34
3.3.3 Karakterisasi Katalis... 36
3.3.4 Uji Aktivitas Katalitik... 39
3.3.5 Analisis Produk... 40
BAB IV HASIL DAN PEMBAHASAN... 42
4.1 Karbonisasi Cangkang Kelapa Sawit... 42
4.2 Analisis Proksimat dan Ultimate... 43
4.2.1 Analisis Proksimat... 43
4.2.2 Analisis Ultimate... 47
4.3 Karakterisasi Katalis... 51
4.3.1 Luas Permukaan Katalis... 51
4.3.2 Karakterisasi Katalis dengan XRD... 54
4.3.3 Identifikasi Gugus Fungsi Katalis dengan FTIR... 57
4.3.4 Analisis Komponen Unsur dengan SEM-EDX... 60
4.4 Uji Aktivitas Katalis... 64
BAB V PENUTUP... 70
5.1 Simpulan... 70
5.2 Saran... 70
xii
DAFTAR GAMBAR
Halaman
Gambar 1. Karbon Aktif... 11
Gambar 2. Grafik Energi Aktivasi Reaksi tanpa Katalis dan Adanya Katalis... 14
Gambar 3. Alat Instrumentasi BET Autosorb 6... 20
Gambar 4. Skema Dasar XRD... 21
Gambar 5. Alat Instrumentasi FTIR... 23
Gambar 6. Skema kerja SEM-EDX... 24
Gambar 7. Alat Intrumentasi CHN Analyzer... 27
Gambar 8. Alat Istrumentasi GC-TCD... 29
Gambar 9. Alat Instrumentasi GC-FID... 29
Gambar 10. Skema Microactivity PID Reactor... 40
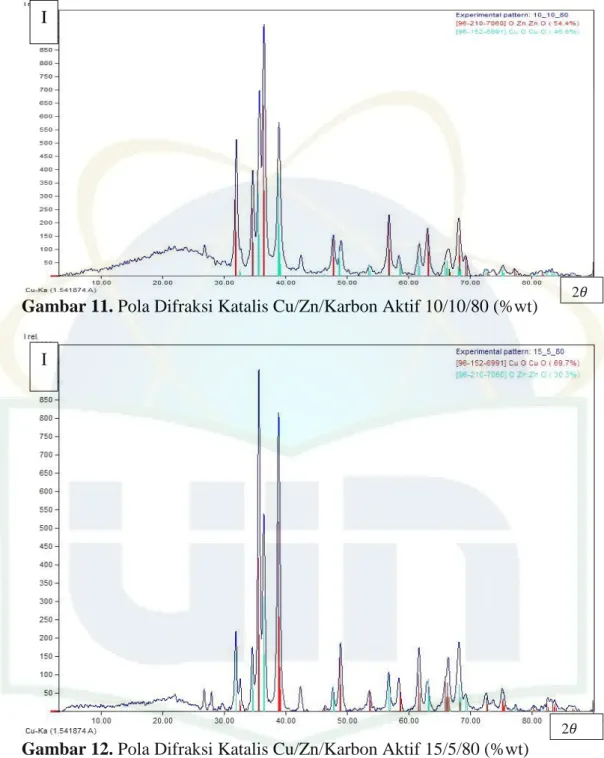
Gambar 11. Pola Difraksi Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt)... 55
Gambar 12. Pola Difraksi Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 55
Gambar 13. Pola Difraksi Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt)... 56
Gambar 14. Spektrum FTIR Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt)...58
xiii
Gambar 15. Morfologi Sampel Katalis Cu/Zn/Karbon Aktif (a) 10/10/80; (b)
15/5/80); (c) 5/15/80 (%wt) dengan Perbesaran 250x...61
Gambar 16. Aktivitas Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt) pada Konversi CO (%)... 65
Gambar 17. Aktivitas Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt) pada Yield Metanol (%)... 66
Gambar 18. Luas Permukaan Katalis Karbon Aktif Sebelum Aktivasi... 87
Gambar 19. Luas Permukaan Katalis Karbon Aktif Setelah Aktivasi... 88
Gambar 20. Luas Permukaan Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt)... 89
Gambar 21. Luas Permukaan Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 90
Gambar 22. Luas Permukaan Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt)... 91
Gambar 23. Spektrum FTIR Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt)... 93
Gambar 24. Spektrum FTIR Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 93
Gambar 25. Spektrum FTIR Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt)... 94
Gambar 26. Kondisi Uji SEM EDX...95
Gambar 27. Morfologi dan Komponen Unsur Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt)... 96
Gambar 28. Morfologi dan Komponen Unsur Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 97
Gambar 29. Morfologi dan Komponen Unsur Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt)... 98
xiv
Gambar 30. Umpan Gas CO (5 mL/menit)... 99
Gambar 31. Konversi CO Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu 200℃... 100 Gambar 32. Konversi CO Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu
230℃... 100 Gambar 33. Konversi CO Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu
250℃... 101 Gambar 34. Konversi CO Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu
240℃ dan 260℃... 102 Gambar 35. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 103
Gambar 36. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt)... 103
Gambar 37. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) pada Suhu 240℃... 104 Gambar 38. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) pada Suhu
250℃... 104 Gambar 39. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) pada Suhu
260℃... 105 Gambar 40. Konversi CO Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu
200℃... 105 Gambar 41. Konversi CO Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu
230℃... 106 Gambar 42. Konversi CO Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu
240℃... 106 Gambar 43. Konversi CO Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu
xv
Gambar 44. Umpan Gas CH3OH Standar... 110
Gambar 45. Yield Metanol Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu 200℃, 230℃, dan 240℃...111
Gambar 46. Yield Metanol Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) pada Suhu 250℃ dan 260℃... 112
Gambar 47. Yield Metanol Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) pada Suhu 200℃, 230℃, dan 240℃... 113
Gambar 48. Yield Metanol Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) pada Suhu 250℃ dan 260℃...114
Gambar 49. Yield Metanol Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu 200℃, 230℃, dan 240℃... 115
Gambar 50. Yield Metanol Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) pada Suhu 250℃ dan 260℃...116
Gambar 51. Cangkang Kelapa Sawit... 120
Gambar 52. Karbonisasi CKS... 120
Gambar 53. Karbon Aktif Dihaluskan... 120
Gambar 54. Karbon Aktif Setelah Dihaluskan... 120
Gambar 55. Karbon Aktif di Ayak...120
Gambar 56. Aktivasi Karbon Aktif... 120
Gambar 57. Karbon Aktif di Cuci Aquadest... 120
xvi
xvii
DAFTAR TABEL
Halaman
Tabel 1. Komposisi Katalis Cu/Zn/Karbon Aktif ... 35
Tabel 2. Kondisi Uji Sampel Katalis Cu/Zn/ Karbon Aktif dengan XRD ... 37
Tabel 3. Kondisi Analisis Unsur Sampel Katalis Cu/Zn/Karbon Aktif dengan SEM-EDX ... 38
Tabel 4. Kondisi Uji Leak Test dan Reduksi Katalis Cu/Zn/Karbon Aktif ... 40
Tabel 5. Kondisi Uji Produk Metanol dengan GC-FID dan GC-TCD ... 41
Tabel 6. Analisis Proksimat Cangkang Kelapa Sawit dan Karbon Aktif ... 43
Tabel 7. Analisis Ultimate Cangkang Kelapa Sawit dan Karbon Terikat... 47
Tabel 8. Analisis BET Karbon Aktif dan Katalis Cu/Zn/Karbon Aktif ... 51
Tabel 9. Pola Difraksi CuO dan ZnO pada Katalis Cu/Zn/Karbon Aktif 10/10/80. 15/5/80, dan 5/15/80 (%wt) ... 56
Tabel 10. Gugus Fungsi dan Bilangan Gelombang Spektrum FTIR ... 58
Tabel 11. Komponen Unsur Penyusun Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt) ... 62
Tabel 12. Analisis Kadar Air Cangkang Kelapa Sawit ... 82
Tabel 13. Analisis Kadar Zat Menguap Cangkang Kelapa Sawit ... 82
xviii
Tabel 15. Analisis Kadar Air Karbon Aktif ... 83
Tabel 16. Analisis Kadar Zat Menguap Karbon Aktif ... 83
Tabel 17. Analisis Kadar Abu dan Kadar Karbon Terikat Karbon Aktif ... 83
Tabel 18. Komposisi Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) ... 84
Tabel 19. Komposisi Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) ... 85
Tabel 20. Komposisi Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) ... 85
Tabel 21. Pola Difraksi Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt) ... 92
Tabel 22. Konversi CO Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) ... 108
Tabel 23. Konversi CO Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) ... 108
Tabel 24. Konversi CO Katalis Cu/Zn/Karbon Aktif 5/15/80 (%wt) ... 109
Tabel 25. Hasil Konversi CO (%) untuk Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, 5/15/80 (%wt) pada Kondisi Suhu 200-260℃ ... 109
Tabel 26. Yield Metanol Katalis Cu/Zn/Karbon Aktif 10/10/80 (%wt) ... 117
Tabel 27. Yield Metanol Katalis Cu/Zn/Karbon Aktif 15/5/80 (%wt) ... 117
Tabel 28. Yield Metanol Katalis Cu/Zn/Karbon AKtif 5/15/80 (%wt) ... 118
Tabel 29. Hasil Yield Metanol (%) untuk Katalis Cu/Zn/Karbon Aktif 10/10/80, 15/5/80, 5/15/80 (%wt) pada Kondisi Suhu 200-260℃ ... 118
xix
DAFTAR LAMPIRAN
Halaman
Lampiran 1Bagan Penelitian ... 81
Lampiran 2 Analisis Proksimat ... 82
Lampiran 3 Rendemen, Impregnasi, dan Konsentrasi Katalis ... 84
Lampiran 4 Karakterisasi BET... 87
Lampiran 5 Karakterisasi XRD ... 92
Lampiran 6 Karakterisasi FTIR ... 93
Lampiran 7 Karakterisasi SEM-EDX ... 95
Lampiran 8 Konversi CO (%) dan Perhitungan ... 99
Lampiran 9 Yield Metanol (%) dan Perhitungan... 110
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara penghasil kelapa sawit nomor dua terbesar di dunia setelah Malaysia. Sejak tahun 2003, produksi minyak kelapa sawit secara nasional sudah mencapai 2 juta ton per tahun dan kecenderungannya semakin meningkat pada tahun-tahun mendatang (Fauzi et al., 2008). Allah telah menciptakan berbagai jenis tumbuhan dan tanaman di muka bumi ini memiliki sejumlah manfaat, diantaranya tanaman kelapa sawit yang memiliki banyak manfaat. Allah telah menjelaskannya dalam Qs. Asy-Syu’ara ayat 7, yaitu:
”Dan apakah mereka tidak memperhatikan bumi, berapakah banyaknya kami tumbuhkan di bumi ini berbagai macam tumbuh-tumbuhan yang baik?” (QS.Asy-Syu’ara:7).
Berdasarkan ayat di atas bahwa Allah telah menumbuhkan berbagai jenis tumbuhan yang baik, yaitu subur dan bermanfaat. Tanaman kelapa sawit banyak dimanfaatkan untuk digunakan sebagai minyak goreng, santan, bahan baku pembuatan biodiesel, dan pupuk kompos (Kurniawan et al., 2014). Produksi kelapa sawit yang semakin meningkat akan diikuti pula dengan peningkatan jumlah limbahnya. Salah satu limbah yang diproduksi dalam jumlah besar, yaitu limbah padat. Limbah ini terdiri atas cangkang, janjang, tandan kosong, dan kulit
2 buah. Selama ini, penanganan limbah tersebut dilakukan oleh sebagian besar pabrik kelapa sawit, yaitu dengan cara membakarnya secara terbuka, baik untuk kebutuhan energi boilernya maupun hanya untuk tujuan menguranginya saja. Pada proses tersebut sering kali menimbulkan pencemaran udara, sehingga meresahkan masyarakat yang bermukim di sekitar pabrik tersebut (Kurniawan et al., 2014).
Menurut Fauzi et al., (2002), cangkang kelapa sawit merupakan salah satu limbah yang jumlahnya mencapai 60% dari produksi minyak kelapa sawit (CPO). Oleh karena itu, diperlukan suatu cara agar limbah kelapa sawit dapat dimanfaatkan, sehingga limbah kelapa sawit dapat ditanggulangi. Salah satu produk yang memiliki nilai ekonomis yang terbuat dari cangkang kelapa sawit adalah karbon aktif. Karbon aktif dibuat melalui proses karbonisasi bahan mentah dan diikuti proses aktivasi baik secara kimia maupun fisika (Kurniawan et al., 2014).
Pemilihan cangkang kelapa sawit sebagai karbon aktif, karena karbon aktif dari cangkang kelapa sawit memiliki luas permukaan yang sangat besar, berkisar antara 300-2000 m2/g (Kurniati, 2008). Oleh karena luas permukaannya yang
sangat besar, maka karbon aktif dari cangkang kelapa sawit dapat digunakan sebagai penyangga (support) katalis (Zurairah, 2016). Luas permukaannya yang besar diperoleh dari kandungan bahan organik dalam cangkang kelapa sawit, seperti selulosa, hemiselulosa, dan lignin (Khor, 2009). Umumnya, karbon aktif mempunyai daya adsorbsi yang rendah, sehingga dapat diperbesar dengan cara mengaktifkan karbon aktif menggunakan uap atau bahan kimia (Kurniati, 2008).
3 Aktivitas katalis dapat ditingkatkan dengan cara mendispersikan logam aktif ke dalam pori-pori karbon aktif. Logam Cu dan Zn dipilih, karena logam Cu mampu bertindak sebagai sisi aktif dari katalis. Namun, logam Cu mudah terdeaktivasi pada suhu tinggi. Permasalahan ini dapat diatasi dengan memodifikasi Cu dengan Zn, sehingga logam Zn bertindak sebagai promotor dari katalis. Oleh sebab itu, logam Zn bertindak untuk mencegah Cu terdeaktivasi pada suhu tinggi (Husin et al., 2010). Menurut Setiadi et al., (2007) bahwa katalis logam Cu berperan sebagai logam aktif katalis dalam reaksi hidrogenasi CO2
menjadi metanol, sedangkan Zn berfungsi untuk mendispersikan dan menstabilkan partikel kristal Cu yang terdispersi/tersebar pada permukaan penyangga.
Katalis dari penyangga karbon aktif dibuat dengan cara memvariasikan rasio logam Cu/Zn melalui metode impregnasi basah, yaitu rasio Cu/Zn/karbon aktif 10/10/80, 15/5/80, dan 5/15/80 (%wt) (Setiadi et al., 2007). Pemilihan rasio bertujuan untuk menentukan pengaruh komposisi logam Cu dan Zn dalam penyangga katalis terhadap karakterisasi dan aktivitas katalis dalam pembentukan produk metanol. Menurut Setiadi et al., (2007) bahwa komposisi katalis CuO dan ZnO dalam katalis CuO/ZnO/ZSM-5 adalah 10, 20, 30, 40 (%wt) untuk reaksi hidrogenasi CO2 menjadi metanol. Menurut Husin et al., (2010) bahwa komposisi
katalis CuO dalam katalis Cu/ZnO/Al2O3 untuk proses steam reforming metanol
menjadi hidrogen adalah 1, 5, 10, dan 15 (%wt).
Selama ini, penyangga katalis yang digunakan dalam proses syngas menjadi metanol adalah γ-Al2O3 (Prasetyo et al., 2017). Pemanfaatan katalis berpenyangga
4 karbon aktif belum banyak dilakukan, karena selama ini penggunaan karbon aktif hanya sebagai adsorben (Vinsiah et al., 2014; Kurniawan et al., 2014). Katalis penyangga karbon aktif digunakan untuk mengonversikan syngas menjadi metanol. Hal ini bertujuan untuk menentukan potensi penggunaan karbon aktif dari cangkang kelapa sawit untuk proses syngas.
Reaksi syngas menjadi metanol dilakukan dalam microactivity PID reactor menggunakan konsentrasi katalis Cu/Zn/karbon aktif 20% pada kondisi operasi, yaitu laju alir H2:CO 10:5 mL/menit; variasi suhu 200℃, 230℃, 240℃, 250℃,
260℃; tekanan 12 bar; dan selama 30 menit (Yue et al., 2000). Kondisi suhu yang bervariasi, bertujuan untuk menentukan pengaruh kenaikan suhu terhadap katalis Cu/Zn/karbon aktif dalam konversi CO dan yield metanol. Menurut Lourentius et al., (2004) pada konversi syngas menjadi dimetil eter dengan katalis Cu-Zn/ γ-Al2O3 dilakukan pada kondisi suhu 220-240℃ dan tekanan 40 bar. Produk
metanol memiliki sejumlah kegunaan, seperti dapat digunakan sebagai pengganti bahan bakar dan bahan baku industri petrokimia (Prasetyo et al., 2017). Analisis produk metanol dilakukan dengan menggunakan alat instrumentasi GC-TCD untuk mengetahui konversi gas CO (%) dan GC-FID untuk yield metanol (%) (Sumanti, 2011).
Beberapa penelitian sebelumnya yang terkait, yaitu Hermansyah et al., (2010) mengenai sintesis dimetil eter menggunakan katalis Cu-Zn/γ-Al2O3 dalam
reaktor fixed bed. Hasil terbaik dengan metode sol-gel impregnasi bahwa komposisi terbaik Cu-Zn/γ-Al2O3, yaitu 40/27/33 untuk hasil konversi CO sebesar
5 70%, selektivitas sebesar 80%, dan yield sebesar 54% pada kondisi operasi tekanan 20 bar dan suhu 220℃.
Penelitian Husin et al., (2010) mengenai pembuatan katalis Cu/ZnO/Al2O3
untuk proses steam reforming metanol menjadi hidrogen sebagai bahan bakar alternatif merupakan reaksi kebalikan dari reaksi syngas dengan menggunakan cracking catalyst, yaitu Cu yang dipadukan dengan ZnO yang mampu mencegah Cu agar tidak terdeaktivasi. Cu yang ditambahkan dengan ZnO dalam jumlah yang proporsional, yaitu saat penambahan Cu 15% pada temperatur reaksi 350℃ diperoleh konversi metanol tertinggi, yaitu 86%. Penelitian Yue et al., (2000) melaporkan bahwa katalis CuO/ZnO/Al2O3 umumnya digunakan sebagai katalis
pada reaksi syngas menjadi metanol. Kondisi suhu reaksi syngas rendah berkisar antara 180-250℃ dan suhu sedang, yaitu 230-350℃.
Berdasarkan ulasan latar belakang diatas, maka akan dilakukan penelitian yang bertujuan untuk mensintesis karbon aktif dari cangkang kelapa sawit sebagai penyangga katalis melalui proses karbonisasi pada suhu 450℃ selama 3 jam dan dilanjutkan melalui proses aktivasi kimia dengan 30 mL larutan H3PO4 9%.
Impregnasi logam Cu dan Zn untuk meningkatkan aktivitas katalis untuk reaksi syngas menjadi metanol pada kondisi operasi, yaitu laju alir H2:CO 10:5
mL/menit; variasi suhu 200℃, 230℃, 240℃, 250℃, 260℃; tekanan 12 bar; dan selama 30 menit.
6 1.2 Rumusan Masalah
1) Apakah karbon aktif dari limbah cangkang kelapa sawit dapat digunakan sebagai penyangga (support) katalis?
2) Apakah katalis Cu/Zn/karbon aktif dengan rasio 10/10/80, 15/5/80, dan 5/15/80 (%wt) berpengaruh terhadap karakterisasi katalis (BET, XRD, FTIR, dan SEM-EDX)?
3) Apakah katalis Cu/Zn/karbon aktif dengan rasio 10/10/80, 15/5/80, dan 5/15/80 (%wt) berpengaruh terhadap reaksi syngas menjadi metanol?
1.3 Hipotesis
1) Limbah cangkang kelapa sawit dapat digunakan sebagai penyangga katalis.
2) Katalis Cu/Zn/karbon aktif dengan rasio 10/10/80, 15/5/80, dan 5/15/80 (%wt) berpengaruh terhadap karakterisasi katalis (BET, XRD, FTIR, dan SEM-EDX).
3) Katalis Cu/Zn/karbon aktif dengan rasio 10/10/80, 15/5/80, dan 5/15/80 (%wt) berpengaruh terhadap reaksi syngas menjadi metanol.
1.4 Tujuan Penelitian
1) Memanfaatkan limbah cangkang kelapa sawit sebagai penyangga katalis.
2) Menentukan karakteristik katalis Cu/Zn/karbon aktif menggunakan alat instumen BET, XRD, FTIR, dan SEM-EDX.
7 3) Menentukan rasio katalis Cu/Zn/karbon aktif terbaik terhadap reaksi
syngas menjadi metanol.
1.5 Manfaat Penelitian
1) Mengatasi persoalan limbah cangkang kelapa sawit yang semakin meningkat.
2) Mengurangi produk impor katalis dengan mampu memproduksi katalis yang memanfaatkan bahan baku alam yang berasal dari dalam negeri.
3) Mampu memproduksi metanol, sehingga dapat digunakan sebagai bahan bakar alternatif dan industri petrokimia.
8 BAB II
TINJAUAN PUSTAKA
2.1 Cangkang Kelapa Sawit
Cangkang kelapa sawit merupakan salah satu limbah pengolahan minyak kelapa sawit yang cukup besar, yaitu mencapai 60% dari produksi minyak kelapa sawit (Fauzi et al., 2002). Limbah padat kelapa sawit mengandung hemiselulosa 33,52%, selulosa 38,52%, lignin 20,36%, zat ekstraktif 3,68% dan abu sebesar 3,92% (Khor, 2009).
Cangkang kelapa sawit merupakan salah satu bahan baku yang kualitasnya cukup baik untuk dijadikan karbon aktif. Cangkang kelapa sawit yang biasanya dijadikan bahan pembuat karbon aktif adalah kelapa sawit yang dijadikan kopra. Bentuk, ukuran, dan kualitas cangkang kelapa sawit harus diperhatikan. Jika ukurannya terlalu hancur, maka cangkang kelapa sawit itu kurang baik dijadikan bahan pembuat karbon aktif. Cangkang kelapa sawit yang umumnya dijadikan syarat karbon aktif adalah cangkang kelapa sawit yang benar-benar tua, hingga warnanya hitam mengkilap dan keras. Pembuatan karbon aktif yang berkualitas, sebaiknya dilakukan dengan cara dibersihkan dan terpisah dari sabutnya, serta berbentuk setengah atau seperempat cangkang kelapa sawit (Sya’ban, 2010).
2.2 Karbon Aktif
Karbon aktif adalah suatu bahan mengandung karbon amorf yang memiliki permukaan dalam (internal surface), sehingga memiliki daya serap tinggi (Purnomo, 2010). Karbon aktif merupakan nama dagang untuk arang aktif yang mempunyai porositas yang tinggi, dibuat dari bahan baku yang mengandung
9 bahan dasar karbon. Tahapan pembuatan karbon aktif, diantaranya dehidrasi, karbonisasi, dan aktivasi.
a. Dehidrasi
Dehidrasi merupakan proses penghilangan kandungan air yang terdapat dalam bahan baku karbon aktif dengan tujuan untuk menyempurnakan proses karbonisasi dan dilakukan dengan cara menjemur bahan baku di bawah sinar matahari, atau dengan memanaskan sampel pada suhu berkisar antara 170℃ dalam oven (Melania, 2012).
b. Karbonisasi
Karbonisasi merupakan tahapan pemecahan bahan-bahan organik menjadi karbon. Cangkang kelapa sawit yang mengandung karbon dikarbonisasi pada suhu 450℃ tanpa adanya gas oksigen dalam furnace. Tujuan proses karbonisasi, yaitu untuk memisahkan bahan non karbon yang terperangkap dalam bahan baku, sehingga sebagian besar yang tersisa dari bahan adalah karbon.
Sebelum proses karbonisasi, cangkang kelapa sawit dibersihkan agar dapat dipisahkan dari kotorannya, seperti tanah dan kerikil. Selain itu, cangkang kelapa sawit didehidrasi, bertujuan untuk menghilangkan kandungan air pada sampel. Cangkang kelapa sawit yang sudah didehidrasi dipotong kecil-kecil untuk menyempurnakan dan meratakan proses karbonisasi (Pujiarti et al., 2005). Selanjutnya, cangkang kelapa sawit dipanaskan tanpa udara dan tanpa penambahan zat kimia. Namun, pada pembentukan karbon proses karbonisasi yang digunakan adalah pembakaran tidak sempurna. Pembakaran tidak sempurna adalah proses pembakaran dengan persediaan oksigen terbatas yang akan menghasilkan CO atau karbon dalam bentuk arang (karbon) (Fessenden, 1982).
10 Proses karbonisasi dilakukan pada suhu 450-700℃. Suhu harus diperhatikan, karena jika suhu terlalu tinggi, seperti diatas 1000℃ akan mengakibatkan banyaknya abu yang terbentuk, sehingga dapat menutupi pori-pori dan membuat luas permukaan berkurang, serta daya adsorpsinya menurun (Shofa, 2012). Proses karbonisasi akan dihasilkan arang (karbon) yang mempunyai kapasitas penyerapan rendah. Selanjutnya, akan dilakukan proses lanjutan, yaitu aktivasi karbon aktif agar memiliki kapasitas penyerapan yang tinggi (Sya’ban, 2010). Faktor-faktor yang mempengaruhi proses karbonisasi, yaitu:
1. Waktu Karbonisasi
Waktu karbonisasi yang lama akan menghasilkan reaksi pirolisis yang semakin sempurna, sehingga hasil arang semakin turun tetapi cairan dan gas makin meningkat. Waktu karbonisasi berbeda-beda tergantung pada jenis-jenis dan jumlah bahan yang diolah.
2. Suhu Karbonisasi
Suhu karbonisasi berpengaruh terhadap hasil arang, karena semakin tinggi suhu, arang (karbon) yang diperoleh makin berkurang tapi hasil cairan dan gas semakin meningkat. Hal ini disebabkan oleh makin banyaknya zat-zat terurai dan yang teruapkan.
Proses karbonisasi mengeluarkan banyak asap sebagai indikasi bahwa senyawa-senyawa volatil (CO, CO2, CH4, dan H2) yang terkandung dalam
cangkang kelapa menguap. Proses karbonisasi sudah selesai, ketika cangkang kelapa sudah sepenuhnya berubah warna menjadi hitam dan hanya sedikit asap yang keluar. Hal ini menunjukkan bahwa karbon aktif sudah terbentuk dan
11 senyawa-senyawa volatil sudah menguap. Karbon hasil proses karbonisasi cangkang kelapa sawit dapat dilihat pada Gambar 1.
Gambar 1. Karbon Aktif (Shofa, 2012) c. Aktivasi
Aktivasi adalah perubahan secara fisik dimana luas permukaan dari karbon meningkat, karena terjadinya penghilangan senyawa tar dan senyawa sisa-sisa karbonisasi (Shreve et al., 1977). Proses aktivasi bertujuan untuk membuka dan menambah pori-pori pada karbon aktif. Semakin bertambahnya jumlah pori-pori karbon aktif akan meningkatkan luas permukaan karbon aktif, sehingga kapasitas penyerapannya menjadi bertambah besar.
Daya serap karbon aktif semakin kuat bersamaan dengan meningkatnya konsentrasi dari aktivator yang ditambahkan. Hal ini memberikan pengaruh yang kuat untuk mengikat senyawa-senyawa tar keluar melewati mikro pori-pori dari karbon aktif, sehingga permukaan dari karbon aktif tersebut semakin lebar atau luas yang mengakibatkan semakin besar pula daya serap karbon aktif tersebut. Studi tentang karbon aktif telah banyak melaporkan bahwa terdapat beberapa kelebihan aktivasi kimia dibandingkan aktivasi fisika, bahwa kelebihannya, yaitu aktivasi kimia memungkinkan untuk diperoleh luas permukaan karbon aktif yang lebih tinggi daripada aktivasi fisika (Gunawan, 2010). Metode aktivasi yang dapat digunakan, antara lain (Tutik et al., 2001).
12 1. Aktivasi kimia
Proses aktivasi dilakukan dengan mempergunakan bahan kimia sebagai activating agent. Metode ini bertujuan untuk mendegradasi molekul organik selama proses karbonisasi, membatasi pembentukan tar, membantu dekomposisi senyawa organik, dehidrasi air yang terjebak dalam rongga-rongga karbon, membantu menghilangkan endapan hidrokarbon yang dihasilkan, serta melindungi permukaan karbon (Alfiany et al., 2013).
Aktivasi kimia ini dilakukan dengan merendam arang (karbon) ke dalam larutan kimia, diantaranya ZnCl2, HNO3, KCl, dan lain lain. Aktivasi kimia
dengan menggunakan ZnCl2 dan H3PO4 digunakan karena dapat meningkatkan
porositas dan rendemen. Akan tetapi penggunaan ZnCl2 bersifat korosif dan
berbahaya karena dapat mengeluarkan gas klor yang bersifat racun (Garcia et al., 2002). Aktivasi menggunakan kombinasi H3PO4 dan uap air sangat dianjurkan
(Baker et al., 1997). Konsentrasi asam fosfat yang biasa digunakan untuk mengaktifkan arang (karbon) adalah sebesar 10-15% yang direndam selama 12-24 jam (Sudrajat et al., 2011). Unsur-unsur mineral dari persenyawaan kimia yang ditambahkan tersebut akan meresap ke dalam karbon dan membuka permukaan yang semula tertutup oleh komponen kimia, sehingga volume dan diameter pori bertambah besar. Pemilihan jenis aktivator akan berpengaruh terhadap kualitas karbon aktif. Masing-masing jenis aktivator akan memberikan pengaruh yang berbeda-beda terhadap luas permukaan maupun volume pori-pori karbon aktif yang dihasilkan (Kurniawan et al., 2014).
Faktor-faktor yang mempengaruhi aktivasi kimia, yaitu lamanya waktu perendaman, sebab waktu perendaman untuk bermacam-macam zat tidak sama.
13 Sebagai contoh, tempurung kelapa dengan aktivator ZnCl2 direndam selama 20
jam (Tutik et al., 2001). Selain itu, faktor lainnya yaitu konsentrasi aktivator. Semakin tinggi konsentrasi larutan kimia yang digunakan untuk aktivasi, maka akan semakin kuat pengaruh larutan tersebut mengikat senyawa-senyawa tar sisa karbonisasi untuk keluar melewati mikro pori-pori dari karbon, sehingga permukaan karbon semakin besar (Sudrajat et al., 1994).
2. Aktivasi Fisika
Pada cara ini arang (karbon) dipanaskan dengan suhu tinggi didalam sistem tertutup tanpa udara sambil dialiri gas inert. Saat ini terjadi reaksi lanjutan pemecahan atau peruraian sisa deposit tar dan senyawa hidrokarbon sisa karbonisasi, sehingga keluar dari permukaan karbon sebagai akibat gas bersuhu tinggi dan adanya aliran gas inert, sehingga akan dihasilkan karbon dengan luas permukaan yang cukup luas atau disebut karbon aktif (Tutik et al., 2001). Faktor yang mempengaruhi aktivasi fisika, yaitu ukuran bahan. Semakin kecil ukuran bahan, maka akan semakin cepat perataan keseluruh umpan, sehingga pirolisis berjalan sempurna.
Selain itu, faktor lainnya yaitu suhu aktivasi. Semakin tinggi suhu aktivasi, luas permukaan yang dihasilkan akan semakin besar. Peningkatan suhu selama waktu tertentu akan meningkatkan pembentukan pori-pori baru baik mikropori, mesopori, dan makropori. Namun, bila suhu dan waktu aktivasi meningkat terus menerus akan menyebabkan luas permukaan menurun. Suhu dan waktu aktivasi harus disesuaikan dengan kandungan karbon pada bahan baku agar karbon yang terkandung pada bahan baku tidak habis (Shofa, 2012).
14 2.3 Katalis
Katalis adalah substansi/zat yang dapat memberikan jalur alternatif dalam suatu reaksi dengan cara menurunkan energi aktivasi, sehingga energi minimum yang dibutuhkan untuk terjadinya reaksi berkurang, dan reaksi menjadi lebih cepat (Tsani, 2011). Energi aktivasi merupakan energi minimum yang dibutuhkan oleh campuran reaktan untuk menghasilkan suatu produk. Perbedaan energi aktivasi menggunakan katalis dan tanpa katalis dijelaskan pada Gambar 2.
Gambar 2. Grafik Energi Aktivasi Reaksi tanpa Katalis dan Adanya Katalis (Silberberg, 2008)
Penurunan energi aktivasi disebabkan reaksi tersebut menempuh jalan lain dengan cara katalis terlebih dulu bereaksi dengan reaktan sebelum berinteraksi dengan reaktan lainnya. Hasil interaksi katalis dengan reaktan tersebut adalah zat antara (intermediet) yang bersifat reaktif dan selanjutnya menghasilkan produk reaksi (Harfani, 2009).
Katalis bersifat spesifik dalam mempercepat laju reaksi. Artinya, suatu katalis dapat mempercepat reaksi tertentu saja tidak pada semua reaksi kimia. Kemampuan suatu katalis dalam mempercepat laju reaksi dipengaruhi oleh berbagai faktor. Faktor-faktor laju reaksi adalah kondisi operasi (temperatur, tekanan, laju alir, dan waktu kontak); jenis umpan yang digunakan; dan jenis padatan pendukung (support) yang digunakan. Katalis yang dipreparasi dengan
15 cara berbeda akan menghasilkan aktivitas dan selektivitas yang berbeda (Rieke et al.,1997).
2.3.1 Komponen Katalis
Komponen katalis berpengaruh terhadap sifat aktivitas dan selektivitas dari katalis, terdiri dari beberapa bagian yaitu:
1. Sisi Aktif
Sisi aktif katalis merupakan sisi yang berfungsi untuk melakukan proses reaksi secara spesifik pada katalis. Sisi aktif yang terdapat pada katalis dapat berupa logam transisi dimana logam tersebut memiliki orbital yang masih dapat diisi oleh elektron dari reaktan, sehingga reaktan dapat dengan mudah membentuk ikatan dengan logam tersebut dan dihasilkan reaksi yang diharapkan (Siswodiharjo, 2006). Maka, komponen situs aktif mampu mengonversikan reaktan dan selektif dalam pembuatan produk. Sisi aktif dapat berupa grup atau kluster dengan atom tetangga pada permukaan katalis maupun spesi yang teradsorpsi ke dalam katalis (Satterfield, 1991).
2. Penyangga (Support)
Penyangga merupakan substansi inert yang dapat mendispersikan sisi aktif katalis. Penyangga berfungsi sebagai tempat distribusi fase aktif dengan reaktan. Penyangga membantu proses adsorpsi dan desorpsi. Selain itu, penyangga katalis digunakan untuk mengefektifkan penggunaan komponen katalis (sisi aktif) yang cukup mahal, seperti platinum, dan untuk meningkatkan kekuatan mekanik dari sisi aktif katalis agar tidak mudah hancur saat terjadi proses katalitik. Penyangga katalis juga dapat berfungsi untuk menstabilkan struktur aktif dengan cara katalitik, sehingga sintering (penggabungan) dapat dikurangi (Satterfield, 1991).
16 3. Promotor
Promotor adalah substansi dalam jumlah sedikit yang dapat meningkatkan aktivitas, selektivitas, atau stabilitas katalis. Promotor dapat teradsorbsi dalam katalis tersebut. Katalis yang ditambahkan promotor bertujuan untuk mencegah aktivitas yang tidak diinginkan, seperti pembentukan deposit karbon. Promotor dapat digolongkan menjadi dua, yaitu promotor tekstural dan promotor struktural (Satterfield, 1991). Promotor tekstural adalah substansi inert yang mencegah penggabungan (sintering) dari mikrokristal pada katalis aktif dimana promotor ini ada dalam bentuk partikel yang sangat halus. Adapun, promotor struktural merupakan promotor yang dapat mengubah komposisi kimia dari katalis (Satterfield, 1991).
2.3.2 Penggolongan Katalis
Berdasarkan fasenya, katalis digolongkan menjadi katalis homogen dan katalis heterogen. Katalis homogen adalah katalis yang fasenya sama dengan fase reaksinya, sehingga sifat katalitiknya lebih besar daripada katalis heterogen. Sulitnya memisahkan katalis dari sistem reaksinya menjadi kelemahan dari katalis homogen. Adapun, katalis heterogen adalah katalis yang fasenya berbeda dengan fase reaksinya. Katalis heterogen relatif kurang reaktif dikarenakan heterogenitas permukaannya. Namun, kelebihannya mudah untuk dipisahkan dari sistem reaksinya dan relatif stabil terhadap perlakuan panas (Zhao et al., 2006). Penggunaan katalis heterogen dalam segi biaya lebih murah daripada katalis homogen. Secara lingkungan, penggunaan katalis heterogen lebih ramah lingkungan daripada katalis homogen. Oleh karena itu, penggunaan katalis
17 heterogen menjadi suatu alternatif yang sangat menarik dalam industri kimia, sebab mudah untuk digunakan kembali.
2.3.3 Impregnasi Katalis
Preparasi pada katalis heterogen umumnya dilakukan dengan cara mengimpregnasikan komponen aktif pada penyangga katalis. Impregnasi bertujuan untuk mengisi pori-pori penyangga dengan larutan logam aktif melalui adsorpsi logam, yaitu dengan merendam penyangga dalam larutan yang mengandung logam aktif. Pembuatannya dilakukan dengan mengontakkan padatan penyangga katalis dengan larutan logam aktif yang mengandung senyawa terlarut dalam air atau pelarut lainnya. Impregnasi dibagi menjadi dua, yaitu impregnasi basah dan impregnasi kering. Pada impregnasi basah, penyangga dilarutkan dengan sejumlah larutan yang mengandung senyawa logam yang dengan volume berlebih dengan volume pori-pori penyangga, setelah itu dikeringkan. Tujuan dikeringkan adalah untuk menghilangkan sisa air. Selanjutnya, di kalsinasi bertujuan untuk mendekomposisi garam logam menjadi oksida logam dan meningkatkan stabilitas katalis terhadap perubahan temperatur. Kelebihan dengan impregnasi basah, yaitu pembuatannya sederhana, murah, dan pemuatan logam dapat dilakukan berulang kali. Selain itu, kekurangan dari impregnasi basah, yaitu jumlah logam yang terimpregnasi sangat bergantung pada kelarutan senyawa logam tersebut. Impregnasi kering, penyangga dikontakkan dengan larutan impregnan dalam volume yang sama dengan volume pori penyangga (Taufiq, 1995).
18 2.4 Fischer-Tropsch
Sintesis Fischer-Tropsch merupakan proses penting dalam industri untuk mengubah gas sintesis yang dihasilkan dari proses steam reforming, parsial oksidasi atau autothermal reforming menjadi senyawa hidrokarbon dan oksigenat. Saat ini, sintesis Fischer-Tropsch merupakan suatu pilihan untuk memproduksi bahan bakar transportasi yang ramah lingkungan dan sebagai bahan baku kimia (Sultan, 2011). Sintesis Fischer-Tropsch merupakan proses dalam indsutri untuk mengubah gas sintesis (H2/CO) yang berasal dari bahan yang mengandung
karbon, seperti batubara, kelapa sawit, biomassa, dan gas alam.
Sintesis Fischer-Tropsch digunakan untuk konversi syngas (H2/CO)
menjadi metanol. Syngas merupakan gas yang terdiri dari campuran gas yang mengandung sejumlah gas karbon monoksida (CO) dan hidrogen (H2). Syngas
dapat digunakan untuk bahan bakar melalui proses Fischer-Tropsch. Pada umumnya katalis yang banyak digunakan pada reaksi syngas menjadi metanol, yaitu Fe/Cu/K untuk suhu tinggi berkisar antara 400-500℃ (Bayron et al., 2010) dan katalis CuO/ZnO/Al2O3 untuk suhu rendah berkisar antara 180-250℃ dan
suhu sedang, yaitu 230-350℃ (Yue et al., 2000). Reaksi sintesis metanol merupakan reaksi katalitik. Secara umum, reaksi sintesis metanol pada fase gas dengan katalis berbasis Cu adalah sebagai berikut (Bondiera et al., 1991).
CO (g)+ 2H2 (g) → CH3OH (g) ∆H300 K = −90,77 kJ/mol
Reaksi tersebut merupakan reaksi eksotermis, karena entalpi pembentukan metanol bernilai negatif. Pembentukan metanol ke arah produk menunjukan terjadinya penurunan jumlah mol atau volume yang diperkecil, sehingga agar tercapai kesetimbangan, maka tekanan harus diperbesar dan suhu diturunkan.
19 Pada sintesis metanol, jenis katalis yang digunakan mempengaruhi kondisi operasi sintesis metanol, karena masing-masing katalis memiliki aktivitas katalitik pada kondisi tertentu.
Produksi metanol dari hidrogenasi CO secara komersial pertama kali dilakukan oleh Badische Anilin and Soda Fabrik (B.A.S.F.) di Jerman pada tahun 1923. Pada prosesnya digunakan tekanan tinggi dengan katalis berbasis Zn yang mengandung ZnO/Cr2O3. Kondisi operasi pada teknologi proses BASF ini
memiliki tekanan 250–350 bar dan suhu 320–450℃. Perkembangan selanjutnya, dikembangkan teknologi sintesis metanol pada tekanan rendah yang menggantikan proses sebelumnya. Pada tahun 1966, Imperial Chemical Industries, Ltd. (I.C.I.) mengembangkan proses sintesis metanol tekanan rendah dengan menggunakan katalis berbasis Cu yang mengandung Cu/ZnO/ Al2O3.
2.5 Karakterisasi Katalis
2.5.1 BET (Bruneur-Emmet Teller)
Luas permukaan merupakan luasan yang ditempati satu molekul adsorbat/zat terlarut yang merupakan fungsi langsung dari luas permukaan sampel. Luas permukaan total merupakan kriteria krusial untuk katalis padat, karena sangat menentukan jumlah situs aktif di dalam katalis yang berkaitan dengan aktivitas katalitik. Prinsip pengukuran dengan metode BET adalah dengan cara adsorpsi fisis gas, yaitu menentukan jumlah molekul yang dibutuhkan untuk menutupi permukaan padatan dengan monolayer zat yang diserap (adsorbat), dengan mengetahui luas yang ditempati oleh suatu molekul adsorbat, maka luas permukaan katalis dapat diketahui ( Gregg et al.,1982).
20 Pengujian BET meliputi pengujian luas permukaan. Sebelum sampel diuji, terlebih dahulu sampel dilakukan degassing pada suhu 120℃ selama 1 jam dan pada suhu 320℃ selama 5 jam dalam keadaan vakum untuk menghilangkan uap air pada permukaan penyangga dan pori-pori penyangga. Jika proses degassing telah selesai, maka sampel dalam dewar flask diisi dengan nitrogen cair. Nitrogen cair berfungsi untuk menciptakan kondisi suhu yang sama pada tabung sampel agar tejadi adsorpsi dan desorpsi gas nitrogen ke permukaan sampel. Selanjutnya, sampel dialirkan gas He untuk mengevakuasi kebocoran pada tabung dan membersihkan sampel dari pengotor yang mampu mengganggu pembacaan adsorpsi gas nitrogen pada penyangga. Gas nitrogen sebagai gas adsorbat yang akan teradsorpsi pada permukaan dan pori-pori. Luas permukaan dipengaruhi oleh ukuran partikel/pori, bentuk pori, dan susunan pori dalam partikel (Martin et al.,1993). Analisis luas permukaan katalis menggunakan alat instrumentasi Autosorb 6-B yang didasarkan pada metode pengujian untuk luas permukaan (ASTM D3663-03).
21 2.5.2 XRD (X-Ray Diffraction)
X-Ray Diffraction (XRD) adalah teknik analisis yang bertujuan untuk mengetahui susunan berbagai jenis atom dalam kristal, orientasi kristal, dan cacat kristal. XRD digunakan untuk mengidentifikasi struktur kristal suatu padatan dengan membandingkan nilai jarak d (bidang kristal) dan intensitas puncak difraksi dengan data standar. Karakterisasi XRD bertujuan untuk mengidentifikasi fase bulk katalis untuk menentukan sifat kristal atau kristalinasi dari suatu kristal. XRD merupakan teknik untuk mengevaluasi sifat fase kristal dan ukuran kristal, sehingga dapat ditentukan apakah suatu material mempunyai kerapatan yang tinggi atau tidak (Leofanti et al., 1997).
Rancangan skematik spektrometer sinar-X yang didasarkan atas analisis Bragg diperlihatkan pada Gambar 4 seberkas sinar-X terarah jatuh pada kristal dengan sudut θ dan sebuah detektor diletakakan untuk mencatat sinar yang sudut hamburannya sebesar θ. Ketika θ diubah, detektor akan mencatat puncak intensitas yang bersesuaian dengan orde n yang akan divisualisasikan dalam difraktogram.
22 Prinsip dasar dari XRD adalah hamburan elektron yang mengenai permukaan kristal. Bila sinar dilewatkan ke permukaan kristal, sebagian kristal akan diteruskan ke lapisan berikutnya. Sinar yang dihamburkan akan berinterferensi secara konstruktif dan destruktif. Hamburan sinar yang berinterferensi konstruktif inilah yang digunakan sebagai analisis. Prinsip dasar yang digunakan untuk menentukan sistem kristal adalah dengan menggunakan persamaan hukum Bragg (Kittel, 1999).
2𝑑 sin 𝜃 = 𝑛𝜆 (1)
Keterangan:
d : jarak antar-bidang kisi 𝑛 : indeks difraksi
𝜆 : panjang gelombang sumber sinar-X 𝜃 : sudut pengukuran
Pengukuran kristalinitas relatif dapat dilakukan dengan membandingkan jumlah tinggi puncak pada sudut-sudut tertentu dengan jumlah tinggi puncak pada sampel standar. Analisis karakterisasi katalis untuk mengetahui kritalinitas katalis dengan menggunaan alat instrumentasi XRD Emperian yang didasarkan pada metode pengujian ASTM D3906-03 dan ASTM D5758-01.
2.5.3 FTIR (Fourier Transform Inframerah)
Inframerah merupakan sinar elektromagnetik yang panjang gelombangnya lebih daripada cahaya tampak dan kurang daripada mikrogelombang, yaitu diantara 700 nm dan 1mm. Inframerah dapat dibagi menjadi tiga macam, yaitu pada daerah inframerah pertengahan, yaitu pada panjang gelombang 2,5-50 M atau pada panjang bilangan gelombang 4000-200 cm-1. Vibrasi yang digunakan
23 untuk identifikasi adalah vibrasi tekuk, khususnya rocking, yaitu yang berada di daerah bilangan gelombang 2000-400 cm-1. Karena, di daerah antara bilangan gelombang 2000-400 cm-1 merupakan daerah khusus yang berguna untuk
identifikasi gugus fungsional, sehingga tiap senyawa mempunyai absorbansi yang unik, sehingga daerah tersebut sering disebut sebagai daerah sidik jari (fingerprint regio ) (Sari, 2010).
Energi yang diadsorp dari radiasi inframerah akan digunakan oleh ikatan molekul untuk menaikkan energi vibrasi dari ikatan tersebut. Vibrasi suatu ikatan adalah vibrasi ulur (stretch vibration) dan vibrasi tekuk (bend vibration). Setiap suatu ikatan kovalen akan menyerap radiasi inframerah pada panjang gelombang tertentu untuk menaikkan energi vibrasinya. Perbedaan radiasi saat inframerah masuk dan keluar sampai di deteksi dan hasilnya merupakan spektrum absorbansi
atau transmitansi (Coates, 2000). FTIR (Fourier Tranform Inframerah) adalah alat instrumentasi yang dapat
mengidentifikasikan tipe ikatan kimia dalam molekul. Karakterisasi dengan FTIR digunakan untuk mengidentifikasi gugus fungsi pada suatu sampel dan dianalisis secara kualitatif. Prinsip FTIR adalah serapan dari senyawa dengan tingkat energi vibrasi dan rotasi pada ikatan kovalen yang mengalami perubahan momen dipole dalam suatu molekul (Gotama, 2012). Analisis karakterisasi katalis untuk mengetahui gugus fungsi pada katalis menggunakan alat instumentasi FTIR yang didasarkan pada metode pengujian ASTM D6348-12e1.
24 2.5.4 SEM-EDX (Scanning Eletron Microscopy- Energy Dispersed X-ray
Spectroscopy)
SEM-EDX merupakan jenis mikroskop elektron yang menggambarkan sampel dengan cara scanning (memindai) menggunakan sinar terfokuskan dari elektron berenergi tinggi. Sumber elektron berasal dari katode pijar yang dipanaskan secara vakum. Ketika elektron menumbuk sampel, maka elektron akan diemisikan. Sinyal ini akan diterjemahkan oleh detektor dalam bentuk gambaran umum morfologi suatu material. Adanya perbedaa warna yang menujukkan topografi permukaan dan komposisi elemen yang berbeda.
Gambar 6. Skema kerja SEM-EDX (Hanke, 2001)
Berdasarkan Gambar 6 diatas, yaitu sebuah pistol elektron memproduksi berkas elektron dan dipercepat pada anoda. Lensa magnetik kemudian memfokuskan elektron menuju sampel. Berkas elektron yang terfokus memindai (scan) keseluruhan sampel dengan diarahkan oleh kumparan pemindai. Ketika elektron mengenai sampel, maka sampel akan mengeluarkan elektron yang baru yang akan diterima oleh detektor (Hanke, 2001).
25 Karakterisasi dengan menggunakan instumentasi SEM-EDX bertujuan untuk mengetahui morfologi katalis Cu/Zn/karbon aktif. Sebelum sampel katalis dikarakterisasi, sampel harus disiapkan dengan cara meratakan permukaan sampel pada sampel holder dan ditambahkan carbon tape, karena memiliki double side untuk merekatkan sampel dengan holder. Jika permukaan sampel tidak merata, maka akan banyak lekukan, lipatan, atau lubang, sehingga tiap-tiap permukaan akan memantulkan elektron dengan jumlah dan arah yang berbeda. Selanjutnya, untuk sampel yang tidak memiliki sifat konduktivitas listrik, seperti karbon aktif perlu untuk di coating (dilapisi) dengan Au dengan ketebalan 30 mm pada kuat arus 30 mA selama 30 detik. Logam Au dipilih, karena logam Au memiliki ukuran pori-pori yang kecil, sehingga tidak akan menutupi permukaan sampel. Selanjutnya, sampel dikarakterisasi SEM-EDX menggunakan sumber elektron dari tungsten pada tegangan 15 kV dalam kondisi vakum. Tungsten dipilih, karena memiliki titik lebur yang tinggi dan tekanan uap yang paling rendah, sehingga dapat dipanaskan untuk menghasilkan elektron. Sampel katalis yang berada dalam chamber harus dalam kondisi vakum, bertujuan agar elektron tidak diskaterd (terpencar) oleh molekul gas (O2) yang dapat menurunkan intensitas dan stability
beam. Jika tidak dalam kondisi vakum, maka akan terdapat molekul gas yang dapat menyebabkan kontras menjadi lebih rendah dan bayangan menjadi kabur. Sinyal yang dihasilkan SEM-EDX adalah berupa secondary electron dimana akan menghasilkan topografi dari sampel yang dianalisis dalam bentuk warna yang lebih cerah untuk permukaan yang lebih tinggi, akibat banyak melepaskan elektron.
26 SEM EDX juga dapat digunakan untuk mengetahui komposisi unsur dari suatu sampel. Energy Dispersed X-ray (EDX) menghasilkan kandungan unsur secara kualitatif ataupun semi kuantitatif terhadap suatu permukaan spesimen. EDX juga dapat digunakan untuk menganalisis secara kuantitatif persentase masing–masing elemen (Cahyana et al., 2014). Analisis menggunakan SEM yang digabung dengan EDX dapat mengidentifikasi unsur-unsur. EDX dihasilkan dari sinar X karakteristik, yaitu dengan menembakkan sinar X pada posisi yang ingin diketahui komposisinya. Setelah ditembakkan pada posisi yang diinginkan, maka akan muncul puncak–puncak tertentu yang mewakili suatu unsur yang terkandung. Emisi sinar-X tiap unsur khas dalam energi dan panjang gelombangnya, maka SEM EDX mampu menentukan tiap unsur yang mengemisikan sinar-X (Nugandini, 2007). Analisis karakterisasi katalis untuk mengetahui komposisi-komposisi unsur pada katalis menggunakan alat instumentasi SEM-EDX yang didasarkan pada metode pengujian ASTM E1508-12a.
2.5.5 CHN Analyzer
Prinsip kerja dari alat CHN analyzer, yaitu berdasarkan prinsip pembakaran dengan mengubah bahan organik atau anorganik menjadi produk pembakaran, kemudian gas hasil reaksi pembakaran berupa senyawa oksida dilewatkan media reduksi dan mengalir melalui kolom kromatografi dengan bantuan gas helium, kemudian dibakar pada temperatur tinggi, lalu gas yang dihasilkan dari pembakaran tersebut dikontrol dalam tekanan, temperatur, volume tertentu didalam chamber dan dipisahkan, kemudian gas yang sudah terpisah diukur oleh detektor konduktivitas termal.
27 Hasil dari analisis ini direpresentasikan sebagai komponen gas C, H, dan S (%w) dari sampel sedimen yang dianalisis (Faadeva et al., 2007). Analisis untuk mengetahui kandungan unsur-unsur, yaitu C, H, dan N pada katalis menggunakan alat instumentasi CHN analyzer yang didasarkan pada metode pengujian ASTM D5373-16.
Gambar 7. Alat Intrumentasi CHN Analyzer 2.5.6 Gas Chromatograph (GC)
Kromatogram gas merupakan suatu teknik analisis yang digunakan untuk mengidentifikasi senyawa kimia yang bersifat mudah menguap. Kromatogram gas (GC) merupakan suatu metode pemisahan campuran yang terdiri dari dua jenis komponen atau lebih, yang didasarkan pada perbedaan migrasi di antara dua fase, yaitu fase diam yang berupa padatan dan fase gerak berupa gas. Prinsip kromatogram gas didasarkan pada berat molekul (Mr Senyawa) dari masing-masing komponen gas, dimana komponen gas yang memiliki berat molekul lebih ringan akan keluar terlebih dahulu dan komposisi gas lainnya yang memiliki berat molekul yang lebih berat akan keluar lebih lama.
Kromatogram gas dapat digunakan untuk analisis kualitatif dan kuantitatif. Analisis kualitatif dilakukan dengan cara membandingkan waktu retensi dari komponen yang dianalisis dengan waktu retensi zat baku pembanding (standar)
28 pada kondisi analisis yang sama. Waktu retensi adalah waktu yang dibutuhkan sampel untuk terdeteksi oleh detektor (ditandai dengan puncak pita elusi). Komponen yang berbeda memiliki waktu retensi yang berbeda akibat perbedaan interaksi dengan fase diam (Abdullah et al., 2008). Analisis kuantitatif dilakukan dengan cara perhitungan relatif dari tinggi atau luas puncak kromatogram komponen yang dianalisis terhadap zat baku pembanding (standar) yang dianalisis (McNair et al., 1998). Sebelum analisis sampel dilakukan, maka sebaiknya dilakukan analisis terhadap gas standar terlebih dahulu, sehingga memiliki tujuan untuk mengetahui waktu retensinya. Berikut ini adalah jenis-jenis kromatogram gas, yaitu:
1. GC-TCD (Gas Chromatogram-Thermal Conductivity Detector)
GC-TCD merupakan analisis yang digunakan untuk gas-gas anorganik, seperti argon, nitrogen, hidrogen, karbon monoksida, dan karbon dioksida, serta molekul hidrokarbon kecil lainnya. Prinsip TCD, yaitu membandingkan konduktivitas panas aliran gas, sehingga gas yang mempunyai konduktivitas panas yang besar, karena adanya pergerakan molekul gas yang cepat, akan keluar lebih dahulu sampai di detektor. Pergerakan molekul gas yang cepat adalah akibat dari berat molekul gas yang ringan, sehingga memiliki daya hantar panas yang lebih baik. Sebaliknya, ketika berat molekul gas besar, maka akan menyebabkan konduktivitas panasnya menjadi kecil, akibat pergerakan molekulnya yang lambat, sehingga gas akan keluar lebih lama untuk sampai di detektor.
Analisis produk menggunakan GC-TCD bertujuan untuk menentukan % konsentrasi gas CO (karbon monoksida) yang masih terdapat dalam sampel yang akan dibandingkan dengan gas CO (karbon monoksida) standar berdasarkan
29 waktu retensinya dan tinggi atau luas puncak kromatogram. Analisis menggunakan alat instrumentasi GC-TCD didasarkan pada ASTM E516-95a.
Gambar 8. Alat Istrumentasi GC-TCD
2. GC-FID (Gas Chromatogram - Flame Ionization Detector)
Kromatogram gas yang digunakan dibedakan berdasarkan jenis detektornya, yaitu GC-FID. Prinsip kerja FID, yaitu terjadinya pembakaran sampel dengan menggunakan gas (udara dan hidrogen), sehingga dihasilkan ion-ion. Ion-ion positif akan tertarik ke elektroda negatif, sehingga arus bertambah. Arus mengalir melalui tahanan dan menimbulkan selisih tegangan. Penurunan tegangan yang terjadi disalurkan melalui amplifier dan masuk ke dalam suatu rekorder (Eiceman, 2000).
Analisis produk menggunakan GC-FID bertujuan untuk menentukan % konsentrasi (yield) gas metanol dari sampel yang dihasilkan yang akan dibandingankan dengan gas metanol standar berdasarkan waktu retensinya dan tinggi atau luas puncak kromatogram. Analisis menggunakan alat instrumentasi GC-FID didasarkan pada ASTM E594-96.
30 BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dimulai bulan Januari 2017 di Laboratorium Pusat Teknologi Sumber Daya Energi dan Industri Kimia (PTSEIK), Badan Pengkajian dan Penerapan Teknologi (BPPT), Kawasan Puspitek, Serpong. Karakterisasi sampel katalis dilakukan di beberapa instansi, seperti BET di Batan, XRD di BPPT klaster Geostek, FTIR di Batan, dan SEM-EDX di STP (Sentra Teknologi Polimer).
3.2 Alat dan Bahan
3.2.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah Autosorb-6B, XRD Empyrean PANalytical, FTIR, SEM-EDX, GC-FID Shimadzu, GC-TCD Shimadzu, microactivity PID reactor, LECO CHN628 ultimate analyzer, cup alumunium, desikator, cawan porselin dan cawan silica, seperangkat alat gelas kimia, oven, furnace, magnetic strirer, sieve shaker, mixer mill.
3.2.2 Bahan
Bahan yang digunakan dalam penelitian ini, yaitu bahan baku limbah cangkang kelapa sawit dari PTPN V Pekanbaru, Riau. Selain itu, bahan kimia yang digunakan, antara lain larutan H3PO4 9%, Cu(NO3)2. 3H2O, Zn(NO3)2.4H2O,
pelet KBr untuk analisis FTIR, logam Au dan etanol p.a untuk analisis SEM-EDX, gas Ar untuk GC-TCD, gas He untuk GC-FID, compress air, gas CO, gas H2, dan gas N2 untuk reaksi syngas, serta aquadest.
31 3.3 Prosedur Kerja
3.3.1 Karbonisasi Cangkang Kelapa Sawit (Kurniawan et al., 2014; Mody, 2014; Erlidawati et al., 2009)
Cangkang kelapa sawit sebanyak 1000 gram dihilangkan uap air, lalu dipanaskan pada suhu 450℃ selama 3 jam dalam furnace tanpa gas O2.
Kemudian, arang ditimbang dan dihaluskan dengan mixer mill, serta diayak menjadi ukuran 60 mesh, 100 mesh, dan 200 mesh dengan alat sieve shaker. Selanjutnya, arang ukuran 60 mesh dianalisis proksimat untuk mengetahui kadar air (moisture), kadar zat mudah menguap (volatile matter), kadar abu (ash), kadar karbon terikat (fixed carbon), dan analisis ultimate untuk mengetahui kadar C, H, N, S, dan O (%w), serta analisis menggunakan instrumentasi BET sebagai karbon aktif sebelum diaktivasi.
3.3.1.1 Analisis Proksimat
1. Kadar Air (Moisture) (ASTM D3173-11)
Cawan crucible ditimbang dengan tutupnya sebagai bobot kosong, lalu ditimbang sampel yang lolos ayakan 60 mesh sebanyak 1 gram dan dimasukkan ke dalam cawan crucible, serta dicatat bobotnya. Analisis kadar air dilakukan pada suhu 105℃. Furnace diatur suhunya hingga mencapai suhu 105℃, jika suhunya sudah konstan pada 105℃, maka tutup crucible dibuka, lalu crucible dimasukkan ke dalam furnace selama 60 menit. Selanjutnya, crucible dikeluarkan dari dalam furnace dan segera ditutup dengan tutup crucible, kemudian dimasukkan ke dalam desikator. Selanjutnya, jika crucible sudah dingin, maka crucible dikeluarkan dari desikator dan ditimbang, serta dicatat sebagai bobot akhir. Kadar air dihitung menggunakan persamaan:
32 KA =
𝜑1− 𝜑2
𝜑1 𝑥 100% (2)
Keterangan:
KA: Kadar air (moisture) (%)
𝜑1: Bobot sampel awal (gram) 𝜑2: Bobot sampel akhir (gram)
2. Kadar Zat Menguap (Volatile Matter) (ASTM D3175-11)
Cawan crucible ditimbang dengan tutupnya sebagai bobot kosong, lalu ditimbang sampel yang lolos ayakan 60 mesh sebanyak 1 gram dan dimasukkan ke dalam cawan crucible, serta dicatat bobotnya. Analisis kadar volatile matter dilakukan pada suhu 950℃. Sebelumnya, furnace diatur suhunya 105℃ selama 60 menit dengan tutup crucible yang dibuka, lalu dinaikkan suhunya hingga mencapai 950℃ dengan menggunakan crucible dan tutupnya selama 7 menit. Selanjutnya, crucible dikeluarkan dari dalam furnace, kemudian dimasukkan ke dalam desikator. Selanjutnya, jika crucible sudah dingin, maka crucible dikeluarkan dari desikator dan ditimbang, serta dicatat sebagai bobot akhir. Kadar volatile matter dihitung menggunakan persamaan:
Vm = 𝜑1− 𝜑2
𝜑1 𝑥 100% - KA (3)
Keterangan:
Vm: Kadar zat menguap (volatile matter) (%)
KA: Kadar air (moisture) (%)
𝜑1: Bobot sampel awal (gram) 𝜑2: Bobot sampel akhir (gram)
33 3. Kadar Abu (Ash Content) (ASTM D3174-12)
Cawan crucible ditimbang dengan tutupnya sebagai bobot kosong, lalu ditimbang sampel yang lolos ayakan 60 mesh sebanyak 1 gram dan dimasukkan ke dalam cawan crucible, serta dicatat bobotnya. Analisis kadar ash content dilakukan pada suhu 750℃. Furnace diatur suhunya hingga mencapai suhu 750℃, jika suhunya sudah konstan pada 750℃, maka crucible tanpa tutupnya dimasukkan ke dalam furnace selama 3 jam. Selanjutnya, crucible dikeluarkan dari dalam furnace dan segera ditutup dengan tutup crucible, kemudian dimasukkan ke dalam desikator. Selanjutnya, jika crucible sudah dingin, maka crucible dikeluarkan dari desikator dan ditimbang, serta dicatat sebagai bobot akhir. Kadar ash content dihitung menggunakan persamaan:
Ac = 𝜑2
𝜑1 𝑥 100% (4)
Keterangan:
Ac: Kadar abu (ash content) (%)
𝜑1: Bobot sampel awal (gram) 𝜑2: Bobot abu (gram)
4. Kadar Karbon Terikat (Fixed Carbon) (ASTM D3172-07a)
Kadar karbon terikat adalah fraksi karbon dalam arang selain fraksi air, zat menguap, dan abu. Kadar karbon terikat dihitung dengan menggunakan persamaan: