Koleksi, Pemurnian Dan Uji Hayati Isolat-Isolat Virus CMV Asal
Sumatera Utara
Edy Batara Mulya Siregar Fakultas Pertanian Jurusan Kehutanan Universitas Sumatera Utara
PENDAHULUAN
Latar Belakang
Virus Mosaik Ketimun (CMV) pertama kali dilaporkan pada tahun 1916 sebagai salah satu penyebab penyakit tanaman (Doolitle, 1916). CMV merupakan anggota genus Cucumovirus dari famili Bromoviridae (Rybicki, 1995; van Regenmortel, et al., 2000), mempunyai kisaran inang yang luas, penyebarannya di seluruh dunia, dan menyebabkan kerusakan berat pada sejumlah tanaman yang dibudidayakan. CMV dapat menginfeksi kelompok tanaman hortikultura, tanaman hias, dan sejumlah tanaman lainnya (terdiri dari 191 spesies iang dari 40 famili tanaman). Karakteristik tersebut membuat CMV menjadi salah virus tanaman yang secara ekonomis penting pada tanaman komersil (Palukaitis et al., 1992).
Diantara tanaman ekonomis penting yang dapat diinfeksi oleh CMV adalah cabai besar, cabai rawit, paprika, tomat, ketimun, melon, pisang, terong-terongan, krisan, lili, dan sejumlah tanaman hias lainnya (Chupp & Sherf, 1960; Agrios, 1998).
Banyaknya variasi gejala pada tanaman inang menjadikan CMV sulit untuk diidentifikasi berdasarkan gejalanya saja. Selain itu, CMV seringkali juga sulit dibedakan dengan isolat dari kelompok Cucumovirus lainnya, seperti alfalfa mosaic virus, tomato aspermy virus, peanut stunt virus, dan zucchini yellow mosaic virus (Francki, Mossop, and Hatta, 1979).
Pada tanaman ketimun (Cucumis sativus) dan anggota Cucurbitaceae lainnya, infeksi CMV menyebabkan gejala mosaik dan kerdil, dan mengurangi produksi buah (kuantitas dan kualitas buah). Pada tanaman tomat (Lycopersicon esculentum), infeksi CMV menyebabkan gejala mosaik, kerdil, dan reduksi lamina daun (fern leaf) (McNab, Sherf, and Springer, 1983). Pada tanaman cabai (Capsicum annuum), infeksi CMV menyebabkan gejala mosaik, blister, malformasi buah, dan bersama-sama dengan virus lainnya (TMV,TEV, PVY, CVMV) menyebabkan gejala infeksi virus kompleks (gejala keriting).
Partikel CMV mengandung tiga molekul ssRNA, yaitu RNA 1, RNA 2, dan RNA 3 serta dua sub genomik RNA, yaitu RNA 4 dan RNA 4A yang berhubungan dengan bagian 3’ dari RNA 3 dan RNA 2 (Ding et al., 1994; Peden and Symons 1973). RNA 1 dan RNA 2 mengkode protein yang berhubungan dengan replikasi, dan RNA 3 mengkode protein yang berhubungan dengan protein penyebaran atau movement protein (MP) (Suzuki et al., 1991).
Tujuan
Tujuan penelitian adalah :
1. Mendapatkan isolat-isolat CMV asal tanaman inang yang berbeda di Sumatera Utara
2. Mendapatkan strain-strain CMV asal Sumatera Utara yang berbeda 3. Mengkarakterisasi isolat-isolat CMV asal Sumatera Utara secara biologis.
TINJAUAN PUSTAKA Biologi CMV
CMV mempunyai nama sinonim, yaitu Cucumber virus, Cucumis virus, Marmor cucumeris, Spinach blight virus, dan Tomato fern leaf virus (Francki et al., 1979). CMV mempunyai banyak strain dan perbedaan antar strain tergantung kepada jenis inangnya, gejala yang dihasilkan, sifat penularannya, dan sifat serta karakteristik lainnya (Francki et al., 1979; Agrios 1998). Bebarapa strain CMV adalah A-CMV, E-CMV, L-CMV, N-CMV, P-N-CMV, Z-N-CMV, WAI dan WAII CMV (Francki et al., 1979).
CMV menyebabkan infeksi sitemik pada kebanyakan tanaman yang diinfeksinya. Bagian jaringan dan organ tanaman tanaman yang terbentuk awal infeksi biasanya tidak terpengaruh oleh infeksi CMV. Pengaruh infeksi CMV terutama terjadi pada sel-sel dan jaringan tanaman yang terbentuk setelah infeksi CMV terjadi. Konsentrasi virus meningkat setelah terjadi inokulasi, kemudian menurun pada tingkat tertentu atau tanaman menjadi mati (Agrios, 1998).
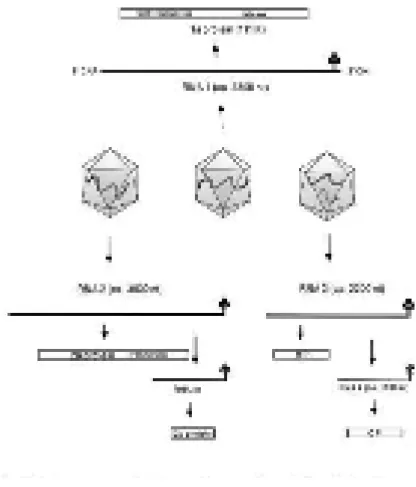
Partikel CMV mengandung tiga molekul ssRNA, yaitu RNA 1, RNA 2, dan RNA 3 serta dua sub genomik RNA, yaitu RNA 4 dan RNA 4A yang berhubungan dengan bagian 3’ dari RNA 3 dan RNA 2 (Ding et al., 1994; Peden and Symons 1973). RNA 1 dan RNA 2 mengkode protein yang berhubungan dengan replikasi, dan RNA 3 mengkode protein yang berhubungan dengan protein penyebaran atau movement protein (MP) (Suzuki et al., 1991). Pada Gambar 1 disajikan organisasi genom CMV.
Sifat fisik CMV adalah sebagai berikut : titik panas inaktifasi antara 50 sampai 55 0
C, titik batas pengenceran antara 1 : 2 000 dan 1 : 3 000. Ketahanan cairan perasannya antara 2 sampai 3 hari, tetapi jika disimpan dalam lemari es bersuhu 5 0C kemampuan infeksinya bertahan antara 5 sampai 6 hari (Sugiura, Bandaranayake, and Hemachandra, 1975).
CMV mempunyai kisaran inang yang sangat luas, dapat ditularkan secara mekanik, dan beberapa spesies inang dapat ditularkan melalui benih (Matthews, 2002), serta vektor serangga (Francki et al., 1979).
CMV mempunyai kisaran inang yang sangat luas, dapat ditularkan secara mekanik, dan beberapa spesies inang dapat ditularkan melalui benih (Matthews, 2002), serta vektor serangga (Francki et al., 1979).
Gambar 1. Organisasi Genom Virus Mosaik Ketimun (CMV) (Ding et al., 1994; Peden and Symons 1973) Epidemiologi
Virus Mosaik Ketimun adalah virus yang berbentuk polihedral dengan diamater 28 nm, menginfeksi lebih dari 775 spesies tumbuhan dalam 67 famili dan dapat ditularkan oleh 75 spesies aphid secara non persistent (Murant & Mayo, 1982). CMV mempunyai kisaran inang yang sangat luas, dapat ditularkan secara mekanik, dan pada beberapa spesies iang dapat ditularkan melalui benih (Matthews, 2002). CMV juga dapat ditularkan oleh vektor serangga, terutama oleh Myzus persicae dan Aphis gossypii secara non persisten (Francki et al., 1979).
Virus Mosaik Ketimun terdapat hampir di semua negara dan strain yang berbeda sifat biologinya telah dilaporkan dari berbagai tempat. Virus Mosaik Ketimun mempunyai banyak strain, oleh karena itu mempunyai jumlah inang yang banyak serta gejala yang ditimbulkan beragam. Di beberapa negara, Virus Mosaik Ketimun telah menyebabkan penyakit yang berat pada tanaman tertentu.
Pada tanaman cabai Virus Mosaik Ketimun dianggap penting untuk diperhatikan, karena serangannya cukup tinggi dan dapat menyebabkan kehilangan hasil yang cukup besar (Sutarya, Duriat, dan Gunaini, 1993). CMV tersebar luas di pertanaman cabai, menyebabkan pemuntiran daun, daun menjadi klorotik, belang ringan, kadang-kadang menunjukkan pola garis nekrotik pada daun. Pada buah juga menyebabkan terjadinya bercak-bercak nekrotik kecil yang banyak dan sangat jelas, atau bercak cekung berwarna coklat (Moorman dan Woodbrigge, 1983).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian pemurnian isolat dan uji hayati dilaksanakan di Laboratorium Bioteknologi dan Rumah Kaca Fakultas Pertanian, Universitas Sumatera mulai bulan Maret sampai dengan bulan Juni 2004. Uji ELISA dilaksanakan di Laboratorium Virologi Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Isolat-isolat CMV yang diduga menginfeksi tanaman inang yang berbeda, seperti ketimun, cabai keriting, cabai rawit, tomat, labu-labuan, dan terong-terongan. Dari masing-masing tanaman tersebut diambil minimal tiga buah sampel yang menunjukkan gejala terserang oleh CMV. Diusahakan agar ketiga sampel tersebut menunjukkan gejala yang berbeda (untuk mendapatkan variasi isolat yang lebih banyak).
Tanaman yang diperlukan untuk memperoleh isolat murni CMV adalah Nicotiana glutinosa, Cucumis. sativus, dan Chenopodium. amaranticolor.
Tanaman indikator untuk mempelajari gejala yang diinfeksi oleh semua isolat yang diperoleh. Tanaman indikator yang digunakan adalah : C. sativus, C. amaranticolor, N. glutinosa, N. tabacum, L. esculentum, C. annuum, C. frutescens, Vigna sinensis, Cucurbita pepo, Solanum melongena, Datura stramonium.
Bahan-bahan lain yang digunakan adalah kit antiserum CMV (AGDIA) untuk uji ELISA, carborundum 600 mesh, dan buffer posfat pH 7.0.
Alat yang digunakan antara lain adalah mortar dan saringan untuk menggiling dan menyaring kegiatan pembuatan inokulum, alat penginokulasi yang dibuat sendiri dengan ujung kapas dan mesin ELISA Reader untuk mengukur absorban hasil uji ELISA dengan panjang gelombang 405 nm.
Metode Penelitian
I. Perbanyakan Isolat CMV Dari Inang Berbeda
Isolat yang diperoleh dari lapang terlebih dahulu diperbanyak pada tanaman N. glutinosa. Setiap isolat diperbanyak minimal pada tiga tanaman N. glutinosa. Isolat yang menunjukkan gejala dan yang tidak menunjukkan gejala dicatat. Setelah gejala awal muncul, maka 14 hari kemudian tanaman sudah sebagai sumber inokulum. Selanjutnya dilakukan kegiatan pemurnian isolat CMV seperti dijelaskan pada kegiatan bagian II .
II. Pemurnian Isolat CMV Dari Inang Berbeda
Pemurnian isolat CMV yang diperoleh dari lapang diuji secara hayati untuk menseleksi isolat CMV. Metode pemurnian isolat CMV dilakukan sebagai berikut : sampel dari lapang yang telah diperbanyak pada tanaman N. glutinosa diinfeksikan ke tanaman C. sativus (pada kotiledonnya), dan selanjutnya diinfeksikan ke tanaman C. amaranticolor (diulang tiga kali). Selanjutnya virus yang diperoleh diinokulasikan kembali ke tanaman N. glutinosa dan C. sativus (Gambar 2). Gejala (waktu mulai muncul gejala, tipe gejala) yang muncul pada setiap tanaman yang diinokulasi dicatat dan didokumentasikan.
Selanjutnya isolat yang diperoleh dipelihara pada N. glutinosa dan untuk memastikan isolat yang diperoleh isolat dideteksi dengan Uji ELISA (AGDIA).
III. Uji Hayati Isolat CMV pada Beberapa Tanaman Indikator
Pada percobaan bagian III, semua isolat yang positif CMV diinokulasikan pada beberapa tanaman indikator dan diharapkan dapat menunjukkan gejala spesifik karena infeksi CMV. Tanaman indikator yang digunakan adalah : C. annuum, C. frutescens, L. esculentum, N. tabacum, Datura stramonium, Vigna sinensis, dan Cucurbita pepo. Masa inkubasi (waktu gejala muncul), tipe gejala (sistemik atau lokal), intensitas dan bentuk gejala dicatat dan didokumentasikan. Perbedaan isolat diharapkan dapat diidentifikasi berdasarkan perbedaan gejala pada tanaman indikator.
Skema Pemisahan Isolat CMV dari Lapang dengan Uji Hayati
Sampel Dari Lapang Inokulasi N. glutinosa (Gejala : mosaik belang, blister atau deformasi)
Inokulasi
C. sativus (Gejala : mosaik sistemik).
Inokulasi
C. amaranticolor (Gejala : lesio lokal)
Tiga lesio lokal diambil
Inokulasi
C. amaranticolor (Gejala : Lesio lokal)
Diulang sebanyak tiga kali
Inokulasi
C. sativus & N. glutinosa (Gejala positif)
Virus Mosaik Ketimun (+ = Uji ELISA)
Gambar 2. Skema Pemurnian Isolat Virus CMV dengan Menggunakan Tanaman Indikator.
HASIL DAN PEMBAHASAN I. Sumber Isolat CMV
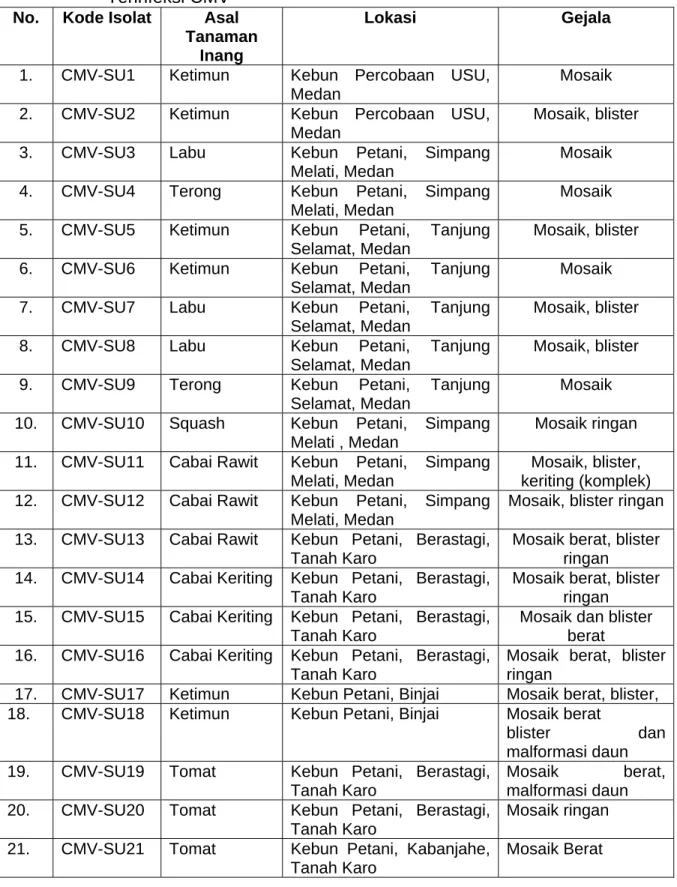
Pada kegiatan penelitian bagian pertama telah dilakukan koleksi isolat CMV dari sejumlah tempat dan tanaman inang yang berbeda di Sumatera Utara. Pada Tabel 1 disajikan data tanaman inang, lokasi dan gejala yang timbul pada tanaman yang diduga diinfeksi oleh CMV.
Isolat yang diperoleh dari lapang sebanyak 21 isolat, berasal dari ketimun (6 isolat), cabai keriting (3 isolat), cabai rawit (3 isolat), labu (3 isolat), terong (2 isolat), squash (1 isolat), dan tomat (3 isolat) (Tabel 1).
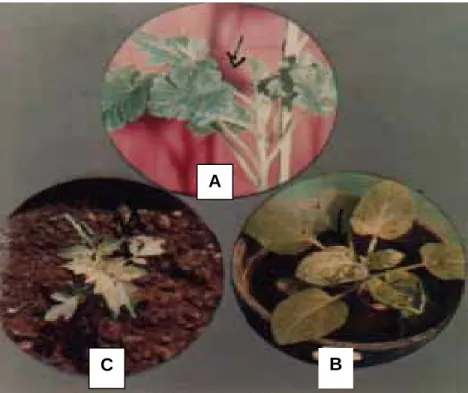
Pada Gambar Lampiran 1, 2, 3, 4, dan 5 disajikan dokumentasi tanaman inang terinfeksi dan diduga disebabkan infeksi CMV. Gejala yang berbeda pada tanaman inang yang sama diharapkan diperolehnya strain CMV yang berbeda. Gejala yang diperoleh mulai dari mosaik ringan sampai mosaik berat, blister, dan terjadinya malformasi daun. Walaupun tanaman yang terinfeksi virus menunjukkan gejala yang kompleks (diinfeksi oleh beberapa virus sekaligus), namun diharapkan terdapat infeksi CMV.
Tanaman yang terinfeksi virus selanjutnya dipurifikasi dengan teknik biologis untuk memisahkan CMV dari virus lainnya. Pemurnian CMV menggunakan tanaman indikator spesifik, sehingga pemisahan virus CMV dengan virus lainnya diharapkan lebih berhasil. Isolat-isolat yang telah berhasil dipisahkan selanjutnya di uji secara serologis dengan menggunakan uji Elisa untuk lebih memastikan virus yang diperoleh adalah CMV.
Tabel 1. Asal Isolat, Lokasi, Tanaman Inang dan Gejala Pada Tanaman Terinfeksi CMV
No. Kode Isolat Asal Tanaman
Inang
Lokasi Gejala
1. CMV-SU1 Ketimun Kebun Percobaan USU,
Medan
Mosaik
2. CMV-SU2 Ketimun Kebun Percobaan USU,
Medan
Mosaik, blister
3. CMV-SU3 Labu Kebun Petani, Simpang
Melati, Medan
Mosaik
4. CMV-SU4 Terong Kebun Petani, Simpang
Melati, Medan
Mosaik
5. CMV-SU5 Ketimun Kebun Petani, Tanjung
Selamat, Medan
Mosaik, blister
6. CMV-SU6 Ketimun Kebun Petani, Tanjung
Selamat, Medan
Mosaik
7. CMV-SU7 Labu Kebun Petani, Tanjung
Selamat, Medan
Mosaik, blister
8. CMV-SU8 Labu Kebun Petani, Tanjung
Selamat, Medan
Mosaik, blister
9. CMV-SU9 Terong Kebun Petani, Tanjung
Selamat, Medan
Mosaik
10. CMV-SU10 Squash Kebun Petani, Simpang
Melati , Medan
Mosaik ringan 11. CMV-SU11 Cabai Rawit Kebun Petani, Simpang
Melati, Medan
Mosaik, blister, keriting (komplek) 12. CMV-SU12 Cabai Rawit Kebun Petani, Simpang
Melati, Medan
Mosaik, blister ringan 13. CMV-SU13 Cabai Rawit Kebun Petani, Berastagi,
Tanah Karo
Mosaik berat, blister ringan
14. CMV-SU14 Cabai Keriting Kebun Petani, Berastagi, Tanah Karo
Mosaik berat, blister ringan
15. CMV-SU15 Cabai Keriting Kebun Petani, Berastagi, Tanah Karo
Mosaik dan blister berat 16. CMV-SU16 Cabai Keriting Kebun Petani, Berastagi,
Tanah Karo
Mosaik berat, blister ringan
17. CMV-SU17 Ketimun Kebun Petani, Binjai Mosaik berat, blister, 18. CMV-SU18 Ketimun Kebun Petani, Binjai Mosaik berat
blister dan malformasi daun
19. CMV-SU19 Tomat Kebun Petani, Berastagi, Tanah Karo
Mosaik berat, malformasi daun
20. CMV-SU20 Tomat Kebun Petani, Berastagi, Tanah Karo
Mosaik ringan 21. CMV-SU21 Tomat Kebun Petani, Kabanjahe,
Tanah Karo
II. Pemisahan Isolat CMV Dari Inang Berbeda
Pemisahan virus dilakukan dengan metode uji hayati pada tanaman indikator penting dengan cara sebagai berikut : Sampel dari lapang pertama kali diinokulasikan ke tanaman N. glutinosa, kemudian diinokulasikan ke tanaman Cucumis sativus, dan selanjutnya diinokulasikan ke tanaman Chenopodium amaranticolor (diulang sebanyak tiga kali). Skema pemisahan dilakukan seperti yang disajikan pada Gambar 2.
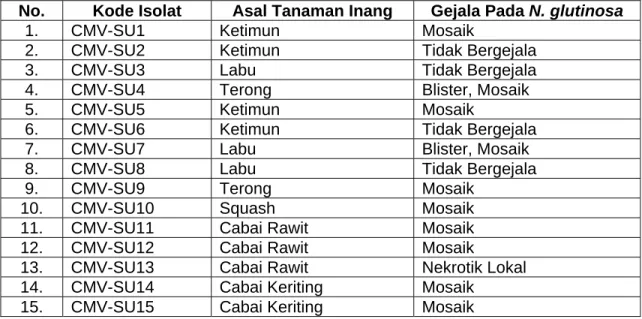
Dari 21 isolat yang diinokulasikan pada tanaman N. glutinosa hanya 10 buah isolat yang menunjukkan gejala mosaik sistemik (Gambar Lampiran 6B), sedangkan 6 isolat lagi tidak menghasilkan gejala, dan 2 isolat menunjukkan gejala nekrotik lokal. Waktu munculnya gejala (masa inkubasi) berkisar 12 hari sampai 18 hari setelah inokulasi. Hasil inokulasi isolat-isolat CMV pada tanaman N. glutinosa disajikan pada Tabel 2.
Isolat yang berasal dari ketimun, hanya satu isolat (CMV-SU1) menunjukkan gejala mosaik pada N. glutinosa (Tabel 2), sedangkan isolat lainnya (SU2, CMV-SU3, CMV-SU5, CMV-SU6, CMV-SU17, dan CMV-SU18) tidak menunjukkan gejala. CMV-SU1 menunjukkan gejala mosaik pada tanaman N. glutinosa. Tiga isolat yang diperoleh dari tanaman labu, hanya satu isolat (CMV-SU7) yang menunjukkan gejala (blister dan mosaik) pada tanaman N. glutinosa, sedangkan dua isolat lainnya (CMV-SU3 dan CMV-SU8) tidak menunjukkan gejala.
Dua isolat (CMV-SU4 dan CMV-SU9) yang diperoleh dari tanaman terong menunjukkan gejala blister dan mosaik pada tanaman N. glutinosa. Satu isolat asal squash (CMV-SU10) menunjukkan gejala mosaik pada tanaman N. glutinosa.
Tiga isolat (CMV-SU11, CMV-SU12, dan CMV-SU13) yang diperoleh dari tanaman cabai rawit menunjukkan gejala mosaik dan nekrotik lokal pada tanaman N. glutinosa. Namun isolat CMV-SU13 yang menunjukkan gejala nekrotik lokal pada tanaman N. glutinosa tidak digunakan, karena bukan gejala spesifik yang disebabkan oleh CMV. Tidak satupun isolat yang diperoleh dari tanaman tomat yang menunjukkan gejala pada tanaman N. glutinosa.
Tabel 2. Isolat Virus yang Menunjukkan Gejala Mosaik Pada N. glutinosa No. Kode Isolat Asal Tanaman Inang Gejala Pada N. glutinosa
1. CMV-SU1 Ketimun Mosaik
2. CMV-SU2 Ketimun Tidak Bergejala
3. CMV-SU3 Labu Tidak Bergejala
4. CMV-SU4 Terong Blister, Mosaik
5. CMV-SU5 Ketimun Mosaik
6. CMV-SU6 Ketimun Tidak Bergejala
7. CMV-SU7 Labu Blister, Mosaik
8. CMV-SU8 Labu Tidak Bergejala
9. CMV-SU9 Terong Mosaik
10. CMV-SU10 Squash Mosaik
11. CMV-SU11 Cabai Rawit Mosaik
12. CMV-SU12 Cabai Rawit Mosaik
13. CMV-SU13 Cabai Rawit Nekrotik Lokal
14. CMV-SU14 Cabai Keriting Mosaik
16. CMV-SU16 Cabai Keriting Nekrotik Lokal
17. CMV-SU17 Ketimun Tidak Bergejala
18. CMV-SU18 Ketimun Tidak Bergejala
19. CMV-SU19 Tomat Tidak Bergejala
20. CMV-SU20 Tomat Tidak Bergejala
21. CMV-SU21 Tomat Tidak Bergejala
III. Uji ELISA
Deteksi dengan I-ELISA (Indirect-Enzyme Linked Immunosorbent Assay) menggunakan antiserum CMV pada penelitian berhasil mendapat empat isolat positif CMV yang berasal dari tanaman ketimun (CMV-SU1), labu (CMV-SU7), cabai rawit ( CMV-SU11), dan cabai keriting (CMV-SU15). Isolat-isolat lain yang menunjukkan gejala pada tanaman N. glutinosa tidak positif diinfeksi oleh CMV (Gambar 3). Sampel dianggap positif, jika hasil pengukuran absorban pada panjang gelombang 405 nm dengan ELISA reader mempunyai nilai dua kali lebih besar dari nilai kontrol negatif tanaman sehat (Matthews, 1993).
Uji ELISA 0.231 0.484 2.392 2.423 0.409 0.241 2.412 0.25 0.261 2.413 0.42 0.525 2.384 0 1 2 3 PBST K(-) k(+) CMV-SU1 CMV-SU4 CMV-SU5 CMV-SU7 CMV-SU9 CMV-SU10 CMV-SU11 CMV-SU12 CMV-SU14 CMV-SU15 Sampel Isolat Ni la i Ab so rb an p a d a 405 n m
Gambar 3. Nilai Absorban pada A 405 nm hasil uji ELISA sampel isolat CMV dengan antiserum CMV (AGDIA).
IV. Uji Hayati Isolat CMV pada Beberapa Tanaman Indikator
Pada Tabel 3 disajikan gejala yang dihasilkan akibat infeksi empat isolat CMV asal Sumatera Utara pada beberapa tanaman indikator penting. Inokulasi secara mekanis semua isolat CMV pada tanaman indikator V. sinensis tidak menunjukkan gejala. Pada tanaman indikator lainnya yang dicobakan, gejala yang muncul adalah mosaik, mosaik berat, dan blister. Gejala muncul secara bervariasi mulai dari 5 hari setelah inokulasi sampai 14 hari setelah inokulasi. Dua isolat, yaitu CMV-SU7 dan CMV-SU15
menunjukkan gejala mosaik berat pada tanaman cabai keriting (C. annuum) maupun pada tanaman cabai rawit (C. frutescens). Semua isolat menunjukkan gejala lesio lokal pada tanaman indikator C. amaranticolor (Tabel 3).
Tabel 3. Gejala Pada Tanaman Indikator Penting Empat Isolat CMV Asal Sumatera Utara
Isolat CMV
CMV-SU1 CMV-SU7 CMV-SU11 CMV-SU15
Tanaman Indikator
Gejala
Nicotiana glutinosa Mosaik Mosaik Mosaik Mosaik
Nicotiana tabacum Mosaik Mosaik Berat, Blister
Mosaik Berat, Blister
Mosaik
Capsicum annum Mosaik Mosaik Berat Mosaik Mosaik Berat
C. frutescens Mosaik Mosaik Berat Mosaik Mosaik Berat
Cucumis sativus Mosaik Mosaik Mosaik Mosaik
Chenopodium amaranticolor
Lesio Lokal Lesio Lokal Lesio Lokal Lesio Lokal
Cucurbita pepo Mosaik Mosaik Mosaik Mosaik
Vigna sinensis Tidak Bergejala Tidak Bergejala Tidak Bergejala Tidak Bergejala Lycopersicon esculentum
Mosaik Mosaik Berat Mosaik Mosaik
Datura stramonium Mosaik Mosaik Mosaik Mosaik
Isolat CMV-SU1 dan CMC-SU11 menyebabkan gejala mosaik pada tanaman cabai (C. annuum) dan cabai rawit (C. frutescens), sedangkan isolat SU7 dan CMV-SU15 menyebabkan gejala mosaik berat. Isolat-isolat yang diperoleh dalam penelitian perlu diuji lebih lanjut pada kedua tanaman tersebut untuk mengetahui virulensinya dan kehilangan hasil akibat infeksinya. Pengujian dilakukan pada beberapa kultivar tanaman cabai besar dan tanaman cabai rawit untuk meyakinkan adanya perbedaan virulensi isolat CMV yang diperoleh.
KESIMPULAN
Hasil penelitian menunjukkan bahwa isolat-isolat yang diperoleh dari lapangan yang diduga oleh infeksi CMV tidak seluruhnya dapat menginfeksi tanaman indikator N. glutinosa. Isolat-isolat yang dapat menginfeksi tanaman indikator N. glutinosa, juga tidak seluruhnya adalah positif CMV setelah diuji secara ELISA.
Deteksi dengan I-ELISA (Indirect-Enzyme Linked Immunosorbent Assay) menggunakan antiserum CMV pada penelitian berhasil mendapat empat isolat positif CMV yang berasal dari tanaman ketimun (CMV-SU1), labu (CMV-SU7), cabai rawit ( CMV-SU11), dan cabai keriting (CMV-SU15).
Semua isolat CMV yang diperoleh perlu diuji lebih lanjut pada sejumlah kultivar tanaman cabai untuk mengetahui perbedaan virulensinya.
DAFTAR PUSTAKA
Agrios, G.N. 1998. Plant Pathology. Academic Press. New York. 803p
Aaziz, R. and Tepfer, M. 1999. Recombination between genomic RNAs of two cucumoviruses under conditions of minimal selection pressure. Virology 263:282-289.
Allison, R. F., Thompson, G., and Ahlquist, P. 1990. Regeneration of a functional RNA virus genome by recombination between deletion mutants and requirement for cowpea chlorotic mosaic virus 3a and coat genes forsystemic infection. Proc. Natl. Acad. Sci. USA 87: 1820-1824.
Chupp, C. and A.F. Sherf. 1960. Vegetables diseases and their control. The Ronald Press Company. New York. 693p.
Ding, S.W., Anderson, B.J., Haase, H.R. and Symons, .RH. 1994. New overlapping gene encoded by the cucumber mosaic virus genome. Virology 198: 593-601
Doolittle, S.P. 1916. A new infectious mosaic disease of cucumber. Phytopathology 6: 145-147.
Francki, R.I.B., D.W. Mossop, and T. Hatta. 1979. Cucumber Mosaic Virus. CMI/AAB Descriptions of Plant Viruses, No.213.
Matthews, R.E.F. 2002. Plant Virology. Fourth Edition. Academic Press. London. McNab, A.A., A.F. Sherf, and J.K. Springer. 1983. Identifying Diseases of Vegetables.
The Pennsylvania State University.
Moorman, G.W. & Woodbridge, W.C. 1983. Morphogenesis cucumber mosaic virus induced chrystalline inclusion in pepper. Phytophatology. 73(8):1106-1108.
Murant, A.F. and A.M. Mayo. 1982. Satellites of plant viruses. Ann. Rev. Phytophatologi. 20:47-70.
Rybicki, E.P. 1995. The Bromoviridae. p. 450-457 In F. A. Murphy, C.M. Fauquet, D.H.L. Bishop, S.A. Ghabrial, A.W. Jarvis, G.P. Martelli, M.A. Summers (ed.) Virus Taxonomy, Sixth Report of the International Committee on Taxonomy of Viruses. Springer-Verlag Wien, New York, USA.
Peden, K.W.C. and Symons, R.H. 1973. Cucumber mosaic virus contains a functionally divided genome. Virology 53: 487-492.
Sugiura, M., Bandaranayake, C.M., & Hemachandra, G.H. 1975. Chilli Virus Diseases in Sri Lanka. Technic Bull. 8.TARC. 62p.
Sutarya, R., Duriat, A.S., dan Gunaeni, N. 1993. Pengaruh tiga jenis vaksin CMV pada tanaman cabai kultivar Barito di Kebun Percobaan Subang. Bull. Penelitian Hortikultura XXV (2) : 20-28.
Suzuki, M., Kuwata, S., Kataoka, J., Masuta, C., Nitta, N. and Takanami, Y. 1991. Functional analysis of deletion mutants of cucumber mosaic virus RNA 3 using an in vitro transcription system. Virology 183: 106-113.
van Regenmortel, M.H.V., Fauquet, C.M., Bishop, D.H.L. et al. (eds) 2000. Virus Taxanomy: Classification and Nomenclature of Viruses. Seventh Report of the International Committee on Taxanomy of Viruses. Academic Press, San Diago, USA.
L A M P I R A N
Gambar 1. Gejala Virus Kompleks Akibat Terinfeksi Sejumlah Virus Pada Tanaman Cabai
Gambar 2. Gejala Mosaik Pada Tanaman Terong
Gambar 4. Beberapa Gejala Berbeda Akibat Infeksi Virus Pada Tanaman Ketimun
Gambar 5. Beberapa Gejala Berbeda Akibat Infeksi Virus Pada Tanaman Cabai Rawit.
A
C B
Gambar 6. Gejala CMV pada Tanaman Indikator: (A) Mosaik dan Blister pada C. pepo, (B) Mosaik pada N. glutinosa, (C) Mosaik pada tomat
D C
B A
Gambar 7. Gejala CMV pada Tanaman Indikator: (A) Mosaik Berat pada Tembakau, (B) Mosaik Berat dan Blister pada Ketimun, (C)
B
C A
D
Gambar 8. Gejala Pada Beberapa Tanaman Indikator Dengan Uji Hayati (A) Mosaik Pada Cabai, (B) Mosaik Dan Malformasi Daun Pada Tomat, (C) Lesio Lokal Pada C. amaranticolor, (D) Mosaik Sistemik Pada N. tabacum White Barley
A B
D C
Gambar 9. Gejala Pada Beberapa Tanaman Indikator Dengan Uji Hayati (A) Mosaik Pada N. tabacum Samsun, (B) Mosaik Pada N. glutinosa, (C) Mosaik Pada Ketimun, (D) Mosaik Sistemik Pada Cabai Rawit
CMV-SU7 CMV-SU1
CMV-SU11 CMV-SU15
Gambar 10. Gejala Berbeda Pada Tanaman Cabai Rawit Akibat Infeksi Isolat CMV Asal Sumatera Utara
Gambar 12. Beberapa Variasi Gejala Infeksi Isolat CMV Asal Sumatera Utara Gambar 11. Beberapa Variasi Gejala Infeksi Isolat CMV Asal Sumatera Utara
Pada Tanaman Indikator C. sativus pada Uji Hayati
CMV-SU1 CMV-SU7