ISOLASI DAN KARAKTERISASI PLANTARISIN
DARI Lactobacillus plantarum S34 SEBAGAI INHIBITOR
RNA HELIKASE VIRUS HEPATITIS C
ADYOS BOBBY CHANDRA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi dan Karakterisasi Plantarisin dari Lactobacillus plantarum S34 sebagai Inhibitor RNA Helikase Virus Hepatitis C adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2013 Adyos Bobby Chandra NIM G851100031
ABSTRACT
ADYOS BOBBY CHANDRA. Isolation and Characterization of Plantaricin from Lactobacillus plantarum S34 as RNA Helicase Inhibitor Hepatitis C Virus. Research was supervised by HASIM and A. ZAENAL MUSTOPA.
The purpose of this study was to isolation and characterization of plantaricin S34 which has inhibition activity against ATPase activity of RNA helicase HCV. Plantaricin was produced by Lactobacillus plantarum S34 isolated from Bekasam, traditional fermentation of meat products from Way Kanan, Lampung. Maximal activity of plantaricin S34 was recorded in MRS broth with 2% glucose 37 °C pH 6,5 after 20 h of growth. Plantaricin S34 results of purification with ammonium sulphate has inhibitory activity of 111,18% (2x dilution). Activity of plantaricin S34 was not affected by 1% SDS, urea, Tween-20, Triton X-100, EDTA and 0,1 mg/mL lysozim, catalase, and proteinase-K. The specific activity after purification was 1,49x10-2 U/mg. The purity of plantaricin S34 increased 18,35 fold than those of the crude protein. According to SDS-PAGE, plantaricin S34 is approximately 6,47 kD in size.
Key words: Lactobacillus plantarum S34, plantaricin S34, RNA helicase hepatitis C virus
RINGKASAN
ADYOS BOBBY CHANDRA. Isolasi dan Karakterisasi Plantarisin dari Lactobacillus plantarum S34 sebagai Inhibitor RNA Helikase Virus Hepatitis C. Dibimbing Oleh HASIM dan A. ZAENAL MUSTOPA.
Virus hepatitis C adalah anggota dari famili flavivirus yang menyebabkan penyakit Hepatitis C. Lebih dari 130 juta penduduk di seluruh dunia terinfeksi virus hepatitis C yang menyebabkan efek berupa radang, sirosis, dan kanker hati. Penyebaran virus hepatitis C yang sangat cepat dan belum adanya obat maupun vaksin yang efektif menjadi penyebab tingginya penderita penyakit hepatitis C.
Beberapa penelitian untuk mencari obat penyakit hepatitis C terus dilakukan, diantaranya adalah terapi target molekular. Terapi target molekular dikembangkan dengan mencari inhibitor enzim RNA helikase virus hepatitis C. Dalam penelitian ini, mikroorganisme yang diisolasi dari Bekasam daging sapi diantaranya adalah Lactobacillus plantarum S34 mempunyai potensi sebagai penghasil plantarisin sebagai inhibitor RNA helikase virus hepatitis C. Masih terbatasnya informasi mengenai plantarisin S34 sebagai peptida inhibitor RNA helikase virus hepatitis C menjadi landasan perlunya penelitian ini dilakukan.
Tujuan penelitian ini adalah untuk melakukan isolasi dan karakterisasi plantarisin dari Lactobacillus plantarum S34 sebagai inhibitor RNA helikase virus hepatitis C. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai plantarisin dari Lactobacillus plantarum S34 sebagai inhibitor RNA helikase virus hepatitis C.
Penelitian ini diawali dengan ekspresi dan purifikasi RNA helikase virus hepatitis C. Enzim RNA helikase virus hepatitis C yang diperoleh di analisis bobot molekulnya dengan metode SDS-PAGE dan dikonfirmasi dengan Western blot. Selanjutnya penelitian dilanjutkan dengan optimasi pertumbuhan Lactobacillus plantarum S34. Biakan Lactobacillus plantarum S34 hasil optimasi pertumbuhan diisolasi plantarisinnya dengan menggunakan garam ammonium sulfat. Hasil pengendapan ammonium sulfat diperoleh ekstrak kasar plantarisin S34. Ekstrak kasar plantarisin S34 dari hasil isolasi diuji aktivitas inhibisinya terhadap RNA helikase virus hepatitis C. Selanjutnya diperoleh nilai aktivitas optimum plantarisin S34 kasar. Plantarisin S34 kasar dengan aktivitas inhibisi terbaik dikarakterisasi dengan berbagai surfaktan, protease inhibitor, dan enzim proteolitik. Selanjutnya plantarisin S34 dipurifikasi dengan teknik kromatografi gel filtrasi menggunakan Sephadex G-50 dengan berbagai eluen. Plantarisin S34 hasil purifikasi terbaik dihitung nilai konsentrasi proteinnya dengan menggunakan kurva standar BSA. Tahap terakhir adalah analisis plantarisin S34 dengan LC-MS dan dihitung bobot molekulnya dengan SDS-PAGE.
Hasil penelitian ini menunjukkan bahwa Lactobacillus plantarum S34 tumbuh dengan baik pada media MRS+glukosa 2% pH 6,5 pada suhu 37 ºC selama 20 jam. Plantarisin S34 hasil purifikasi dengan ammonium sulfat 80% mempunyai aktivitas inhibisi terhadap RNA helikase virus hepatitis C sebesar 111,18% dengan 2x pengenceran. Ekstrak kasar plantarisin S34 stabil terhadap SDS, urea, tween-20, Triton X-100, EDTA dan lisozim, katalase, proteinase-K dengan konsentrasi masing-masing 1% dan 0,1 mg/mL. Plantarisin S34 hasil purifikasi dengan kromatografi gel filtrasi mempunyai aktivitas spesifik sebesar
1,49x10-2 U/mg dengan tingkat kemurnian sebesar 18,35 kali. Plantarisin S34 berhasil diisolasi dengan bobot molekul sebesar 6,47 kD.
Kata Kunci: Lactobacillus plantarum S34, plantarisin S34, RNA helikase virus hepatitis C
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
ISOLASI DAN KARAKTERISASI PLANTARISIN
DARI Lactobacillus plantarum S34 SEBAGAI INHIBITOR
RNA HELIKASE VIRUS HEPATITIS C
ADYOS BOBBY CHANDRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Pada Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Tesis : Isolasi dan Karakterisasi Plantarisin dari Lactobacillus plantarum S34 sebagai Inhibitor RNA Helikase Virus Hepatitis C
Nama : Adyos Bobby Chandra
NIM : G851100031
Disetujui Komisi Pembimbing
Dr. drh. Hasim, DEA A. Zaenal Mustopa, M. Si.
Ketua
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, M.S
Tanggal Ujian: 29 Juli 2013
Anggota
Diketahui
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Syukur alhamdulillah penulis haturkan kepada Allah SWT atas nikmat iman dan islam serta petunjukNya sehingga tesis ini berhasil diselesaikan. Tesis ini berjudul Isolasi dan Karakterisasi Plantarisin dari Lactobacillus plantarum S34 sebagai Inhibitor RNA Helikase Virus Hepatitis C. Kegiatan Penelitian ini dilaksanakan di Laboratorium Bakteriologi dan Virologi Molekular, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. drh. Hasim, DEA dan Bapak A. Zaenal Mustopa, M.Si. selaku komisi pembimbing, serta Prof. Dr. drh. Maria Bintang, MS atas saran dan arahannya. Ucapan terima kasih kepada Bapak Dr. (HC) Ahmad Heryawan, Lc. Selaku Gubernur Jawa Barat yang memberikan bantuan tugas akhir. Penulis juga mengucapkan terima kasih kepada Bapak M. Ridwan, S.Farm atas bimbingan dan diskusinya selama di laboratorium. Penulis juga sampaikan terima kasih kepada Ibu Linda Sukmarini, M. Eng., Ibu Rifqiyah Nur Umami, M. Sc., teman-teman di laboratorium (Patur, Bowo, Hari, Krisna, Aksar, Kang Aris, Umam, Ace, Kang Kukun, Neng Tantri, Mba Rere, Bia, Meita, Reni, Maya, Maridha, dan Ikrimah), teman-teman biokimia angkatan 2010 dan 2011. Penghargaan penulis sampaikan untuk Prof. Dr. drh. Mansur Hawab (alm) atas dedikasi beliau yang memberikan bimbingan dan motivasi serta rekomendasi awal kuliah di Pascasarjana IPB.
Untuk ibunda Yusmaniaharti, ayahanda Edy Epri, Nanda, Herlan, ibu Syafni, Adeyosi Meliawati (alm), dan keluarga besar penulis sampaikan terima kasih atas doa dan kasih sayangnya. Terima kasih yang tulus untuk Tania P. Putri dan ananda A. Fathiyya Yusra yang mendampingi penulis hingga karya ilmiah ini selesai ditulis.
Semoga hasil penelitian ini bermanfaat.
Bogor, Agustus 2013
RIWAYAT HIDUP
Penulis dilahirkan di Kepahiang, Bengkulu pada tanggal 14 Mei 1986 dari ayahanda Edy Epri, S. Sos dan ibunda Yusmaniaharti. Penulis merupakan putra pertama dari lima bersaudara.
Lulusan SD Negeri 78 Perumnas dan SMP Negeri 1 Curup berturut-turut pada tahun 1998 dan 2001. Pada tahun 2004 penulis lulus dari SMA Negeri 1 Curup, Bengkulu dan pada tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB (USMI). Penulis mengikuti program Sekolah Pascasarjana pada mayor Biokimia angkatan 2010 dengan bantuan beasiswa Gubernur Provinsi Jawa Barat.
Selama mengikuti perkuliahan hingga saat ini, penulis aktif menjadi mentor Pendidikan Agama Islam. Penulis pernah mengikuti lomba Penulisan Ilmiah Mahasiswa Nasional (Pimnas) Bidang Ilmiah dan Pengabdian Masyarakat. Penulis pernah menjadi ketua KAMMI IPB dan calon ketua BEM TPB IPB. Saat ini aktif sebagai ketua LSM Waruna dan Gapoktan Alami, Kota Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN ... 1 TINJAUAN PUSTAKA Hepatitis C ... 3 Virus Hepatitis C ... 4 Lactobacillus plantarum ... 6 Kromatografi... 9
Elektroforesis Gel Poliakrilamida Sodium Dodesil Sulfat ... 11
BAHAN DAN METODE Bahan dan Alat ... 13
Metode Penelitian... 14
HASIL DAN PEMBAHASAN Ekspresi dan Purifikasi RNA Helikase Virus Hepatitis C ... 19
Optimasi Kultivasi Plantarisin dari Lactobacillus plantarum S34 ... 21
Isolasi dan Purifikasi Plantarisin dari Lactobacillus plantarum S34 ... 24
Aktivitas Inhibisi Plantarisin S34 pada RNA Helikase Virus Hepatitis C . 27 Karakterisasi Plantarisin dari Lactobacillus plantarum S34 ... 31
SIMPULAN DAN SARAN ... 34
DAFTAR PUSTAKA ... 35
DAFTAR TABEL
Halaman
1 Klasifikasi bakteriosin ... 8
2 Ringkasan purifikasi plantarisin dari Lactobacillus plantarum S34 ... 33
DAFTAR GAMBAR Halaman 1 Virus hepatitis C ... 4
2 Genom virus hepatitis C ... 4
3 Cara kerja enzim Helikase saat replikasi ... 5
4 Lactobacillus plantarum WCFS1 ... 6
5 Permeabilisasi membran oleh bakteriosin kelas IIa ... 9
6 Pita hasil SDS-PAGE RNA helikase virus hepatitis C ... 19
7 Pita protein hasil western blot RNA helikase virus hepatitis C ... 20
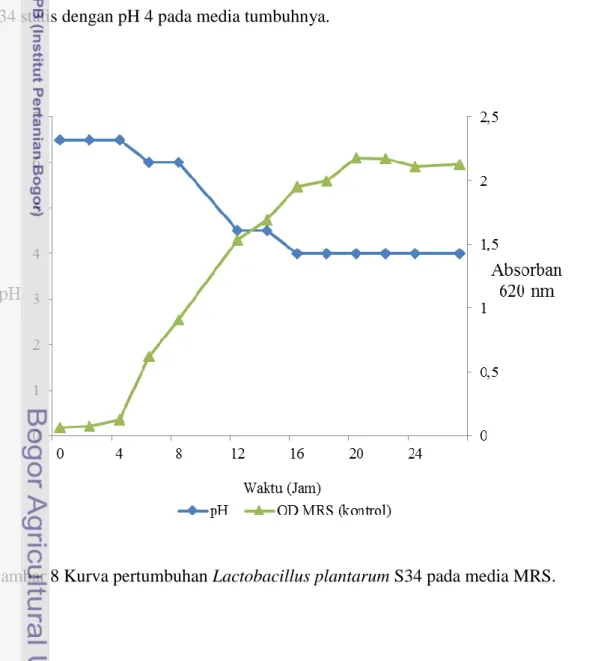
8 Kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS ... 22
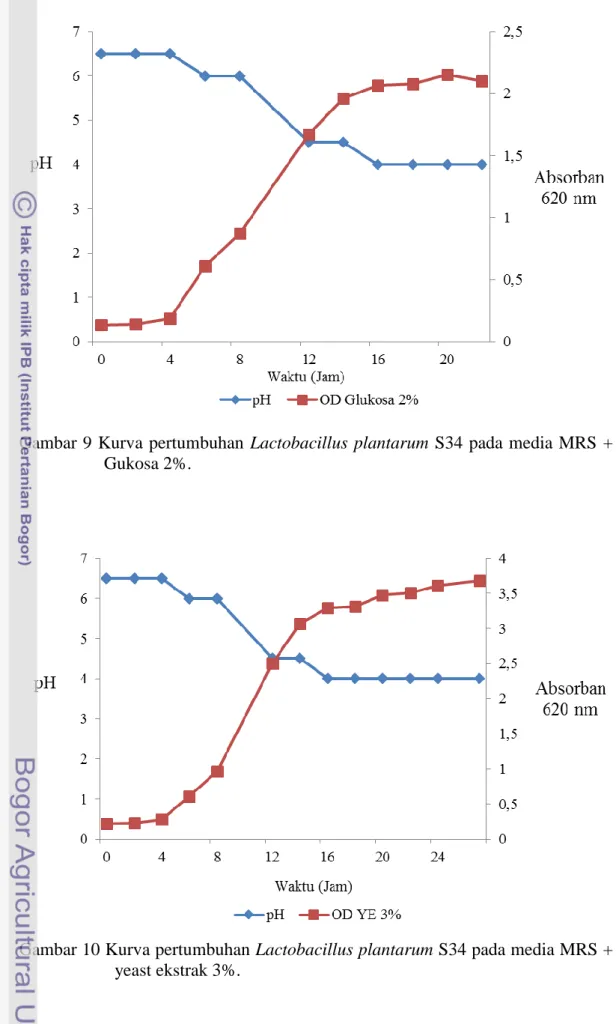
9 Kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS + Gukosa 2% ... 23
10 Kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS + yeast ekstrak 3% ... 23
11 Daya inhibisi ekstrak kasar plantarisin S34 pada RNA helikase virus hepatitis C ... 25
12 Karakterisasi ekstrak kasar plantarisin S34 pada berbagai enzim [0.1 mg/mL] ... 26
13 Karakteristik ekstrak kasar plantarisin S34 pada berbagai surfaktan dan protease inhibitor (1% v/v) ... 26
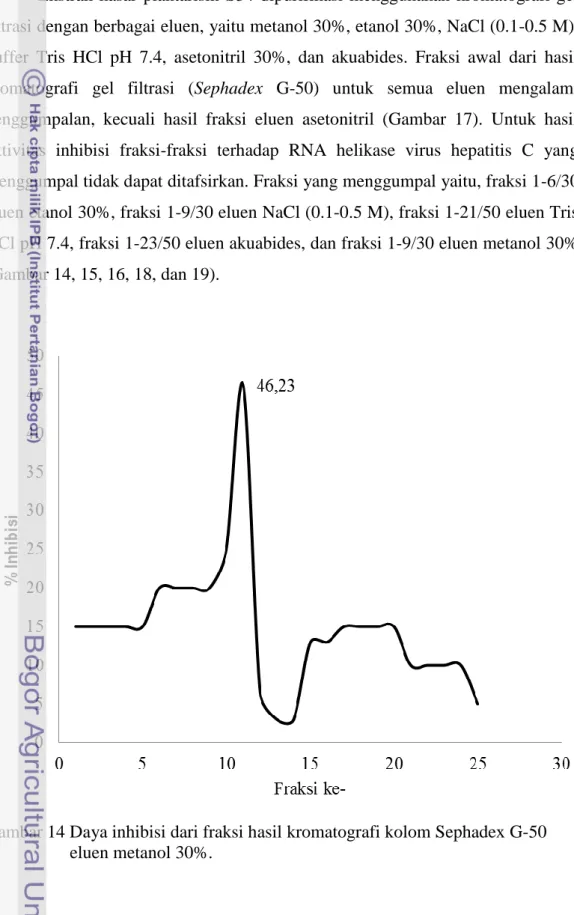
14 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen metanol 30% ... 28
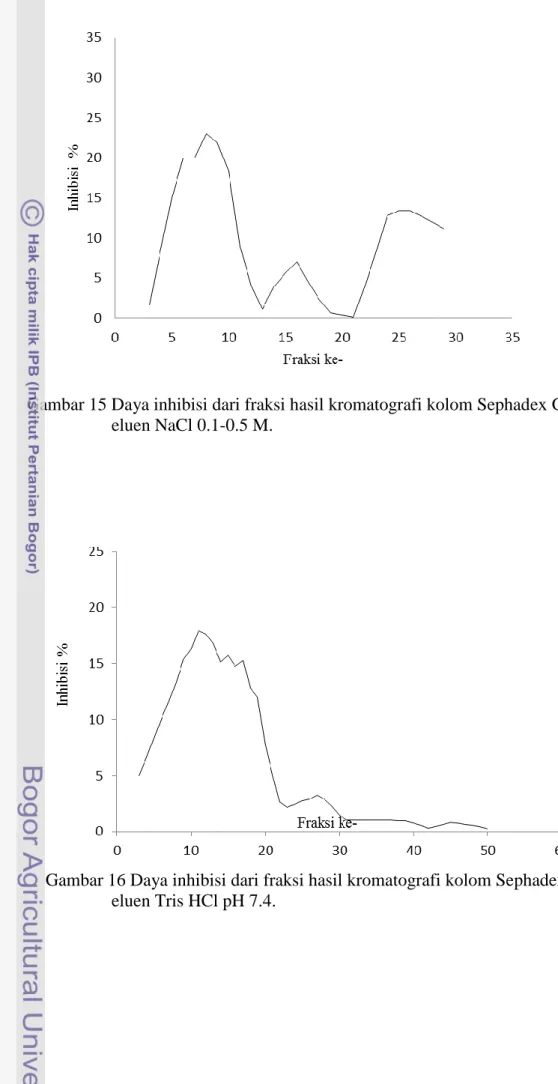
15 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen NaCl 0.1-0.5 M ... 29
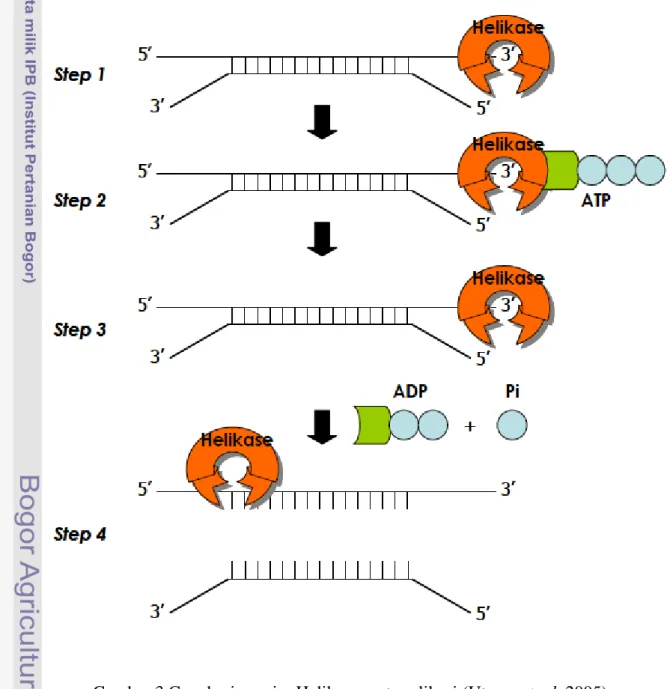
16 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen Tris HCl pH 7.4 ... 29 17 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen
asetonitril ... 30 18 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen
akuabides ... 30 19 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen
etanol 30% ... 31 20 Pita protein hasil purifikasi plantarisin S34 dengan eluen metanol 30% ... 32 21 Kromatogram fraksi ke-11 plantarisin S34 hasil HPLC ... 34
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 42 2 Alur ekspresi dan purifikasi RNA helikase virus hepatitis C ... 42 3 Alur purifikasi plantarisin S34 ... 42 4 Karakterisasi plantarisin S34... 43 5 Kurva standar fosfat (UJi ATPase) ... 44 6 Perhitungan aktivitas protein inhibitor ... 44 7 Perhitungan bobot molekul plantarisin S34 ... 46 8 Kromatogram hasil analisis LCMS ... 47
1
PENDAHULUAN
Latar Belakang
Hepatitis C merupakan penyakit menular yang disebabkan oleh Virus Hepatitis C. Virus Hepatitis C menginfeksi lebih dari 130 juta penduduk di seluruh dunia (Zeisel et al. 2013). Kementrian Kesehatan Republik Indonesia menyatakan bahwa jumlah penderita hepatitis C tahun 2010 sebesar 30 juta jiwa. Infeksi dari Virus Hepatitis C dapat menyebabkan efek berupa radang, sirosis, dan kanker hati. Belum ada obat maupun vaksin yang efektif untuk penanganan penyakit ini (Zeisel et al. 2013).
Penelitian untuk mencari solusi terhadap infeksi virus hepatitis C terus dilakukan. Diantarnya adalah pemanfaatan sumber daya alam berbasis lokal (Indegenous Indonesia) seperti Bekasam daging sapi, makanan khas Way Kanan, Provinsi Lampung (Mustopa et al. 2010). Mikroorganisme potensial yang diisolasi dari Bekasam daging sapi diantaranya Lactobacillus plantarum S34 (Mustopa et al. 2010) yang dapat memproduksi plantarisin (Holo et al. 2001; Jimẻnez-Dỉaz et al. 1993; Powell et al. 2007).
Plantarisin dari Lactobacillus plantarum (Todorov & Dicks 2005b; Todorov et al. 2010) selain berfungsi sebagai antibakteri (Atrih et al. 2001; Mustopa et al. 2010; Xie et al. 2011) juga dapat menghambat perkembangan virus (Hatsu et al. 2002; Serkedjieva et al. 2000). Beberapa mikroba yang sudah diteliti dan peptida yang dihasilkan diantaranya adalah L. acidophilus D20079 penghasil asidosin D20079, Carnobacterium piscicola CS526 penghasil piscikosin CS526, L. pentosus 31-1 penghasil pentosin 31-1, L. plantarum A-1 penghasil plantarisin ASM1, L. plantarum ST8KF penghasil bakteriosin ST8KF, L. plantarum AMA-K penghasil bakteriosin AMA-K (Deraz et al. 2005; Yamazaki et al. 2005; Liu et al. 2008; Hata et al. 2010; Powel et al. 2007; Todorov et al. 2007).
Berbagai hasil penelitian menyebutkan bahwa plantarisin bermanfaat dalam menghambat bakteri pembusuk pada daging (Todorov et al. 2010), menghambat bakteri genus Listeria (Atrih et al. 2001; Liu et al. 2008; Xie et al. 2011), sedangkan bakteriosin dari Lactobacillus delbrueckii dapat menghambat
2
virus influenza (Serkedjieva et al. 2000). Sejalan dengan penelitian tersebut, Putri (2011) menyebutkan bahwa isolat mikroba potensial asal Bekasam daging sapi adalah Lactobacillus plantarum S34. Lactobacillus plantarum S34 mempunyai potensi untuk menghasilkan plantarisin sebagai inhibitor RNA helikase virus hepatitis C. Masih terbatasnya informasi mengenai plantarisin S34 sebagai inhibitor RNA helikase virus hepatitis C menjadi landasan perlunya penelitian ini dilakukan.
Penelitian ini bertujuan untuk melakukan isolasi dan karakterisasi plantarisin dari Lactobacillus plantarum S34 sebagai inhibitor RNA helikase virus hepatitis C. Hipotesis penelitian ini adalah Lactobacillus plantarum S34 dapat menghasilkan plantarisin sebagai inhibitor RNA helikase virus hepatitis C. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai plantarisin dari Lactobacillus plantarum S34 sebagai inhibitor RNA helikase virus hepatitis C.
3
TINJAUAN PUSTAKA
Hepatitis C
Hepatitis C adalah penyakit yang disebabkan oleh virus hepatitis C. Awal identifikasi penyakit ini pada tahun 1989 dikenal sebagai hepatitis Non-A dan Non-B. Virus hepatitis C menginfeksi melalui kontak antara darah yang tercemar saat donor atau pada saat penggunaan jarum suntik. Penyakit hepatitis C ditandai dengan demam, mual disertai hilangnya nafsu makan, nyeri di sekitar sendi, dan mudah lelah. Gejala awal dapat berlangsung hingga 3-4 pekan yang diikuti timbulnya warna kekuningan pada retina mata dan warna coklat pada urin (Lauer & Walker 2001; Zeisel et al. 2013).
Virus hepatitis C yang menginfeksi manusia menyebabkan hepatitis atau peradangan hati. Tahap lanjut dari penyakit hepatitis C menyebabkan sirosis dan kanker hati (Lauer & Walker 2001). Sampai saat ini belum ditemukan vaksin atau obat yang cocok untuk penyembuhan penyakit hepatitis C (Zeisel et al 2013).
Saat ini pengobatan penyakit hepatitis C dilakukan dengan pemberian interferon dan ribavirin. Interferon adalah protein yang dikeluarkan oleh sel-sel tubuh untuk melindungi berbagai infeksi dari luar. Interferon yang diproduksi oleh tubuh diantaranya adalah interferon alfa, interferon beta, dan interferon gamma dengan berat molekul 20-30 kDa. Interferon alfa dan interferon beta sering disebut sebagai interferon I karena kemiripan strukturnya. Sedangkan interferon gamma biasanya disebut sebagai interferon II. Meskipun tingkat penyembuhannya kurang dari 30%, pemakaian interferon dan ribavirin sebagai alternatif utama tetap menjadi andalan (Utama 2003, diacu dalam Ratnakomala 2009).
Interferon I diproduksi oleh sel-sel yang berhubungan dengan pertahanan tubuh, diantaranya sel B, makrofag, dan sel Natural Killer (NK). Aktivitas interferon I erat hubungannya dengan anti virus dan juga dapat menghambat pertumbuhan sel (cell growth inhibitor), anti kanker, aktivator makrofag, dan aktivator sel Natural Killer (NK). Sedangkan interferon II hanya diproduksi oleh sel-sel NK. Namun demikian, pengaruhnya dalam memberikan efek sama terhadap interferon alfa dan beta. Fungsi interferon ini langsung berperan dalam
4
sistem pertahanan tubuh terhadap serangan virus, bakteri, tumor dan atau substansi lain yang merusak pertahanan sel tubuh (Utama 2003, diacu dalam Ratnakomala 2009).
Virus Hepatitis C
Virus hepatitis C adalah virus RNA positif untai tunggal. Virus hepatitis C termasuk kelompok Flaviviridae. Gambar 1 memperlihatkan struktur inti Virus hepatitis C berupa RNA yang dilindungi kapsid (selubung) dari protein dan dibungkus oleh amplop berupa lipid pada bagian luarnya. Protein struktural yang dibuat oleh Virus Hepatitis C meliputi protein selubung inti E1 dan E2, sedangkan protein non struktural yaitu NS2, NS3, NS4, NS4B, NS5, NS5A, dan NS5B (Gambar 2) (Utama 2008). Genom Virus Hepatitis C berukuran 9.6 kilobasa yang mengkodekan sekitar 3011 asam amino.
Gambar 1 Virus Hepatitis C (Perkins 2001).
Virus hepatitis C memiliki gen yang mengkodekan RNA helikase spesifik virus, protease, dan polimerase. RNA helikase adalah salah satu enzim yang berperan dalam replikasi virus (Utama et al. 2000). Terlihat pada Gambar 2, RNA helikase virus hepatitis C dikodekan oleh gen non struktur (NS3). Penghambatan enzim RNA helikase menjadi target yang potensial untuk penemuan dan pengembangan obat anti virus hepatitis C.
5
Virus hepatitis C melakukan replikasi untuk bertahan pada inangnya. Saat replikasi terjadi akan terbentuk garpu replikasi atau cabang replikasi (replication fork). Adapun yang membentuk garpu replikasi adalah enzim RNA helikase yang memutus ikatan-ikatan hidrogen pada sense RNA dan antisense RNA (Gambar 3). Tiap-tiap untai RNA yang telah terpisah akan menjadi cetakan untuk pembentukan komplementernya oleh RNA polimerase (Utama et al. 2000). Dengan kondisi tersebut, penghambatan RNA helikase virus hepatitis C sangat mungkin dilakukan.
6
Lactobacillus plantarum
Bakteri asam laktat (BAL) adalah termasuk bakteri Gram positif yang tidak membentuk spora. Terdapat sekitar 20 genus bakteri yang termasuk dalam kelompok BAL. Beberapa BAL yang sering digunakan dalam pengolahan pangan adalah kelompok Aerococcus, Bifidobacterium, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus, dan Weisella (Salminen et al. 2004). Diantara 20 genus BAL, Lactobacillus plantarum adalah salah satu jenis mikroba dapat menghasilkan zat antibakteri yang dinamakan plantarisin (Fuller 1992; Hata et al. 2010; Todorov et al. 2011). Lactobacillus plantarum adalah jenis BAL yang berpotensi dalam menghasilkan plantarisin (Jimẻnez-Dỉaz et al. 1995; Todorov et al. 2010).
Taksonomi dari Lactobacillus plantarum adalah Dunia : Bakteria Filum : Firmicutes Kelas : Bacilli Ordo : Lactobacillales Famili : Lactobacillaceae Genus : Lactobacillus Spesies : plantarum
Gambar 4 Lactobacillus plantarum (Dennis Kunkel Microscopy 2004). Lactobacillus plantarum adalah bakteri Gram positif yang berbentuk batang, dapat membentuk rantai panjang atau pendek, dan tidak membentuk spora
7
(Salminen et al. 2004). Lactobacillus plantarum dapat tumbuh pada suhu 5-53 °C dengan suhu tumbuh optimum pada 30-40 °C (Pelczar dan Chan, 1988). Lactobacillus plantarum menghasilkan dua molekul asam laktat, dua molekul Adenosine Tri Phosphate (ATP), dan tidak menghasilkan CO2 dari fermentasi
glukosa melalui jalur Embden Meyerhof Parnas (EMP). Lactobacillus plantarum memproduksi zat antibakteri yang digunakan untuk menghambat mikroba lain (Salminen et al. 2004).
Berbagai penelitian mengenai Lactobacillus plantarum (Delgado et al. 2007; Todorov & Dicks 2005b) sudah diisolasi untuk dimanfaatkan sebagai biopreservasi pangan (Atrih et al. 2001; Mustopa et al. 2010; Xie et al. 2011) dan anti virus (Hatsu et al. 2002; Serkedjieva et al. 2000). Plantarisin S34 dari Lactobacillus plantarum S34 yang diisolasi dari bekasam daging makanan khas Kabupaten Way Kanan, Provinsi Lampung (Mustopa et al. 2010) sudah berhasil diisolasi, sehingga perlu dilakukan dilakukan purifikasi dan karakterisasi lebih lanjut agar dapat diketahui aktivitasnya sebagai inhibitor RNA helikase virus Hepatitis C.
Bakteriosin
Bakteriosin adalah senyawa protein yang disintesis di ribosom oleh bakteri Gram positif maupun bakteri Gram negatif. Bakteriosin disintesis di ribosom baik dalam keadaan termodifikasi atau tidak termodifikasi (Drider et al. 2006; Wood & Warner 2003; Wiryawan & Tjakradidjaja 2001). Bakteriosin mempunyai beberapa karakteristik, diantaranya adalah (a) mempunyai aktivitas yang penghambatan pada bakteri sekerabat (filogenik atau genetikanya cukup dekat), (b) senyawa aktifnya berupa peptida dengan 20 sampai 60 asam amino, (c) mempunyai reseptor spesifik pada sel sasarannya, (d) biosintesisnya melibatkan gen yang berada di plasmid (Wiryawan & Tjakradidjaja 2001; Lisboa et al. 2006; Parada et al. 2007 diacu dalam Baruno 2008).
Bakteriosin yang dihasilkan dari Lactobacillus plantarum telah banyak dipelajari (Hata et al. 2010; Powel et al. 2007; Todorov et al. 2010; Xie et al. 2011). Tabel 1 menunjukkan klasifikasi dan berbagai contoh mikroba yang menghasilkan bakteriosin.
8
Tabel 1 Klasifikasi bakteriosin
Katagori Ciri-ciri Subkatagori Contoh
Kelas I Lantibiotik (mengandung lantionin dan β-lantionin) Tipe A (molekul panjang, <4 kD) Tipe B (molekul bulat, 1,8-2,1 kD)
Nisin A [Lactococcus lactis]a
Mersadicin [Bacillus sp. Galur HIL Y-85,54728]b
Kelas II Bakteriosin tidak termodifikasi, stabil panas, mengandung peptida dengan BM <10 kD Subkelas IIa (bakteriosin antisteril seperti pediocin) Subkelas IIb (bakteriosin dua peptida) Subkelas IIc (bakteriosin peptida lain)
Bavaricin A [Lactococcus sakei] Enterocin SE-K4 [E. faecium] Lactoccocin MMFII [L. lactis] Plantarisin EF [L. plantarum] Plantarisin JK [L. plantarum] Lactococcin 972 [L. lactis
Kelas III Bakteriosin dengan BM >30 kD
Helveticin J [L. helveticus]c
Kelas IV Protein kompleks Enterolysin A[E. faecium]d
Sumber : Drider et al. (2006); aCuesta et al. (2000); bTeo & Tan (2005); cMathot et al. (2003) dalam Baruno (2008); dFranz et al. 2007.
Plantarisin (Wood & Warner 2003) merupakan salah satu jenis dari bakteriosin yang dihasilkan bakteri asam laktat. Plantarisin adalah suatu peptida inhibitor yang dihasilkan oleh bakteri Lactobacillus plantarum. Beberapa plantarisin yang telah diteliti diantaranya adalah plantarisin ASM1 dari L. plantarum, bakteriosin ST8KFdari L. plantarum ST8KF, bakteriosin AMA-K dari L. plantarum AMA-K (Hata et al. 2010; Powel et al. 2007; Todorov et al. 2007).
Mekanisme Biokimia Bakteriosin
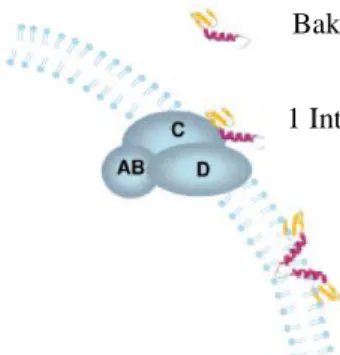
Mekanisme biokimia dari bakteriosin terhadap aktivitas penghambatannya bergantung pada dua hal, yaitu molekul reseptor dan permeabilisasi membran. Pada Gambar 5 terlihat bakteriosin kelas IIa berinteraksi dengan dua tahap. Tahap pertama, bakteriosin menempel pada permukaan membran sel dengan bantuan reseptor (interaksi dengan docking). Tahap kedua, bakteriosin membentuk lubang (permeabilisasi membran) (Drider et al. 2006).
9
Gambar 5 Permeabilisasi membran oleh bakteriosin kelas Iia (Drider et al. 2006).
Proses awal permeabilisasi membran oleh bakteriosin dipengaruhi oleh komposisi membran sel target, muatan membran, dan adanya reseptor target. Bakteri Gram negatif dengan struktur membran sel yang lebih tebal lebih sulit ditembus oleh bakteriosin dibandingkan dengan bakteri Gram positif yang mempunyai membran sel yang lebih tipis. Pada tahap permeabilisasi membran, struktur atom karbon pada membran dan protein imunitas mempengaruhi aktivitas biosintesis dalam menembus lapisan ini (Drider et al. 2006).
Bakteriosin yang aktif di membran dapat menyebabkan permeabilisasi langsung pada sel, sehingga langsung dapat membunuh mikroba target. Adanya pelepasan gradien proton saat permeabilisasi juga dapat menyebabkan autolisis sel membran (Cuesta et al 2000 dalam Baruno 2008).
Kromatografi
Kromatografi merupakan metode pemisahan suatu senyawa dengan struktur yang berbeda atau sama berdasarkan 9dsorbs secara selektif pada absorban yang berbeda. Terdapat dua fase pada kromatografi, yaitu fase mobil atau fase gerak yang membawa sampel dan fase stasioner atau fase diam yang menahan sampel. Fase gerak dapat berupa cairan atau gas, sedangkan fase diam dapat berupa padatan atau cairan. Apabila fase gerak berupa cairan disebut kromatografi cair dan apabila fase gerak berupa gas disebut kromatografi gas. Prinsip dasar dari kromatografi adalah koefisien partisi atau koefisien distribusi (Kd) yang menggambarkan jalur distribusi senyawa yang dianalisis antara dua fase
Bakteriosin Kelas IIa
2 Permeabilisasi membran 1 Interaksi dengan docking
10
yang tidak saling bercampur (Bintang 2010). Koefisien distribusi dihitung dengan cara:
Kd = konsentrasi zat yang terlarut dalam fase gerak
konsentrasi zat yang terlarut dalam fase diam
Kromatografi Gel Filtrasi
Kromatografi gel filtrasi adalah salah satu contoh sistem kromatografi padat-cair. Gel yang berbentuk padat berfungsi sebagai fase diam. Sedangkan fase geraknya berupa eluen yang berbentuk cair. Untuk memisahkan protein berdasarkan bobot molekulnya, kromatografi gel filtrasi dapat digunakan. Selain efektif, teknik ini juga mudah dilakukan (Bintang 2010).
Menurut Bintang (2010) selain kromatografi gel filtrasi, kromatografi cair kinerja tinggi (KCKT) dengan fase diam dan gerak berupa cairan juga efektif untuk purifikasi protein. Prinsipnya adalah adanya interaksi antara molekul dengan fase gerak dan fase diam yang memisahkan komponen dari senyawa tersebut berdasarkan tingkat kepolarannya. Molekul yang polar akan lebih kuat berinteraksi dengan eluen polar segingga mudah terelusi, begitu juga sebaliknya dengan molekul non polar.
Liquid Chromatography Mass Spectroscopy (LC-MS)
LC-MS adalah metode analisis kuantitatif yang mengkombinasikan antara kromatografi cair kinerja tinggi dengan spektroskopi massa. Instrumen LC-MS terdiri atas inlet-LC, sumber ion, tekanan permukaan, Mass analyzer, detektor, dan proses data. Prinsip dari analisis kuantitatif dengan LC-MS adalah ionisasi molekul. Senyawa yang akan dianalisis difragmentasi oleh molekul bermuatan positif, sehingga terbentuk fragmen-fragmen berupa ion positif. Fragmen dari ion-ion positif yang dihasilkan mencirikan komponen dari molekul yang akan dianalisis (Willard et al. 1988)
Metode LC-MS digunakan untuk menentukan massa molekul. Selain untuk mengetahui massa molekul, metode ini efektif untuk mengetahui tingkat kemurnian molekul yang dianalisis, karena analisis diperoleh dari kromatogram HPLC dan spektroskopi massa.
11
Elektroforesis Gel Poliakrilamida Sodium Dodesil Sulfat
Elektroforesis adalah suatu cara yang digunakan untuk memisahkan fraksi-fraksi campuran suatu senyawa berdasarkan pergerakan partikel-partikel koloid bermuatan dengan pengaruh medan listrik. Elektroforesis dapat digunakan untuk menentukan berat molekul suatu protein. Saat elektroforesis, protein yang bermuatan negatif akan menuju elektroda yang bermuatan positif. Protein yang dipisahkan berdasarkan bobot molekulnya. Dua jenis gel yang umum digunakan dalam elektroforesis adalah agarosa dan poliakrilamid. Untuk penentuan bobot molekul suatu protein dapat digunakan gel poliakrilamid (Bintang 2010).
Konsentrasi akrilamida yang digunakan dalam elektroforesis berbanding lurus dengan kerapatan gel. Semakin besar konsentrasi akrlimida yang digunakan maka gel akan semakin rapat, sehingga sangat efektif untuk pemisahan protein yang berbobot molekul rendah ( < 20 kD). Adanya kandungan sodium dodesil sulfat (SDS) efektif untuk mempertahankan polipeptida setelah terdenaturasi dari struktur sekunder dan tersier (Bintang 2010).
13
BAHAN DAN METODE Bahan dan Alat
Bahan-bahan yang digunakan adalah Escherichia coli BL21(DE3)pLysS, Lactobacillus plantarumS34 (koleksi Pusat Penelitian Bioteknologi LIPI-Cibinong), isopropil β-D-tio galaktopiranosida (IPTG), malachite green, polivinil alkohol, amonium molibdat, sodium sitrat, ATP, media de Man, Rogosa, Sharpe (MRS), media Luria Bertani (LB), natrium azida dalam 6 N HCl, amonium sulfat, resin TALON, silver staining, commasie blue, imidazole, ampisilin, buffer B, buffer Tris-HCl, buffer elusi, gliserol, Sephadex G-50, metanol, asam 4-morfolinopropanafosfat sulfonat (MOPS), MgCl2, kolom Pak C18 MG II,
TEMED, akrilamid, amonium per sulfat (APS), tripsin, proteinase-K, katalase, lipase, marker (penanda bobot molekul), dan akuades.
Alat-alat yang digunakan adalah sentrifuse, sonikator, kolom kromatografi, SDS PAGE, kolorimeter, inkubator -20 °C, pH meter, oven, mikropipet, dan alat-alat gelas lainnya.
14
Metode Penelitian
Ekspresi dan Purifikasi RNA Helikase Virus Hepatitis C (Utama et al. 2000) Kultur bakteri E. coli BL21(DE3)pLysS yang membawa gen NS3 RNA helikase virus hepatitis C ditumbuhkan dalam media Luria Bertani (LB) yang telah ditambahkan ampisilin 100 μg/mL. Kultur bakteri digoyang pada 200 rpm, suhu 37 °C selama 16 jam. Ekspresi enzim RNA helikase virus hepatitis C dilakukan dengan menambahkan 10 mL kultur ke dalam 400 mL media LB yang telah ditambahkan ampisilin 100 μg/mL. Media kemudian digoyang 150 rpm, suhu 37 °C selama 30 menit. Selanjutnya, sejumlah isopropil β-D-tio galaktopiranosida (IPTG) 0,3 mM ditambahkan ke dalam media LB yang telah ditambah ampisilin dan digoyang 150 rpm, suhu 37 °C selama 3 jam. Setelah 3 jam, kultur disentrifugasi pada 4000 rpm, suhu 4 °C, selama 10 menit. Supernatan dibuang, pelet dicampur dengan kultur yang tersisa dan disentrifugasi kembali pada 4000 rpm, suhu 4 °C, selama 10 menit. Pelet yang diperoleh disimpan pada suhu -20 °C.
Pelet E. coli BL21(DE3)pLysS yang mengandung RNA helikase virus hepatitis C dipecah dengan metode beku-cair dengan tiga kali ulangan. Pelet ditambahkan buffer B (Tris HCl 10 mM pH 8,5; NaCl 100 mM, dan tween-20 0,25%) sebanyak 20 mL, lalu disonikasi selama 45 detik, interval satu menit dengan 3 kali pengulangan. Pelet hasil sonikasi disentrifugasi pada 10000 rpm, 4 °C, selama 20 menit. Supernatan hasil sentrifugasi dipindahkan ke falcon steril dan ditambahkan resin ekuilibrasi 300 μL. Campuran supernatan dan resin ekuilibrasi diinkubasi pada rotator suhu 4 °C selama 3 jam. Setelah diinkubasi campuran supernatan dan resin ekuilibrasi disentrifugasi 3500 rpm, pada suhu 4 °C, selama 7 menit. Pelet hasil sentrifugasi ditambah buffer B 20 mL dan digoyang dalam es selama 5 menit, sedangkan sejumlah 1.5 mL supernatan dipindahkan ke dalam tabung mikro sentrifus untuk analisis SDS PAGE. Campuran pelet dan buffer B disentrifugasi pada 3500 rpm suhu 4 °C, selama 5 menit. Pelet hasil sentrifugasi ditambahkan buffer B 20 mL dan digoyang dalam es selama 5 menit, sedangkan sejumlah 1 mL supernatan dipindahkan dalam tabung mikro sentrifus (dilakukan 2 kali sehingga diperoleh supernatan hasil
15
pencucian satu dan pencucian dua). Pelet hasil pencucian kedua ditambahkan buffer elusi sebanyak 400 mL dan diinkubasi pada suhu 4 °C selama 15 jam.
Campuran pelet dan resin hasil inkubasi selanjutnya disentrifugasi pada 3000 rpm, suhu 4 °C, selama 2 menit. Sejumlah 50 μL supernatan dipindahkan ke tabung mikrosentrifus, sedangkan resin yang tersisa ditambahkan buffer elusi lalu dirotator selama 3 jam pada suhu 4 °C. Campuran resin disentrifuse kembali pada 3000 rpm, suhu 4 °C selama 2 menit. Supernatan yang diperoleh (enzim RNA helikase virus hepatitis C) dipindahkan dalam tabung mikrosentrifuse dan di simpan pada suhu 4 °C. Resin yang tersisa disimpan pada suhu 4 °C untuk analisis bobot molekul.
Analisis bobot molekul enzim RNA helikase virus hepatitis C dilakukan dengan metode Sodium Dedosyl Sulfate Poly Acrilamide Gel Electrophoresis (SDS PAGE). Setelah elektroforesis selesai, gel diwarnai dengan Commassie Brilliant Blue R-250. Analisis lebih lanjut enzim RNA helikase virus hepatitis C digunakan metode Western blot.
Proses western blot dilakukan beberapa tahap, yaitu pencucian membran nitroselulosa dengan larutan Posphate Buffer Saline Tween-20 (PBST), transfer protein pada membran menggunakan antibodi horseradish peroxidase (HRP), dan pewarnaan gel hasil western blot dengan Commassie Brilliant Blue R-250.
Tahap pertama proses western blot adalah SDS-PAGE protein target. Setelah SDS-PAGE selesai, gel elektroforesis direndam dalam buffer blocking (PBST + 5% susu skim ) selama 1 jam pada suhu ruang. Pengotor yang terlepas dari perendaman dalam buffer blocking dicuci dengan PBST (PBS + 0.05% Tween-20). Setelah proses pencucian selesai, protein target ditransfer ke membran nitroselulosa menggunakan antibodi HRP dan buffer blocking dengan perbandingan 1:2500. Protein target hasil transfer di membran nitroselulosa diwarnai dengan Commassie Brilliant Blue R-250.
Optimasi Kultivasi Lactobacillus plantarum S34 (Todorov & Dicks, 2005a modifikasi)
Bakteri Lactobacillus plantarum S34 masing-masing dikultur dalam media de Man, Rogosa, Sharpe (MRS), media MRS+yeast ekstrak 3%, dan media
16
MRS+glukosa 2% dengan pH 6,5 pada suhu 37 °C. Kultur Lactobacillus plantarum S34 yang tumbuh pada masing-masing media dibuat kurva Optical Density (OD) dan pH.
Isolasi dan Purifikasi Plantarisin dari Lactobacillus plantarum S34 (Todorov
et al. 2010 modifikasi)
Hasil kultivasi biakan Lactobacillus plantarum S34 disentrifugasi dengan kecepatan 10000 rpm selama 30 menit pada suhu 4 °C. Supernatan yang dihasilkan diatur pada pH 7 lalu dipanaskan selama 15 menit pada suhu 90 °C dan 121 °C. Setelah pemanasan supernatan diendapkan dengan amonium sulfat hingga kejenuhan 80% pada suhu 4 °C, kemudian didiamkan selama selama satu malam pada suhu 4 °C. Supernatan hasil pengendapan disentrifugasi dengan kecepatan 10000 rpm selama 30 menit pada suhu 4 °C. Pelet yang diperoleh diresuspensi dengan Tris HCl 10 mM pH 7.4, kemudian disimpan di tabung vial pada suhu -20 °C. Suspensi pelet aktivitas inhibisinya diuji dengan metode kolorimetri.
Suspensi pelet dipurifikasi lebih lanjut dengan kromatografi adsorpsi (kromatografi kolom dengan fase diam sephadex-G50). Sejumlah 1 mL suspensi pelet dimasukkan dalam kolom kromatografi, kemudian dielusi menggunakan berbagai eluen (metanol 30%, etanol 30%, NaCl 0,1-0,5 M, akuabides, dan Buffer Tris HCl pH 7,4) dengan kecepatan laju alir 1 mL/menit. Hasil fraksi kolom kromatografi ditampung dalam tabung mikrosentrifuse, kemudian dilakukan uji dengan metode kolorimetri. Fraksi dengan aktivitas inhibisi tertinggi dipurifikasi lebih lanjut dengan LC-MS dan ditentukan bobot molekulnya dengan SDS-PAGE.
Pengujian aktivitas plantarisin S34 dengan metode kolorimetri ATP (Utama
et al. 2000)
Komponen pereaksi untuk kolorimetri dinamakan campuran utama yang terdiri atas 10 mM MOPS pH 6.5, 1 mM MgCl2, dan 2 mM ATP. Campuran
utama, sampel, dan enzim dengan jumlah 50 μL/sumur direaksikan selama 45 menit pada suhu ruang. Larutan pewarna (akuades, malachite green 0.081%, polivinil alkohol 2.3%, dan ammonium molibdat 5.7% dalam HCl 6 N dengan
17
perbandingan 2:2:1:1) ditambahkan pada tiap sumur sejumlah 100 μL. Selanjutnya sampel diinkubasi kembali selama 5 menit, lalu ditambahkan sodium sitrat sejumlah 25 μL untuk menghentikan reaksi warna. Sampel diukur absorbansinya pada panjang gelombang 620 nm dengan referensi 405 nm. Jumlah mol fosfat bebas (Pi) yang terhidrolisis dari ATP per menit per mg protein diartikan sebagai satu unit aktivitas RNA helikase virus hepatitis C. Inhibisi (%) RNA helikase virus hepatitis C dihitung dengan persamaan (A-I) /A x 100, dimana A adalah aktivitas enzim tanpa inhibitor, dan I adalah aktivitas enzim dengan inhibitor (Hatsu et al. 2002).
Karakterisasi plantarisin dari Lactobacillus plantarum S34 Uji Enzim(Todorov et al. 2010)
Ekstrak kasar plantarisin dariL.plantarum S34 diinkubasi selama 2 jam setelah penambahan masing-masing(1 mg/mL) enzim tripsin, proteinase-K, katalase, dan lisozim. Aktivitas enzim pada plantarisin S34dihentikan dengan pemanasan pada 100 °C selama 5 menit, kemudian diuji aktivitas inhibisi RNA helikasenya dengan metode kolorimetri.
Uji Surfaktan dan Protease Inhibitor (Todorov et al. 2010)
Ekstrak kasar plantarisin dari L.plantarum S34 diuji aktivitasnya terhadap penambahan masing-masing (1% v/v) SDS, urea, tween-20. Triton X-100, dan EDTA. Selanjutnya,plantarisin S34 diuji aktivitasnya dengan metode kolorimetri. Pengukuran Kadar Protein (Bradford 1976)
Sampel dari fraksi dengan aktivitas inhibisi tertinggi diukur kadar proteinnya secara kuantitatif menggunakan Bovine Serume Albumnine (BSA) kit. Sampel dan working reaction diinkubasi pada 37 °C selama 30 menit, kemudian hasil reaksi dibaca pada panjang gelombang 562 nm. Untuk blanko, digunakan akuades sebagai pengganti sampel fraksi.
Analisis Bobot Molekuldengan SDS PAGE (Laemmli 1970)
Sampel berupa fraksi hasil kolom dengan daya inhibisi tertinggi dianalisis bobot molekulnya dengan elektroforesis gel sodium dodesil sulfat poliakrilamid
18
(SDS PAGE). Gel poliakrilamid dibuat dengan mencampurkan sukrosa, poliakrilamid, akuades, TEMED, dan amonium persulfat. Selanjutnya, sampel dicampurkan dengan loading dye dan didenaturasi pada suhu 95 °C selama 10 menit. Setelah perangkat elektroforesis disiapkan, sampel dan penanda bobot molekul (sebagai pembanding) dimasukkan ke sumur elektroforesis. Setelah elektroforesis selesai, gel diwarnai dengan pewarnaan perak (silver stainning) hingga muncul pita-pita yang menandakan bobot molekul.
19
HASIL DAN PEMBAHASAN
Ekspresi dan Purifikasi RNA Helikase Virus Hepatitis C
54 kD
25 kD
1 2 3 4 5 6
Gambar 6 Pita hasil SDS-PAGE RNA helikase virus hepatitis C (1: marker; 2: Eluat 1; 3: Eluat 2; 4: inner volume; 5: washing 1; 6: washing 2) dengan pewarna coomassie brilliant blue.
Enzim RNA helikase virus hepatitis C rekombinan dari bakteri E. coli BL21(DE3)pLysS berhasil dipurifikasi dengan baik. Gambar 6 menunjukkan pita hasil Sodium Dedosyl Sulfate Poly Acrilamide Gel Electrophoresis (SDS-PAGE) RNA helikase virus hepatitis C. Lajur 2 dan 3 adalah RNA helikase virus hepatitis C hasil purifikasi (eluat). Lajur 4 adalah hasil pemisahan sel debris dan komponen intraseluler (inner volume). Lajur 5 dan 6 adalah hasil pemisahan eluat dan resin (washing 1 dan washing 2). Terlihat pada Gambar 6, lajur 4 masih banyak pita yang muncul. Hal ini menandakan protein target yang masih bercampur dengan pengotor sehingga harus dipurifikasi lebih lanjut. Lajur 5 dan 6 yang tidak disertai adanya pita hasil SDS-PAGE menandakan saat pencucian dengan buffer B tidak ada protein target yang terlepas. Pita protein target muncul pada lajur 2 dan 3. Lajur 3 menunjukkan hasil pita protein yang lebih jelas karena resin TALON dipurifikasi kembali selama 16 jam. Hasil pita protein ukuran 54 kD ini sesuai dengan hasil penelitian Utama et al. (2000).
Kultur bakteri E. coli BL21(DE3)pLysS dapat tumbuh dengan baik dalam media Luria Bertani (LB). Media LB terdiri atas tripton, NaCl, dan yeast ekstrak.
20
Tripton berfungsi sebagai sumber karbon, nitrogen,dan vitamin. NaCl sebagai sumber mineral, sedangkan yeast ekstrak sebagai sumber asam amino esensial dan vitamin yang bermanfaat untuk proses pertumbuhan bakteri dan metabolisme. Kultur yang tumbuh ditandai dengan perubahan warna media dari kuning cerah menjadi kuning kekeruhan. Penambahan ampisilin (100 mg/mL) ke dalam kultur bertujuan sebagai seleksi terhadap bakteri yang hidup pada media. Ekpresi enzim RNA helikase virus hepatitis C dilakukan dengan penambahan Isopropyl-β-D-thiogalactopyranoside (IPTG) di awal fase logaritmik (OD600 = 0,3) hingga fase
stasioner (OD600 = 1).
Produksi enzim RNA helikase virus hepatitis C tidak selalu berjalan dengan baik. Hal ini dipengaruhi oleh berbagai faktor, diantaranya dari bakteri E.coli BL21(DE3)pLysS dan teknik purifikasi. Untuk itulah dilakukan pengecekan ada tidaknya kandungan protein pada enzim RNA helikase virus hepatitis C dengan western blot (Gambar 7). Penggunaan western blot untuk mengidentifikasi suatu protein sangat akurat dan spesifik. Hal ini dikarenakan prinsip western blot menggunakan antibodi yang spesifik untuk mengikat protein target.
Gambar 7 Pita protein hasil western blot RNA helikase virus hepatitis C (1 dan 5: Inner volume; 2 dan 6: washing 1; 3 dan 7: eluat 1; 4 dan 9: resin; 10: RNA Helikase virus hepatitis C; M: marker).
75 kD
21
Hasil pada Gambar 7 menunjukkan pita protein RNA helikase virus hepatitis C hasil western blot. Lajur ke-10 dengan jelas menunjukkan pita protein RNA helikase virus hepatitis C berhasil dideteksi dengan antigen horseradish peroxidase (HRP). Hal ini menunjukkan bahwa, pada lajur tersebut benar terdapat protein. Lajur ke-1 sampai dengan lajur ke-9 pada Gambar 7 tanpa pita protein, hal ini menunjukkan bahwa tidak adanya kandungan protein yang terdeteksi dalam sampel.
Enzim RNA helikase virus hepatitis C selanjutnya diproduksi terus menerus selama penelitian dan digunakan sebagai target untuk pengujian aktivitas inhibisi plantarisin S34 dari Lactobacillus plantarum selama tahap purifikasi.
Optimasi Kultivasi Plantarisin dari Lactobacillus plantarum S34
Lactobacillus plantarum S34 tumbuh dengan baik dalam media de Man, Rogosa, Sharpe (MRS) + glukosa (2% b/v) pH 6,5 pada suhu 37 °C selama 20 jam. Pertumbuhan Lactobacillus plantarum S34 meningkat dari jam ke-2 sampai dengan jam ke-20, lalu mulai mengalami penurunan pada jam ke-22 (Gambar 10). Masih pada Gambar 10, pH media kultur mengalami penurunan dari 6,5 diawal kultivasi menjadi pH 4 diakhir kultivasi. Penurunan pH pada media kultur disebabkan karena bertambahnya asam laktat yang dikeluarkan oleh Lactobacillus plantarum S34 selama proses fermentasi. Adapun penambahan glukosa sebanyak 2% (b/v) pada media bertujuan untuk mendukung pertumbuhan bakteri Lactobacillus plantarum S34. Todorov dan Dicks (2005a) melaporkan bahwa penambahan glukosa 2% (b/v) sebagai sumber karbon pada media tumbuh membuat aktivitas tertinggi bakteriosin ST28MS dan ST26MS, yaitu masing-masing sebesar 12.400 AU/mL dan 6400 AU/mL.
Komposisi media MRS terdiri atas pepton (10 g/L) dan meat ekstrak (8 g/L) yang berfungsi sebagai sumber karbon, nitrogen, dan vitamin, yeast ekstrak (4 g/L) sebagai sumber vitamin dan asam amino esensial yang mendukung pertumbuhan bakteri, glukosa (20 g/L) sebagai sumber karbon, mangan sulfat (0.05 g/L) dan magnesium sulfat (0,2 g/L) sebagai sumber kation, tween 80 1 mL sebagai sumber surfaktan, triamonium sitrat (2 g/L) dan dipotasium hidrogen fosfat (2 g/L). Penambahan glukosa sebanyak 2% (b/v) pada media bertujuan
22
untuk mendukung pertumbuhan bakteri Lactobacillus plantarum S34 (Todorov and Dicks 2005a). Gambar 9 dan 10 berturut-turut menunjukkan kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS + glukosa 2% (Todorov & Dicks 2005) dan MRS + yeast ekstrak 3% (Arief 2012) yang dibandingkan dengan kurva pertumbuhan pada media kontrol (Gambar 8).
Kurva pertumbuhan Lactobacillus plantarum S34 tidak berbeda antara media tumbuh MRS + glukosa 2%, media MRS + yeast ekstrak 3%, dan media MRS sebagai kontrol (Gambar 8, 9, dan 10). Lactobacillus plantarum S34 yang ditumbuhkan pada masing-masing media tumbuh dengan baik hingga jam ke-20. Fase log pertumbuhan Lactobacillus plantarum S34 dimulai pada jam ke-8 sampai dengan jam ke-20. Pada jam ke-22 pertumbuhan Lactobacillus plantarum S34 statis dengan pH 4 pada media tumbuhnya.
23
Gambar 9 Kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS + Gukosa 2%.
Gambar 10 Kurva pertumbuhan Lactobacillus plantarum S34 pada media MRS + yeast ekstrak 3%.
24
Isolasi dan Purifikasi plantarisin dari Lactobacillus plantarum S34
Hasil isolasi plantarisin dari 500 mL media kultur Lactobacillus plantarum S34 diperoleh berupa ekstrak kasar sebanyak 5 mL. Aktivitas ekstrak kasar plantarisin S34 dari media MRS + glukosa 2% dalam menginhibisi RNA helikase virus hepatitis C yang diperoleh mencapai 111,18% (2x pengenceran) (Gambar 11). Aktivitas inhibisi diatas 100% menunjukkan ekstrak kasar plantarisin S34 yang siap dimurnikan. Nilai inhibisi ekstrak kasar plantarisin S34 dari media MRS + glukosa 2% lebih tinggi dibandingkan dengan ekstrak kasar plantarisin S34 dari media tumbuh MRS dan MRS + yeast ekstrak 3%, yaitu masing-masing sebesar 70,08% dan 98,42% (Gambar 11). Nilai inhibisi ekstrak kasar plantarisin S34 dari media MRS + glukosa 2% yang tinggi diduga karena penambahan glukosa 2% yang langsung bisa diuraikan sebagai sumber karbon dalam menginduksi pembentukan plantarisin pada proses fermentasi. Untuk proses selanjutnya, ekstrak kasar plantarisin S34 yang digunakan berasal dari media tumbuh MRS + glukosa 2%.
Supernatan yang diperoleh mengandung banyak komponen intraseluler sehingga dilakukan purifikasi lebih lanjut menggunakan teknik pengendapan protein dengan ammonium sulfat. Pada pengendapan protein, apabila konsentrasi garam tinggi maka protein akan mengendap pada lapisan bawah. Hal ini disebut ‘salting out’. Sejak berbagai pengendapan protein dilakukan pada berbagai konsentrasi garam, sistem ‘salting out’ sering dipakai untuk proses pengendapan protein. Amonium sulfat adalah salah satu pilihan untuk pengendapan protein. Pada amonium sulfat terdapat kombinasi antara efektivitas ‘salting out’, pH versatility, mudah larut air, low heat solution, dan harganya murah (Scopes 1982). Konsentrasi ammonium sulfat yang digunakan dalam bentuk persen pengendapan.
Pada saat penambahan amonium sulfat dalam larutan, harus sedikit demi sedikit. Pada larutan 100 mL, dengan konsentrasi pengendapan amonium sulfat 80% , jumlah ammonium sulfat yang ditambahkan sebesar 56.1 gram. Biasanya setelah penambahan 1 sendok teh amonium sulfat, ditunggu 5-10 menit sampai seluruh garam larut, baru ditambahkan garam amonium sulfat berikutnya. Saat pelarutan amonium sulfat, magnetic stirrer tidak boleh terlalu cepat agar tidak
25
timbul buih dan tidak timbul panas. Buffer yang digunakan sebaiknya mengandung agen pengkelat seperti EDTA. Buffer sebaiknya tidak mengandung ion logam agar tidak merusak protein. Untuk memperoleh hasil yang maksimal, protein yang digunakan pada saat pengendapan sebaiknya pada konsentrasi lebih dari 1 mg/mL. Pengendapan dengan ammonium sulfat adalah cara terbaik untuk menjaga protein pada saat penyimpanan (Scopes 1982).
Gambar 11 Daya inhibisi ekstrak kasar plantarisin S34 pada RNA helikase virus hepatitis C.
Gambar 11 menunjukkan hasil inhibisi ekstrak kasar plantarisin S34 yang lebih besar pada media MRS + glukosa 2% dengan pemanasan pada 90 °C selama 15 menit. Sehingga untuk proses selanjutnya ekstrak kasar plantarisin S34 yang digunakan adalah hasil produksi dari kultur pada media MRS + glukosa 2% (b/v) dengan pemanasan 90 °C selama 15 menit.
Pemanasan 90 °C dan 121 °C selama 15 menit bertujuan sebagai seleksi terhadap peptida yang tahan panas. Sehingga peptida lain yang tidak tahan terhadap pemanasan akan mengalami denaturasi. Hasil penelitian Todorov dan Dicks (2005a) menyatakan bahwa bakteriosin ST28MS dan ST26MS mempunyai aktivitas antibakteri yang sama pada perlakuan pemanasan 100 °C selama 90 menit dan 121 °C selama 20 menit. Penelitian lain menyebutkan bahwa plantarisin ASM1 tahan terhadap pemanasan selama 15 menit pada suhu 90 °C (Hata et al. 2010).
26
Gambar 12 Karakterisasi ekstrak kasar plantarisin S34 pada berbagai enzim [0.1 mg/mL].
Gambar 13 Karakteristik ekstrak kasar plantarisin S34 pada berbagai surfaktan dan protease inhibitor (1% v/v).
27
Ekstrak kasar plantarisin S34 juga diuji karakteristiknya dengan perlakuan pada berbagai enzim [0.1 mg/mL] (Gambar 12) dan karakteristik pada berbagai surfaktan dan protease inhibitor (1% v/v) (Gambar 13). Pada Gambar 12 dapat dilihat ekstrak kasar plantarisin S34 stabil terhadap perlakuan dengan enzim katalase, proteinase-K, dan lisozim pada konsentrasi 0.1 mg/mL. Katalase yang tidak mempengaruhi aktivitas inhibisi menunjukkan bahwa adanya hidrogen peroksida tidak mempengaruhi aktivitas plantarisin S34 dalam menghambat RNA helikase virus hepatitis C. Sedangkan dengan perlakuan terhadap tripsin, ekstrak kasar plantarisin S34 mengalami penurunan aktivitas inhibisi terhadap RNA helikase virus hepatitis C sebesar 54,36 % (Gambar 12). Hal ini menunjukkan bahwa plantarisin S34 dapat direduksi aktivitasnya dengan enzim proteolitik. Perlakuan ekstrak kasar plantarisin S34 terhadap sodium dodesil sulfat (SDS), urea, tween-20, triton X-100, dan EDTA (1% v/v) masih mempunyai aktivitas inhibisi terhadap RNA helikase virus hepatitis C diatas 80% (Gambar 13). Hal ini menunjukkan bahwa surfaktan dan protease inhibitor (1% v/v) tidak mempengaruhi aktivitas ekstrak kasar plantarisin S34 secara signifikan. Penelitian serupa juga menunjukkan Bakteriosin ST202Ch dan Bakteriosin ST216Ch yang tidak dipengaruhi aktivitasnya terhadap perlakuan surfaktan dan protease inhibitor (1 % v/v) (Todorov et al. 2010).
Aktivitas Inhibisi Plantarisin S34 pada RNA Helikase Virus Hepatitis C Hasil aktivitas inhibisi plantarisin S34 dari eluen etanol 30%, NaCl (0.1-0.5 M), buffer Tris HCl pH 7.4, asetonitril 30%, akuabides, dan metanol 30% berturut-turut adalah 13,78%; 9,37%; 3,59%; 37,96%; 1,55% dan 46,53% (Gambar 14, 15, 16, 17, 18, dan 19). Nilai inhibisi plantarisin S34 tertinggi diperoleh dari hasil pemurnian dengan menggunakan eluan metanol 30%. Terlihat pada Gambar 14, ada satu puncak dengan aktivitas inhibisi paling tinggi, yaitu fraksi ke-11 dengan aktivitas sebesar 46,23%. Fraksi dengan aktivitas tinggi menandakan tingginya konsentrasi plantarisin S34 dalam menginhibisi RNA helikase virus hepatitis C. Sementara fraksi-fraksi dengan aktivitas yang rendah menandakan konsentrasi plantarisin S34 yang rendah atau tidak ada sama sekali. Fraksi ke-1 sampai dengan ke-9 mengalami penggumpalan, sehingga aktivitas
28
inhibisi RNA helikase virus hepatitis C tidak dapat diidentifikasi. Hal ini menandakan saat keluar dari kolom kromatografi, peptida belum terpisahkan dengan baik (Gambar 14).
Ekstrak kasar plantarisin S34 dipurifikasi menggunakan kromatografi gel filtrasi dengan berbagai eluen, yaitu metanol 30%, etanol 30%, NaCl (0.1-0.5 M), buffer Tris HCl pH 7.4, asetonitril 30%, dan akuabides. Fraksi awal dari hasil kromatografi gel filtrasi (Sephadex G-50) untuk semua eluen mengalami penggumpalan, kecuali hasil fraksi eluen asetonitril (Gambar 17). Untuk hasil aktivitas inhibisi fraksi-fraksi terhadap RNA helikase virus hepatitis C yang menggumpal tidak dapat ditafsirkan. Fraksi yang menggumpal yaitu, fraksi 1-6/30 eluen etanol 30%, fraksi 1-9/30 eluen NaCl (0.1-0.5 M), fraksi 1-21/50 eluen Tris HCl pH 7.4, fraksi 1-23/50 eluen akuabides, dan fraksi 1-9/30 eluen metanol 30% (Gambar 14, 15, 16, 18, dan 19).
Gambar 14 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen metanol 30%.
29
Gambar 15 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen NaCl 0.1-0.5 M.
Gambar 16 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen Tris HCl pH 7.4.
30
Gambar 17 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen asetonitril.
Gambar 18 Daya Inhibisi dari fraksi kromatografi kolom Sephadex G-50 eluen akuabides.
31
Gambar 19 Daya inhibisi dari fraksi hasil kromatografi kolom Sephadex G-50 eluen etanol 30%.
Karakterisasi Plantarisin dari Lactobacillus plantarum S34
Untuk karakterisasi plantarisin S34 terhadap berbagai enzim, surfaktan, dan protease inhibitor digunakan ekstrak kasarnya. Hasil uji ekstrak kasar plantarisin S34 dengan perlakuan pada berbagai enzim [0.1 mg/mL] dalam menginhibisi RNA helikase virus hepatitis C adalah katalase 85,36%; proteinase-K 92,03%; lisozim 90,81%; dan tripsin 54,36%. Ekstrak kasar plantarisin S34 relatif stabil terhadap perlakuan dengan enzim katalase, proteinase-K, dan lisozim pada konsentrasi 0,1 mg/mL. Sedangkan dengan perlakuan terhadap tripsin, ekstrak kasar plantarisin S34 mengalami penurunan aktivitas sebesar 52,58%. Hasil uji ekstrak kasar plantarisin S34 pada berbagai surfaktan dan protease inhibitor (1% v/v) dalam menginhibisi RNA helikase virus hepatitis C adalah SDS 85,19%, urea 94,86%, tween-20 96,77%, triton X-100 81,74%, dan EDTA 99,52%. Perlakuan ekstrak kasar plantarisin S34 terhadap SDS, urea, tween-20, triton X-100, dan EDTA (1% v/v) tidak mempengaruhi karakteristiknya secara signifikan dalam menginhibisi RNA helikase virus hepatitis C.
32
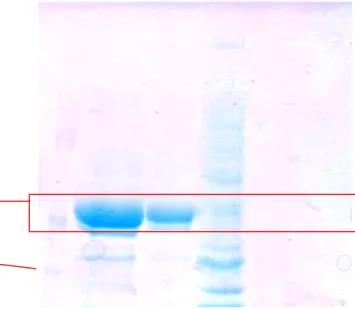
Gambar 20 Pita protein hasil purifikasi plantarisin S34 dengan eluen metanol 30% (1: Ekstrak kasar plantarisin S34; 2: supernatan plantarisin S34; 3: fraksi ke-11 hasil freeze dry; M: marker)
Untuk penentuan bobot molekul plantarisin S34 dilakukan dengan metode SDS-PAGE. Pada Gambar 20 lajur 3 menunjukkan pita SDS PAGE fraksi ke-11 hasil freeze dry plantarisin S34 dengan ukuran 6,47 kD. Lajur ke-1 dan ke-2 adalah ekstrak kasar plantarisin S34 dan supernatan S34. Pada lajur 1 masih banyak pita hasil SDS PAGE yang muncul. Hal ini berarti masih banyak komponen lain dalam ekstrak kasar plantarisin S34. Sedangkan pada lajur 2 tidak muncul pita hasil SDS PAGE yang manandakan tidak adanya kandungan peptida pada supernatan plantarisin S34 hasil sentrifuse. Lajur 5 adalah marker dengan densitas protein yang rendah (1,7-25 kD). Fraksi ke-11 dengan bobot molekul sebesar 6,47 kD dianalisis lebih lanjut dengan LCMS. Hasil kromatogram LCMS yang diperoleh menunjukkan plantarisin S34 target masih banyak pengotor, sehingga tidak dapat dilakukan identifikasi lebih lanjut (Lampiran 8).
Berbagai penelitian serupa yang menunjukkan peptida inhibitor dan bobot molekul hasil SDS-PAGE diantaranya adalah plantarisin ASM1 5,05 kD; bakteriosin ST216Ch 10 kD; pediosin LB-B1; dan bakteriosin ST8KF 3,5 kD (Hata et al. 2010; Todorov et al. 2010; Xie et al. 2011; Powel et al. 2007).
1 2 3 M 6,47 kD Marker (kD) 25 20 15 10 4,6
33
Tabel 2 Ringkasan purifikasi plantarisin dari Lactobacillus plantarum S34 Volume (mL) [Protein] (mg/mL) Total Protein (mg) Aktivitas Inhibisi (U/mL) Aktivitas Total (U) Aktivitas Spesifik (U/mg) Hasil (%) Kemurnian Supernatan 500 12,53 6.265 - - - 100 1 Pengendapan 80% Ammonium Sulfate 5 57,40 287 4,66x10-2 23,3x10-2 0,08x10-2 100 1 Fraksi 11 Sephadex G-50 1 1,43 1,43 2,13x10-2 2,13x10-2 1,49x10-2 9,12 18,35
Sebanyak 500 mL supernatan awal dari hasil kultur Lactobacillus plantarum S34 dengan konsentrasi protein sebesar 12,53 mg/mL menghasilkan ekstrak kasar plantarisin S34 sebanyak 5 mL. Aktivitas supernatan plantarisin S34 tidak dapat dihitung karena nilai uji inhibisi dengan metode kolorimetri yang tak terdefenisi. Sehingga dari supernatan plantarisin S34 ini, aktivitas inhibisi, aktivitas total, dan aktivitas spesifiknya juga tidak bisa dihitung. Hasil untuk ekstrak kasar plantarisin S34 dari pengendapan dengan ammonium sulfat 80% mempunyai konsentrasi protein sebesar 57,40 mg/mL. Ekstrak kasar plantarisin S34 ini memiliki aktivitas inhibisi sebesar 4,66 x 10-2 U/mL, aktivitas total sebesar 23,3 x 10-2 U, dan aktivitas spesifik sebesar 0,08 x 10-2 U/mg. Berbeda dari ekstrak kasar, hasil plantarisin S34 setelah dipurifikasi dengan kromatografi gel filtrasi mempunyai konsentrasi protein yang lebih kecil, yaitu sebesar 1.43 mg/mL. Aktivitas inhibisi dan aktivitas total plantarisin S34 hasil purifikasi lebih kecil dari ekstrak kasar, yaitu berturut-turut sebesar 2,13 x 10-2U/mL dan 2,13 x 10-2U. Sedangkan aktivitas spesifiknya lebih besar dari ekstrak kasar, yaitu sebesar 1,49 x 10-2U/mg. Hasil purifikasi plantarisin S34 melalui kromatografi gel filtrasi sebesar 9,12 % dengan peningkatan hasil kemurnian sebesar 18,35 kali (Tabel 2). Fraksi ke-11 selanjutnya dianalisis dengan LCMS untuk melihat karakternya. Namun demikian, kromatogram hasil LCMS menunjukkan masih banyaknya pengotor pada Fraksi ke-11 (Lampiran 47).
34
Gambar 21 Kromatogram fraksi ke-11 plantarisin S34 hasil HPLC.
Data pada Gambar 21 adalah kromatogram fraksi ke-11 hasil High Performance Liquid Chromatography (HPLC). Terlihat pada Gambar 21 bagian yang dilingkari adalah kromatogram target plantarisin S34. Banyaknya puncak yang terlihat pada kromatogram target menunjukkan plantarisin S34 yang masih kotor, sehingga harus dipurifikasi lebih lanjut.
SIMPULAN DAN SARAN
Lactobacillus plantarum S34 tumbuh dengan baik pada media MRS+glukosa 2% pH 6,5 suhu 37 ºC selama 20 jam. Plantarisin S34 hasil purifikasi dengan ammonium sulfat 80% mempunyai aktivitas inhibisi terhadap RNA helikase virus hepatitis C sebesar 111,18% dengan 2x pengenceran. Ekstrak kasar plantarisin S34 stabil terhadap SDS, urea, tween-20, Triton X-100, EDTA dan lisozim, katalase, proteinase-K dengan konsentrasi masing-masing 1% dan 0,1 mg/mL. Plantarisin S34 hasil purifikasi dengan kromatografi gel filtrasi mempunyai aktivitas spesifik sebesar 1,49x10-2 U/mg dengan tingkat kemurnian sebesar 18,35 kali. Plantarisin S34 berhasil diisolasi dengan bobot molekul sebesar 6,47 kD.
Plantarisin S34 yang berhasil diisolasi harus dipurifikasi dan dikarakterisasi lebih lanjut. Perlu juga dilakukan penentuan sekuen asam amino dari plantarisin S34 untuk mengetahui karakteristiknya.
35
DAFTAR PUSTAKA
Arief II. 2012. Isolation, Purification, and Characterization Novel Plantaricin: Bacteriocin Produced by Indonesian Lactic Acid Bacteria Lactobacillus plantarum strains. ITSF.
Atrih A, Rekhif N, Moir AJG, Lebrihi A, Lefebvre G. 2001. Mode of Action, Purification and Amino Acid Sequence of Plantaricin C19, An Anti-ListeriaBacteriocin Produced by Lactobacillus plantarum C19. International Journal of Food Microbiology 68:93-104.
Baruno A. 2008. Karakterisasi Antimikrob Bakteriosin dari Bacillus sp. Galur LTC-8 Asal Tambak Udang [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Bell JE, Bell ET. 1988. Proteins and Enzymes. New Jersey: Englewood Cliffs. Bintang, M. 2010. Biokimia: Teknik Penelitian. Jakarta: Erlangga.
Bradford MM. 1976. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing Principles of Protein-dye Binding. Anal Biochem 72:248-254.
Cuesta MCM et al. 2000. Requirement of Autolytic Activity for Bacteriocin-induced Lysis. Appl Environ Microbiol 66:3174-3179.
Dennis Kunkel Microscopy 2004. Lactobacillus plantarum. [terhubung berkala] http://www.google.com/imgres?imgurl=http://www.nadidem.net/k/Lac/i mages/Lactobacillus%2520plantarum_jpg. [15 Agustus 2013].
Delgado A, et al. 2007. Optimum Bacteriocin Production by Lactobacillus plantarum 17.2b Requires Absence of NaCl and Apparently Follows A Mixed Metabolite Kinetics. Journal of Biotechnology 130:193-201. Deraz SF, Karlsson EN, Hedström M, Andersson MM, Bo Mattiasson. 2005.
Purification and Characterization of Acidocin D20079, a Bacteriocin Produced by Lactobacillus acidophilus DSM 20079. Journal of Biotechnology 117:343-354.
Drider D, Fimland G, Hechard Y, McMullen M, Prevost H. 2006. The Continuing Story of Class IIa Bacteriocins. Microbiol Mol Biol Rev 70:564-582. [DEPKES] Departemen Kesehatan 2010. Masyarakat Dunia Peringati Hari
Hepatitis. http://www.depkes.go.id/index.php/berita/press-release/1156-masyarakat-dunia-peringati-hari-hepatitis. html [24 Januari 2011].
36
Franz CMAP, Van Belkum MJ, Holzapfel WH, Abriouel H, Gàlvez A. 2007. Diversity of Enterococcal Bacteriocins and Their Grouping in A New Classification Scheme. FEMS Microbiology Reviews 31(3):293-310. Fuller R.1992. Probiotics The Scientific Basis. Tokyo: Chapman & Hall.
Hata T, Tanaka R, Ohmomo S. 2010. Isolation and Characterization of Plantaricin ASM1: A New Bacteriocin Produced by Lactobacillus plantarum A-1. International Journal of food Microbiology 137:94-99.
Hatsu M, Tanaka M, Utama A, Shimizu H, Takamizawa K. 2002. A Japanese Enchepalitis Virus NS3 Inhibitor Produced by A Streptomyces sp. Actinomycetol 16:6-8.
Holo H, Jeknic Z, Daeschel M, Stevanovic S, Nes IF. 2001. Plantaricin W from Lactobacillus plantarum Belongs to A New Family of Two-Peptide Lantibiotics. Microbiology 147:643-651.
Jimẻnez-Dỉaz R, Rios-Sanchez RM, Desmazeaud M, Ruiz-Barba JL, Piard JC.1993. Plantaricin S and T, Two New Bacteriocins Produced by Lactobacillus plantarum LPC010 Isolated from A Green Olive Fermentation. Applied and Environmental Microbiology 59(5):1416-1424.
Jimẻnez-Dỉaz R, et al. 1995. Purification and Partial Amino Acid Sequence of Plantaricin S, A Bacteriocin Produced by Lactobacillus plantarum LPC010, the Activity of Which Depends on the Complementary Action of Two Peptides. Applied and Environmental Microbiology 61(12):4459-4463.
Laemmli UK 1970. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature 227 (5259):680-685.
Lauer GM, Walker BD. 2001. Review Article: Hepatitis C Virus Infection. N. Engl J. Med. 1:41-50.
Lisboa MP, Bonatto D, Bizani D, Henriques JAP, Brandelli A. 2006. Characterization of a Bacteriocin-like Substance Produced by Bacillus amyloliquefaciens Isolated from the Brazilian Atlantic Forest. Int Microbiol 9:111-118.
Liu G, Yanni Lv, Li Pinglan, Zhou K, Zhang J. 2008. Pentocin 31-1, an Anti-Listeria Bacteriocin Prodoced by Lactobacillus pentosus 31-1 Isolated from Xuan-Wei Ham, a Traditional China Fermented Meat Product.Food Control 19: 353-359.

![Gambar 12 Karakterisasi ekstrak kasar plantarisin S34 pada berbagai enzim [0.1 mg/mL]](https://thumb-ap.123doks.com/thumbv2/123dok/4817109.3452954/50.892.151.702.100.1171/gambar-karakterisasi-ekstrak-kasar-plantarisin-s-berbagai-enzim.webp)