KONSEP ANALISIS KUANTITATIF DAN PENGUKURAN
Saskia Sayidati Fauziah 143020291
Asisten: Angkeu Nur Rahmawati
Tujuan Percobaan
Tujuan percobaan konsep analisis kuantitatif dan pengukuran adalah untuk menentukan pH larutan membuat dan membakukan larutan, menentukan konsentrasi dan dapat memilih indikator yang tepat pada larutan untuk titrasi sesuai pH indikator dari larutan tersebut.
Prinsip Percobaan
Prinsip percobaan analisis kuantitatif dan pengukuran adalah berdasarkan metode asidimetri dan alkalimetri, dimana pereaksi standar bereaksi dengan larutan yang diuji dengan dibantu oleh indikator sebagai petunjuk TAT (Titik Akhir Titrasi) sehingga bereaksi secara kuantitatif. Berdasarkan teori arrhenius(1884), bahwa apabila suatu elektron melarut sebagian dari elektrolit ini terurai menjadi partikel positif dan partikel negatif yang disebut ion.
Metode Percobaan 1. Pengukuran pH
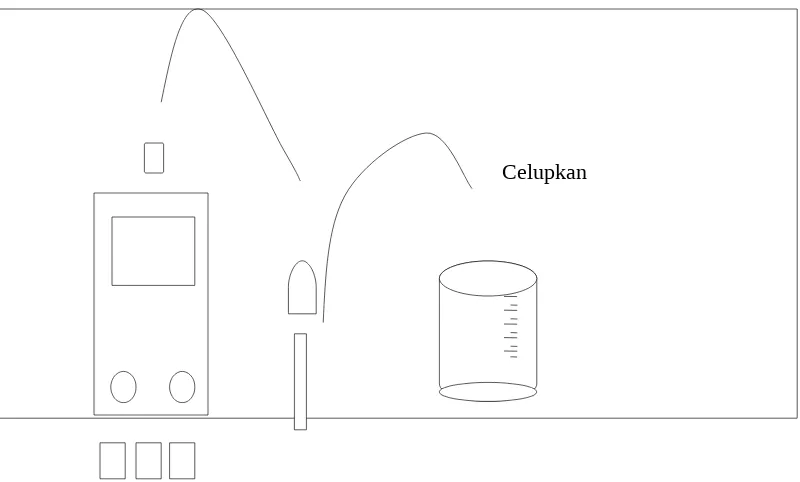
a. pH meter
Tekan tombol ON
Geser tombol kearah SET/RED kea rah SET, tekan tombol pH dan putar pengatur AET sampai jarum menunjukkan kira-kira titik nol dari elektroda (bukan angka nol skala)
Hubungkan elektroda dengan meter dan celupkan elektroda kedalam buffer tertentu
Geser tombol SET/RED kea rah RED dan putar pengatur SET sehingga jarum menunjukkan pH fari larutan buffer.
Alat ini sudah dapat dipergunakan. Jangan merubah pengatur SET selama pengukuran. Hati-hati dengan elektroda.
Gambar 2. Metode Percobaan Pengukuran pH dengan pH Meter.
b. Indikator Universal
Sampel yang akan diukur pHnya disiapkan didalam gelas kimia, celupkan pH universal dalam larutan. Cocokkan warna pada pH
Celupkan
universal pada warna tingkatan pH sebenarnya yang berada dalam wadah.
Gambar 3. Metode Percobaan Pengukuran pH dengan Indikator Universal.
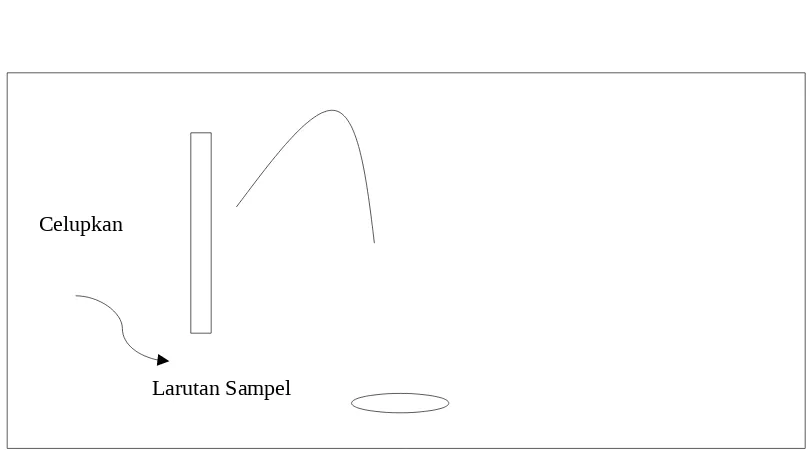
c. Kertas Lakmus
Sampel yang akan didentifikasi disiapkan didalam gelas kimia, celupkan lakmus merah dan biru secara berturut-turut. Perubahan warna pada kertas lakmus diamati.
Celupkan
Larutan Sampel
Gambar 4. Metode Percobaan Pengukuran pH dengan Kertas Lakmus
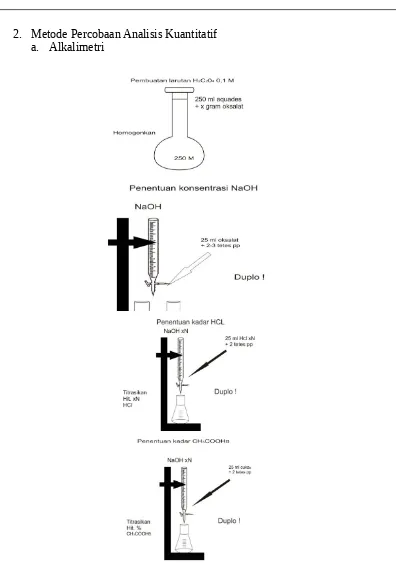
Gambar 5 Metode Percobaan Analisis Kuantitatif Alkalimetri
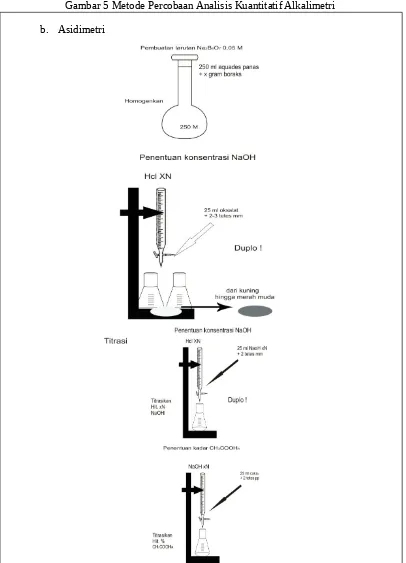
Gambar 6. Metode Percobaan Analisis Kuantitatif Asidimetri
Hasil Pengamatan Analisis Kuantitatif
Tabel 1. Hasil Pengamatan Analisis Kuantitatif Asidimetri
Percobaan Hasil
(sumber: Saskia S, Rizki Siti, Meja 2, Kelompok K, 2014)
Pembahasan Analisis Kuantitatif
Berdasarkan hasil pengamatan dapat diketahui volume NaOH 21,7ml, N NaOH 0,1152M, volume H2C2O4 25ml, N H2C2O4 0,1M, volume HCl 25ml, N HCl,
102,096M, volume cuka 10,4ml dan % cuka 2,8753%.
Dasar dari percobaan ini adalah metode Asidimetri dan Alkalimetri, dimana pereaksi standar bereaksi dengan larutan yang diuji dengan dibantu oleh indikator sebagai petunjuk TAT (Titik Akhir Titrasi) sehingga bereaksi secara kuantitatif. Berdasarkan teori arrhenius(1884), bahwa apabila suatu elektron melarut sebagian dari elektrolit ini terurai menjadi partikel positif dan partikel negatif yang disebut ion. Faktor kesalahan dalam percobaan ini adalah kurang telitinya praktikan saat praktikum dilakukan seperti pada saat dititrasikannya suatu larutan, pada saat larutan mengalami perubahan warna. Kemudian, saat memasukan larutan kedalam gelaskimia, labu Erlenmeyer, buret, pastikan alat yang akan digunakan steril. Sebaiknya, sebelum menggunakan peralatan tersebut bilas terlebih dahulu menggunakan aquades
asam sedangkan alkalimetri mencari konsentrasi basa, selain itu larutan standar yang digunakan berbeda alkalimetri menggunakan larutan baku asam sedangkan asidimetri menggunakan larutan baku basa (Daintith, 1997).
TAT (Titik Akhir Titrasi) adalah keadaan dimana reaksi telah berjalan dengan sempurna yang biasanya ditandai dengan pengamatan visual melalui perubahan warna indikator. Sedangkan TET (Titik Ekuivalen Titrasi) adalah titik dimana titrant dan analit tepat bereaksi atau jumlah volume larutan titrant dengan mol tertentu telah sama dengan mol analit.
Perbedaan dari TAT dan TET, jika suatu larutan dikatakan TAT apabila larutan itu telah mengalami perubahan warna dan warnanya tidak kembali kepada semula, sedangkan suatu larutan dikatakann TET apabila larutan itu mengalami perubahan warna tetapi warnanya kembali ke semula dan dikatakan TET jika molnya telah konsentrasi dari larutan lain. Ada dua macam larutan baku, yaitu:
1. Larutan Baku Primer: Zat yang dipakai langsung umtuk menentukan kadar atau konsentrasi dari larutan lain.
2. Larutan Baku Sekunder: Zat yang dipakai untuk menentukan konsentrasi dari larutan lain tapi harus distandarisasikan ke larutan baku primer.
Syarat larutan baku yaitu; Stabil(tidak mudah berubah), mudah ditimbang, dan mudah didapat dalam bentuk yang murni(Sutrisno, 2014).
Aplikasi di Bidang Pangan
Aplikasi di bidang pangan analisis kuantitatif adalah dapat menentukan persen boraks yang ada dalam bakso atau dalam bahan pangan yang biasa digunakan dalam kehidupan sehari-hari, menentukan persen cuka yang digunakan untuk kebutuhan rumah tangga, membuat garam dapur (NaCl) dari pencampuran antara NaOH dan HCl, mengetahui zat-zat yang dapat dijadikan bahan aditif makanan, membuat soda kue (Natrium Bikarbonat) untuk pengembang kue, pembuatan yogurt dan pembuatan nata de coco.
Hasil Pengamatan Pengukuran pH
Tabel 2. Hasil Pengamatan Pengukuran pH N
o Larutan pH Meter Indikator Universal Lakmus
1. A Basa (8,06) Basa (8) merah→biru
biru→biru
2. B Asam (3,92) Asam (4) merah→mera
h
biru→merah
h
biru→biru (sumber: Saskia Sayidati, Rizki Siti, Meja 2, Kelompok K, 2014)
Pembahasan
Pengukuran pH suatu larutan, asam atau basa dapat diukur dengan menggunakan kertas lakmus, indikator universal ataupun pH meter. Pengukuran pH yang lebih akurat dilakukan dengan mengguakan pH meter.
Adapun beberapa faktor yang menjadi faktor kesalahan saat pengukuran pH seperti kurang telitinya praktikan, kurang sterilnya elektroda pada ph meter, pastikan elektroda steril dan sebelum digunakan bilas terlebih dahulu menggunakan aquadest.
Berdasarkan hasil pengamatan dapat diketahui bahwa larutan A adalah larutan basa, karena pada pH meter menunjukkan angka 8.06, pada Indikator Universal menunjukkan angka 8, dan pada lakmus merah menjadi biru sedangkan lakmus biru tetap biru. Larutan B adalah larutan asam karena pH meter menunjukkan 3.92, pada indikator universal menunjukkan angka 4, dan pada lakmus merah tetap merah sedangkan lakmus biru menjadi merah. Larutan C adalah larutan netral karena pH meter menunjukkan angka 7.00, indikator universal menunjukkan angka 7, dan lakmus merah tetap merah lakmus biru tetap biru.
Kelebihan kertas lakmus adalah kita dapat mengetahui larutan asam atau basa dengan cepat dan mudah sedangkan kelemahan dari kertas lakmus adalah kurang praktis dan tidak dapat menunjukkan nilai pH larutan secara teliti. Kelebihan indikator universal adalah mampu mengukur pH suatu larutan, sedangkan kekurangannya adalah kurang teliti dalam menunjukkan nilai pH. Kelebihan pH meter adalah penggunaannya sangat praktis dan nilai pH dari larutan sangat teliti, keurangannya adalah pada saat pengukuran memerlukan waktu yang cukup lama.
Deionized water adalah air murni yang didapat dengan cara mengambil ion
Aplikasi dalam bidang pangan pengukuran pH ini adalah untuk dapat menentukan kadar apa saja yang ada dalam suatu makanan dengan memasukkan kertas lakmus kedalam makanan dan akan diketahui asam basanya dengan perubahan warna, mengetahui zat-zat yang dapat dijadikan bahan aditif makanan.
Kesimpulan
Berdasarkan hasil pengamatan dapat disimpulkan bahwa Alkalimetri adalah metode pengukuran konsentrasi dalam susasana asam dengan larutan baku basa. Dapat diketahui V NaOH 21,7ml, N NaOH 0,1152M, V H2C2O4 25ml, N H2C2O4 V
Untuk pengukuran pH dapat disimpulkan bahwa larutan A adalah basa, karena pada pH meter menunjukkan angka 8.06, pada Indikator Universal menunjukkan angka 8, dan pada lakmus merah menjadi biru sedangkan lakmus biru tetap biru. Larutan B adalah larutan asam karena pH meter menunjukkan 3.92, pada indikator universal menunjukkan angka 4, dan pada lakmus merah tetap merah sedangkan lakmus biru menjadi merah. Larutan C adalah larutan netral karena pH meter menunjukkan angka 7.00, indikator universal menunjukkan angka 7, dan lakmus merah tetap merah lakmus biru tetap biru.
DAFTAR PUSTAKA
Sutrisno,T.E dkk. 2014. Penuntun Praktikum Kimia Dasar. Universitas Pasundan: Bandung.
Chang, Raymond. 2003. Kimia Dasar Konsep-Konsep Inti. Jilid 1. Erlangga: Jakarta Daintith, J.1997, Kamus Lengkap Kimia. Erlangga: Jakarta.