Berk. Penel. Hayati: 13 (1–5), 2007
KEANEKARAGAMAN JENIS BENALU PARASIT PADA TANAMAN
KOLEKSI DI KEBUN RAYA EKA KARYA, BALI
Tahan Uji, Sunaryo, dan Erlin Rachman Bidang Botani, Puslit Biologi – LIPI, Jalan Raya Bogor-Jakarta Km 46 Cibinong, Bogor
ABSTRACT
Benalu is one of the parasitic plants which have ataccked many collection plants species in Eka Karya Botanical Garden, Bali. Exploration and collection of these parasitic plants in this area are conducted. Four parasitic plants species, i.e. Dendrophthoe pentandra, Helixanthera cylindrica, Scurrula atropurpurea, and S. parasitica are recorded and they attack 32 collection plants species in Eka Karya Botanical Garden. Dendrophthoe pentandra is reported as the highest population species to parasiting collection plants species. While the Myrtaceae family and Syzygium genera are also reported as the highest parasited species.
Key words: diversity- parasitic plants species – Loranthaceae- Eka Karya Botanical Garden- Bali
PENGANTAR
Benalu merupakan salah satu kelompok tumbuhan parasit yang termasuk dalam suku Loranthaceae. Tumbuhan parasit ini umumnya menyerang pepohonan atau pun tumbuhan perdu terutama pada bagian ranting dan cabang-cabangnya. Pohon atau pun perdu yang diserang benalu akan terganggu bahkan dapat mati apabila serangan tersebut dalam jumlah besar (Sunaryo et al., 2006). Kelompok tumbuhan parasit ini selain menyerang tumbuhan liar juga tanaman budidaya (Pitoyo, 1996).
Di kawasan Malesia suku Loranthaceae terdiri atas 23 marga dan 193 jenis (Barlow, 1997) sedangkan di Jawa dilaporkan hanya dapat ditemukan 38 jenis benalu dari 14 marga (Backer dan Bakhuizen van den Brink, 1965). Berdasarkan pengamatan terhadap spesimen herbarium yang disimpan di Herbarium Bogoriense telah ditemukan 8 jenis tumbuhan benalu di Pulau Bali. Kedelapan jenis benalu tersebut adalah Amyema cuernosensis (Elmer) Barlow, A. longipes (Danser) Barlow, A. tristis (Zoll.) Tiegh., Dendrophthoe lanosa (Korth.) Danser, D. pentandra (L.) Miq., Helixanthera setigera (Korth.) Danser, Scurrula atropurpurea (Blume) Danser, dan S. parasitica L. Namun Barlow (1997) melaporkan bahwa keberadaan Helixanthera setigera (Korth.) Danser di Pulau Bali masih diragukan.
Kebun Raya Eka Karya di Bali merupakan salah satu kawasan konservasi ex-situ dan merupakan Kebun Raya pertama yang dibangun oleh rakyat Indonesia pada tanggal 15 Juli 1959. Kebun Raya ini dirancang untuk penanaman hasil koleksi tumbuhan yang berasal dari kawasan Indonesia bagian Timur dan beriklim pegunungan kering. Lokasi Kebun Raya Eka Karya terletak pada ketinggian 1200–1450 m dpl di daerah Candi Kuning di lereng bagian
Timur Bukit Tapak atau sekitar 50 km sebelah Utara Kota Denpasar, Provinsi Bali. Jumlah tanaman koleksinya mencapai 1420 jenis yang terdiri atas 160 suku dan 677 marga (Siregar et al., 2004).
Usaha menjaga kelestarian tanaman koleksi di Kebun Raya dilakukan dengan cara melakukan perawatan tanaman, antara lain melakukan kontrol dari serangan tumbuhan benalu. Namun sampai saat ini belum pernah dilakukan identifikasi jenis-jenis benalu parasit pada tanaman koleksi di Kebun Raya Eka Karya.
Penelitian ini merupakan penelitian lanjutan yang telah dilakukan pada tahun 2005 di Kebun Raya Purwodadi, Jawa Timur (Uji et al., 2006). Tujuan penelitian adalah untuk menyediakan data dan informasi tentang keanekaragaman jenis tumbuhan benalu parasit yang menyerang tanaman koleksi di Kebun Raya Eka Karya serta untuk panduan pengenalan jenis-jenis benalu di lapangan. Di samping itu, hasil penelitian ini juga diharapkan dapat membantu usaha pemberantasan benalu parasit di Kebun Raya Eka Karya di Bali.
BAHAN DAN CARA KERJA
Keanekaragaman Jenis Benalu Parasit
selesai dilakukan. Khusus untuk spesimen tumbuhan benalu identifikasinya juga dibantu dengan menggunakan acuan pustaka yang ada (Danser, 1930; Backer dan Bakhuizen van den Brink, 1965; Barlow, 1997).
HASIL
Pada penelitian terhadap tumbuhan benalu parasit di Kebun Raya Eka Karya telah ditemukan 4 jenis benalu (suku Loranthaceae) yang memarasiti 32 jenis tanaman inang (tanaman koleksi) dari 16 suku (Tabel 1). Keempat jenis benalu tersebut adalah Dendrophthoe pentandra
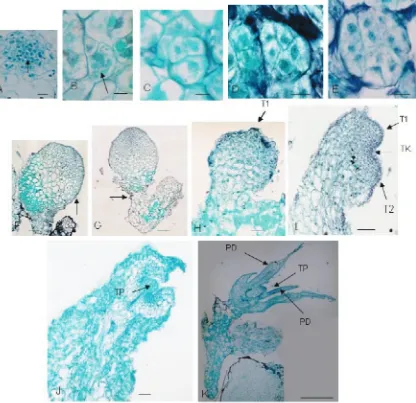
(L.) Miq., Helixanthera cylindrica (Jack) Dans., Scurrula atropurpurea (Blume) Dans., Scurrula parasitica L. (Gambar 1–4).
Gambar 1. Dendropthoe pentandra (L.) Miq. (1) Ranting danRanting dan Perbungaan; (2)a. buah, b. bunga, dan c. daun.
Gambar 2. Helixanthera cylindrica (Jack) Danser. (1) Ranting(1) Ranting dan buah; (2) Bunga.
Gambar 3. Scurrula parasitica L. (1) Ranting dan Perbungaan;Ranting dan Perbungaan; (2)a. Buah dan b. Bunga.
(1)
(2)
(1)
(2) (1)
Uji, Sunaryo, dan Rachman
Tabel 1. Daftar suku dan jenis tanaman inang/koleksi di Kebun Raya Eka Karya yang diparasiti benalu dan jenis serta jumlah benalu parasitnya.
No. Nama suku dan jenis tanaman inang Nama jenis benalu Jumlah benalu
1.
Rhododendron mucronatum (Blume) G.Don. EUPHORBIACEAE
Flacourtia rukam Zoll. & Mor. LAURACEAE
Cinnamomum burmanii Nees. Ex Blume Lindera polyantha (Blume) Boerl. Persea americana Miller
Toona sureni (Blume) Merr. MORACEAE
Ficus glaberrima Blume MYRICACEAE
Myrica rubra Sieb. & Zucc. MYRTACEAE
Decaspermum fruticosum J.R.& G. Forst. Leptospermum flavescens Sm.
Syzygium acuminatissima (Blume) Merr. & Perry S. microcarpum (K.&V.) Amsh.
S. polyanthum (Wight.) Walp. S. polysepalum (Miq.) Merr. & Perry S. polycephaloides (C.B.Robinson) Merr. S. racemosum (Blume) DC.
S. zippelianum Miq.
S. zollingerianum (Miq.) Amsh. PITTOSPORACEAE
Pittosporum ferrugineum Ait. P. moluccanum (Lam.) Miq. P. tobira (Thunb.) Aiton RUTACEAE
Acronychia trifoliata Zoll. & Mor. SAURAUIACEAE
Saurauia reindwardtiana Blume THEACEAE
Camellia sinensis (L.) Kuntze
II
Keanekaragaman Jenis Benalu Parasit
PEMBAHASAN
Empat jenis benalu yang ditemukan di Kebun Raya Eka Karya adalah Dendropthoe pentandra (L.) Miq.,
Helixanthera cylindrica (Jack) Danser, Scurrula parasitica
L., dan Scurrula atropurpurea (Blume) Danser.
Deskripsi Suku Loranthaceae
Suku Loranthaceae merupakan hemiparasit, melekat pada tumbuhan inang dengan haustoria yang banyak atau merupakan kompleks haustoria primer tunggal. Daun kebanyakan berhadapan dan kadang-kadang berseling, tunggal. Perbungaan pada umumnya aksiler jarang sekali terminal, dikasium atau bunga tunggal, biasanya mengelompok membentuk tandan atau payung. Bunga diklamid, biseksual. Kelopak bunga merupakan bibir menyelaput di ujung bakal buah. Mahkota bunga koripetalus atau gamopetalus, 4–6 merus, mengatup. Benangsari sama banyaknya dengan daun mahkota dan terletak saling berhadapan, epipetalus. Bakal buah tenggelam, tangkai putik dan kepala putik tunggal. Buah menyerupai beri. Berbiji satu dan dikelilingi oleh lapisan lekat di luar berkas pengangkutan.
Kunci Identifikasi Jenis Benalu
Untuk membantu dan mempermudah dalam pengenalan jenis-jenis benalu di Kebun Raya Eka Karya, berikut adalah kunci identifikasi jenis benalu.
1. a. Daun-daun mahkota bunga saling bergabung satu dengan lainnya (gamopetalus)...2
b. Daun-daun mahkota bunga bebas satu dengan lainnya (choripetalus)...Helixanthera cylindrica
2. a. Mahkota bunga terdiri atas 5 daun mahkota. Buah bulat telur atau jorong...Dendrophthoe pentandra
b. Mahkota bunga terdiri atas 4 daun mahkota. Buah menyerupai gada ...3
3. a. Tumbuhan ditutupi oleh rambut-rambut yang berwarna coklat kemerahan gelap, panjang helaian daun 3–7 cm, panjang mahkota bunga 8–16 mm... ...Scurrula parasitica
b. Tumbuhan ditutupi oleh rambut-rambut yang berwarna krem, panjang helaian daun 5–10 cm, panjang mahkota bunga 13–20 mm ...
Scurrula atropurpurea
Deskripsi Jenis-jenis Benalu
1. Dendrophthoe pentandra (L.) Miq.
Perdu, hemiparasit, agak tegar, bercabang banyak, tinggi 0,5–1,5 m. Daun agak berhadapan, bentuk bervariasi dari jorong lanset–agak bundar, panjang 6–13 cm dan lebar 3–8 cm, pangkal menirus–membaji, ujung tumpul – agak runcing, pertulangan menyirip dengan tulang lateral kadang-kadang melengkung, panjang tangkai daun 5–20 mm. Perbungaan tandan dengan 6–12 bunga, panjang sumbu perbungaan 10–35 mm. Bunga dengan 1 braktea di pangkal, biseksual, diklamid; kelopak mereduksi; mahkota bunga 5 merus, di bagian bawah saling berpautan, agak menggelendut, panjang 13–26 mm, menyempit membentuk leher, bagian ujung menggada, mula-mula hijau kemudian menjadi hijau kekuningan sampai kuning orange atau merah orange, panjang tabung 6–12 mm dan menggenta; benang sari 5, kepala sari panjang 2–5 mm dan tumpul serta melekat pada bagian pangkal (basifik); putik dengan kepala putik membintul. Buah bulat telur, panjang 10 mm dan lebar 6 mm. Berbiji satu, biji ditutupi oleh lapisan lengket.
Penyebaran: India sampai Indo Cina; Semenanjung Malaya, Sumatra, Jawa, Kalimantan, Bali, Nusa Tenggara, dan Filipina. Habitat: Umumnya di hutan hujan atau di hutan-hutan yang terbuka dan di perkebunan-p e r ke bu n a n d a t a r a n r e n d a h s a m perkebunan-p a i ke t i n g g i a n
Gambar 4. Scurrula atropurpurea (Blume) Danser. (1) Ranting(1) RantingRanting dan perbungaan; (2)a. Bunga dan b. buah.
(1)
Uji, Sunaryo, dan Rachman
500 m dpl. Nilai guna: Bubur daun untuk mengobati luka pedih, bernanah, dan infeksi pada kulit. Air rebusan semua bagian tumbuhan bila diminum dapat mengobati hipertensi dan apabila dicampur minuman teh untuk obat batuk (Valkenburg, 2003).
2. Helixanthera cylindrica (Jack) Danser
Perdu, hemiparasit, gundul kecuali pada bagian-bagian yang masih muda. Daun agak berhadapan atau agak terpusar; helaian daun jorong atau bundar telur, panjang 6–20 cm dan lebar 1,5–6 cm, pangkal menirus atau membaji, panjang tangkai daun 8–15 mm, ujung daun menirus dan runcing, permukaan atas agak mengkilap dan permukaan bawah suram; pertulangan menyirip dengan tulang tengah nyata pada kedua sisi. Perbungaan mucul pada ruas-ruas dan jarang di terminal, malai dengan beberapa bunga sampai 25 bunga. Braktea tunggal, tumpul, bakal buah silindris; bibir kelopak menyebar, panjang 1–1,5 mm. Mahkota 5 merus, secara perlahan-lahan menyempit ke atas, ujung runcing, merah orange–merah terang, kadang-kadang kuning kehijauan. Kepala sari panjang 5–8 mm, tangkai putik panjangnya 15–32 mm; kepala putik mementol, agak lebih lebar daripada tangkai putik.
Penyebaran: Myanmar sampai Vietnam; Malesia (Sumatera, Semenanjung Malaysia, Jawa, Kalimantan, Sulawesi, dan Bali. Habitat: Hutan-hutan basah dan terbuka, sering kali pada tanaman budidaya pada ketinggian 0–2000 m dpl. Nilai guna: Belum diketahui.
3. Scurrula atropurpurea (Blume) Danser
Perdu, ramping atau cukup tegar, bagian yang muda ditutupi rambut-rambut yang padat dan berwarna krem atau abu-abu tetapi menjadi jarang setelah dewasa. Daun berhadapan, lonjong–bundar telur terbalik, panjang 5–10 cm dan lebar 2,5–5 cm, pangkal daun runcing dan ujung tumpul, pertulangan tidak nyata kecuali pada tulang tengah dan beberapa tulang lateral atas, panjang tangkai daun 6–12 mm. Perbungaan aksiler, tandan dengan 2–8 bunga, panjang sumbu perbungaan 5–12 mm. Bunga biseksual, diklamid, panjang pedisel 2–3 mm; braktea berbentuk delta; mahkota bunga ramping, 4 merus, ujung menggada dan runcing, panjang tabung 7–15 mm; kepala sari melekat pangkal (basifik), panjang 1 mm; kepala putik membintul. Buah bulat telur terbalik atau menggada, bergaris tengah 2–3 mm. Berbiji 1 dan ditutupi oleh lapisan lengket.
Penyebaran: Thailand sampai Vietnam, Jawa, Bali, Nusa Tenggara, Maluku, dan Filipina. Habitat: Tumbuh pada ketinggian 0 – 600 m dpl, dan kadang-kadang sampai
2300 m. Nilai guna: Seluruh bagian tumbuhan digunakan untuk mengobati kanker khususnya kanker dada dan kerongkongan (Valkenburg, 2003).
4. Scurrula parasitica L.
Perdu, hemiparasit, ramping atau cukup tegar, bagian-bagian yang muda ditutupi rambut-rambut yang padat dan berwarna coklat gelap serta menjadi jarang setelah dewasa. Daun berhadapan, helaian daun bundar telur menyempit– bundar telur terbalik, panjang 3–9 cm dan lebar 1,5–4,5 cm, tipis, pangkal membaji–menirus, panjang tangkai daun 3–10 mm, ujung tumpul, pertulangan pada kedua permukaan tersembunyi kecuali pada tulang tengah dan beberapa tulang lateral. Perbungaan muncul pada ruas-ruas batang, tandan dengan 2–6 bunga, panjang aksis 1–6 mm, panjang pedisel 1–5 mm; braktea menyempit, tegak, panjang 1–3 mm. Mahkota bunga 4 merus, panjang 8–16 mm, ramping dan pada bagian ujungnya runcing, membentuk tabung dengan panjang 6 –2 mm, terbelah sampai pada pertengahan atau bagian lebih bawah. Panjang kepala sari 0,7–1,5 mm, kira-kira 2/3 panjang dari bagian yang bebas dari tangkai sari. Buah dengan panjang 8–10 mm (termasuk tangkainya), ujung tumpul.
Penyebaran: India ke Timur sampai China dan Vietnam; Malesia bagian Barat meluas ke Timur sampai Filipina, Maluku, Timor, dan Bali. Habitat: Umumnya di hutan primer dan daerah-daerah yang telah terganggu. Nilai guna: Tumbuhan dapat dimanfaatkan sebagai tonik dan diberikan untuk wanita hamil serta untuk menjaga uterus. Selain itu juga memberikan kekuatan pada tulang, mengurangi sakit pinggang dan lutut, serta mengurangi tekanan darah tinggi (Valkenburg, 2003).
Tanaman Koleksi/Inang yang Diparasiti Benalu
Pada Tabel 1 dapat dilaporkan bahwa jenis-jenis tanaman koleksi di Kebun Raya Eka Karya yang paling banyak diparasiti benalu adalah dari suku Myrtaceae, yaitu berjumlah 10 jenis dan 8 jenis di antaranya dari marga
Syzygium. Kondisi ini berbeda dengan di Kebun Raya Purwodadi, dilaporkan bahwa di Kebun Raya Purwodadi jenis tanaman inang (tanaman koleksi) yang paling banyak diparasiti benalu adalah dari suku Moraceae khususnya pada marga Ficus (Uji et al., 2006). Jenis-jenis tanaman koleksi lainnya yang juga banyak diparasiti benalu antara lain: Suku Euphorbiaceae (diparasiti 4 jenis benalu), Lauraceae dan Pittosporaceae (masing-masing 3 jenis benalu).
Keanekaragaman Jenis Benalu Parasit
Raya Eka Karya. Dari 31 jenis tanaman koleksi, 27 jenis di antaranya telah diparasiti oleh D. pentandra. Kemudian disusul Helixanthera cylindrica yang memarasiti 6 jenis tanaman inang. Jenis benalu lainnya yaitu Scurrula atropurpurea dan S. parasitica, masing-masing hanya memarasiti 2 jenis tanaman inang. Serangan benalu D. pentandra juga dilaporkan merupakan parasit terbanyak pada tanaman koleksi di Kebun Raya Purwodadi. Tercatat ada 52 dari 61 jenis tanaman koleksi di Kebun Raya Purwodadi yang diserang benalu (Uji et al., 2006). Hal ini menunjukkan bahwa D. pentandra merupakan salah satu jenis benalu parasit yang menunjukkan agresivitas pemarasitan paling tinggi (Sunaryo et al., 2006).
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Kepala Puslit Biologi dan Kabid Botani serta Koordinator Sub Kegiatan Penelitian tentang “Valuasi kerusakan ekosistem mikro oleh tumbuhan parasit dan upaya pengendaliannya” yang telah menugaskan penulis untuk melakukan penelitian ini. Penulis juga mengucapkan terima kasih kepada Kepala Kebun Raya Eka Karya di Bali beserta staf yang telah membantu penelitian ini hingga selesai.
KEPUSTAKAAN
Backer CA, dan Bakhuizen van den Brink RC, 1965. Flora of Java vol. 2. Noordhoff, Groningen, The Netherlands, 67–76.
Balgooy van MMJ, 1987. Collecting. In: Vogel (ed.). Mannual of Herbarium Taxonomy. Theory and Practice. Unesco. Barlow BA, 1997. Loranthaceae. In: C. Kalkman, D.W. Kirkup,
H.P. Nootebom, P.F. Stevens, W.J.J.O. de Wilde (eds.) Flora Malesiana. Series I, vol. 13. Rijksherbarium/Hortus Botanicus, The Netherlands, 209–401.
Danser BH, 1930. The Loranthaceae of Nederlands Indies. Bulletin de Jardin Botanique. III.(XI): 233–519.
Pitoyo S, 1996. Benalu hortikultura: Pengendalian dan pemanfaatan. Trubus Agriwidya, Ungaran.
Rugayah, Widjaja EA, dan Praptiwi, 2004. Pedoman pengumpulan data keanekaragaman flora. Pusat Penelitian Biologi – LIPI, Bogor.
Siregar M, Lugrayasa IN, Arinase IBK, dan Mudiana P (eds.), 2004. An alphabetical list of plant collection in Eka Karya Botanic Garden, Bali. Published by Eka Karya Botanic Garden, Bali–Indonesia. 202 halaman.
Sunaryo, Rachman E, dan Uji T, 2006. Kerusakan morfologi tumbuhan koleksi Kebun Raya Purwodadi oleh benalu (Loranthaceae dan Viscaceae). Berita Biologi 8(2): 129– 139.
Uji T, Sunaryo, dan Rachman E, 2006. Keanekaragaman jenis benalu parasit pada tanaman koleksi di Kebun Raya Purwodadi, Jawa Timur. Jurnal Teknologi Lingkungan. Edisi khusus “Hari Lingkungan Hidup, 2006: 223–231. Valkenburg van JLCH, 2003. Dendrophthoe, Scurrula,In: R.H.M.J.
Lemmens and N. Bunyapraphatsara (eds.). Medicinal and poisonous plants 3. PROSEA. Backhuys Publisher, Leiden. 157–158; 370–372.
Berk. Penel. Hayati: 13 (7–13), 2007
KARAKTERISASI HIDROLISAT PROTEIN KEDELAI HASIL HIDROLISIS
PROTEIN KEDELAI HASIL HIDROLISIS
MENGGUNAKAN PROTEASE DARI TANAMAN BIDURI (
Calotropis
gigantea
)
Yuli Witono*, Aulanni’am**, Achmad Subagio*, dan Simon Bambang Widjanarko*** * Fakultas Teknologi Pertanian Universitas Jember
**Fakultas MIPA Universitas Brawijaya Malang *** Fakultas Teknologi Pertanian Universitas Brawijaya Malang
Alamat Koresponden: FTP-UNEJ: Jl. Kalimantan I-Kampus Tegal Boto, Jember 68121, HP: 081336700946; email: ylwitono@yahoo.com
ABSTRACT
Properties of soy protein hydrolysate produced by protease from biduri plant were studied. The soy protein hydrolysate had different properties due to various concentrations and hydrolysis times of protease from biduri. Enzymatic hydrolysis of the soy protein decreased significantly in the TBA value. This process increased the soluble protein content and promoted the Maillard reaction, resulting in a more brown color. Moreover, the soy protein hydrolysate had a higher value of ‘umami’ taste by organoleptic evaluation.
Key words: biduri protease, hydrolysate, Maillard, organoleptic, soy protein
PENGANTAR
Kedelai merupakan komoditi yang sangat penting karena mengandung protein dan lemak yang tinggi (Liang, 1999), sebagai sumber nutrisi bagi manusia, kedelai mengandung sejumlah asam amino esensial (Marsman et al., 1997). Kedelai mempunyai banyak manfaat, di antaranya dapat diolah menjadi bahan makanan alternatif dan minuman (Kinney, 2003) serta hidrolisat protein (Hrckova et al., 2002).
Hidrolisat protein kedelai berpotensi sebagai bumbu penyedap masakan pengganti MSG (Monosodium Glutamate). Meskipun diperkenankan sebagai penyedap masakan, penggunaan MSG yang berlebihan bisa mengakibatkan rasa pusing dan sedikit mual. Gejala itu disebut Chinese Restaurant Syndrome (Indriasari, 2006; Syarifah, 2006). Penggunaan MSG pada makanan yang dikonsumsi sering mengganggu kesehatan karena MSG ketika dimakan akan terurai menjadi sodium dan glutamat sehingga MSG merupakan sumber natrium yang tinggi. Garam yang disuplai melalui MSG mampu memenuhi kebutuhan akan garam sebanyak 20–30%, sehingga konsumsi MSG yang berlebihan menyebabkan kenaikan kadar garam dalam darah. Hasil studi Prescott and Young (2002) menunjukkan bahwa 65% dari sampel responden mengklaim terjadi reaksi alergi pada beberapa orang akibat mengonsumsi makanan (sop) yang telah ditambahkan MSG. Kenyataan menunjukkan bahwa masyarakat dalam mengonsumsi MSG sebagai penyedap berbagai masakan sering melebihi dosis konsumsi yang aman bagi kesehatan.
Berdasarkan hal tersebut, maka pengembangan sumber cita rasa alami sangat perlu dilakukan. Diharapkan cita rasa alternatif tersebut tidak hanya berfungsi dalam menciptakan rasa gurih (umami) pada makanan, tetapi juga memberikan peran nutrisi dan aman bagi kesehatan.
Melalui teknik hidrolisis, protein dari suatu bahan dapat diubah menjadi senyawa asam amino L, nukleotida, dan berbagai ragam peptida. Bahan-bahan tersebut dipakai untuk menimbulkan umami pada makanan yang sering disebut flavor enhancer. Proses hidrolisis dapat dilakukan secara kimiawi maupun enzimatis. Proses hidrolisis kimiawi, yaitu dengan penambahan asam klorida dapat memperpendek waktu, mempermudah dan mengurangi biaya pembuatan. Namun demikian dengan teknik ini, flavor
yang dihasilkan kurang baik dan keamanan bagi kesehatan kurang terjamin (Anonim, 2000). Teknik hidrolisis secara kimiawi akhir-akhir ini mulai dihindari oleh kebanyakan industri food ingredient di Indonesia. Hidrolisis secara enzimatis merupakan pilihan metode paling aman dalam produksi flavor.
Hidrolisis secara enzimatis lebih menguntungkan dibanding secara kimiawi, karena dapat menghasilkan asam-asam amino bebas dan peptida dengan rantai pendek yang bervariasi. Hal ini akan lebih menguntungkan karena memungkinkan untuk memproduksi hidrolisat dengan
Karakterisasi Hidrolisat Protein Kedelai Hasil Hidrolisis
protein mempunyai range aplikasi yang sangat luas terkait dengan sifat fungsional atau sifat nutrisinya.
Mengingat enzim protease untuk industri pangan selama ini kebanyakan masih impor dan harganya relatif mahal. Untuk itu perlu dikembangkan pemanfaatan enzim protease yang bersumber dari bahan alam lokal di Indonesia, salah satunya adalah protease dari tanaman biduri (Calotropis gigantea). Hasil penelitian sebelumnya menunjukkan bahwa ekstrak dari tanaman biduri baik getah, batang, maupun daun sangat potensial sebagai sumber enzim protease (Witono, 2002a; 2002b). Hasil karakterisasi enzim protease dari tumbuhan biduri, berdasarkan spesifitasnya mengindikasikan termasuk dalam golongan eksopeptidase (Witono dkk., 2004) yang sangat sesuai untuk aplikasi pada pembuatan hidrolisat protein (flavor enhancer). Tujuan dari penelitian ini adalah untuk mempelajari aplikasi protease biduri dalam pembuatan hidrolisat protein kedelai, serta untuk mengetahui karakteristik hidrolisat protein kedelai yang dihasilkan.
BAHAN DAN CARA KERJA
Bahan dan Alat Penelitian
Bahan baku yang digunakan dalam penelitian ini adalah kedelai putih yang dibeli dari Pasar Tanjung Jember. Enzim protease biduri diperoleh dari hasil penelitian sebelumnya (Witono dkk., 2006) yakni crude protease dalam bentuk serbuk kering yang diekstrak dari tumbuhan biduri dengan aktivitas spesifik 0,14 Unit/mg. Bahan kimia yang digunakan berspesifikasi Pro Analysis sebagian besar bermerk Merck (Jerman). Peralatan yang digunakan meliputi: blender (stainless steel), sentrifus (Yenaco model YC-1180), spektronik 21 D (Melton Roy), pH meter (Jen Way type 3320, Jerman), pengaduk magnetik (Stuart Scientific), vortex (Thermolyne type 16700), lemari pendingin, penangas air (GFL 1083), neraca analitik (Ohaus), pemanas listrik (Gerhardt), spatula, oven vakum, vortex (Maxi MaxType
16700), ayakan 80 mesh dan alat-alat gelas.
Cara Kerja
Penelitian dirancang secara acak kelompok faktorial dengan dua faktor, yaitu faktor A dan faktor B. Faktor A (konsentrasi protease biduri) terdiri atas 3 level meliputi: konsentrasi proteasae biduri 0,05% (w/w) (A1); 0,10% (w/w) (A2) dan 0,15% (w/w) (A3). Faktor B (lama hidrolisis) terdiri atas 3 level meliputi: lama hidrolisis 0 jam (B1); 1,5 jam (B2); dan 3 jam (B3). Masing-masing kombinasi perlakuan diulang 3 kali. Data dianalisis secara sidik ragam
(α= 0,05) (Gaspersz, 1991), selanjutnya ditampilkan dalam bentuk histogram dan tabel.
Pelaksanaan Penelitian
Kedelai direndam selama 24 jam, direbus selama 10 menit dengan tujuan untuk mendenaturasi protein kedelai sehingga mudah dihidrolisis, menginaktifkan enzim lipoksigenase, dan merusak tripsin inhibitor. Kemudian campuran ini diblender dengan rasio bahan dan air = 1 : 2 (berat/berat). Suspensi kedelai yang dihasilkan ditambahkan enzim protease biduri dengan konsentrasi 0,05%; 0,1%; dan 0,15% (% berat dari kedelai rebus kupas). Kemudian pH diatur menjadi 7 dan dihidrolisis dalam penangas air suhu 55 ºC dengan waktu sesuai perlakuan (0 jam; 1,5 jam; dan 3 jam), dididihkan selama 10 menit untuk menginaktifkan enzim. Ditambahkan 0,4% CMC; 2% gula; dan 2% garam (% berat dari kedelai rebus kupas) sambil terus diaduk sampai mengental. Setelah mengental dihamparkan dalam loyang dan dikeringkan dalam oven vakum suhu 40 ºC, tekanan 20 mmHg selama 18 jam. Setelah kering diblender dan diayak 80 mesh.
Parameter Pengamatan
Variabel yang diamati meliputi: warna menggunakan
colour reader (Subagio dan Morita, 1997), kadar air (AOAC, 1995), kadar protein terlarut menggunakan metode Lowry (1951 dalam Walker 2002), tingkat ketengikan menggunakan metode TBA dengan modifikasi (Subagio dkk, 2002), produk Maillard (Hofmann et al., 1999), penentuan laju reaksi enzim protease biduri pada substrat kedelai dengan menentukan nilai Km dan Vmax menggunakan metode Lineweaver-Burk (Pelletier dan Sygusch, 1990 dengan modifikasi) dan sifat organoleptik yang meliputi warna, aroma, dan rasa dengan uji kesukaan (Lawless dan Heymann, 1998).
HASIL
Warna (Tingkat Kecerahan)
Konsentrasi protease biduri dan lama hidrolisis berpengaruh (α = 0,05%) terhadap warna hidrolisat protein kedelai yang dihasilkan. Adapun histogram nilai warna hidrolisat protein kedelai pada berbagai variasi konsentrasi protease biduri dan lama hidrolisisnya tertera pada Gambar 1.
Witono, Aulanni'am, Subagio, dan Widjanarko 11
(konsentrasi enzim 0,15% dan lama hidrolisis 0 jam) sebesar 2,56 (tidak suka sampai agak suka).
Nilai kesukaan rasa hidrolisat protein kedelai tertinggi terdapat pada perlakuan A3B2 (konsentrasi enzim 0,15% dan lama hidrolisis 1,5 jam) dengan nilai 3,44 (agak suka sampai suka) sedangkan nilai kesukaan rasa hidrolisat protein kedelai terendah diperoleh pada perlakuan A1B1 (konsentrasi enzim 0,05% dan lama hidrolisis 0 jam) sebesar 2,72 (tidak suka sampai agak suka).
PEMBAHASAN
Warna (Tingkat Kecerahan)
Semakin besar konsentrasi protease biduri menghasilkan hidrolisat protein kedelai yang semakin gelap (kecoklatan). Hal ini terjadi karena pada saat proses hidrolisis terjadi pemutusan ikatan peptida oleh enzim protease menghasilkan gugus amina yang merupakan prekursor reaksi Maillard, di mana pada keadaan ini gugus amina protein bereaksi dengan gugus aldehid atau keton dari gula pereduksi yang menghasilkan warna coklat. Semakin banyak konsentrasi protease biduri yang digunakan, maka produk Maillard yang dihasilkan semakin tinggi, sehingga hidrolisat protein kedelai yang dihasilkan semakin gelap.
Demikian juga, semakin lama hidrolisis, maka hidrolisat protein kedelai yang dihasilkan semakin gelap (kecoklatan). Hal ini karena semakin lama hidrolisis nilai produk Maillard yang dihasilkan semakin banyak sehingga warna hidrolisat semakin gelap. Hasil ini sesuai dengan penelitian Subagio dkk. (2002) bahwa semakin lama inkubasi dengan enzim protease FlavourzymeTM, maka warna hidrolisat protein
tempe kedelai yang dihasilkan semakin gelap.
Kadar Air
Semakin banyak konsentrasi enzim protease biduri yang ditambahkan dan semakin lama waktu hidrolisis, maka semakin banyak ikatan peptida dari protein yang terputus menjadi molekul yang lebih kecil sehingga kemampuan protein untuk mengikat air semakin menurun. Whittaker (1994) menyatakan bahwa hidrolisis protein selain mengurangi berat molekul polipeptida juga menyebabkan kerusakan dari struktur globular protein sehingga keterikatan air menjadi berkurang. Kumagai et al. (2002) melaporkan bahwa selama hidrolisis isolat protein kedelai dengan enzim tripsin juga menunjukkan terjadi penurunan aktivitas air.
Kadar Protein Terlarut
Semakin besar konsentrasi protease biduri dan semakin lama waktu hidrolisis, maka kadar protein terlarut hidrolisat kedelai semakin tinggi. Hal ini karena enzim protease bersifat memecah protein menjadi peptida pendek dan asam-asam amino yang mudah larut. Menurut Nielsen (1997) semakin besar konsentrasi protease akan semakin banyak ikatan peptida dari protein yang terputus menjadi peptida-peptida sederhana sehingga kelarutan protein semakin meningkat. Semakin lama hidrolisis, kontak enzim dengan substrat semakin lama, sehingga tingkat hidrolisis semakin tinggi dan dihasilkan molekul-molekul protein yang pendek sehingga kelarutannya meningkat. Sebagaimana juga dilaporkan oleh Hrckova et al. (2002) bahwa jumlah asam amino bebas dari hidrolisis protein kedelai bebas lemak menggunakan protease selektif juga meningkat seiring dengan lamanya waktu inkubasi.
Tingkat Ketengikan
Semakin besar konsentrasi enzim protease biduri, maka tingkat ketengikan hidrolisat protein kedelai yang dihasilkan semakin menurun. Hal ini terjadi karena enzim protease biduri yang digunakan dalam bentuk crude (kasar). Witono dkk. (2006) melaporkan bahwa enzim protease yang diekstrak secara langsung dari tumbuhan (batang dan daun) biduri masih mengandung klorofil. Menurut Dalimartha (2003) suatu protease kasar juga dapat mengandung saponin, flavonoid, polifenol, tanin, dan kalsium oksalat. Klorofil, flavonoid, dan polifenol merupakan antioksidan, maka semakin banyak konsentrasi enzim yang ditambahkan, semakin banyak kandungan flavonoid dan polifenol pada hidrolisat protein kedelai, sehingga tingkat ketengikannya semakin kecil. Sifat antioksidatif dari crude protease biduri ini merupakan fenomena yang menarik untuk ditelaah lebih lanjut.
Karakterisasi Hidrolisat Protein Kedelai Hasil Hidrolisis
1
Produk Maillard
Semakin banyaknya enzim protease biduri yang digunakan maka semakin banyak produksi asam amino yang bereaksi dengan gula reduksi, dengan demikian produk Maillard yang dihasilkan juga semakin banyak. Reaksi Maillard (browning non enzymatic) merupakan reaksi antara gugus karbonil dan gugus amina primer yang melibatkan reaksi kondensasi (Karel et al., 1993
dalam Miao and Roos, 2004; Miller dan Gerrard, 2005). Dengan demikian semakin banyak konsentrasi enzim, reaksi Maillard yang terjadi semakin intensif.
Semakin lama hidrolisis maka nilai produk Maillard hidrolisat protein kedelai yang dihasilkan juga semakin meningkat. Hal ini terjadi karena semakin lama hidrolisis, semakin banyak ikatan peptida yang terhidrolisis, sehingga semakin banyak pula gugus amina primer yang dihasilkan, dengan demikian reaksi Maillard yang terjadi semakin intensif. Sebagaimana hasil penelitian Subagio dkk (2002) menunjukkan bahwa nilai absorban produk Maillard dari hidrolisat tempe kedelai meningkat seiring dengan semakin lamanya waktu hidrolisis. Dengan semakin tinggi absorbanDengan semakin tinggi absorban berarti produk reaksi Maillard semakin tinggi.
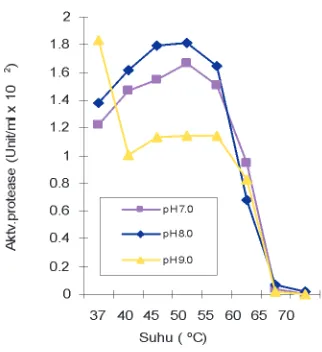
Laju Reaksi Enzim Protease Biduri pada Substrat Kedelai
Hasil penelitian menunjukkan bahwa untuk mendapatkan kecepatan awal sebesar ½ Vmax, maka 1 bagian protease biduri dapat digunakan untuk menghidrolisis 842,1846 bagian substrat kedelai kering. Nilai ini lebih kecil jika dibandingkan dengan hidrolisis pada kasein dengan menggunakan protease biduri (Witono dkk, 2004), yaitu untuk memperoleh kecepatan awal sebesar Vmax/2, maka 1 bagian enzim protease biduri dapat digunakan untuk menghidrolisis sebanyak 1235,795 bagian substrat kasein. Hal ini diduga karena substrat kedelai yang digunakan berupa complex raw material yang masih mengandung komponen-komponen nonprotein yang melindungi (membentuk matriks) dengan protein sehingga menjadi penghalang (penghambat) interaksi antara enzim dengan substrat.
Sifat Organoleptik
Hidrolisis protein akan mengakibatkan terjadinya perubahan cita rasa yang disebabkan oleh terbentuknya peptida-peptida rantai pendek dan asam amino yang berperan dalam pembentukan cita rasa gurih pada hidrolisat protein kedelai yang dihasilkan. Di samping itu, aroma juga disebabkan oleh adanya produk Maillard. Aroma dapat terbentuk dari gula yang ditambahkan, asam amino bebas,
peptida-peptida, nukleotida, dan asam-asam organik yang berperan sebagai prekursor utama dalam pembentukan cita rasa gurih pada hidrolisat yang dihasilkan. Selain itu, reaksi Maillard menyebabkan terjadinya perubahan cita rasa yang khas pada makanan.
Rasa gurih yang terbentuk dari peptida-peptida rantai pendek dan asam amino hasil hidrolisis serta rasa dari poduk Maillard yang dihasilkan memberikan komposisi rasa disukai. Akan tetapi perlakuan dengan kombinasi konsentrasi protease yang terlalu tinggi dan lama hidrolisis yang terlalu lama, akan menghasilkan cita rasa hidrolisat yang kurang disukai. Hal ini diduga karena proses hidrolisis yang berlebihan akan menghasilkan cita rasa pahit. Sebagaimana dinyatakan oleh Nielsen (1997), apabila derajat hidrolisis mencapai kondisi di mana gugus hidrophobik peptida menjadi terekspos, akan menimbulkan rasa pahit.
Selanjutnya perlu dikaji potensi antioksidatif dari crude protease biduri, terutama peranannya dalam membantu mengurangi flavor langu pada kedelai yang merupakan permasalahan utama dalam produksi susu kedelai. Disarankan agar proses produksi hidrolisat protein kedelai menggunakan substrat dalam bentuk isolat protein. Juga perlu dilakukan penelitian lebih lanjut tentang perbaikan
flavor pada produk pangan lainnya dengan memanfaatkan aktivitas proteolitik dari protease biduri.
KEPUSTAKAAN
Anonim, 2000. Hidrolisis Enzimatis Protein pada Pembuatan Flavor Hewani Alami. Laporan Penelitian. FTP Unej dan PT Sentrafood Indonusa Corporation, Jember.
AOAC, 1995. Official Methods of Analysis 16th editionition. Association of Official Analytical International, Maryland. USA. Dalimartha S, 2003. Biduri (Calotropis gigantea [Wild.] Dryand.
ex W.T.Ait.).Pdpersi Jakarta.
Erickson DR, Pryde EH, Brekke OL, Mounts TL, dan Falb RA,dan Falb RA, 1980. Handbook of Soy Oil Processing and Utilization. American Soybean. Association and the American Oil Chemistís Society, St. Louis, Missouri and Champaign, Illinois.
Hofmann T, Bors W, dan Stettmaier K, 1999. Studies on Radical Intermidiates in The Early Stage of The Nonenzymatic Browning Reaction of Carbohydrates and Amino Acids, J. Agric. Food Chem. 47: 379–390.
Hrckova M, Rusnakova M, dan Zemanovic J, 2002. Enzymaticdan Zemanovic J, 2002. Enzymatic Zemanovic J, 2002. EnzymaticEnzymatic Hydrolysis of Defatted Soy Flour by Three Different Proteases and their Effect on the Functional Properties of Resulting Protein Hydrolysates. Czech J. Food Sci. 20(1): 7–14.
Witono, Aulanni'am, Subagio, dan Widjanarko 1
Kinney AJ, 2003. Engineering Soybeans for Food and Health. AgBioForum, 6(1&2): 18–22.
Kumagai H, Seto H, Norimatsu Y, Ishii K, dan Kumagai H, 2002. Change Activity Coefficient γw of Water and The Foaming Capacity of Protein During Hydrolysis. Biosci. Biotechnol. Biochem. 66(7): 1445–1461.
Kunts A, 2000. Enzymatic Modification of Soy Proteins to Improve Their Functional Properties, Magazine of Industrial Protein, 8(3): 9–11.
Lawless HT dan Heymann H, 1998. Sensory Evaluation of Food. Chapman & Hall, New York, 729–734.
Liang JH, 1999. Fluorescence due to interactions of oxidizing soybean oil and soy proteins. J. Food Chem., 66: 103–108.
Marsman GJP, Gruppen H, Mul AJ, dan Voragen AG, 1997. In vitro accessibility of untreated, toasted and extruded soybean meals for proteases and carbohydrates. J. Agric. Food Chem., 45: 4088–4095.
Miao S dan Roos YH, 2004. Comparison of Nonenzymatic Browning Kinetics in Spray-dried and Freeze-dried Carbohydrate-based Food Model Systems. J. Food Sci. 69(7): 321–331.
Nielsen PM, 1997. Food Proteins and Their Applications. Marcel Dekker, Inc. New York.
Pelletier A dan Sygusch J, 1990. Purification and Characterization of Three Chitosanase Activities from Bacillus megaterium P1. Applied and Enviromental Microbiology. 56(4): 844– 848.
Prescott J dan Young A, 2002. Does Information about MSG (Monosodium Glutamate) Content Influence Consumer Ratings of Soups with and without added MSG ?. Appetite. 39: 25–33.
Subagio A, Hartanti S, Windrati WS, Unus, Fauzi M, dan Herry B, 2002. Characteristics of protein hydrolysate from tempe, Jurnal Teknologi & Industri Pangan, 8: 204–210. Subagio A dan Morita N, 1997. Changes in Carotenoids and Their
Fatty Acid Esters in Banana Peel during Ripening. Food Sci. Technol. 3(3): 264–268.
Syarifah, 2006. MSG dan ”Chinese Restaurant Syndrome”, Pikiran Rakyat 24 Maret 2006. Bandung.
Walker JM, 2002. The Protein Protocols Handbook. Second Edtion. Humana Press, New Jersey, 3–10.
Whitaker JR., 1994. Principle of Enzymology for The Food Science. Marcel Decker, New York, 29–62.
Witono Y, 2002a. Isolasi dan Karakterisasi Enzim Protease dari Getah Tanaman Biduri. J. Teknologi Hasil Pertanian, 1(1): 1–14.
Witono Y, 2002b. Pemanfaatan Enzim Protease dari Tanaman Biduri untuk Pengolahan Makanan. J. Sains dan Teknologi, 1(1): 32–37.
Witono Y, Subagio A, Windrati WS, Praptiningsih Y, dan Hartanti S, 2004. Enzim Protease dari Tanaman Biduri (Calotropis gigantea), Prosiding Seminar Nasional - Perhimpunan Ahli Teknologi Pangan Indonesia (PATPI), Jakarta.
Witono Y, Subagio A, SusantoT, dan WidjanarkoSB, 2006. Telaah Teknik Produksi Enzim Protease dari Tanaman Biduri (Calotropis gigantea), Prosiding Seminar Nasional Perhimpunan Ahli Teknologi Pangan Indonesia, Yogyakarya.
Berk. Penel. Hayati: 13 (15–26), 2007
KONSTRUKSI VEKTOR BINER UNTUK EKSPRESI GEN
dip22
(
yang
diisolasi dari tebu varietas M 442-51
) PADA TANAMAN
Wiwit Budi Widyasari*dan Sony Suhandono**
* Pusat Penelitian Perkebunan Gula Indonesia, Jl. Pahlawan 25 Pasuruan ** Sekolah Ilmu dan Teknologi Hayati, Institut Teknologi Bandung, Jl. Ganesa 10 Bandung
ABSTRACT
Sugarcane is the principle plant for producing sugar in Indonesia. Water supply is one key element in the agronomy of sugarcane. Sugarcane is a high biomass crop which requires large amounts of water. Low yields of sugar observed in water stressed plants indicate that sugarcane is very sensititive to drought. A number of genes that respond to drought, salt, and cold stress at the trasnscriptional level have been reported. dip22 (drought inducible protein) protein isolated from drought resistance variety M 442-51 was predicted to be a protein regulator to water stress in sugarcane. Increasing of tolerance to water stress by over expression of dip22 genes in high yield sugarcane variety hopefully will maintain sugar production. The goal of this research was to construct a binary vector for dip22 gene expression in plant. dip22 gene from mutated PCR was cloned to pGEM®–T Easy and transformed to Escherichia coli strain DH5α. And then, these gene was isolated again from pGEM®–T Easy-dip22 (pGdip) plasmid using restriction enzymes NcoI and PmlI. pCAMBIA 1303 plasmid is an expression vector which has the constitutive promoter CaMV35S. Recombinant plasmid was transformed to Escherichia coli strain DH5α for plasmid propagation through DNA replication. Recombinant plasmid was isolated, and digested with NcoI and PmlI to examine the presence of dip22 gene in the pCAMBIA 1303 plasmid. The recombinant plasmid was transformed to A. tumefaciens strain LBA 4404. Plasmid isolated from A. tumefaciens was digested with Bst XI and Bst EII to examine the similarity between pCAMBIA 1303-dip22 (pCdip) from Escherichia coli and A. tumefaciens. The result by electrophoresis showed that both plasmids had the same size after digested. It was concluded that the transformed A. tumefaciens strain LBA 4404 bacteria has pCAMBIA 1303-dip22 (pCdip) plasmid indeed. Therefore, this construct of dip22 gene in binary vector can be used for improving drought tolerance in plant.
Key words: dip22 gene, sugarcane, binary vector, drought tolerant
PENGANTAR
Pergeseran budidaya tebu dari lahan sawah ke lahan kering menuntut tersedianya varietas tebu komersial yang toleran terhadap cekaman kekeringan, sehingga produksi kristal gula yang optimal dapat dipertahankan. Hal ini didukung dengan kondisi tanaman tebu yang memiliki biomassa tinggi sehingga membutuhkan air dalam jumlah yang banyak (Inmam-Bamber dan McGlinchey, 2003; Wiedenfeld, 1995 dalam Wiedenfeld, 2004). Hasil panen tebu yang kurang maksimal pada kondisi cekaman air ringan mengindikasikan bahwa tebu sangat sensitif terhadap kekeringan (Wiedenfeld, 2004).
Upaya untuk meningkatkan sifat toleransi tanaman terhadap cekaman kekeringan melalui rekayasa genetik, dapat ditempuh dengan cara transformasi gen yang mengkode suatu protein atau enzim, yang berperan dalam sistem pertahanan diri tumbuhan terhadap cekaman kekeringan. Pendekatan melalui teknik ini telah berhasil dilakukan pada padi (Xu etal., 1996), tembakau (Kishore
et al., 1995), dan tebu (Zhen Zhang et al., 2006).
Meskipun pemuliaan konvensional dapat menghasilkan varietas yang toleran terhadap cekaman lingkungan tertentu, tetapi pencapaian lebih jauh hanya bisa dicapai melalui manipulasi gen yang terlibat dalam toleransi terhadap cekaman (Smirnoff dalam Babu et al., 2004). MetodeMetode konvensional yang dipakai sebelumnya untuk mengatasi masalah kekeringan pada tebu adalah dengan perkawinan silang. Namun varietas tebu yang digunakan sebagai tetua adalah tebu hibrida hasil persilangan sebelumnya. Dengan demikian metode pemuliaan konvensional pada tebu, dibatasi oleh gene pool yang sempit, genom yang kompleks, fertilitas rendah, dan siklus seleksi yang panjang (Suprasanna dan Bapat, 2006).
Konstruksi Vektor Biner untuk Ekspresi Gen dip22
1
memodifikasi gen, yang selanjutnya dimasukkan kembali ke dalam sel atau organisme sehingga dapat meningkatkan (over ekspresi) atau menurunkan (silencing) sejumlah protein yang dihasilkan tanaman transgenik. Gen yang direkayasa dapat berasal dari spesies yang sama atau berbeda dengan spesies tanaman yang akan disisipkan gen tambahan (Alberts et al., 1994).
Teknologi DNA rekombinan merupakan perpaduan sejumlah teknik dalam biologi molekuler. Beberapa teknik tersebut antara lain adalah (1) restriksi DNA dengan enzim nuklease, sehingga memudahkan isolasi dan menipulasi setiap gen yang dikehendaki; (2) kloning DNA, yaitu apabila sebuah fragmen DNA tertentu telah diintegrasikan ke dalam suatu unsur genetik yang dapat menggandakan diri sendiri (plasmid atau virus) dan hidup pada bakteri sehingga sebuah molekul DNA dapat direproduksi untuk menghasilkan salinan identik yang berjumlah jutaan; (3) rekayasa genetika, yaitu suatu cara mengubah urutan DNA untuk memodifikasi gen, yang selanjutnya dimasukkan kembali ke dalam sel atau organisme (Alberts et al., 1994).
Pada dasarnya tersedianya promoter aktif yang kuat sangat diperlukan untuk over-ekspresi suatu gen pada tanaman baik monokotil maupun dikotil. Beberapa hasil penelitian menyatakan bahwa CaMV35S adalah promoter konstitutif yang aktif pada sel tanaman monokotil, akan tetapi kekuatannya sedikit menurun pada sel dikotil dan tidak aktif pada beberapa tipe sel seperti pollen (Christensen dan Quail, 1996). Selain itu, promoter Adh1 yang diisolasi dari jagung sudah digunakan pada penelitian transformasi gen pada tanaman monokotil, akan tetapi aktivitasnya terbatas pada akar, tunas meristem, endosperm, dan pollen (Christensen dan Quail, 1996). Sejauh ini, kebanyakan laporan penelitian tentang over ekspresi gen asing untuk meningkatkan toleransi terhadap cekaman abiotik pada tanaman menggunakan promoter konstitutif (Su dan Wu, 2004).
Pada penelitian sebelumnya, dilaporkan adanya ekspresi kuat dari gen dip22 (drought inducible protein) pada tebu yang tercekam kekeringan (Widyasari, 2004 dan Widyasari et al., 2004). Dengan menggunakan metode DNA rekombinan, over ekspresi gen dip22 pada varietas tebu unggul yang peka kekeringan, diharapkan dapat meningkatkan sifat toleransi varietas tersebut terhadap cekaman kekeringan sehingga produksi gula yang dihasilkan tetap optimal meskipun ditanam pada lahan kering. Penelitian ini bertujuan mengkonstruksi vektorPenelitian ini bertujuan mengkonstruksi vektor biner untuk ekspresi gen dip22 pada tanaman, khususnya tanaman tebu.
BAHAN DAN CARA KERJA
Bahan Penelitian
Dalam penelitian ini digunakan beberapa bahan, di antaranya adalah klon gen dip22 dalam plasmid pGEM®-T
Easy yang diperoleh dari penelitian sebelumnya (Sugiharto
dkk., 2001). Selanjutnya klon gen dip22 tersebut diperbanyak pada E. coli strain DH5α (Widyasari, 2004). Vektor ekspresi yang digunakan adalah plasmid pCAMBIA 1303 (Lampiran 2) yang diperoleh dari Center for Application of Molecular Biology on International Agriculture (CAMBIA), Australia.
Cara Kerja
Persiapan PCR mutagenesis
Agar gen dip22 dapat disisipkan pada vektor ekspresi yang diinginkan, maka gen tersebut harus dimutasi dengan metode PCR mutagenesis sehingga memiliki tempat pemotongan enzim yang sesuai dengan vector ekspresinya. Pada penelitian ini, dip22 akan disambungkan pada pCAMBIA 1303, oleh karena itu dilakukan strategi sebagai berikut.
Design primer
Gen dip22 memiliki ukuran sekitar 840 pasang basa (pb). Start codon berada pada basa ke 130 sedangkan stop codon pada nukleotida ke-560 (Lampiran I). Pada start codon
(±130 pb) terdapat tempat pemotongan untuk enzim Nco I, hal ini sesuai dengan peta restriksi pCAMBIA 1303. Pada
stop codon tidak terdapat tempat pemotongan untuk enzim
PmlI seperti yang ada pada pCAMBIA 1303. Oleh karena itu, perlu dilakukan penyisipan tempat pemotongan PmlI
pada gen dip22 menggunakan metode PCR mutagenesis. Pertama kali yang harus dilakukan adalah merancang primer untuk PCR mutagenesis. PrimerPrimer forward yang digunakan adalah 5’- TCG ATC CAA TTG TTC ACT CGC TCA G-3’ (dimulai dari basa ke-50 sampai 74). Sedangkan primer
backward adalah 5’-CAC↓GTG ATC AGC CGA AGA AGT GGT GCT TC-3’ (dimulai dari basa nukleotida ke 560).
Reaksi PCR mutagenesis
Widyasari dan Suhandono 17
Purifikasi DNA dengan Gel Extraction Kit dari QIAGEN
Purifikasi DNA dari gel mengikuti protokol dari produsen Qiagen. Ke dalam tabung mikrosentrifuga yang berisi gel, ditambahkan 3× volume gel agarosa bufer Q1. Tabung diinkubasi pada temperatur 50 °C selama 10 menit atau sampai semua gel larut sehingga warnanya sama dengan bufer Q1. Campuran bufer Q1 dan gel agarosa yang telah larut dimasukkan ke dalam kolom membran kemudian disentrifugasi dengan kecepatan 12.000 g selama 1 menit. Cairan yang tertampung di bagian bawah kolom dibuang. Untuk membersihkan kolom dari sisa-sisa gel agarosa, ke dalam kolom ditambahkan 500 µL bufer Q1 kemudian kolom disentrifugasi dengan kecepatan 12.000 g selama 1 menit. Pemurnian dilanjutkan dengan menambahkan 750 µL bufer P1 ke dalam kolom, kemudian kolom disentrifugasi dengan kecepatan 12.000 g selama 1 menit. Lalu ke dalam kolom ditambahkan 40 µL bufer EB tepat di bagian tengah dari membran yang terdapat pada kolom. Kolom ditempatkan pada tabung mikrosentrifuga steril kemudian disentrifugasi dengan kecepatan 15.000 g selama 1 menit. DNA yang bersih akan terlarut dalam bufer EB dan ditampung dalam tabung mikrosentrifuga baru.
Persiapan sel kompeten
Pembuatan sel kompeten dilakukan sesuai anjuran protokol yang terdapat dalam kit sel kompeten E. coli
(Promega) dengan sedikit modifikasi. Bakteri strain DH5α dari stok gliserol (–70 °C) digoreskan di atas permukaan medium agar padat M9+thiamine HCl. Medium tersebut mengandung 0,6% Na2HPO4; 0,3% KH2PO4; 0,5% NaCl; 0,1% NH4Cl; 1,5% agar; 0,2% (v/v) 1 M MgSO4, 0,01% (v/v) 1 M CaCl2; 1% (v/v) 20% glukosa; dan 0,1% (v/v) 1 M Thiamine HCl.
Cawan petri tersebut diinkubasi semalam pada suhu 30 °C. Setelah itu diambil 1–2 koloni tunggal dan dimasukan dalam LB cair dan dikocok pada kecepatan 150 rpm, suhu 30 °C selama 24 jam. Sebanyak 0,5 ml LB cair, dan dikocok pada suhu 30 °C sampai nilai absorbansi pada OD600 mencapai 0,45–0,55 selama kurang lebih 1 jam 45 menit. Suspensi sel dipindah ke dalam tabung baru dingin dan steril dalam keadaan aseptik, kemudian didinginkan dalam es selama 2 jam. Selanjutnya tabung berisi suspensi bakteri disentrifugasi pada 5000 rpm, 4 °C selama 10 menit. Fasa air dibuang dengan hati-hati agar endapan bakteri tidak ikut terbuang. Sebanyak 1–2 ml buffer triturasi dingin dimasukkan dalam tabung secara hati-hati untuk mensuspensikan endapan bakteri. Kemudian ditambahkan buffer yang sama sebanyak 50 ml. Selanjutnya suspensi bakteri diinkubasi
dalam es selama 45 menit dan disentrifugasi pada kecepatan 4000 rpm selama 10 menit. Fasa air dibuang sedangkan endapan bakteri yang diperoleh disuspensikan dengan 5 ml buffer triturasi dingin. Sel kompeten bisa langsung digunakan atau disimpan dalam –80 °C.
Transformasi plasmid rekombinan ke dalam bakteri E. coli strain DH5α
Transformasi plasmid ke dalam sel kompeten mengikuti prosedur dari Promega dengan sedikit modifikasi. Sebanyak 5 µl dari setiap hasil ligasi atau plasmid dimasukkan secara hati-hati ke dalam tabung polipropilen 50 ml dingin dan ke dalam setiap tabung dimasukkan bakteri yang telah kompeten sebanyak 100 µl. Tabung berisi bakteri kompetenTabung berisi bakteri kompeten dan plasmid selanjutnya disimpan dalam es selama 30 menit. Setelah itu tabung dimasukkan keSetelah itu tabung dimasukkan ke water bath
untuk memberi kejutan panas pada suhu 42 °C selama 50 detik. Selanjutnya tabung tersebut segera didinginkan dalam es selama 2 menit. Sebanyak 950 µl SOC cair ditambahkan ke dalam tabung kemudian suspensi sel diinkubasi pada suhu 37 °C pada 175 rpm selama 21 jam. Setelah diinkubasi, 100 µl kultur ditanam pada medium LB padat yang mengandung 100 µg/ml antibiotik ampisilin dan 50 mg/ml X-gal serta 100 µl 0.1 M IPTG. Kultur bakteri diratakan di atas medium LB padat dengan bantuan bola-bola kaca steril berdiameter 3 mm. Kultur bakteri selanjutnya diinkubasi pada suhu 37 °C selama semalam (16–18) jam.
Isolasi plasmid
Konstruksi Vektor Biner untuk Ekspresi Gen dip22
1
10 menit. Supernatan dibuang, pellet dicuci dengan 70% etanol kemudian dikering-anginkan. Pelet kering disuspensikan dalam 100 µl TE.
Konstruksi gen dip22 pada vektor ekspresi
Pada penelitian ininelitian ini dip22 akan disisipkan pada vektor ekspresi pCAMBIA1303 yang mengandung promoter
CAMV35S pada tempat pemotongan enzim NcoI dan PmlI. Untuk mencapai tujuan tersebut pCAMBIA1303 dipotong terlebih dahulu dengan PmlI dan NcoI. Pemotongan atau restriksi ini dimaksudkan untuk menyediakan tempat penyisipan bagi gen dip22 yang sudah termutasi. Setelah itu dilakukan penyambungan atau ligasi. Ligasi dilakukan dengan mencampur reaksi antara vektor plasmid, DNA sisipan, dan T4 DNA Ligase. Ligasi dilakukan dalam tabung mikrosentrifuga 0,5 ml pada suhu 4 °C selama satu malam. Pada proses ligasi digunakan Ligation Buffer 10 × sejumlah 0,1 × volume total reaksi. Selanjutnya hasil ligasi sebanyak 5 µl ditransformasi ke E. coli (DH5α) dan ditanam pada medium LB yang mengandung 50 µg/ml kanamisin.
Transformasi pCAMBIA1303-CAMV35S-dip22 (pCdip)
ke Agrobacterium tumefaciens
Sebelum transformasi, dilakukan pembuatan sel kompeten Agrobacterium tumefaciens. Mula-mula 1 koloniMula-mula 1 koloni
A. tumefaciens dimasukkan ke dalam 50 ml medium YEP cair yang telah ditambahkan antibiotik rifampisin 25 ppm. Bakteri ditumbuhkan pada suhu ruang (28°C) selama 12 jam sambil dikocok 200 rpm. Lalu 2 ml kultur dipindahkan ke 50 ml medium baru YEP cair yang telah ditambahkan antibiotik rifampisin 25 ppm. Kultur ditumbuhkan pada suhu ruang (28°C) sampai OD600 mencapai 0,4 –0,5 sambil dikocok 200 rpm. Kultur lalu didinginkan di es selama 10 menit, kemudian kultur disentrifugasi 5.000 rpm selama 5 menit pada suhu 4 °C sehingga terbentuk 2 fase, fase supernatan yang merupakan medium YEP dibuang. Pelet sel kompeten A. tumefaciens dilarutkan dalam 1 ml 20 mM CaCl2.
Proses transformasi dimulai dengan memasukkan 100 µl sel kompetenµl sel kompetenl sel kompeten A. tumefaciens ke dalam tabung mikrosentrifuga 1,5 ml, kemudian ditambahkan 1 µlµll plasmid. Tabung lalu didinginkan ke dalam nitrogen cairTabung lalu didinginkan ke dalam nitrogen cair selama 5 menit, lalu diinkubasi pada suhu 37 °C selama 25 menit. Ke dalam tabung kemudian ditambahkan 1 ml medium YEP cair, dan bakteri ditumbuhkan pada suhu ruang (28 °C) selama 3 jam sambil dikocok 50 rpm. Setelah itu kultur disentrifugasi 12.000 g selama 30 detik. Pelet yang merupakan sel transforman A. tumefaciens disuspensikan dengan 1 ml YEP. Bakteri lalu ditumbuhkan dalam
25 ml medium YEP padat yang telah ditambahkan antibiotik rifampisin 25 ppm dan kanamisin 50 ppm pada suhu ruang (28 °C) selama 48 jam.
Isolasi pCAMBIA1303-CAMV35S-dip22 (pCdip) dari
Agrobacterium tumefaciens
Ke dalam tabung reaksi yang berisi 10 ml medium YEP yang telah ditambahkan antibiotik rifampisin 25 ppm dan kanamisin 50 ppm dimasukkan satu koloni bakteri A. tumefaciens hasil transformasi. Bakteri lalu ditumbuhkan selama 24 jam pada suhu ruang (28 ˚C) selama 24 jam sambil dikocok 200 rpm. Kultur lalu dimasukkan dalam tabung mikrosentrifuga 1,5 ml, kemudian disentrifugasi 12.000 g selama 10 menit sampai terbentuk 2 fase, supernatan yang merupakan medium YEP dibuang. Tahapan isolasi plasmid dari A. tumefaciens, sama dengan isolasi plasmid dari E. coli. Perbedaannya pada isolasi plasmid A. tumefaciens
perlu diekstraksi dengan fenol:kloroform (1:1).
Sequencing konstruk pCAMBIA1303-CAMV35S-dip22
(pCdip)
Setelah diperoleh konstruk gen dip22 pada vector
pCAMBIA1303 dilakukan sequencing untuk mengkonfirmasi kebenaran konstruk tersebut.
HASIL
Hasil PCR Mutagenesis
Hasil PCR termutasi ditunjukkan pada Gambar 1. Pada Gambar 1 terlihat ada pita yang berukuran 510 pb yang tampak cukup tebal.
Widyasari dan Suhandono 1
Selanjutnya pita yang berukuran 510 pb tersebut diekstraksi dari gel. Pita DNA 510 pb tersebut adalah gen dip22 yang termutasi. Hasil ekstraksi disajikan pada Gambar 2.
Pada Gambar 2 terlihat pita DNA 510 pb yang diekstraksi dari gel berukuran sama dengan DNA hasil PCR termutasi.
Kloning dip22 hasil PCR mutagenesis pada pGEM®
T-Easy-(pGdip)
Hasil ekstraksi pita 510 pb tersebut (Gambar 2), kemudian diligasi pada vektor kloning pGEMT-easy dan selanjutnya ditransformasi ke E. coli strain DH5α untuk memperbanyak plasmid. Setelah itu, DNA sisipan yang merupakan gen dip22 termutasi tersebut, diisolasi lagi dari plasmid. Tahap pertama dilakukan isolasi plasmid pada 10 koloni tunggal putih. Hasil isolasi plasmid dari kelima klon ditunjukkan pada Gambar 3.
Selanjutnya DNA plasmid dari semua klon (klon 1-10) dipotong dengan EcoRI untuk melihat ada tidaknya DNA sisipan. Hasil pemotongan DNA plasmid kesepuluh klon dengan enzim EcoRI, ditampilkan pada Gambar 4.
Pada Gambar 4 terlihat adanya sisipan DNA yang berukuran 510 pasang basa. DNA dengan ukuran 510 pbDNA dengan ukuran 510 pb tersebut tidak lain adalah gen dip22 hasil PCR termutasi. Selanjutnya gen dip22 tersebut diisolasi dari plasmid pGEMT-easy (pG-dip). Isolasi gen dip22 dilakukan dengan menggunakan dua enzim restriksi. Pada awalnya plasmid pGdip dipotong dengan enzim NcoI. Reaksi pemotongan dilakukan pada suhu 37 °C. Hasil elektroforesis plasmid hasil restriksi ditunjukkan pada Gambar 5.
Gambar 2. DNA ukuran 510 pb (dip22 termutasi) sebelum (sumur 1 dan 2) dan setelah ekstraksi dari gel (sumur 3 dan 4) (M = Marker 100 pb DNA Ladder)
Gambar 3. Hasil isolasi DNA plasmid dari 5 klon (1 = Marker Lambda DNA/ Hind III, 2, 3, 4, 5, 6 = DNA plasmid klon 1, klon 2, klon 3, klon 4, klon 5)
Konstruksi Vektor Biner untuk Ekspresi Gen dip22
0
Selanjutnya pita DNA yang berkuran 455 pb dipotong dan diekstraksi dari gel. Hasil purifikasi dari gel ditampilkanHasil purifikasi dari gel ditampilkan pada Gambar 6.
Larik DNA yang berukuran 455 pb dipurifikasi dengan Gel Extraction Kit. Hasil purifikasi dipotong lagi dengan enzim PmlI. Reaksi pemotongan dilakukan pada suhu 37 °C selama 4 jam. Seluruh volume reaksi lalu dielektroforesis pada gel agarosa 1% seperti terlihat dalam Gambar 7.
Pada Gambar 7 terlihat ada dua larik DNA yang berukuran 430 pb dan 25 pb. Larik DNA yang berukuran 430 pb kemudian diisolasi dari gel dan dipurifikasi, sehingga didapatkan gen dip22 dengan ujung 5’ yang merupakan hasil restriksi NcoI dan ujung 3’ yang merupakan hasil restriksi PmlI.
Konstruksi Gen dip22 pada pCAMBIA1303
Supaya gen dip22 dapat disambungkan pada vektor ekspresi pCAMBIA1303, maka terlebih dahulu pCAMBIA
1303 dipotong dengan enzim PmlI dan NcoI. Hasil restriksi
pCAMBIA 1303 ditampilkan pada Gambar 8.
Setelah dipotong dengan enzim PmlI dan NcoI, hasil elektroforesis pada Gambar 8 menunjukkan ada 2 pita dengan ukuran 9798 bp dan 2563 bp. Pita dengan ukuran 9798 bp dipotong dari gel kemudian diekstraksi dengan Gel extraction DNA dari Qiagen untuk disisipi dip22.
Selanjutnya gen dip22 diligasi dengan plasmid pCAMBIA 1303 yang telah dipotong dengan enzim NcoI dan PmlI dengan reaksi: 0,8 µg pCAMBIA 1303; 0,6 µg
dip22; 2 µl Air Deion; 1 µl Buffer Ligase 10×; 3 U T4 DNA Ligase.
Hasil ligasi antara pCAMBIA 1303 dan dip22 kemudian ditransformasi ke E. coli strain DH5α. Transformasi ke E. coli dilakukan untuk memperbanyak jumlah DNA plasmid rekombinan. Kemudian plasmid rekombinan diisolasi lagi dari bakteri untuk ditransformasikan ke A. tumefaciens.
Gambar 5. Hasil pemotongan plasmid klon no 7 dengan NcoI (1 = Marker DNA Ladder 100 pb, 2 = klon no. 7 yang dipotong dengan NCoI)
Gambar 6. Hasil purifikasi pita 455 pb (M = Marker DNA Ladder 100 pb, 1 = pita 455 pb)
Gambar 7. Hasil pemotongan fragmen 455 pb plasmid pGEM®–T
Easy-dip 22/NcoI dengan PmlI. M = Marker 100 bp DNA Ladder, 2. pGdip/NcoI + PmlI (10 μg)
Widyasari dan Suhandono 1
Hasil Isolasi Plasmid pCAMBIA 1303-dip22 (pCdip) dari Escherichia coli Strain DH5α
Hasil isolasi DNA plasmid dielektroforesis sehingga larik-larik DNA yang berbeda ukuran terpisah. Hasil elektroforesis setelah diwarnai terlihat seperti pada Gambar 9. Konsentrasi DNA plasmid hasil isolasi adalah 11,95 µg/µl.µg/µl.g/µl.µl.l.
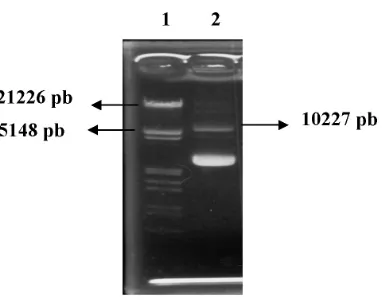
DNA plasmid hasil isolasi kemudian dipotong dengan enzim NcoI dan PmlI untuk memeriksa bahwa plasmid tersebut benar adalah pCAMBIA 1303 dan mengandung gen
dip22. Hasil pemotongan DNA kemudian dielektroforesis pada gel agarosa dan ditampilkan pada Gambar 10.
Hasil pemotongan menunjukkan bahwa plasmid klon 3 adalah pCAMBIA 1303 yang telah disisipi gen dip22. Hal ini diperlihatkan dari ukuran larik DNA 9794 pb yang merupakan ukuran rantai DNA pCAMBIA 1303 setelah dipotong dengan NcoI dan PmlI, dan larik DNA 430 pb yang merupakan ukuran dari gen dip22.
Hasil Transformasi pCAMBIA 1303-dip22 ke
Agrobacterium tumefaciens Strain LBA 4404
Untuk menguji plasmid hasil isolasi adalah pCdip
maka hasil isolasi plasmid dari Agrobacterium tumefaciens
dipotong dengan enzim restriksi Bst XI dan Bst EII. Hasil restriksi kemudian dielektroforesis dalam gel agarosa dan diwarnai. Hasil restriksi terlihat pada Gambar 11.
Sekuensing Konstruk pCAMBIA1303-CAMV35S-dip22
(pCdip)
Hasil sekuensing plasmid pC-dip22 lalu dibandingkan dengan urutan nukleotida gen dip22 yang sebelumnya telah diklon pada pGEMT-easy. Penjajaran urutan DNA tersebut menggunakan program genedoc dan hasilnya ditunjukkan pada Gambar 12.
PEMBAHASAN
Strategi dalam mengkonstruksi suatu gen harus mempertimbangkan dua hal yaitu urutan nukleotida gen yang akan dikonstruksi dan vektor ekspresi yang akan digunakan. Pada penelitian ini urutan nukleotida dip22
dimulai dengan start kodon yang mengandung tempat pemotongan enzim NcoI, dan diakhiri dengan stop kodon yang mengandung tempat pemotongan enzim Sau3AI,
MboI, dan NdeII. Pada peta restriksi pCAMBIA1303, terdapat NcoI tepat di belakang promoter CaMV35S, yang mengekspresikan gen gusA dang gen gfp. Sebelum NOS poly-A terdapat tempat pemotongan enzim PmlI. Dengan demikian urutan nukleotida dip22 harus dimutasi dengan cara menambahkan urutan DNA untuk menyediakan tempat pemotongan PmlI. Urutan nukleotida tersebut ditambahkan pada primer reverse yaitu pada nukleotida ke-560.
Gambar 9. Hasil isolasi plasmid pCAMBIA 1303-dip22 dari Escherichia coli strain DH5/. 1. Marker Lambda DNA/ Eco RI + Hind III, 2. pCdip
Gambar 10. Hasil pemotongan plasmid pCAMBIA 1303-dip22 dengan NcoI dan PmlI. 1. Marker Lambda DNA/Eco RI + Hind III, 2. pCdip/NcoI + PmlI klon 1, 3. Marker 100 bp DNA Ladder, 4. pCdip/NcoI + PmlI klon 2, 5. pCdip/NcoI + PmlI klon 3
Konstruksi Vektor Biner untuk Ekspresi Gen dip22
Sebelum dip22 disisipkan pada pCAMBIA1303, vektor dipotong terlebih dahulu dengan enzim NcoI dan PmlI untuk menghilangkan daerah gen gusA dan gfp, sehingga sebagai penanda selektif adalah gen resistensi terhadap kanamisin dan higromisin. Selanjutnya gen dip22 hasil PCR termutasi dipotong dengan NcoI dan PmlI kemudian disambungkan ke pCAMBIA1303/NcoI/PmlI.
Elektroforesis DNA plasmid yang mengandung sisipan gen dip22 termutasi, menghasilkan beberapa larik DNA yang berbeda ukuran (Gambar 3). Hal ini disebabkan oleh sebagian besar molekul DNA berada dalam bentuk molekul sirkuler, misalnya plasmid bakteri, kromosom, dan kebanyakan molekul DNA virus. Untai ganda DNA yang berpasangan bergabung membentuk lingkaran, dan berputar satu sama lain melalui garis heliks DNA. Deformasi ini disebut superkoil karena berbentuk seperti gulungan (koil) DNA yang aksisnya adalah DNA itu sendiri dan berhubungan dengan jumlah pertemuan dari kondisi sirkuler sederhana tersebut. Hampir seluruh molekul DNA dalam sel merupakan superkoil negatif, yaitu putarannya tidak searah dengan heliks DNA (Turner et al., 2000).
Pada Gambar 3, terlihat beberapa larik DNA hasil isolasi, sementara plasmid pGdip yang ditransformasi ke dalam sel E. coli hanya satu ukuran yaitu 3530 pb. Timbulnya beberapa larik DNA hasil isolasi disebabkan oleh adanya perbedaan konformasi dari plasmid-plasmid tersebut. Pergerakan fragmen DNA pada gel agarosa proporsional terhadap logaritma berat molekul fragmen tersebut (Maniatis et al., 1975 dalam Winnacker, 1987). Plasmid yang memiliki putaran (koil) lebih banyak memiliki bentuk yang lebih kompak sehingga lebih mudah melalui pori-pori dalam gel agarosa daripada plasmid yang putarannya lebih sedikit, sehingga plasmid yang memiliki putaran lebih banyak lebih cepat jalannya di dalam gel dibanding plasmid yang memiliki putaran lebih sedikit.
Geometri molekul superkoil bisa berubah oleh bermacam-macam faktor yang memengaruhi putaran intrinsik DNA heliks. Sebagai contoh, peningkatan temperatur dapat menurunkan jumlah putaran, dan peningkatan kekuatan ion dapat meningkatkan jumlah putaran. Faktor penting lain adalah kehadiran interkalator. Interkalator yang paling terkenal adalah etidium bromida.
Gambar 12. Penjajaran urutan nukleotida gen dip22 dari pGEM®–T Easy (pGdip) dengan hasil sekuensing dip22 dari pCAMBIA1303
Widyasari dan Suhandono
Etidium bromida merupakan senyawa polisiklik aromatik bermuatan positif, yang akan berikatan dengan DNA yang bermuatan negatif dengan menginsersikan dirinya di antara pasangan basa (interkalasi). Interkalasi menyebabkan DNA heliks melonggar sekitar 26° (Turner et al., 2000). Proses isolasi, elektroforesis, dan pewarnaan DNA dengan etidium bromida ternyata juga mempengaruhi putaran DNA heliks. Pada Gambar 3 sumur 4, 5, dan 6 menunjukkan bahwa larik DNA paling bawah yang memiliki bentuk superkoil memiliki konsentrasi yang lebih tinggi dibandingkan dengan DNA superkoil yang lebih sederhana.
Elektroforesis gel agarosa (sejenis polisakarida yang diisolasi dari ganggang laut) dapat memisahkan DNA linear berdasarkan perbedaan ukuran, melalui migrasi DNA pada sebuah matriks dalam pengaruh medan listrik karena setiap nukleotida dalam sebuah molekul asam nukleat membawa sebuah muatan negatif. Elektroforesis bisa digunakan untuk mendeterminasi organisasi molekul plasmid (Alberts et al., 1994; Turner et al., 2000).
Setelah diperoleh DNA plasmid rekombinan (pGdip), plasmid tersebut ditransformasi ke E. coli strain DH5α untuk memperbanyak DNA yang disisipkan (dip22). Transformasi adalah proses memasukkan DNA asing (gene transfer), biasanya plasmid, ke dalam suatu organisme. Metode transformasi antara lain dengan metode fisika (injeksi, partikel bombardment, pulsa medan listrik), metode kimia (melarutkan DNA dalam larutan PEG dan penggunaan kejutan panas), atau secara biologis (menggunakan vektor
E. coli atau Agrobacterium tumefaciens) (Endress, 1994). Transformasi ke sel bakteri dilakukan dengan perlakuan Ca2+ sehingga membuat bakteri tersebut kompeten untuk
dimasuki DNA plasmid (Turner et al., 2000).
Selanjutnya pGdip tersebut dipotong dengan enzim restriksi EcoRI. Pada Gambar 4 tampak adanya gen
dip22 termutasi yang disisipkan pada pGEM®–T Easy.
Enzim restriksi merupakan enzim bakteri yang memotong (hidrolisis) DNA menjadi fragmen berukuran tertentu. Pada banyak spesies bakteri, sistem restriksi merupakan mekanisme pertahanan terhadap introduksi DNA asing ke dalam sel. Sistem restriksi terdiri atas dua tahap; pertama adalah metilasi, penambahan gugus metil tehadap basa C atau A di antara urutan yang dikenali dalam DNA seluler. Tahap kedua adalah endonuklease yang mengenali urutan DNA pendek (4–8 nukleotida) dan simetris, dan memotong (hidrolisis) ikatan DNA pada tiap rantai pada sisi spesifik di antara urutan DNA (Glover, 1986; Turner et al., 2000; Alberts et al., 1994). Enzim restriksi (endonuklease) contohnya EcoRI yang diisolasi dari E. coli, berperan sebagai dimer dan hanya akan mengenali urutan 5’GAATTC 3’. Produk dari reaksi pemotongan pada sisi ini pada DNA linear adalah dua fragmen rantai ganda DNA, masing-masing dengan sebuah ujung identik rantai tunggal ujung 5’- dengan gugus fosfat, sedangkan ujung 3’- memiliki gugus hidroksil. Hasil pemotongan ini disebut ujung lancip, karena mereka bisa berikatan pada ujung mana pun yang memiliki urutan overhang yang sama, melalui pasangan basa ujung rantai tunggal. Enzim restriksi lain seperti HaeIII dari Haemophilus aegyptius dapat menghasilkan ujung tumpul. Ujung 5’- yang baru terbentuk pada ujung tumpul selalu memiliki grup fosfat (Turner et al., 2000).
Berdasarkan hasil pemotongan pGdip dengan enzim
NcoI (seperti pada Gambar 5), ada dua kemungkinan orientasi penempelan DNA hasil PCR termutasi pada plasmid pGEM®–T Easy yang mengandung T overhang
Konstruksi Vektor Biner untuk Ekspresi Gen dip22
pada kedua ujungnya. Kemungkinan orientasi gen dip22
dalam plasmid pGEM®–T Easy adalah seperti pada
Gambar 13.
Pada Gambar 5, pemotongan plasmid menghasilkan 2 larik DNA berukuran 3095 pb dan 455 pb. Dua larik DNA ini disebabkan adanya dua sisi restriksi yang dikenali oleh enzim restriksi NcoI dalam urutan nukleotida plasmid. Satu sisi restriksi berasal dari plasmid pGEM®–T Easy, seperti
terlihat pada Gambar 14 dan satu sisi lainnya berasal dari gen dip22, seperti terlihat dalam Gambar 15. Karena hasil pemotongan memperlihatkan larik DNA berukuran 455 pb maka diketahui bahwa orientasi penempelan gen dip22
termutasi pada plasmid pGEM®–T Easy adalah seperti
orientasi A pada Gambar 13.
Setelah gen dip22 diisolasi kembali dari pGdip, dip22
disambungkan ke vektor pCAMBIA1303 menggunakan enzim DNA ligase. Enzim DNA ligase berfungsi menempelkan rantai tunggal pada ujung molekul dsDNA, yang memiliki ujung 5’- yang memiliki gugus fosfat dan ujung 3’- yang memiliki gugus hidroksil. Sifat komplementer
hasil restriksi dari enzim restriksi yang sama (atau enzim berbeda yang menghasilkan ujung lancip yang sama) sangat penting untuk menempelkan DNA dari sumber yang berbeda (Glover, 1986). Enzim ligase memiliki efisiensi lebih tinggi menempelkan ikatan fosfodiester yang putus pada pasangan ujung lancip daripada ujung tumpul (Turner
et al., 2000).
Skema ligasi gen dip22 dengan plasmid pCAMBIA
1303 terlihat pada Gambar 16. Orientasi penempelan gen dip22 pada plasmid pCAMBIA 1303 hanya ada satu kemungkinan seperti diperlihatkan pada Gambar 17, dikarenakan masing-masing gen dan plasmid memiliki sisi pemotongan yang unik.
Plasmid pCAMBIA dikonstruksi sebagai vektor DNA dalam metode transformasi langsung dan menggunakan
Gambar 14. Peta plasmid pGEM®–T Easy (Promega, 2003)
Gambar 15. Peta restriksi gen dip22
Gambar 16. Skema ligasi gen dip22 dengan plasmid pCAMBIA 1303