PEMURNIAN PRIMORDIAL GERM CELLS (PGCs) AYAM
LOKAL DENGAN METODE NICODENZ DENSITY
GRADIENT CENTRIFUGATION (NGC)
(Local Chicken Primordial Germ Cells (PGCs) Purification by Nicodenz
Density Gradient Centrifugation (NGC))
S.SOPIYANA,T.KOSTAMAN danA.R.SETIOKO
Balai Penelitian Ternak, PO Box 221, Bogor 16002
ABSTRACT
Many methods have been conducted to conserve genetic material of animal, and the use of in-situ and ex-situ conservation methods are generally conducted. Primordial germ cells (PGCs) conservation is an alternative way to preserve genetic resources in both male and female sides. The objective of this study is to test a method to purify primordial germ cells (PGCs) of local chicken by Nicodenz density gradient centrifugation (NGC). Fertilized eggs of native chicken were used for blood collection. The eggs were incubated to obtain embryos at stage 15. The stage of embryo development was determined during the period of study. The blood of the whole embryo was collected using a fine glass micropipette under the microscope. The collected blood was pooled in a 1.5 ml micro tube and suspended to 0.5 ml PBS medium. In this experiment, harvesting PGCs was conducted using standard NGC method refers to Zhao and Kuwana. Blood from the embryo on the stage of 13 – 18 was able to be collected with average 15,47 ± 0,5 and with percentage of succeed 87,1 ± 9,1%. The use of standard NGC to purify PGCs was successfully collected some PGCs from the blood. The number of PGCs is still relatively varied with the average of 28,60 ± 5,7 cells per embrio. It is concluded that NGC technique could be used to purify PGCs of local chicken.
Key Words: Poultry, Germ Plasm, Primordial Germ Cells ABSTRAK
Berbagai metode telah dilakukan untuk konservasi sumberdaya genetik pada ternak, dan umumnya dengan metode in-situ dan ex-situ. Kriopreservasi primordial germ cells (PGCs) merupakan cara alternatif untuk menyimpan materi genetik, baik pada unggas jantan maupun betina. Tujuan penelitian ini adalah menguji metode pemurnian PGCs pada ayam lokal dengan menggunakan teknik Nicodenz density gradient centrifugation (NGC). Telur-telur dari ayam lokal yang fertil dieramkan selama 53 jam untuk mendapatkan embrio pada stage 15. Telur dipecahkan, kemudian darah embrio diambil dengan menggunakan fine glass micropipette di bawah mikroskop. Darah dikumpulkan dalam 1,5 ml micro tube yang telah diisi 0,5 ml media PBS. Selanjutnya pemanenan PGCs dari darah embrio dilakukan dengan metode NGC baku mengacu kepada Metode Zhao dan Kuwana. Hasil penelitian sudah berhasil menampung darah embrio pada stage antara 13 – 18 dengan rataan 15,5 ± 0,5, dengan persentase keberhasilan yang cukup tinggi yaitu 87,03 ± 9,1%. Jumlah PGCs yang dapat dipanen dengan menggunakan metode NGC adalah sekitar 28,60 ± 5,7 sel per embrio yang terlihat di mikroskop. Dapat disimpulkan bahwa teknik NGC ternyata mampu digunakan untuk memurnikan PGCs pada ayam lokal.
Kata Kunci: Unggas, Plasmanutfah, Primordial Germ Cells
PENDAHULUAN
Berbagai metode telah dilakukan untuk kegiatan konservasi sumberdaya genetik pada ternak, dan umumnya dengan metode in-situ
atau conservation by utilization lebih disukai
untuk konservasi breed ternak. Selain itu melalui konservasi ex-situ yang merupakan metode atau teknik untuk memelihara hewan hidup di luar habitat atau lingkungannya ( ex-situ hidup) atau melalui kriopreservasi sumberdaya genetik (ex-situ) biasanya
dilakukan untuk menyimpan sumber genetik binatang langka atau lebih banyak digunakan untuk preservasi breed komersial.
Kriopreservasi materi genetik pada unggas dapat disimpan dalam waktu sangat lama tanpa kerusakan (MAZUR, 1985). Preservasi genetik material pada unggas digunakan untuk pengembangan unggas di masa datang dan menyimpan spesies langka. Kriopreservasi sperma unggas seperti ayam, itik, angsa dan kalkun telah dilaporkan (LAKE dan STEWART, 1978; HAMMERSTEDT dan GRAHAM, 1992). Namun demikian banyak terjadi variasi yang tinggi antara penelitian pada fertilitas telur seperti dilaporkan oleh HAMMERSTEDT dan GRAHAM (1992), bervariasi dari 9 – 91%. Tidak seperti halnya pada semen, ovum yang difertilisasi tidak dapat disimpan karena ukuran yang besar pada kuning telur dan struktur yang komplek. Oleh sebab itu, preservasi materi genetik unggas betina masih belum memungkinkan.
Kriopreservasi primordial germ cells
(PGCs), yang merupakan progenitor dari jantan dan betina atau sel telur dan sperma, merupakan cara alternatif untuk menyimpan materi genetik, baik pada unggas jantan maupun betina. Pada ayam, PGCs dapat dipanen dan disimpan melalui teknik kriopreservasi. Langkah pertama yang penting dalam kegiatan ini adalah bagaimana memanen dan memurnikan PGC. ZHAO dan KUWANA (2003) berhasil memanen, mengidentifikasi, dan memurnikan PGCs pada ayam dengan menggunakan metode Nycodenz density gradient centrifugation (NGC). Teknik ini efisien dan mampu menghasilkan PGCs dalam jumlah banyak dalam waktu yang relatif singkat. Metode pemurnian PGCs ini dimulai dari pengumpulan darah embryo ayam umur 56 jam (stage 14 – 16 menurut HUMBERGER dan HAMILTON, 1951). Setelah itu, melalui berbagai tahapan pengenceran menggunakan berbagai konsentrasi larutan Nycodenz dan tingkatan sentrifuge, maka akan diperoleh PGCs yang cukup banyak dan bersih dari sel darah merah. Metode ini telah digunakan sebagai stándar pemurnian PGCs di beberapa laboratorium.
Penelitian ini bertujuan untuk melakukan suatu metode memurnikan PGCs pada ayam lokal dengan menggunakan metode Nicodenz density gradient centrifugation (NGC) baku mengacu metode NGC Zhao dan Kuwana.
MATERI DAN DAN METODE Pelatihan pengumpulan darah
Telur-telur dari ayam lokal yang fertil digunakan untuk latihan pengumpulan darah. Telur yang digunakan diperoleh dari kandang ayam di Balai Penelitian Ternak, Ciawi. Ayam diinseminasi dua kali seminggu untuk menghasilkan telur fertil dalam penelitian ini. Sekitar 600 butir telur tetas ayam digunakan dalam penelitian ini. Jumlah telur yang dipecah untuk sekali observasi adalah 25 butir, observasi dilaksanakan satu minggu dua kali selama 7 minggu. Telur diinkubasi pada suhu 38,5°C dan kelembaban 65% selama 53 jam menggunakan inkubator portabel model P008B
Showa Furanki Incubator Laboratory, untuk mendapatkan embrio pada tahap 13 – 16 (HUMBERGER dan HAMILTON, 1951). Telur dipecahkan, seluruh isinya ditampung dalam cawan petridish dan darah keseluruhan dari embrio (Gambar 1.) dikumpulkan dari terminal vein atau dorsal aorta menggunakan fine glass micropipette di bawah mikoskop. Darah dikumpulkan dari sekitar 30 embrio untuk setiap observasi, dikumpulkan dalam sebuah 1,5 ml microtube yang telah diisi 0,5 ml media 1% phosphate buffer (PBS).
Gambar 1. Telur setelah dipecahkan
Parameter yang diukur
1. Tingkat keberhasilan pengumpulan darah embrio
2. Fertilitas, tahap perkembangan embrio 3. Jumlah PGCs yang didapat
Gambar 2. Embrio ayam umur 53 jam inkubasi stage 13 – 15 dilihat dengan menggunakan mikroskop
Pemanenan PGCs
Dalam penelitian ini pemanenan PGCs dilakukan dengan dua metode, yakni metode
Nycodenz gradient gradient centrifugation
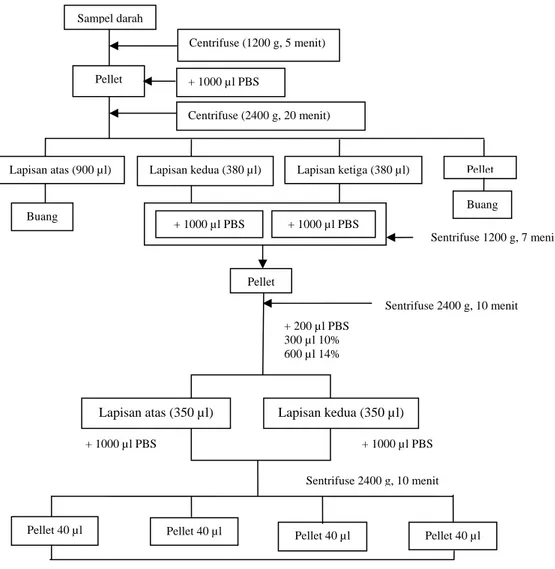
(NGC) yang baku dan metode NGC yang dimodifikasi. Hal ini dilakukan karena dengan menggunakan metode yang baku, tidak berhasil diperoleh PGCs pada kondisi laboratorium Balitnak, Ciawi. Setelah dilakukan modifikasi maka diperoleh PGCs walaupun masih dalam jumlah sedikit. Berikut ini disajikan kedua metode pemurnian PGCs (Gambar 2).
Gambar 2. Metode pemurnian PGC dengan teknik NGC baku Zhao dan Kuwana Sampel darah Pellet Centrifuse (1200 g, 5 menit) + 1000 µl PBS Centrifuse (2400 g, 20 menit) Lapisan atas (900 µl) Buang
Lapisan kedua (380 µl) Lapisan ketiga (380 µl) Pellet Buang + 1000 µl PBS + 1000 µl PBS Sentrifuse 1200 g, 7 menit Pellet Sentrifuse 2400 g, 10 menit + 200 µl PBS 300 µl 10% 600 µl 14%
Lapisan atas (350 µl) Lapisan kedua (350 µl)
+ 1000 µl PBS + 1000 µl PBS
Sentrifuse 2400 g, 10 menit
Pellet 40 µl Pellet 40 µl Pellet 40 µl Pellet 40 µl
HASIL DAN PEMBAHASAN Persentase fertilitas, tahapan
perkembangan embrio, dan tingkat keberhasilan pengumpulan darah embrio
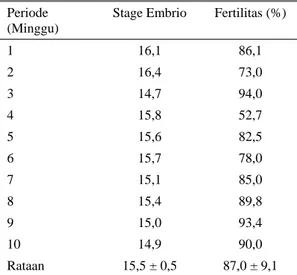
Tingkat fertilitas telur tetas dan tahapan perkembangan embrio selama penelitian disajikan pada Tabel 1.
Tabel 1. Tingkat fertilitas telur tetas dan tahapan perkembangan embrio pada pengumpulan darah embrio ayam lokal umur 56 jam pada stage antara 12 – 18
Periode (Minggu)
Stage Embrio Fertilitas (%)
1 16,1 86,1 2 16,4 73,0 3 14,7 94,0 4 15,8 52,7 5 15,6 82,5 6 15,7 78,0 7 15,1 85,0 8 15,4 89,8 9 15,0 93,4 10 14,9 90,0 Rataan 15,5 ± 0,5 87,0 ± 9,1
Persentase fertilitas telur tetas selama penelitian bervariasi dari 52,7% sampai 94,0%
dengan rataan sebesar 87,0%. Pada kegiatan ini tahapan perkembangan embrio bervariasi dari tahap 14,7 sampai 16,4, dengan rataan tahap 15,5. Hasil ini tidak jauh dengan hasil yang didapat SETIOKO et al. (2007), bahwa rataan tahapan perkembangan embrio berada pada tahap 14,9. Pada tahap ini terdapat kandungan PGCs paling tinggi dalam darah. Kandungan PGCs tertinggi dalam sirkulasi darah diperoleh dari embrio pada tahap 13 – 16 (TAGAMI dan KAGAMI, 1998; ZHAO dan KUWANA, 2003). TAJIMA et al. (1999) melaporkan bahwa konsentrasi PGCs tertinggi pada tahap 14 dan kemudian akan menurun. Namun konsentrasi PGC antar telur sangat bervariasi terutama pada tahap 13, 14, 15 dan 16, dan hal ini sedang diteliti. Penelitian terakhir mengatakan bahwa variasi PGC yang tinggi ini mungkin disebabkan oleh perbedaan individu diantara produksi telur induk. Fertilitas dan perkembangan embrio merupakan dua parameter penting dalam kegiatan pengumpulan PGCs dari darah embrio ayam. Fertilitas yang rendah dan perkembangan embrio yang lambat dapat mempengaruhi hasil yang akan didapat.
Tingkat keberhasilan pengumpulan darah embrio berkisar dari 69,1% sampai 100% dengan rataan 87% (Gambar 3). Tingginya tingkat keberhasilan pengumpulan darah embrio pada penelitian ini salah satunya disebabkan sudah dilakukannya pelatihan cara pengumpulan darah embrio sampai ke tingkat terampil. 0 20 40 60 80 100 120 1 2 3 4 5 6 7 8 9 10 Periode koleksi T ingk at K eber has ilan (% )
Pemanenan PGCs dengan metode Nycodenz
density gradient centrifugation (NGC) baku
Zhao dan Kuwana
Pemanenan PGCs dilakukan dengan menggunakan teknik Nycodenz density gradient centrifugation (NGC)(modifikasi dari ZHAO dan KUWANA, 2003). Persiapan dalam pemurnian PGCs ini sudah berhasil. Tahap awal kegiatan pemanenan belum didapatkan PGCs dan masih ada kontaminasi sejenis materi fibroid (fibroid materials) pada sampel yang diperoleh. Kontaminasi tersebut kemungkinan berasal dari FBS (Foetal Bovine Serum) yang dibeli. Pengalaman menunjukkan bahwa sekalipun FBS sudah difilter dengan diameter 0,22 mikron, masih ada materi fibroid yang tersisa, khususnya pada tetes terakhir (last drops). Untuk itu, diupayakan menggunakan filter yang bagus dan dilakukan beberapa kali sampai betul-betul bebas dari kontaminasi, sebab bila tidak, maka sampel tidak dapat disimpan, atau kualitas PGC akan sangat rendah dan angka kematian akan tinggi bila disimpan pada suhu rendah, sehingga PGC yang ada tidak dapat digunakan sebagai sampel untuk dibekukan. Selanjutnya setelah beberapa kali dicoba, akhirnya berhasil didapatkan dan dikumpulkan PGCs pada ayam lokal seperti tertera pada Tabel 2.
Tabel 2 menunjukkan bahwa rataan jumlah PGCs pada ayam lokal hasil penelitian sebesar 28,60 ± 6,41 sel per embrio dengan rataaan hasil tertinggi mencapai 71,00 ± 9,9 sel per embrio dan hasil terendah 8,96 ± 1,3 sel per embrio. Hasil ini masih lebih rendah dari hasil beberapa penelitian lainnya yang telah dilaporkan pada ayam ras. NAKAMURA et al.
(2007) melaporkan bahwa jumlah PGCs ayam Rhode Island Red (RIR) yaitu 67 – 73 sel per embrio ada pada stage 15, sedangkan NIRASAWA (2007, komunikasi pribadi) menyampaikan bahwa jumlah PGCs pada sirkulasi darah embrio ayam White Leghorn (WL) stage 15 adalah sekitar 100 sel. Selain itu, juga informasi tentang jumlah PGCs pada embrio ayam lokal masih belum dilaporkan sebelumnya. Hasil penelitian juga menunjukkan kisaran variasi yang besar. Hasil yang dicapai akan bergantung kepada: (1) kondisi laboratorium. Hal ini didukung oleh pernyataan peneliti Jepang bahwa masing-masing laboratorium memiliki karakter yang
berbeda-beda sehingga perlu dilakukan modifikasi dalam teknik dan metode (TAGAMI, 2007; NAKAMURA, 2008; komunikasi pribadi), (2) strain ayam yang digunakan yakni ayam lokal kemungkinan hanya memiliki PGC dalam jumlah relatif sedikit. Hal ini diperkuat oleh pendapat peneliti Jepang bahwa setiap strain ayam memiliki jumlah PGC yang berbeda-beda. Beberapa strain ayam hanya memiliki sedikit jumlah PGC dalam embrio darah. Idealnya kita harus memeriksa atau mengecek jumlah PGC dalam embrio darah dari strain ayam yang kita gunakan (TAGAMI, 2008 komunikasi pribadi), dan (3) Ketepatan kecepatan dalam penggunaan centrifuse terutama mengenai konfersi dari rpm ke G. Untuk itu perlu beberapa uji coba tentang kecepatan dan waktu centrifugasi.
Tabel 2. Jumlah PGCs per embrio dengan modifikasi metode Nycodenz density gradient centrifugation (NGC) pada ayam lokal Periode pengumpulan PGCs Rataan Stdev 1 15,24 3,6 2 8,96 1,3 3 17,36 4,2 4 11,27 0,7 5 26,00 9,5 6 71,00 9,9 7 57,27 18,8 8 27,74 3,2 9 40,39 8,7 10 14,41 4,9 11 31,88 2,6 12 41,54 9,3 13 34,09 15,8 14 16,34 0,9 15 10,83 2,5 Rataan total 28,60 6,41 KESIMPULAN
Kegiatan pemanenan PGCs dengan menggunakan metode NGC yang baku Zhao dan Kuwana telah berhasil mengumpulkan
PGCs pada ayam lokal, walaupun hasilnya masih bervariasi.
Perlu dilakukan penelitian lanjutan untuk mendapatkan metode yang lebih baik, sehingga diperoleh jumlah PGCs yang lebih banyak, yaitu dengan cara (1) mengatur centrifuse agar sesuai dengan standar yang ada, dan (2) mencari fraksi yang terbanyak PGCs-nya.
DAFTAR PUSTAKA
HAMBURGER,V.and H.L.HAMILTON. 1951. A series of normal stages in the development of the chick embrio. J. Morphol. 8: 49 – 92.
HAMMERSTEDT, R.H. and J.K. GRAHAM. 1992. Cryopreservation of poultry sperm: The enigma of glycerol. Cryobiology 29: 26 – 38. LAKE,P.E. and J.M.STEWART. 1978. Preservation of
fowl semen in liquid nitrogen – an improved method. British Poult. Sci. 19: 187 – 194. MAZUR,P. 1985. Basic Concept in Freezing Cells.
Proc. of the First International Conference on Deep Freezing of Boar Semen, Uppsala, 1985. pp. 91 – 111.
NAKAMURA, Y., Y. YAMAMOTO, F. USUI, T. MUSHICA,T.ONO,A.R.SETIOKO,K.TAKEDA, K. NIRASAWA, H. KAGAMI and T. TAGAMI. 2007. Migration and Ploriferation of Primordial Germ Cells in theEearly Chicken Embryo. Poult. Sci. 86(10).
SETIOKO,A.R.,T.TAGAMI and K.NIRASAWA. 2007. Cryopreservation of Primordial Germ Cells (PGCSs) From White Leghorn Embryo Using Different Cryoprotectant. J. Poult. Sci. 44(1) Januari 2007.
TAGAMI, T. and H. KAGAMI. 1998. Development origin of Avian primordial germ cells and its unique differentiation in the gonads of mixed-sex chimeras. Moleculae Reproduction and development 50: 370 – 376.
TAJIMA,A.,M.NAITO,Y.YASUDA and T.KUWANA. Production of germ line chimeras by transfer of cryopreserved gonadal primordial germ cells in chicken. J. Experimental Zoology 280: 265 – 267.
ZHAO,D.F. and T.KUWANA. 2003. Purification of avian circulating primordial germ cells by Nycodenz density gradient centrifugation. British Poult. Sci. 44: 30 – 35.