RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
Nama Sekolah : SMA Negeri 1 Indralaya Utara Mata Pelajaran : Kimia
Kelas/Semester : XI/1
Topik : Kesetimbangan
Alokasi Waktu: 6 x 45 menit (3 kali pertemuan)
A. Standar Kompetensi :
a. Memahami kinetika reaksi kesetimbangan kimia, b. faktor-faktor yang mempengaruhinya,
c. penerapannya dalam kehidupan sehari-hari dan industri. B. Kompetensi Dasar :
a. Menjelaskan tentang kesetimbangan kimia
b. Mengetahui faktor-faktor yangmemengaruhi pergeseran arah kesetimbangan denganmelakukan percobaan
c. Menentukan contoh kestimangan kimia dalam kehidupan sehari-hari
C. Indikator :
1. Menjelaskan pengertian kesetimbangan kimia.
2. Menjelaskan faktor-faktor yang memengaruhi pergeseran kesetimbangan berdasarkan asas Le Chatelier.
3. Menerapkan asas Le Chatelier melalui percobaan. 4. Menghitung tetapan kesetimbangan.
5. Menganalisis pengaruh perubahan suhu, konsentrasi, tekanan dan volum pada pergeseran kesetimbangan melalui percobaan.
6. Meramalkan arah pergeseran kesetimbangan dengan menggunakan azas le Chate D. Tujuan Pembelajaran
1. Siswa dapat menjelaskan pengertian kesetimbangan kimia.
2. Siswa dapat menjelaskan faktor-faktor yang mempengaruhi pergeseran kesetimbangan berdasarkan asas Le Chatelier.
3. Siswa dapat menerapkan asas Le Chatelier melalui percobaan. 4. Siswa dapat menghitung tetapan kesetimbangan.
5. Siswa dapat Menganalisis pengaruh perubahan suhu, konsentrasi, tekanan dan volum pada pergeseran kesetimbangan melalui percobaan.
E. Materi Pembelajaran
Reaksi kimia terjadi sebagai akibat tumbukan antara molekul-molekul. Jumlah tumbukan antara molekul-molekul per satuan waktu disebut frekuensi tumbukan. Besar frekuensi tumbukan ini dipengaruhi oleh berbagai faktor antara lain, konsentrasi, suhu, dan luas permukaan bidang sentuh.
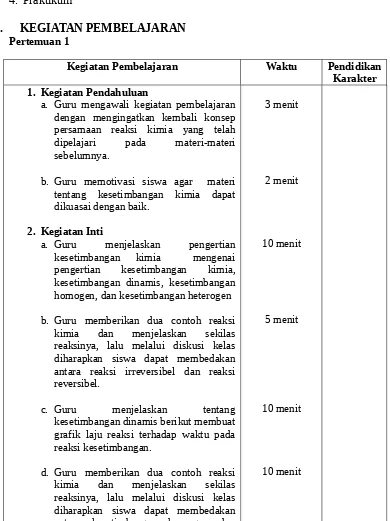
a. Guru mengawali kegiatan pembelajaran dengan mengingatkan kembali konsep persamaan reaksi kimia yang telah dipelajari pada materi-materi sebelumnya.
b. Guru memotivasi siswa agar materi tentang kesetimbangan kimia dapat dikuasai dengan baik.
2. Kegiatan Inti
a. Guru menjelaskan pengertian kesetimbangan kimia mengenai pengertian kesetimbangan kimia, kesetimbangan dinamis, kesetimbangan homogen, dan kesetimbangan heterogen
kesetimbangan heterogen.
e. Guru memberikan kesempatan kepada siswa untuk mengajukan pertanyaan seputar materi kesetimbangan kimia yang telah diajarkan.
f. Guru memandu siswa untuk melakukan tanya jawab mengenai kesetimbangan kimia. reaksi reversibel dan reaksi irreversibel; kesetimbangan dinamis; serta kesetimbangan homogen dan heterogen.
b. Guru meminta siswa untuk melanjutkan latihan di rumah.
a. Guru mengawali kegiatan pembelajaran dengan membahas pekerjaan rumah yang telah ditugaskan sebelumnya.
b. Guru terus memotivasi siswa mengenai manfaat mempelajari kesetimbangan kimia.
2. Kegiatan Inti
a. Guru menjelaskan secara singkat praktikum yang akan dilakukan, praktikum untuk menguji kebenaran asas Le Chatelier).
b. Masing-masing kelompok diminta mengambil zat-zat kimia yang dibutuhkan, yaitu air suling, kristal Na2HPO4, larutan KSCN, dan larutan FeCl3; serta menyiapkan alat-alatnya, yaitu tabung reaksi, pipet, gelas kimia, tabung ukur, dan alat pengaduk.
c. Guru membimbing siswa dalam mengerjakan percobaan sesuai dengan
langkah-langkah kegiatan yang telah diberikan.
d. Selama siswa melakukan praktikum, guru melakukan penilaian proses.
e. Setelah itu guru meminta siswa untuk menghentikan percobaannya, lalu diadakan diskusi bersama.
f. Masing-masing perwakilan kelompok diminta menyampaikan hasil percobaannya secara lisan di depan teman-temannya. Sementara itu siswa yang lain boleh memberikan tanggapan.
g. Bila ada percobaan yang gagal, maka
i. Guru meminta siswa untuk melanjutkan kerja kelompoknya dengan menjawab pertanyaan dan tugas yang ada di lembar kegiatan ilmiah .
3. Kegiatan Penutup
Guru membimbing siswa dalam menyimpulkan hasil percobaan yang telah dilakukan.
a. Guru mengawali kegiatan pembelajaran dengan mengingatkan kembali percobaan yang telah dilakukan pada faktor-faktor yang memengaruhi pergeseran kesetimbangan mengenai
4 menit
1 menit
pengaruh suhu, konsentrasi, pengaruh tekanan dan volum terhadap pergeseran kesetimbangan).
b. Guru membagi siswa menjadi 4 kelompok. Masing-masing kelompok diberikan waktu 15 menit untuk berdiskusi tentang salah satu salah faktor yang memengaruhi pergeseran kesetimbangan.
c. Setelah itu masing-masing kelompok diberi kesempatan untuk mempresentasikan hasil diskusinya di depan semua siswa di kelas XI.
d. Guru memandu siswa untuk melakukan tanya jawab.
e. Guru menerangkan lebih lanjut tentang pengaruh suhu, konsentrasi, tekanan, dan volum terhadap pergeseran kesetimbangan.
3. Kegiatan Penutup
a. Siswa dengan bimbingan guru membuat satu kesimpulan tentang faktor-faktor yang memengaruhi pergeseran kesetimbangan.
H. Media, Alat dan Sumber Pembelajaran : 1. Media : LKS,
2. Alat : Papan Tulis, Spidol, gelas ukur, beker gelas, pipet tetes dan stopwatch Bahan : Larutan HCl 1 M & 2 M, Larutan Na2S2O3 0,1 M dan 0,2 M, Kertas yang
diberi tanda X
3. Sumber Pembelajaran :
A. Buku-Buku Kimia SMA Kelas XI
Purba, Michael dan Sunardi. 2012. Kimia 2 untuk SMA/MA Kelas XI. Jakarta: Penerbit Erlangga.
Sunardi dan Kurniawati, Dini. 2012. Kimia untuk SMA/MA Kelas XI. Bandung: PT SEWU.
Anonim. 2012. Kesetibangan Kimia. (Online)
(https://pasihahtetrasianoferat.wordpress.com/kelas-xi/kesetimbangan-kimia/). Diakses 21 September 2015.
Dwi, Krisna. 2012. Kesetimbangan Kimia. (Online) kimia-berbasis-scientific-approach/). Diakses 21 September 2015.
I. PENILAIAN
1. Teknik penilaian : Tes tertulis dan observasi 2. Bentuk Instrumen : Tes pilihan ganda dan uraian 3. Pedoman penskoran : Σ skor yang diperolehskor maksimal x100 4. Contoh Instrumen
a. Pilihan Ganda
1. Kesetimbangan dinamis adalah satu keadaan dari sistem yang menyatakan .... A. jumlah mol zat-zat pereaksi sama dengan jumlah mol zat-zat hasil reaksi
B. jumlah partikel setiap zat yang bereaksi sama dengan jumlah partikel yang terbentuk C. secara makroskopis reaksi berlangsung terus
D. reaksi terus berlangsung dalam dua arah yang berlawanan secara mikroskopis E. zat-zat hasil reaksi tidak bereaksi lebih lanjut karena telah mencapai kesetimbangan
2. Di antara reaksi kesetimbangan di bawah ini yang kesetimbangannya bergeser ke kanan jika tekanan diperbesar adalah ....
A. 2HI(g) H2 (g) + I2 (g) B. N2O4 (g) 2NO2 (g)
C. CaCO3 (s) CaO(s) + CO2 (g) D. 2NO(g) + O2 (g) 2NO2 (g) E. S(s) + O2 (g) SO2 (g)
3. Larutan FeCl3 bereaksi dengan KSCN membentuk ion Fe(SCN)2+ yang bewarna merah menurut persamaan:
Jika pada suhu tetap sistem ini ditambah air, maka ....
A. kesetimbangan akan bergeser ke kanan, warna makin merah, dan harga Kc bertambah B. kesetimbangan bergeser ke kiri, warna makin merah, dan harga Kc berkurang
D. kesetimbangan bergeser ke kiri, warna memudar, dan harga Kc tetap E. kesetimbangan tidak bergeser
4. Untuk reaksi N2 (g) + 3H2 (g) 2NH3 (g) ∆H = – 22 kkal, konstanta kesetimbangan mengecil jika ....
A. temperatur diturunkan B. temperatur dinaikkan C. tekanan diperbesar D. tekanan tetap E. gas NH3 ditambah
5. Pada suhu tertentu, dalam bejana 1 liter terdapat kesetimbangan: 2SO3 (g) 2SO2 (g) + O2 (g)
Semula terdapat 0,5 mol SO3 dan setelah tercapai kesetimbangan perbandingan mol SO3 dengan mol O2 adalah 4 : 3, harga Kc = ....
A. 6.00 D. 0.30
B. 2.25 E. 0.23
C. 0.33
b. Uraian
1. Buktikan bahwa harga Kc untuk reaksi kesetimbangan N2 (g)+ 2O(g) 2NO2 (g) adalah K1 × K2, jika diketahui reaksi:
2NO(g) + O2 (g) 2NO2 (g) Kc = K1 N2(g) + O2 (g) 2NO(g) Kc = K2
2. Padatan kalsium klorida dapat bereaksi dengan air membentuk reaksi kesetimbangan sebagai berikut.
CaCl2 (s) + 6H2O(g) CaCl2.6H2O(s)
Jika harga Kp reaksi tersebut 1,28 × 1085 pada suhu 298K, hitung tekanan parsial uap air pada reaksi tersebut!
3. Dalam tabung terdapat N2 0,02 M, H2 0,06 M dan NH3 0,01 M. Akankah amonia dibentuk atau diuraikan? Jika campuran menuju kesetimbangan pada suhu 400oC, dan persamaan kimia reaksi tersebut adalah sebagai berikut.
N2 (g) + 3H2 (g) 2NH3 (g) Kc = 0,5
4. Pada suhu 275oC tetapan kesetimbangan untuk reaksi NH
4Cl(s) NH3 (g) + HCl(g) adalah 1,04 × 10–2, berapa tekanan parsial gas NH
3 dan HCl pada suhu yang sama? 5. Bagaimana pengaruh penurunan tekanan untuk reaksi-reaksi berikut?
a. 2H2S(g) 2H2 (g) + S2 (g) b. CO(g) + Cl2 (g) COCl2 (g)
,
Kepala Sekolah guru Mapel Kimia
FITRIYANI
Lampiran 1. Lembar Kerja Siswa
Kelompok :
Kelas :
Anggota : 1. 4.
TETAPAN KESETIMBANGAN
Susunan komposisi suatu kesetimbangan dapat berubah bergantung pada kondisi reaksi. Pada percobaan berulang-ulang dengan suhu tetap akan dihasilkan perbandingan konsentrasi yang tetap pul. Pada tahun 1864 Cato Maximillian Gulberg dan Peter Wage menemukan adanya suatu hubungan yang tetap antara konsentrasi komponen dalam kesetimbangan, yang
selanjutnya disebut Hukum Kesetimbangan atau Hukum Aksi Massa.
(MENGAMATI)
Perhatikan tabel berikut dengan teliti!
Tabel Susunan kesetimbangan reaksi pembentukan asam iodida pada suhu 445oC dalam
volume ruangan 0,8 L berdasarkan reaksi berikut.
H2(g) + I2(g) 2HI(g)
INSTRUKSI
1. Setiap siswa harus membaca LKS ini dengan seksama
dan mengerjakan pertanyaan-pertanyaan terkait sesuai
dengan instruksi yang diberikan oleh guru.
2.
Apabila terdapat hal yang tidak dimengerti atau sulit
dipahami mintalah bantuan kepada guru untuk
Percobaa n
Jumlah mol × 103
(keadaan awal)
Jumlah mol × 103
(keadaan setimbang)
Konsentrasi M × 103
(keadaan setimbang) K
H2 I2 HI H2 I2 HI [H2] [I2] [HI]
1 1,50 1,50 - 0,330 0,330 2,34 0,412 0,412 2,92 50,
2
2 - - 1,50 0,165 0,165 1,17 0,206 0,206 1,46 50,
2
3 1,50 1,50 1,50 0,495 0,495 3,51 0,619 0,619 4,39 50,
2
Berdasarkan tabel di atas, jawablah pertanyaan-pertanyaan berikut dengan bertanggung jawab!
1. Apakah yang dapat kalian temukan berdasarkan tabel di atas?
Jawab:... ... ... ... ... (MENANYA)
1. Tuliskan hal-hal yang tidak kalian pahami berdasarkan pengamatan yang telah kalian lakukan (dalam bentuk pertanyaan)!
Jawab:... ... ... ... ...
(MENCOBA)
Perbandingan tertentu [HI] terhadap [H2] dan [I2] akan memberikan hasil yang konstan untuk
Berdasarkan informasi konsentrasi saat setimbang pada tabel 1 di atas, coba kalian rumuskan persamaan lain yang menunjukkan harga perbandingan dari konsentrasi-konsentrasi dalam kesetimbangan seperti contoh, sampai didapatkan harga K yang tetap (50,2).
Mari menghitung!
Percobaa n
Coba :
[
HI]
[
H2] [
I2]
[H2]×[I2][HI]2
Coba : 2×
[
HI]
[
H2] [
I2]
Coba : Coba :
1. 2. 3.
1. Berdasarkan perhitungan yang kalian lakukan, kombinasi manakah dalam tabel di atas yang hasil perbandingannya menunjukkan harga konstan? Tuliskan persamaannya! Jawab:... ... ... ... ...
(MENALAR)
1. Apakah hasil perbandingan yang menunjukkan harga konstan dipengaruhi oleh koefisien reaksi? ... Dalam perhitungan, koefisien reaksi digunakan sebagai
... Persamaan inilah yang disebut dengan konstanta/tetapan
Contoh:
kesetimbangan (Kc). Jadi, tetapan kesetimbangan
adalah ... ... ... ... ... ...
2. Perhatikan reaksi berikut:
aA + bB cC + dD Tuliskan bagaimana tetapan kesetimbangannya!
Jawab:
Kc=
Persamaan inilah yang ditemukan oleh Cato Maximillian Gulberg dan Peter Wage pada tahun 1864 yang selanjutnya disebut Hukum Kesetimbangan atau Hukum Aksi Massa. Jadi, Hukum Kesetimbangan atau Hukum Aksi Massa berbunyi:
... ... ... ... ...
(MEMBENTUK JEJARING)
Presentasikan hasil diskusi kelompok anda di depan kelas!
Kesetimbangan Kimia
Sebagian besar reaksi yang ada merupakan reaksi kesetimbangan, maka sangat penting untuk memahami tentang reaksi kesetimbangan. Dengan pemahaman reaksi kesetimbangan akan membantu untuk menyelesaikan perhitungan yang berhubungan dengan prinsip kesetimbangan kimia tanpa harus menghafalkan rumus seperti tentang pH asam dan basa lemah, hidrolisis, buffer, kesetimbangan kelarutan, pembentuka kompleks dll. Suatu sistem dikatakan setimbang jika dua proses yang berlawanan terjadi dengan laju yang sama atau dengan kata lain tidak terjadi perubahan dalam sistem yang setimbang. Salah satu indikator saat terjadi kesetimbangan adalah tidak terjadi perubahan konsentrasi semua komponen yaitu reaktan dan produk.
Sebagai contoh adalah pelarutan padatan, sampai pada titik laju padatan yang terlarut sama dengan padatan yang mengendap saat konsentrasi larutan jenuh tercapai (tidak ada perubahan konsentrasi). Kesetimbangan kimia adalah penting untuk menjelaskan peristiwa yang banyak terjadi secara alamiah dan berperan penting dalam kaidah-kaidah pada proses industri kimia.
Konsep Kesetimbangan
Pada keadaan kesetimbangan kecepatan pembentukan produk sama dengan kecepatan penguraian produk (laju reaksi ke kanan = laju reaksi ke kiri).
Reaksi ke kanan : A → B Rate = kf[A]. kf : konstanta laju reaksi ke kanan
Reaksi balik : B → A Rate = kr[B]. kr : konstanta laju reaksi ke kiri
Saat A bereaksi membentuk senyawa B, konsentrasi A berkurang sedangkan konsentrasi B bertambah.
Pada keadaan kesetimbangan kf [A] = kr [B]
Laju reaksi laju reaksi balik ke kanan ke kiri
Penulisan persamaan adalah
[B]/[A] = kf/kr = a konstan Kedua proses terjadi pada kecepatan yang sama
A D B
Untuk memahami tentang konsep kesetimbangan kimia perhatikan pembahasan berikut ini.
Percobaan 1.
Masing-masing sebanyak 0,00150 mol H2 dan I2 dibiarkan bereaksi membentuk HI(g)
Konsentrasi H2(g) dan I2(g) akan berkurang sedangkan HI(g) bertambah hingga tercapai
kesetimbangan semua komponen H2(g), I2(g) dan HI(g) konsentrasinya tidak berubah.
Reaksi ke depan: H2(g) + I2(g) → 2HI(g)
Reaksi balik: 2HI(g) → H2(g) + I2(g)
Penulisan reaksi kesetimbangan : H2(g) + I2(g) 2 HI⇌ (g)
Setelah mencapai 0,00234 mol jumlah HI tidak berubah
Percobaan 2
Dimulai dengan pereaksi HI(g) murni dengan konsentrasi 0,0015 M, dibiarkan terurai
membentuk H2(g) dan I2(g) sehingga mencapai kesetimbangan.
Percobaan 3
Menggambarkan keadaan ketiga pereaksi dengan konsentrasi yang sama 0,0015 M , dibiarkan mencapai kesetimbangan.
Dari tiga percobaan diatas didapat suatu hubungan yang menunjuk pada angka numeris tertentu
Untuk menetapkan nilai tetapan diatas, tiga percobaan tersebut dilakukan berulang-ulang pada 445oC dan memberikan hasil yang sama.
Contoh
Kc= [HI] 2
[H2][I2]=50,2 pada445
N2O4(g) D 2NO2(g)
Kc = [NO2]2 / [N2O4] = (0.0172)2 / 0.00140 = 0.211
Konsentrasi awal dan kesetimbangan (M) dari N2O4 and NO2 dalam fase gas pada
100oC adalah sbb:
Pe r
Konsentrasi awal (M) Konsentrasi pada kesetimbangan (M)
Kc
N2O4 NO2 N2O4 NO2
1 0.0 0.0200 0.00140 0.0172 0.211
2 0.0 0.0300 0.00280 0.0243 0.211
3 0.0 0.0400 0.00452 0.0310 0.213
4 0.0200 0.0 0.00452 0.0310 0.213
Tetapan Kesetimbangan Kc
Untuk reaksi umum,
aA + bB + … gG + hH + …
Rumus tetapan kesetimbangan berbentuk
Pembilang adalah hasil kali konsentrasi spesies-spesies yang ditulis disebelah kanan persamaan ([G], [H] …) masing-masing konsentrasi dipangkatkan dengan koefisien dalam persamaan reaksi yang setara (g, h …). Penyebut adalah hasil kali konsentrasi spesies-spesies yang ditulis disebelah kiri persamaan ([A]. [B] ..) dan setiap konsentrasi dipangkatkan dengan koefisien reaksinya (a, b, …). Nilai numerik tetapan kesetimbangan Kc sangat tergantung pada jenis reaksi dan suhu.
Contoh Soal
Tuliskan pernyataan kesetimbagan Kc untuk reaksi berikut : (a) 2O3(g)D3O2(g)
(b) 2NO(g) + Cl2D 2NOCl(g)
Jawab:
(a) Kc = [O2]3 / [O3]2
(b) Kc = [NOCl]2 / [NO]2[Cl 2]
Hubungan Tambahan Jika ada 3 reaksi berikut:
2SO2(g) + O 2(g) 2SO3(g) Kc(a) = 2,8 x 102 1000 K
Dalam menentukan nilai Kc maka setiap persaman reaksi kimia harus disetarakan.
Jika persamaannya dibalik, maka nilai Kc dari persamaan yang baru adalah kebalikan dari persamaan aslinya
Jika koefisien dalam persamaan setara dikalikan dengan faktor yang sama, maka tetapan kesetimbangan yang baru adalah akar berpangkat faktor tetapan kesetimbangan yang lama
Konstanta kesetimbangan hanya bergantung pada stoikiometri, tidak dipengaruhi oleh mekanisme.
Penggabungan Rumus Tetapan Kesetimbangan
Tetapan kesetimbangan untuk reaksi bersih (Kc (net) adalah Kc(1) x Kc(2), hasil kali
tetapan kesetimbangan untuk reaksi-reaksi terpisah yang digabungkan
Sering terjadi konsentrasi dari suatu reaksi kesetimbangan tidak diketahui. Namun jika konsentrasi salah satu spesies dalam system kesetimbangan diketahui maka dengan menggunakan persamaan reaksi yang ada, secara stoikiometri spesies yang lain dapat dihitung. Dengan tahapan berikut:
1. Buat tabel konsentrasi awal dan kesetimbangan dari semua spesies yang diketahui dalam system kesetimbangan.
2. Berdasarkan spesies-spesies dari kosentrasi awal dan kesetimbangan yang diketahui, hitung perubahan konsentrasi dalam system kesetimbangan.
3. Gunakan stoikiometri reaksi untuk menghitung perubahan konsentrasi untuk semua spesies dalam kesetimbangan.
4. Dari kosentrasi awal dan perubahan konsentrasinya, hitung konsentrasi dalam kesetimbangan. Nilai konsentrasi dalam kesetimbangan digunakan untuk menghitung konstanta kesetimbangan.
Contoh
1. Suatu campuran dari 5.000x10-3 mol H
2 dan 1.000x10-2 mol I2 ditempatkan dalam
wadah 5 L pada 448oC dan dibiarkan mencapai kesetimbangan. Analisis dari
campuran kesetimbangan menunjukkan konsentrasi HI adalah 1.87x10-3 M. Hitung
Kc pada 448oC reaksi berikut :
H2(g) + I2(g)D 2HI(g)
Jawab
Pertama, tabulasikan konsentrasi awal, perubahan dan kesetimbangan semua spesies dalam system setimbang seperti ditunjukkan pada tabel berikut:
Dalam contoh ini konsentrasi H2 dan I2 harus dihitung:
[H2]awal = 5.000x10-3 mol /5.000 L = 1.000x10-3 M
[I2]awal = 1.000x10-2 mol / 5.000 L = 2.000x10-3 M
Kemudian masukkan dalam tabel berikut:
H2(g) + I2(g) D 2HI(g)
Awal 1.000x10-3 M 2.000x10-3 M 0 M
Perubahan
Kedua hitung perubahan konsentrasi HI dengan menggunakan nilai awal dan kesetimbangan. Perubahannya adalah perbedaan antara nilai awal dan kesetimbangan yaitu 1.87x10-3 M.
Ketiga, gunakan stoikiometri dari persamaan reaksi untuk menghitung perubahan spesies yang lain. Dari persamaan kimia yang setimbang menunjukkan tiap 2 mol HI yang terbentuk membutuhkan 1 mol H2 dan 1 mol I2. Jadi jumlah H2 yang dibutuhkan
adalah :
1.87x10-3 mol HI / L ) (1 mol H
2 / 2 mol HI ) = 0.935x10-3 mol H2 / L
Dengan cara yang sama karena perbandingan I2 dan H2 sama maka jumlah I2 yang
dibutuhkan adalah 0.935x10-3 M
Keempat, hitung konsentrasi pada kesetimbangan, gunakan konsentrasi awal dan perubahan konsentrasi. Konsentrasi H2 kesetimbangan adalah konsentrasi awal
dikurangi konsentrasi yang dibutuhkan :
[H2] = 1.000x10-3 M – 0.935x10-3 M = 0.065x10-3 M
Konsentrasi I2 pada kesetimbangan :
[I2] = 2.000x10-3 M – 0.935x10 -3 M = 1.065x10-3 M
H2(g) + I2(g) D 2HI(g)
Awal 1.000x10-3 M 2.000x10-3 M 0 M
Perubahan – 0.935x10 -3 M – 0.935x10 -3 M 1.87x10-3 M
Kesetimbangan 0.065x10-3 M 0.065x10-3 M 1.87x10-3 M
Dari konsentrasi kesetimbangan masing-masing reaktan dan produk, gunakan persamaan kesetimbangan untuk menghitung konstanta kesetimbangan, Kc.
Kc = [HI]2 / [H2][I
2] = (1.87x10-3)2 / (0.065x10-3)(1.065x10-3) = 51
Untuk mempermudah dalam melakukan perhitungan kesetimbangan sebaiknya lakukan langkah diatas cukup menggunakan tabel-tabel seperti pada contoh.
2. 1 L tabung diisi dengan 1,00 mol H2 dan 2,00 mol I2 pada 448oC. Konstanta
kesetimbangan Kc reaksi adalah 50,5. H2(g) + I2(g)D 2HI(g) Kc = 50.5.
Jawab
[H2] = 1.000M, [I2] = 2.000 M, [HI] = 0
H2(g) + I2(g) D 2HI(g)
Awal 1.000 M 2.000 M 0 M
Perubahan - x M - x M +2x M Kesetimbangan (1.000 – x) M (2.000 –x) M 2x M
Kc = [HI]2 / [H2][I2] = (2x)2 / (1.000-x)(2.000-x) = 50.5 4x2 = 50.5(x2 – 3.000x + 2.000) 46.5x2 – 151.5 x + 101.0 = 0 Penyelesaian persamaan kuadrat :
x = -(-151.5) ± √(-151.5)2 -4(46.5)(101.0) / 2(46.5) = 2.323 atau 0.935
Substitusikan nilai x = 2.323, kedalam pernyataan konsentrasi kesetimbangan , konsentrasi H2 dan I2 bernilai negatif. Masukkan nilai x = 0.935 diperoleh :
[H2] = 1.000 – x = 0.065 M
[I2] = 2.000 – x = 1.065 M
[HI] = 2x = 1.870 M
Cek kembali nilai yang diperoleh dengan memasukkan angka tersebut kedalam pernyataan Kc :
Kc = [HI]2 / [H2][I2] = (1.870)2 / (0.065)(1.065) = 51
Soal latihan
1. Untuk reaksi NH3 ½ N⇌ 2 + 3/2 H2 Kc = 5,2 x 10-5 pada 298 K.
Berapakah nilai Kc pada 298 K untuk reaksi: N2 + 3H2 2NH⇌ 3
2. Senyawa ClF3 disiapkan melalui 2 tahap reaksi fluorinasi gas klor sebagai berikut
(i) Cl2(g) + F2(g) ClF⇌ (g)
Seimbangkan masing-masing reaksi diatas dan tuliskan reaksi overallnya!
Buktikan bahwa Kc overall sama dengan hasil kali Kc masing-masing tahap reaksi ?
3. Dekomposisi HI dipelajari dengan mengijeksikan 2,50 mol HI kedalam 10,32-L tabung pada 25oC. Berapa [H
2] pada kesetimbangan untuk reaksi berikut :