1 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
PENENTUAN KADAR KLORIDA DALAM MgCl
2DENGAN ANALISIS GRAVIMETRI
Tujuan: Menerapkan analisis gravimetric dalam penentuan kadar klorida
Menentukan kadar klorida dalam MgCl2
Widya Kusumaningrum (1112016200005), Ipa Ida Rosita, Nurul Mu’nisah Awaliyah, Ummu Kalsum A.L, Amelia Rachmawati.
Program Studi Pendidikan Kimia
Jurusan Pendidikan Ilmu Pengetahuan Alam
Fakultas Ilmu Tarbiyah dan Keguruan
Universitas lslam Negeri Syarif Hidayatullah Jakarta
ABSTRAK
Ion klorida adalah anion yang dominan di perairan laut. Sekitar ¾ dari clorin (Cl2) yang terdapat di
bumi berada dalam bentuk larutan, sedangkan sebagian besar florin (F2) berada dalam bentuk batuan
mineral. Unsur klor dalam air terdapat dalam bentuk ion klorida (Cl-). Ion klorida adalah salah satu anion
anorganik utama yang ditemukan di perairan alami dalam jumlah lebih banyak daripada anion halogen lainnya. Klorida biasanya terdapat dalam bentuk senyawa natrium klorida (NaCl), kalium klorida (KCl) dan kalsium klorida (CaCl2). Pada percobaan ini menggunakan klorida dalam MgCl2. Klorida dalam MgCl2
dapat dicari dengan menggunakan prinsip analisis gravimetri dengan metode pengendapan. menggunakan metode endapan untuk membuat agar Cl- mengendap dalam AgCl kemudian dilakukan proses pengeringan dan penimbangan untuk mendapatkan massa akhir residu. Massa awal sebelum dipanaskan sebesar 3,47 gram dan massa setelah pengeringan 3,5267 gram. Massa yang hilang dari proses pengeringan dapat dihitung dari selisih massa pengeringan. dikurangi massa awal Dan didapatkan kadar klorida sebesar 1,6 gram.
2 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri I. PENDAHULUAN
Ion klorida adalah anion yang dominan di perairan laut. Sekitar ¾ dari clorin (Cl2) yang
terdapat di bumi berada dalam bentuk larutan, sedangkan sebagian besar florin (F2) berada
dalam bentuk batuan mineral. Unsur klor dalam air terdapat dalam bentuk ion klorida (Cl-). Ion klorida adalah salah satu anion anorganik utama yang ditemukan di perairan alami dalam jumlah lebih banyak daripada anion halogen lainnya. Klorida biasanya terdapat dalam bentuk senyawa natrium klorida (NaCl), kalium klorida (KCl) dan kalsium klorida (CaCl2). Klorida
tidak bersifat toksik pada makhluk hidup, bahkan berperan dalam pengaturan tekanan osmotik sel (Hefni Effendi, 2003: 135-136).
Kebanyakan klorida larut dalam air. Merkurium (I) klorida, Hg2Cl2¸ perak klorida,
AgCl, timbel klorida, PbCl2¸ (yang ini larut sangat sedikit dalam air dingin, tetapi mudah
larut dalam air mendidih), tembaga (I) klorida, CuCl, bismut oksiklorida, BiOCl, stibium oksiklorida, SbOCl, dan merkurium (II) oksiklorida Hg2OCl2, tak larut dalam air (G. Svehla,
1985: 345).
Anion Cl- dengan larutan perak nitrat AgNO3 membentuk endapan perak klorida ,
AgCl, yang seperti dadih dan putih. Ia tak larut dalam air dan dalam asam nitrat encer tetapi larut dalam larutan amonia encer dan dalam larutan-larutan kalium sianida dan tiosulfat (G. Svehla, 1985: 346).
Ion klorida terdapat dalam bentuk senyawa. Banyak senyawa kimia dalam kehidupan sehari-hari yang mengandung klorida. Kadar klorida tiap senyawa berbeda-beda. Untuk menentukan kadar klorida pada garam magnesium klorida (MgCl2) dapat menggunakan
3 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
Analisis gravimetri adalah proses isolasi dan pengukuran berat suatu unsur atau senyawa tertentu. Bagian terbesar dari penetuan secara analisis gravimetri meliputi transformasi unsur atau radikal ke senyawa murni stabil yang dapat segera diubah menjadi bentuk yang dapat ditimbang dengan teliti. Berat unsur dihitung berdasarkan rumus senyawa dan berat atom unsur-unsur yang menyusunnya. Pemisahan unsur-unsur atau senyawa yang dikandung dilakukan dengan beberapa cara, seperti: metode pengendapan, metode penguapan, metode elektroanalisis, atau berbagai macam metode lainnya. Pada prakteknya, dua metode pertama adalah yang terpenting. Metode gravimetri memakan waktu cukup lama, adanya pengotor pada konstituen dapat diuji dan bila perlu faktor-faktor koreksi dapat digunakan (S.M Khopkar, 1990: 25).
Penentuan presentase zat yang terbentuk dapat dicari dengan menggunakan persamaan
S= berat sampel (gram): W= berat residu, P= presentase zat yang yang terbentuk (S.M Khopkar, 1990: 26).
II. ALAT, BAHAN, DAN PROSEDUR KERJA
4 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
Gelas ukur 1 buah
Langkah kerja:
1) Masukkan 10 ml larutan Mgcl2 ke dalam labu erlenmeyer.
2) Tambahkan indikator asam kromat.
3) Titrasi dengan larutan AgNO3 0,5 M, sampai endapan berwarna ungu.
4) Panaskan larutan yang terdapat endapat endapan ungu dengan pemanas air ( temperature 500C) sambil mengaduk + 5 menit.
5) Diamkan pada suhu tersebut selama 2-3 menit sampai terjadi pemisahan endapan dan larutan jernih.
6) Uji kesempurnaan endapan dengan menambahkan 2-3 tetes AgNO3 0,1 M, sampai
tidak terbentuk endapan lagi.
7) Simpan di tempat yang gelap selama 20 menit.
8) Saring endapan dan cuci dengan 10 ml HNO3 0,05 M sebanyak 3 kali sampai bebas
AgNO3 (cek dengan HCl 0,1 M).
9) Pindahkan endapan dalam porselen yang sudah diketahui beratnya.
10)Panaskan krus yang sudah ada endapan kloridanya selama 10 menit dalam oven dengan temperature 1050C dan dinginkan selama 20 menit dalam desikator dan timbang.
11)Lakukan langkah ke 10 sampai berat konstan (3X penimbangan).
III. HASIL DAN PEMBAHASAN
Tabel 1
Langkah Kerja Pengamatan
Larutan MgCl2 + indikator H2CrO4 +AgNO3 Terbentuk endapan berwarna keunguan (ungu
muda)
Dipanaskan pada suhu 500C Tetap, tidak terjadi perubahan
Diamkan selama 5 menit Larutan berubah menjadi tidak berwarna (jernih) dan endapan terpisah
5 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
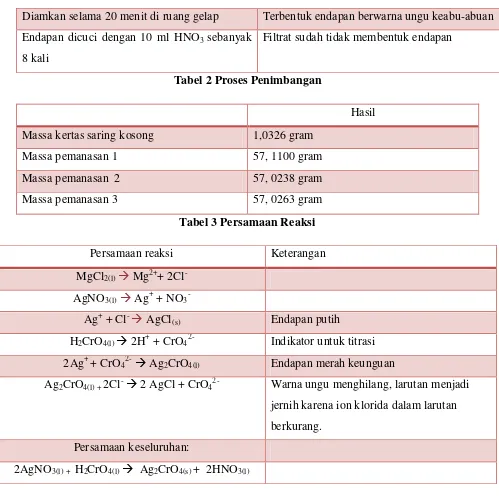
Diamkan selama 20 menit di ruang gelap Terbentuk endapan berwarna ungu keabu-abuan Endapan dicuci dengan 10 ml HNO3 sebanyak
8 kali
Filtrat sudah tidak membentuk endapan
Tabel 2 Proses Penimbangan
Hasil Massa kertas saring kosong 1,0326 gram
Massa pemanasan 1 57, 1100 gram
Massa pemanasan 2 57, 0238 gram
Massa pemanasan 3 57, 0263 gram
Tabel 3 Persamaan Reaksi
6 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
= 57, 0533 gram
2. Massa hasil pemanasan (w) = massa awal - massa rata-rata - massa kertas saring = 60,5800 gram - 57, 0533 gram
= 3,5267 gram 3. Massa awal (S)
V1 X M1 = V2 X M2 73 ml X 0,5 M= 10 ml X M2
M2 = 3,65 M
x
x
3,47 gram
P=
7 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
Jadi, kadar klorida dalam MgCl
2sebesar 1,6 gram
Penentuan kadar klorida pada MgCl2 dengan menggunakan analisis gravimetri ialah
menitikberatkan pada proses penimbangan sampai didapatkan massa konstan dari analit. Untuk dapat melakukan proses penimbangan, analit harus berupa endapan. Oleh karena itu penetuan kadar klorida pada MgCl2 juga menggunakan metode pengendapan. Tetapi, endapan
yang dihasilkan ialah melalui proses titrasi pengendapan.
Titrasi pengendapan didasarkan atas terjadinya pengendapan kuantitatif, yang dilakukan dengan penambahan larutan pengukur yang diketahui kadarnya pada larutan senyawa yang hendak ditentukan. Titik akhir titrasi tercapai bila semua bagian titran sudah membentuk endapan (Hermann dan Goffried, 1985: 248).
Setelah mendapatkan endapan, kemudian dilakukan proses pengeringan menggunakan oven pada temperatur 1050 C. Proses pengeringan dan penimbangan residu dilakukan secara berulang sampai mendapatkan massa konstan. Dalam hal ini pada proses pemanasan dan pengeringan yang ketiga dengan ketelitian dua angka di belakang koma, massa konstan telah didapatkan.
Selanjutnya kadar klorida dapat dihitung dengan menggunakan persamaan
Didapatkan hasil sebesar 1,6 gram kadar klorida dalam MgCl2. Prinsip dri analisis
gravimetri ialah penimbangan, sehingga massa sampel yang digunakan berdasarkan hasil penimbangan. Massa akhir yang didapatkan merupakan massa hasil pengeringan. Untuk mendapatkan massa yang hilang pada sampel, maka bisa didapatkan dari selisih massa awal dengan massa hasil pengeringan.
Massa awal sampel sebelum dilakukan pengeringan didapatkan dengan cara mencari molaritas sampel setelah titik ekuivalen. Kemudian setelah mendapatkan molaritas, barulah mencari massa klorida yang terbentuk.
8 Penentuan Kadar Klorida dalam MgCl2 dengan analisis gravimetri
suatu simplisia, yang ditentukan dengan pengeringan dengan masing-masing kondisi yang diberikan.
IV. KESIMPULAN
Berdasarkan data hasil percobaan dan pembahasan di atas, maka dapat disimpulkan bahwa:
1) Penentuan kadar klorida pada MgCl2 dapat menggunakan analisis gravimetri
dengan metode pengendapan.
2) Massa klorida yang didapatkan sebesar 1,6 gram dari massa awal sampel.
V. DAFTAR PUSTAKA
Effendi, Hefni.2003.Telaah Kualitas Air.Yogyakarta: Penerbit Kanisius
J.Roth, Hermann dan Blaschke, Goffried.1985.Analisis Farmasi. Penerbit: Gadjah Mada University Press.
Khopkar, S.M. 1990. Konsep Dasar Kimia Analitik. Penerbit: UI-Press.