MEKANISME KERJA EKSTRAK BUAH DELIMA (Punica granatum L) TERSTANDAR TERHADAP DEGRADASI SEL MUKOSA RONGGA MULUT MENCIT YANG MENGALAMI TRANSFORMASI MELALUI
EKSPRESI BCL-2,VEGF, Wildp53 DAN APOPTOSIS
(Studi Eksperimental Pada Hewan Model Transformasi Sel)
SRI HERNAWATI
PROGRAM STUDI S3 ILMU KEDOKTERAN
FAKULTAS KEDOKTERAN
UNIVERSITAS AIRLANGGA
SURABAYA
MEKANISME KERJA EKSTRAK BUAH DELIMA (Punica granatum L) TERSTANDAR TERHADAP DEGRADASI SEL MUKOSA RONGGA MULUT MENCIT YANG MENGALAMI TRANSFORMASI MELALUI
EKSPRESI BCL-2,VEGF, Wildp53 DAN APOPTOSIS
(Studi Eksperimental Pada Hewan Model Transformasi Sel)
SRI HERNAWATI
PROGRAM STUDI S-3 ILMU KEDOKTERAN FAKULTAS KEDOKTERAN
UNIVERSITAS AIRLANGGA SURABAYA
MEKANISME KERJA EKSTRAK BUAH DELIMA (Punica granatum L) TERSTANDAR TERHADAP DEGRADASI SEL MUKOSA RONGGA MULUT MENCIT YANG MENGALAMI TRANSFORMASI MELALUI
EKSPRESI BCL-2,VEGF, Wildp53 DAN APOPTOSIS
(Studi Eksperimental Pada Hewan Model Transformasi Sel)
DISERTASI
Untuk Memperoleh Gelar Doktor Dalam Program Studi S3 Ilmu Kedokteran Pada Fakultas Kedokteran Universitas Airlangga
Dan Dipertahankan Di hadapan Panitia Ujian Doktor Tahap II (Terbuka)
Oleh : SRI HERNAWATI
090970133
PROGRAM STUDI S-3 ILMU KEDOKTERAN FAKULTAS KEDOKTERAN
UNIVERSITAS AIRLANGGA SURABAYA
LEMBAR PENGESAHAN
Telah Disetujui Untuk Ujian Doktor Tahap II (Terbuka) pada tanggal 21 September 2012
Oleh Promotor :
Nip. 19591003 198701 1 001 Prof. Dr. Fedik Abdul Rantam, Drh
Ko Promotor I
Nip : 19550705 198003 1 005 Dr. I Ketut Sudiana, Drs. M.Si
Ko Promotor II
Nip. 19591114 198603 2 002 Dr. A. Retno Pudji Rahayu, drg,M.Si
Mengetahui
Ketua Program Studi Ilmu Kedokteran Program Pasca Sarjana Universitas Airlangga
Nip. 19501216 197703 1 002
Disertasi ini telah diuji dan dinilai
oleh panitia penguji pada ujian Tertutup (Tahap I)
Fakultas Kedokteran Universitas Airlangga Pada Tanggal 17 September 2012
Panitia Penguji :
Ketua : Prof. M.Coen Pramono D.,drg.,S.U.,Sp.BM Anggota :
1. Prof. Dr. Fedik Abdul Rantam, drh 2. Dr. I Ketut Sudiana, MS
3. Dr. A. Retno Pudji Rahayu, drg.,M.Kes 4. Dr. Hari Basuki Notobroto, M.Kes.,dr 5. Dr. Iwan Hernawan, drg.,M.Kes.,Sp.PM 6. Prof. Dr. Aulanni’am, Drh., DES
Ditetapkan dengan Surat Keputusan Dekan Fakultas Kedokteran
Universitas Airlangga Nomor : 182/H3.1.1/KD/2012
UCAPAN TERIMA KASIH
Puji syukur penulis panjatkan kehadirat ALLAH SWT atas segala rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan disertasi dengan judul “Mekanisme Kerja Ekstrak Buah Delima (Punica granatum L) Terstandar
Terhadap Degradasi Sel Mukosa Rongga Mulut Mencit Yang Mengalami
Transformasi Melalui Ekspresi BCL-2, VEGF, Wild p53 dan Apoptosis”
Penelitian Disertasi ini menjadi salah satu persyaratan yang harus ditempuh oleh mahasiswa Program Pendidikan S-3 Ilmu Kedokteran di Universitas Airlangga.
Disertasi ini dapat diselesaikan berkat dorongan, bimbingan, arahan, saran dan perbaikan dari banyak pihak. Oleh karena itu, dengan segala kerendahan hati, perkenankan saya menghaturkan terimakasih yang tulus serta penghargaan yang setinggi-tingginya kepada yang terhormat :
Prof. Dr. Fedik Abdul Rantam, Drh. selaku promotor yang dengan penuh perhatian telah meluangkan waktu, memberikan dorongan semangat dengan penuh kesabaran, memberikan bimbingan dan saran sehingga ujian disertasi ini dapat diselesaikan.
Dr. I Ketut Sudiana, Drs. M.Si, selaku Ko-Promotor I yang dengan penuh perhatian dan kesabaran, telah memberikan dorongan, bimbingan dan saran, sehingga ujian Disertasi ini dapat diselesaikan.
Ucapan terima kasih yang sebesar-besarnya juga saya haturkan kepada : Rektor Universitas Airlangga, Prof. Dr. H. Fasich, Apt. yang telah memberi kesempatan kepada saya untuk mengikuti pendidikan Program Doktor pada Program Ilmu Kedokteran Pascasarjana Universitas Airlangga Surabaya.
Prof. Dr. Agung Pranoto, dr., M.Kes., SpPD.,KEM.,FINASIN Dekan Fakultas Kedokteran Universitas Airlangga yang telah memberi kesempatan kepada saya untuk mengikuti Pendidikan Program Doktor pada Program Ilmu Kedokteran Pascasarjana Fakultas Kedokteran Universitas Airlangga Surabaya. Direktur Program Pascasarjana, Prof .Dr.Hj.Sri Hajati,SH.,MS., beserta seluruh pimpinan dan staf Program Pascasarjana Universitas Airlangga atas kesempatan dan fasilitas yang diberikan kepada saya untuk menjadi mahasiswa Program Doktor pada Program Ilmu Kedokteran Pascasarjana Universitas Airlangga.
Prof. Dr. Teddy Ontoseno, dr. SpA(k)Spjp.,AKK, selaku Ketua Program Studi Program Doktor Ilmu Kedokteran Pascasarjana Universitas Airlangga yang telah banyak membantu dalam kelancaran proses pelaksanaan ujian disertasi ini.
Rektor Universitas Jember dan Dekan Fakultas Kedokteran Gigi Universitas Jember yang telah banyak membantu saya dalam menempuh Program Doktor pada Program Pascasarjana Universitas Airlangga.
bimbingan yang sangat berharga mulai penyusunan pra usulan penelitian hingga penyusunan disertasi ini.
Para dosen pengajar S-3 Kedokteran dan karyawan di laboratorium biokimia, laboratorium mikroskop elektron Gramik Fakultas Kedokteran Universitas Airlangga.
Terima kasih kepada Direktorat Jenderal Pendidikan Tinggi Kementerian Pendidikan Nasional yang telah memberikan Beasiswa Pendidikan Pascasarjana demi kelancaran studi saya.
Teman-teman angkatan 2009/2010 pendidikan Program Doktor Bidang Ilmu Kedokteran pada Program Pascasarjana Universitas Airlangga. Selama ini kita telah saling menemani, memotivasi, mengingatkan dan memberi masukan yang semuanya memberi nilai tambah dalam rangkaian penyusunan disertasi ini.
Pada kesempatan ini saya menyampaikan terimakasih ,rasa hormat dan penuh kasih kepada :
Orangtua saya, ayahanda tercinta Samiruddin (Alm) dan ibunda Sunaryati, tidak lupa kepada seluruh saudara dan keluarga besar saya ucapkan terimakasih yang tak terhingga. Terimakasih atas semua kebaikan dan doa yang telah diberikan.
Saya ucapkan terima kasih pada semua pihak yang telah membantu dalam terselesaikannya disertasi ini. Saya berharap disertasi ini akan dapat memberikan manfaat bagi masyarakat, khususnya bagi pengembangan dunia pendidikan dan kesehatan. Semoga Allah SWT melimpahkan taufik dan hidayah-Nya kepada semua pihak yang telah membantu penyelesaian disertasi ini. Amien Ya Rabbal Allamin.
Surabaya, September 2012
RINGKASAN
Mekanisme Kerja Ekstrak Buah Delima
(Punica granatum L) Terstandar Terhadap Degradasi Sel Mukosa Rongga Mulut Mencit Yang Mengalami Transformasi Melalui Ekspresi BCL-2,
VEGF, Wildp53 Dan Apoptosis
Karsinoma sel skuamosa rongga mulut adalah kanker urutan keenam di dunia, setiap tahun angka kejadiannya semakin meningkat. Di negara berkembang, kejadian ini mempunyai angka yang tinggi. Kemajuan di bidang bedah, radiasi dan kemoterapi telah berkembang dengan pesat, tetapi hasilnya masih relatif belum menggembirakan. Pasien yang mempunyai umur panjang kurang dari 50%. Terjadinya kanker bisa disebabkan karena hambatan apoptosis. Apoptosis merupakan suatu mekanisme yang efisien untuk mengeliminasi sel yang tidak diperlukan dan mungkin berbahaya sehingga dapat menyelamatkan organisme. Delima (PGL) salah satu tanaman obat yang memiliki aktivitas sebagai antikanker. Fakta ini mempunyai harapan bahwa ekstrak buah delima (PGL) dapat membunuh sel yang mengalami transformasi ke karsinoma sel skuamosa rongga mulut mencit melalui penurunan ekspresi BCL-2,VEGF dan peningkatan ekspresi wild p53, apoptosis. Tujuan penelitian ini adalah untuk menguji secara eksperimental mekanisme kerja ekstrak buah Delima (Punica granatum L) terstandar terhadap sel mukosa rongga mulut mencit yang mengalami transformasi melalui ekspresi BCL-2,VEGF, Wild p53 dan Apoptosis.
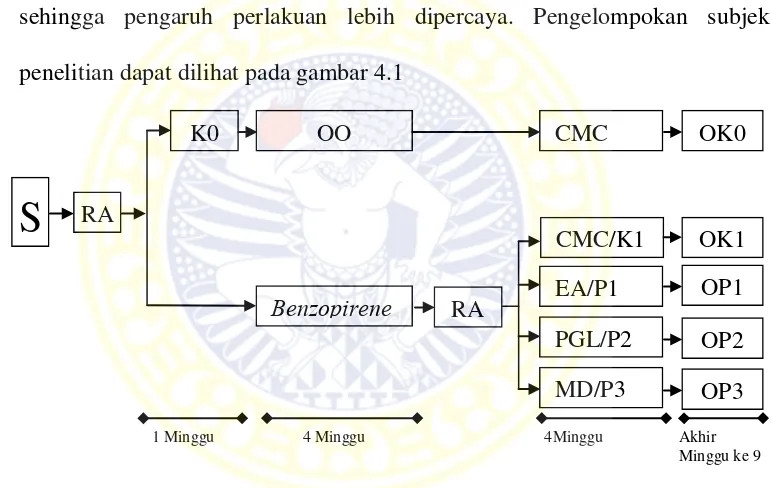
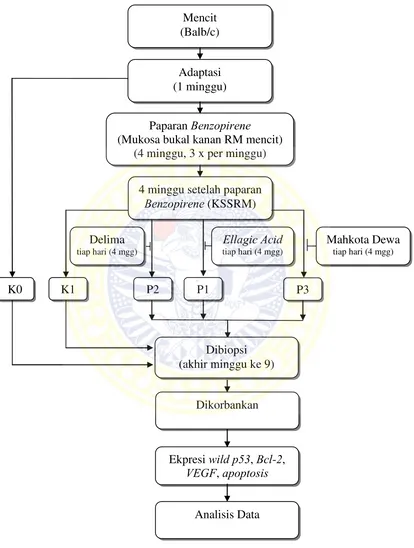
Metode penelitian ini adalah eksperimental laboratories. Hewan coba yang digunakan adalah mencit Strain Swiss Webster (Balb/c), 30 ekor mencit jantan umur 5 bulan, dibagi 5 kelompok. Kelompok kontrol (K0/K-, K1/K+) dan 3 kelompok perlakuan (P1, P2, P3). Paparan benzopirene diberikan untuk hewan coba pada kelompok (K1, P1, P2, P3) dengan dosis 0,04 mg benzopirene / 0,04 ml olium olivarum diberikan 3 kali seminggu selama 4 minggu. Pemberian ellagic acid, PGL, mahkota dewa pada kelompok (P1, P2, P3 ) dengan dosis 75 mg/kg bb mencit, diberikan tiap hari selama 4 minggu per oral. Teknik pemeriksaan dengan teknik imunohistokimia dan tunnel assay analisis data menggunakan uji MANOVA, LSD, uji korelasi dan regresi.
P1, P3, tetapi berbeda secara signifikan dengan kelompok K0 dan K1. Hasil uji korelasi menunjukkan, ada korelasi positif antara penurunan ekspresi Bcl-2 dengan penurunan ekspresi VEGF, tetapi ada korelasi negatif antara penurunan ekspresi Bcl-2 dengan peningkatan ekspresi wild p53, dan ada korelasi positif antara peningkatan wild p53 dengan peningkatan ekspresi apoptosis.
SUMMARY
Mechanism of Action of Standardized Pomegranate Extracts (Punica Granatum L) on Degradation of Mice Oral Cavity Mucosal Cells Transforming through Expression of Bcl-2, VEGF, p53Wild andApoptosis
Squamous cell carcinoma of the oral cavity is the sixth cancer in the world, every year the number of events increases. In developing countries, these events have a high number. The developments in the field of surgery, radiation and chemotherapy have improved dramatically, but the results are still relatively encouraging. In facts, patients who have a long life are still less than 50%. The occurrence of cancer could be due to apoptosis resistance. Apoptosis is an efficient mechanism to eliminate cells that are unnecessary and potentially dangerous so as to save the organism. Pomegranate (PGL) is one of medicinal plants that have anticancer activity. This fact has the expectation that pomegranate extract (PGL) can kill cells undergoing transformation into squamous cell carcinoma of the oral cavity of mice with decreased expression of BCL-2, VEGF and increased expression of p53 wild, apoptosis. The purpose of the research was to experimentally test the mechanism of action of Pomegranate extract (Punica granatum L) standardized to oral mucosal cells of mice undergoing a transformation through the expression of BCL-2, VEGF, p53 and Apoptosis Wild. The research method was experimental laboratories. Experimental animals used were Swiss Webster mice strains (Balb / c), 30 male mice aged 5 months, divided 5 groups. The control group (K0/K-, K1 / K +) and 3 treatment groups (P1, P2, P3). Exposure benzopirene was given to experimental animals in the group (K1, P1, P2, P3) at a dose of 0.04 mg benzopirene / 0.04 ml olium olivarum given 3 times a week for 4 weeks. Usage of ellagic acid, PGL, mahkota dewa on the groups (P1, P2, P3) at a dose of 75 mg / kg bb mice, given daily for 4 weeks per oral. Examination techniques with imunohistokimia technique and tunnel assay
data analysis using MANOVA test, LSD, correlation and regression testing.
expression of Bcl-2 with increased expression of p53 wild, and there is a positive correlation between the increase in p53 wild with increased expression of apoptosis.
ABSTRAK
Mekanisme Kerja Ekstrak Buah Delima
(Punica granatum L) Terstandar Terhadap Degradasi Sel Mukosa Rongga Mulut Mencit Yang Mengalami Transformasi Melalui Ekspresi BCL-2,
VEGF, Wildp53 Dan Apoptosis
Karsinoma sel skuamosa rongga mulut adalah merupakan kanker urutan keenam di dunia. Perkembangan kemajuan di bidang bedah, radiasi dan kemoterapi belum memberikan hasil yang signifikan. Pasien karsinoma sel skuamosa rongga mulut yang berumur panjang kurang dari 50%. Terjadinya kanker salah satu disebabkan oleh karena hambatan apoptosis sel dan mutasi. Delima (PGL) merupakan alternatif dan salah satu tanaman obat yang memiliki aktivitasnya sebagai antikanker. Fakta ini mempunyai harapan bahwa ekstrak buah delima (PGL) terstandar dapat membunuh sel yang mengalami transformasi ke karsinoma sel skuamosa rongga mulut mencit melalui penurunan ekspresi
BCL-2,VEGF dan peningkatan ekspresi wild p53, apoptosis.Tujuan penelitian ini adalah untuk menguji secara eksperimental mekanisme kerja ekstrak buah Delima
(Punica granatum L) terstandar terhadap sel mukosa rongga mulut mencit yang mengalami transformasi melalui ekspresi BCL-2,VEGF, Wildp53 dan Apoptosis.
Metode penelitian yang digunakan adalah eksperimental laboratories, tiga puluh ekor mencit jantan umur 5 bulan dibagi secara random menjadi 5 kelompok; 2 kelompok control (K0, K1), 3 kelompok perlakuan (P1,P2,P3). Paparan benzopirene dengan dosis 0,04 mg benzopirene/0,04 ml olium olivarum selama 4 minggu, 3 kali seminggu. Pemberian ellagic acid, PGL, mahkota dewa dengan dosis 75 mg/kg bb mencit setiap hari selama 4 minggu. Pemeriksaan dilakukan dengan menggunakan teknik imunohistokimia dan tunnel assay.
Hasil penelitian berdasarkan teknik imunohistokimia menujukkan bahwa pemberian ekstrak buah delima (PGL) terstandar dapat menurunkan ekspresi Bcl -2, VEGF, dapat meningkatkan ekspresi wild p53 dengan teknik pemeriksaan
tunnel assay, dan meningkatkan ekspresi apoptosis. Hasil uji korelasi menunjukkan, ada korelasi positif antara penurunan ekspresi Bcl-2 dengan penurunan ekspresi VEGF, ada korelasi negatif antara penurunan ekspresi Bcl-2 dengan peningkatan ekspresi wildp53, dan ada korelasi positif antara peningkatan ekspresi wildp53 dengan peningkatan ekspresi apoptosis.
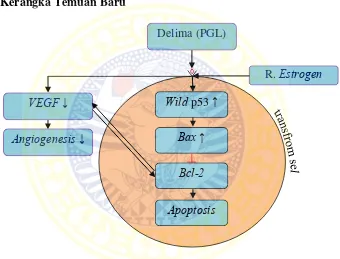
Kesimpulan penelitian ini adalah ada mekanisme kerja ekstrak buah delima (PGL) terhadap apoptosis melalui jalur intrinsik dan ada korelasi positif dua arah antara ekspresi Bcl-2 dengan ekspresi VEGF.
ABSTRACT
Mechanism of Action of Standardized Pomegranate Extracts (Punica Granatum L) on Degradation of Mice Oral Cavity Mucosal Cells Transforming through Expression of Bcl-2, VEGF, p53 wild and Apoptosis
Squamous cell carcinoma of the oral cavity is the sixth cancer in the world. The developments in the field of surgery, radiation and chemotherapy have not yielded significant results. Patients with squamous cell carcinoma of the oral cavity that have a long life is still less than 50%. One occurrence of cancer was caused by cell apoptosis and mutation. Pomegranate (PGL) is an alternative and one that has the medicinal plants as anticancer activity. This fact has the expectation that pomegranate extract (PGL) standardized to kill the cells undergoing transformation into squamous cell carcinoma of the oral cavity of mice with decreased expression of BCL-2, VEGF and increased expression of p53 wild, apoptosis. The purpose of this study was to experimentally test the mechanism of action of Pomegranate extract (Punica granatum L) standardized to oral mucosal cells of mice undergoing a transformation through the expression of BCL-2, VEGF, p53 and Apoptosis Wild.
The research method used was experimental laboratories, thirty male mice aged 5 months were randomly divided into 5 groups: 2 groups of control (K0, K1), 3 treatment groups (P1, P2, P3). Exposure of benzopirene with a dose of 0.04 mg benzopirene/ 0.04 ml olium olivarum for 4 weeks, 3 times a week. Usage of ellagic acid, PGL, mahkota dewa with a dose of 75 mg / kg bb mice every day for 4 weeks. Examinations were done by using imunohistokimia and tunnel as say techniques.
The results based on the technique of imunohistokimia showed that pomegranate extract (PGL) standardized could reduce the expression of Bcl-2, VEGF, p53, could increase the expression of wild-tunnel as say examination techniques, and could increase expression of apoptosis. Correlation test results showed that there was a positive correlation between the decreased expression of Bcl-2 and decreased expression of VEGF, there was a negative correlation between the decreased expression of Bcl-2 and increased expression of p53 wild, and there was a positive correlation between the increased expression of p53 and increased expression of wild apoptosis.
DAFTAR ISI
DAFTAR SINGKATAN ... xxvii
BAB 1 PENDAHULUAN ... 1
2.1.2 Karsinoma Sel Skuamosa Rongga Mulut (KSSRM) .... 13
2.1.2.1 Etiologi dan faktor predisposisi sel skuamosa rongga mulut (KSSRM) ... 14
2.2 Kematian Sel ... 18
2.6.2 VascularEndothelialGrowthFactor (VEGF) ... 37
2.7 Benzopirene ... 38
2.8 Punicagranatum L (Delima) ... 42
2.8.1 Klasifikasi, Nama Lain Komposisi Delima (National Plant DateCentre, 2000) ... 42
2.8.2 Bahan Aktif Delima (PGL) ... 43
BAB 4 METODE PENELITIAN... 65
4.1 Jenis dan Rancangan penelitian ... 65
4.2 Unit Eksperimental, Replikasi dan Randomisasi ... 67
4.2.1 Unit Eksperimental ... 67
4.2.2 Replikasi ... 68
4.2.3 Randomisasi ... 69
4.3 Variabel Penelitian dan Definisi Operasional Variabel ... 69
4.3.1 Variabel Penelitian ... 69
4.7.1 Persiapan Penelitian... 74
4.8 Prosedur Pengambilan dan Pengumpulan Data ... 76
4.9 Cara Pengolahan dan Analisis Data ... 77
4.10 Kerangka Operasional Penelitian ... 79
BAB 5 HASIL PENELITIAN ... 80
5.1 Karakteristik Subyek Penelitian ... 80
5.3 Ekspresi Bcl-2, VEGF, wild p53 dan Jumlah sel yang
6.1 Aktivitas Ekstrak Buah Delima (PGL) terhadap Ekspresi Protein Bcl-2 pada Sel Mukosa Rongga Mencit akibat paparan Benzopirene. ... 109
6.3 Efek Ekstrak Buah Delima (PGL) terhadap Ekspresi Protein wild p53 pada Sel Mukosa Rongga Mulut Mencit Hewan
Coba Akibat Paparan Benzopirene ... 120
6.4 Aktivitas Ekstrak Buah Delima (PGL) Terhadap Perubahan Ekspresi Jumlah Sel Yang Mengalami Apoptosis Pada Sel Mukosa Rongga Mulut Akibat Paparan Benzopirene ... 124
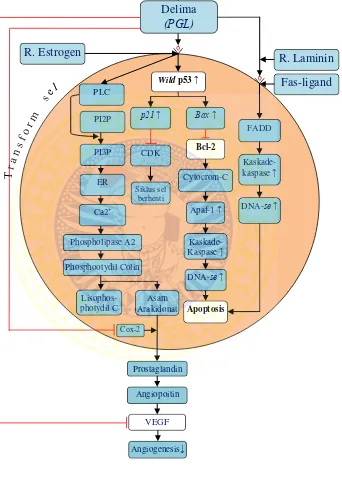
6.5 Temuan baru ... 128
6.5.1 Kerangka Temuan Baru ... 128
6.5.2 Keterangan Kerangka Temuan Baru ... 128
BAB 7 PENUTUP... 131
7.1 Kesimpulan ... 131
7.2 Saran ... 131
DAFTAR PUSTAKA ... 133
DAFTAR TABEL
Halaman
Tabel 5.1 Uji Homogenitas Subjek Penelitian Berdasarkan Berat Badan Awal dan akhir mencit percobaan ... 84 Tabel 5.2 Nilai Signifikansi Uji Normalitas Ekspresi Bcl-2, VEGF, wild
p53 dan jumlah sel yang mengalami apoptosis ... 85 Tabel 5.3 Rerata dan Simpangan Baku Jumlah Sel yang Mengekspresikan
Bcl-2 Pada Hewan Percobaan ... 86 Tabel 5.4 Rerata dan Simpangan Baku Jumlah Sel yang Mengekspresikan
VEGF pada Hewan Percobaan ... 90 Tabel 5.5 Rerata dan Simpangan Baku Jumlah Sel yang Mengekspresikan
wild p53 Pada Hewan Percobaan ... 94 Tabel 5.6 Rerata dan Simpangan Baku ekspresi sel yang mengalami
DAFTAR GAMBAR
Halaman
Gambar 2.1 Tahapan-tahapan proses karsinogenesis (Kresno, 2011) ... 11
Gambar 2.2 Tiga jalur apoptosis yaitu jalur ekstrinsik (death-receptor pathway), jalur intrinsik yang juga disebut jalur mitokhondria dan jalur perforin/granzim (Jalur ekstrinsik dan jalur intrinsik merupakan jalur utama) (Kresno, 2011) ... 24
Gambar 2.3 Struktur Kimia Benzopirene (Vidmar et all., 2004) ... 41
Gambar 2.4 Reaksi aromatik hidrosilasi dan epoksidasi (Sudiana, 2008) .. 41
Gambar 2.5 Punica granatum L (Delima) ( National Plant Data Center, 2000) ... 43
Gambar 2.6 Struktur Kimia Punicalagin (a) dan Ellagic Acid (b) (Seeram et al., 2005) ... 45
Gambar 3.1 Kerangka Konsep ... 60
Gambar 4.1 Rancangan Penelitian ... 65
Gambar 4.2 Kerangka Operasional Penelitian ... 78
Gambar 5.1 Gambaran HPA (pembentukan keratin abnormal, proliferasi sel-sel epitel skuamous, terlihat sel-sel atipia, sel tidak beraturan) pada transform sel ke karsinoma rongga mulut dosis 0.04 ml benzopirene, paparan 3 x seminggu selama 4 minggu dan pembesaran 100 x dengan pewarnaan HE (penelitian pendahuluan) ... 81
Gambar 5.3 Gambaran secara klinis dari hasil penelitian pendahuluan dengan dosis benzopirene 0,04 ml menunjukkan gambaran mikroskopis (kemerahan, indurasi, tumor) ... 82 Gambar 5.4 Grafik Uji Homogenitas Subjek Penelitian Berdasarkan Berat
Badan Awal dan akhir mencit percobaan ... 84 Gambar 5.5 Grafik Rerata dan Simpangan Baku Jumlah Sel yang
Mengekspresikan Bcl-2 Pada Hewan Percobaan ... 86 Gambar 5.6 Kelompok K0 / Kontrol negatif (mencit normal) → (Positif)
Pengecatan imunohistokimia dengan antibodi poliklonal terhadap ekspresi Bcl-2, pembesaran 400 x pada transform sel ... 87 Gambar 5.7 Kelompok K1 / Kontrol positif (Benzopirene) → (Positif)
Pengecatan imunohistokimia dengan antibodi poliklonal terhadap ekspresi Bcl-2, pembesaran 400 x pada transform sel ... 88 Gambar 5.8 Kelompok P1 (Benzopirene + EA) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi Bcl-2, pembesaran 400 x pada transform sel ... 88 Gambar 5.9 Kelompok P2 (Benzopirene + PGL) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi Bcl-2, pembesaran 400 x pada transform sel ... 89 Gambar 5.10 Kelompok P3 (Benzopirene + MD) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi Bcl-2, pembesaran 400 x pada transform sel ... 89 Gambar 5.11 Grafik Rerata dan Simpangan Baku Jumlah Sel yang
Mengekspresikan VEGF pada Hewan Percobaan ... 90 Gambar 5.12 Kelompok K0 / Kontrol negatif (mencit normal) → (Positif)
Gambar 5.13 Kelompok K1 / Kontrol positif (Benzopirene) → (Positif) Pengecatan imunohistokimia dengan antibodi poliklonal terhadap ekspresi VEGF pembesaran 400 x pada transform sel ... 92 Gambar 5.14 Kelompok P1 (Benzopirene + EA) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi VEGF pembesaran 400 x pada transform sel ... 92 Gambar 5.15 Kelompok P2 (Benzopirene + PGL) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi VEGF pembesaran 400 x pada transform sel ... 93 Gambar 5.16 Kelompok P3 (Benzopirene + MD) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi VEGF pembesaran 400 x pada transform sel ... 93 Gambar 5.17 Grafik Rerata dan Simpangan Baku Jumlah Sel yang
Mengekspresikan wild p53 Pada Hewan Percobaan ... 94 Gambar 5.18 Kelompok K0 / Kontrol negatif (mencit normal) → (Positif)
Pengecatan imunohistokimia dengan antibodi poliklonal terhadap ekspresi wild p53 pembesaran 400 x pada transform sel ... 95 Gambar 5.19 Kelompok K1 / Kontrol positif (Benzopirene) → (Positif)
Pengecatan imunohistokimia dengan antibodi poliklonal terhadap ekspresi wild p53 pembesaran 400 x pada transform sel ... 96 Gambar 5.20 Kelompok P1 (Benzopirene + EA) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi wild p53 pembesaran 400 x pada transform sel ... 96 Gambar 5.21 Kelompok P2 (Benzopirene + PGL) → (Positif) Pengecatan
Gambar 5.22 Kelompok P3 (Benzopirene + MD) → (Positif) Pengecatan
imunohistokimia dengan antibodi poliklonal terhadap ekspresi wild p53 pembesaran 400 x pada transform sel ... 97 Gambar 5.23 Grafik Rerata dan Simpangan Baku Jumlah Sel yang
Mengekspresikan wild p53 Pada Hewan Percobaan ... 98 Gambar 5.24 Kelompok K0 / Kontrol negatif (mencit normal) → (Positif)
Pengecatan teknik tunnel assay dengan antibodi poliklonal terhadap ekspresi apoptosis pembesaran 400 x pada transform sel ... 99 Gambar 5.25 Kelompok K1 / Kontrol positif (Benzopirene) → (Positif)
Pengecatan teknik tunnel assay dengan antibodi poliklonal terhadap ekspresi apoptosis pembesaran 400 x pada transform sel ... 100 Gambar 5.26 Kelompok P1 (Benzopirene + EA) → (Positif) Pengecatan
teknik tunnel assay dengan antibodi poliklonal terhadap ekspresi apoptosis pembesaran 400 x pada transform sel ... 100 Gambar 5.27 Kelompok P2 (Benzopirene + PGL) → (Positif) Pengecatan
teknik tunnel assay dengan antibodi poliklonal terhadap ekspresi apoptosis pembesaran 400 x pada transform sel ... 100 Gambar 5.28 Kelompok P3 (Benzopirene + MD) → (Positif) Pengecatan
teknik tunnel assay dengan antibodi poliklonal terhadap ekspresi apoptosis pembesaran 400 x pada transform sel ... 101 Gambar 5.29 Korelasi antara Bcl-2 dengan VEGF ... 101 Gambar 5.30 Korelasi antara Bcl-2 dengan wild p53 ... 102 Gambar 5.31 Korelasi antara wild p53 dengan apoptosis ... 103 Gambar 5.32 Hubungan antara Bcl-2, VEGF, wild p53 dan Apoptosis
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Sertifikasi standarisasi (COA) ekstra buah delima (PGL) dan
DAFTAR SINGKATAN / ISTILAH
bFGF : Basic fibroblast growth faktor
IAP : Inhibitor of apoptosis protein IKK : IkB kinase
KSSRM : Karsinoma sel skuamosa rongga mulu LOX : Lipoxygenase Tumor suppressor gene : Protein yang berperan sebagai faktor pengendalian
pertumbuhan sel
Telomerase : Enzim yang berperan pada apoptosis fisiologis TRAIL : Anggota superfamily TNF
T2 : Ukuran tumor 2-4 cm
T3 : Ukuran tumor lebih dari 4 cm TSG : Tumor supressor gene
VEGF : Vascular endothelial growth factor
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Trasformasi sel merupakan sel yang mengalami perubahan perilaku sebagai akibat adanya transkripsi dari suatu onkogen. Protooncogene yang mengalami mutasi, gen tersebut dikenal dengan onkogen. Protein yang di kode oleh gen tersebut akan overaktif dan dapat berkembang menjadi kanker (Sudiana, 2008; Kresno, 2011)
Karsinoma sel skuamosa rongga mulut merupakan kanker keenam di dunia, di India dilaporkan setiap tahun 75.000-80.000 kasus baru, di Singapura dan negara-negara Asia lainnya juga dilaporkan tinggi angka kejadiannya (Epstein and Waal, 2008; Solomon, 2010). Karsinoma sel skuamosa rongga mulut merupakan kelanjutan dari kejadian transformasi sel pada sel skuamosa rongga mulut.
Lebih dari 90% dari karsinoma rongga mulut berasal dari sel skuamosa dan menjadi masalah kesehatan utama di negara berkembang serta merupakan penyebab utama kematian. Indeks survival ini terus merosot (50%), dibandingkan dengan kemajuan dalam hal diagnosis dan pengobatan kanker (Mehrotra and Yadav, 2006).
menimbulkan keluhan pada tahap awal, pasien dengan karsinoma sel skuamosa pada mukosa bukal 68% diantaranya merupakan lesi T2 atau T3 dan sebesar 48% menyebar ke nodes limfa (Wahyuni, 2010).
Berbagai upaya penatalaksanaan penyakit kanker masih banyak menemui kendala yang mengakibatkan kurangnya keberhasilan dalam mencegah dan mengobati kanker. Pengobatan yang selama ini dilakukan meliputi pembedahan, penyinaran radioterapi dan penggunaan obat-obat kemoterapi. Tindakan operasi untuk mengangkat jaringan kanker belum sepenuhnya menjamin kesembuhan dan ada kecenderungan untuk terjadinya remultiplikasi sel kanker. Penggunaan radioterapi menimbulkan resiko terjadinya kerusakan lain di sekitar jaringan yang terkena kanker. Pemberian kemoterapi antikanker memiliki efek farmakologi kurang selektif, efek samping yang merugikan dan dilaporkan adanya resistensi beberapa jenis kanker (Rizali dan Auerkari, 2003; Sismindari, 2005).
Penanganan penyakit kanker yang kurang optimal pada kasus karsinoma sel skuamosa rongga mulut yang telah metastasis luas, didapatkan sekitar 30-65% penderita meninggal dunia dalam kurang waktu 5 tahun. Karsinoma sel skuamosa rongga mulut merupakan kanker yang sering terjadi pada rongga mulut. Pemeriksaan DNA menunjukkan hampir 90% kasus dijumpai adanya mutasi gen p53 (Syafriadi, 2008).
obat dengan sifat alamiahnya akan meningkatkan daya tahan tubuh penderita terutama sel yang berada di sekitar kanker. Senyawa-senyawa aktif tanaman obat juga banyak mempunyai fungsi untuk menghambat pertumbuhan sel kanker dan membunuhnya, memutus pasokan zat-zat makanan dan oksigen ke jaringan sel kanker. Selain bebagai alasan tersebut di atas, penggunaan obat herbal dalam menangani sel kanker merupakan cara pengobatan dengan biaya murah (McCutcheon et a l.,2008). Delima (PGL) adalah Salah satu tanaman obat yang mempunyai efek farmakologis terhadap penyakit kanker telah banyak diteliti secara invitro dan sedikit penelitian yang di lakukan secara invivo .
Penelitian ini tidak mungkin digunakan manusia sebagai subjek penelitian, sehingga digunakan hewan coba mencit. Hewan coba yang di gunakan mencit Strain Swiss Webster (Balb/c) jantan, lokasi paparan pada mukosa bukal sebelah kanan dengan dosis paparan benzopirene berdasarkan penelitian pendahuluan 0,04 mg benzopirene / 0,04 ml olium ol ivarum, diberikan 3 kali dalam semingggu selama 4 minggu.
Benzopirene (B(a)P) merupakan senyawa polisiklik ar omatik
hidrokarbon yang bersifat karsinogenik dan paling sering menyebabkan
kanker di rongga mulut (Cotran, 2005). Benzopirene menghasilkan metabolit reaktif BP-7, 8-diol-9, 10-oxide yang dapat berikatan secara kovalen dengan
basaguanin DNA sehingga terjadi mutasi genetik (Sattar et al.,1999). Hal ini
proses pembakaran bahan organik dan makanan yang diasap atau dipanggang.
Benzopirene dapat menimbulkan mutasi gen p53 sehingga menimbulkan
kanker (Martin et al., 2001).
Pada sel yang mengalami transformasi mutasi gen p53 akan mengubah sifat protein yang diproduksinya sehingga menghilangkan kemampuan wild
p53 baik sebagai antiproliferasi, maupun sebagai pengatur proses apoptosis
(Mendelsohn et al., 2008).
Mutasi gen p53 menyebabkan inaktivasi wild p53 sehingga siklus sel tidak berhenti pada fase G1 tetapi berlanjut ke fase S dan G2 atau M. Hal ini berakibat DNA yang mengalami mutasi tetap dilipatgandakan. Sel yang mengandung DNA mutasi tetap mitosis menghasilkan populasi sel yang mengandung DNA cacat. Pada proses apoptosis wild p53 berperan memicu faktor transkripsi terhadap p21 dan memicu aktivitas Bax dan menekan Bcl-2. Apabila sistem yang menginduksi apoptosis tidak mampu bekerja maka akan mengalami pembelahan sel yang tidak terkendali, sehingga menjadi kanker (Sudiana, 2008).
Bcl-2 adalah sebuah onkogen anggota dari keluarga Bcl yang
mempunyai fungsi untuk menghambat proses apoptosi (hambatan kompetitif terhadap aktivasi Bax). Apabila jumlah protein Bcl-2 sedikit, maka protein pro apoptosis (Bax) akan menginduksi apoptosis (Kresno, 2011).
Angiogenesis merupakan pertumbuhan pembuluh darah baru dari
pembuluh darah yang sudah ada, merupakan salah satu faktor penting pada pertumbuhan dan perkembangan sel kanker. Faktor yang mempengaruhi pembentukan angiogenesis adalah VEGF, VEGF sebagai inducer
angiogenesis dari sebagian besar kanker mengekspresikan VEGF (Hasina et
al., 2001; Kresno, 2011).
Dewasa ini telah dilakukan berbagai upaya penelitian guna pencarian obat antikanker. Salah satu upaya di antaranya adalah menggali potensi tanaman obat Indonesia termasuk delima atau Punica G ranatum L inn ( PGL), yang banyak diteliti secara invitro tapi masih jarang diteliti secara invivo. Apabila efek ekstrak buah delima (Punica Granatum L) pada mencit (Mus Musculus)
Strain Sw iss W ebster (Balb/c) dapat terungkap, maka ekstrak buah delima
(Punica Granatum L) dapat dijadikan sebagai salah satu alternatif pengobatan terhadap karsinoma sel skuamosa rongga mulut.
Buah delima merupakan bagian tanaman delima yang memiliki komponen paling lengkap bila dibandingkan bagian tanaman delima lainnya. Buah delima banyak mengandung senyawa polyphenol yang terdiri dari
flavonoid, hydrolyzahle tannins (ellagitannins dan gallotannins) dan
di dalam buah delima adalah punicalagin dan ellagicacid (EA). Ekstrak buah delima terstandar yang baik umumnya mengandung 40% atau lebih ellagic
acid. Ekstrak buah delima (PGL) dengan standar 40% ellagic a cid dapat
menghambat perkembangan sel kanker, antiproliferasi, menginduksi apoptosis dan antioksidan secara invitro (Seeram et al., 2006; Jurenka, 2008). Ekstrak etanol buah delima dapat meningkatkan apoptosis secara invitro pada biakan sel karsinoma skuamosa lidah manusia dengan dosis 250 ug/ml (Kholifa, 2010). Standarisasi 40% ellagic ac id dengan tujuan 40% ellagic
acid dapat menggambarkan kekuatan delima yang bertanggung jawab
terhadap aktivitas farmakologi (Saifudin et al ., 2011). Dosis ekstrak buah delima yang digunakan dalam penelitian ini adalah 75 mg/kg/hari (Valadares
et al.,2010).
Berdasarkan fakta tersebut, tidak menutup kemungkinan bahwa ekstrak buah delima (PGL) terstandar dengan komposisi yang lengkap bila dibandingkan dengan bagian tanaman delima lainnya, dapat dimanfaatkan sebagai bahan antikanker melalui hewan percobaan yang sedang dalam proses transformasi ke karsinoma sel skuamosa rongga mulut (KSSRM).
Langkah awal yang akan dilakukan pada penelitian ini adalah memberikan ekstrak buah delima (PGL) terstandar yang mengandung 40%
ellagic acid kepada hewan coba yang sedang dalam proses kearah karsinoma
untuk ekspresi Bcl-2, VEGF, wild p53 dan metode tunnel assay untuk sel yang mengalami apoptosis.
1.2 Rumusan Masalah
Rumusan permasalahan dari penelitian ini adalah :
1.2.1 Apakah pemberian ekstrak buah delima (PGL) terstandar dapat menurunkan ekspresi Bcl-2 pada sel mukosa rongga mulut mencit yang mengalami transformasi ?
1.2.2 Apakah pemberian ekstrak buah delima (PGL) terstandar dapat menurunkan ekspresi VEGF pada sel mukosa rongga mulut mencit yang mengalami transformasi ?
1.2.3 Apakah pemberian ekstrak buah delima (PGL) terstandar dapat meningkatkan ekspresi wild p53 pada sel mukosa rongga mulut mencit yang mengalami transformasi ?
1.2.4 Apakah pemberian ekstrak buah delima (PGL) terstandar dapat meningkatkan apoptosis pada sel mukosa rongga mulut mencit yang mengalami transformasi ?
1.3 Tujuan Penelitian
1.3.1 Tujuan umum penelitian
Menjelaskan mekanisme kerja ekstrak buah delima (PGL) terstandar terhadap hambatan / degradasi sel mukosa rongga mulut mencit Strain Swiss
1.3.2 Tujuan khusus penelitian
Tujuan khusus dari penelitian ini adalah
a. Menganalisis hambatan/degradasi ekstrak buah delima (PGL) terstandar terhadap sel mukosa rongga mulut mencit Strain Swiss Webster (Balb/c) yang mengalami transformasi melalui penurunan ekspresi Bcl-2.
b. Menganalisis hambatan/degradasi ekstrak buah delima (PGL) terstandar terhadap sel mukosa rongga mulut mencit Strain Swiss Webster (Balb/c) yang mengalami transformasi melalui penurunan ekspresi VEGF
c. Menganalisis hambatan/degradasi ekstrak buah delima (PGL) terstandar terhadap sel mukosa rongga mulut mencit Strain Swiss Webster (Balb/c) yang mengalami transformasi melalui peningkatan ekspresi wildp53 d. Menganalisis hambatan/degradasi ekstrak buah delima (PGL) terstandar
terhadap sel mukosa rongga mulut mencit (Mus musculus) Strain Swiss
Webster ( Balb/c) yang mengalami transformasi melalui peningkatan
apoptosis.
1.4 Manfaat penelitian
1.4.1 Manfaat teoritik
Penelitian ini memberikan kontribusi keilmuan dalam mengungkap mekanisme kerja ekstrak buah delima (PGL) terhadap penurunan onkogenesis pada sel mukosa rongga mulut mencit (Mus musculus)Strain
Swiss Webster (Balb/c) sebagai hewan coba yang mengalami transformasi
sel menjadi karsinoma sel skuamosa rongga mulut akibat paparan
1.4.2 Manfaat praktis penelitian
Ekstrak buah delima (PGL) dapat meningkatkan apoptosis melalui jalur intrinsik melalui meningkatkan ekspresi wild p53, penurunan ekspresi
Bcl-2 dan menghambat angiogenesis melalui penurunan ekspresi VEGF,
BAB 2
TINJAUAN PUSTAKA
2.1 Karsinogenesis
Pertumbuhan kanker merupakan proses mikroevolusioner yang berlangsung beberapa bulan atau beberapa tahun. Proses pertumbuhan ini disebut karsinogenesis yang merupakan proses perubahan sekelompok sel normal menjadi sel kanker akibat pengaruh karsinogen. Karsinogen adalah bahan yang dapat memicu terjadinya kanker atau keganasan. Karsinogen dapat mempengaruhi DNA atau suatu protein yang berperan pada pengaturan siklus pembelahan sel, seperti protooncogene atau tumor s upressor ge ne (Sudiana, 2008).
Karsinogenesis dimulai dari satu sel kanker yang memperbanyak diri dan membentuk suatu koloni dalam jaringan yang sama. Perkembangan berikutnya akan terjadi perubahan genetik (seperti aktivasi oncogene). Munculnya kanker dapat dipicu oleh beberapa faktor seperti, bahan kimia, radiasi, dan virus. Faktor-faktor pencetus kanker ini memberikan pengaruh pada suatu kelompok gen yang disebut gen kanker. Protooncogene secara normal melakukan fungsi seluler yang berkaitan dengan pengaturan pembelahan sel, tetapi beberapa faktor pemicu dapat mengubah fungsi
protooncogene menjadi oncogene yang menyebabkan terjadinya pembelahan
cara yang dapat mengubah fungsi protooncogene adalah mutasi (Griffiths et
al.,1993; Kresno, 2011).
Proses karsinogenesis melalui beberapa stadium yang meliputi stadium inisiasi, stadium promosi dan stadium progresi (fase pr evaskuler dan f ase
vaskuler).
Gambar 2.1 Tahapan-tahapan proses karsinogenesis (Kresno, 2011)
perubahan genetik nyata melibatkan perubahan struktur dalam inti sel. Stadium progresi bersifat invasif dan seringkali diikuti dengan prosen pembentukan pembuluh darah baru (angiogenesis) (Mendelsohn et al., 2001; Sudiana, 2008).
2.1.1 Transformasi sel
Transformasi sel merupakan sel yang mengalami perubahan perilaku sebagai akibat adanya transkripsi dari suatu oncogene. Oncogene adalah
protooncogene yang mengalami mutasi. Transformasi sel normal menjadi sel
kanker terjadi sebagai akibat terganggunya sistem regulasi atau siklus sel. Secara fisiologi sel tumbuh dan berdiferensiasi, ada unsur genetik yang diaktifkan (Switched o n) dan yang lain diinaktifkan (Switched of f) .. Terganggunya sistem regulasi berakibat sel-sel kanker mampu membelah diri menjadi lebih lebih banyak dan tidak menghasilkan pertumbuhan sel-sel progenitor normal. Salah satu unsur penting dalam gangguan sistem regulasi pertumbuhan sel adalah oncogene (Sudiana, 2008; Kresno, 2011).
Karsinoma in situ (CIS) adalah bentuk awal dari kanker yang didefinisikan oleh tidak adanya invasi sel kanker ke jaringan sekitarnya, biasanya sebelum penetrasi ke membram basal. Dengan kata lain, sel-sel
neoplastik berkembang biak di habitat normal (Mendelsohn et al., 2008).
terjadinya disregulasi sel pada batas dimana terjadi pertumbuhan otonom dan perkembangan yang invasif. Proses neoplastik mula-mula bermanifestasi secara intraepitel dekat membran basal kemudian terjadi pertumbuhan klonal keratinosit sel yang berubah secara berlebihan, menggantikan epitelium normal. Setelah beberapa waktu atau beberapa tahun, terjadi invasi membran dasar jaringan epitel menandakan awal kanker invasif (Wahyuni, 2010). 2.1.2 Karsinoma Sel Skuamosa Rongga Mulut (KSSRM)
Karsinoma merupakan istilah yang digunakan untuk menyebut
neoplasma ganas yang berasal dari epitel. Neoplasma diartikan sebagai massa
jaringan abnormal, yang tumbuh berlebih, tidak terkoordinasi dan pertumbuhan terus berlanjut walaupun rangsangan telah hilang. Neoplasma merupakan sel yang telah berubah struktur dan fungsi, sehingga sel tersebut mengalami peningkatan jumlah yang abnormal, invasif, dapat menyebar melalui pembuluh getah bening dan pembuluh darah serta dapat menimbulkan metastasis di organ yang jauh (King, 2000).
Karsinoma sel skuamosa merupakan kanker yang sering terjadi pada rongga mulut, secara klinis terlihat sebagai plak keratosis, ulserasi, tepi lesi indurasi dan kemerahan. Pemeriksaan DNA menunjukkan mutasi p53 paling umum dijumpai hingga 90% kasus (Syafriadi, 2008).
Karsinoma sel skuamosa secara histologis menunjukkan proliferasi sel-sel epitel skuamosa. Terlihat sel-sel-sel-sel yang atipia disertai perubahan bentuk ret
peg processus, pembentukan keratin yang abnormal, pertumbuhan proliferasi
berinfiltrasi ke jaringan sekitarnya. Menurut WHO dalam (Syafriadi, 2008) klasifikasi karsinoma sel skuamosa rongga mulut secara histopalogis dibagi : 1. Well differentiated (Grade I ) : yaitu proliferasi sel-sel kanker di mana
sel-sel basaloid tersebut masih berdiferensiasi dengan baik membentuk keratin (keratin pearl).
2. Moderate differentiated (Grade II) : yaitu proliferasi sel-sel kanker di mana sebagian sel-sel basaloid tersebut masih menunjukkan diferensiasi membentuk keratin.
3. Poorly differentiated (Grade III) : yaitu proliferasi sel-sel kanker di mana seluruh sel-sel basaloid tidak berdiferensiasi membentuk keratin, sehingga sel sulit dikenali lagi.
2.1.2.1 Etiologi dan faktor predisposisi sel skuamosa rongga mulut
(KSSRM)
Faktor-faktor yang diketahui berimplikasi sebagai pemicu potensial atau
promotor karsinoma sel skuamosa rongga mulut adalah tembakau, alkohol,
bahan kimia, radiasi sinar matahari, radiasi, ionisasi, karsinogen yang berhubungan dengan pekerjaan, polutan lingkungan, obat-obatan, agen infeksi dan nutrisi (Mehrotra and Syadav, 2006).
terhadap kejadian kanker rongga mulut hingga saat ini belum jelas (Sunitha and Gabriel, 2004).
Karsinogen dari radiasi ada langsung dan tidak langsung. Secara tidak langsung; radiasi yang memapar tubuh akan mempengaruhi komponen air yang ada di dalam sel, sehingga terbentuk suatu bahan yang dikenal sebagai radikal bebas. Radikal bebas yang terbentuk dapat memicu mutasi DNA sehingga terbentuk klon baru (transform c ell), selanjutnya dapat memicu terjadinya suatu keganasan (malignant) (Sudiana, 2008 ; Kresno, 2011). Bahan kimia yang bersifat karsinogenik memiliki sifat yang sama, yaitu memicu terjadinya mutasi gen. Bahan kimia akan mengadakan ikatan dengan rantai DNA, sehingga DNA menjadi cacat (defect) (Sudiana, 2008).
Pertumbuhan KSSRM sangat dipengaruhi faktor eksogen dan endogen. KSSRM dapat terjadi akibat fungsi protein yang abnormal, akibat mutasi gen. Proliferasi berlebihan dan tidak terkendali dari sel yang abnormal dapat terjadi akibat gangguan siklus sel. Apoptosis yang mengalami kegagalan juga berperan terhadap karsinogenesis pada mukosa rongga mulut. Terdapat 4 golongan gen mengatur pertumbuhan normal yaitu protooncogene, tumor
suppressor gene, apoptosis gene serta DNA repair gene (Epstein and Waal,
2008).
2.1.2.2 Patobiologi molekuler sel skuamosa rongga mulut (KSSRM)
Perkembangan kanker dipengaruhi oleh banyak faktor dan pada umumnya merupakan interaksi antara faktor gen dan faktor lingkungan (
gen-environment interaction), khususnya lingkungan mikro yang ada di sekitar
kanker, yaitu hubungan antara perubahan genetik yang menyebabkan kanker dengan aktivasi reaksi inflamasi pro-kanker (Kresno, 2011).
Patogenesis molekuler karsinoma sel skuamosa rongga mulut merupakan akumulasi perubahan genetik yang melibatkan gen-gen, protooncogene dan
gen s upresor t umor (TSG), faktor-faktor lain yang terlibat antara lain;
kematian allel pada kromosom lain, mutasi protooncogene dan TSG, perubahan epigenetik seperti metilasi DNA atau deasetilasi histone (Epstein and Waal, 2008).
Karsinogenesis skuamosa rongga mulut merupakan proses kejadian genetik, yang mengubah fungsi normal protooncogene dan tumor suppressor
gene, hal ini dapat mengakibatkan peningkatan produksi faktor pertumbuhan,
peningkatn produksi faktor transkripsi. Hilangnya aktivitas penekan tumor menghasilkan fenotip sel yang mampu meningkatkan proliferasi sel yang cacat/abnormal. Secara fisiologis sistem pertumbuhan sel dalam individu diatur oleh sistem keseimbangan antara apoptosis dan proliferasi. Apabila pada individu terjadi proliferasi secara berlebihan, maka akan terjadi massa tumor (William, 2000; Sudiana, 2008).
banyak sel yang diproduksi dalam satuan waktu. Kedua, penurunan jumlah kematian sel akibat gangguan pada proses apoptosis. Gangguan pada berbagai protooncogen yang merangsang sel dan gen penekan tumor (TSGs) yang menghambat penghentian proses siklus sel (Mendelsohn et al, 2008). Gen p53 merupakan tumor s upresor ge n, yang berfungsi mencegah replikasi sel pada sel yang cacat atau rusak secara genetik melalui penghentian siklus sel, sehingga sel mempunyai waktu untuk menginduksi apoptosis. Gen p53 tidak bisa berfungsi akan menyebabkan proses apoptosis tidak bisa berjalan sehingga sel yang cacat akan terus berproliferasi (Lumongga, 2008).
Dalam kaitan dengan pengendalian onkogenesis, apoptosis merupakan mekanisme penting untuk mencegah proliferasi sel yang mengalami kerusakan DNA, agar sel-sel dengan lesi DNA tersebut tidak dilipatgandakan.
Apoptosis berfungsi sebagai salah satu kontrol dalam siklus sel. Kegagalan
sel-sel tumor untuk melaksanakan mekanisme apoptosis merupakan salah satu faktor yang mendasari pertumbuhan kanker yang makin lama makin besar. Selain akibat instabilitas genetik dan akumulasi kelainan genetik, juga akibat perubahan terhadap aturan yang ditentukan pada checkpoint siklus sel untuk menginduksi apoptosis (Budhy, 2004).
di atas fungsi apoptosis pada kanker seringkali terganggu, sehingga tidak jarang menyebabkan resistensi terhadap terapi. Karena itu pengetahuan rinci tentang jalur apoptosis dapat membantu untuk memberikan terapi yang lebih spesifik (Kresno, 2011).
2.2 Kematian Sel
Kematian sel terjadi setiap saat, kematian dapat bersifat fisiologis maupun patologis, keduanya adalah akibat serangkaian jejas atau stimulus. Pertumbuhan dan kematian sel adalah untuk upaya tubuh mencapai homeostatis jaringan (Pelengaris, et al.,2006). Kematian sel, secara morfologi dapat menunjukkan gambaran campuran apoptosis dan nekrosis (Yakovlev and Faden,2004).
2.2.1 Apoptosis
Apoptosis merupakan mekanisme alamiah yang dialami oleh sel. Ada dua
alasan utama mengapa sel melakukan mekanisme ini. Pertama apoptosis memang diperlukan untuk proses pertumbuhan atau perkembangan sel, jaringan atau organ lebih lanjut. Alasan kedua adalah untuk menghancurkan sel-sel yang dianggap membahayakan bagi integritas organisme itu sendiri, seperti sel yang terinfeksi oleh virus, sel dengan kerusakan DNA maupun kanker (Meir, 2000; Nurhayati dan Lusiyanti, 2006).
Apoptosis merupakan kematian sel melalui mekanisme genetik yang
kemoterapi, infeksi virus, gangguan hormonal, bahan-bahan kimia dan faktor pertumbuhan (Salido et al., 2009).
Apoptosis merupakan bentuk kematian sel yang diperlukan baik untuk
perkembangan sel normal maupun homeostatis jaringan. Peristiwa ini dikendalikan secara ketat oleh berbagai gen, baik gen yang bersifat apoptotik maupun anti apoptotik. Apoptosis terjadi melalui 3 fase yaitu; fase inisiasi, fase efektor dan fase ekskusi atau degradasi (Kresno, 2011).
Apoptosis adalah program bunuh diri intraseluler, terlaksana dengan
mengaktifkan caspase. Apoptosis diawali oleh aksi termasuk yang dimediasi oleh reseptor dari kompleks sinyal yang menginduksi kematian DISC (Death
Inducing Signaling C omplex). Komponen utama dari DISC adalah FasL
(CD95L), TRAIL (Tumor Necroting F actor-Related A poptosis I nducing
Ligand). Sekali teraktivasi oleh mekanisme aktifasi atau autokatalisator,
maka kerusakan sel bermula pada caspase 8 yang melepaskan DISC, yang menyebabkan aksi selanjutnya. Caspase ini juga dinamakan caspase pengekskusi (Baert, 2008).
2.2.1.1 Apoptosis fisiologis
Telomer yang terletak pada ujung kromosom merupakan salah satu faktor
yang sangat penting dalam melindungi kromosom. Pada sel normal, telomer ini akan mengalami pemendekan pada waktu sel melakukan pembelahan diri. Bila ukuran telomer mencapai ukuran tertentu (level kritis) sebagai akibat dari pembelahan berulang, maka sel tersebut tidak dapat melakukan pembelahan diri lagi. Selanjutnya akan terjadi fragmentasi kromosom dan akhirnya sel mengalami apoptosis secara fisiologis (Sudiana, 2008).
Pada sel ganas, pemendekan telomer sampai pada level kritis tidak akan terjadi, karena pada sel ganas terjadi aktivitas dari enzim ribonukleoprotein (telomerase) secara terus menerus, dimana enzim ini sangat berperan pada sentesis telomeric DNA, sehingga berbagai elemen yang dibutuhkan pada pembentukan telomer dapat dibentuk secara terus menerus dan keberadaan ukuran telomer pada ujung kromosom dapat dipertahankan. Pada sel normal, aktivitas telomerase waktunya terbatas, tetapi pada sel kanker enzim ini sangat aktif, sehingga terjadi pemblokiran proses pemendekan telomer pada waktu pembelahan diri. Oleh karena itu, maka sel ganas dapat bersifat
immortal (Mendelsohn et al., 2008).
2.2.1.2 Apoptosis patologis
Kematian sel karena adanya suatu rangsangan. Proses kematian sel
(apoptosis) ini dapat melalui beberapa jalur, antara lain;
a. Aktivitas wildp53
dalam suatu sel dapat dipicu oleh banyak faktor antara lain bahan kimia, radikal bebas, maupun virus (oncovirus). Gen yang cacat dapat memicu aktivitas beberapa enzim seperti PKC dan CPK-K2. Dimana kedua enzim memicu aktivitas wild p53, wild p53 merupakan faktor transkripsi terhadap pembentukan p21. Peningkatan p21 yang disentesis akan menekan semua CDK. Terjadinya siklus pembelahan sel sangat tergantung pada ikatan kompleks antara CDK dengan cyclin (Kresno, 2011).
CDK yang muncul pada fase M adalah CDK-1. Demikian juga halnya CDK yang muncul pada fase S adalah CDk-2, CDK-4, CDK-6.
Cyclin adalah suatu protein yang dihasilkan oleh sel, dimana protein ini
dapat muncul dan hilang pada fase siklus sel, cyclin pada fase M adalah
cyclin A dan cyclin B, pada fase G-1 adalah cyclin-D dan cyclin-E.
Sementara pada fase S adalah cyclin-A dan cyclin-E (Sudiana, 2008). Apabila terjadi peningkatan p21, maka semua CDK akan ditekan,
dengan terjadinya penekanan semua CDK pada fase siklus sel, maka siklus sel akan berhenti. Saat siklus sel berhenti, wild p53 akan memicu
Bax, protein Bax akan menekan aktivitas Bcl-2 pada membran
membran inti dan merusak DNA, sehingga DNA sel yang bersangkutan rusak (fragmentasi) dan akhirnya sel mengalami kematian (apoptosis), (Mendelsohn et al., 2008).
b. Jalur sitotoksik
Terjadinya apoptosis melalui jalur sitotoksik ini dipicu oleh adanya sel yang memiliki gen cacat (gene defect). Dengan adanya kecacatan gen ini, maka sel tersebut akan mengekspresikan protein asing. Protein asing yang dihasilkan dapat bersifat imunogenik, sehingga memicu terjadinya proses pembentukan antibodi. Antibodi yang terbentuk dapat menempel dipermukaan sel tertentu. Hal ini terjadi karena ada beberapa sel yang pada membrannya memiliki FC receptor dan antibodi (khususnya FC
receptor terhadap Ig-G), antara lain sel killer. Dengan adanya reseptor
tersebut, maka antibodi yang berada di permukaan killer, selanjutnya akan mengikat protein asing yang berada di permukaan sel yang memiliki gen cacat (Kresno, 2011).
yang merusak DNA yang berada di dalam inti, sehingga sel mengalami kematian (apoptosis) (Mendelsohn, et al., 2008).
c. Kompleks fas dan ligand
Terjadinya apoptosis melalui jalur ligand dan fas dapat terjadi karena dipicu oleh adanya sel tumor atau sel kanker. Pada sel tumor atau sel kanker, di permukaannya akan tereksperesi suatu protein yang disebut
fas. Sementara di dalam tubuh terdapat beberapa sel seperti NK-cell
(Natural Killer Cell) dan CTL (Cytotoxic T-Lymphocyte) (Baratawidjaja
dan Rengganis, 2010).
Cytotoxic T -Lymphocyte adalah suatu sel ketahanan tubuh yang
dapat mengekspresikan ligand, sehingga fas di permukaan sel tumor atau kanker akan diikat oleh ligand yang berada di permukaan NK-cell atau
CTL. Adanya ikatan antara fas-ligand tersebut menimbulkan sinyal
transduksi ke dalam sitosol pada sel kanker, sehingga di dalam sitosol pada sel tersebut terjadi aktivasi suatu protein yang disebut sebagai Fas
Associated P rotein D eath D omain (FADD). FADD kemudian
2.2.1.3 Jalur Utama Apoptosis
Jalur utama apoptosis ada dua yaitu jalur intrinsik (mitokondria ) dan jalur ekstrinsik (death receptor pathway). Kedua jalur terhubung satu dengan lain, molekul di jalur yang satu dapat mempengaruhi molekul di jalur yang lain. Selain itu ada jalur tambahan yang melibatkan sitotoksisitas yang dimediasi oleh sel T dan pembunuhan sel yang bergantung pada perforin
/granzim tetapi yang paling berperan dalam bidang onkologi adalah jalur
intrinsik dan jalur ekstrinsik (Nurhayati dan Lusiyanti, 2006; Kresno, 2011).
Gambar 2.2 Tiga jalur apoptosis yaitu jalur ekstrinsik (death-receptor
pathway), jalur intrinsik yang juga disebut jalur mitokondria dan jalur perforin/granzim (Jalur ekstrinsik dan jalur intrinsik merupakan jalur utama) (Kresno, 2011).
a. Jalur Intrinsik
intrasel dan berkaitan erat dengan mitokondria. Stimulus yang mengawali jalur intrinsik menghasilkan sinyal intrasel yang dapat berupa sinyal negatif atau sinyal positif. Semua stimulus menyebabkan perubahan pada pori membran mitokondria sehingga menjadi permeable dan dilepaskan dua kelompok protein pro-apototik ke dalam sitosol. Kelompok pertama terdiri atas cytochrome-c, Smac/DIABLO, dan serine protease HtrA2/Omi. Protein-protein ini mengaktivasi jalur mitochondria yang bergantung caspase. Cytochrome-c mengikat Apaf-1 dan pro-caspase-9 dan membentuk apoptosom. Smac/DIABLO dan HtrA2/Omi mempromosikan apoptosis dengan cara menghambat IAP (inhibitor o f
apotosis pr otein). Kelompok kedua adalah AIF, endonuklease G dan
CAD, yang dilepaskan pada saat sel akan mengalami (committed) apoptosis. Pengontrolan dan pengaturan proses dalam jalur mitochondria dilakukan melalui keluarga protein Bcl-2 (Kreno, 2011).
b. Jalur Ekstrinsik
Jalur ekstrinsik melibatkan interaksi yang dimediasi oleh reseptor transmembran, mencakup antara lain reseptor kematian (death-receptor) keluaga TNF. Receptor dari keluarga memiliki domain ekstra sel yang kaya akan cystein dan memiliki domain sitoplasmik yang disebut
death-domain yang berperan penting dalam meneruskan sinyal kematian dari
dan fungsinya sudah jelas, yaitu Fas/FasR, TNFα/TNFR, Apo3L/DR3, Apo2L/DR4 dan Apo2L/DR5.
Urutan peristiwa yang terjadi pada jalur ekstrinsik dimulai dengan pengikatan ligand, misalnya FasL, dengan FasR, disusul dengan rekrutmen protein-protein adapter sitoplasmik yang merupakan death domain yang berikatan dengan reseptor tersebut. Dalam hal jalur FsL/FasR, death domain-nya adalah FADD (Fas associated de ath
domain ), sedangkan pada jalur TNF/TNFR adapter protein yang terikat
adalah TRADD (TNF r eceptor as sociated de ath dom ain). FADD dan TRADD kemudian berikatan dengan pro-caspase-8 melalui dimerisasi domain efektor kematian (death efffector dom ain). Pada saat ini terbentuklah death inducing s ignaling c omplex (DISC) yang menyebabkan aktivasi autokatalitik pro-caspase-8. Setelah caspase-8 diaktivasi, terjadi stimulasi fase ekskusi. Apoptosis yang dimediasi oleh reseptor kematian dapat dihambat oleh protein yang disebut c-FLIP yang mengikat FADD dan caspase-8 sehingga keduanya menjadi tidak efektif (Kresno, 2011).
2.2.2 Nekrosis
Nekrosis adalah kematian sel, yang terjadi pada kasus jejas berat dan
patologik (misal iskemia otak) atau kerusakan jantung yang disebabkan oleh sitokin dan toksin, kematian sel dapat terjadi kedua-duanya melalui nekrosis dan apoptosis. Secara morfologi, nekrosis ditandai dengan pembengkakan seluler. Hal ini menyebabkan membran plasma pecah yang berakibat pada pelepasan isi sitoplasma ke jaringan sekitarnya yang menyebabkan respons inflamasi. Organel juga bengkak dan pecah, sedang inti masih utuh meskipun dalam keadaan mmbengkak terjadi penggumpalan kromatin, degradasi DNA. Degradasi DNA fragmen besar pada waktu nekrosis lebih mengendalikan
serin pr otease daripada kaspase untuk menginduksi aktifitas endonuklease.
Lebih jauh faktor kondensasi kromatin tidak bergantung kaspase AIF ini bisa berperan juga, seperti merelokalisasi inti selama nekrosis. Keberadaan jalur kematian sel seperti nekrosis ini diatur oleh program kematian intrinsik yang khusus yang berbeda dengan apoptosis. Elemen pokok pada nekrosis fosforilasi oksidatif mitokondria, produksi oksigen reaktif, dan kaskade proteolitik non kaspase yang tergantung serin protease yaitu calpain atau cat
thepsin. Nekrosis merupakan kematian sebagian jaringan (Pulmeriastuti,
2006).
Nekrosis adalah kematian sel karena adanya kerusakan sistem membran.
protein-protein, baik yang berada pada sitosol maupun protein penyusun sistem membran dari sel tersebut (Sudiana, 2008).
2.3 Proliferasi sel
Pada sel normal terdapat keseimbangan antara faktor pertumbuhan sel dan faktor kematian sel (apoptosis) yang dipengaruhi oleh protooncogene dan
tumor suppresor ge ne. Pertumbuhan sel terjadi karena penambahan ukuran
dan jumlah sel dari populasi sel yang aktif melakukan siklus sel atau aktivitas proliferasi. Keseimbangan dalam pertumbuhan harus terkontrol. Pada manusia dewasa jumlah sel relatif tetap. Mitosis pada manusia dewasa bertujuan untuk menggantikan sel yang mati karena proses apoptosis atau
nekrosis. Kegagalan kontrol keseimbangan mekanisme tersebut dapat
mengakibatkan siklus sel yang tidak terkendali (Mendelsohhn et al., 2008). Siklus pembelahan sel :
Siklus pembelahan sel pada dasarnya dibagi dua fase : 1. Fase mitosis (M)
semakin ganas dan makin cepat pertumbuhannya. Aktivitas proliferasi sel sangat tergantung pada waktu sel (cell c ycle tim e) yaitu waktu yang diperlukan untuk suatu proses mitosis ke mitosis berikutnya. Siklus pembelahan sel dikendalikan oleh suatu protein regulator yaitu cyclin dan katalisator Cyclin D ependent K inase (CDK). Siklus proliferasi sel atau pembelahan sel dihambat oleh inhibitor, antara lain ; p2, p21, p27 dan p57. Inhibitor ini akan mengikat CDK-cyclin complex sehingga menghambat aktivitas kinase yang akhirnya menghentikan siklus pembelahan sel (Roger and Robin, 2006).
2.4 Regulasi Apoptosis
2.4.1 Bcl-2
Regulasi dalam apoptosis antara lain adalah anggota keluarga Bcl-2. Ada 18 anggota keluarga Bcl-2 yang diketahui sampai saat ini, dibagi dalam tiga sub kelompok, yang didasarkan atas strukturnya. Anggota sub kelompok pertama diwakili oleh Bcl-2 dan Bcl-xl yang memiliki fungsi sebagai anti
apoptosis (Mendelsohn etal., 2008).
Bcl-2 (B C ell L ymphoma) adalah suatu protein yang berukuran 26 kDa
yang berfungsi sebagai penekan kematian sel yang terprogram (apoptosis).
Bcl-2 menghambat apoptosis dan memperpanjang masa hidup sel saat ada
sinyal apoptosis (Baert, 2008).
mencegah apoptosis atau anti apopt osis dan mempromosikan pertumbuhan sel, sedang Bax memicu terjadinya apoptosis yang menyebabkan kematian sel. Keseimbangan antara Bcl-2 dan Bax adalah merupakan hal yang penting apakah sel akan terus tumbuh atau mengalami apoptosis (Pelengaris et al ., 2006).
Bcl-2 merupakan protein regulator apoptosis sepanjang 25 kDa yang
terletak pada membran mitokondria bagian dalam retikulum endoplasma dan selubung neklues. Ekspresinya dikaitkan dengan proliferasi sel, perkembangan jaringan dan morfogenesis (Solomon et al., 2010).
Bcl-2 mengkode protein yang berperan sebagai anti apopt osis.
Dimana protein ini bekerja untuk menekan fungsi protein Bax pada membran mitokondria karena protein Bax berperan membuka pt-pore, sehingga
cytochrome-c keluar dari mitokondria. Cytochrome-c kemudian mengaktifkan
Apaf-1. Selanjutnya, Apaf-1 mengaktivasi kaskade-kaspase, sehingga sel
mengalami kematian (apoptosis). Dengan adanya aktivasi dari protein Bcl-2, maka apoptosis tidak terjadi (Sudiana, 2008).
Bcl-2 merupakan protein regulator apoptosis sepanjang 25 kDa yang
terletak pada membran mitokondria bagian dalam, retikulum endoplasma dan selubung nukleus, ekspresinya dikaitkan dengan proliferasi sel kanker, perkembangan jaringan sel kanker (Solomon, 2010).
Bcl-2 dikenal sebagai inhibitor apoptosis. Bcl-2 secara spesifik
Bcl-2 dapat diperiksa melalui reaksi komplek antigen antibodi dengan
pemeriksaan imunohistokimia metode streptavidin-biotin. 2.5 Regulasi Proliferasi
2.5.1 Wild p53
Tumor suppressor protein adalah suatu protein yang berperan sebagai
faktor pengendalian pertumbuhan sel, yang termasuk kelompok ini adalah;
pRb, wild p53. Protein pRb dan wild p53 dapat bekerja di dalam inti sel,
khususnya pada proses pengendalian siklus pembelahan sel, dimana pRb berperan pada pengendalian faktor transkripsi pada siklus pembelahan sel, sedangkan wild p53 berperan pada pengendalian CDK pada siklus pembelahan sel. Selain itu wildp53 juga mempunyai peran dalam pengaturan kematian sel (apoptosis), yaitu merusak sel yang memiliki urutan nukleotida yang abnormal (Mendelsohn et al., 2008).
Secara fisiologi pada sel, ada suatu sistem yang mengatur susunan nukleotida pada rantai DNA yang mengalami perubahan (mutasi). Sistem tersebut dikenal dengan DNA repair. Kerja dari sistem ini adalah dengan memperbaiki urutan DNA yang mengalami mutasi. Artinya, apabila terjadi kerusakan susunan DNA baik disebabkan oleh suatu karsinogen atau
ultraviolet, maka akan muncul suatu respons sel yang disebut sebagai NER
(Nucleotidie Excision Repair). Secara konseptual kerja NER ini dibagi dalam lima fase, yaitu (1) Damage recognition (b) Incision (c) Excision (d)
Synthesis repair dan (e) Ligation. Oleh karena itu, secara normal sel yang
memiliki susunan nukleotida yang tidak menyimpang. Apabila perbaikan DNA gagal, maka akan dilakukan penghentian pertumbuhan sel melalui penghambatan siklus pembelahan sel, dan selanjutnya terjadi apoptosis. Selain p21 ekspresinya dikendalikan oleh wild p53, yang bekerja dengan menghambat semua CDK, juga ditemukan beberapa protein yang berperan pada siklus pembelahan sel, seperti p15 dan p16. Namun, pengaturan ekspresi dari protein p15 dan p16 sampai saat ini belum jelas. Akan tetapi, target kerja dari kedua protein tersebut telah diketahui dengan jelas, yaitu menghambat CDK-4 dan CDK-6 pada fase G-1. Kinase yang bekerja memicu aktivitas
wild p53 untuk memodulasi protein Bax pada proses apoptosis, antara lain
CPK-2 (Cystein Protein Kinase-2) dan PKC (Sudiana, 2008).
Wild p53 adalah suatu tumor suppressor gene dengan Berat Molekul
(BM) 53 kDa, terletak pada kromosom 17 lengan pendek (17p) dan mempunyai 11 ekson serta memiliki tiga domain struktural yang diekspresikan pada semua jaringan tubuh. Struktur wild p53 terdiri atas daerah N terminal trans-aktivasi, daerah DNA binding dan daerah C terminal. Daerah N terminal trans-aktivasi bertanggung jawab mengatur stabilitas wild
p53 intrasel. Ikatan dengan MDM2 (Murine D ouble Minute 2) akan
menghambat trans-aktivasi wild p53 dan menyebabkan degradasi wild p53. Daerah DNA binding spesifik berguna untuk menempel wild p53 pada DNA di mana penempelan ini berefek menghambat proses transkripsi. Daerah C