lxiii
Bab IV Hasil dan Pembahasan
IV.1 Karakteristik katalis
Pembuatan katalis HTSC ITB didasarkan pada prosedur menurut dokumen paten Jennings 1984 yang secara garis besar dapat diuraikan sebagai berikut :
Proses presipitasi diawali dengan membuat dua macam larutan, yaitu larutan I dan II. Larutan I berupa larutan ferri nitrat dan kromium nitrat, masing-masing dengan konsentrasi 0,429 mol/liter dan 0,0429 mol/liter. Sedangkan larutan presipitator (larutan II) berupa larutan Na2CO3 2,358 mol/liter. Selanjutnya
larutan I dituang ke dalam larutan II. Pencampuran dilakukan pada temperatur 60 oC dan pH akhir pencampuran yang mendekati netral (pH =7-8,5) sambil terus diaduk sehingga karbon dioksida yang larut dapat terlepas. Suspensi yang dihasilkan selanjutnya disaring dan dicuci. Presipitat yang dihasilkan dikeringkan dan direduksi dengan menggunakan campuran kukus dan hidrogen pada temperatur 300 oC sebelum digunakan untuk reaksi.
Pada prosedur ini tidak disebutkan kondisi pengeringan dan kalsinasi, sehingga perlu dilakukan studi literatur untuk mencari kondisi pengeringan dan kalsinasi (waktu dan temperatur). Berdasarkan hasil studi literatur, digunakan temperatur pengeringan 105 oC selama 18 jam (Richardson, 1989). Temperatur pengeringan ini dipilih untuk menghindari terjadinya gradien temperatur yang tinggi antara presipitat dan lingkungannya sehingga mengakibatkan tekanan tinggi dalam pori katalis. Tekanan tersebut menyebabkan runtuhnya dinding pori katalis dan membentuk pori katalis yang sangat besar. Akibatnya luas permukaan katalis menjadi sangat kecil (Richardson, 1989). Menurut Satterfield (1991), temperatur kalsinasi yang digunakan harus lebih tinggi dari temperatur reaksi dengan tujuan untuk meningkatkan ketahanan katalis terhadap perubahan temperatur. Karena reaksi HTSC biasanya dilangsungkan pada temperatur 370-400 oC, maka pada percobaan I dipilih temperatur kalsinasi 400 oC dan waktu kalsinasi 6 jam.
Percobaan pertama penerapan prosedur ini menghasilkan katalis yang diberi nama katalis HTSC ITB 1. Katalis tersebut berwarna coklat tua mendekati hitam dan memiliki luas permukaan 15 m2/g.
lxiv
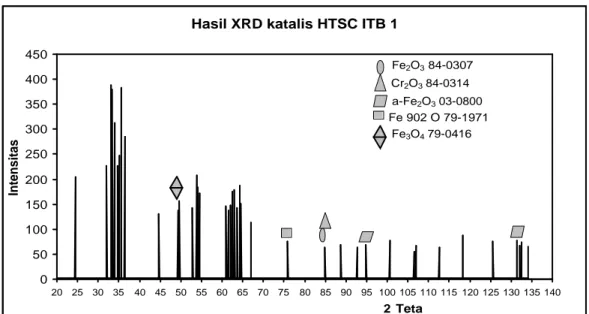
Hasil analisa XRD katalis HTSC ITB 1 dapat dilihat pada gambar IV.1 berikut ini.
Gambar IV.1 Difraktogram katalis HTSC ITB 1
Pada gambar IV.1 dapat diamati puncak – puncak difraktogram katalis HTSC ITB 1. Berdasarkan pengamatan terhadap difraktogram tersebut, katalis ini berfasa amorf dengan terbentuknya puncak – puncak yang melebar (Richardson, 1991). Selanjutnya difraktogram katalis HTSC ITB 1 dibandingkan dengan difraktogram standar Fe2O3, C r2O3, F e3O4, α -Fe2O3, dan Fe902O
(Lampiran F) yang dapat dilihat pada tabel IV.1 berikut ini.
Tabel IV.1 Perbandingan difraktogram katalis HTSC ITB 1 dengan standar Fe2O3, α-Fe2O3, Fe902O, Fe3O4, dan Cr2O3 (Lampiran F)
Menunjukkan Puncak Katalis HTSC
ITB 1 Fe2O3 α-Fe2O3 Fe902O Fe3O4 Cr2O3
2θ Int 2θ Int 2θ Int 2θ Int 2θ Int 2θ Int
49.340 137 - - - 48.459 135 - - 75.860 75 - - - - 75.577 82 - - - - 84.920 63 85.16 64 - - - 84.44 61 94.900 68 - - 94.333 70 - - - - 131.4 77 - - 131.9 80 - - - - Int = Intensitas
Hasil XRD katalis HTSC ITB 1
0 50 100 150 200 250 300 350 400 450 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 110 115 120 125 130 135 140 2 Teta Intensitas Fe2O3 84-0307 Cr2O3 84-0314 a-Fe2O3 03-0800 Fe 902 O 79-1971 Fe3O4 79-0416 IV-2
lxv
Dengan membandingkan difraktogram katalis HTSC ITB 1 dengan difraktogram standar (Lampiran F), diperkirakan katalis HTSC ITB 1 mengandung Fe2O3, α-Fe2O3, Fe902O, dan Cr2O3. Menurut Reade (2006), Fe3O4
berwarna hitam dan menurut Weiser (1935), α-Fe2O3 berwarna merah,
sedangkan Fe2O3 berwana merah tua. Karena adanya campuran Fe2O3 yang
berwarna merah tua, α-Fe2O3 yang berwarna merah, dan Fe3O4 yang berwarna
hitam menyebabkan katalis HTSC ITB 1 cenderung berwarna coklat tua mendekati hitam.
Luas permukaan yang dihasilkan katalis HTSC ITB 1 (15 m2/g) jauh lebih kecil dari luas permukaan katalis yang diklaim Jennings yaitu 100-200 m2/g. Selanjutnya dilakukan analisis untuk mengetahui faktor – faktor yang mempengaruhi luas permukaan katalis. Menurut berbagai literatur luas permukaan katalis dipengaruhi oleh variabel pembuatan sebagai berikut.
1. pH pencampuran
pH pencampuran sangat mempengaruhi ukuran partikel presipitat yang dihasilkan. Presipitasi pada kondisi yang asam atau basa akan menghasilkan ukuran partikel yang besar (Twigg, 1989). Hal ini harus dihindari karena ukuran partikel yang besar akan menyebabkan luas permukaan katalis menjadi lebih kecil. Oleh karena itu, sebaiknya pH akhir pencampuran yang digunakan adalah pH akhir pencampuran mendekati netral (pH = 7–8,5) (Jennings, 1984).
Selain itu pH akhir pencampuran harus tetap dijaga 7-8,5 untuk menghindari terjadinya perubahan pH menjadi asam atau basa yang akan mempengaruhi sifat amfoterik oksida krom hidrat (Vogel, 1951). Bila larutan bersifat basa, maka oksida krom hidrat akan membentuk Cr(OH)4- dan bila
larutan bersifat asam maka oksida krom hidrat akan membentuk Cr3+. Keduanya larut dalam air dan akan hilang pada saat pencucian presipitat.
lxvi
Reaksi pembentukan Cr(OH)4- dan Cr3+ dapat dilihat pada persamaan 4.1
dan 4.2 berikut ini.
Cr(OH)3(s) + OH-(aq) à Cr(OH)4-(aq) ...(4.1)
Cr(OH)3(s) + 3H+ (aq) à Cr3+(aq) + 3H2O(l) ...(4.2)
2. Proses aging
Proses aging bertujuan untuk memperbaiki tingkat kristalinitas presipitat. Hal ini disebabkan karena pada saat aging terjadi interaksi kimia antar partikel (Kolthoff, 1952). Akan tetapi proses aging pada pembuatan katalis HTSC ITB sebaiknya dihindari. Hal ini disebabkan karena kristal presipitat yang besar akan menyebabkan luas permukaan menjadi lebih kecil.
3. Temperatur kalsinasi
Kalsinasi bertujuan untuk mendekomposisi Fe(OH)3 menjadi Fe2O3,
menghilangkan sisa molekul air dan impuritis dari proses pencampuran, seperti karbonat dan nitrat. Sisa karbonat dan nitrat yang terperangkap akan menyebabkan luas permukaan aktif katalis menjadi lebih kecil (Twigg, 1989). Selain itu proses kalsinasi juga bertujuan untuk meningkatkan ketahanan katalis terhadap temperatur (Satterfield, 1991). Menurut Neel (1979), temperatur kalsinasi yang baik digunakan untuk katalis HTSC adalah 400-1000 oC selama 6 jam. Akan tetapi penggunaan temperatur kalsinasi yang terlalu tinggi dapat menyebabkan katalis mengalami sintering sehingga luas permukaan katalis yang dihasilkan menjadi lebih kecil. Akibatnya aktivitas katalis menjadi lebih rendah (Satterfield, 1991).
Menurut Davis (1998) pada pembuatan katalis Fischer-Tropsch berbasis Fe, Fe2O3 murni yang dihasilkan melalui metode presipitasi yang dikalsinasi pada
temperatur 350 oC memiliki luas permukaan 100 m2/g. Sedangkan pada temperatur kalsinasi yang lebih tinggi yaitu 400 oC , F e2O3 memiliki luas
permukaan 53 m2/g. Perbedaan ini membuktikan bahwa temperatur kalsinasi berpengaruh terhadap luas permukaan katalis berbasis oksida besi.
Berdasarkan hasil studi literatur dan percobaan, dapat disimpulkan bahwa faktor yang sangat berpengaruh terhadap luas permukaan katalis adalah
lxvii
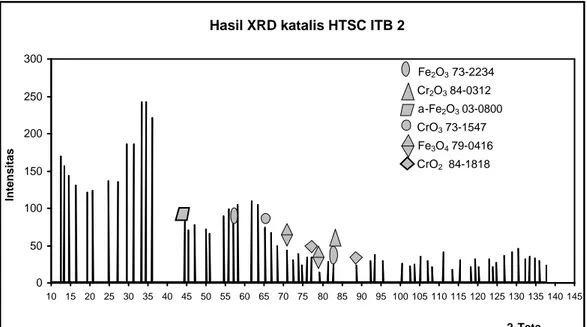
temperatur kalsinasi. Oleh karena itu, percobaan dilanjutkan dengan menggunakan temperatur kalsinasi yang lebih rendah yaitu 300 oC. Katalis yang dihasilkan berwarna coklat tua dan memiliki luas permukaan 163 m2/g. Katalis ini diberi nama katalis HTSC ITB 2. Hasil analisa XRD katalis HTSC ITB 2 dapat dilihat pada gambar IV.2 berikut ini.
Gambar IV.2 Difraktogram katalis HTSC ITB 2
Gambar IV.2 menampilkan difraktogram katalis HTSC ITB 2. Puncak – puncak yang dihasilkan berbentuk melebar sehingga dapat dikatakan bahwa katalis HTSC ITB 2 berfasa amorf. Selanjutnya difraktogram katalis HTSC ITB 2 dibandingkan dengan difraktogram standar Fe3O4, α-Fe2O3, Fe2O3, CrO3, Cr2O3,
CrO2, dan g-Fe2O3 (Lampiran F) yang dapat dilihat pada tabel IV.2 berikut ini. Hasil XRD katalis HTSC ITB 2
0 50 100 150 200 250 300 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 110 115 120 125 130 135 140 145 2 Teta Intensitas Fe2O3 73-2234 Cr2O3 84-0312 a-Fe2O3 03-0800 CrO3 73-1547 Fe3O4 79-0416 CrO2 84-1818 IV-5
lxviii
Tabel IV.2 Perbandingan difraktogram katalis HTSC ITB 2 dengan standar Fe3O4, α-Fe2O3, Fe2O3, CrO3, CrO2, dan Cr2O3 (Lampiran F)
Menunjukkan Puncak Katalis
HTSC
ITB 2 Fe3O4 α-Fe2O3 Fe2O3 CrO3 Cr2O3 CrO2
2θ Int 2θ Int 2θ Int 2θ Int 2θ Int 2θ Int 2θ Int
45.38 71 - - 44.99 70 - - - - 57.02 79 - - - - 57.64 76 - - - - 66.84 67 - - - 66.47 79 - - - - 70.90 43 70.95 32 - - - - 79.30 14 78.96 24 - - - 78.55 19 82.82 26 - - - - 83.02 36 - - 82.24 31 - - 88.78 24 - - - 88.41 20 Int = Intensitas
Dengan membandingkan difraktogram katalis HTSC ITB 2 dengan difraktogram standar (Lampiran F), diperkirakan katalis HTSC ITB 2 mengandung Fe3O4, α-Fe2O3, Fe2O3, CrO3, Cr2O3, dan CrO2. Karena adanya
campuran Fe2O3 yang berwarna merah tua, α-Fe2O3 yang berwarna merah, dan
Fe3O4 yang berwarna hitam menyebabkan katalis HTSC ITB 2 berwarna coklat
tua sedikit lebih muda dari katalis HTSC ITB 1. Sedangkan luas permukaan katalis HTSC ITB 2 (163 m2/g) yang diperoleh sudah lebih baik dari luas permukaan katalis HTSC ITB 1 (15 m2/g). Akan tetapi luas permukaan katalis HTSC ITB 2 belum mendekati luas permukaan maksimum yang diklaim Jennings yaitu 200 m2/g.
Selanjutnya pada kunjungan ke pabrik katalis Kujang Sud Chemie diperoleh informasi bahwa pencucian presipitat dengan menggunakan air hangat akan menyebabkan luas permukaan katalis menjadi lebih besar. Dari studi literatur diperoleh penjelasan bahwa impuritis mudah larut dalam air hangat (sekitar 50 oC) dan kembali ke larutan sehingga presipitat yang dihasilkan menjadi lebih murni (Hobart, 1940). Kemurnian presipitat ini nantinya akan berpengaruh terhadap luas permukaan dan aktivitas katalis yang dihasilkan. Selain itu pencucian dengan menggunakan air hangat akan meningkatkan laju penyaringan presipitat yang dihasilkan (Szabo, 1976).
Berdasarkan informasi tersebut di atas, pada percobaan selanjutnya pencucian presipitat dilakukan dengan menggunakan aqua dm 50 oC. Katalis yang dihasilkan diberi nama katalis HTSC ITB 3. Katalis ini berwarna coklat tua dan memiliki luas permukaan 192 m2/g.
lxix
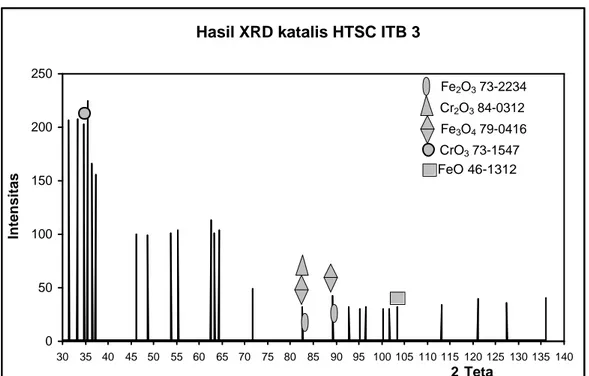
Hasil analisa XRD katalis HTSC ITB 3 dapat dilihat pada gambar IV.3 berikut ini.
Gambar IV.3 Difraktogram katalis HTSC ITB 3
Gambar IV.3 menunjukkan difraktogram katalis HTSC ITB 3. Berdasarkan hasil pengamatan dapat diketahui bahwa katalis ini berfasa amorf. Difraktogram katalis ini selanjutnya dibandingkan dengan difraktogram standar Fe2O3, Cr2O3, Fe3O4, CrO3, dan FeO (Lampiran F) yang dapat dilihat pada tabel
IV.3 berikut ini.
Tabel IV.3 Perbandingan difraktogram katalis HTSC ITB 3 dengan standar Fe3O4, Fe2O3, FeO, CrO3, dan Cr2O3 (Lampiran F)
Menunjukkan Puncak Katalis HTSC
ITB 3 Fe3O4 Fe2O3 FeO CrO3 Cr2O3
2θ Int 2θ Int 2θ Int 2θ Int 2θ Inte 2θ Int
37.28 156 - - - 37.99 156 - -
82.60 32 81.89 41 83.02 36 - - - - 82.24 31
89.30 42 89.64 37 88.62 49 - - - -
103.36 32 - - - - 102.89 30 - - - -
Int = Intensitas
Hasil XRD katalis HTSC ITB 3
0 50 100 150 200 250 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 110 115 120 125 130 135 140 2 Teta Intensitas Fe2O3 73-2234 Cr2O3 84-0312 Fe3O4 79-0416 CrO3 73-1547 FeO 46-1312 IV-7
lxx
Dengan membandingkan difraktogram katalis HTSC ITB 3 dengan difraktogram standar (Lampiran F), diperkirakan katalis HTSC ITB 3 mengandung Fe2O3, C r2O3, Fe3O4, CrO3, dan FeO. Karena adanya campuran
Fe2O3 yang berwarna merah tua, dan Fe3O4 yang berwarna hitam menyebabkan
katalis HTSC ITB 3 berwarna coklat tua namun sedikit lebih tua dari katalis HTSC ITB 2. Hal yang sangat menggembirakan adalah dengan prosedur ini (prosedur pembuatan katalis HTSC ITB 3) diperoleh katalis dengan luas permukaan 192 m2/g. Luas permukaan katalis ini telah mendekati luas permukaan maksimum yang diklaim Jennings yaitu 200 m2/g.
Kalsinasi pada temperatur yang rendah (T = 300 oC) telah menghasilkan katalis dengan luas permukaan yang besar (192 m2/g). Akan tetapi dikhawatirkan Fe(OH)3 belum terdekomposisi secara sempurna pada temperatur 300 oC. Oleh
karena itu percobaan dilanjutkan dengan meningkatkan temperatur kalsinasi menjadi 330 oC. Temperatur ini tidak terlalu tinggi untuk menghindari terjadinya sintering dan tidak terlalu rendah agar Fe(OH)3 dapat terdekomposisi secara
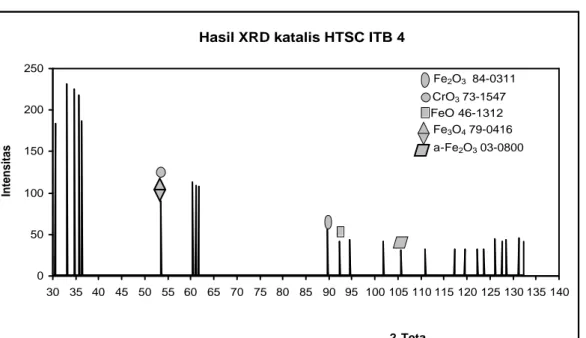
sempurna. Katalis yang dihasilkan diberi nama katalis HTSC ITB 4. Katalis ini berwarna coklat tua dan memiliki luas permukaan 162 m2/g. Hasil analisa XRD katalis HTSC ITB 4 dapat dilihat pada gambar IV.4 berikut ini.
Gambar IV.4 Difraktogram katalis HTSC ITB 4 Hasil XRD katalis HTSC ITB 4
0 50 100 150 200 250 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100 105 110 115 120 125 130 135 140 2 Teta Intensitas Fe2O3 84-0311 CrO3 73-1547 FeO 46-1312 Fe3O4 79-0416 a-Fe2O3 03-0800 IV-8
lxxi
Pada gambar IV.4 dapat diamati bahwa puncak – puncak difraktogram katalis HTSC ITB 4. Berdasarkan hasil pengamatan puncak – puncak difraktogram dapat diketahui bahwa katalis HTSC ITB 4 berfasa amorf. Selanjutnya difraktogram katalis HTSC ITB 4 dibandingkan dengan difraktogram standar Fe2O3, α-Fe2O3,
FeO, Fe3O4, dan CrO3 (Lampiran F) yang dapat dilihat pada tabel IV.4 berikut ini.
Tabel IV.4 Perbandingan difraktogram katalis HTSC ITB 4 dengan standar Fe2O3, α-Fe2O3, FeO, Fe3O4, dan CrO3 (Lampiran F)
Menunjukkan Puncak Katalis HTSC
ITB 4 Fe2O3 α-Fe2O3 FeO Fe3O4 CrO3
2θ Int 2θ Int 2θ Int 2θ Int 2θ Int 2θ Int
53.500 90 - - - 53.431 98 54.248 89
89.700 56 89.387 58 - - - -
92.300 41 - - - - 91.817 40 - - - -
105.680 31 - - 105.01 30 - - - -
Int = Intensitas
Dengan membandingkan difraktogram katalis HTSC ITB 4 dengan difraktogram standar (Lampiran F), diperkirakan katalis HTSC ITB 4 mengandung Fe2O3, α-Fe2O3, FeO, Fe3O4, dan CrO3. Karena adanya campuran
Fe2O3 yang berwarna merah tua, α-Fe2O3 yang berwarna merah, dan Fe3O4 yang
berwarna hitam menyebabkan katalis HTSC ITB 4 berwarna coklat tua namun sedikit lebih muda dari katalis HTSC ITB 1. Luas permukaan katalis HTSC ITB 4 (162 m2/g) yang dihasilkan lebih kecil dari luas permukaan katalis HTSC ITB 3 (192 m2/g).
Untuk meyakinkan bahwa prosedur pembuatan katalis HTSC ITB 3 lebih baik dari katalis HTSC ITB 4 serta untuk meyakinkan bahwa prosedur pembuatan katalis HTSC ITB 4 menghasilkan katalis dengan luas permukaan yang lebih kecil dari HTSC ITB 3, maka prosedur pembuatan katalis HTSC ITB 3 dan 4 diulangi kembali. Hanya saja pada proses pembuatan ini digunakan aquadest sebagai pengganti aqua dm. Katalis yang dihasilkan diberi nama katalis HTSC ITB 5 dan 6. Katalis HTSC ITB 5 merupakan katalis hasil pengulangan prosedur pembuatan katalis HTSC ITB 4 sedangkan katalis HTSC ITB 6 merupakan pengulangan prosedur pembuatan katalis HTSC ITB 3.
lxxii
Katalis HTSC ITB 5 berwarna coklat tua dan memiliki luas permukaan 174 m2/g. Selanjutnya dilakukan analisa XRD terhadap katalis HTSC ITB 5. Hasil analisa tersebut berupa difraktogram katalis HTSC ITB 5. Difraktogram ini kemudian dibandingkan terhadap difraktogram katalis HTSC ITB 4 sebagai acuan. Hasil perbandingannya dapat dilihat pada gambar IV.5 berikut ini.
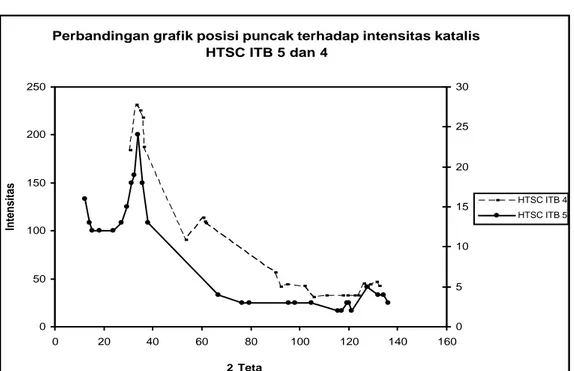
Gambar IV.5 Perbandingan difraktogram katalis HTSC ITB 5 dan 4
Pada gambar IV.5 dapat diamati bahwa difraktogram yang dihasilkan oleh katalis HTSC ITB 5 memiliki bentuk yang hampir sama dengan difraktogram katalis HTSC ITB 4, tetapi memiliki intensitas yang berbeda.
Luas permukaan katalis HTSC ITB 5 adalah 174 m2/g. Luas permukaan katalis ini (174 m2/g) sedikit lebih besar daripada luas permukaan HTSC ITB 4 (162 m2/g).
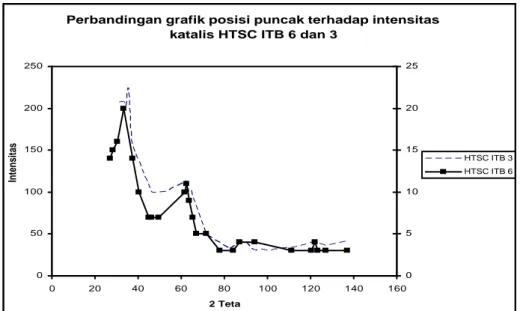
Katalis HTSC ITB 6 berwarna coklat tua dan memiliki luas permukaan (198 m2/g) yang hampir sama dengan katalis HTSC ITB 3 (192 m2/g). Hasil analisa XRD katalis HTSC ITB 6 selanjutnya dibandingkan dengan hasil analisa XRD katalis HTSC ITB 3 seperti yang disajikan pada gambar IV.6 berikut ini.
Perbandingan grafik posisi puncak terhadap intensitas katalis HTSC ITB 5 dan 4 0 50 100 150 200 250 0 20 40 60 80 100 120 140 160 2 Teta Intensitas 0 5 10 15 20 25 30 HTSC ITB 4 HTSC ITB 5 IV-10
lxxiii
Gambar IV.6 Perbandingan difraktogram katalis HTSC ITB 6 dan 3
Gambar IV.6 menunjukkan difraktogram katalis HTSC ITB 6 dan 3. Kedua katalis ini menghasilkan difraktogram yang hampir sama, tetapi memiliki intensitas yang berbeda.
Berdasarkan perbandingan hasil analisis XRD dan BET dapat dikatakan bahwa pengulangan prosedur pembuatan katalis HTSC 3 dan 4 mampu menghasilkan katalis yang hampir sama dengan luas permukaan yang hampir sama pula sehingga dapat disimpulkan bahwa prosedur pembuatan katalis HTSC ITB 3 dan 4 sudah reproducible. Selanjutnya dengan membandingkan luas
permukaan yang diperoleh pada katalis HTSC ITB 4/5 dan 3/6, maka dapat disimpulkan bahwa penggunaan temperatur kalsinasi 300 oC lebih baik dari temperatur 330 oC.
Kondisi pembuatan dan beberapa sifat katalis HTSC yang dihasilkan dapat dilihat pada tabel IV.5.
Perbandingan grafik posisi puncak terhadap intensitas katalis HTSC ITB 6 dan 3
0 50 100 150 200 250 0 20 40 60 80 100 120 140 160 2 Teta Intensitas 0 5 10 15 20 25 HTSC ITB 3 HTSC ITB 6 IV-11
lxxiv
Tabel IV.5 Kondisi pembuatan dan beberapa sifat katalis HTSC yang dihasilkan
No. Jenis
katalis Prosedur pembuatan Warna
Luas permukaan (m2/g)
1. HTSC ITB 1 Pencucian 2 x dengan aqua dm 1 liter Kalsinasi 400 oC selama 6 jam
Coklat tua
mendekati hitam 15
2. HTSC ITB 2 Pencucian 2 x dengan aqua dm 1 liter
Kalsinasi 300 oC selama 6 jam Coklat tua 163
3.
HTSC ITB 3
HTSC ITB 6
Pencucian 2 x yang terdiri dari : - aqua dm 25 oC 1 liter
- aqua dm 50 oC 1 liter
Kalsinasi 300 oC selama 6 jam
Coklat tua Coklat tua 192 198 4. HTSC ITB 4 HTSC ITB 5
Pencucian 2 x yang terdiri dari : - aqua dm 25 oC 1 liter - aqua dm 50 oC 1 liter Kertas saring bebas abu Kalsinasi 330 oC selama 6 jam
Coklat tua
Coklat tua
162
174
IV.2 Kinerja Katalis
Kinerja katalis HTSC ITB yang dihasilkan dapat dinilai berdasarkan aktivitasnya. Aktivitas katalis merupakan kemampuan katalis untuk mengkonversi CO pada kondisi operasi tertentu. Katalis dengan aktivitas yang tinggi merupakan katalis yang memiliki kinerja yang baik. Untuk mengetahui aktivitasnya, katalis HTSC ITB untuk reaksi pergeseran CO diuji selama 10 jam.
Sebelum uji aktivitas dilakukan, katalis yang berupa Fe2O3 terlebih dahulu
direduksi menjadi katalis yang aktif (Fe3O4). Pada dokumen paten Jennings 1984
disebutkan reduksi dilakukan dengan menggunakan campuran kukus dan hidrogen pada temperatur 300 oC. Tetapi menurut Twigg (1989), kehadiran kukus walaupun pada konsentrasi rendah sangat efektif menyebabkan terjadinya sintering pada oksida.
Berdasarkan hasil studi literatur, gas pereduksi yang lebih baik digunakan untuk reduksi katalis logam adalah campuran H2 dan N2 (Twigg, 1989). Menurut
lxxv
Satterfield (1991), gas N2 yang dialirkan bersama – sama dengan gas H2
memiliki fungsi sebagai faktor pengaman sehingga dapat mencegah kebakaran apabila terjadi kebocoran dan dapat mengendalikan konsentrasi H2.
Pada prosedur paten Jennings 1984 disebutkan temperatur reduksi yang digunakan adalah 300 oC. Akan tetapi temperatur ini hampir sama dengan temperatur kalsinasi yang digunakan pada katalis HTSC ITB, sehingga dikhawatirkan katalis akan mengalami sintering. Selanjutnya dilakukan studi literatur untuk mengetahui temperatur reduksi yang akan digunakan. Beberapa pertimbangan yang dapat dijadikan sebagai dasar untuk menetapkan temperatur reduksi awal yang akan digunakan adalah sebagai berikut :
1. Temperatur yang terlalu tinggi selama proses reduksi akan menyebabkan terjadinya sintering (Twigg, 1989).
2. Penggunaan temperatur operasi yang tinggi akan menyebabkan terjadinya sintering dan dengan adanya gas hidrogen, sintering dapat terjadi pada temperatur yang lebih rendah (Satterfield, 1991).
3. Pengendalian terhadap temperatur reduksi dan konsentrasi kukus yang dihasilkan perlu dilakukan untuk menghindari terjadinya sintering (Twigg, 1989).
4. Reduksi katalis dimulai pada temperatur 150 oC dan kesempurnaan proses reduksi baru dapat diperoleh bila temperatur reduksi mencapai 400 oC (Twigg, 1989).
Selanjutnya pertimbangan yang digunakan sebagai dasar pemilihan temperatur reduksi yang akan digunakan adalah pertimbangan ke 4. Pertimbangan ini dipilih karena pada temperatur 300-565 oC fasa stabil yang terbentuk adalah besi metalik (Fe) dan magnetit (Fe3O4). Fasa stabil untuk magnetit (Fe3O4) baru dapat dicapai
pada temperatur reduksi 400 oC (Twigg, 1989). Karena itu apabila menggunakan temperatur reduksi 300 oC dikhawatirkan Fe3O4 belum mencapai fasa stabil.
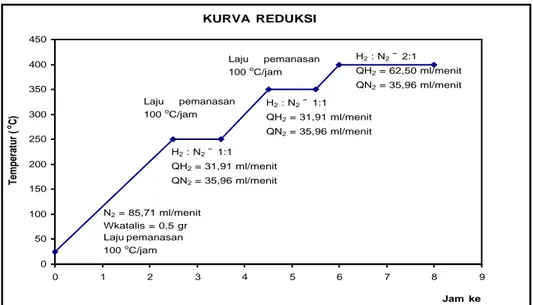
Keseluruhan tahapan yang dilangsungkan pada proses reduksi dapat dilihat pada gambar IV.7 berikut ini.
lxxvi
Gambar IV.7 Proses reduksi katalis HTSC ITB
Pada gambar IV.7 dapat diamati tahap – tahap pelaksanaan proses reduksi katalis HTSC ITB. Terlebih dahulu 0,5 gr katalis dipanaskan dari temperatur 25 oC hingga 250 oC dengan laju pemanasan 100 oC/jam. Tujuan pemanasan adalah untuk menghilangkan air yang teradsorb dalam katalis. Saat pemanasan, dialirkan gas N2 dengan laju alir 85,71 ml/menit untuk mendorong udara dan air
yang mungkin masih ada pada aliran gas masuk dan keluar.
Proses reduksi awal dilakukan pada temperatur 250 oC selama 1 jam. Gas pereduksi yang digunakan berupa campuran H2 dan N2 dengan perbandingan H2
dan N2 adalah 1:1. Selanjutnya dilakukan pengamatan terhadap pembentukan
embun (titik – titik air) di bagian bawah reaktor sebagai produk dari reaksi reduksi. Embun (titik – titik air) ini menandakan bahwa reaksi reduksi telah berlangsung. Setelah 1 jam, temperatur reduksi dinaikkan menjadi 350 oC dengan laju pemanasan 100 oC/jam. Proses reduksi pada temperatur 350 oC ini dilakukan selama 1 jam dengan perbandingan H2 dan N2 yang sama sambil
dilakukan pengamatan terhadap pembentukan embun yang mungkin masih terjadi. Selanjutnya temperatur reduksi dinaikkan menjadi 400 oC dengan laju pemanasan 100 oC/jam. Reduksi pada temperatur 400 oC ini dilakukan selama 2 jam menggunakan gas pereduksi dengan perbandingan H2 dan N2 2:1. Pada
proses reduksi akhir ini digunakan kadar hidrogen lebih besar agar laju reduksi menjadi lebih cepat. Laju reduksi dapat dipercepat dengan menaikkan temperatur
KURVA REDUKSI 0 50 100 150 200 250 300 350 400 450 0 1 2 3 4 5 6 7 8 9 Jam ke Temperatur ( oC) H2 : N2 ˜ 1:1 QH2 = 31,91 ml/menit QN2 = 35,96 ml/menit H2 : N2 ˜ 2:1 QH2 = 62,50 ml/menit QN2 = 35,96 ml/menit H2 : N2 ˜ 1:1 QH2 = 31,91 ml/menit QN2 = 35,96 ml/menit Laju pemanasan 100 oC/jam Laju pemanasan 100 oC/jam N2 = 85,71 ml/menit Wkatalis = 0,5 gr Laju pemanasan 100 oC/jam IV-14
lxxvii
dan konsentrasi reaktan. Setelah katalis direduksi selama 2 jam, konsentrasi Fe2O3
yang tersisa menjadi lebih sedikit sehingga untuk mempercepat laju reduksi maka konsentrasi H2 diperbesar.
Proses reduksi menghasilkan pembentukan embun (titik – titik air) sebagai produk. Embun (titik – titik air) ini terlihat kurang lebih 15 menit setelah temperatur reduksi mencapai 250 oC dan H2 mulai dialirkan. Embun hanya terjadi
sesaat dan tidak begitu banyak. Walaupun embun tidak terlihat lagi, proses reduksi pada temperatur 250 oC tetap dilangsungkan selama 1 jam.
Saat temperatur reduksi dinaikkan menjadi 350 oC terlihat pembentukan embun kurang lebih 10 menit setelah mencapai temperatur tersebut. Embun hanya terjadi sesaat dan lebih sedikit dari embun yang terbentuk pada temperatur 250 oC. Selanjutnya tidak terlihat pembentukan embun hingga proses reduksi selesai.
Setelah proses reduksi selesai, dilakukan purging dengan mengalirkan gas N2 untuk menyingkirkan gas H2 dalam keseluruhan sistem reaksi. Laju alir gas N2
yang digunakan untuk proses purging yaitu 85,71 ml/menit. Proses purging ini dilakukan hingga tidak ada gas H2 yang tersisa, biasanya sekitar 2 jam. Untuk
mengetahui tidak ada gas H2 yang tersisa, dilakukan analisa dengan menggunakan
Gas Chromatography (GC) terhadap aliran gas masuk dan keluar.
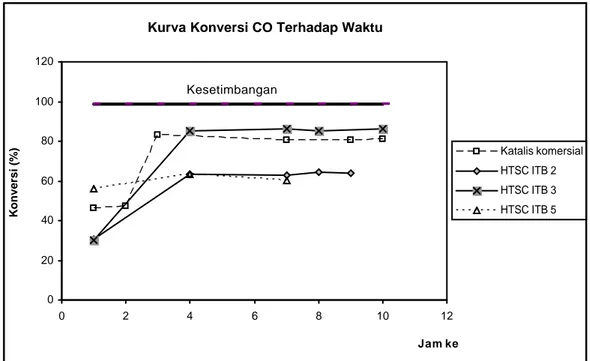
Selanjutnya reaksi pergeseran dilangsungkan pada temperatur 370 oC selama 10 jam. Hasil uji aktivitas katalis HTSC ITB pada temperatur 370 oC, SVW 19000, laju alir N2 85,71 ml/menit, laju alir CO 13,33 ml/menit, dan laju alir H2O 0,06
ml/menit dapat dilihat pada gambar IV.8 berikut ini.
lxxviii
Gambar IV.8 Hasil uji aktivitas katalis HTSC ITB
Pada gambar IV.8 dapat diamati konversi CO yang dihasilkan oleh beberapa katalis HTSC ITB selama 10 jam. Pada kondisi yang sama, konversi CO dapat menunjukkan aktivitas katalis. Katalis yang aktivitasnya dapat dibandingkan adalah HTSC ITB 2, 3, dan 5. Sedangkan uji aktivitas katalis HTSC ITB 4 dan 6 tidak terlaksana dengan baik karena terdapat kebocoran pada aliran masuk saat reaksi berlangsung, sehingga udara dapat masuk ke dalam sistem reaksi. Kehadiran oksigen sangat tidak diinginkan karena oksigen lebih kuat diadsorp oleh logam dari hidrogen dan mengurangi aktivitas katalis. Aktivitas katalis HTSC ITB yang dibandingkan adalah aktivitas pada keadaan tunak (konversi CO tidak mengalami perubahan terhadap waktu) yang umumnya terjadi setelah 2-4 jam operasi. Selanjutnya aktivitas katalis HTSC ITB dibandingkan terhadap aktivitas katalis komersial.
Hasil uji aktivitas menunjukkan bahwa aktivitas yang dihasilkan oleh katalis HTSC ITB 2 lebih rendah daripada katalis HTSC ITB 3 dan sedikit lebih tinggi daripada katalis HTSC ITB 5. Perbedaan yang kecil antara aktivitas katalis HTSC ITB 2 dan 5 disebabkan karena luas permukaan yang dimiliki oleh kedua katalis tersebut tidak jauh berbeda. Untuk lebih jelas hasil uji aktivitas katalis HTSC ITB dan komersial dapat dilihat pada tabel IV.6 berikut ini.
Kurva Konversi CO Terhadap Waktu
0 20 40 60 80 100 120 0 2 4 6 8 10 12 Jam ke Konversi (%) Katalis komersial HTSC ITB 2 HTSC ITB 3 HTSC ITB 5 Kesetimbangan IV-16
lxxix
Tabel IV.6 Hasil uji aktivitas katalis HTSC ITB dan komersial
Jenis katalis Luas permukaan (m2/g) Konversi pada
keadaan tunak (%) Kesetimbangan 98,1 Komersial 60 80,8-81,1 HTSC ITB 3 192 85,3-86,2 HTSC ITB 5 174 60,5-63,6 HTSC ITB 2 163 62,7-64,2
Berdasarkan hasil uji aktivitas dapat disimpulkan bahwa aktivitas katalis HTSC ITB yang paling baik adalah katalis HTSC ITB 3. Aktivitas katalis ini sedikit lebih tinggi daripada katalis komersial. Selain itu juga dapat disimpulkan bahwa aktivitas yang dihasilkan sangat dipengaruhi oleh luas permukaan. Semakin besar luas permukaan katalis HTSC ITB, semakin tinggi aktivitasnya. Katalis komersial memiliki sifat yang berbeda dari katalis HTSC ITB yang dihasilkan. Katalis komersial memiliki luas permukaan yang lebih kecil dari luas permukaan katalis HTSC ITB, akan tetapi mampu menghasilkan aktivitas yang sama dengan katalis HTSC ITB 3. Hal ini disebabkan karena adanya campuran bahan lain sehingga katalis menjadi lebih porous dan aktivitasnya menjadi lebih besar.