PENGARUH PEMBERIAN CENDAWAN MIKORIZA ARBUSKULAR (CMA)
DAN Rhizobium TERHADAP KARAKTERISTIK ANATOMI DAUN DAN
KADAR KLOROFIL TANAMAN KACANG KORO PEDANG
(Canavalia ensiformis L.)
Indah Rohmatul Zuroidah
Prodi S-1 Biologi, Departemen Biologi, Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya
Abstract
The aim of this research was to know effects of AMF, Rhizobium and their combination on the anatomy characteristics and chlorophyll content in leaves of Jackbean (Canavalia ensiformis L). This is an experimental research and factorial Completely Randomized Design (CRD) 4x4 was used with three replicates. The datas were analyzed used MANOVA at 5 % level and continue by Duncan test. The results showed that the giving of AMF, Rhizobium, and combination of both of them are influenced for the anatomy characteristic (the amount of stomata, the leaf thickness, and thickness of palisade) and chlorophyll content. For the giving of AMF 20 g / plant provided the highest point for leaf thickness. The highest point of giving Rhizobium 30 mL/ plant for amount of stomata (9,13 mm2) and leaf thickness (37,67 mm), while thickness of palisade the highest point by Rhizobium 10 mL/plant (21,67 mm), and the highest point for chlorophyll content (16,29 mg/L) has given by Rhizobium 20 mL/plant. While the combination AMF 30 g with Rhizobium 10 mL/plant gave the highest point for the amount of stomata (9,73 mm2), the highest for thickness of palisade (27,33 mm) in the giving of combination of both AMF 30 g with Rhizobium 30 mL/plant, the highest point for the leaf thickness (44,33 mm) and chlorophyll content (21,26 mg/L) giving of combination of both AMF 30 g with Rhizobium 20 mL/plant.
Key words : Jackbean (Canavalia ensiformis L.), AMF, Rhizobium, chlorophyll content.
Pendahuluan
Pemupukan termasuk salah satu cara untuk meningkatkan jumlah hara yang
tersedia didalam tanah. Namun,
penggunaan pupuk kimia dalam jangka
waktu lama dapat menyebabkan
tercemarnya kondisi lingkungan. Selain itu penggunaan pupuk kimia juga dapat mengubah sifat tanah menjadi keras (Sugito, 1999). Oleh karena itu perlu
adanya suatu pupuk yang ramah
lingkungan. Pupuk hayati adalah pupuk yang dapat memperbaiki sifat fisika, kimia, dan biologi tanah serta lingkungan, dengan demikian pupuk hayati merupakan solusi yang sangat tepat. Selain itu, pupuk hayati dapat melindungi akar tanaman dari serangan bakteri patogen, bisa mengurangi residu pestisida sehingga menjadi senyawa yang tidak berbahaya bagi tanaman (Yulipriyanto, 2010) dan dapat digunakan sebagai pelindung tanaman dari logam berat (Sasli, 2004).
Pupuk hayati yang sering
digunakan adalah Cendawan Mikoriza Arbuskular (CMA) dan pupuk mikroba. Cendawan mikoriza arbuskular merupakan
suatu bentuk hubungan simbiosis
mutualisme antara cendawan dan
perakaran tumbuhan tinggi dimana jenis mikoriza ini membentuk arbuskular dan vesikular dalam sel korteks akar. Cendawan mikoriza arbuskular dapat meningkatkan kemampuan tanaman dalam pengambilan unsur hara (K, Mg, Ca, O, H,
C, dan S) terutama fosfor (Yulipriyanto,
2010) yang berguna untuk dapat
merangsang pertumbuhan dan
perkembangan akar (Hamidahmamur’s,
2010). Selain itu CMA mampu
memberikan ketahanan terhadap
kekeringan karena hifa cendawan masih mampu untuk menyerap air pada pori-pori tanah dan penyebaran hifa di dalam tanah sangat luas sehingga dapat mengambil air relatif lebih banyak (Imas et al., 1989) hal ini dibuktikan pada penelitian Karti (2004) bahwa pemberian CMA meningkatkan pertumbuhan dan produksi rumput Setaria
splendida.
Pupuk hayati selain CMA juga dapat digunakan pupuk mikroba seperti
Rhizobium. Rhizobium adalah bakteri
penambat nitrogen yang hidup di dalam tanah dan membentuk asosiasi simbiotik dengan sel akar tanaman. Rhizobium
digunakan untuk membantu
memperbanyak pembentukan bintil akar. Selain itu Rhizobium yang tumbuh dalam bintil akar mengambil nitrogen langsung dari udara bersama sel tanaman dan bakteri (Anonimous, 2009). Menurut hasil penelitian Tahir et al. (2009) pemberian
Rhizobium mempengaruhi perbanyakan
bintil akar hingga dua kali lipat dan bintil akar dapat meningkatkan pertumbuhan dan produksi kacang kedelai.
Karateristik anatomi daun adalah kunci untuk mengetahui bagaimana tanaman bereaksi dan beradaptasi terhadap lingkungan. Struktur anatomi daun adalah dasar dari fungsi fisiologi tanaman, perubahan pada struktur anatomi daun akan memberikan efek yang besar pada pertumbuhan tanaman (Guan et al., 2010). Karakteristik anatomi daun meliputi ketebalan kutikula, tebal daun, tebal palisade, ukuran stomata, dan jumlah daun per luas persegi (Dickison, 2000, dalam Juwarno dan Samiyarsih, 2009).
Kacang koro dipilih karena
tanaman ini merupakan salah satu program
pemerintah dalam meningkatkan
ketahanan pangan, dapat digunakan untuk mengganti pakan lain seperti kacang
kedelai yang sekarang harganya mulai naik (Anonimous, 2007). Selain itu Biji kacang koro pedang merupakan sumber protein nabati yang setara dengan kedelai. Biji kacang pedang mengandung protein 23%– 34% dan karbohidrat sekitar 55%, selain itu juga mengandung sumber Ca, Zn, P, Mg, Cu dan Ni (Karuniawan dan Ismail, 2007).
Metode Penelitian
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di
Laboratorium Mikrobiologi Departemen
Biologi, FSAINTEK, Universitas
Airlangga dan penanaman dilakukan di tegalan sawah, Rungkut Asri, Surabaya. Penelitian ini dilaksanakan pada bulan September 2010- April 2011.
Bahan yang digunakan adalah bibit kacang koro pedang dari Balai Besar Bioteknologi Sumber Daya Genetik Pertanian Bogor, propagul Cendawan
Mikoriza Arbuskular (CMA) dari
Laboratorium Bioteknologi Hutan dan Lingkungan PUSLIT Sumber Hayati dan BIOTEK Institut Pertanian Bogor, biakan bakteri Rhizobium yang di produksi oleh Departemen Biologi Fakultas Sains dan Teknologi Universitas Airlangga, pupuk NPK, pupuk kandang, alkohol 96%, air, dan daun.
Alat yang digunakan adalah cangkul, tugal (alat pembuat lubang tanaman), sentrifuse, spektrofotometer UV-1700 (SHIMADZU), mikrometer okuler, mikrometer pentas, mikroskop, gelas objek, gelas penutup, tabung cuvet, mortar dengan penggerusnya, labu ukur 50 mL, botol semprot, pipet, botol kaca 100 mL, gunting, timbangan, tissu, silet,
handcounter, silet, dan label.
Tahap pembuatan pupuk Rhizobium
Setelah isolat bakteri Rhizobium diremajakan, diukur OD dan dihitung jumlah bakterinya (TPC). Selanjutnya adalah tahap pembuatan media pupuk.
Pembuatan media produksi bakteri
molase 2%. Pembuatan media molase 2% dilakukan dengan cara mencampurkan 108 ml molase dengan 5292 ml aquades. Sebanyak 600 ml bakteri Rhizobium sp. dari larutan NB dimasukkan ke dalam 5400 ml yang sudah dicampur dengan larutan Molase 2% yang sebelumnya sudah di didihkan dan telah dingin.
Sebelum dilakukan pembuatan media produksi bakteri, dihitung TPC bakteri
Rhizobium sp. yang ada dalam media NB
dengan cara membuat seri pengenceran larutan bakteri dalam molase sampai 10-8. Sebanyak 1 ml larutan bakteri pada pengenceran 10-6, 10-7,dan 10-8 dipour plate pada media NA. Inkubasi 24 jam pada suhu kamar, dan hitung TPC bakteri (cfu/ml) (Supriyanto, 2007).
Tahap penanaman
Biji yang ditanam dipilih yang bagus, yaitu yang tenggelam ketika direndam di air.Tanah diolah terlebih dahulu sebelum ditanami.Luas setiap plot adalah 3 x 3 m2 dengan 25 tanaman. Masing- masing plot dipisahkan oleh bedengan sepanjang 25 cm.Tanaman diberi pupuk konsorsium mikroba dengan dosis sesuai perlakuan yaitu 0, 10, 20 dan 30 mL/tanaman dengan kontrol positif (5 g NPK), setiap perlakuan diulang tiga kali. Tahap penghitungan jumlah stomata Daun ketiga dari bawah berumur ± 3 bulan dan di sayat bagian epidermis bawah daun (abaksial). Diamati di bawah mikroskop dengan perbesara 400 x dan menghitung dalam 3 kali lapang pandang perluas lapang pandang.
Tahap pengukuran tebal daun dan tebal palisade
Daun ketiga dari bawah berumur ± 4 bulan di ambil. Bagian yang terlebar dari daun di potong transversal. Tebal daun diamati dari epidermis atas hingga epidermis bawah. Tebal palisade diamati dari bagian bawah epidermis bagian atas hingga bagian atas bunga karang dengan perbesaran 100 x.
Tahap pengukuran kadar klorofil
Daun yang sudah tua diambil 3 secara acak. Gunting kecil-kecil daun tanpa tulang daun. Daun ditimbang 2,5 g dan digerus dalam mortar dengan pelarut alkohol 96%. Setelah klorofil larut dalam alcohol 96% disentrifugasi selama 10 menit dengan kecepatan 500 rpm.
Supernatan diambil kemudian di
spektrofotometer.
Dalam spektrofotometer ini
terdapat 2 tabung cuvet, tabung cuvet 1 berisi alkohol 96% sebagai blanko dan tabung cuvet 2 berisi ekstrak klorofil. Absorbansi larutan ekstrak klrofil ini menggunakan panjang gelombang 649 nm dan 665 nm (Purnobasuki, 2009). Setelah kadar klorofil diketahui, delanjutnya dapat dihitung kadar klorofil total dengan
menggunakan turunan rumus
(Winstermans dan Mots, 1965 dalam Purnobasuki, 2009). Klorofil a (mg/L) = (13,7 x OD665) -(5,76 x OD649) Klorofil b (mg/L) = (25,8 x OD649) - (7,7 x OD665) Klorofil total (mg/L) = (20,0 x OD649) + (6,1 x OD665)
Hasil dan Pembahasan
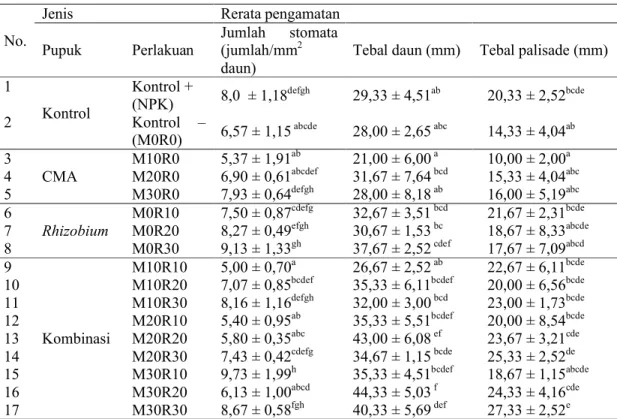
Tabel 4.1 Pengaruh pemberian CMA, Rhizobium dan kombinasi keduanya terhadap karakteristik anatomi daun tanaman kacang koro pedang (C. ensiformis)
No.
Jenis Rerata pengamatan
Pupuk Perlakuan
Jumlah stomata (jumlah/mm2
daun)
Tebal daun (mm) Tebal palisade (mm) 1 Kontrol Kontrol + (NPK) 8,0 ± 1,18defgh 29,33 ± 4,51ab 20,33 ± 2,52bcde 2 Kontrol – (M0R0) 6,57 ± 1,15abcde 28,00 ± 2,65abc 14,33 ± 4,04ab 3 CMA M10R0 5,37 ± 1,91ab 21,00 ± 6,00a 10,00 ± 2,00a 4 M20R0 6,90 ± 0,61abcdef 31,67 ± 7,64bcd 15,33 ± 4,04abc 5 M30R0 7,93 ± 0,64defgh 28,00 ± 8,18ab 16,00 ± 5,19abc 6 Rhizobium M0R10 7,50 ± 0,87cdefg 32,67 ± 3,51bcd 21,67 ± 2,31bcde 7 M0R20 8,27 ± 0,49efgh 30,67 ± 1,53bc 18,67 ± 8,33abcde 8 M0R30 9,13 ± 1,33gh 37,67 ± 2,52cdef 17,67 ± 7,09abcd 9 Kombinasi M10R10 5,00 ± 0,70a 26,67 ± 2,52ab 22,67 ± 6,11bcde
10 M10R20 7,07 ± 0,85bcdef 35,33 ± 6,11bcdef 20,00 ± 6,56bcde
11 M10R30 8,16 ± 1,16defgh 32,00 ± 3,00bcd 23,00 ± 1,73bcde 12 M20R10 5,40 ± 0,95ab 35,33 ± 5,51bcdef 20,00 ± 8,54bcde 13 M20R20 5,80 ± 0,35abc 43,00 ± 6,08ef 23,67 ± 3,21cde 14 M20R30 7,43 ± 0,42cdefg 34,67 ± 1,15bcde 25,33 ± 2,52de 15 M30R10 9,73 ± 1,99h 35,33 ± 4,51bcdef 18,67 ± 1,15abcde 16 M30R20 6,13 ± 1,00abcd 44,33 ± 5,03f 24,33 ± 4,16cde 17 M30R30 8,67 ± 0,58fgh 40,33 ± 5,69def 27,33 ± 2,52e
Keterangan : angka yang diikuti dengan huruf berbeda menunjukkan perbedaaan yang nyata berdasarkan uji Duncan pada taraf 5%
Tabel 4.2 Pengaruh pemberian CMA, Rhizobium dan kombinasi keduanya terhadap kadar klorofil daun tanaman kacang koro pedang (C. ensiformis)
No. Jenis Rerata kadar klorofil
Pupuk Perlakuan (mg/L) (mg/g daun) 1 Kontrol Kontrol + (NPK) 15,09 ± 1,82bc 0,30 ± 0,04 2 Kontrol – (M0R0) 9,78 ± 1,33a 0,20 ± 0,03 3 CMA M10R0 13,42 ± 1,03abc 0,27 ± 0,02 4 M20R0 12,69 ± 2,79ab 0,25 ± 0,06 5 M30R0 14,71 ± 0,60bc 0,30 ± 0,01 6 Rhizobium M0R10 13,83 ± 2,68abc 0,27 ± 0,05 7 M0R20 16,29 ± 2,64bc 0,33 ± 0,05 8 M0R30 16,08 ± 5,37bc 0,32 ± 0,11 9 Kombinasi M10R10 18,03 ± 2,95cd 0,36 ± 0,06 10 M10R20 16,89 ± 2,61bc 0,34 ± 0,05 11 M10R30 13,85 ± 2,49abc 0,28 ± 0,05 12 M20R10 15,13 ± 2,17bc 0,30 ± 0,04 13 M20R20 13,90 ± 1,76abc 0,28 ± 0,03 14 M20R30 13,54 ± 1,61abc 0,27 ± 0,03 15 M30R10 15,78 ± 2,22bc 0,32 ± 0,04 16 M30R20 21,26 ± 0,03d 0,42 ± 0,001 17 M30R30 14,82 ± 2,12bc 0,30 ± 0,04
Dari hasil uji Duncan (Tabel 4.1) menunjukkan bahwa kontrol + (NPK 5 g/tanaman) memberikan hasil tertinggi pada karakteristik anatomi yaitu jumlah stomata, tebal palisade, dan kadar klorofil. Tetapi tidak berbeda signifikan dengan perlakuan CMA 30 g (M30R0). Hal ini berarti bahwa perlakuan CMA 30 g dapat menggantikan pupuk NPK (kontrol +). Dengan penggunaan pupuk CMA lebih baik dibanding dengan pupuk NPK bila memberikan hasil yang tidak berbeda nyata. Karena pupuk CMA tidak mencemari lingkungan bahkan dapat memperbaiki struktur tanah, melindungi akar tanaman dari perubahan pH, perubahan temperature, dan dari serangan bakteri patogen (Yulipriyanto, 2010).
Pada tebal daun pemberian CMA dengan dosis 20 g memberikan nilai tertinggi dibanding dengan CMA 30 g. Hal ini diduga karena pada tanah unsur P sudah tercukupi. Hal ini sesuai dengan pernyataan Mosse (1973) bahwa infeksi cendawan sering dihambat oleh kadar P yang tinggi dalam larutan tanah. Dengan pemberian CMA 20 g menghasilkan pertumbuhan (tebal daun) sudah optimal. Sehingga dengan pemberian CMA 30 g menghasilkan pertumbuhan untuk tebal daun lebih tipis (menurun) dibandingkan dengan pemberian CMA 20 g.
Seperti diketahui, CMA membantu tanaman sehingga mudah menyerap unsur P dan air (Imas et al., 1989). Adanya unsur
P pada tanaman berfungsi untuk
mengedarkan energi keseluruh bagian tanaman, berguna untuk merangsang pertumbuhan dan perkembangan akar, khususnya akar benih dan tanaman muda (Akbar, 2011) dan unsur P dibutuhkan
tumbuhan pada saat pembentukan
fosfolipida dan nukleoprotein. Tetapi bila unsur P tinggi dalam larutan tanah bahkan dapat menghambat infeksi cendawan (Mosse, 1973).
Berdasarkan tabel 4.1
menunjukkan bahwa pemberian Rhizobium 30 mL adalah hasil tertinggi pada jumlah stomata dan tebal daun. Sedangkan
pemberian Rhizobium 10 mL adalah hasil tertinggi pada tebal palisade. Adanya
Rhizobium dalam tanah yang dapat
menambat unsur N menghasilkan nilai tertinggi hal ini juga didukung dengan penelitian Juwarno dan Samiyarsi (2009), bahwa jumlah stomata meningkat jika pemberian pupuk nitrogen meningkat dan banyaknya unsur N mempengaruhi tebal tipis nya daun. Tebal tipisnya suatu daun berpengaruh terhadap banyaknya radiasi matahari yang diteruskan oleh daun, karena semakin meningkatnya intensitas radiasi matahari laju fotosintesis juga akan meningkat sampai pada intensitas tertentu
(optimum) kemudian peningkatan
intensitas radiasi setelah titik optimum tidak akan dapat meningkatkan laju fotosintesis lagi (Sugito, 1999). Rhizobium yang dapat menambat unsur N yang berfungsi untuk merangsang tanaman pada masa vegetatif, khususnya daun (Akbar, 2011).
Pemberian Rhizobium 20 mL menunjukkan hasil tertinggi (Tabel 4.2) terhadap kadar klorofil dan hasil terendah tanpa pemberian pupuk (Kontrol – /M0R0). Kadar klorofil dapat dijadikan indikator yang sensitif pada kondisi
fisiologis suatu tumbuhan karena
kandungan klorofil berkorelasi positif
dengan kandungan nitrogen daun,
sehingga dapat dijadikan indikator laju fotosintesis (Sampson et al., 2003). Djukri dan Bambang (2003) menyatakan bahwa adanya penurunan kadar nitrogen pada
tanaman berpengaruh terhadap
fotosintesis, baik lewat kandungan klorofil maupun enzim fotosintetik.
Dari tabel 4.1 dapat diketahui bahwa perlakuan M30R10 (CMA 30 g dan
Rhizobium 10 mL) memberikan hasil
tertinggi terhadap jumlah stomata
dibandingkan dengan kombinasi lainnya.
Jumlah stomata dipengaruhi oleh
kesuburan tanah dan kesehatan tanaman. Unsur utama seperti N yang memberikan
kontribusi untuk kesuburan tanah
berpengaruh pada struktur daun yang
(Juwarno dan Samiyarsih, 2009). Adanya unsur N yang dapat difiksasi oleh
Rhizobium dan CMA yang membantu
meningkatkan unsur P. Jika di dalam tanah unsur P tidak cukup banyak, maka
nitrogen (N) akan berkurang
(Dwijoseputro, 1990). CMA berfungsi membantu tanaman dalam pengaturan air dengan memperluas hifa (Arumugam et
al., 2010) serta membantu tanaman dalam
menyerap unsur P sehingga dapat mempengaruhi kesuburan tanah, karena mikoriza (CMA) bisa memperbaiki unsur tanah.
Pada tabel 4.1 menunjukkan bahwa perlakuan kombinasi CMA 30 g dengan
Rhizobium 20 mL (M30R20) menghasilkan tebal daun tertinggi. Hal ini
dikarenakan tanaman yang diberi
perlakuan M30R20 unsur hara makronya tercukupi karena Rhizobium 20 mL yang dapat menambat unsur N lebih banyak dan CMA 30 g yang membantu menyerap unsur P lebih banyak. Tebal daun berkorelasi dengan ketersediaan sumber energi yang ada pada tanaman (Guan et
al., 2010). Daun yang tebal menentukan
absorbsi cahaya (Sitompul dan Guritno, 1995). Jika suatu daun tebal biasanya di indikasikan bahwa proses fotosinetsis berlangsung secara sempurna karena pada daun terdapat beberapa jaringan yang penting untuk pertumbuhan tanaman, salah satunya palisade.
Dari hasil penelitian ini tebal palisade tertinggi pada perlakuan M30R30. Hal ini dikarenakan pemberian CMA 30 g dengan Rhizobium 30 mL (M30R30)
sangat membantu tanaman untuk
memperoleh unsur hara yang maksimal sehingga menghasilkan tebal palisade yang tinggi dibandingkan dengan perlakuan lain. Palisade sangat terorganisir dan terletak tepat di bawah epidermis bawah daun (abaksial) yang banyak mengandung kloroplas (Zaman dan Padmesh, 2009). Kloroplas adalah tempat berlangsungnya fotosintesis (Lakitan, 2004). Menurut Iriawati (2009), palisade terspesialisasi untuk meningkatkan efisiensi fotosintesis.
Bentuk dan susunan sel pada palisade memungkinkan kloroplas terlokalisasi pada posisi yang paling strategis untuk
menyerap cahaya matahari secara
maksimum.
Peningkatan efisiensi fotosintesis juga ditentukan oleh adanya ruang antar sel pada mesofil, yang akan memfasilitasi pertukaran gas. Area permukaan sel yang bebas dari kontak dengan sel lain pada sel-sel palisade juga merupakan faktor yang menentukan tingginya efisiensi fotosintesis pada jaringan palisade (Irawati, 2009). Sehingga palisade yang tebal akan mengandung banyak klorofil, karena klorofil terletak pada kloroplas dan klorofil adalah salah satu bahan dalam proses fotosintesis yang akan mengakibatkan laju
fotosintesis meningkat. Dengan
meningkatnya laju fotosintesis,
pertumbuhan tanaman dan produksi dari tanaman juga akan meningkat.
Dari tabel 4.2 pengaruh kombinasi CMA dengan Rhizobium terhadap kadar klorofil menunjukkan bahwa perlakuan M30R20 (CMA 30 g dan Rhizobium 20 mL) menghasilkan kadar klorofil tertinggi dengan rata-rata 21, 26 mg/L. Hal ini menunjukkan adanya interaksi pada pemberian kombinasi CMA 30 g dengan
Rhizobium 20 mL/tanaman berjalan dengan baik. Hal ini didukung dengan penelitian Arumugam et al. (2010) bahwa
inokulasi CMA dan pupuk hayati
Rhizobium lebih efektif dalam
meningkatkan pertumbuhan, nutrisi,
kandungan klorofil dan produksi biomassa kacang-kacangan. Menurut Fitter (1994)
dalam Suliatsih dan Suciatmih (1998)
kombinasi keduanya dapat saling
mempengaruhi dalam proses metabolisme, bakteri dapat mempengaruhi metabolisme CMA sehingga dapat meningkatkan suplai P, dan konsentrasi P yang tinggi akan meningkatkan penambatan nitrogen.
Kadar klorofil dapat dijadikan indikator yang sensitif kondisi fisiologis suatu tumbuhan, karena kandungan
klorofil berkorelasi positif dengan
dijadikan indikator laju fotosintesis (Sampson et al., 2003). Laju fotosintesis
meningkat maka semakin banyak
karbohidrat yang terbentuk. Karbohidrat yang tersedia dalam jumlah banyak akan meningkatkan sintesis klorofil sehingga kadar klorofil akan semakin tinggi (Anggarwulan et al., 2008).
Kesimpulan dan Saran
Kesimpulan yang dapat diambil dari penelitian ini :
1. Pemberian CMA berpengaruh secara
signifikan terhadap peningkatan jumlah stomata, tebal daun dan tebal palisade, serta kadar klorofil daun tanaman kacang koro pedang (C.
ensiformis L.).
2. Pemberian Rhizobium berpengaruh
secara signifikan terhadap
peningkatan jumlah stomata, tebal daun dan tebal palisade, serta kadar klorofil daun tanaman kacang koro pedang (C. ensiformis L.).
3. Pemberian kombinasi CMA dengan
Rhizobium berpengaruh secara signifikan terhadap peningkatan jumlah stomata, tebal daun dan tebal palisade, serta kadar klorofil daun tanaman kacang koro pedang (C.
ensiformis L.).
Saran pada penelitian ini adalah pada penelitian selanjutnya, penanaman kacang koro pedang disarankan menggunakan pupuk hayati dengan kombinasi CMA 30 g/tanaman dengan Rhizobium 10, 20 atau 30 mL/tanaman, karena terbukti dapat menghasilkan hasil tertinggi terhadap karakteristik anatomi dan kadar klorofil.
Daftar Pustaka
Akbar, 2011, Citing Computer References;
htt p://bangunindonesia.com/
index.php?option=com_content&vie w=article&id=58:poc&catid=34:pen yuluhan (Diakses 12 juni 2011) Anggarwulan, E., Solichatun, dan Widya
M., 2008, Karakter Fisiologi Kimpul
(Xanthosoma sagittifolium (L.)
Schott) pada Variasi Naungan dan Ketersediaan Air. Biodiversitas, 9 (4) : 264-268.
Anonimous, 2007, Citing Computer
References; Kelayakan dan
teknologi budaya koro pedang (Canavalia Sp.), Balai Penelitian
dan Pegembangan Umbi-Umbian dan Kacang-Kacangan.
Anonimous, 2009, Citing Computer
References; Rhizobium,
http://login.ru /articles/1291/
(Diakses 1 Nopember 2009).
Arumugam, R., Rajasekaran, S., and Nagarajan, S.M., 2010, Response of Arbuscular mycorrhizal fungi and Rhizobium inoculation on growth and chlorophyll content of Vigna
unguiculata (L) Walp Var. Pusa 151, J. Appl. Sci. Environ. Manage 14
(4): 113 – 115.
Djukri dan Bambang S. P., 2003, Pengaruh Naungan Paranet Terhadap Sifat Toleransi Tanaman Talas (Colocasia
esculenta (L.) Schott), Ilmu Pertanian 10 (2): 17-25.
Dwijoseputro, D., 1990, Pengantar
Fisiologi Tumbuhan, PT. Gramedia
Pustaka Utama, Jakarta.
Guan, Z., Shi-Bao Z., Kai-Yun G., Shu-Yun L., and Hong H., 2010, Leaf
Anatomical Structures of
Paphiopedilum and Cyperipedium
and Their Adaptive Significance,
Journal of Plant Research, The Botanical Society of Japan and Springer,
10.1007/s10265-010-0372-z.
Hamidahmamur’s, 2010, Citing Computer References; Jenis dan kegunaan
unsur hara,
http://hamidahmamur.wordpress.co m/jenis-dan-kegunaan-unsur-hara/ (Diakses 2 Januari 2011)
Irawati, S., 2009, Struktur dan Fungsi
Daun, ITB. Bandung.
Imas, T., Hadioetomo, R. S., Gunawan, A.W., dan Setiadi, Y., 1989,
Mikrobiologi tanah II, Departemen
Direktorat Jendral Pendidikan Tinggi
Pusat Antar Universitas
Bioteknologi Institut Pertanian Bogor.
Juwarno, S. and Samiyarsih, S., 2009, The Effect of Nitrogen Fertilizer Dosages
on Anatomical Characters of
Ipomoea batatas L. Leaf, Fakultas
Biologi, Universitas Jendral
Soedirman, Purwokerto.
Karti, P D., 2004, Pengaruh Pemberian
Cendawan Mikoriza Arbuskula
Terhadap Pertumbuhan dan Produksi Rumput Setaria splendida Stapf
yang Mengalami Cekaman
Kekeringan. Jurnal Media
Peternakan, 27 (2).
Karuniawan, A., dan Ismail, A., 2007, Diversitas Genetik Plasma Nutfah
Kacang Pedang (Canavalia
ensiformis L.) Berdasarkan Karakter
Morfologi Bunga dan Daun. Zuriat, 18 (2).
Lakitan, B., 2004, Dasar-dasar Fisiologi
Tumbuhan, PT. Raja Grafindo
Persada, Jakarta.
Mosse, B., 1973, Plant growth responses to vesicular-arbuscular mycorrhiza,
New Phytol, 72 : 809-815.
Purnobasuki, H., 2009, Panduan
Praktikum Fisiologi Tumbuhan,
Departemen Biologi, Fakultas Sains
dan Teknologi, Universitas
Airlangga, Surabaya.
Sampson, P.H., Zarco, T.P., Mohammed, G.H., Miller, J.R., and Noland, T., 2003, Hyperspectral Remote Sensing of Forest Condition: Estimating Chlorophyll Content in Tolerant Hardwoods, Forest Science 49 (3): 381-391.
Sasli, I. 2004. Citing Computer
References; Peranan Mikoriza
Vesikula Arbuskular (MVA) dalam Peningkatan Resistensi Tanaman Terhadap Cekaman Kekeringan.
http://www.google.co.id/iwan+sasli (Diakses 12 Nopember 2010).
Sitompul, M. dan Guritno, 1995, Analisis
Pertumbuhan Tanaman, Gajah Mada
University Press, Yogyakarta.
Sugito, Y., 1999, Ekologi Tanaman:
Pengaruh Factor Lingkungan Terhadap Pertumbuhan Tanaman dan Beberapa aspeknya, UB Press.
Malang.
Suliatsih dan Suciatmih. 1998. Citing Computer References; Pemanfaatan
Rhizobium dan Jamur MVA pada Tanaman Legum Tumbuh Cepat untuk Reklamasi Lahan Bekas Galian Emas, Sukabumi.
katalog.pdii.lipi.go.id (Diakses 6 Oktober 2010)
Supriyanto, A., 2007, Petunjuk Pratikum
Mikrobiologi Umum, Departemen
Biologi FST, Airlangga University Press, Surabaya.
Tahir, M., Abbasi, M., Rahim, N., Khaliq, A., and Kazmi, M., 2009, Effect of Rhizobium Inoculation and NP Fertilization on Growth, Yield and Nodulation of Soybean (Glycine max
L.) in the Sub-Humid Hilly Region
of Rawalakot Azad Jammu and Kashmir, Pakistan, African Journal
of Biotechnology 8 (22).
Yulipriyanto, H., 2010, Biologi Tanah dan
Strategi Pengelolaannya, Graha
Ilmu, Yogyakarta
Zaman, S., and Padmesh, S., 2009, Leaf Anatomical Adaptations of Selected Kuwait’s Native Desert Plants,
European Journal of Scientific Research 37 (2): 261-268.