BAB II
TINJAUAN PUSTAKA
2.1 Kaca
Kaca adalah salah satu produk industri kimia yang paling akrab dengankehidupan sehari-hari. Dipandang dari segi fisika kaca merupakan zat cair yang sangat dingin. Disebut demikian karena struktur partikel-partikel penyusunnya yang saling berjauhan seperti dalam zat cair, namun kaca sendiri berwujud padat. Dari segi kimia, kaca adalah gabungan dari berbagai oksida anorganik yang tidak mudah menguap, yang dihasilkan dari dekomposisi dan peleburan senyawa alkali dan alkali tanah, pasir serta berbagai bahan penyusun lainnya (Dian, 2001).
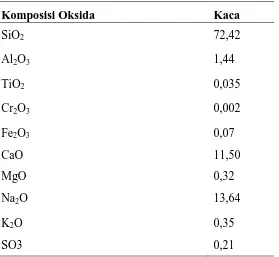
Tabel 2.1 Kandungan kimia dari kaca
Komposisi Oksida Kaca
SiO2 72,42
Al2O3 1,44
TiO2 0,035
Cr2O3 0,002
Fe2O3 0,07
CaO 11,50
MgO 0,32
Na2O 13,64
K2O 0,35
SO3 0,21
Senyawa utama yang terkandung dalam limbah kaca adalah silikon dioksida (SiO2) dengan kadar lebih dari 70% dari total campuran senyawanya (Coleman dkk, 2013). Tingginya kandungan SiO2 dalam limbah kaca dapat dimanfaatkan dan diolah menjadi silika gel melalui pembentukkan natrium silikat yang dihasilkan dari reaksi antara SiO2 di dalam limbah kaca dengan natrium hidroksida (Mori, 2003). Larutan natrium silikat yang dihasilkan dapat direaksikan dengan suatu asam hingga membentuk asam silikat yang akan terpolimerisasi menjadi silika gel (Affandi dkk, 2009).
2.2 Silika (SiO2)
Silika (silicon dioxide) merupakan senyawa kimia dengan rumus molekul SiO2 yang dapat diperoleh dari silika mineral dan sintesis kristal. Silika mineral adalah senyawa yang banyak mengandung SiO2 yang ditemukan dalam bahan tambang dan galian yang berupa mineral seperti pasir kuarsa dan granit (Kalapathy, 2000).
Selain terbentuk secara alami, silika dengan struktur kristal trimidit dapat diperoleh dengan cara memanaskan pasir kuarsa pada suhu 8700C dan bila pemanasan dilakukan pada suhu 14700C dapat diperoleh silika dengan struktur kristobalit. Silika juga dapat dibentuk dengan mereaksikan silikon dengan oksigen atau udara pada suhu tinggi (Iler, 1979).
Beberapa sifat umum silika :
Nama IUPAC : Silikon dioksida
Nama lain : Kuarsa, silika, silkat oksida, silikon (IV) oksida Rumus molekul : SiO2
Massa molar : 60.08 g mol-1 Tampilan : kristal transparan Kepadatan : 2.648 g cm-3
Titik lebur : 1600 – 1725 0C, 1873 – 1998 K, 2912 – 3137 0F Titik didih : 2230 0C, 2503 K, 4046 0F
Kelarutan : 0.079 g L-1 (dalam air) (Brownell, 1983)
Silika ditemukan sedikitnya dalam dua belas bentuk yang berbeda. Bentuk kristal silika yang umum yakni quartz, trydmit, cristobalit, sedangkan bentuk silika amorf berupa endapan silika, silika gel, koloidal sol silika dan silika pyrogenik. Silika amorf sangat berperan penting pada berbagai bidang seperti digunakan sebagai adsorben dan untuk sintesis ultrafilrasi membran, katalis, support material, dan bidang permukaan yang aplikasinya berhubungan dengan
porositas (Rouqe-Malherbe, 2007).
Bentuk umum dari Kristal silika tersebut bila ditinjau berdasarkan kestabilannya terhadap kenaikan suhu tinggi dapat dibagi atas 3 (McColm, 1983), yaitu :
a. Quartz, sampai pada suhu 870 0C
b. Trydimit, pada suhu 870 0C sampai 1470 0C c. Cristobalit, pada suhu 1470 0C sampai 1730 0C
Perubahan bentuk Perubahan bentuk 867 0C 1470 0C
Kuarsa Timidit Kristobalit tinggi tinggi tinggi
Perubahan Perubahan Perubahan struktur struktur struktur 573 0C 160 0C 200 – 270 0 Kuarsa Trimidit Kristobalit
Rendah sedang rendah
Trimidit Rendah
Gambar 2.1. Perubahan Polimorf dari silika (Barsoum, 1997)
2.3 Jenis dan Struktur Silika
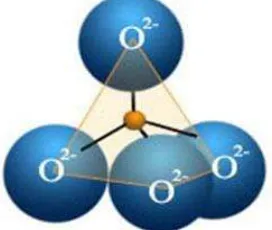
Silika terbentuk melalui ikatan kovalen yang kuat serta memiliki struktur dengan empat atom oksigen terikat pada posisi sudut tetrahedral di sekitar atom pusat yaitu atom silikon memperlihatkan struktur silika tetrahedral.
Gambar 2.1. Struktur Tetrahedral Silika (Anonim B, 2013). 2.3.1 Silika Kristal
Silika kristalin memiliki banyak bentuk, bergantung dari orientasi dan posisi dari tetrahedron yang dibentuk. Fenomena ini yang disebut sebagai polymorphism. Tiga bentuk umum silika kristalin adalah kuarsa, tridimit dan
kristobalit. Pada tekanan atmosferik, silika kuarsa terbentuk pada temperatur 8700C, trimidit terbentuk pada temperatur 870 – 1470 0C, sementara kristobalit terbentuk pada 1470 0C. Struktur dari silika tergantung pada temperatur dan tekanan terbentuknya atau pada kasus tertentu kecepatan pendinginan sehingga padatan silika membentuk struktur yang berbeda (Jones, 2000)
2.3.2 Silika Amorf
Silika amorf tidak memiliki struktur kristalin sebagai mana terlihat pada pengukuran dengan difraksi sinar X (XRD) ditandai dengan bentuk peak yang melebar. Silika amorf memiliki susunan atom dan molekul berbentuk pola acak dan tidak beraturan. Silika amorf dapat terjadi secara alami dan sintetik, keduanya memiliki permukaan berhidrat atau anhidrat. Pada tahun 1987, agen dari WHO (World Health Organization) yaitu IARC (International Agency for Research on Cancer), mengevaluasi dan membuktikan bahwa silika kristalin bersifat
2.4 Sifat Kimia Silika
Silika dalam bentuk amorf memiliki densitas sebesar 2,21 grcm-3 dengan modulus elastisitas sebesar 10 x 106 psi. Kandungan unsur silikon (Si) dan oksigen (O) pada silika jenis ini, adalah 46,7 persen dan 53,3 persen. Nilai kekerasan material ini pada pembebanan tegak lurus dengan menggunakan indentor intan (metode vickers atau knoop) sebesar 710 kgmm-2 sedangkan pada arah pembebanan dengan sudut elevasi diketahui nilai kekerasannya mencapai 790 kgmm-2 (Mantell, 1958).
2.4.1 Reaksi – reaksi
2.4.1.1 Reaksi dengan Asam
Silika relatif silika tidak reaktif terhadap asam kecuali asam hidrofluorida (Basset,J. 1989) seperti reaksi berikut.
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dalam asam hidrofluorida berlebih reaksinya menjadi:
SiO2(s) + 6HF(aq) H2[SiF6](aq) + 2H2O(l)
2.4.1.2Reaksi dengan Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, sepertidengan hidroksida alkali (Basset,J. 1989)
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l)
Secara komersial, silika dibuat dengan mencampurkan larutan natrium silikat dengan suatu asam mineral. Reaksi ini menghasilkan suatu dispersi peka yang akhirnya memisahkan partikel dari silika terhidrat, yang dikenal dengan silika hydrosol atau asam silikat yang kemudian dikeringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi (Bakri, R. 2008) :
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
2.5 Porositas
Porositas dapat menggambarkan distribusi ukuran pori yang bisa digunakan untuk menggambarkan penyerapan silika. Menurut IUPAC (International Union of Pure and Applied Chemistry), ukuran pori dapat diklasifikasikan menjadi 3 (Brinkmann dkk, 2006), yaitu :
1. Mikropori, diameter lebih kecil dari 2 nm (d < 2 nm)
2. Mesopori, diameter antara 2 sampai 50 nm (2 nm < d < 50 nm) 3. Makropori, diameter lebih besar dari 50 nm (d > 50 nm)
Suatu padatan dapat dikatakan sebagai berpori apabila memiliki pori-pori berupa lubang, terusan (chanel) atau celah yang lebih dalam dari luasnya. Pori-pori memiliki tipe yang berbeda dan diklasifikasikan berdasarkan aliran zat yang masuk melalui pori seperti gambar 2.2. berikut.
Gambar 2.3 Perbedaan jenis pori (Schubert and Husing, 2006)
Tipe pori umumnya diklasifikasikan menjadi dua tipe yaitu: A. Pori yang terisolasi dari pori yang lain disebut closed-pores (a)
B. Pori yang terbuka kepermukaan luar dari padatan, yang dipengaruhi sifatmakroskopik padatan dan tidak aktif dalam reaksi kimia disebut open-pores yang terdiri dari: bentuk botol tinta (ink-bottle) (b), bentuk silinder
Luas permukaan dan porositas merupakan karakteristik yang sangat penting pada berbagai material. Penentuan dari isoterm adsorpsi dan desorpsi merupakan variabel yang sangat penting untuk menentukan struktur pori dan metode BET digunakan untuk menentukan total luas permukaan (Brown, 2003).
Dalam karakterisasi pori sering digunakan istilah seperti yang terdapat pada tabel 2.2 berikut ini:
Tabel 2.2. Istilah yang digunakan dalam karakterisasi pori padatan
Istilah Keterangan
Densitas True density Densitas dari material tidak termasuk pori dan kekosongan interpartikel (densitas dari jaringan
padatan)
Apparent density
Densitas dari material tertutup dan pori yang
tidak dapat dilalui
Bulk density Densitas material termasuk pori dan kekosongan interpartikel (massa per total volume, dengan
volume = fase padatan + pori tertutup + pori
terbuka)
Volume pori Vp Volume pori
Ukuran pori Biasanya disebut lebar pori (diameter); jarak dari
dua dinding yang berlawanan
Porositas Perbandingan dari volume total pori Vp dengan
volume yang terlihat (apparent volume) V dari
partikel atau serbuk
Luas Permukaan Area yang tercapai pada permukaan padatan per
satuan unit material
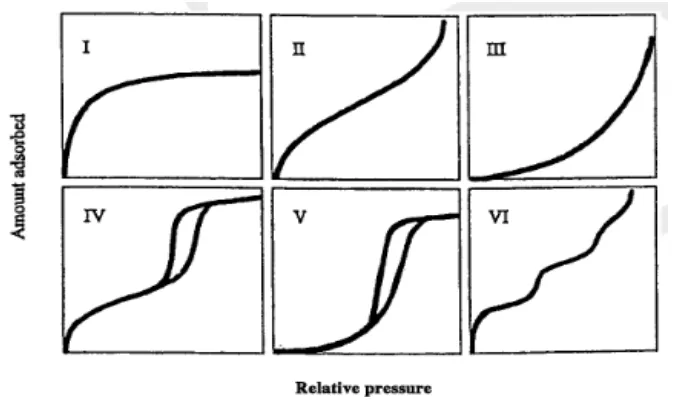
Gambar 2.4 Tipe Grafik Isotherm Adsorbsi Berdasarkan IUPAC (International Union OfPure and Applied Chemistry)
• Tipe I : merupakan karakteristik material mikropori (d < 2 nm)
• Tipe II dan Tipe III : merupakan karakteristik material yang tidak berpori dan makropori (d > 50 nm)
• Tipe IV dan Tipe V : merupakan karakteristik material mesopori (2 nm < d < 50 nm) dimana terdapat pembentukkan multilayer dari kurva adsorbsi dan desorbsi.
• Tipe VI : merupakan karakteristik padatan dua dimensi yang sangat homogen seperti grafit.
Silika berpori merupakan variasi dari bentuk silika amorf. Material berbahan silika banyak diteliti karena memiliki struktur variasi yang luas, dapat diatur pada reaksi hidrolisis dan kondensasi, stabilitas termal yang tinggi pada jaringan amorf dan memiliki kekuatan grafting pada fungsi organik. Silika berpori dibuat dengan mengasamkan larutan silikat basa berair dan diperoleh gel silika pori. Material padatannya diperoleh dengan proses sol-gel dalam larutan yang dikeringkan pada temperatur rendah dimana terjadi penekanan gel menjadi xerogel (Affandi, 2009).
2.6 Karakterisasi Silika
pengujian gugus fungsional silika dan XRD (X-ray Diffraction) melalui pengujian struktur Kristal silika. Kemurnian silika juga dapat dianalisis secara kualitatif melalui uji FTIR dan XRD. Analisis mengenai luas permukaan spesifik partikel silika yang dihasilkan dapat dilakukan dengan menggunakan BET (Brunauer, Emmet, Teller) surface area analyzer.
2.6.1. Spektroskopi Infra Merah (FT-IR)
Spektroskopi inframerah telah digunakan untuk analisis bahan di laboratorium selama lebih dari tujuh puluh tahun. Spektrum inframerah merupakan sidik jari dari sampel dengan puncak serapan yang sesuai dengan frekuensi getaran antara ikatan atom yang membentuk materi. Karena setiap perbedaan material adalah kombinasi unik dari atom, sehingga tidak ada dua senyawa menghasilkan spektrum inframerah yang sama. Oleh karena itu, spektroskopi inframerah dapat menghasilkan identifikasi positif (analisis kualitatif) dari setiap jenis materi yang berbeda. Selain itu, ukuran puncak dalam spektrum merupakan indikasi langsung dari jumlah material (Setyawan dkk. 2013).
Teknik spektroskopi IR digunakan untuk mengetahui gugus fungsional, mengidentifikasi senyawa , menentukan struktur molekul, mengetahui kemurnian dan mempelajari reaksi yang sedang berjalan. Senyawa yang dianalisa berupa senyawa organik maupun anorganik. Hampir semua senyawa dapat menyerap radiasi inframerah ( Mudzakir, 2008 ).
Metode spektroskopi IR banyak digunakan karena : - Cepat dan relatif murah
- Dapat digunakan untuk mengidentifikasi
molekul
- Spektrum inframerah yang dihasilkan oleh suatu senyawa adalah khas dan oleh karena itu dapat menyajikan sebuah finger print (sidik jari) untuk senyawa tersebut (Setyawan dkk. 2013).
spektrum getaran tampak bukan sebagai garis-garis melainkan berupa pita-pita. Letak pita dalam spektrum inframerah disajikan sebagai bilangan gelombang atau panjang gelombang. Satuan bilangan gelombang (cm-1) (Silverstein, 1986).
Penetapan secara kualitatif dapat dilakukan dengan membandingkan tinggi peak (transmitansi) pada panjang gelombang tertentu yang dihasilkan oleh zat yang diuji dan zat yang standar. Dalam ilmu material analisa ini digunakan untuk mengetahui ada tidaknya reaksi atau interaksi antara bahan-bahan yang dicampurkan. Selain itu, nilai intensitas gugus yang terdeteksi dapat menentukan jumlah bahan yang bereaksi atau yang terkandung dalam suatu campuran (Silverstein, 1986)
2.6.2 Spektroskopi Difraksi Sinar – X (XRD)
Spektroskopi difraksi sinar-x (X-Ray diffraction / XRD) merupakan salah satu metode karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan parameter struktur kisi serta untuk mendapatkaan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastis foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar penggunaan difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg (Cullity, 1978) :
n.λ = 2.d.sin θ ; n =1,2,… λ : panjang gelombang sinar-x yang digunakan
d : jarak antara dua bidang kisi
θ : sudut antara sinar datang dengan bidang normal
n : bilangan bulat yang disebut sebagai orde pembiasan
elektron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas pantulan yang disebabkan oleh bidang tersebut dan menyebabkan makin jelas spot yang terekam pada film. Dengan menggunakan suatu metoda yang dikenal dengan nama metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi elektron maksimum (Bird, 1993). 2.6.3 Metode Adsorpsi Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) dikembangkan oleh Brunauer, Emmet dan Teller. Proses adsorpsi digambarkan sebagai proses lapisan dengan lapisan (Layer-by-layer), permukaan secara energetik dianggap homogen, medan adsorpsi sama dalam setiap tempat permukaan. Proses adsorpsi dianggap tidak bergerak (setiap molekul yang diadsorbsi pada sisi dasar adsorbsi pada permukaan). Lapisan pertama molekul yang diadsorbsi memiliki energi interaksi dengan medan adsorbs (Ea0) dan interaksi vertikal antara molekul setelah lapisan pertama (EL0) sama terhadap panasadsorbat dan molekul yang diadsorbsi tidak berinteraksi secara menyamping(Roque-Malherbe, 2007).
Untuk menerapkan persamaan isotherm BET terhadap data adsorpsi yang diperoleh digunakan persamaan linier berikut:
� = ��.�.�
(��−�).[1+(�−1).� �⁄ �] ……….. (1)
V = volume gas yang terserap pada tekanan p Vm = volume gas terserap pada monolayer
C merupakan parameter yang dapat ditentukan dengan cara berikut:
� =�.����1−��
�� ……… (3)
Dengan A adalah konstanta, E1 merupakan panas yang diserap lapisan pertama dan El adalah panas yang kondensasi dari gas.
Untuk area yang dilewati setiap molekul dalam monolayer dianggap sempurna, dimana untuk nitrogen (N2) = 0,162 nm2 pada 77K dan argon (Ar) = 0,138 nm2 pada 87K (Kanellopoulos, N. 2011).
Metode BET tidak tepat untuk perhitungan mikropori, karena ketika metode ini diterapkan pada adsorben mikro maka akan terjadi penyerapan pada tekanan yang relatif rendah sehingga memungkinkan volume monolayer yang dihitung lebih dari satu lapisan terserap. Jika nilai ini diubah menjadi luas permukaan BET maka nilai yang dihasilkan akan lebih besar dari nilai yang sebenarnya. Meskipun metode BET tidak menggambarkan keadaan yang sebenarnya, namum metode ini yang lebih umum digunakan untuk analisa isotherm adsorbsi. Ini disebabkan metode BET relatif sederhana dan dianggap memberikan kapasitas adsorpsi yang baik dari adsorben yang digunakan (Kanellopoulos, N. 2011).
2.6.4 Scanning Electron Microscopy (SEM)