8.1.Tujuan Percobaan
1. Untuk mengetahui pengertian dari air formasi. 2. Untuk mengetahui sifat-sifat air formasi 3. Untuk mengetahui kegunaan dari air formasi
4. Untuk mengetahui kesulitan yang ditumbulkan air formasi
5. Untuk mengetahui factor-faktor yang berpengaruh dalam penentuan tingkat pengendapan & pelarutan.
8.2.Dasar Teori
Air formasi atau disebut connate water mempunyai komposisi kimia yang berbeda-beda antara reservoir yang satu dengan yang lainnya. Oleh karena itu, analisa kimia pada air formasi perlu dilakukan untuk mengetahui sifat-sifatnya. Dibandingkan dengan air laut, air formasi ini rata-rata memiliki kadar garam yang lebih tinggi, sehingga studi mengenai ion-ion air formasi dan sifat-sifat fisiknya ini menjadi penting artinya karena kedua hal tersebut sangat berhubungan dengan terjadinya penyumbatan pada formasi dan korosi pada peralatan di bawah dan di atas permukaan.
Air formasi tersebut terdiri dari bahan-bahan mineral, misalnya kombinasi metal-metal alkali dan alkali tanah, belerang, oksida besi dan alumunium serta bahan-bahan organis seperti asam nafta dan asam gemuk.
Komposisi ion-ion penyusun air formasi terdiri dari anion-anion dan kation-kation.
Kation-kation yang terkandung dalam air formasi dapat dikelompokkan sebagai berikut :
2. Metal alkali tanah : Br++, Mg++, Ca++, Sr++, Ba++ membentuk basa lemah
3. Ion Hidrogen : OH+
4. Metal berat : Fe++ dan Mn++
Sedangkan anion-anion yang terkandung dalam air formasi adalah sebagai berikut :
1. Asam kuat : Cl-, SO
4-, NO3 -2. Asam lemah : CO3-, HCO3-, S
-Ion-ion tersebut di atas akan bergabung berdasarkan empat sifat, yaitu : 1. Salinitas primer, yaitu bila alkali bereaksi dengan asam kuat, misalnya
NaCl dan Na2SO4
2. Salinitas sekunder, yaitu bila alkali tanah bereaksi dengan asam kuat, misalnya CaCl2, MgCl2, CaSO4,MgSO4.
3. Alkalinitas primer, yaitu apabila alkali bereaksi dengan asam lemah, seperti Na2CO3 dan Na(HCO3)2
4. Alkalinitas sekunder, yaitu apabila alkali tanah bereaksi dengan asam lemah, seperti CaCO3, MgCO3, Ca(HCO3)2 dan Mg(HCO3)2
Air formasi merupakan faktor utama yang berkaitan dengan pembentukan scale. Scale merupakan endapan kristal yang menempel pada matrik batuan maupun pada dinding-dinding pipa dan peralatan di permukaan, seperti halnya endapan yang sering kita jumpai pada panci ataupun ketel untuk memasak air. Adanya endapan scale akan berpengaruh terhadap penurunan laju produksi produksi. Bisa juga disederhanakan,
scale adalah hasil kristalisasi dan pengendapan mineral dari air formasi
yang terproduksi bersama minyak dan gas
Terbentuknya endapan scale pada lapangan minyak berkaitan erat dengan air formasi, dimana scale mulai terbentuk setelah air formasi ikut terproduksi ke permukaan. Selain itu jenis scale yang terbentuk juga tergantung dari komposisi komponen-komponen penyusun air formasi.
Mekanisme terbentuknya kristal-kristal pembentuk scale berhubungan dengan kelarutan masing-masing komponen dalam air formasi. Sedangkan kecepatan pembentukan scale dipengaruhi oleh kondisi sistem formasi,
terutama tekanan dan temperatur. Perubahan kondisi sistem juga akan berpengaruh terhadap kelarutan komponen.
Air formasi biasanya disebut dengan oil field water atau connate
water intertial water adalah air yang diproduksikan ikut bersama-sama
dengan minyak dan gas. Air ini biasanya mengandung bermacam-macam garam dan asam, terutama NaCl sehingga merupakan air yang asam bahkan asam sekali.
Air formasi hampir selalu ditemukan di dalam reservoir hidrokarbon karena memang didalam suatu akumulasi minyak, air selalu menempati sebagian dari suatu reservoir, minimal 10% dan maksimal 100% dari keseluruhan pori.
Untuk menganalisa air formasi secara tepat, dipakai klasifikasi air formasi yang digambarkan, secara grafis hal ini dimaksudkan untuk mengidentifikasi sifat air formasi dengan cara yang paling sederhana tetapi dapat dipertanggungjawabkan, hanya kelemahannya tergantung pada spesifikasinya.
Pengambilan sample air formasi dilakukan di kepala sumur dan atau di separator dengan menggunakan penampung bertutup terbuat dari kaca atau plastic agar tidak terjadi kontaminasi dan hilangnya ion Hidrogen karena akan mempengaruhi kebasahan sample.
Percobaan yang dilakukan adalah dengan menentukan pH, Alkalinitas,
penentuan kandungan kalsium, Magnesium, Barium, Sulfat, Ferro, Klorida, Sodium dan perhitungan indeks stabilitas kalsium karbonat ( CaCO3).
1. Penentuan Kalsium dan Magnesium
Untuk kandungan Ca dan Mg perlu terlebih dahulu ditentukan kesadahan totalnya.
2. Penentuan Alkalinitas
Alakalinitas dari suatu cairan biasa dilaporkan sebagai CO3-, HCO3 -dan OH-, yaitu dengan menitrasi air sample dengan larutan asam yang
lemah dan larutan indicator. larutan penunjuk (indicator) yang digunakan dalam penentuan kebasahan CO3- dan OH- adalah Phenolphtelein (PP), sedangkan Methyl Orange (MO) digunakan sebagai indicator dalam penentuan HCO3-.
3. Penentuan Klorida
Unsur ion baku ditentukan dalam air formasi ialah Cl, yang konsentrasinya lemah sampai pekat. Metode mohr selalu digunakan dalam penentuan kadar klorit, tanpa perbaikan nilai pH. Cara pengujian dapat ditentukan untuk fluida yang bernilai pH antara 6 sampai 8.5 dan hanya ion SO yang sering mengganggu. gangguan dapat diketahui dari warna etelah titrasi dengan larutan AgNO3 warna abu-abu sampai hitam. Bila hal ini dapat diketahui sebelumnya, ion ini dapat dihilangkan dengan cara mengasamkan contoh air yang akan diperiksa dengan larutan asam senyawa (HNO) dan dimasak selama 10 menit. setelah didinginkan, naikan pH samapi 6 hingga 8.5 dengan NHOH., larutan buffer kesadahan total atau larutan buffer Calver, dan tidak sekali-sekali mengurangi pH dengan HCL.
4. Penentuan Sodium
Sodium tidak ditentukan dilapangan, karena nilai sodium tidak dapat dianggap nilai yang nyata atau absolut. Perhitungannya ialah dengan pengurangan jumlah anion dengan jumlah kation dengan me/L kesadahan total tidak dimasukkan dalam jumlah perhitungan ini.Air formasi selain berasal dari lapisan lain yang masuk kedalam lapisan produktivitasnya yang disebabkan oleh :
1. Penyemenan yang kurang baik
2. Kebocoran casing yang disebabkan oleh: 1. Korosi pada casing.
2. Sambungan kuran dapat.
3. Pengaruh gaya tektonik (patahan).
Pengambilan contoh air formasi sebaiknya dari kepala sumur dan atau separator dengan pipa plastic lentur jangan dari bahan tembaga
(Cu) karena mudah larut. Peralatan harus bersih dari bekas noda dan di cuci alirkan dengan air formasi yang akan diambil.
Alkalinitas CO3, HCO3, dan OH harus ditentukan ditempat pengambilan contoh, karena ion-ion ini tidak stabil seiring dengan waktu dan suhu. Untuk itu pH perlu diturunkan sampai 1 dengan asam garam. Penentuan kadar barium harus dilkukan segera setelah contoh diterima, karena unsur BaSO4 terbatas kelarutannya, karena barium bereaksi dengan cepat terhadap SO4 sehingga akan mengurangi konsentrasi barium dan akan menimbulkan kesalahan dalam penelitian. Selain dengan barium,SO4 juga cepat bereaksi dengan kalsium menjadi CaSO4 pada saat suhu turun.
Untuk mengetahui air formasi secara cepat dan praktis digunakan sisem klasifikasi dari air formasi, hal ini dapat memudahkan pengerjaan pengidentifikasian sifat-sifat air formasi. Dimana kita dapat memplot hasil analisa air formasi tersebut, hal ini memudahkan kita dalam korelasi terhadap lapisan –lapisan batuan dari sumur secara tepat.
Beberapa kegunaan yang paling penting dari analisa air formasi ini adalah:
1. Untuk korelasi lapisan batuan 2. Menentukan kebocoran casing
3. Menentukan kualitas sumber air untuk proses water flooding
Identifikasi kecenderungan pembentukan scale juga dapat dilakukan secara matematik dengan menghitung besarnya harga kecenderungan pembentukan scale (scale tendency). Metode yang digunakan berbeda-beda untuk tiap jenis scale. Untuk memperkirakan kecenderungan pembentukan scale kalsium karbonat dapat dilakukan dengan menggunakan metode Langelier, Ryznar, Stiff-Davis, serta metode Oddo-Tompson. Sedangkan perkiraan kecenderungan
terbentuknya scale kalsium sulfat dilakukan dengan menggunakan metode Case dan metode Skillman-McDonald-Stiff. Metode-metode tersebut diatas mempunyai keterbatasan-keterbatasan dan keakuratan hasilnya tergantung pada data analisa air yang representatif untuk tiap kondisi yang dianalisa.
Hal-hal pokok yang perlu diperhatikan dalam pemilihan dan penggunaan metode perhitungan kelarutan antara lain adalah sebagai berikut:
1. Metode Langelier hanya diperuntukkan untuk air tawar dan tidak dapat digunakan pada analisa air formasi, sehingga membutuhkan perhitungan konversi untuk digunakan pada air formasi.
2. Metode Stiff and Davis merupakan modifikasi dari metode Langelier, dan dapat digunakan untuk menganalisa air formasi, tetapi hanya pada kondisi tertentu, sehingga untuk menganalisa pada kondisi reservoir diperlukan perhitungan ekstrapolasi.
3. Perhitungan kecenderungan pembentukan scale kalsium sulfat dengan menggunakan metode Skillman-McDonald-Stiff, hanya dapat digunakan pada air formasi dengan kandungan total padatan (total dissolved solids, TDS) kurang dari 150.000 mg/lt, sehingga untuk air formasi dengan TDS lebih besar dari batas tersebut harus ditentukan dengan ekstrapolasi.
Identifikasi terhadap mekanisme dan kondisi pembentukan, lokasi terbentuknya scale serta komposisi endapan yang terbentuk merupakan langkah awal dalam perencanaan program penanganan, baik pencegahan maupun penanggulangan yang effektif.
Hasil Perhitungan SI digunakan untuk identifikasi terbentuknya
Scale dengan kriteria :
1. Jika SI negatif berarti air tidak di jenuhi CaCO3 atau kelarutan yang dihasilkan lebih besar dari padatan yang dilarutkan,pada konsentrasi ini cenderung terbentuk scale dan air tersebut bersifat korosif.
2. Jika SI positip berarti air di jenuhi CaCO3 sehingga cenderung terbentuk scale.
3. Jika harga SI = O , berarti air berada dalam kondisi jenuh Pencegahan dan Penanggulangan Scale :
1. Pencegahan terbentuknya scale adalah usaha yang preventif yang
dilakukan sebelum terbentuk endapan scale
2. Apabila endapan scale telah terbentuk maka harus ditanggulangi
untuk menghilangkan scale yang telah terbentuk tersebut. Penanggulangan endapan scale ini dapat dilakukan secara mekanik, kimiawi ataupun secara kombinasi antara mekanik dan kimia.
Mengatasi Endapan Scale :
1. Menghilangkan Scale di Pipa-Pipa
Dengan kombinasi penggunaan zat kimia dan line Scrapper atau
line pigging
2. Menghilangkan Scale Di dalam Sumur dan Formasi 1. Pembersihan scale pada tubing dan perforasi
2. Pembersihan scale dari ruang pori dan rekahan (Well
Stimulation) dengan cara menginjeksikan asam kedalam
formasi produktif.
Ada 3 metode pengasaman meliputi :
1. Matrix Acidizing. 2. Acid Fracturing.
3. Acid Washing.
8.3.Peralatan dan Bahan 8.3.1. Peralatan
1. Statis dan Buret titrasi 2. Labu ukur
3. pH paper strip 4. Alat ukur elektrolit 5. Pipet
1. Sampel air formasi 2. Larutan buffer 3. Larutan indicator 4. Larutan H2SO4 5. Larutan AgNO3
Gambar 8.1. Statis dan Buret Titrasi
Gambar 8.2. Labu Ukur
Gambar 8.4. Pipet tetes
Gambar 8.5. Pipet Ukur
8.4. Prosedur Percobaan
8.4.1. Penentuan pH (Elektrolit)
1. Dengan menggunakan pH paper strip dapat langsung menentukan harga pH dari sample setelah mencocokkan warna pada standar pH paper strip, maka diperlukan kejelian dalam memilih dan mencocokkan warna dari paper strip.
2. Dengan alat ukur elektrolit, kalibrasi alat sebelum digunakan dengan cara : isi botol dengan larutan Buffer yang telah diketahui harga pH-nya, masukkan elektroda pada botol yang berisi larutan buffer. Putar tombol kalibrasi sampai digit menunjukkan harga pH larutan buffer. 3. Cuci botol dan elektrodanya sebelum digunakan untuk menguji sample
dengan air destilasi untuk mencegah terjadinya kontaminasi. 8.4.2. Penentuan Alkalinitas
1. Ambil contoh air pada gelas titrasi sebanyak 1 cc dan tambahkan larutan PP (Phenolptalein) sebanyak 2 tetes.
2. Titrasi dengan larutan H2SO4 0,02 M sambil digoyang. Warna akan berubah dari pink menjadi jernih. Catat jumlah larutan asam tersebut sebagai Vp.
3. Tetesi lagi dengan 2 tetes MO (Metyl Orange), warna akan berubah menjadi orange.
4. Titrasi lagi dengan H2SO4 0,02 M sampai warna menjadi merah/merah muda. Catat banyaknya larutan asam total yaitu : jumlah asam (2) + asam (4) sebagai Vm.
Perhitungan
Kebasahan P = Vp / banyaknya cc contoh air Kebasahan M = Vm / banyaknya cc contoh air
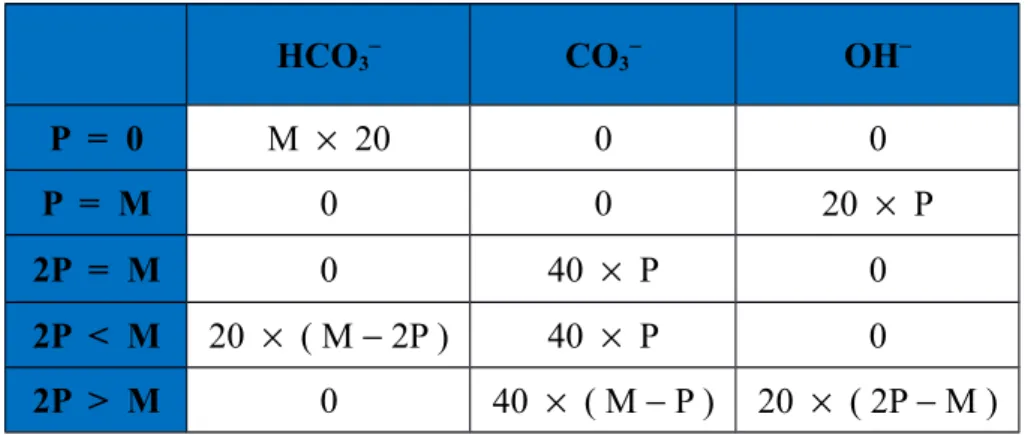
Konsentrasi untuk setiap ion dalam mili ekivalen ( me/L ) dapat ditentukan dari tabel berikut :
Tabel 8.1 Harga kebasahan setiap ion
HCO3 CO3 OH P = 0 M 20 0 0 P = M 0 0 20 P 2P = M 0 40 P 0 2P < M 20 ( M 2P ) 40 P 0 2P > M 0 40 ( M P ) 20 ( 2P M ) 8.4.3. Penentuan Kalsium
1. Ambil 20 ml air suling, tambah 2 tetes larutan buffer calver dan 1 tepung indicator calcer II, warna akan berubah menjadi cerah. Bila warnanya kemerahan, titrasi dengan larutan kesadahan total sampai warna kemerahan hilang.
2. Tambahkan 5 cc air yang dianalisa. Bila ada Ca, warna larutan berubah menjadi kemerahan.
3. Titer dengan larutan titrasi kesadahan total ( 1 ml = 20 epm ) sambil digoyang sehingga warna berubah menjadi biru cerah (jernih). Catat volume titrasi.
Perhitungan
Bila menggunakan larutan 1 ml = 2 epm
Kalsium, me/L = mlcontoh air
2 * titer ml
Bila menggunakan larutan 1 ml = 20 epm
Kalsium, me/L = mlcontoh air
20 * titer ml
Konversi kadar Ca dalam mg/L = Ca, mg/L * 20
8.4.4. Penentuan Magnesium
Magnesium ditentukan dengan dua cara sebagai berikut :
Magnesium, me/L = ( kesadahan total, me/L ) – ( kalsium, me.L ) Magnesium, me/L = Magnesium, me/L * 12,2
8.4.5. Penentuan Klorida
1. Mengambil 20 ml air sample, menambahkan 5 tetes KCrO, warna akan menjadi bening.
2. Mentitrasi dengan larutan AgNO3 1 ml = 0,001 g Cl sampai warna coklat kemerahan, mencatat volume pentitrasi.
3. Jika menggunakan AgNO3 0,001 N :
Kadar Cl, mg/L = air contoh ml titer ml *1000
Kadar Cl, mg/L = air contoh ml titer ml *10000 8.4.6. Penentuan Sodium
1. Mengkonversikan mg/L anion dengan me/L dan menjumlahkan harganya. 5 . 35 / ,mg L Cl + 48 / , 4 mg L SO + 30 / , 3 mg L CO + 61 / , 3 mg L HCO + 17 / ,mg L OH
2. Mengkonversikan mg/L kation menjadi me/L dan menjumlahkan harganya. 7 . 68 / , 6 . 18 / , 2 . 12 / , 20 / ,mg L Mg mg L Fe mg L Ba mg L Ca
3. Kadar sodium ( Na ), mg/L = ( anion – kation ) 23 8.4.7. Grafik Hasil Analisa Air
Hasil analisa air sering dinyatakan dengan bentuk grafik. Kita dapat menandai perbedaan dari contoh air dengan membandingkan dua macam contoh air (atau lebih) dari grafik tersebut. Metode yang umum digunakan adalah metode stiff. Metode ini dapat diplot secara logaritma atau normal antara konsentrasi kation pada sisi kiri titik pusat dan konsentrasi anion diplot pada sisi kanan pusat.
Contoh :
Tabel 8.2. Harga Konsentrasi Komponen
KOMPONEN KONSENTRASI
Natrium Kalsium Magnesium Barium Klorrida Sulfat Karbonat Bikarbonat Iron 1794 39 19 0 1248 645 280 1440 13 78.04 1.95 1.65 0 39.19 13.43 9.33 23.80 0.23
8.4.8. Perhitungan Indeks Stabilitas CaCO3
Air yang mengandung CO3 dalam bentuk apapun akan membentuk kerak atau korosi , tergantung pH dan suhu . Hal ini dapat diketahui dengan perhitungan indeks stabilitas air. CO3 yang terdapat didalam air tersebut mungkin akan tersebut sebagai asam arang (H2CO3), bikarbonat (HCO3), atau karbonat (CO3). Asam arang terdapat bila air tersebut terlalu jenuh dengan CO3, bikarbonat terdapat bila nilai pH air pada range 4 - 8.3, karbonat terdapat bila nilai pH air pada range 8.3 – 11. Rumus untuk menghitung indeksstabilitas CaCO3 adalah:
Bila indeks berharga 0, berarti air tersebut secara kimiawi seimbang. Bila indeks berharga positif, air tersebut mempunyai gejala membentuk endapan. Bila indeks berharga negative, air tersebut bersifat korosif. Nilai pH dan Konsentrasi ion Ca++, Mg++, Na++, CO-, SO
4-, HCO3 -Dimana : pH = Nilai pH pada pengukuran contoh air
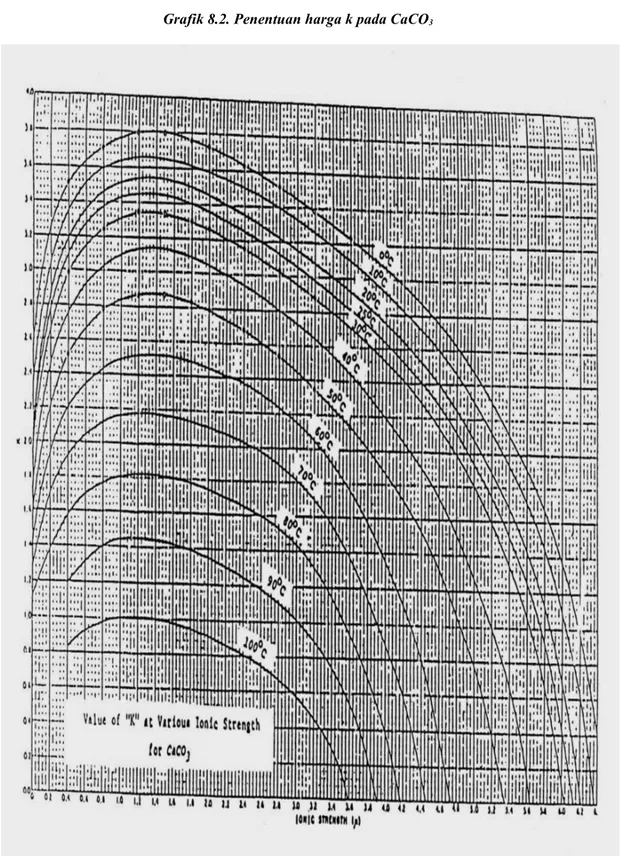
K = Tenaga ion (ditandai m) dan suhu
Tenaga ion ini terdapat pada grafik I. Jumlah tenaga ion didapat dengan mengalikan factor tiap - tiap ion dengan konsentrasi dalam air
(dalam me/L atau mg/L) kemudian dijumlahkan dan K ditentukan dari grafik II.
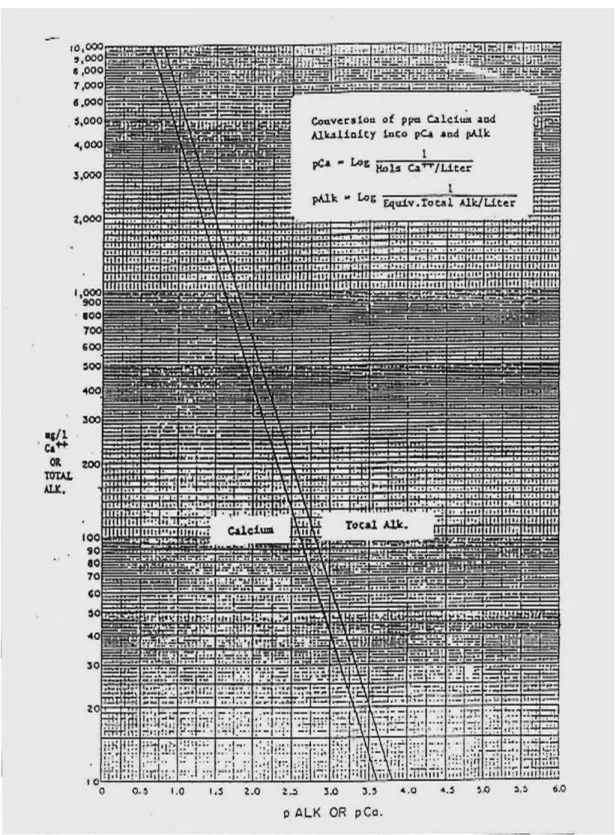
pCa = konversi ion Ca++ dalam mg/L, lihat grafik II pAlk = konversi ion HCO3- dalam mg/L, lihat grafik II
Setelah selesai perhitungan dapat digambarkan suatu kurva indeks stabilitas terhadap suhu agar diperhatikan gejala relative pada air dari segi – segi sistemnya.
Contoh permasalahan :
Hitung indeks stabilitas air pada suhu 50, 77, 177, dan 158 oF dengan air pH = 6.9
Tabel 8.3. Indeks Stabilitas
Dengan menggunakan
factor- factor yang
terdapat pada grafik I,
jumlah tenaga ion
dapat dihitung
sebagai berikut:
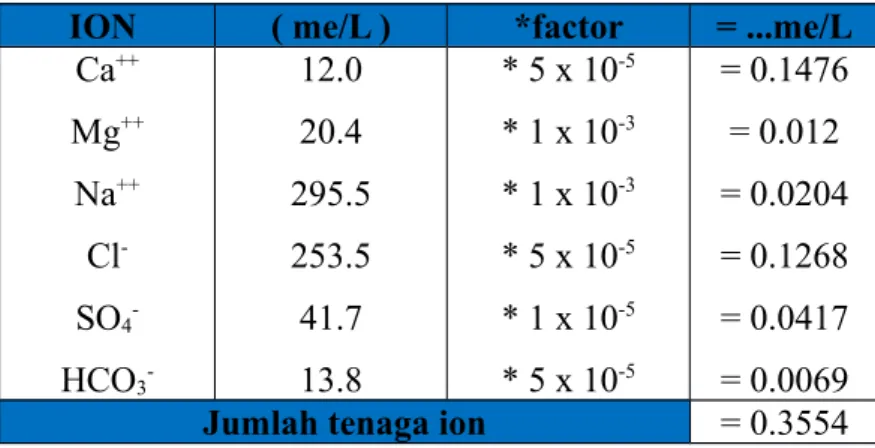
Tabel 8.4. Perhitungan Tenaga Ion
ION me/L mg/L Ca++ Mg++ Na++ Cl -SO4 -HCO3 -12.0 20.4 295.5 253.5 41.7 13.8 240 249 6769 9000 2000 841
ION ( me/L ) *factor = ...me/L
Ca++ Mg++ Na++ Cl -SO4 -HCO3 -12.0 20.4 295.5 253.5 41.7 13.8 * 5 x 10-5 * 1 x 10-3 * 1 x 10-3 * 5 x 10-5 * 1 x 10-5 * 5 x 10-5 = 0.1476 = 0.012 = 0.0204 = 0.1268 = 0.0417 = 0.0069
Setelah menggunakan ion dari air dapat dihitung, tentukan nilai L dari grafik I dimulai dari bawah grafik jumlah tenaga ion (µ), ikuti garis tegak lurus hingga bertemu dengan kurva suhu, kemudian baca nilai K ke sisi kiri.
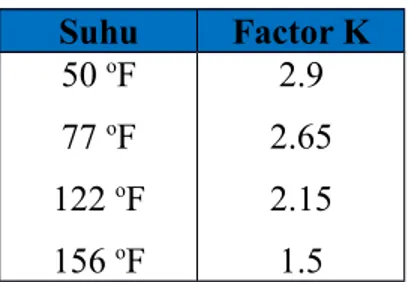
Tabel 8.5. Harga Faktor K dan Suhu
Suhu Factor K 50 oF 77 oF 122 oF 156 oF 2.9 2.65 2.15 1.5
Grafik II digunakan untuk menentukan nilai pCa dan pAlk. Tentukan titik konsentrasi Ca++ pada nilai sebelah kiri grafik, tarik garis lurus hingga bertemu pada kurva kiri. Ikuti garis kebawah untuk menentukan nilai pCa. Cara yang sama untuk konsentrasi HCO3- dengan kurva kekanan dan ke bawah untuk pAlk. Setelah didapat harga pCa dan pAlk, maka hitung indeks stabilitas dengan rumus pAlk
SI/50 oF = 6.9 – 2.90 -2.2 -1.85 = -0.05 SI/77 oF = 6.9 – 2.65 -2.2 -1.85 = 0.20 SI/50 oF = 6.9 – 2.15 -2.2 -1.85 = -0.70 SI/50 oF = 6.9 – 1.50 -2.2 -1.85 = 1.35 Kesimpulan :
1. Air tersebut bergejala scalling pada suhu 54 oF ke atas 2. Air tersebut bergejala corrosive pada suhu 54 oF ke bawah
0
-8.5. Hasil Analisa dan Perhitungan
8.5.1 Hasil Analisa
Tabel 8.6. Tabulasi Konsentrasi Ion Anion dan Kation
Konsentrasi Anion Konsentrasi Kation
Anion BM Mg/L Me/ L(*) Kation BM Mg/L Me/L
Cl 35.5 24600 692,958 Ca++ 40 42 2,1
SO42 96 360 7,5 Mg++ 24 0 0
CO32 60 360 12 Fe++ 56 1300 46,429
HCO3 61 0 0 Ba++ 137 Negatif Negatif
OH 17 53 3,118 Na+ 23 Negatif Negatif
Anion 715,576 Kation 48,529
Konversi mg/L ke me/L = ((mg/L)* valensi/BM) Kadar Sodium ( Na+ ) = Anion Kation
= ( 715,576 48,529 ) Me/l = 667,047 Me/l
Grafik 8.1. Diagram Stiff – Davis
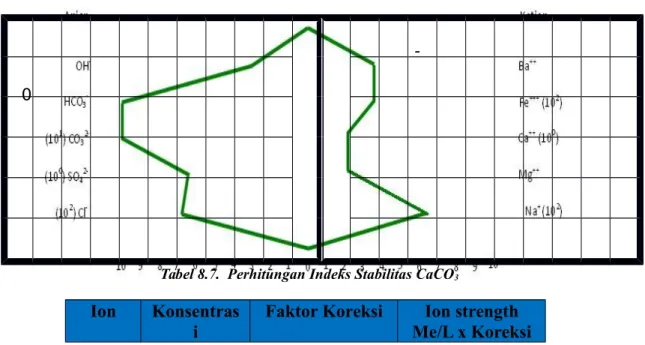
Tabel 8.7. Perhitungan Indeks Stabilitas CaCO3
Ion Konsentras i
Faktor Koreksi Ion strength Me/L x Koreksi
Me/L Me/L Cl 692,958 6 104 0,416 SO42- 7,5 1 103 0,0075 CO32- 12 1,5 103 0,018 HCO3- 0 5 103 0 Ca2+ 2,1 2 103 0,0042 Mg2+ 0 1 103 0 Fe3+ 46,429 1,5 103 0,0696
Ba2+ Negative Negatif Negatif
Na+ 667,047 2 104 0,133
Dari grafik diperoleh:
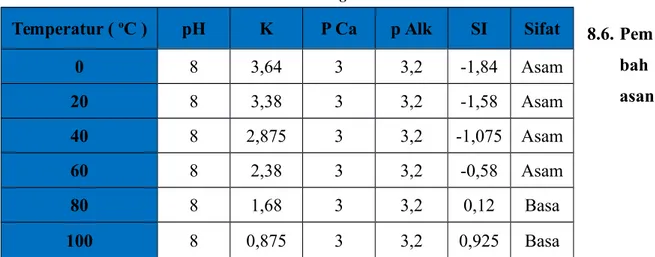
Tenaga ion keseluruhan ( k, dari grafik 8.1. ) pada suhu: Pada temperatur 0 C = 3,64 Pada temperatur 20 C = 3,38 Pada temperatur 40 C = 2,875 Pada temperatur 60 C = 2,38 Pada temperatur 80 C = 1,68 Pada temperatur 100 C = 0,875
Harga pCa = 3,0 ( dari grafik 8.3.) pAlk = 3,2 ( dari grafik 8.3 )
Harga indeks stabilitas CaCO3 (SI) = pH – K – pCa – palk 8.5.2 Perhitungan Konversi Satuan 1. Cl -elektron valensi = 1 Konversi mg/L ke me/L = 35.5 1 24600 x = 692,958 me/L 2. SO4 2-elektron valensi = 2 Konversi mg/L ke me/L = 96 2 360x = 7,5 me/L 3. CO3 2- elektron valensi = 2 Konversi mg/L ke me/L = 60 2 360 x = 12 me/L 4. HCO3 -elektron valensi = 1
Konversi mg/L ke me/L = 61 1 0 x
= 0 me/L 5. OH -elektron valensi = 1
Konversi mg/L ke me/L = 17 1 53 x = 3,118 me/L 6. Ca 2+ elektron valensi = 2 Konversi mg/L ke me/L = 40 2 42 x = 2,1 me/L 7. Mg 2+ elektron valensi = 2 Konversi mg/L ke me/L = 24 2 0 x = 0 me/L 8. Fe 2+ elektron valensi = 2 Konversi mg/L ke me/L = 56 2 1300 x = 35,714 me/L Ion Strength 1. Cl- = 692,958 x 6 x 10-4 = 0,416 2. SO42- = 7,5 x 1 x 10-3 = 0,0075 3. CO32- = 12 x 1,5 x 10-3 = 0,018 4. HCO3- = 0 x 5 x 10-3 = 0 5. Ca2+ = 2,1 x 2 x 10-3 = 0,0042 6. Mg2+ = 0 x 1 x 10-3 = 0 7. Fe2+ = 46,429 x 1,5 x 10-3 = 0,0696 8. Ba2+ = negatif 9. Na+ = 667,047 x 2 x 10-4 = 0,133 Nilai SI 1. SI0 oC = 8 – 3,64 – 3,0 – 3,2 = -1,84 2. SI 20 oC = 8 – 3,38 – 3,0 – 3,2 = -1,58 3. SI 40 oC = 8 – 2,875 – 3,0 – 3,2 = -1,075 4. SI 60 oC = 8 – 2,38– 3,0 – 3,2 = -0,58 5. SI 80 oC = 8 – 1,68 – 3,0 – 3,2 = 0,12 6. SI 100 oC = 8 – 0,875 – 3,0 – 3,2 = 0,925
Tabel 8.8. Harga Indeks Stabilitas
8.6. Pem bah asan
Pengambilan sample air formasi dilakukan di kepala sumur dan / atau di separator dengan menggunakan penampung bertutup terbuat dari kaca atau plastik agar tidak terjadi kontaminasi dan hilangnya ion Hidrogen karena akan mempengaruhi kebasahan sample. SI (Stabilitas Indeks) didapatkan dari beberapa data yaitu: temperatur, pH, K (tenaga ion keseluruhan), pAlk, dan pCa. Air formasi hampir selalu ditemukan didalam reservoir hidrokarbon karena memang didalam suatu akumulasi minyak, air selalu menempati sebagian dari suatu reservoir, minimal 10% dan maksimal 100% dari keseluruhan pori. Pada data yang telah diberikan, diketahui bahwa pH = 8, pCa = 3,0, pAlkali = 3,2. Untuk nilai k (tenaga ion keseluruhan) didapat dengan membaca grafik Ionic Strength (terlampir dalam bagian lampiran). Setelah pembacaan grafik kita lakukan, barulah kita bisa menentukan harga SI (Stabilitas Indeks) pada temperatur tertentu dimana kita mendapatkan pembacaan nilai k (tenaga ion keseluruhan).
Dari data tabel 8.8 di atas, kemudian diplotkan ke dalam suatu grafik menjadi grafik seperti di bawah ini :
Grafik 8.4. Stabilitas Indeks CaCO3 terhadap Temperatur ( oC )
Temperatur ( oC ) pH K P Ca p Alk SI Sifat
0 8 3,64 3 3,2 -1,84 Asam 20 8 3,38 3 3,2 -1,58 Asam 40 8 2,875 3 3,2 -1,075 Asam 60 8 2,38 3 3,2 -0,58 Asam 80 8 1,68 3 3,2 0,12 Basa 100 8 0,875 3 3,2 0,925 Basa
-2 -1.5 -1 -0.5 0 0.5 1 1.5 0 20 40 60 80 100 0 20 40 60 80 100
Grafik Hubungan Indeks Solubilitas Vs Temperatur
Indeks Solubilitas Temperatur
Dapat dilihat bahwa pada suhu 00C, 200C, 400C dan 600C stabilitas CaCO3 berada pada angka negative yang berarti dalam keadaan asam dan pada 800C dan 1000C stabilitas CaCO
3 berada dalam keadaan basa. Grafik 8.5 Harga K terhadap temperatur
1 2 3 4 5 0 20 40 60 80 100 80 60 40 20 0
Grafik Ion Keseluruhan K Vs Temperatur
Ion Keselurahan Temperatur
K semakin besar. Dan dapat dikatakan bahwa hubungan suhu terhadap nilai K adalah berbanding terbalik.
8.7. Kesimpulan
1. Air formasi adalah air yang ikut terproduksi bersama-sama minyak dan gas
2. Sifat-sifat dari air formasi ada 2 yaitu : sifat fisik, dan sifat kimia. Sifat fisik yang meliputi kompressibilitas kelarutan gas dalam air , viskositas air dalam formasi, berat jenis konduktivitas dan sifat kimia yaitu anion dan kation
3. Untuk mengetahui penyebab korosi pada peralatan produksi suatu sumur, untuk mengetahui adanya scale formation , untuk dapat menentukan sifat lapisan dan adanya kandungan yodium & barium yang cukup besar.
4. Adanya korosi, adanya solid deposit, adanya scale formation,adanya emulsi,adanya kerusakan formasi
5. Faktor-faktor yang sangat berpengaruh dalam penentuan tingkat pengendapan dan pelarutan dalam air formasi adalah PH, temperature, serta total tenaga ion keseluruhan dari air formasi tersebut