ANALISIS PERKEMBANGAN HISTAMIN TUNA (Thunnus sp.)
DAN BAKTERI PEMBENTUKNYA PADA BEBERAPA
SETTING STANDAR SUHU PENYIMPANAN
Oleh: IBNU AFFIANO
C34060951
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2011
ANALISIS PERKEMBANGAN HISTAMIN TUNA (Thunnus sp.)
DAN BAKTERI PEMBENTUKNYA PADA BEBERAPA
SETTING STANDAR SUHU PENYIMPANAN
IBNU AFFIANO C34060951
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2011
RINGKASAN
IBNU AFFIANO. Analisis Histamin Tuna (Thunnus sp.) dan Bakteri Pembentuknya pada Beberapa Setting Standar Suhu Penyimpanan). Dibimbing oleh WINI TRILAKSANI dan IRIANI SETYANINGSIH.
Histamin merupakan salah satu permasalahan dalam industri tuna Indonesia. Standar kadar histamin di negara tujuan ekspor yaitu Uni Eropa dan Amerika berkaitan dengan standar suhu optimal penanganan ikan tuna yang dapat mempertahankan kadar histamin ikan tuna dalam batas aman konsumsi. Tujuan penelitian ini adalah mengkaji perkembangan histamin ikan tuna dan bakteri pembentuknya serta parameter total bakteri (TPC) dan indeks kesegaran TVB dalam setting standar suhu penyimpanan (0-1) °C, 4 °C, dan 30 °C sehingga dapat menentukan suhu penyimpanan tuna yang optimal. Perlakuan yang diberikan pada ikan tuna dalam penelitian ini adalah perbedaan suhu, yakni suhu (0-1) °C, 4 °C, dan 30 °C dan kelompok bagian tubuh depan, perut, dan ekor
yang disimpan selama 24 jam, kemudian diuji dengan beberapa parameter, yakni analisis kadar histamin, jumlah bakteri pembentuk histamin, Total Volatile Base (TVB), dan total mikroba (TPC). Kadar histamin pada suhu perlakuan (0-1) °C (2,16-3,02 ppm) dan 4 °C (2,61-3,91 ppm) berbeda nyata dengan 30 °C (>1000 ppm) yang telah melampaui batas maksimal kadar histamin. Kadar TVB suhu (0-1) °C (8,39-11,23 Mg N/100g), 4 °C (11,07-13,52 Mg N/100g), dan 30 °C (43,01-48,40 Mg N/100g) saling berbeda nyata satu sama lain, namun tuna dengan perlakuan suhu (0-1) °C dan 4 °C masih berada dalam batas aman konsumsi dan berada dalam kategori sangat segar dan segar. Bagian perut memiliki kadar TVB tertinggi pada tiap suhu perlakuan. Nilai log Total Plate Count (TPC) perlakuan suhu (0-1) °C dan 4 °C berbeda nyata dan memiliki kisaran antara 4,38-4,47, sementara perlakuan suhu 30 °C, nilai log TPC TBUD. Nilai log jumlah Bakteri Pembentuk Histamin (BPH) perlakuan suhu (0-1) °C dan 4 °C berbeda nyata dan memiliki kisaran antara 3,58-3,68 dan 3,83-3,91, sementara nilai log BPH pada perlakuan suhu 30 °C TBUD. Suhu (0-1) °C dan 4 °C dapat melindungi ikan tuna dengan baik berdasarkan parameter yang diujikan selama 24 jam, sementara bagian perut ikan tuna merupakan bagian yang paling rentan terhadap penurunan mutu sehingga dibutuhkan penanganan khsusus untuk menjaga kualitas agar tetap aman untuk dikonsumsi. Penelitian lebih lanjut sangat diperlukan dengan penambahan perlakuan lama waktu penyimpanan sehingga didapatkan data yang dapat menggambarkan perubahan mutu ikan tuna dalam masa penyimpanan saat transportasi berlangsung.
LEMBAR PENGESAHAN
Judul Penelitian : ANALISIS HISTAMIN TUNA (Thunnus sp.) DAN BAKTERI PEMBENTUKNYA PADA BEBERAPA
SETTING STANDAR SUHU PENYIMPANAN Nama Mahasiswa : Ibnu Affiano
NIM : C34060951
Program Sarjana : Teknologi Hasil Perairan
Menyetujui: Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Wini Trilaksani, M.Sc. Dr. Ir. Iriani Setyaningsih, MS NIP. 196101281986012001 NIP. 196009251986012001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil. NIP. 195805111985031002
PERYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Analisis Histamin Tuna (Thunnus sp.) dan Bakteri Pembentuknya pada Beberapa Setting Standar Suhu Penyimpanan)”adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Desember 2011
Ibnu Affiano C34060951
KATA PENGANTAR
Segala puji kehadirat Allah SWT penulis panjatkan berkat rahmat dan nikmat-Nya, penulis dapat merampungkan skripsi ini dengan baik. Selawat berserta salam penulis sanjungkan kepada nabi Muhammad SAW yang telah membimbing umat ini menuju jalan kebenaran hingga akhir jaman.
Skripsi ini merupakan tulisan yang disusun berdasarkan hasil penelitian dengan judul “Analisis Perkembangan Histamin Tuna (Thunnus sp.) dan Bakteri Pembentuknya pada Beberapa Setting Standar Suhu Penyimpanan”, sebagai syarat untuk memperoleh gelar sarjana perikanan (S.Pi) di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada :
1. Dr. Ir. Wini Trilaksani, M.Sc. dan Dr. Ir. Iriani Setyaningsih, MS selaku dosen pembimbing, atas segala bimbingan dan semangat yang diberikan. 2. Dr. Tati Nurhayati, S.Pi, M.Si selaku dosen penguji atas bimbingan dan
masukan kepada penulis.
3. Dr. Ir. Ruddy Suwandi, M.S, M.Phil selaku Ketua Departemen Teknologi Hasil Perairan dan Dr. Ir. Agoes M. Jacob, Dipl, Biol. selaku ketua Komisi Pendidikan Departemen THP atas dukungannya.
4. Ir. Wachyuni, M.Si selaku kepala BPMPHPK dan Ir. Devi Lidya, M.Si 5. Bapak Hendra Sugandhi dan Bapak Nur Hadipitoyo (PT LNJ).
6. Ayah Drs. H. Emir Basri Soeganda dan ibu Hj. Sherry Meiyanti serta segenap keluarga besar atas semua dukungan dan kasih sayang
7. Erna Anggraeni atas bantuan dan semangat tanpa henti.
8. Sahabat-sahabat THP 40, 41, 42, 43, 44, 45, 46, atas kebersamaan
Penulis menyadari bahwa skripsi ini masih mempunyai kekurangan, untuk itu diharapkan saran dan kritik yang bersifat membangun untuk perbaikan penulisan skripsi ini.
Bogor, Desember 2011
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di DKI Jakarta pada tanggal 30 Juni 1988, merupakan anak kedua dari tiga bersaudara dari pasangan Drs. H. Emir Basri Suganda dan Hj. Sherry Meiyanti.Selama ini penulis telah menempuh jalur pendidikan formal dari SDI Azhar 8 Kembangan dan lulus pada tahun 2000, SLTPI Al-Azhar 10 Kembangan, lulus pada tahun 2003 dan SMAN 112 Jakarta, lulus pada tahun 2006.
Pada tahun 2006 penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan mengambil Program Studi Teknologi Hasil Perairan. Selama menjadi mahasiswa, penulis pernah aktif sebagai Asisten Praktikum mata kuliah Diversifikasi dan Pengembangan Produk Hasil Perairan tahun ajaran 2009/2010 dan Pengolahan Limbah Hasil Perairan tahun ajaran 2009/2010.
Penulis pernah mewakili IPB dalam Pekan Karya Ilmiah Mahasiswa (PIMNAS) XXIV, Makassar pada tahun 2011 dengan karya ilmiah berjudul Analisis Perkembangan Histamin Tuna (Thunnus sp.) dan Bakteri Pembentuknya pada Beberapa Setting Standar Suhu Negara Tujuan Ekspor dan meraih penghargaan setara perak dalam kategori poster ilmiah. Selain itu, penulis juga pernah menjabat sebagai staf divisi kesehatan pada acara OMBAK 2008 dan mewakili FPIK dalam Olimpiade Mahasiswa IPB (OMI) cabang olah raga basket pada tahun 2008, 2009, dan 2010.
Sebagai salah satu syarat untuk menyelesaikan program sarjana di
Departemen Teknologi Hasil Perairan, penulis melaksanakan penelitian dengan judul Analisis Perkembangan Histamin Tuna (Thunnus sp.) dan Bakteri Pembentuknya pada Beberapa Setting Standar Suhu Penyimpanan dibawah bimbingan Dr. Ir. Wini Trilaksani, M.Sc dan Dr. Ir. Iriani Setyaningsih, MS
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Deskripsi Ikan Tuna ... 3
2.2 Komposisi Gizi Ikan Tuna ... 5
2.3 Mutu dan Kemunduran Mutu Ikan ... 5
2.4 Histamin ... 8
2.4.1 Pembentukan histamin akibat aktivitas bakteri ... 9
2.4.2 Reaksi fisiologis histamin ... 11
3 METODE PENELITIAN ... 13
3.1 Waktu dan Tempat ... 13
3.2 Alat dan Bahan ... 13
3.3 Alur penelitian ... 14
3.4 Prosedur Pengujian Sampel ... 14
3.4.1 Analisis kadar histamin (SNI 2354.10: 2009) ... 15
3.4.2 Analisis kadar total volatile base (TVB) (SNI 2354.8:2009) ... 16
3.4.3 Analisis total plate count (TPC) (SNI 01-2332.3-2006) ... 17
3.4.4 Analisis jumlah bakteri pembentuk histamin (Niven et al.1981) . 18 3.4.5 Analisis data (Steel dan Torrie 1991)... 19
4 HASIL DAN PEMBAHASAN ... 21
4.1 Kadar Histamin Ikan Tuna ... 22
4.2 Kadar TVB Ikan Tuna ... 25
4.3 Nilai TPC Ikan Tuna ... 28
4.4 Jumlah Bakteri Pembentuk Histamin Ikan Tuna ... 32
4.5 Perbandingan Jumlah Bakteri Pembentuk Histamin (BPH) dengan Jumlah Total Bakteri (TPC) Ikan Tuna ... 35
Halaman
5 KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Nomor Halaman
1 Jenis-jenis ikan tuna besar ... 4
2 Komposisi gizi beberapa jenis ikan tuna (Thunnus sp.) per 100 gram daging ikan ... 5
3 Jenis-jenis dan spesifikasi bakteri pembentuk histamin yang terdapat pada ikan laut ... 11
4 Tingkat bahaya histamin per 100 g daging ikan ... 12
5 Data hasil penelitian ... 21
6 Kadar histamin ikan tuna ... 22
7 Kadar TVB ikan tuna ... 25
8 Nilai rataan log TPC ikan tuna ... 29
DAFTAR GAMBAR
Nomor Halaman
1 Ikan tuna (Thunnus sp.) ... 4
2 Struktur kimia histamin ... 8
3 Proses dekarboksilase histidin menjadi histamin ... 9
4 Histogram rataan kadar histamin ikan tuna ... 23
5 Skema dekarboksilasi asam amino ... 23
6 Histogram rataan kadar TVB ikan tuna ... 26
7 Histogram nilai log TPC ikan tuna ... 29
8 Histogram nilai log bakteri penghasil histamin ikan tuna ... 33
9 Histogram perbandingan jumlah bakteri pembentuk histamin (BPH) dengan jumlah total bakteri (TPC) ikan tuna pada perlakuan suhu penyimpanan 0-1 °C... 35
10 Histogram Perbandingan jumlah bakteri pembentuk histamin (BPH) dengan jumlah total bakteri (TPC) ikan tuna pada perlakuan suhu penyimpanan 4 °C... 36
1 PENDAHULUAN
1.1 Latar Belakang
Ikan tuna (Thunnus sp.) merupakan salah satu komoditas perikanan Indonesia yang memiliki nilai ekonomis tinggi dan mampu menembus pasar internasional. Potensi ikan tuna di perairan Indonesia masih cukup besar. Hal ini ditunjukkan dengan kenaikan volume produksi ikan tuna pada tahun 2007 mencapai 191.558 ton. Volume produksi ikan tuna ini naik 20,17% bila dibandingkan dengan volume produksi ikan tuna pada tahun 2006 (DKP 2008a). Volume ekspor ikan tuna, cakalang, dan tongkol pada tahun 2007 mencapai 121.316 ton atau naik 32,12% bila dibandingkan dengan volume ekspor ikan tuna, cakalang, dan tongkol pada tahun 2006 (DKP 2008b) dan meningkat sebesar 203.269 ton pada tahun 2009 dan 207.100 ton pada tahun 2010 (KKP 2010).
Produksi tuna Indonesia yang besar dan memiliki pasar yang besar masih menemui beberapa kendala dalam perdagangan. Kasus penolakan terjadi pada produk tuna Indonesia di negara importir diakibatkan oleh permasalahan kemanan pangan, terutama oleh kadar histamin yang melampaui batas. Food and Drugs Administration Amerika Serikat (US-FDA) melaporkan terdapat 8 kasus penolakan tuna Indonesia pada tahun 2009 akibat kadar histamin yang melebihi ambang batas keamanan pangan (FDA 2010). Rapid Alert System for Food and Feed (RASFF) Uni Eropa pada tahun 2007 mencatat terdapat 22 kasus impor tuna
Indonesia yang mengandung histamin melebihi batas keamanan pangan (EC 2007) dan sebanyak 7 kasus penolakan tuna Indonesia sepanjang tahun 2010 akibat kesalahan penanganan dan kadar histamin yang melebihi batas (EC 2011).
Histamin terbentuk karena adanya kesalahan selama proses penanganan dan pengolahan. Jika pada saat penangkapan tidak ditangani dengan tepat maka histidin yang terkandung pada ikan jenis scombroid tersebut dapat diubah menjadi senyawa toksik yang disebut dengan histamin (Dalgaard 2008). Keracunan histamin ditandai dengan adanya gejala klinis seperti peradangan kulit, mual, muntah, diare, kram perut, tekanan darah rendah, sakit kepala, kesemutan, dan gangguan pernapasan. Gejala yang paling terlihat adalah munculnya tanda
kemerahan pada wajah dan leher yang menyebabkan rasa panas yang tidak nyaman (New Zealand Ministry of Health 2001).
Penanganan adalah faktor kunci untuk menghambat terbentuknya histamin pada tuna. Histamin umumnya dibentuk pada temperatur tinggi (>20 °C). Pendinginan dan pembekuan yang cepat segera setelah ikan mati merupakan tindakan yang sangat penting dalam upaya mencegah pembentukan histamin (Taylor dan Alasalvar 2002). Hasil penelitian menunjukkan bahwa pembentukan histamin akan terhambat pada suhu 0 °C atau lebih rendah (Price et al. 1991). Uni Eropa melalui European Comission (EC) menentukan bahwa suhu lebur es (melting ice), yakni (0-1) °C merupakan suhu yang tepat dalam penanganan tuna (EC 2004), sedangkan Food And Drug Administration (FDA) menetapkan batas kritis suhu untuk perkembangan histamin pada tubuh ikan yaitu 4,4 °C (FDA 2001).
Industri tuna Indonesia menerapkan penanganan tuna dengan suhu rendah untuk mencegah terbentuknya histamin. Suhu rendah menuntut pengeluaran biaya yang tidak sedikit, khususnya di negara dengan iklim tropis seperti Indonesia yang mempunyai suhu ruang yang lebih tinggi dibandingkan negara dengan iklim sub tropis, sedang, atau dingin. Biaya penurunan suhu yang mahal mengakibatkan timbulnya resiko suhu penanganan tuna yang tidak tepat sehingga kadar histamin produk tuna Indonesia melebihi batas. Oleh karena itu, diperlukan penelitian untuk menganalisis suhu penanganan tuna yang optimal di Indonesia yang berkorelasi dengan kadar histamin yang terbentuk.
1.2 Tujuan
Tujuan penelitian ini adalah mengkaji perkembangan histamin ikan tuna dan bakteri pembentuknya serta parameter total bakteri (TPC) dan indeks kesegaran TVB dalam setting standar suhu penyimpanan (0-1) °C, 4 °C, dan 30 °C sehingga dapat menentukan suhu penyimpanan tuna yang optimal.
2 TINJAUAN PUSTAKA
2.1 Deskripsi Ikan Tuna
Klasifikasi ikan tuna (Saanin 1984) adalah sebagai berikut : Phylum : Chordata Subphylum : Vertebrata Class : Teleostei Subclass : Actinopterygi Ordo : Perciformes Subordo : Scombridae Family : Scombridae Genus : Thunnus
Species : Thunnus obesus (big eye tuna, tuna mata besar) Thunnus alalunga (albacore, tuna alcar) Thunnus albacore (yellowfin tuna, madidihang)
Tuna mempunyai bentuk tubuh seperti torpedo dengan kepala yang lancip. Tubuhnya licin, sirip dada melengkung dan sirip ekor bersesak dengan celah yang lebar. Bagian belakang sirip punggung dan sirip dubur terdapat sirip–sirip tambahan yang kecil-kecil dan terpisah-pisah. Sirip-sirip punggung, dubur, perut, dan dada, pada pangkalnya mempunyai lekukan pada tubuh sehingga dapat memperkecil daya gesakan air pada saat ikan itu berenang dengan kecepatan penuh. Ikan tuna terkenal sebagai perenang-perenang yang hebat, bisa mencapai kecepatan sekiatar 77 km/jam. Umumnya ikan-ikan tuna ini hidup dengan mengarungi samudra-samudra besar didunia (Nontji 2002). Morfologi ikan Tuna dapat dilihat pada Gambar 1.
Gambar 1 Ikan tuna (Thunnus sp) (Fishbase 2010).
Migrasi ikan tuna di perairan Indonesia mencakup wilayah perairan pantai, teritorial, dan Zona Ekonomi Eksklusif Indonesia. Migrasi jenis ikan tuna di perairan Indonesia merupakan bagian dari jalur migrasi tuna dunia karena wilayah Indonesia terletak pada lintasan perairan Samudera Hindia dan Samudera Pasifik (DKP 2008c). Tuna yang termasuk komoditi ekspor adalah madidihang, tuna mata besar, albacora, tuna sirip biru dan cakalang. Jenis-jenis tuna besar tercantum dalam Tabel 1.
Tabel 1 Jenis-jenis ikan tuna
Nama ilmiah Nama Indonesia Nama Inggris
Thunnus albacore Madidihang Yellowfin tuna
T. obesus Tuna mata besar Big eye tuna
T. alalunga Albacora Albacore
T. maccoyii Tuna sirip biru selatan Southtern bluefin tuna T. tonggol Tuna ekor panjang Longtile tuna
T. thynnus Tuna sirip biru utara Northtern bluefin tuna T. altanticus Tuna sirip hitam Blackfin tuna
Sumber : Uktolseja et al., (1998)
Ikan tuna mempunyai daerah penyebaran yang luas. Tuna kecil sifatnya lebih kosmopolitan karena terdapat di seluruh perairan, terkecuali cakalang lebih menyukai perairan yang kadar garamnya tinggi. Ikan tuna dapat berenang dengan cepat dan beberapa jenis misalnya cakalang dan madidihang migrasinya sangat jauh tidak saja antar negara tetapi juga antar samudera.
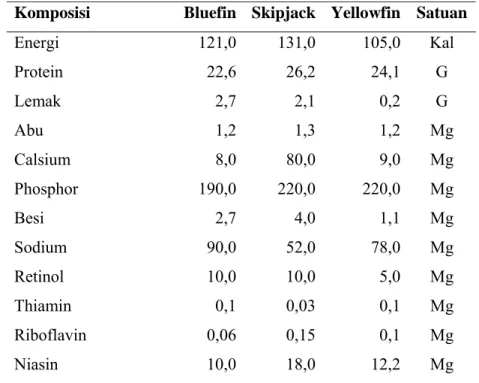
2.2 Komposisi Gizi Ikan Tuna
Ikan tuna adalah jenis ikan dengan kandungan protein yang tinggi dan lemak yang rendah. Ikan tuna mengandung protein antara 22,6-26,2 g/100 g daging, lemak antara 0,2-2,7 g/100 g daging serta mengandung mineral (kalsium, fosfor, besi, sodium), vitamin A (retinol), dan vitamin B (thiamin,riboflavin, dan niasin). Komposisi gizi beberapa jenis tuna tercantum pada Tabel 2.
Tabel 2 Komposisi gizi beberapa jenis ikan tuna (Thunnus sp.) per 100 gram daging ikan
Komposisi Bluefin Skipjack Yellowfin Satuan
Energi 121,0 131,0 105,0 Kal Protein 22,6 26,2 24,1 G Lemak 2,7 2,1 0,2 G Abu 1,2 1,3 1,2 Mg Calsium 8,0 80,0 9,0 Mg Phosphor 190,0 220,0 220,0 Mg Besi 2,7 4,0 1,1 Mg Sodium 90,0 52,0 78,0 Mg Retinol 10,0 10,0 5,0 Μg Thiamin 0,1 0,03 0,1 Mg Riboflavin 0,06 0,15 0,1 Mg Niasin 10,0 18,0 12,2 Mg
Sumber : US Departemen of Health, Education, and Welfare 1972
2.3 Mutu dan Kemunduran Mutu Ikan
Mutu ikan identik dengan kesegaran ikan. Bentuk bahan baku ikan segar dapat berupa ikan utuh atau tanpa insang dan isi perut. Bahan baku harus bersih, bebas dari setiap bau yang menandakan kebusukan, bebas dari tanda dekomposisi dan pemalsuan, bebas dari sifat alamiah lain yang dapat menurunkan mutu dan tidak membahayakan kesehatan. Kesegaran ikan memberikan kontribusi besar terhadap mutu dari ikan tersebut. Kemunduran mutu pada ikan dapat
disebabkan oleh penanganan bahan baku pada saat pascapanen ataupun saat diolah (Bremner 2000).
Perubahan reaksi biokimia dan fisika kimia yang sangat cepat terjadi mulai dari ikan tersebut dibunuh sampai dikonsumsi. Perubahan ini dapat diklasifikasikan menjadi tiga tahap yaitu :
a. Hiperaemia (pre rigor)
Tahap hiperaemia secara biokimia ditandai dengan menurunnya kadar Adenosin Tri Phosphat (ATP) dan kreatin fosfat seperti halnya pada reaksi aktif glikolisis serta lendir yang terlepas dari kelenjar-kelenjarnya di dalam kulit ikan. Pelepasan lendir dari kelenjar lendir ini merupakan reaksi alami ikan terhadap keadaan yang tidak menyenangkan. Jumlah lendir yang terlepas dan menyelimuti tubuh ikan dapat sangat banyak hingga mencapai 1,2-5% dari berat tubuhnya (Eskin 1990).
b. Rigor mortis
Perubahan selanjutnya, ikan memasuki tahap rigor mortis. Tingkat atau tahapan rigor ditandai dengan mengejangnya tubuh ikan yang merupakan hasil dari perubahan-perubahan biokimia yang kompleks di dalam otot ikan. Tubuh ikan yang mengejang yang berhubungan dengan terbentuknya aktomiosin yang
berlangsung lambat pada tahap awal dan menjadi cepat pada tahap selanjutnya (Zaitsev et al. 1969).
Tingkat rigor ini berlangsung sekitar 1 sampai 12 jam sesaat setelah ikan mati. Pada umumnya ikan mempunyai proses rigor yang pendek, kira-kira 1 sampai 7 jam setelah ikan mati. Lamanya rigor dipengaruhi oleh kandungan glikogen dalam tubuh ikan dan temperatur lingkungan (Zaitsev et al. 1969). Kandungan glikogen yang tinggi menunda datangnya proses rigor sehingga menghasilkan produksi daging dengan kualitas tinggi dan pH rendah. Pencapaian pH serendah mungkin dalam jaringan ikan merupakan hal yang penting karena dapat mencegah pertumbuhan bakteri dan untuk memperoleh warna daging yang diinginkan (Eskin 1990).
Pada fase rigor mortis, pH tubuh ikan menurun menjadi 6,2-6,6 dari pH mula-mula 6,9-7,2. Tinggi rendahnya pH awal ikan sangat tergantung pada jumlah glikogen yang ada dan kekuatan penyangga (buffering power) pada daging
ikan. Kekuatan penyangga pada daging ikan disebabkan oleh protein, asam laktat, asam fosfat, tri metil amin oksida (TMAO) dan basa-basa menguap. Proses rigor mortis dikehendaki selama mungkin karena proses ini dapat menghambat proses penurunan mutu oleh aksi mikroba. Semakin singkat proses rigor mortis maka ikan semakin cepat membusuk (FAO 1995).
c. Post Rigor
Indikasi awal proses pembusukan ikan adalah terjadinya kehilangan karakteristik dari bau dan rasa ikan, yang berkaitan dengan degradasi secara autolisis. Autolisis adalah proses penguraian protein dan lemak oleh enzim (protease dan lipase) yang terdapat di dalam daging ikan. Salah satu ciri-ciri terjadinya perubahan secara autolisis adalah dihasilkannya amoniak sebagai hasil akhir pada jaringan tubuh. Penguraian protein dan lemak dalam autolisis menyebabkan perubahan rasa, tekstur, dan penampakan ikan (FAO 1995).
Autolisis dimulai bersamaan dengan penurunan pH. Mula-mula protein terpecah menjadi molekul-molekul makro yang menyebabkan peningkatan dehidrasi lalu pecah lagi menjadi polipeptida, pepton, dan akhirnya menjadi asam amino. Disamping asam amino, autolisis juga menghasilkan sejumlah kecil pirimidin dan purin, basa yang dibebaskan pada waktu pemecahan asam nukleat. Bersamaan dengan itu, hidrolisis lemak menghasilkan asam lemak bebas dan gliserol. Autolisis akan merubah struktur daging sehingga kekenyalan menurun (Zaitsev et al. 1969). Autolisis tidak dapat dihentikan walaupun dalam suhu yang sangat rendah. Biasanya proses autolisis akan selalu diikuti dengan meningkatnya jumlah bakteri. Semua hasil penguraian enzim selama proses autolisis merupakan media yang sangat cocok untuk pertumbuhan bakteri dan mikroba lainnya (FAO 1995).
d. Busuk
Setelah fase rigor mortis berakhir dan pembusukan bakteri berlangsung maka pH daging akan naik mendekati netral hingga 7,5-8,0 atau lebih tinggi jika proses pembusukan sangat parah. Tingkat keparahan pembusukan disebabkan oleh kadar senyawa-senyawa yang bersifat basa. Pada kondisi ini, pH ikan akan naik dengan perlahan-lahan dan dengan semakin banyaknya senyawa basa yang terbentuk akan semakin mempercepat kenaikan pH ikan (FAO 1995). Jumlah
bakteri pada tahap ini sudah cukup tinggi akibat perkembangbiakan yang terjadi pada tahap-tahap sebelumnya. Kegiatan bakteri pembusuk dimulai pada saat yang hampir bersamaan dengan autolisis dan kemudian berjalan sejajar (Eskin 1990).
2.4 Histamin
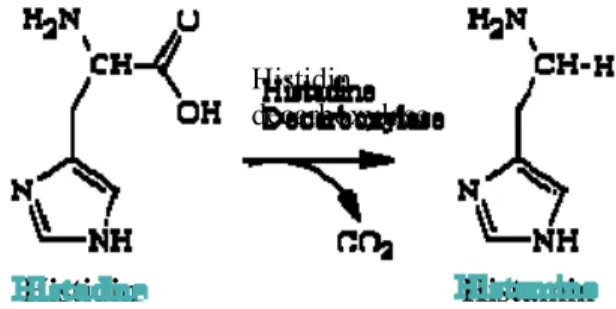
Histamin merupakan komponen amin biogenik yaitu bahan aktif yang diproduksi secara biologis melalui proses dekarboksilasi dari asam amino bebas serta terdapat pada berbagai bahan pangan, seperti ikan, daging merah, keju dan makanan fermentasi (Keer et al. 2002). Keracunan histamin merupakan suatu intoksikasi akibat mengkonsumsi ikan laut yang umumnya berasal dari famili scombroid, seperti tuna, mackerel, cakalang, dan sejenisnya. Histamin merupakan senyawa amin biogenik yang terbentuk dari asam amino histidin akibat reaksi dengan enzim dekarboksilase (Dalgaard et al. 2008).
Indriati et al. (2006) menyatakan bahwa histamin merupakan salah satu senyawa biogenik amin yang dianggap sebagai penyebab utama keracunan makanan yang berasal dari ikan, terutama dari kelompok scombroid. Histamin merupakan komponen yang kecil, mempunyai berat molekul rendah yang terdiri dari cincin imidazol dan sisi rantai etilamin. Histamin juga merupakan komponen yang tidak larut air. Histamin merupakan salah satu amin biogenik yang mempunyai pengaruh terhadap fisiologis manusia. Struktur kimia histamin dapat dilihat pada Gambar 2.
Gambar 2 Struktur kimia histamin (Keer et al. 2002).
Satuan kadar histamin dalam daging ikan dapat dinyatakan dalam mg/100g atau ppm (mg/1000g). Kandungan histidin bebas pada jaringan ikan tuna lebih tinggi dibandingkan dengan spesies ikan lainnya sehingga meningkatkan
potensi peningkatan kadar histamin, khususnya untuk penyimpanan dan penanganan yang salah (Keer et al. 2002).
Proses dekarboksilase histidin menjadi histamin dapat terjadi melalui dua cara yaitu autolisis dan aktivitas bakteri. Proses dekarboksilase histidin menjadi histamin dapat dilihat pada Gambar 3
Gambar 3 Proses dekarboksilase histidin menjadi histamin (Keer et al. 2002).
2.4.1 Pembentukan histamin akibat aktivitas bakteri
Setelah ikan mati, sistem pertahanan tubuhnya tidak bisa lagi melindungi dari serangan bakteri, dan bakteri pembentuk histamin mulai tumbuh dan memproduksi enzim dekarboksilase yang akan menyerang histidin dan asam amino bebas lainnya menjadi histamin. Histamin umumnya dibentuk pada temperatur tinggi (>20 °C). Pendinginan dan pembekuan yang cepat, segera setelah ikan mati merupakan tindakan yang sangat penting dalam upaya mencegah pembentukan scombrotoxin (histamin). Histamin tidak akan terbentuk bila ikan selalu disimpan dibawah suhu 5 °C. Pembekuan yang terlalu lama (24 minggu) diduga akan menginaktifkan bakteri pembentuk enzim dekarboksilase dan diduga pula dapat mengurangi pembentukan histamin. Penelitian lebih lanjut menyebutkan bahwa kenaikan pembentukan histamin dapat terus berjalan walaupun dalam keadaan penyimpanan beku (Taylor dan Alasalvar 2002).
Selama proses kemunduran mutu, bakteri memproduksi enzim dekarboksilase yang akan mengubah histidin bebas dan asam amino lain pada daging ikan menjadi histamin dan amin biogenik lain seperti putresin (dari ornitin), kadaverin (dari lisin), serta spermidin dan spermin (dari arginin) (Lehane dan Olley 2000).
Histidin Histamin
Histidin decarboxylase
Bakteri pembentuk histamin secara alami terdapat pada insang dan isi perut ikan. Kemungkinan besar insang dan isi perut merupakan sumber bakteri ini karena jaringan otot ikan segar biasanya bebas dari mikroorganisme. Bakteri ini akan menyebar ke seluruh bagian tubuh selama proses penanganan. Penyebaran bakteri biasanya terjadi pada saat proses pembuangan insang (gilling) dan penyiangan (gutting) (Sumner et al. 2004). Bakteri pembentuk histamin umumnya adalah bakteri mesofilik (Shahidi dan Botta 1994).
Berbagai jenis bakteri mampu menghasilkan enzim histidin dekarboksilase (Hdc) termasuk bakteri Enterobacteriaceae dan Bacillaceae (Allen 2004). Umumnya genus Bacillus, Citrobacter, Clostridium, Escherichia, Klebsiella, Lactobacillus, Pediococcus, Photobacterium, Proteus, Pseudomonas, Salmonella, Shigella dan Streptococcus menunjukkan aktivitas dekarboksilase asam amino (Kanki et al. 2002). Bakteri Pembentuk Histamin (BPH) dapat tumbuh pada kisaran suhu yang cukup luas. Pertumbuhan Bakteri Pembentuk Histamin (BPH) berlangsung lebih cepat pada temperatur yang tinggi (21,1 °C) dibandingkan pada temperatur rendah (7,2 °C) (FDA 2001).
Laporan mengenai temperatur optimum dan batas suhu terendah pembentukan histamin sangat bervariasi. Suhu optimum pembentukan histamin adalah pada suhu 25 °C (Keer et al. 2002). Penyimpanan ikan pada suhu 25 °C selama 24 jam dapat meningkatkan kandungan histamin yang terkandung hingga 120 mg/100 g (Yoghuci et al. 1990). Menurut Fletcher et al. (1995) pembentukan histamin pada suhu 0-5 °C sangat kecil bahkan dapat diabaikan. Hasil penelitian Price et al. (1991) juga menunjukkan bahwa pembentukan histamin akan terhambat pada suhu 0 °C atau lebih rendah. Oleh karena itu, Food And Drug Administration (FDA) menetapkan batas kritis suhu untuk pertumbuhan histamin pada tubuh ikan yaitu 4,4 °C (FDA 2001). Jenis-jenis bakteri pembentuk histamin yang terdapat pada ikan laut dan spesifikasinya dapat dilihat pada Tabel 3.
Tabel 3 Jenis-jenis dan spesifikasi bakteri pembentuk histamin yang terdapat pada ikan laut Bakteri Spesifikasi Hafnia sp Klebsiella sp Escherichia coli Clostridium sp Lactobacillus sp Enterobacter spp Proteus sp
Gram negatif, fakultatif anaerobik (Hafnia alvei)
Gram negatif, fakultatif anaerobik (Klebsiella pneumonia) Gram negatif, Fakultatif anaerobik
Gram positif, anaerobik (Clostridium perfringens) Gram positif, fakultatif anaerobik (Lactobacillus 30a) Gram negatif, fakultatif anaerobik (Enterobacter aerogenes)
Gram negatif, fakultatif anaerobik (Proteus morganii)
Sumber: Eitenmiller et al. (1982)
2.4.2 Reaksi fisiologis histamin
Keracunan histamin disebabkan oleh konsumsi ikan yang mengandung histamin dengan level yang tinggi (Bremer et al. 2003). Gejala keracunan histamin meliputi sakit kepala, kejang, mual, wajah dan leher kemerah-merahan, tubuh gatal-gatal, mulut dan kerongkongan terasa terbakar, bibir membengkak, badan lemas dan muntah-muntah (Eitenmiller et al. 1982). Gejala keracunan histamin dapat terjadi sangat cepat, sekitar 30 menit setelah mengkonsumsi ikan yang mengandung histamin tinggi. (Bremer et al. 2003).
Histamin pada ikan yang busuk dapat menimbulkan keracunan jika terdapat sekitar 100 mg dalam 100 g sampel daging ikan yang diuji (Kimata 1961). Food And Drug Administration (FDA) menetapkan bahwa untuk ikan tuna, mahi-mahi dan ikan sejenis, 5 mg histamin/100 g daging ikan merupakan level yang harus diwaspadai sebagai indikator terjadinya dekomposisi, sedangkan 50 mg histamin/100g daging ikan merupakan level yang membahayakan atau dapat menimbulkan keracunan. Oleh karena itu, jika ditemukan ikan dengan kandungan 5 mg histamin/100 g daging ikan pada satu unit, maka kemungkinan pada unit yang lain, level histamin dapat mencapai lebih dari 50 mg/100 g (FDA 2002). Tingkat bahaya histamin per 100 g daging ikan dapat dilihat pada Tabel 4.
Tabel 4 Tingkat bahaya histamin per 100 g daging ikan
Kadar histamin per 100 g Tingkatan bahaya
< 5 mg 5-20 mg 20-100 mg > 100 mg Aman dikonsumsi Kemungkinan toksik Berpeluang toksik Toksik
3 METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilakukan pada bulan Agustus sampai dengan September 2010, bertempat di PT. Lautan Niaga Jaya, Muara Baru – Jakarta Utara, dan Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta).
3.2 Alat dan Bahan
Alat yang digunakan untuk analisis histamin dengan spektrofluorometri dan Kromatografi Cair Kinerja Tinggi (KCKT) (SNI 2354.10:2009) adalah labu erlenmeyer, gelas ukur, pisau, homogenizer (blender), water bath, labu ukur, kertas saring Whattmann, spektrofluorometer tipe Varian Cary Eclipse FL0811M007, glass wool, pipet volumetrik, pipet tetes, kolom kromatografi, timbangan analitik dan buret. Alat yang digunakan pada analisis TVB (SNI 2354.8:2009) adalah blender, buret, corong gelas, erlenmeyer, gelas piala, kertas saring Whattman, labu takar, seperangkat alat destilasi uap, dan timbangan analitik dengan ketelitian 0,0001 gram. Alat yang digunakan untuk analisis Total Plate Count (TPC) (SNI 01-2332.3-2006) dan analisis bakteri penghasil histamin dengan media Niven (Modifikasi Niven 1981) adalah laminar, pipet volumetrik, Homogenizer, plastik steril, cawan petri, inkubator, autoklaf, talenan, water bath, dan stopwatch.
Bahan utama yang digunakan dalam penelitian ini adalah ikan laut jenis tuna (Thunnus sp.), sedangkan bahan-bahan lainnya adalah metanol, resin penukar ion (dowex 1-x800-100-mesh), aquades, HCl, NaOH, H3PO4, ortoptalatdikarboksilaldehide (OPT), larutan TCA, asam borat, K2CO3, vaseline, indikator conway, larutan Butterfield’s Phospate Buffered, Plate Count Agar (PCA), Media niven (0.1% trypton, 0.2% yeast ekstrak, 0.1% L-histidin, 0.1% CaCO3, 2% NaCl, 2.5% agar, 0.01% phenol red).
3.3 Alur Penelitian
Penelitian dimulai dengan tahapan pengambilan sampel di PT. LNJ, Muara Baru, Jakarta Utara. Sampel diambil dari ikan tuna segar yang baru tiba sebanyak 300 gram per bagian tubuh yang akan diuji, yakni bagian tubuh depan, perut, dan ekor ikan tuna. Sampel dimasukkan ke dalam plastik High Density Poly Etylen (HDPE) yang telah disterilkan dengan autoklaf untuk menghindari kontaminasi. Kemudian dimasukkan ke dalam cool box berukuran 25 liter yang telah diisi es berbentuk flake.
Setelah sampel tersimpan baik di dalam cool box, sampel ikan tuna kemudian dibawa menuju ruang preparasi sampel, laboratorium organoleptik Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta) dengan menempuh waktu perjalanan 15 menit dari PT.LNJ.
Preparasi sampel dilakukan secara aseptik dan terbagi ke dalam beberapa kelompok sampel. Pertama adalah sampel kontrol yang tidak mendapatkan perlakuan perbedaan suhu dan lama penyimpanan, diuji pada hari yang sama. Kedua adalah sampel untuk perlakuan suhu penyimpanan (0-1) °C selama 24 jam, ketiga adalah sampel untuk perlakuan suhu penyimpanan 4 °C selama 24 jam, dan terakhir adalah sampel untuk perlakuan suhu penyimpanan 30 °C selama 24 jam.
Setelah dipreparasi, sampel kontrol segera diuji Total Plate Count (TPC) dan uji bakteri penghasil histamin, dan diuji kadar histamin dan Total Volatile Base (TVB). Sampel untuk pengujian hasil perlakuan perbedaan suhu penyimpanan disimpan pada masing-masing suhu uji akan diuji setelah 24 jam penyimpanan.
3.4 Prosedur Pengujian Sampel
Prosedur kerja analisis dalam pengujian sampel pada penelitian ini meliputi analisis kadar histamin, kadar Total Volatile Base (TVB), Total Plate Count (TPC), dan analisis jumlah bakteri pembentuk histamin.
3.4.1 Analisis kadar histamin (SNI 2354.10: 2009)
Prinsip penentuan kadar histamin adalah zat histamin dalam contoh dikonversikan ke dalam bentuk –OH, kemudian diisolasi dengan resin penukar ion dan diubah ke bentuk derivatnya dengan ortoptalatdikarboksilaldehide (OPT) dan diukur secara fluorometris. Hasil yang diperoleh dinyatakan dalam ekuivalen kadar histamin. Prosedur kerja analisis kadar histamin terdiri atas tiga tahap, yaitu sebagai berikut :
a) Tahap ekstraksi
Sepuluh gram sampel ditimbang lalu ditambahkan dengan metanol sebanyak 50 ml kemudian dihomogenkan dengan homogenizer (blender) kurang lebih selama 1-2 menit. Sampel yang sudah dipanaskan dalam water bath pada suhu 60 °C selama 15 menit, kemudian didinginkan pada suhu ruang. Sampel tersebut dimasukkan ke dalam labu ukur 100 ml, kemudian ditambahkan metanol sampai tanda tera lalu dikocok agar homogen. Setelah itu, larutan sampel disaring menggunakan kertas saring dan dimasukkan ke dalam erlenmeyer. Filtrat dari hasil penyaringan akan digunakan pada proses clean up.
b) Tahap clean up atau tahap elusi
Pertama-tama disiapkan kolom kromatografi (panjang 20 cm dan diameter 7 mm) kemudian ke dalam kolom tersebut dimasukkan glass wool secukupnya (tingginya 1 cm). Selanjutnya resin penukar ion (dowex 1-x800-100-mesh) dimasukkan ke dalam kolom sampai tingginya kurang lebih 8 cm (diusahakan resin tidak sampai kering dengan cara dibilas dengan akuades karena akan mempengaruhi daya kerja penukar ion tersebut). Selanjutnya sampel filtrat hasil penyaringan pada tahap ekstraksi dilewatkan ke dalam kolom sebanyak 1 ml dan ditampung hasilnya dalam labu ukur yang telah diberi 5 ml HCl 1 N.
c) Tahap pembentukan
Sebanyak 10 ml HCl 0,1 N dipipet dan dimasukkan ke dalam tabung reaksi kemudian ditambahkan 5 ml sampel hasil tahap celan up/elusi, 5 ml standar histamin (sebagai larutan standar), dan 5 ml HCl 0,1 N (sebagai blanko). Setelah itu, ditambahkan 3 ml NaOH 1 N ke dalam tabung reaksi lalu dihomogenkan dan dibiarkan selama 5 menit. Kemudian ditambahkan lagi ortoptalatdikarboksilaldehide (OPT) 1% sebanyak 1 ml lalu dihomgenkan dan
didiamkan selama 4 menit. Selanjutnya ditambahkan 3 ml H3PO4 3,57 N dan dihomogenkan. Setelah selesai, sampel yang telah melalui tahap pembentukan siap untuk dibaca menggunakan spektrofluorometer pada panjang gelombang eksitasi 350 nm dan panjang gelombang emisi 444 nm. Rumus perhitungan kadar histamin (ppm) adalah sebagai berikut :
Histamin (ppm) =
IU Keterangan : IU = Absorban sampel A = Intersep B = Slope Fp = Faktor pengencer3.4.2 Analisis kadar Total Volatile Base (TVB) (SNI 2354.8:2009)
Analisis ini bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein. Prosedur kerja analisis kadar TVB terbagi atas 3 tahap sebagai berikut :
a) Tahap ekstraksi
Pertama-tama sampel ditimbang sebanyak 10 gram dengan gelas piala, lalu ditambahkan 90 ml asam perklorat (PCA) 6%. Sampel dihomogenkan menggunakan homogenizer selama 2 menit. Selanjutnya sampel disaring dengan menggunakan kertas saring kasar dan menghasilkan filtrat yang akan digunakan pada tahapan selanjutnya.
b) Tahap destilasi
Sebanyak 50 ml sampel filtrat dimasukkan ke tabung destilasi, kemudian ditambahkan beberapa tetes indikator Fenolftalein dan ditambahkan beberapa tetes silikon anti foaming. Tabung destilasi dipasang pada destilator dan ditambahkan 10 ml NaOH 20% sampai basa yang ditandai dengan warna merah. Kemudian disiapkan penampung erlenmeyer yang berisi 100 ml H3BO4 3% dan 3-5 tetes indikator tashiro yang berwarna ungu. Setelah itu sampel didestilasi uap kurang lebih 10 menit sampai memperoleh destilat 100 ml sehingga pada volume akhir mencapai kurang lebih 200 ml larutan berwarna hijau. Larutan blanko
disiapkan dengan mengganti ekstrak sampel dengan 50 ml asam perklorat (PCA) 6% dan dikerjakan dengan proses yang sama dengan sampel
c) Tahap titrasi
Larutan destilat sampel dan blanko kemudian dititrasi dengan menggunakan larutan HCl 0,02 N. Titik akhir titrasi ditandai dengan terbentuknya kembali warna ungu. Perhitungan kadar TVB dapat dilakukan dengan perumusan berikut ini :
Kadar TVB (mgN/100g) = V V N HC A N
Keterangan :
Vc = volume larutan HCl pada titrasi contoh/sampel Vb = volume larutan HCl pada titrasi blanko
Ar N = berat atom nitrogen (14,007) Fp = faktor pengenceran
3.4.3 Analisis total mikroba (Total Plate Count) (SNI 01-2332.3-2006)
Prinsip kerja analisis TPC adalah pertumbuhan mikroorganisme setelah contoh diinkubasi dalam media agar pada suhu 35 °C selama 48 jam, maka mikroorganisme tersebut akan tumbuh berkembang biak dengan membentuk koloni yang dapat langsung dihitung.
Prosedur kerja analisis TPC adalah sebagai berikut: sampel ditimbang secara aseptik sebanyak 25 gram dan ditambahkan 225 ml larutan Butterfield’s Phospate Buffered, kemudian dihomogenkan slama 2 menit. Homogenat ini merupakan larutan pengenceran 10-1. Sebanyak 1 ml homogenat diambil menggunakan pipet steril dimasukkan ke dalam botol berisi 9 ml larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2. Pada setiap pengenceran dilakukan pengocokan minimal 25 kali. Kemudian dilakukan hal yang sama untuk pengenceran 10-3, 10-4, 10-5, dan seterusnya sesuai kondisi sampel. Selanjutnya untuk metode cawan agar tuang (pour plate method), dipipet sebanyak 1 ml dari setiap pengenceran dan dimasukkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Ke dalam masing-masing cawan yang sudah berisi sampel, ditambahkan 12-15 ml media Plate Count Agar
(PCA) yang sudah didinginkan hingga mencapai suhu 45 °C. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 35 °C. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni bakteri yang ada di dalam cawan petri menggunakan alat penghitung koloni. Jumlah koloni yang dihitung adalah cawan petri yang mempunyai koloni bakteri antara 25-250 koloni.
3.4.4 Analisis jumlah bakteri pembentuk histamin (Niven et al. 1981)
Prinsip analisis bakteri pembentuk histamin adalah enterobactericeae akan mengubah histidin menjadi histamin melalui proses dekarboksilase yang akan menaikkan pH dan merubah warna pada media.
Media modifikasi niven agar dipersiapkan dengan cara mencampurkan semua bahan, yaitu 0,1% trypton, 0,3% yeast extract, 1,8% L-histidin monohydrochlorid monohydrat, 0,1% CaCO3, 0,5% NaCl, 2,5% agar, dan 0,003% phenol red, kemudian dimasukkan ke dalam erlenmeyer lalu diencerkan menggunakan aquades hingga 1000 ml. Selanjutnya dipanaskan hingga mendidih dan diatur pH 6,4 kemudian disterilisasi menggunakan otoklaf pada suhu 121 °C selama 15 menit.
Sampel sebanyak 25 gram dimasukkan ke dalam botol yang berisi 225 ml larutan Butterfield’s Phospate Buffered, kemudian dilumatkan dengan blender hingga larutan homogen. Homogenat ini merupakan larutan pengenceran 10-1. Dari campuran tersebut diambil 1 ml dan dimasukkan ke dalam botol berisi 9 ml larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2, kemudian dikocok sampai homogen. Pengenceran dilakukan hingga 10-4. Satu ml larutan sampel hasil setiap pengenceran dimasukkan ke dalam cawan petri, lalu 12-15 ml media niven agar cair yang sudah didinginkan hingga mencapai suhu 45 °C dituangkan ke dalam masing-masing cawan yang sudah berisi sampel. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 35 °C. Selanjutnya dilakukan penghitungan jumlah koloni berwarna merah muda dengan halo pink pada latar belakang
berwarna kuning atau orange. Koloni tersebut merupakan koloni bakteri pembentuk histamin. Hasil penghitungan jumlah koloni bakteri pembentuk histamin tersebut kemudian dibandingkan dengan nilai TPC sehingga diperoleh persentase jumlah bakteri pembentuk histamin terhadap nilai TPC.
3.5 Analsis Data (Steel dan Torrie 1991)
Data hasil analsis kadar histamin, TVB, TPC, dan jumlah bakteri pembentuk histamin dianalisis menggunakan program Microsoft Excel 2007 dan SPSS. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap Faktorial, yakni menunjukkan pengaruh perlakuan suhu dan kelompok bagian tubuh tuna (bagian depan, perut, dan ekor) terhadap kadar histamin, TVB, TPC, dan jumlah bakteri penghasil histamin, serta interaksi keterkaitan antara suhu perlakuan dan perbedaan bagian tubuh yang diuji. Ulangan yang digunakan dalam penelitian ini adalah 3 kali ulangan. Model Rancangan Acak Lengkap Faktorial adalah sebagai berikut :
Keterangan :
Yijk = Pengamatan pada satuan percobaan ke k yang memperoleh kombinasi perlakuan taraf ke i dari faktor α dan taraf ke j dari faktor β
µ = Mean populasi
αi = Pengaruh taraf ke i dari faktor α βj = Pengaruh taraf ke j dari faktor β
(αβ)ij = Pengaruh taraf ke i dari faktor α dan taraf ke j dari faktor β
εijk = Pengaruh acak satuan ke k yang memperoleh kombinasi perlakuan Apabila hasil analisis data menunjukkan hasil yang berbeda nyata, maka dilakukan uji lanjut tukey atau uji Beda Nyata Jujur (BNJ) yang bertujuan untuk mengetahui perlakuan mana yang memberikan pengaruh yang berbeda nyata terhadap parameter yang dianalisis. Rumus pengujian dengan Uji Tukey (BNJ) adalah sebagai berikut:
Keterangan :
q = Nilai pada tabel q p = Perlakuan
dbs = Derajat bebas sisa α = 0,05
4 HASIL DAN PEMBAHASAN
Kadar histamin merupakan salah satu faktor penting dalam menentukan kualitas tuna. Amerika Serikat mempunyai standar kadar histamin pada tuna, yaitu 20 mg per 100 g yang menunjukkan indikasi penanganan yang tidak higiene pada tahap penanganan pasca tangkap dan 50 mg per 100 g menunjukkan bakwa ikan tuna telah membahayakan kesehatan konsumen bila dikonsumsi. Oleh karena itu, jika ditemukan ikan dengan kandungan 5 mg histamin/100 gram daging ikan pada satu bagian, maka terdapat kemungkinan pada bagian yang lain, kadar histamin dapat mencapai lebih dari 50 mg/100 gram (FDA 2001). Indikator kualitas tuna yang juga penting adalah kadar TVB. Analisis TVB masuk dalam indeks kesegaran ikan bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein dan zat-zat lainnya.
Analisis total mikroba atau TPC dilakukan untuk mengetahui angka pertumbuhan mikroorganisme setelah contoh diinkubasi dalam media agar pada suhu 35 °C selama 48 jam sehingga membentuk koloni yang dapat langsung dihitung. Total bakteri yang dihitung dapat menjadi indikator mikrobologi kesegaran ikan tuna.
Standar nilai total bakteri (TPC) yang sudah ditetapkan untuk ikan tuna segar yaitu 5x105 CFU/g (BSN 2006b). Analisis jumlah bakteri pembentuk histamin dilakukan untuk mengetahui persentase bakteri spesifik pembentuk histamin. Data hasil penelitian dapat dilihat pada Tabel 5.
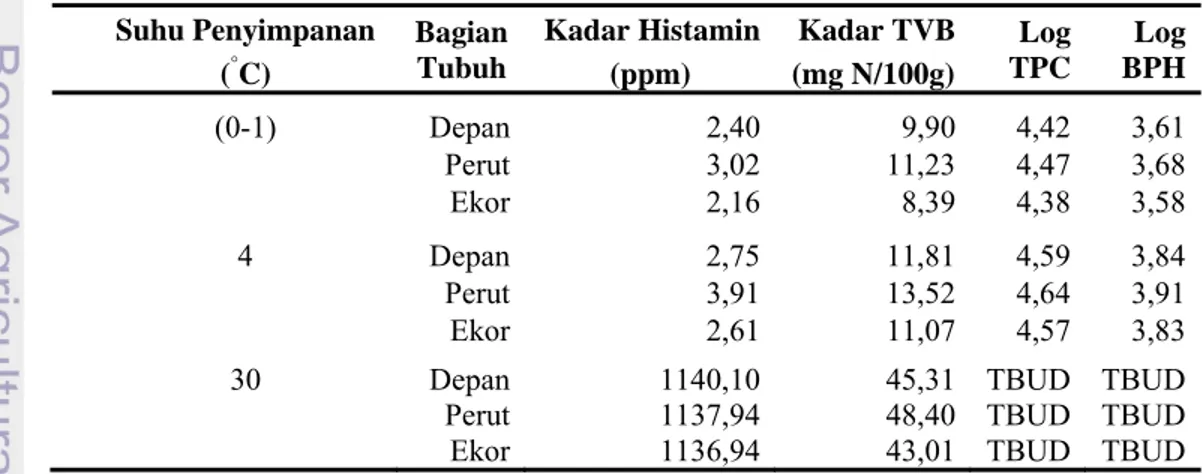
Tabel 5 Data hasil penelitian
Suhu Penyimpanan Bagian
Tubuh
Kadar Histamin Kadar TVB Log
TPC Log BPH (°C) (ppm) (mg N/100g) (0-1) Depan 2,40 9,90 4,42 3,61 Perut 3,02 11,23 4,47 3,68 Ekor 2,16 8,39 4,38 3,58 4 Depan 2,75 11,81 4,59 3,84 Perut 3,91 13,52 4,64 3,91 Ekor 2,61 11,07 4,57 3,83
30 Depan 1140,10 45,31 TBUD TBUD
Perut 1137,94 48,40 TBUD TBUD
Penelitian dibagi berdasarkan suhu penyimpanan dan kelompok bagian tubuh ikan tuna. Bagian ikan tuna yang dianalisis diambil dari tiga lokasi bagian tubuh, yakni bagian depan dekat insang, bagian perut, dan bagian ekor tuna yang akan disimpan ke dalam suhu perlakuan (0-1) °C, 4 °C, dan 30 °C, sedangkan untuk kontrol perlakuan dianalisis tanpa penyimpanan 24 jam.
4.1 Kadar Histamin Ikan Tuna
Histamin merupakan komponen amin biogenik, yaitu bahan aktif yang diproduksi secara biologis melalui proses dekarboksilasi dari asam amino bebas (Keer et al. 2002). Ikan tuna segar sebenarnya tidak mengandung histamin, tetapi memiliki histidin dalam jumlah besar pada jaringan daging. Histamin terbentuk dari histidin selama pembusukan oleh bakteri yang memiliki enzim histidin dekarboksilase (Taylor & Speckhard 1983). Hasil analisis kadar histamin dengan perlakuan perbedaan suhu dan kelompok bagian tubuh sampel dapat dilihat pada Tabel 6.
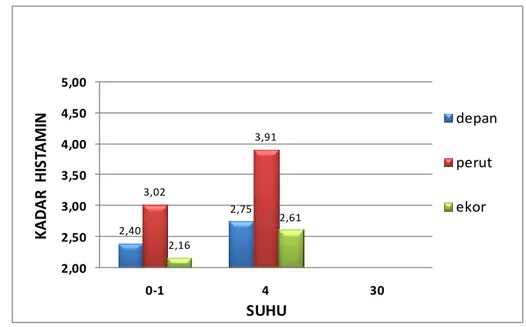
Tabel 6 Kadar histamin ikan tuna
Suhu penyimpanan (°C) Kadar histamin (ppm)
Depan Perut Ekor
Kontrol 1,84 2,35 1,64
(0-1) 2,4 3,02 2,16
4 2,75 3,91 2,61
30 1140,1 1137,94 1136,94
Hasil rataan analisis kadar histamin pada perlakuan suhu penyimpanan 0-1° C dan 4 °C selama 24 jam dengan kelompok tiap sampel bagian tubuh masih berada dibawah batas maksimal kadar histamin 100 ppm, sehingga masih aman dan layak untuk dikonsumsi (BSN 2006a). Kadar histamin dengan perlakuan suhu penyimpanan 30 °C selama 24 jam dan kelompok tiap sampel bagian tubuh berada di atas 1000 ppm. Histogram rataan hasil analisis kadar histamin dapat dilihat pada Gambar 4.
Gambar 4 Histogram rataan kadar histamin ikan tuna ( depan perut ekor). Berdasarkan histogram pada Gambar 4 dapat diketahui bahwa kadar histamin ikan tuna semakin tinggi seiring dengan kenaikan suhu perlakuan penyimpanan. Analisis ragam pada selang kepercayaan 95% menunjukkan hasil bahwa perbedaan suhu penyimpanan memberikan pengaruh nyata terhadap kadar histamin ikan tuna yang terbentuk. Hal ini disebabkan karena suhu merupakan faktor yang mempengaruhi dalam pembentukan histamin. Taylor dan Alasalvar (2002) menyatakan bahwa histamin umumnya dibentuk pada temperatur tinggi (>20 °C). Tuna merupakan ikan yang mengandung asam amino histidin. Asam amino ini merupakan substrat bagi enzim histidine decarboxylase (hdc), baik yang dihasilkan oleh bakteri dalam daging maupun oleh ikan itu sendiri, untuk kemudian diubah menjadi histamin (Hungerford 2010). Skema dekarboksilasi asam amino menjadi biogenik amin dapat dilihat pada Gambar 5.
Hasil analisis sidik ragam dengan selang kepercayaan 95% pada kelompok sampel bagian tubuh ikan tuna menunjukkan bahwa perbedaan bagian tubuh tidak
a
a
a a a a a a a a ab
(p pm ) (°C) DekarboksilasiAsam amino Biogenik amin
Gambar 5 Skema dekarboksilasi asam amino (Sachs et al. 2005). Suhu °C K a dar Hi stamin ( ppm) 2,40 2,75 3,02 3,91 2,16 2,61 2,00 2,50 3,00 3,50 4,00 4,50 5,00 0‐1 4 30 KAD AR HI ST A M IN SUHU depan perut ekor
memberikan pengaruh nyata terhadap kadar histamin yang terbentuk. Hal ini dikarenakan oleh pembentukan histamin pada setiap bagian tubuh tidak berlangsung secara optimal akibat oleh perlakuan suhu penyimpanan (0-1) °C dan 4 °C dan lama penyimpanan selama 24 jam. Pertumbuhan bakteri pembentuk histamin berlangsung lebih cepat pada temperatur yang tinggi (21,1 ºC) daripada temperatur rendah (7,2 ºC) (FDA 2001).
Hasil uji lanjut Tukey terhadap perlakuan suhu penyimpanan menunjukkan bahwa kadar histamin pada suhu penyimpanan 0-1 °C dan 4 °C berbeda nyata dengan kadar histamin pada perlakuan suhu penyimpanan 30 °C (> 1000 ppm). Fletcher et al. (1995) menyatakan bahwa kadar histamin ikan kahawai (Arripis sp.) yang disimpan pada suhu 35 °C, 30 °C, 25 °C, 20 °C, 15 °C, dan 10 °C naik dan berada di atas 20 mg/100g selama 8 hari penyimpanan, sedangkan kadar histamin kahawai pada penyimpanan 5 °C tidak menunjukkan kenaikan selama 8 hari penyimpanan, sehingga pembentukan histamin pada suhu 0-5 °C sangat kecil bahkan dapat diabaikan. Kerr et al. (2002) juga menyatakan bahwa kadar histamin ikan tuna yang disimpan pada suhu 0 °C dan 4 °C selama 0-1 tidak mengalami kenaikan dan berada pada kisaran 1-2 ppm.
Perlakuan suhu penyimpanan 30 °C (1140,1, 1137,94, 1136,94 ppm) memiliki kadar histamin sangat tinggi melebihi 1000 ppm. Hal ini menunjukkan bahwa pembentukan histamin pada suhu 30 °C sangat cepat. Suhu merupakan salah satu faktor kunci yang menentukan pada pembentukan kadar histamin. Suhu 30 °C termasuk suhu optimum perkembangan bakteri mesofilik (20 °C-40 °C) (Tiwari et al. 2009) dan BPH umumnya merupakan golongan bakteri Gram negatif jenis mesofilik (Butler et al. 2010). Hal ini dibuktikan dengan jumlah log TPC dan log BPH pada penyimpanan suhu 30 °C yang sangat tinggi dan termasuk TBUD. Jumlah BPH yang tinggi akan meningkatkan jumlah enzim histidine decarboxylase (Hdc) yang akan mengubah histidin bebas menjadi histamin. Hasil penelitian Visciano et al. (2006) terhadap ikan jenis Sardina pilchardus yang disimpan pada suhu 25 °C selama 24 jam menghasilkan kadar histamin hingga 110,6 mg/100g. Shakila et al. (2003) juga menemukan kandungan histamin di atas 50 ppm pada ikan sardin (Sardinella fimbriata) dan mackerel (Rastrelliger
kanagurta) setelah penyimpanan selama 12-15 jam pada suhu penyimpanan 32 °C.
Bakteri pembentuk histamin berkembang biak seiring dengan laju kemunduran mutu ikan yang terjadi dan mengubah histidin bebas dan asam amino lain pada daging ikan menjadi histamin dan amin biogenik lain seperti putresin (dari ornitin), kadaverin (dari lisin), serta spermidin dan spermin (dari arginin) (Lehane dan Olley 2000).
Berdasarkan parameter kadar histamin ikan tuna yang terbentuk dapat dilihat bahwa perlakuan suhu penyimpanan 0-1 °C dan 4 °C tidak memiliki perbedaan nyata dalam perlindungan kualitas ikan tuna yang dihasilkan. Suhu 4 °C mampu mempertahankan kadar histamin ikan tuna sama baiknya dengan suhu 0-1 °C.
4.2 Kadar TVB Ikan Tuna
Total Volatile Base (TVB) atau Total Volatile Basic Nitrogen (TVB-N) atau Total Volatile Nitrogen (TVN) merupakan jumlah dari amonia, dimetilamin (DMA), trimetilamin (TMA), dan komponen basa lainnya berbasis nitrogen yang bersifat volatil (Etienne et al. 2005). Hasil analisis kadar total volatil base (TVB) ikan tuna dengan perlakuan perbedaan suhu penyimpanan dan perbedaan kelompok sampel berdasarkan bagian tubuh dapat dilihat pada Tabel 7.
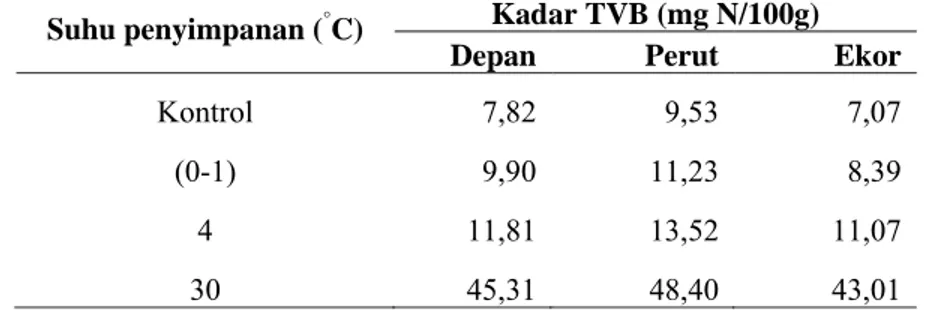
Tabel 7 kadar TVB ikan tuna
Suhu penyimpanan (°C) Kadar TVB (mg N/100g)
Depan Perut Ekor
Kontrol 7,82 9,53 7,07
(0-1) 9,90 11,23 8,39
4 11,81 13,52 11,07
30 45,31 48,40 43,01
Tingkat kesegaran hasil perikanan berdasarkan nilai TVB dikelompokkan menjadi empat, yaitu ikan sangat segar dengan kadar TVB ≤ 10 mg N/100 g, ikan segar dengan kadar TVB 10-20 mg N/100 g, ikan yang berada pada garis batas kesegaran yang masih dapat dikonsumsi dengan kadar TVB 20-30 mg N/100 g
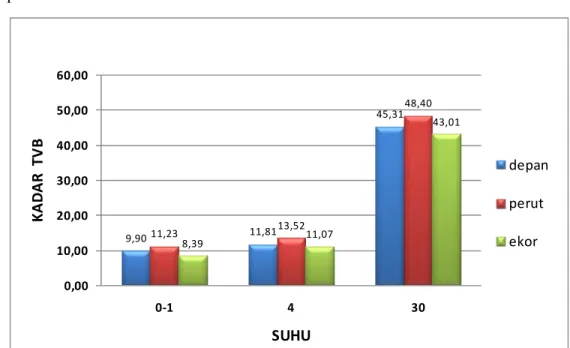
dan ikan busuk yang tidak dapat dikonsumsi dengan kadar TVB > 30 mg N/100 g (Farber 1965). Histogram rataan hasil analisis kadar TVB ikan tuna dapat dilihat pada Gambar 6.
Gambar 6 menujukkan kadar TVB pada ikan tuna naik seiring suhu perlakuan penyimpanan yang meningkat. Hasil analisis sidik ragam dengan selang kepercayaan 95% menunjukkan bahwa perbedaan suhu penyimpanan memberikan pengaruh nyata terhadap kadar TVB ikan tuna yang terbentuk. Hal ini menunjukkan bahwa suhu penyimpanan yang semakin rendah akan menghambat terbentuknya TVB pada ikan tuna. Hasil analisis sidik ragam dengan selang kepercayaan 95% pada perbedaan kelompok sampel berdasarkan bagian tubuh ikan tuna menunjukkan bahwa perbedaan bagian tubuh ikan tuna memberikan pengaruh nyata terhadap kadar TVB yang terbentuk.
Hasil analisis sidik ragam dengan tingkat kepercayaan 95% terhadap interaksi antara perlakuan suhu penyimpanan dan perbedaan kelompok sampel bagian tubuh ikan menunjukkan tidak ada interaksi yang berpengaruh terhadap kadar TVB yang terbentuk, sehingga suhu penyimpanan tidak memiliki keterkaitan dengan perbedaan kelompok bagian tubuh ikan tuna terhadap pembentukan TVB ikan tuna.
c
a
b
a b a a b a a b a (°C) KAD A R TVB (M g N /10 0 g)Gambar 6 Histogram rataan kadar TVB ikan tuna ( depan perut ekor). Suhu °C K ad ar TVB (Mg N /100 g) 9,90 11,81 45,31 11,23 13,52 48,40 8,39 11,07 43,01 0,00 10,00 20,00 30,00 40,00 50,00 60,00 0‐1 4 30 KA D A R TV B SUHU depan perut ekor
Hasil uji lanjut Tukey kadar TVB terhadap perbedaan perlakuan suhu penyimpanan ikan tuna selama 24 jam menunjukkan bahwa ikan tuna
dengan perlakuan suhu penyimpanan 0-1 °C (8,39-11,23 mg N/100g), 4 °C (11,07-13,52 mg N/100g) dan 30 °C (43,01-48,40 mg N/100g) saling berbeda
nyata satu sama lain. Hal ini menunjukkan bahwa suhu penyimpanan yang rendah dapat menghambat pembentukan TVB pada ikan tuna, sebaliknya pada suhu tinggi, kadar TVB ikan tuna yang terbentuk sangat tinggi. Pembentukan TVB oleh mikroba erat kaitannya dengan enzim dehidrogenase yang akan mengurai asam amino menjadi bigoenik amin dan TMAO-ase yang mereduksi TMAO menjadi DMA dan FA.
Suhu 0 °C dapat menghambat perkembangan bakteri dan memperpanjang fase lag bakteri (FAO 1995). Suhu penyimpanan (0-1) °C memiliki kadar TVB yang paling rendah (8,39-11,23 mg N/100g). Hal ini diperkuat dengan nilai log TPC tuna yang sangat rendah, berkisar antara 4,38 hingga 4,47. Jumlah total mikroba yang rendah akan berdampak kepada daya degradasi mikroba pada saat pembusukan akan rendah dan akan mengakibatkan pembentukan TVB akan terhambat.
Suhu penyimpanan 4 °C selama 24 jam memiliki kadar TVB ikan tuna lebih tinggi dibandingkan ikan tuna dengan penyimpanan pada suhu 0 °C, yakni 11,07-13,52 mg N/100g. Pembentukan TVB dimungkinkan terjadi oleh mikroba psikrofilik yang sudah dapat berkembang walaupun dengan sangat lambat (FAO 1995). Jumlah log TPC ikan tuna pada penyimpanan 4 °C juga terbukti lebih tinggi dibandingkan dengan suhu penyimpanan 0 °C, yakni 4,57-4,64. Koral et al. (2010) menemukan kadar TVB sebesar 14 mg N/100g pada ikan bonito (Sarda sarda) yang disimpan pada suhu 4 °C selama 1 hari.
Suhu penyimpanan 0 °C lebih baik dalam melindungi tuna dari kenaikan kadar TVB dibandingkan suhu 4 °C, namun keduanya masih tergolong ke dalam kategori ikan sangat segar dan segar sehingga aman untuk dikonsumsi manusia.
Kadar TVB ikan tuna pada perlakuan suhu penyimpanan 30 °C selama 24 jam (43,01-48,40 mg N/100g) yang sangat tinggi diakibatkan oleh fase pembusukan lanjut pada tuna mengakibatkan perkembangan mikroba pengurai
(Etienne et al. 2005). Hal ini dibuktikan dengan nilai log TPC ikan tuna pada suhu penyimpanan 30 °C yang sangat tinggi dan masuk dalam kategori TBUD. Afilal et al. (2006) menemukan kadar TVB ikan sardin yang disimpan pada
suhu 30 °C sebesar 23,52 mg N/100g selama 7 jam dan meningkat hingga 80 mg N/100g pada penyimpanan selama 24 jam. Shakila et al. (2003) juga
menemukan kadar TVB sudah berada di atas 35 mg N/100 pada ikan barracuda (Sphyraena barracuda) pada suhu penyimpanan 32 °C selama 15 jam.
Hasil uji lanjut Tukey kadar TVB ikan tuna terhadap perbedaan kelompok sampel berdasarkan bagian tubuh menunjukkan bahwa kadar TVB pada tubuh ikan tuna bagian depan dan ekor berbeda nyata dengan kadar TVB bagian perut. Bagian perut ikan tuna sangat rentan dengan pembentukan TVB. Tingginya kadar TVB berkaitan dengan jumlah mikroba pembusuk yang menguraikan asam amino dan TMAO selama proses pembusukan. Hal ini disebabkan perut merupakan isi perut merupakan sumber terbesar keberadaan mikroba.
Bakteri secara alami terdapat pada otot, insang dan isi perut ikan dan kemungkinan besar insang dan isi perut merupakan sumber bakteri
(Sumner et al. 2004). Hal ini sejalan dengan nilai log TPC pada bagian perut ikan tuna yang lebih tinggi dibandingkan dengan bagian depan dan ekor, yakni sebesar
4,47 pada suhu penyimpanan 0 °C dan 4,64 pada suhu penyimpanan 4 °C. Ozogul dan Ozogul (1999) menemukan kadar TVB ikan jenis Rainbow Trout (Onchorhynchus mykiss) pada bagian ventral sebesar 30 mg N/100g, lebih tinggi dibandingkan dengan bagian lateral (24 mg N/100g) dan dorsal (18 mg N/100g) pada penyimpanan dengan suhu 4 °C selama 7 hari.
4.3 Nilai TPC Ikan Tuna
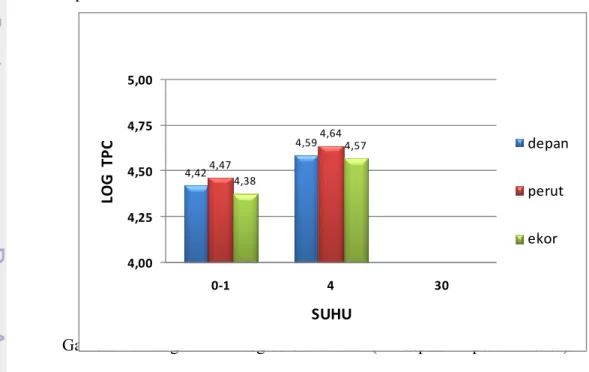
Nilai Total Plate Count (TPC) merupakan salah satu parameter tingkat kesegaran ikan. Pengujian TPC dilakukan berdasarkan SNI 01-2332.3-2006 dengan prinsip menghitung jumlah mikroba yang ditumbuhkan pada suatu media nutrien yang telah melewati proses inkubasi. Nilai rataan log TPC dapat dilihat pada Tabel 8.
Tabel 8 Nilai rataan log TPC ikan tuna
Suhu penyimpanan (°C) Nilai Log TPC
Depan Perut Ekor
Kontrol 3,86 3,89 3,82
(0-1) 4,42 4,47 4,38
4 4,59 4,64 4,57
30 TBUD TBUD TBUD
Hasil pengujian TPC pada ikan tuna dengan suhu penyimpanan 0-1 °C dan 4 °C selama 24 jam pada semua bagian tubuh ikan tuna masih berada dibawah
batas maksimal penerimaan yang sesuai dengan SNI 01-2332.3-2006 (BSN 2006b) yakni log TPC 5,7 (5 x105 CFU/ml) dan aman konsumsi. Pada
perlakuan suhu penyimpanan 30 °C selama 24 jam, nilai rataan TPC pada semua bagian tubuh tuna tidak dapat dihitung atau TBUD yang menandakan bahwa jumlah bakteri sudah terlalu banyak. Histogram rataan log TPC ikan tuna dapat dilihat pada Gambar 7.
Gambar 7 menunjukkan jumlah bakteri yang terkandung pada ikan tuna naik seiring dengan kenaikan suhu penyimpanannya. Hasil analisis sidik ragam dengan selang kepercayaan 95% menyatakan bahwa perbedaan perlakuan suhu
Gambar 7 Histogram nilai log TPC ikan tuna ( depan perut ekor).
(°C) Suhu °C Log TP C a b 4,42 4,59 4,47 4,64 4,38 4,57 4,00 4,25 4,50 4,75 5,00 0‐1 4 30 LO G TP C SUHU depan perut ekor
penyimpanan ikan tuna memberikan pengaruh nyata terhadap nilai TPC yang dihasilkan. Hal ini dikarenakan pertumbuhan bakteri dapat dihambat dengan perlakuan suhu rendah. Semakin rendah suhu ikan, maka tingkat autolisis dan pertumbuhan jumlah bakteri pembusuk akan semakin terhambat.
Berdasarkan hasil analisis sidik ragam dengan selang kepercayaan 95%, kelompok sampel bagian tubuh ikan tuna memberikan pengaruh nyata terhadap nilai TPC yang dihasilkan. Hal ini dikarenakan oleh akumulasi bakteri pembusuk yang dominan berada di perut dan insang ikan. Perut dan insang ikan merupakan bagian tubuh yang sangat rentan terhadap pertumbuhan mikroba karena terdapat banyak organ tubuh ikan yang dengan sangat cepat terdegradasi hingga membusuk saat ikan mati. Hal ini disebabkan perut merupakan isi perut merupakan sumber terbesar keberadaan mikroba. Bakteri secara alami terdapat pada otot, insang dan isi perut ikan dan kemungkinan besar insang dan isi perut merupakan sumber bakteri (Sumner et al. 2004).
Perlakuan suhu penyimpanan 30 °C tidak tercantum di dalam histogram nilai log TPC pada Gambar 6 dikarenakan oleh pada suhu 30 °C, jumlah koloni bakteri setelah inkubasi melebihi rentang jumlah koloni bakteri yang diizinkan untuk dihitung, yakni 25-250 koloni bakteri sehingga masuk ke dalam TBUD atau tidak bisa untuk dihitung. Parameter kadar histamin dan TVB tuna pada penyimpanan 30 °C yang tinggi sejalan dengan nilai log TPC dan sudah tidak layak untuk dikonsumsi. Afilal et al. (2006) melaporkan pada ikan jenis sardin (Sardina pilchardus) yang disimpan pada suhu 30 °C selama 24 jam memiliki jumlah total mikroba sebesar 300 x 105 CFU/g.
Suhu penyimpanan 0 °C (Log TPC 4,38-4,47) memiliki jumlah total bakeri lebih rendah dibandingkan pada 4 °C (Log TPC 4,57-4,64). Kadar histamin dan TVB tuna pada penyimpanan suhu 0 °C menunjukkan hal yang sama saat dibandingkan dengan penyimpanan suhu 4 °C. Yassoralipour et al. (2010) menemukan nilai log TPC ikan baramundi (Lates calclifer) yang bekisar 3-3,2 pada penyimpanan dengan suhu 0 °C selama 1-3 hari, sementara Zapata et al. (2011) menemukan nilai log total mikroba sebesar 4,11 pada daging ikan tuna (Thunnus albacares) yang disimpan pada suhu 4 °C selama 24 jam. Hal ini
membuktikan bahwa suhu yang lebih rendah dapat menghambat kenaikan jumlah mikroba.
Ikan yang berasal dari perairan hangat, mengandung mikroba yang didominasi oleh mikroba mesofilik. Oleh karena perlakuan suhu yang diberikan adalah suhu rendah, diduga mengakibatkan pertumbuhan bakteri tersebut terhambat atau bahkan tidak tumbuh. Penggunaan suhu penyimpanan (0-1) °C dan 4 °C dapat menghambat pertumbuhan mikroba baik golongan mesofilik maupun psikrofilik (Guizani et al. 2005). Suhu optimal perkembangan bakteri mesofilik adalah 20 °C sampai 45 °C, sedangkan bakteri psikrofilik pada suhu 10 °C sampai 20 °C (Tiwari et al. 2009).
Bagian perut (log TPC 4,47 – 4,64) merupakan bagian yang paling rentan terhadap kenaikan jumlah total mikroba dibandingkan dengan bagian depan (4,42 - 4,59) dan bagian ekor (4,38 – 4,57). Adedeji et al. (2011) melaporkan nilai log total mikroba pada bagian dalam perut ikan jenis cat fish (Clarias sp.) sebesar 13,11.
Hasil analisis kadar histamin dan TVB pada ikan tuna juga lebih tinggi pada bagian perut. Lebih Ozogul dan Ozogull (1999) menemukan kadar TVB ikan jenis Rainbow Trout (Onchorhynchus mykiss) pada bagian ventral sebesar 30 mg N/100g, lebih tinggi dibandingkan dengan bagian lateral (24 mg N/100g) dan dorsal (18 mg N/100g) pada penyimpanan dengan suhu 4 °C selama 7 hari. Hal ini membuktikan bahwa bakteri pembusuk lebih banyak dan cepat bekerja pada bagian perut.
Suhu 0 °C dan 4 °C mampu melindungi ikan tuna dari kenaikan nilai TPC selama 24 jam dan masih berada di bawah standar SNI 01-2332.3-2006 (BSN 2006b) yakni log TPC 5,7 (5 x105 CFU/ml) sehingga aman untuk dikonsumsi
Jumlah awal mikroba yang terdapat dalam tubuh ikan ada hubungannya dengan kondisi perairan tempat ikan tersebut hidup. Perbedaan jenis dan jumlah bakteri yang dijumpai pada ikan disebabkan oleh makanan, cara penangkapan, penanganan, dan perbedaan suhu yang dipengaruhi oleh musim dan letak geografis (Junianto 2003).
4.4 Jumlah Bakteri Pembentuk Histamin Ikan Tuna
Proses pembentukan histamin pada ikan sangat dipengaruhi oleh aktivitas enzim L-Histidine Decarboxylase (HDC) (Mangunwardoyo et al. 2007). Bakteri pembentuk histamin (BPH) biasanya terdapat dalam lingkungan perairan, menetap di insang dan usus ikan laut yang hidup serta tidak berbahaya bagi ikan itu sendiri (Ko 2006). Berbagai jenis bakteri yang mampu menghasilkan enzim HDC, termasuk kelompok Enterobacteriaceae, misalnya: Enterobacter agglomerans, Enterobacter cloacae, Enterobacter intermedium, Hafnia alvei, Klebsiella pneumoniae, dan Morganella morganii (Allen 2004).
Jumlah bakteri pembentuk histamin pada ikan tuna ditentukan dengan inkubasi bakteri dengan media spesifik yang mengandung trypton, yeast extract, L-histidin monohydrochlorid monohydrat, CaCO3, NaCl, agar, phenol red. Bakteri penghasil histamin yang terbentuk ditandai dengan koloni bakteri yang berwarna merah muda dengan halo pink pada latar belakang berwarna kuning atau orange. Nilai log jumlah bakteri penghasil histamin dapat dilihat pada Tabel 9.
Tabel 9 Nilai log jumlah bakteri penghasil histamin ikan tuna
Suhu penyimpanan (°C)
Nilai log bakteri pembentuk histamin
Depan Perut Ekor
Kontrol 3,25 3,35 3,17
(0-1) 3,61 3,68 3,58
4 3,84 3,91 3,83
30 TBUD TBUD TBUD
Perlakuan suhu penyimpanan 30 °C melebihi ketentuan perhitungan koloni bakteri sehingga TBUD atau tidak bisa untuk dihitung. Histogram nilai log bakteri penghasil histamin ikan tuna dapat dilihat pada Gambar 8.
Gambar 8 Histogram nilai log BPH ikan tuna ( depan perut ekor).
Berdasarkan histogram nilai log bakteri penghasil histamin ikan tuna pada Gambar 8, dapat diketahui bahwa jumlah bakteri penghasil histamin naik seiring dengan kenaikan suhu perlakuan penyimpanan. Hasil analisis sidik ragam pada selang kepercayaan 95% menyatakan bahwa perbedaan perlakuan suhu penyimpanan ikan tuna memberikan pengaruh nyata terhadap jumlah bakteri penghasil histamin yang dihasilkan. Pertumbuhan jumlah bakteri pembusuk dapat dihambat dengan perlakuan suhu rendah. Hal ini dikarenakan bakteri tidak berada pada suhu optimum untuk pertumbuhannya.
Hasil analisis sidik ragam pada selang kepercayaan 95% menunjukkan bahwa perbedaan perlakuan kelompok bagian tubuh depan, perut, dan ekor tuna tidak memberikan pengaruh nyata terhadap jumlah bakteri penghasil histamin yang dihasilkan. .
Penyimpanan dengan suhu (0-1) ºC (log BPH 3,58-3,68) memiliki jumlah BPH yang lebih rendah dibandingkan pada suhu 4 ºC (log BPH 3,83-3,91). Hal ini sejalan dengan hasil analisis kadar histamin dan nilai TPC pada ikan tuna. Kadar histamin dan TPC tuna pada suhu penyimpanan (0-1) ºC lebih rendah dibandingkan pada suhu 4 ºC. Bakteri pembentuk histamin (BPH) umumnya
merupakan golongan bakteri Gram negatif jenis enterik mesofilik (Butler et al. 2010). Bakteri mesofilik memiliki rentang suhu hidup 20-45 ºC
(°C) Suhu °C Log BPH a b 3,61 3,84 3,68 3,91 3,58 3,83 3,00 3,25 3,50 3,75 4,00 4,25 4,50 0‐1 4 30 LOG NI V EN SUHU depan perut ekor
(Tiwari et al. 2009), namun dimungkinkan masih dapat berkembang pada suhu rendah. Jenis BPH yang sering kali ditemui pada suhu ruang (mesofilik) adalah Proteus spp. dan Morganella morganii (Kim et al. 2003), sedangkan jenis BPH yang dapat tumbuh pada suhu dingin (psikrofilik) diantaranya adalah Photobacterium phosphoreum dan Photobacterium histaminum (Ishimoto et al. 1995). Mangunwardoyo et al. (2007) menyimpulkan bahwa
Enterobacter spp. merupakan BPH terbesar dengan nilai aktivitas spesifik (U) sebesar 305,49.
Ariyani et al. (2004) menemukan kenaikan log BPH ikan tongkol (Euthynnus sp.) yang disimpan pada suhu 4 ºC berjalan setengah kali lipat dari suhu 30 ºC. Hal ini berarti bahwa meskipun jumlahnya tidak sebanyak bakteri pembentuk histamin yang aktif pada suhu kamar, bakteri pembentuk histamin yang aktif pada suhu dingin tetap dapat tumbuh dengan kecepatan yang lebih rendah dibanding dengan kecepatan pertumbuhan bakteri yang aktif pada suhu kamar. sehingga suhu penyimpanan (0-1) ºC dan 4 ºC yang tergolong rendah menyebabkan proses metabolisme bakteri terhambat dan aktivitas pertumbuhannya juga terhambat.
Bakteri penghasil histamin tidak selalu menjadi bagian dari bakteri normal yang terdapat pada bagian luar (kulit) atau bagian dalam (insang dan daging) ikan yang ditangkap. Ikan menjadi terkontaminasi akibat adanya kontak dengan permukaan yang tidak bersih. Pada suhu pertumbuhan yang cocok selama beberapa jam, mikroorganisme akan tumbuh sangat cepat sehingga mengakibatkan peningkatan jumlah histamin dalam jaringan. Keracunan scombroid lebih umum terjadi pada konsumsi scombroid dan ikan sejenis dari daerah tropis, dimana fasilitas refrigerasi tidak tersedia untuk pendinginan atau pembekuan yang cukup untuk ikan yang baru ditangkap (Niven et al. 1981).
Kehadiran bakteri pembentuk histamin dalam jumlah tinggi tidak selalu berhubungan langsung dengan kadar histamin yang tinggi dalam sampel. Hal ini disebabkan bahwa respon dan isolat bakteri dalam sampel bervariasi dalam kecepatan dan kemampuan memproduksi histamin. Beberapa kondisi lain yang mempengaruhi kecepatan produksi histamin dan biogenik amin lainnya meliputi ketersediaan asama amino histidin bebas (Allen 2004).