Akreditasi LIPI Nomor : 452/D/2010 Tanggal 6 Mei 2010
ANALISIS KINETIKA REAKSI PEMBENTUKAN LiFePO
4DENGAN MENGGUNAKAN METODE
KISSINGER
Indra Gunawan
Pusat Teknologi Bahan Industri Nuklir (PTBIN)-BATAN Kawasan Puspiptek Serpong 15314, Tangerang
e-mail : gindra@lycos.com
ABSTRAK
ANALISIS KINETIKA REAKSI PEMBENTUKAN LiFePO4DENGAN MENGGUNAKAN METODEKISSINGER. Telah dilakukan analisis kinetika reaksi pembentukan LiFePO4dengan menggunakan metodeKissinger. Sintesis LiFePO4dilakukan dengan mencampur LiCl, FeCl2.4H2O dan H3PO4ekuimolar dengan pelarut air. Homogenasi larutan dilakukan dengan pengaduk magnet pada suhu 60 ºC. Prekursor LiFePO4 diperoleh setelah dilakukan pemanasan pada suhu 200 ºC selama 2 jam untuk menghilangkan pelarut. Prekursor LiFePO4dianalisis denganDifferential Thermal Analysis(DTA) pada beberapa kecepatan pemanasan yaitu 5 ºC menit-1, 10 ºC menit-1, 15 ºC menit-1dan 20 ºC menit-1. Prekursor juga dipanaskan pada suhu 700 ºC selama
4 jam di dalamfurnaceuntuk dikonfirmasi kemurnian fasa dan struktur kristalnya dengan menggunakanX-Ray Diffactometer(XRD) dan pengamatan morfologinya dengan menggunakanScanning Electron Microscope(SEM). Dengan menggunakan metodeKissinger, energi aktivasi reaksi pembentukan LiFePO4telah dapat ditentukan sebesar Ea= 412 kJmol-1dan frekuensi tumbukan A =1,1705 x 103.
Kata kunci:Kinetika reaksi, MetodeKissinger,DTA, LiFePO4
ABSTRACT
REACTION KINETIC ANALYSIS OF SYNTESIZED LiFePO4USING KISSINGER METHOD. The reaction kinetic analyses of synthesized LiFePO4have been done using Kissinger method. LiFePO4was prepared by mixing equimolar amount of LiCl, FeCl2.4H2O and H3PO4in distilled water solution. Solution homogenization was achived by magnetic stirring and heating at 60 ºC. LiFePO4precursor obtained after heat treatment at 200 ºC for 2 hours. LiFePO4 precursor was then analysized by using Differential Thermal Analysis (DTA) at heating rate of 5, 10, 15 and 20 ºC min-1respectively. LiFePO
4powder was obtained after
heating at 700 ºC for 4 hours, then the X-Ray Diffactometer (XRD) analysis was done to confirm phase purity and crystalline structure, meanwhile morphology observation was done by using Scanning Electron Microscope (SEM). By using Kissinger method, activation energy of LiFePO4formation reaction was about Ea= 412 kJmol-1, and the frequeny factor A =1,1705 x 103.
Key words:Reaction kinetic, Kissinger method, DTA, LiFePO4
PENDAHULUAN
Berbagai peralatan komunikasi dan transportasi menuntut adanya sumber energi yang dapat dipindahkan. Disisi lain penggunan bahan bakar berbasis fosil sebagai penggerak alat transportasi menimbulkan berbagai dampak lingkungan akibat emisi gas buangnya. Dari sini terlihat jelas bahwa isu lingkungan terkait dengan energi tidak hanya terbatas pada sumber energi baru dan terbarukan tetapi juga dalam masalah pencegahan polusi udara. Diantara solusi terbaik dalam hal ini adalah pemanfaatan energi listrik yang disimpan dalam sebuah media seperti
fuel cell dan baterai sebagai penggerak kendaraan bermotor.
Baterai menjadi perangkat yang penting untuk menyimpan energi listrik [1]. Baterai dapat ditemukan di hampir semua kendaraan bermotor (mobil, kapal, pesawat), berbagai jenis peralatan elektronika portabel (telepon selular, komputer, radio portabel), fasilitas bangunan (sebagai catu daya cadangan), peralatan nirkabel, senter, alarm asap, alat pacu jantung, instrumen biomedis, jam tangan dan alat bantu dengar. Pada dasarnya baterai sederhana dalam konsep, akan tetapi pengembangan baterai ternyata jauh lebih lambat dibanding peralatan elektronika lain. Lambatnya kemajuan ini karena sulitnya mendapatkan bahan elektroda dan elektrolit yang sesuai, bersamaan
Indonesian Journal of Materials Science ISSN : 1411-1098
dengan itu adalah kesulitan penguasaan antarmuka antara keduanya.
Karakterisitik bahan juga menentukan jumlah energi listrik yang tersimpan dalam sistem baterai. Maka pengembangan bahan baru elektrolit dan elektroda baterai menjadi kunci pengembangan baterai sebagai penyimpanan energi dan perangkat konversi generasi baru.
Jumlah energi listrik per massa atau volume dari baterai yang bisa diberikan adalah fungsi dari tegangan sel dan kapasitas, dan tergantung pada sistem kimia di dalamnya. Kandungan energi yang tersimpan dari baterai dapat dimaksimalkan dalam tiga cara, yaitu mencari beda potensial kimia yang besar antara dua elektroda, membuat massa (volume) dari reaktan per elektron yang dipertukarkan sekecil mungkin dan memastikan bahwa elektrolit tidak terkonsumsi secara kimia di dalam baterai. Kondisi ini berlaku untuk bateraiMH(Metal Hydride) lebih baru, Ni dan baterai lithium-ion. Salah satu elemen kunci dari kedua baterai adalah bahwa ion yang sama (H+ untuk Ni-MH dan Li+ untuk baterai ion lithium)
berpartisipasi pada kedua elektroda, bergerak reversibel dari bahan elektroda, bersamaan dengan penangkapan atau pelepasan elektron. Baterai Ni-MHdigunakan untuk kendaraan listrik hibrida dan elektronika lebih murah, sedangkan baterai ion lithium digunakan pada perangkat elektronika high-end dan sekarang digunakan dalam alat-alat listrik.
Pertukaran ion Li+terjadi diantara anoda grafit
(Li
xC6) dan katoda oksida berlapis (Li1-xTMO2), dengan
TM adalah logam transisi (biasanya kobalt tetapi kadang-kadang nikel atau mangan). Energi yang besar (
≈
180Whkg-1) dengan tegangan rata-rata 3,8 V adalah5 kali lebih tinggi dari yang disimpan oleh baterai timbal-asam. Selama 20 tahun terakhir, berbagai jenis baterai telah dikembangkan, terutama yang dapat digunakan untuk menggerakkan electric vehicles
(kendaraan listrik). Sebagian besar dari perkembangan ini didorong juga oleh kebutuhan baterai untuk komputer laptop, ponsel dan alat-alat listrik tanpa kabel.
Dibandingkan dengan semua sistem lain, ion lithium adalah baterai paling serbaguna. Baterai ini dapat dirangkai dari beragam pasangan bahan elektrokimia karena ada sejumlah besar struktur yang dapat bertindak sebagai elektroda untuk lithium seperti Al, Si, Sn dan Sb, dan senyawa antar logam, seperti SnSb, Cu6Sn5 dan Cu2Sb, telah dikembangkan karena bereaksi dengan lithium, baik dengan cara penyisipan lithium atau dengan kombinasi lithium dimasukkan kedalamnya.
Logam transisi oksida, seperti LiCoO2, LiNiO2, dan spinel LiMnO2[3] telah dipelajari sebagai bahan katoda. LiFePO4 dapat digunakan sebagai bahan katoda baterai lithium ion. Kemudian Li-M-PO4 (M = Fe, Co, Mn, Ni) secara intensif dipelajari sebagai katoda baterai ion lithium. Karena biaya murah, kapasitas kepadatan teoritis tinggi (170 mAhg-1), kestabilan panas dan reversibilitas
yang sangat baik, LiFePO4telah dianggap sebagai bahan
katoda yang menjanjikan untuk baterai ion lithium [4]. Pelarut cair dan air, jauh lebih murah dibanding N-Metil-2-Pirolidone(NMP) dan ramah lingkungan.Poliacrylic Acid(PAA) juga lebih murah dibandingPolivinylidene Fluoride (PVDF) sebagai pengikat (binder) dalam preparasi katoda dan anoda [5]. Sebagian besar fokus penelitian bahan LiFePO
4pada perbaikan metode sintesis
dan peningkatan kemampuan elektrokimia [6,7]. Sejauh ini studi kinetika reaksi sintesis LiFePO
4 belum
banyak dilaporkan.
Pada penelitian ini dipelajari analisis kinetika reaksi pembentukan LiFePO
4sebagai alternatif lain bahan
katoda untuk sel baterai berbasis lithium dengan menggunakan metodekissinger.
TEORI
Ada sejumlah metode untuk mengukur energi aktivasi reaksi kimia. Metode umum yang sering digunakan adalah metode hamburan balik spektrometer Rutherford dan resonansi spin elektron. Satu metode sederhana lain adalah berdasarkan data pengukuran termogravimetri (TG/DTA) pada suatu rentang suhu (nonisotermal) yang pertama sekali dilaporkan olehKissinger.
Anggapan yang biasanya digunakan untuk menyederhanakan permasalahan adalah bahwa kecepatan reaksi (transformasi fasa) adalah perkalian dua fungsi, satu bergantung hanya pada suhu (T) dan yang lainnya bergantung hanya pada perubahan fraksi
(konversi), α mengikuti Persamaan (1):
nk dt
d
1 ... (1)
Konstanta kecepatan reaksi k adalah fungsi suhu mengikuti Persamaan Arrhenius seperti Persamaan (2) :
RT Ea A k exp ... (2)
Dengan persamaan kecepatan pemanasan seoerti Persamaan (3) :
dt dT
... (3) Maka ketiga Persamaan (1), Persamaan (2) dan Persamaan (3) di atas dapat disubstitusikan dan diperoleh Persamaan (4) :
max 1 max 2 max exp 1 RT E An RT Ea n a ... (4)Dengan menganggap reaksi tingkat satu maka
n = 1, sehingga Persamaan (4) dapat ditulis menjadi Persamaan (5) : max 2 max exp RT E A RT Ea a ... (5)
Untuk reaksi tingkat lain dengan n
≠
0 dan n≠
1, karena harga
E RT n 1 2 max << 1, maka diperoleh Persamaan (6) :
1
1 1
1
2 max 1 max a n E RT n n ... (6) Jika Persamaan (6) disubstitusikan ke Persamaan (4) maka diperoleh hasil yang sama seperti ditulis dengan Persamaan (5). Jika Persamaan (5) diambil logaritmanya maka diperoleh Persamaan (7) :max 2 max ln ln RT E E AR T a a ... (7) Dimana :
β =Kecepatanscanalat DTA (°C menit-1), E
a = Energy aktivasi reaksi (kJ mol -1),
R = Konstanta gas umum (8,314 kJ mol-1K-1).
Grafik antara ln(β/Tmax2) terhadap T max
-1adalah
linier dengan kemiringan (-Ea/R), sehingga energi aktivasi reaksi Eadapat dihitung. Faktor frekuensi tumbukan A dihitung dengan menggunakan Persamaan (7).
METODE PERCOBAAN
Bahan
Bahan-bahan kimia yang digunakan: lithium klorida LiCl (Merck), ferroklorida tetrahidrat FeCl
2.4H2O
(Merck) dan asam fosfat H
3PO4(Merck) dari pelarut air.
Alat
Alat-alat karakterisasi yang digunakan meliputi :
Simultaneous Thermal Analysis (STA) (Setaram TAG 24 S). Kemurnian fasa dan struktur Kristal ditentukan dengan X-Ray Diffractometry (XRD) Shimadzu XD 610. Morfologi diamati denganScanning Electron Microscope (SEM) JEOL JSM 6510 LA.
Furnace (Fischer) untuk sintering prekursor. Semua peralatan ada di PTBIN BATAN Serpong.
Cara Kerja
Bahan-bahan LiCl, FeCl
2 dan H3PO4dengan
perbandingan stoikiometris dicampur dan dilarutkan dengan air. Pemanasan dilakukan pada 60 °C dengan plat pemanas dan pengaduk magnet agar homogen. Penguapan pelarut sekaligus presinter dilakukan pada suhu 200 °C selama 2 jam diperoleh prekursor. Prekursor LiFePO
4dianalisis dengan DTA/TGA pada beberapa
kecepatan pemanasan yaitu 5 °C/menit, 10 °C/menit, 15 °C/menit dan 20 °C/menit. Prekursor juga dipanaskan pada suhu 700 °C selama 4 jam didalam furnace
dengan mengalirkan gas N
2untuk membentuk fasa
kristalitnya, kemudian dikonfirmasi kemurnian fasa dan strukturnya dengan menggunakan XRD, sedangkan pengamatan morfologi permukaan dilakukan dengan menggunakanSEM.
HASIL DAN PEMBAHASAN
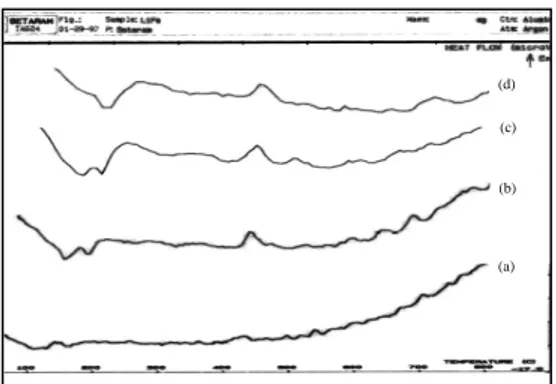
Gambar 1 menunjukkan kurva Thermogravimetri dan Differential Thermal Analyses (TG–DTA) dari prekursor LiFePO4 pada kecepatan pemanasan 10 K/menit. Sedangkan Gambar 2 memperlihatkan kurva
DTAdari prekursor LiFePO4pada kecepatan pemanasan berturut-turut 5 K/menit, 10 K/menit, 15 K/menit dan 20 K/menit.
Dari kurva TG-DTAdapat dilihat terdapatnya dua puncak yaitu puncak endotermis ditandai dengan kurva minimum dan puncak eksotermis ditandai dengan kurva maksimum pada grafikDTA. Puncak endotermis muncul dalam rentang suhu 80 °C hingga 230 °C disertai dengan penurunan massa secara curam seperti terlihat dengan kurva TG. Penurunan massa cenderung lebih lambat seiring kenaikan suhu. Suhu pada saat puncak endotermis terjadi disebabkan oleh dekomposisi air kristal yang terdapat di bahan awal. Puncak eksotermis muncul dalam kisaran suhu 400 °C hingga 500 °C. Munculnya puncak eksotermis ini disebabkan oleh proses perubahan prekursor LiFePO4yang amorf menuju fasa kristalin. Setelah kristal inti terbentuk, seiring dengan kenaikan
Gambar 1.KurvaTG-DTAdari prekursor LiFePO4pada
kecepatan pemanasan 10 K/menit.
(d) (c)
(b)
(a)
Gambar 2. Kurva DTA dari prekursor LiFePO4 pada kecepatan pemanasan: (a). 5 K/menit, (b). 10 K/menit, (c). 15 K/menit dan (d). 20 K/menit.
Indonesian Journal of Materials Science ISSN : 1411-1098
suhu, inti kristal membesar, dan kemudian sejumlah besar kristal LiFePO4 terbentuk dengan disertai pelepasan panas.
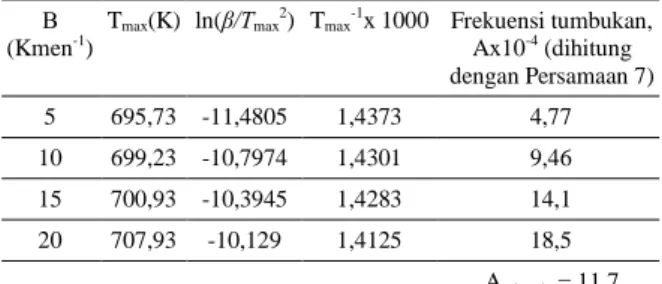
Dari berbagai kecepatan pemanasan diperoleh beberapa kurvaDTAseperti terlihat di Gambar 2, sehingga dapat ditentukan suhu puncak Tmaxonset yang merupakan titik puncak eksotermis. Kemudian dibuat grafik hubungan antara ln(β/Tmax2) terhadapT
max -1untuk
menentukan energi aktivasi reaksi pembentukan LiFePO4 dengan menggunakan metodeKissinger. Gambar 3 dan Tabel 1 menunjukkan hubungan dimaksud.
Gambar 3 memberikan kemiringan -Ea/R = -49,638 sehingga energi aktivasi Ea= 412,7 kJmol-1. Dari dinamika
reaksi kimia, karena energi aktivasi transformasi fasa kristal lebih besar dari 400 kJmol-1, pembentukan kristal
LiFePO4dari prekursornya terjadi lambat. Pertumbuhan kristal yang lambat menentukan tekstur permukaan dan biasanya distribusi kristal LiFePO4lebih seragam. Frekuensi tumbukan A diperoleh dengan menggunakan Persamaan (7) diperoleh hasil A = 1,1705x103, sehingga
persamaan kecepatan reaksi pembentukan LiFePO4dapat ditentukan dengan menggunakan Persamaan (1) dan Persamaan (2), yaitu :
1,1705 10 exp 4,127 10 1 5 3 RT x x dt d ... (8)Gambar 4 menunjukkan pola XRD LiFePO4 setelah disinter dari prekursornya pada suhu sintesis 700 °C selama 4 jam, menunjukkan terbentuknya kristal LiFePO4, yang ditandai oleh munculnya puncak difraksi
cukup sempit, simetris pada sudut-sudut 17 °; 20,73 °; 23,14 °; 24,33 °; 26,5 °; 27,45 °; 28,8 °; 29,32 °; 32,11 °, 35,6 °; 36,5 °;38 °; 42 °; 44 °; 54 ° dan 56,93 ° yang sesuai dengan data difraksi LiFePO4dariJCPDS PDF 40-1499
sebagai referensi yaitu puncak difraksi terjadi pada sudut-sudut 17,12 °; 20,75 °; 22,65 °; 24 °; 25,252 °; 29,676 °; 32,16 °; 34,44 °; 35,5 °; 36,5 °; 38,71 °; 42,15 °; 44,88 °; 54,87 ° dan 56,53 ° bersesuaian dengan refleksi bidang (020), (011), (120), (101), (111/021), (121/200), (031), (220), (131), (211), (041), (112), (122), (142) dan (331).
Gambar 5 memperlihatkan foto SEM serbuk LiFePO4setelahsintering pada suhu 700 °C selama 4 jam. Terlihat partikel berbentuk polihedral, berpori dan sedikit teraglomerasi. Dari pengamatan SEM, partikel berbentuk polihedral diperkirakan berukuran antara 1 µm hingga 5 µm. Berdasarkan pengamatan ini, pemanasan pada suhu 700 °C selama 4 jam sudah mencukupi untuk membentuk struktur kristal LiFePO4.
KESIMPULAN
Dari percobaan yang telah dilakukan, diperoleh beberapa kesimpulan sebagai berikut :
1. Dengan menggunakan metode Kissinger, energi aktivasi reaksi pembentukan LiFePO4 telah dapat ditentukan sebesar Ea = 412 kJmol-1,
frekuensi tumbukan A=1,1705x103 dan
persamaan kecepatan reaksi pembentukan LiFePO4
adalah = 1,170510 exp 4,127 10
1
. 5 3 RT x x dt d Β (Kmen-1)Tmax(K) ln(β/Tmax2) Tmax-1x 1000 Frekuensi tumbukan,
Ax10-4(dihitung dengan Persamaan 7) 5 695,73 -11,4805 1,4373 4,77 10 699,23 -10,7974 1,4301 9,46 15 700,93 -10,3945 1,4283 14,1 20 707,93 -10,129 1,4125 18,5 Arata-rata= 11,7
Tabel 1.Hubungan antara ln(/Tmax
2) terhadap T max
-1dari puncak
DTApada beberapa kecepatan pemanasan ().
Gambar 4. Pola XRD LiFePO4setelah disinter dari
prekursornya pada suhu sintesis 700 °C selama 4 jam.
Gambar 5. FotoSEMserbuk LiFePO4setelahsintering
pada suhu 700 °C selama 4 jam. -12.5 -12 -11.5 -11 -10.5 -10 -9.5 -9 1.400 1.406 1.413 1.419 1.425 1.431 1.438 1.444 1/TmaxX 1000 (K-1) ln (b /T m a x 2)
Gambar 3.Grafik linierisasi antara ln(/Tmax2) terhadap
Tmax
-1 dari puncak DTA pada beberapa kecepatan
2. PolaXRDLiFePO
4setelah disinterdari prekursornya
pada suhu sintesis 700 °C selama 4 jam, menunjukkan terbentuknya kristal LiFePO
4. Terbentuknya kristal
LiFePO
4ditandai oleh munculnya puncak difraksi
cukup sempit, simetris pada sudut-sudut 17 °; 20,73 °; 23,14 °; 24,33 °; 26,5 °; 27,45 °; 28,8 °; 29,32 °; 32,11 °, 35,6 °; 36,5 °; 38 °; 42 °; 44 °; 54 °; 56,93 ° yang sesuai dengan data difraksi LiFePO
4sesuaiJCPDS PDF 40-1499.
3. Dari pengamatanSEM, partikel LiFePO
4berbentuk
polihedral, berpori dan sedikit teraglomerasi, partikel polihedral diperkirakan berukuran antara 1 µm hingga 5 µm.
DAFTAR ACUAN
[1]. ARMAND M., TARASCON J. M.,Nature,451 (7)
(2008) 652-658
[2]. D. LINDEN, T. B. REDDY, (Eds),Handbook of
Batteries, 3rdEd, McGraw-Hill,New York, (2002)
[3]. ZHU S., ZHOU H., MIYOSHI T., HIBINO M., HONMA I., ICHIHARA M.,Adv. Mater.,16(2004) 2012
[4]. SURESH P., SHUKLAA.K.,MUNICHANDRAIAH N.,J. Power Sources,161(2006)1307-1313 [5]. PARK K.S.,KANG K.T.,LEE S.B.,Mater. Res. Bull.,
39(2004) 1803-1810
[6]. PROSINI P.P.,CAREWSKA M.,SCACCIA S.,
Electrochim. Acta,48(2003) 4205-4211
[7]. FRANGER S., LECRAS F., BOURBON C.,J. Power Sources,119-121(2003) 252-257
[8]. PANJAITAN E., KARTINI E., WAGIYO, NUGRAHA T.,IHSAN M., Development of Thin Film Electrode LiCoO
2 by DC-Sputtering, International Conference on Materials Science and Technology, Serpong, (2010)