6 BAB II
TINJAUAN PUSTAKA 2.1. Tinjauan Antibiotik
2.1.1 Definisi Antibiotik
Antibiotik adalah suatu obat yang biasa digunakan untuk menghilangkan suatu infeksi dari penyakit dengan aman, namun dapat juga menimbulkan bahaya (Pottinger et al, 2014). Menurut (Utami, 2011) antibiotik merupakan suatu senyawa kimia yang diproduksi mikroorganisme, khususnya adalah fungi atau diproduksi secara sintetik yang dapat menghambat hingga dapat membunuh bakteri atau mikroorganisme lain, sedangkan antimikroba merupakan suatu substansi yang digunakan untuk mengobati atau mengatasi suatu infeksi bakteri pada manusia.
2.1.2 Macam-Macam Terapi Penggunaan Antibiotik 2.1.2.1 Antibiotik Profilaksis
Penggunaan antibiotik sebelum, selama, dan hingga 24 jam pasca operasi pada kasus yang secara klinis tidak memperlihatkan tanda-tanda infeksi dengan tujuan untuk mencegah terjadinya Infeksi Daerah Operasi (IDO) (SPO RSUD Dr. Iskak, 2019). Prinsip penggunaan antibiotik profilaksis selain tepat dalam pemilihan jenis juga mempertimbangkan konsentrasi antibiotik dalam jaringan saat mulai dan selama operasi berlangsung (Kemenkes RI, 2011). Pemberian 30-60 menit sebelum insisi, sekali pemberian atau dosis tunggal dalam waktu 15-30 menit secara drip intravena dan pemberian di kamar operasi. Pemberian antibiotik profilaksis diulang bila terjadi perdarahan lebih dari 1500 ml atau lebih dari 30% Estimated blood
volume atau EBV (pada pasien anak > 15% EBV) atau lama operasi lebih dari
3 jam, lama pemberian maksimal 24 jam sejak pemberian antibiotik profilaksis pertama (SPO RSUD Dr. Iskak, 2019). Penggunaan antibiotik profilaksis terbatas hanya pada pasien dengan pasien yang memiliki risiko tinggi terkena infeksi, pada pasien yang menerima terapi immunosupresan, pasien kanker, dan pasien yang akan menjalani prosedur pembedahan.Pertahanan tubuh alami pasien tersebut sangat lemah sehingga rentan terhadap infeksi. Karena kemungkinan itu dapat terjadi infeksi oleh
beberapa jenis organisme dan jika sampai terjadi infeksi pada pasien akan membawa pasien pada kondisi yang buruk maka diberikanlah antibiotik profilaksis (Gallagher & MacDougall, 2018).
2.1.2.2 Antibiotik Empiris
Terapi antibiotik empiris merupakan penggunaan antibiotik pada kasus infeksi bakterial atau diduga infeksi bakterial yang belum diketahui jenis bakteri penyebab dan pola kepekaannya (SPO RSUD Dr. Iskak, 2019). Dasar pemilihan jenis dan dosis antibiotik empiris didasarkan pada data epidemiologi, pola resistensi, kondisi pasien, ketersediaan, dan spektrum antibiotik (Kemenkes RI, 2011). Waktu dimulainya pemberian antibiotik empiris berdasarkan dari situasi kedaduratan pada pasien. Pada kondisi kritis atau darurat seperti pada pasien septic syok, pasien neutropenia febril, dan pasien dengan meningitis bakteri, terapi empiris harus segera dimulai setelah atau bersamaan dengan koleksi diagnostik spesimen atau kultur kuman (Leekha et al., 2011). Pada umumunya terapi empiris diberikan sebelum dokter dapat mengidentifikasi organisme penyebab dan pola kepekaannya. Terapi empiris merupakan agen paling aktif terhadap kemungkinan penyebab infeksi (Gallagher & MacDougall, 2018). Pemberian antibiotik empiris harus mempertimbangkan beberapa hal, yaitu lokasi infeksi dan jenis mikroba yang paling banyak menginfeksi lokasi tersebut, pola resistensi bakteri pada fasilitas kesehatan tersebut dan pengetahuan tentang bakteri yang sebelumnya pernah menginfeksi pasien (Leekha et al., 2011).
2.1.2.3 Antibiotik Definitif
Penggunaan antibiotik definitif merupakan penggunaan antibiotik pada kasus infeksi yang telah diketahui jenis bakteri penyebab dan pola kepekaannya (SPO RSUD Dr. Iskak, 2019). Bertujuan untuk eradikasi dan menghambat pertumbuhan bakteri berdasarkan hasil pemeriksaan mikrobiologi. Setelah pemeriksaan kultur dan uji sensitivitas dilakukan, terapi antibiotik definitif dapat diberikan, dengan mengetahui bakteri penyebab infeksi maka pemilihan terapi antibiotik dapat lebih tepat dan efektif. Dasar pemilihan jenis dan dosis antibiotik definitif yaitu berdasarkan efikasi, sensitivitas, kondisi pasien, biaya, dan minim risiko resistensi.
Penggunaan antibiotik definitif yaitu diutamakan menggunakan antibiotik lini pertama dan berspektrum sempit (Kemenkes RI, 2011). Hal ini dapat meminimalisir toksisitas, kegagalan terapi, kemungkinan berkembangnya resistensi, dan juga membantu pengelolaan biaya yang minimal (Gallagher & MacDougall, 2018).
2.1.3 Klasifikasi Antibiotik
Menurut Kementrian Kesehatan RI tahun 2011, antibiotik dapat diklasifikasikan berdasarkan mekanisme kerjanya, berikut klasifikasinya: 1. Merusak atau menghambat dinding sel bakteri. Golongan antibiotik yang
bekerja dengan mekanisme tersebut adalah golongan beta-laktam seperti inhibitor beta-laktamase, karbapenem, monobaktam, penisilin dan sefalosporin, dan beberapa juga terdapat dari kelas lain seperti basitrasin dan vankomisin
2. Memodifikasi atau menghambat sintesis protein antara lain, aminoglikosida, golongan makrolida (azitromisin, eritromisin, klaritromisin), klindamisin, kloramfenikol, mupisorin, spektinomisin, dan tetrasiklin.
3. Bekerja dengan menginhibisi enzim-enzim esensial pada metabolisme asam folat seperti sulfonamid dan trimetoprim.
4. Mempengaruhi pada metabolisme atau sintesis asam nukleat seperti kuinolon, nitrofurantoin (Kemenkes, 2011).
2.1.3.1 Obat yang merusak atau menghambat dinding sel bakteri 2.1.3.1.1 Antibiotik golongan beta-laktam
Antibiotik beta-laktam adalah kelompok obat yang dari berbagai golongan yang memiliki struktur cincin laktam seperti inhibitor beta-laktamase, monobaktam, penisilin, sefalosporin. Antibiotik golongan ini umumnya bersifat bakterisid. Sebagian besar golongan ini efektif terhadap organisme Gram positif dan negatif (Kemenkes, 2011). Semua golongan beta-laktam dapat menyebabkan reaksi hipersensitivitas, seperti demam ringan, intersitial nefritis akut hingga anafilaksis. Terdapat juga beberapa sensitivitas silang antar kelas, namun tidak ada cara yang tepat untuk
memprediksi seberapa sering hal tersebut dapat terjadi (Gallagher & MacDougall, 2018).
2.1.3.1.2 Penisilin
Penisilin merupakan antibiotik yang pertama kali ditemukan oleh Alexander Fleming dari jamur dengan genus Penicillium (Goodman & Gilman, 2012). Golongan penisilin mempunyai persamaan sifat kimiawi, mekanisme kerja, farmakologi, dan karakterisktik imunologis dengan sefalosforin, monobaktam, karbapenem, dan penghambat beta-laktamase. Semua obat tersebut merupakan senyawa beta laktam yang dinamakan demikian karena mempunyai cincin beta-laktam beranggota empat yang unik (Katzung, 2012). Hidrolisis cincin beta-laktam oleh bakteri ß-lactamases akan menghasilkan asam penilloid yang mana asam penilloit tidak memiliki aktivitas antibakteri (Katzung, 2018). Penisilin memiliki waktu paruh yang relatif singkat ( kurang dari 2 jam) sehingga harus diberikan beberapa kali. Sebagian besar waktu paruh penisilin yang berkepanjangan dapat menyebabkan disfungsi ginjal (Gallagher & MacDougall, 2018).
Polisakarida tersebut mengandung gula amino, N-asetilglukosamin, dan asam N-asetilmuramik yang mengikat 5 peptida dari asam amino, dimana rangkaian peptida ini akan berakhir di D-alanyl dan D-alanin. Penicillin
binding protein (PBP) akan menghilangkan terminal D-alanin sehingga akan
terbentuk sambung silang (cross linking) dengan peptida terdekat. Reaksi sambung silang ini akan menyebabkan kekakuan struktural pada dinding sel bakteri. Antibiotik beta laktam merupakan analog struktural alami substrat D-Alanyl dan D-Alanin yang secara kovalen mengikat ke situs aktif PBP yang mengakibatkan penghambatan reaksi transpeptidase dan menghentikan sintesis peptidoglikan yang merupakan salah satu komponen sel bakteri, sehingga sel mengalami kematian (Deck, Daniel H. 2015).
Derivat penisilin yang sering dipakai secara luas sebagai terapi pengobatan infeksi bakteri yaitu benzilpenisilin, penisilin G prokain, penisilin G benzatin, penisilin V, fenetisilin, metisilin, nafsilin, tikarsilin, sulbenisilin, karbenisilin, amoksisilin, ampisilin, flukloksasilin, dikloksasilin, kloksasilin dan oksasilin (Siswandono, 2016). Golongan penisilin diklasifikasikan
berdasarkan spektrum aktivitas antibiotiknya, antara lain penisilin G dan penisilin V, penisilin yang resisten terhadap beta-laktamase, aminopenislin, karboksipenislin, ureidopenisilin. Pengklasifikasiannya seperti berikut: Tabel II. 1 Antibiotik Golongan Penisilin
Golongan Contoh Aktivitas
Penisilin G dan Penisilin V
Penisilin G dan Penisilin V
Sangat aktif terhadap kokus Gram positif, tetapi cepat dihidrolisis oleh penisilinase atau beta-laktamase. Tidak efektif terhadap S.aureus Aminopenisilin Ampisilin,
Amoksisilin
Selain memiliki aktivitas terhadap bakteri Gram-positif, juga memiliki aktivitas pada mikroorganisme Gram negatif, seperti Haemophilus influenzae, Escherichia coli, dan Proteus mirabilis. Obat-obat ini sering diberikan bersama inhibitor betalaktamase (asam klavulanat, sulbaktam, tazobaktam) untuk mencegah hidrolisis oleh betalaktamase yang semakin banyak ditemukan pada bakteri Gram negatif ini.
Ureidopenisilin mezlosilin, azlosilin,dan piperasilin
Aktivitas antibiotik terhadap Pseudomonas, Klebsiella, dan Gramnegatif lainnya. Golongan ini dirusak oleh beta-laktamase.
Lanjutan tabel II.1 Antibiotik golongan Penisilin
Golongan Contoh Aktivitas
Karboksipenisilin karbenisilin, tikarsilin
Antibiotik yang digunakan untuk bakteri Pseudomonas, Enterobacter, dan Proteus. Aktivitas antibiotik lebih rendah dibanding ampisilin terhadap kokus Gram-positif, dan kurang aktif dibanding piperasilin dalam melawan Pseudomonas. Golongan ini dirusak oleh beta-laktamase. Sumber: Kemenkes RI, 2011; Katzung et al, 2013; Siswandono, 2016
Penisilin V merupakan bentuk oral dari penisilin G. Spektrumnya baik untuk bakteri Treponema pallidum, streptococci termasuk Streptococcus
pneumoniae, dan berspektrum sedang pada bakteri enterococci. Benzathine
dan prokain merupakan penisilin yang dapat diberikan secara intramuskular karena dapat memberikan efek depot. Natural penisilin umumnya digunakan untuk indikasi sifilis, terutama neurosifilis. Selain itu penisilin juga digunakan pada pasien yang rentan terhadap infeksi streptococcus seperti faringitis atau endokarditis (Gallagher & MacDougall, 2018).
Penisilin G (Benzil Penisilin) merupakan klasifikasi dari antibiotik golongan penisilin yang diindikasikan pada pasien dengan penyakit pneumonia, infeksi tenggorokan, otitis media, penyakit Lyme, endokarditis streptokokus, infeksi meningokokus, enterokolitis nekrotika, fasciitis nekrotika, leptospirosis, antraks, aktinomikosis, abses otak, gas gangren, selulitis, osteomielitis. Sedangkan obat antibiotik ini dikontraindikasikan kepada pasien hipersensitif. Dosis pemakaian penisilin pada infeksi ringan sampai sedang pada organisme yang sensitif adalah dengan cara injeksi secara intramuskular (i.m.) atau dengan intravena (IV) lambat atau infus Intravena (Gallagher & MacDougall, 2018).
2.1.3.1.3 Sefalosporin
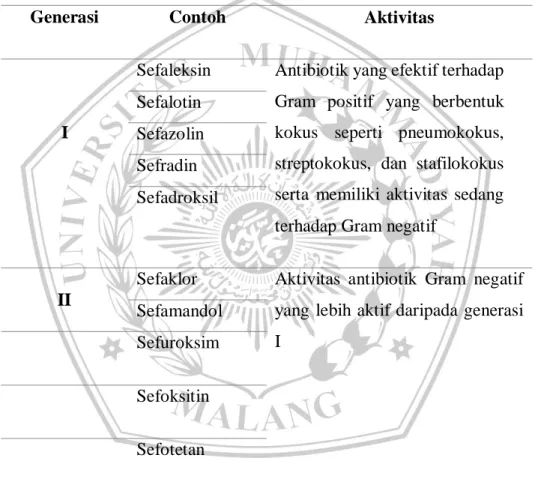
Aktivitas antibiotik golongan sefalosporin serupa dengan penisilin, tetapi sefaloporin memiliki keunggulan lebih tahan dan lebih stabil terhadap enzim beta laktamase daripada golongan penisilin. Oleh karena itu, sefalosporin mempunyai spektrum yang lebih luas. Sefalosporin dibagi menjadi 4 generasi berdasarkan perbedaan luas spektrum (Deck, Daniel H. 2015).Penggolongan sefalosporin dibagi menjadi 4 generasi yaitu generasi I, generasi II, generasi III, dan generasi IV. Penggolongan tersebut seperti tabel berikut ini:
Tabel II. 2 Klasifikasi dan aktivitas Sefalosporin
Generasi Contoh Aktivitas
I
Sefaleksin Antibiotik yang efektif terhadap Gram positif yang berbentuk kokus seperti pneumokokus, streptokokus, dan stafilokokus serta memiliki aktivitas sedang terhadap Gram negatif
Sefalotin Sefazolin Sefradin Sefadroksil
II
Sefaklor Aktivitas antibiotik Gram negatif yang lebih aktif daripada generasi I Sefamandol Sefuroksim Sefoksitin Sefotetan Sefmetazol
Lanjutan tabel II.2 Klasifikasi dan aktivitas Sefalosporin
Generasi Contoh Aktivitas
III
Moksolaktam Aktivitas kurang aktif terhadap kokus Gram positif dibandingkan generasi I, tapi lebih aktif terhadap
Enterobacteriaceae,
termasuk strain yang
memproduksi beta
laktamase. Seftazidim dan sefoperazon juga aktif terhadap P. Aeruginosa, tapi kurang aktif dibandingkan generasi III lainnya terhadap kokus Gram positif
Sefotaksim Seftriakson Sefiksim Sefoperazon Sefrizoksim Sefpodoksim Seftazidim IV
Sefepim Aktivitas lebih luas
dibandingkan dan lebih stabil dari generasi sebelumnya dan tahan terhadap beta-laktamase Sefpirom
Sumber: Kemenkes RI, 2011; Katzung et al, 2013; Siswandono, 2016 Sefalosporin generasi pertama memiliki aktivitas yang baik pada bakteri cocci gram positif, seperti Streptococcus, dan Staphylococcus, tetapi memiliki aktivitas yang kurang baik pada bakteri gram negatif (Deck, Daniel H. 2015). Sefaleksin, sefadrin, dan sefadroksil diberikan secara per oral karena absorbsi per oral yang baik dan lebih dianjurkan diberikan bersama makanan karena dapat mengurangi efek samping obat pada saluran pencernaan. Sedangkan sefazolin diberikan secara intravena. Semua obat sefalosporin generasi 1 dieliminasi sebagian besar melalui urin (70% - 100%) sehingga perlu dikontrol dan disesuaikan apabila terdapat gangguan fungsi
ginjal (Petri, William A. 2006). Sefalosporin generasi pertama banyak digunakan sebagai antibiotik profilaksis saat prosedur pembedahan karena spektrumnya luas, harganya terjangkau, dan insiden efek samping obat rendah (Gallagher & MacDougall, 2018).
Sefalosporin generasi kedua mempunyai aktivitas yang lebih baik pada bakteri gram negatif tetapi lebih rendah pada bakteri gram positif dan lebih tahan terhadap enzim betalaktamase (Katzung, 2013). Cefmetazole dan sefotetan memiliki aktivitas melawan bakteri anaerob. Umumnya obat-obat sefalosporin generasi kedua diberikan secara intravena, tetapi beberapa obat seperti Sefaklor, sefuroksim axetil, dan sefprozil dapat diberikan secara oral. Pemberian secara intramuskular menyakitkan sehingga harus dihindari. Penyesuaian dosis dibutuhkan ketika terjadi gangguan fungsi ginjal karena hampir semua obat dieliminasi melalui ginjal (Siswandono, 2016). Sefalosporin generasi kedua banyak digunakan untuk mengatasi infeksi saluran pernafasan bagian bawah, sinusitis, otitis, pneumonia, infeksi anaerobik campuran seperti peritonitis, diverticulitis, dan penyakit radang panggul (Deck, Daniel H. 2015).
Sefalosporin generasi ketiga mempunyai spektrum yang lebih luas pada bakteri gram negatif dari sefalosporin generasi sebelumnya, tetapi memiliki aktivitas yang kurang baik pada bakteri gram positif. Selain itu, generasi ini bisa menembus sawar darah otak dan memiliki ketahanan terhadap enzim betalaktamase. Ceftazidime dan cefoperazone adalah golongan sefalosporin yang memiliki aktivitas melawan bakteri Pseudomonas aeruginosa. Sefalosporin generasi ketiga dapat menembus cairan tubuh dan jaringan dengan baik, sehingga hampir semuanya diberikan secara intravena dengan pengecualian sefoperazon. Hampir semua obat dieliminasi melalui urin kecuali sefoperazon dan seftriakson yang diekskresi melalui empedu sehingga untuk kedua obat ini tidak perlu penyesuaian dosis pada pasien gangguan ginjal. Digunakan untuk indikasi berbagai macam infeksi serius yang disebabkan oleh organisme yang resisten dan meningitis (Deck, Daniel H. 2015).
Sefalosporin generasi keempat mempunyai spektrum yang lebih luas dari generasi ketiga. Selain itu ketahanan terhadap betalaktamase juga lebih baik. Sefepim memiliki aktivitas yang baik melawan P. aeruginosa,
Enterobacteriaceae, S. aureus, dan S. Pneumoniae (Deck, Daniel H. 2015).
Menembus dengan baik ke dalam cairan cerebrospinal, diberikan secara intravena dan mengalami eliminasi dalam bentuk aktif di ginjal (80%-90%). Penyesuaian dosis dilakukan ketika terdapat gangguan ginjal. Penggunaan di klinis umumnya untuk terapi empiris pada infeksi di rumah sakit yang disebabkan oleh bakteri gram positif (Petri, William A. 2006).
2.1.3.1.4 Karbapenem
Karbapenem merupakan antibiotik lini ketiga yang mempunyai aktivitas antibiotik yang lebih luas dibanding sebagian besar beta-laktam lainnya. Spektrum dengan aktivitas menghambat sebagian besar Gram-positif, Gram negatif, dan anaerob (Kemenkes RI, 2011). Efek samping yang paling sering adalah mual dan muntah, dan kejang pada dosis tinggi yang diberi pada pasien dengan lesi (Sistem Saraf Pusat) SSP atau dengan insufisiensi ginjal. Meropenem dan doripenem mempunyai efikasi serupa imipenem, tetapi lebih jarang menyebabkan kejang (Kemenkes RI, 2011).
Obat yang termasuk karbapenem adalah meropenem. Antibiotik ini diindikasikan pada pasien dengan infeksi berat oleh kuman gram negatif yang resisten terhadap antibiotik turunan penisilin dan sefalosporin generasi ketiga serta resisten terhadap bakteri yang memproduksi extended spectrum beta
lactamase (ESBL). Antibiotik ini dikontraindikasikan pada pasien dengan
gangguan fungsi ginjal dan riwayat kejang (Tjay & Rahardja, 2010). 2.1.3.1.5 Inhibitor beta-laktamase
Inhibitor beta-laktamase melindungi antibiotik beta-laktam dengan cara menginaktivasi beta-laktamase. Golongan antibiotik ini adalah asam klavulanat, sulbaktam, dan tazobaktam. Asam klavulanat merupakan suicide
inhibitor yang mengikat beta-laktamase dari bakteri positif dan
Gram-negatif secara ireversibel. Obat ini dikombinasi dengan amoksisilin untuk pemberian oral dan dengan tikarsilin untuk pemberian parenteral. Sulbaktam dikombinasi dengan ampisilin untuk penggunaan parenteral, dan kombinasi
ini aktif terhadap kokus Grampositif, termasuk S. aureus penghasil beta-laktamase, aerob Gram-negatif (tapi tidak terhadap Pseudomonas) dan bakteri anaerob. Sulbaktam kurang poten dibanding klavulanat sebagai inhibitor beta-laktamase. Tazobaktam dikombinasi dengan piperasilin untuk penggunaan parenteral. Waktu paruhnya memanjang dengan kombinasi dan ekskresinya melalui ginjal (Kemenkes, 2011).
2.1.3.1.6 Golongan Antibiotik Kelas Lain 2.1.3.1.6.1 Basitrasin
Basitrasin adalah kelompok yang terdiri dari antibiotik polipeptida, yang utama adalah basitrasin A. Berbagai kokus dan basil Gram-positif, Neisseria,
H. influenzae, dan Treponema pallidum sensitif terhadap obat ini. Basitrasin
tersedia dalam bentuk salep mata dan kulit, serta bedak untuk topikal. Basitrasin jarang menyebabkan hipersensitivitas. Pada beberapa sediaan, sering dikombinasi dengan neomisin dan/atau polimiksin. Basitrasin bersifat nefrotoksik bila memasuki sirkulasi sistemik (Kemenkes, 2011; Katzung, 2013).
2.1.3.1.6.2 Vankomisin
Vankomisin merupakan contoh antibiotik golongan glikopeptida. Vankomisin memiliki mekanisme kerja dengan menghambat sintesis dinding sel bakteri. Sifat dari antibiotik ini adalah bakteriosida terutama pada bakteri gram positif. Absorbsi vankomisin buruk pada saluran pencernaan, sehingga diberikan secara intravena. (Deck, Daniel H. 2015). Vankomisin peroral hanya diberikan untuk terapi enterokolitis akibat C.difficile yang disebabkan oleh penggunaan antibiotik yang berlebihan (Katzung, 2012).
2.1.3.2 Antibiotik yang memodifikasi atau menghambat sintesis protein Obat antibiotik yang termasuk golongan ini adalah aminoglikosid, tetrasiklin, kloramfenikol, makrolida (eritromisin, azitromisin, klaritromisin), klindamisin, mupirosin, dan spektinomisin (Kemenkes, 2011).
2.1.3.2.1 Golongan aminoglikosida
Aminoglikosid diproduksi oleh jenis-jenis fungi Micromanospora dan
Streptomyces semua senyawa dan turunan semi-sintesisnya mengandung dua
glukosidis. Dengan adanya gugusan-amino, zat-zat ini bersifat basa lemah dan garam sulfatnya yang digunakan dalam terapi mudah larut dalam air (Tjay & Rahardja, 2010). Golongan ini umumnya bersifat bakterisidal (Goodman & Gilman, 2012).
Gentamisin merupakan golongan aminoglikosid yang bersifat bakterisidal aktif terutama pada gram negatif termasuk Pseudomonas aerogenosa,
Proteus serratia. Antibiotik ini diindikasikan pada pasien dengan pneumonia,
kolesistisis, peritonitis, septikemia, pyelo nefritis, infeksi kulit, inflamasi pada tulang panggul, endokarditis, meningitis, listeriosis, brucellosis, pes, pencegahan infeksi setelah pembedahan (Katzung, 2012).
2.1.3.2.2 Tetrasiklin
Tetrasiklin merupakan antibiotik bakteriostatik berspektrum luas yang mekanisme kerjanya menghambat sintesis protein bakteri. Tetrasiklin masuk ke mikroorganisme dengan difusi pasif dan sebagian dengan transpor aktif. Tetrasikilin bekerja dengan cara mengikat subunit ribosom 30S serta memblokir pengikatan aminoasil-tRNA ke situs akseptor pada kompleks mRNA-ribosom dan mencegah penambahan asam amino ke peptida yang tumbuh. Tetrasiklin digunakan dalam pengobatan atau profilaksis infeksi protozoa, pneumonia, jerawat, eksaserbasi bronkitis, penyakit Lyme, leptospirosis, infeksi saluran kemih dan beberapa infeksi mycobacterial
nontuberculous (Deck, Daniel H. 2015).
Doksisiklin merupakan antibiotik golongan tetrasiklin dan mempunyai spektrum luas. Efektif pada kondisi yang disebabkan oleh klamidia sp,
riketsia sp, brucella sp dan spirochaete, Borrelia burgdorfer (Lyme disease).
Merupakan golongan tetrasiklin yang paling disukai karena mempunyai profil farmakokinetik yang lebih baik dibandingkan dengan tetrasiklin. Tidak diberikan pada anak usia dibawah 12 tahun atau pada wanita hamil. Antibiotik ini diindikasikan pada pasien dengan infeksi saluran napas, termasuk pneumonia dan bronkitis kronik, infeksi saluran urin, sifilis,klamidia, mikoplasma, dan riketsia, prostatitis, limfogranuloma venereum, penyakit radang pelvik dengan metronidazol, penyakit Lyme, brucellosis dengan
rifampisin, leptospirosis, kolera, melioidosis, pes, antraks (Gallagher & MacDougall, 2014).
2.1.3.2.3 Kloramfenikol
Kloramfenikol merupakan antibiotik penghambat kuat protein mikroba dengan mengikat sub unit ribosom 50S dari bakteri secara reversibel dan menghambat pembentukan ikatan peptida. Kloramfenikol adalah antibiotik bakteriostatik berspektrum luas yang aktif melawan bakteri baik aerobik dan anaerobik maupun gram positif dan gram negatif. Kloramfenikol diberikan secara per oral, mudah menembus membran sel dan didistribusikan secara luas hampir ke semua jaringan dan cairan tubuh, termasuk sistem araf pusat dan cairan serebrospina(Gallagher & MacDougall, 2014). Sebagian besar obat dieliminasi di ginjal dan sebagian kecil obat aktif diekskresikan melalui empedu dan feces. Pemberian kloramfenikol pada bayi harus berhati hati karena dapat menyebabkan gray baby syndrome. Kloramfenikol digunakan untuk indikasi tifus, meningitis bakteri yang terjadi pada pasien yang memiliki reaksi hipersensitif besar terhadap penisilin. Selain itu, kloramfenikol juga digunakan secara topikal untuk infeksi mata karena spektrumnya yang luas dan penetrasi baik ke dalam jaringan okular dan aqueous humor (Deck, Daniel H. 2015; Siswandono, 2016).
2.1.3.2.4 Makrolida
Makrolida aktif terhadap bakteri Gram-positif, tetapi juga dapat menghambat beberapa Enterococcus dan basil Grampositif. Sebagian besar Gram-negatif aerob resisten terhadap makrolida, namun azitromisin dapat menghambat Salmonela. Azitromisin dan klaritromisin dapat menghambat H.
influenzae, tapi azitromisin mempunyai aktivitas terbesar. Keduanya juga
aktif terhadap H. Pylori (Kemenkes, 2011). Makrolid bekerja dengan cara menghambat sintesis protein melalui pengikatan subunit ribosom 50S pada RNA secara reversibel. Eritromisin aktif terhadap bakteri aerob gram positif bentuk coccus dan basil. Obat makrolida antara lain eritromisin, azitromisin, clarithromisin dan telithromisin. Basis eritromisin dihancurkan oleh asam lambung sehingga harus diberikan dengan lapisan enterik. Penyesuaian untuk gagal ginjal tidak diperlukan karena sejumlah besar dosis yang diberikan
diekskresikan melalui empedu dan hilang dalam kotoran, dan hanya 5% yang diekskresikan melalui urin. Obat terserap didistribusikan secara luas kecuali ke otak dan cairan serebrospinal. Eritromisin dapat menembus sawar darah plasenta dan mencapai janin. Eritromisin digunakan untuk indikasi infeksi saluran pernafasan, pneumonia, faringitis, infeksi kulit dan jaringan lunak, dan profilaksis endokarditis (Deck, Daniel H. 2015; Siswandono, 2016).
Azitromisin merupakan suatu senyawa cincin makrolid lakton 15-atom, diturunkan dari eritromisin melalui penambahan nitrogen termetilisasi kedalam cincin lakton. Spektrum aktivitas dan penggunaan klinisnya hampir identik dengan klaritomitin. Azitromisin efektif terhadap Mavium kompleks dan T gondii. Azitromisin sedikit kurang aktif dari pada eritromisin dan klaritomisin terhadap stafilokokus dan streptokokus serta sedikit lebih aktif terhadap H influenzae. Azitromisin sangat efektif terhadap klamid (Katzung, 2012). Sekitar 37% dosis diabsorpsi, dan semakin menurun dengan adanya makanan. Obat ini dapatmeningkatkan kadar SGOT dan SGPT pada hati (Kemenkes, 2011).
2.1.3.2.5 Klindamisin
Klindamisin menghambat sebagian besar kokus Gram-positif dan sebagian besar bakteri anaerob, tetapi tidak bisa menghambat bakteri Gram-negatif aerob seperti Haemophilus, Mycoplasma dan Chlamydia (Kemenkes, 2011). Mekanisme kerja klindamisin sama dengan eritromisin. Klindamisin terutama diberikan untuk pengobatan infeksi yang disebabkan oleh bakteri anaerob, seperti bakteri Bakteriodes fragilis yang sering kali menimbulkan infeksi abdomen yang diakibatkan trauma (Katzung, 2012).
2.1.3.3 Obat Antimetabolit yang Menghambat Enzim-Enzim Esensial Dalam Metabolit Folat
2.1.3.3.1 Sulfonamida dan Trimetropim
Mekanisme kerja antibiotik golongan sulfonamid yaitu dengan menghambat dihidropteroat sintase yang merupakan salah satu enzim yang dibutuhkan untuk mensintesis purin dan menghambat produksi folat. Sulfonamid peka terhadap bakteri gram positif dan gram negatif, dan beberapa protozoa, akan tetapi aktivitasnya buruk terhadap anaerob.
Pseudomonas aeruginosa secara intrinsik resisten terhadap antibiotik golongan sulfonamid. Sulfonamid diabsorbsi dan didistribusikan secara luas ke jaringan dan cairan tubuh (termasuk sistem saraf pusat dan cairan serebrospinal), plasenta, dan janin. Pengikatan protein bervariasi dari 20% hingga lebih dari 90% (Deck, Daniel H. 2015). Sulfonamida diekskresikan ke dalam urin, terutama oleh filtrasi glomerulus sehingga perlu penyesuaian dosis untuk pasien yang mengalami gangguan ginjal. Sulfonamid jarang digunakan sebagai agen tunggal dan biasanya dikombinasi dengan trimetoprim untuk meningkatkan aktivitasnya. Kombinasi trimethoprim-sulfamethoxazole adalah obat pilihan untuk infeksi seperti Pneumocystis
jiroveci, pneumonia, toksoplasmosis, nocardiosis, dan infeksi bakteri lainnya
(Petri, William A. 2011; Goodman & Gilman, 2012).
Mekanisme kerja trimetoprim yaitu selektif menghambat reduktase asam dihidrofolat bakteri yang merupakan salah satu enzim yang dibutuhkan untuk membentuk purin. Trimetoprim biasanya diberikan secara oral, baik tunggal mauapun kombinasi dengan sulfamethoxazole. Trimethoprim-sulfamethoxazole juga bisa diberikan secara intravena. Trimetoprim diabsorbsi dengan baik di usus dan didistribusikan secara luas dalam cairan tubuh dan jaringan, termasuk cairan serebrospinal. Diekskresikan lewat urin, sehingga perlu dilakukan penyesuaian dosis jika klirens kreatinin 15-30 ml/menit. Trimetoprim digunakan untuk infeksi saluran kemih akut, infeksi saluran pernafasan, infeksi gastrointestinal (Katzung, 2013; Deck, Daniel H. 2015).
2.1.3.4 Obat yang Mempengaruhi Sintesis atau Metabolisme Asam Nukleat
Kuinolon merupakan antibiotik yang dapat mempengaruhi sintesis atau metabolisme asam nukleat. Mekanisme antibiotik golongan kuinolon yaitu memblokir sintesis DNA bakteri dengan menghambat bakteri topoisomerase II (DNA gyrase) dan topoisomerase IV (Katzung, 2012). Memiliki aktivitas aktivitas yang sangat baik terhadap bakteri aerobik gram negatif dan memiliki aktivitas terbatas terhadap organisme gram positif. Beberapa senyawa golongan ini adalah siprofloksasin, enoksasin, lomefloksasin, levofloksasin,
ofloksasin, dan pefloksasin. fluoroquinolones terserap baik dengan bioavailabilitas 80-95% dan didistribusikan secara luas dalam cairan tubuh dan jaringan. Florokuinolon dieliminasi di ginjal baik sekresi tubular atau filtrasi glomerular dan perlu penyesuaian dosis pada pasien dengan klirens kreatinin kurang dari 50 ml/menit. Banyak digunakan untuk infeksi saluran kemih, infeksi jaringan lunak, tulang dan sendi dan infeksi saluran intra-abdomen dan infeksi saluran pernafasan atas dan bawah (Deck, Daniel H. 2015).
2.1.3.5 Golongan Antibiotik yang berdasarkan luas spektrum kerja Antibiotik berdasarkan luas spektrum kerjanya dibagi menjadi dua. Antibiotik bekerja dengan cara menghambat pertumbuhan atau membunuh bakteri, dimana antibiotik yang membunuh banyak spesies bakteri disebut antibiotik dengan spektrum luas atau broad spectrum antibiotik, sedangkan antibiotik yang membunuh hanya beberapa spesies bakteri disebut antibiotik spektrum sempit atau narrow spectrum antibiotik (Oliphant, 2016).
2.1.3.6 Golongan Antibiotik yang berdasarkan Farmakodinamik
Berdasarkan farmakodinamiknya, antibiotik dibagi menjadi 2 kelompok, yaitu concentration dependent activity dan time dependent activity.
Concentration dependent activity adalah antibiotik yang aktivitas membunuh
bakteri berkorelasi dengan kadarnnya di dalam plasma, dan tidak tergantung pada waktu sehingga tidak perlu dipertahankan dalam jangka waktu yang lama. Antibiotik akan menghasilkan daya bunuh maksimal terhadap bakteri apabila kadarnya tinggi sehingga semakin tinggi kadar antibiotik dalam plasma maka akan semakin poten pula (Katzung, 2012). Antibiotik yang termasuk dalam concentration dependent killing adalah golongan aminoglikosida, fluorokuinolon, daptomisin, ketolid, metronidazole, dan amfoterisin B. Sedangkan time dependent killing adalah antibiotik yang aktivitas membunuh bakterinya berkorelasi dengan berapa lama antibiotik tersebut berada pada kadar yang efektif untuk membunuh bakteri. Antibiotik akan menghasilkan daya bunuh yang maksimal terhadap bakteri bila kadarnya dipertahankan cukup lama di atas Kadar Hambat Minimal atau
konsentrasi antibiotik dalam plasma lebih tinggi dari MIC maka semakin poten. Kadar yang sangat tinggi tidak meningkatkan efektivitas obat untuk membunuh bakteri (Deck, Daniel H. 2015). Antibiotik yang termasuk dalam
time dependent killing adalah golongan beta laktam, makrolida, klindamisin,
tetrasiklin, dan glikopeptida (Katzung, 2013). 2.2 Resistensi Antibiotik
Resistensi adalah suatu kemampuan alami yang dapat dilakukan oleh suatu organisme untuk melawan mikroorganisme, toksin/racun, atau zat lain yang diproduksi dalam suatu terapi penyakit (Albert, Daniel. 2012). Resistensi antibiotik terjadi ketika suatu mikroorganisme mengalami perubahan yang menyebabkan obat yang diberikan untuk melawan bakteri tersebut menjadi tidak efektif lagi. Pada saat kondisi ini sudah terjadi, organisme tidak dapat dihambat lagi meskipun konsentrasi efektif telah tercapai (Pottinger et al, 2014). Waktu pembelahan bakteri berlangsung cepat dan kemampuan bakteri untuk menerima DNA dari bakteri lain juga cepat, sehingga resistensi bakteri terhadap antibiotik dapat terjadi sangat cepat pula (Finberg & Guharoy, 2012).
2.2.1 Mekanisme Resistensi Antibiotik
Mekanisme resistensi antibiotik terjadi pada tahapan yang berurutan dimulai pada saat obat masuk kedalam tubuh, terakumulasi, mengikat target hingga pada saat obat menimbulkan efek toksik. Mekanisme seperti ini dapat dipengaruhi oleh perubahan kode gen karena mutasi pada bakteri (CDC, 2014). Terjadinya resistensi antibiotik hanya memerlukan waktu yang singkat karena dilihat dari waktu pembelahan suatu bakteri dengan cepat dan kemampuan bakteri untuk menerima DNA dari bakteri yang lain sehingga kebanyakan waktu antara penemuan Antibiotik dan resistensi cukup singkat (Finberg&Guharoy, 2012). Seperti contoh pada tahun 2010 jenis antibiotik Ceftarolin yang efektif untuk mengatasi bakteri Staphylococcus menjadi resisten pada tahun 2011pada suatu kelompok (CDC, 2014).
Menurut (Gumbo, 2011) terdapat lima tahapan mekanisme resistensi antibiotik, dimana resistensi antibiotik dapat berkembang melalui satu atau
beberapa tahap pada saat antibiotik tersebut menuju targetnya. Mekanisme resistensi antibiotik antara lain yaitu:
1. Resistensi melalui sistem pompa (efflux pumps). Bakteri dapat meningkatkan aktivitas efflux dengan ekskresi yang berlebihan sehingga pengeluaran antibiotik akan di tahan atau memberikan efek inhibisi. 2. Resistensi yang disebabkan karena terdapat perubahan sel protein
pengikat dinding. Umumnya terjadi dalam kasus antibiotik golongan beta-laktam yang bertarget pada sintesis dinding sel.
3. Resistensi yang diakibatkan oleh bakteri karena memproduksi enzim untuk menginaktivasi antibiotik. Enzim yang dihasilkan mampu memodifikasi struktur antibiotik dan membuat antibiotik menjadi tidak aktif, hal ini terjadi pada bakteri penghasil aminoglycoside-modifying
enzyme yang dapat resisten dengan antibiotik golongan aminoglikosida,
dan bakteri Eschericia coli yang dapat menghasilkan enzim beta laktamase dan dapat menyebabkan resisten dengan antibiotik golongan beta laktam. 4. Resistensi dengan mengurangi masuknya antibiotik kedalam bakteri
karena adanya hambatan penetrasi yang disebabkan oleh perubahan permeabilitas membran.
5. Resistensi akibat adanya perubahan dari dinding sel yang mencegah masuknya antibiotik.
Menurut (Leekha et al., 2011) terdapat beberapa faktor yang menyebabkan berkembangnya resistensi antibiotik antara lain:
a. Pemberian antibiotik empiris secara terus menerus tanpa mengetahui bukti penyebab infeksi.
b. Perawatan klinis pasien dengan kultur yang positif tanpa adanya infeksi atau mengetahui penyakitnya.
c. Kegagalan terapi Antibiotik spektrum sempit saat sudah diketahui penyebab bakterinya.
d. Penggunaan antibiotik profilaksis yang diperpanjang. e. Penggunaan antibiotik yang berlebihan.
2.2.2 Upaya Pencegahan Resistensi Antibiotik
Pendekatan yang dianjurkan untuk meminimalkan perkembangan resistensi antibiotik (Gumbo, 2011) yaitu antara lain:
1. Tidak menggunakan antibiotik tanpa indikasi klinis.
2. Menggunakan antibiotik dalam waktu terapi yang sesuao untuk membunuh bakteri serta menggunakan dengan waktu yang sesingkat mungkin.
3. Menggunakan antibiotik dengan dosis obat yang cukup dan tepat untuk membunuh semua bakteri atau berada dalam rentang dosis terapeutik tetapi tidak dibawah dosis MIC.
4. Penggunaan antibiotik profilaksis dan empiris harus dipantau secara hati-hati dan hanya digunakan ketika ada indikasi yang jelas.
2.3 Tinjauan Evaluasi Antibiotik
Evaluasi penggunaan antibiotik bertujuan untuk mengetahui kualitas dari penggunaan antibiotik. Selain itu, juga bisa dijadikan dasar dalam menetapkan surveilans penggunaan antibiotik di rumah sakit secara sistematik dan terstandar serta sebagai indikator kualitas layanan rumah sakit. Evaluasi penggunaan antibiotik dapat dilakukan secara kualitatif maupun kuantitatif. Evaluasi secara kualitatif yang bertujuan unutuk menilai ketepatan penggunaan antibiotik dapat menggunakan metode Gyssens, sedangkan untuk evaluasi secara kuantitatif untuk mengevaluasi jenis dan jumlah antibiotik yang digunakan dapat dilakukan dengan metode perhitungan DDDper 100 hari rawat (Kemenkes RI, 2011).
2.3.1 Tinjauan ATC/DDD 2.3.1.1 Definisi ATC/DDD
Defined Daily Dose atau yang biasa disingkat DDD merupakan asumsi dosis rata-rata perhari untuk penggunaan antibiotik pada indikasi tertentu pada orang dewasa (Kemenkes RI, 2011). Menurut WHOdefinisi Anatomical
Therapeutic Chemical dan Defined Daily Dose (ATC/DDD) adalah suatu
sistem klasifikasi serta pengukuran penggunaan obat yang digunakan untuk meningkatkan kualitas penggunaan obat (WHO, 2019).
2.3.1.2 Manfaat Sistem ATC/DDD
Sistem ATC/DDD bermanfaat sebagai alat untuk melakukan penelitian terkait pemanfaatan obat dalam rangka meningkatkan kualitas penggunaan obat. Tidak hanya itu, sistem ini dapat pula digunakan untuk melakukan perbandingan tingkat konsumsi obat secara internasional (WHO, 2019). Data ini sangat berguna untuk melihat perubahan penggunaan obat dari waktu ke waktu di suatu negara atau wilayah, dan data ini juga berguna untuk membandingkan tingkat konsumsi obat antar fasilitas kesehatan, wilayah, dan negara dan untuk mengidentifikasi penggunaan obat yang berlebihan, penggunaan obat yang kurang serta penyalahgunaan obat-obatan (Wertheimer & Santella,2007).
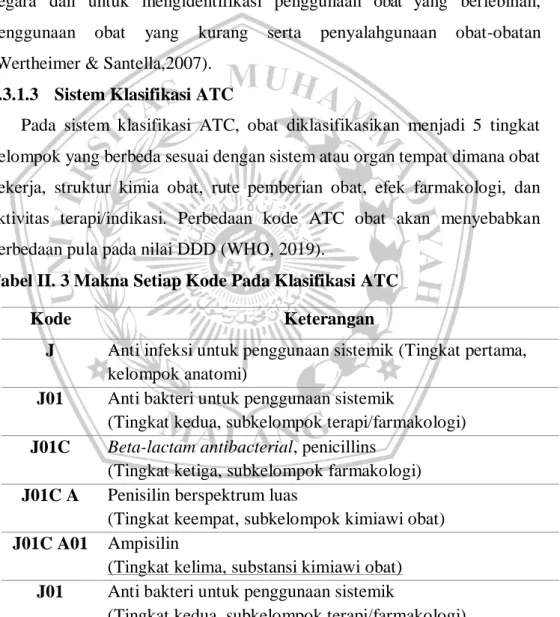
2.3.1.3 Sistem Klasifikasi ATC
Pada sistem klasifikasi ATC, obat diklasifikasikan menjadi 5 tingkat kelompok yang berbeda sesuai dengan sistem atau organ tempat dimana obat bekerja, struktur kimia obat, rute pemberian obat, efek farmakologi, dan aktivitas terapi/indikasi. Perbedaan kode ATC obat akan menyebabkan perbedaan pula pada nilai DDD (WHO, 2019).
Tabel II. 3 Makna Setiap Kode Pada Klasifikasi ATC
Sumber: WHO, 2019
Kode Keterangan
J Anti infeksi untuk penggunaan sistemik (Tingkat pertama, kelompok anatomi)
J01 Anti bakteri untuk penggunaan sistemik
(Tingkat kedua, subkelompok terapi/farmakologi) J01C Beta-lactam antibacterial, penicillins
(Tingkat ketiga, subkelompok farmakologi) J01C A Penisilin berspektrum luas
(Tingkat keempat, subkelompok kimiawi obat) J01C A01 Ampisilin
(Tingkat kelima, substansi kimiawi obat) J01 Anti bakteri untuk penggunaan sistemik
Adapun klasifikasi antiinfeksi yang dikelompokkan sebagai berikut: Tabel II. 4 Makna Setiap Kode Antiinfeksi pada Klasifikasi ATC
Kode Keterangan
A01AB Antiinfeksi dan antiseptik untuk terapi oral lokal
A02BD Kombinasi eradikasi untuk Helicobacter
pylori
Kode Keterangan
A07A Antiinfeksi usus
D06 Antibiotik dan kemoterapeutik untuk pemakaian dermatologi
D07C Kortikosteroid, kombinasi dengan antibiotik D09AA Dressing salep dengan antiinfeksi
D10AF Antiinfeksi untuk pengobatan jerawat G01 Antiinfeksi dan antiseptik unttuk ginekologi
P Produk antiparasit, insektisida dan repellent S01/
S02/
S03 Sediaan untuk mata dan telinga dengan antiinfeksi
Sumber: WHO, 2019 2.3.1.3 Perhitungan DDD
Defined Daily Doses adalah asumsi dosis rata-rata per hari penggunaan
antibiotik untuk suatu indikasi tertentu pada pasien dewasa. DDD hanya bisa dihitung untuk obat yang memiliki kode ATC. Penilaian penggunaan antibiotik di rumah sakit dengan satuan DDD/100 hari rawat, dan di komunitas dengan satuan DDD/1000 penduduk (Kemenkes RI, 2011).
Rumus perhitungan konsumsi antibiotik dengan metode perhitungan DDD per 100 hari rawat sebagai berikut:
=
( jumlah gram AB yang digunakan dalam setahunStandar DDD WHO (gram)
×
100
Untuk menghitung penggunaan antibiotik selama 1 tahun
a. Jumlah antibiotik terjual adalah jumlah antibiotik terjual dalam waktu 1 tahun
b. DDD WHO sesuai dengan ATC/DDD c. Angka 100 untuk 100 hari rawat
d. Jumlah populasi: (jumlah tempat tidur X dengan Bed Occupation Rate (BOR) Rumah Sakit dalam tahun yang sama)
e. Angka 365: lamanya hari dalam 1 tahun (Kemenkes RI, 2011)
Cara perhitungan DDD di rumah sakit yang dinyatakan dalam DDD 100 patient-days:
a. Mengumpulkan data semua pasien yang menerima terapi antibiotik b. Mengumpulkan lamanya waktu perawatan pasien rawat inap (total length
of stay) semua pasien
c. Menghitung jumlah dosis antibiotik (gram) selama dirawat d. Menghitung DDD 100patient-days:
(𝐽𝑢𝑚𝑙𝑎ℎ 𝑔𝑟𝑎𝑚 𝐴𝐵 𝑦𝑎𝑛𝑔 𝑑𝑖𝑔𝑢𝑛𝑎𝑘𝑎𝑛 𝑜𝑙𝑒ℎ 𝑝𝑎𝑠𝑖𝑒𝑛) 𝑥 100
𝑠𝑡𝑎𝑛𝑑𝑎𝑟 𝐷𝐷𝐷 𝑊𝐻𝑂 𝑑𝑎𝑙𝑎𝑚 𝑔𝑟𝑎𝑚 𝑥 (𝑡𝑜𝑡𝑎𝑙 𝐿𝑂𝑆)
(Kemenkes RI, 2011). 2.3.2 Tinjauan Metode Gyssens
Penggunaan antibiotik yang rasional berdasar pada pengetahuan dan pemahaman dari penyakit infeksi dan antibiotik. Host, virulensi, farmakokinetik dan farmakodinamik obat, identitas, dan kerentanan mikroorganisme harus diperhatikan. Kualitas penggunaan antibiotik harus dimaksimalkan agar menjamin keberhasilan dalam jangka panjang. Dalam melakukan evaluasi kualitas, penilaian dinilai dengan menggunakan rekam pemberian obat khususnya antibiotik, catatan medis pasien dan kondisi klinisnya. Dengan menggunakan alur penilaian metode Gyssens bisa didapatkan hasil secara kualitatif (Kemenkes RI, 2011).
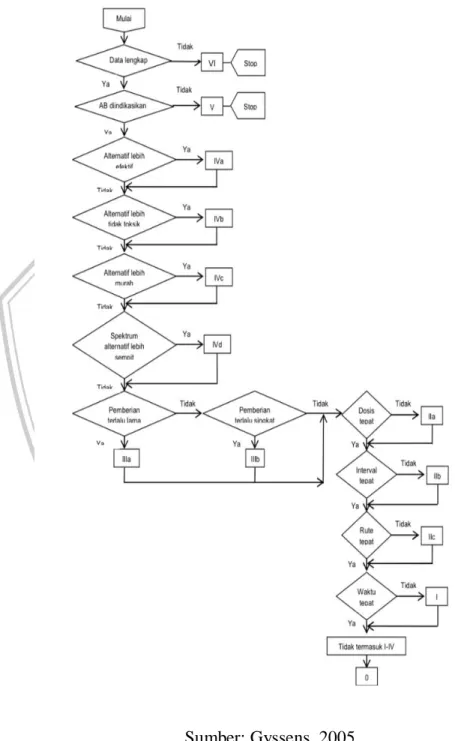
Metode Gyssens berbentuk diagram alir yang diadaptasi dan dikembangkan dari metode Kunin dengan menambahkan aspek waktu dari pemberian didalamnya. Metode Gyssens mengevaluasi seluruh aspek peresepan antibiotik seperti penilaian peresepan (data pasien), alternatif yang lebih efektif, lebih tidak toksik, lebih murah, spektrum lebih sempit. Selain
itu juga dievaluasi lama pengobatan dan dosis, interval dan rute pemberian serta waktu pemberian (Gyssens, 2005).
Gambar 2. 1 Bagan Alur Gyssens
Sumber: Gyssens, 2005
Dengan menggunakan diagram alur ini, evaluasi akan dilakukan secara lengkap, pertanyaan harus berada pada urutan yang tetap sehingga tidak ada
parameter yang ditinggalkan. Pembacaannya dimulai dari atas (Katagori VI) ke bawah untuk mengevaluasi keseluruhan proses.
1. Bila data tidak lengkap, berhenti di kategori VI. Yang dimaksudkan data tidak lengkap adalah data yang tertera pada rekam medis tanpa diagnosis kerja , atau ada halaman rekam medis yang hilang sehingga tidak dapat dievaluasi. Pemeriksaan penunjang seperti data laboratorium tidak harus dilakukan karena mungkin pasien tidak memiliki biaya dengan catatan sudah direncanakan pemeriksaannya untuk mendukung diagnosis kerja. Diagnosis kerja dapat ditegakkan secara klinis dari anamnesis dan pemeriksaan fisik. Apabila data lengkap, analisis dapat dilanjutkan ke pertanyaan di bawahnya yaitu apakah indikasi pemberian antibiotik? 2. Bila tidak ada indikasi pemberian Antibiotik, maka analisis berhenti di
kategori V. Indikasi adanya infeksi ditunjukkan dengan sindrom klinis yang mengarah pada keterlibatan bakteri. Pada awal mula infeksi ditandai dengan demam, namun demam tidak selalu diakibatkan oleh infeksi, oleh karena itu pengetahuan tentang penyakit infeksi, dilihat dari parameter klinis tertentu sehingga dapat menentukan apakah pasien membutuhkan antibiotik atau tidak. Jika terdapat indikasi pada pemberian antibiotik, dapat dilanjutkan dengan pertanyaan, apakah pemilihan Antibiotik sudah tepat?
3. Bila ada pilihan Antibiotik lain yang lebih efektif, berhenti di kategori IVa. Awal pemberian antibiotik dimulai pada saat bakteri penyebab infeksi belum teridentifikasi atau diketahui, oleh karena itu diberikan terapi empiris. Bila infeksi yang dialami berat, dapat dilakukan kombinasi. Pilihan Antibiotik yang lebih efektif didasarkan pada hasil pemeriksaan mikrobiologi lalu diberikan terapi Antibiotik yang berlaku. Apabila tidak ada, pertanyaan selanjutnya adalah apakah ada alternatif lain yang kurang toksik?
4. Bila ada pilihan antibiotik alternatif yang kurang toksik, berhenti di kategori IVb Penyesuaian toksisitas disesuaikan dengan kondisi pasien masing-masing seperti kelainan pada ginjal. Sehingga untuk menghindari hal tersebut peresepan antibiotik dilakukan penyesuaian
(Gyssens, 2005). Apabila tidak toksik maka pertanyaan dilanjutkan ke bawah, apakah ada alternatif lain lebih murah?
5. Bila ada antibiotik yang lebih murah daripada yang diberikan, berhenti di kategori Ivc. Perhitungan berdasarkan harga yang ada di RS Dr. Iskak dan dianggap sebagai obat generik. Bila tidak ada, pertanyaan selanjutnya adalah apakah ada alternatif lain yang spektrum lebih sempit?
6. Bila ada antibiotik lain dengan spektrum lebih sempit, maka berhenti di kategori Ivd. Apabila tidak ada alternatif lain yang spektrum aktivitasnya lebih sempit, dilanjutkan dengan pertanyaan, apakah durasi antibiotik yang diberikan terlalu panjang/singkat?
7. Lama pemberian antibiotik dinilai sesuai guideline yang ada yaitu apabila durasi pemberian Antibiotik terlalu panjang, berhenti di kategori IIIa. Namun bila durasi pemberian Antibiotik terlalu singkat, berhenti di kategori IIIb. Apabila tidak, dilanjutkan dengan pertanyaan mengenai dosis. Apakah dosis sudah benar?
8. Bila dosis pemberian Antibiotik tidak tepat, berhenti di kategori IIa Dosis pemberian Antibiotik harus diatas MIC (Minimum Inhibitory Concentration) dapat dikatakan optimal. Selain itu, dosis yang diberikan harus Bila dosisnya sudah tepat, dilanjutkan pertanyaan apakah interval saat pemberian Antibiotik sudah tepat?
9. Bila interval tidak tepat, berhenti di kategori IIb
Penentuan interval dapat dilihat dari waktu paruh dan mekanisme aksi dari obat. Bila interval pemberian antibiotik sudah tepat, dilanjutkan pertanyaan apakah rute pemberian antibiotik sudah tepat?
10. Bila rute pemberian antibiotik tidak tepat, berhenti di kategori IIc Pemberian secara intravena dapat digunakan pada pasien dengan masalah yang berat. Selanjutnya bisa disesuaikan bila dibutuhkan terapi oral dengan respon klinik dan fungsi saluran pencernaan yang baik. Apabila rute pemberian sudah tepat, dilanjutkan pada waktu pemberian antibiotik apakah sudah tepat?
Pemberian antibiotik profilaksis optimal yaitu 30-60 menit sebelum dilakukan operasi dengan durasi pemberian maksimal 24 jam (Kemenkes 2011; SPO RSUD Dr. Iskak Tulunggaung, 2019).
12. Bila antibiotik tidak termasuk kategori I sampai dengan VI, Antibiotik tersebut merupakan katagori 0 atau tepat penggunaan.