PENENTUAN PARAMETER KINETIK DEKOMPOSISI
KATALITIK METANA DENGAN KATALIS Ni-Cu-Al UNTUK
PRODUKSI NANO KARBON
SKRIPSI
MARCHO RIZAL 0806333272 FAKULTAS TEKNIK TEKNIK KIMIA DEPOK JUNI 2012UNIVERSITAS INDONESIA
PENENTUAN PARAMETER KINETIK DEKOMPOSISI
KATALITIK METANA DENGAN KATALIS Ni-Cu-Al UNTUK
PRODUKSI NANO KARBON
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknik
MARCHO RIZAL 0806333272 FAKULTAS TEKNIK TEKNIK KIMIA DEPOK JUNI 2012
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar.
Nama : Marcho Rizal NPM : 0806333272 Tanda Tangan : Tanggal : 26 Juni 2012
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Marcho Rizal
NPM : 0806333272
Program Studi : Teknik Kimia
Judul Skripsi : Penentuan Parameter Kinetik Dekomposisi Katalitik Metana dengan Katalis Ni-Cu-Al untuk Produksi Nano Karbon
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Teknik pada Program Studi Teknik Kimia, Fakultas Teknik, Universitas Indonesia
DEWAN PENGUJI
Pembimbing 1 : Dr. Ir. Praswasti P.D.K Wulan, M.T. Pembimbing 2 : Dr . rer. nat. Ir. Yuswan Muharam, MT Penguji : Dr. Ir. Tania Surya Utami, M.T.
Penguji : Ir. Mahmud Sudibandriyo MSc, PhD Penguji : Ir. Rita Arbianti MSi
Ditetapkan di : Departemen Teknik Kimia FTUI, Depok Tanggal : 26 Juni 2012
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan sebaik-baiknya. Skripsi dengan judul “Metode Alternatif Penentuan Angka Oktana Bahan Bakar Komersial Dengan Menggunakan Model Kinetika Pembakaran Hidrokarbon Multikomponen” ini disusun sebagai salah satu syarat untuk mencapai gelar Sarjana Teknik Jurusan Teknik Kimia pada Fakultas Teknik Universitas Indonesia.
Dalam penulisan skripsi ini, penulis berterima kasih atas bantuan dan dukungan yang telah diberikan oleh berbagai pihak. Secara khusus, penulis mengucapkan terima kasih yang sedalam-dalamnya kepada :
1. Prof. Dr. Ir. Widodo Wahyu Purwanto, DEA selaku ketua Departemen Teknik Kimia Fakultas Teknik Universitas Indonesia.
2. Dr. Ir. Praswast PDK Wulan selaku pembimbing skripsi
3. Dr. rer. nat. Ir. Yuswan Muharam, MT selaku pembimbing skripsi
4. Orang tua tercinta atas semua dukungan doa dan kasih sayang serta segala hal yang telah diberikan.
5. Rekan-rekan mahasiswa Teknik Kimia angkatan 2008 atas semua kerja sama dan bantuannya selama ini serta Seluruh teman-teman saya terutama Chandra Hadiwijaya, Kenny Viriya, Shelly Apsari, dan Fiona Wijaya yang sangat membantu dalam penyelesaian skripsi ini.
6. Semua staf dan karyawan di Departemen Teknik Kimia Universitas Indonesia atas segala bantuannya.
7. Serta berbagai pihak yang tidak dapat disebutkan satu persatu untuk segala kontribusinya.
Harapan penulis skripsi ini dapat bermanfaat secara keilmuan bagi setiap orang yang membacanya. Kritik dan saran yang membangun sangat diharapkan oleh penulis demi tercapainya hasil yang lebih baik.
Depok, 2012 Penulis
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Marcho Rizal
NPM : 0806333272
Program Studi : Teknik Kimia Departemen : Teknik Kimia Fakultas : Teknik Jenis karya : Skripsi
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive Royalty-Free Right) atas karya ilmiah saya yang berjudul :
“Penentuan Parameter Kinetik Dekomposisi Katalitik Metana dengan Katalis Ni-Cu-Al untuk Produksi Nano Karbon”
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalihmedia/formatkan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok Pada tanggal : 26 Juni 2012
Yang menyatakan (Marcho Rizal)
ABSTRAK
Nama : Marcho Rizal Program Studi : Teknik Kimia
Judul : Penentuan Parameter Kinetik Dekomposisi Katalitik Metana dengan Katalis Ni-Cu-Al untuk Produksi Nano Karbon
Nano Teknologi semakin berkembang sekarang ini. Reaksi dekomposisi katalitik metana merupakan salah satu cara untuk memproduksi nano karbon. Kendala dari proses produksi nano karbon dengan menggunakan reaksi dekomposisi katalitik metana berada pada parameter kinetika yang belum diketahui terutama jika memperhitungkan deaktivasi katalis. Penelitian ini dilakukan untuk mengembangkan model serta menentukan parameter kinetik dari reaksi-reaksi elementer dekomposisi katalitik metana dengan mengikutsertakan reaksi deaktivasi katalis yang akan diselesaikan dengan menggunakan regresi non linear, metode Marquadt. Model menghasilkan nilai pra eksponensial yang berkisar antara 0.00042 hingga 34.3, dengan kisaran nilai energy aktivasi antara 50,274 kJ/mol hingga 104,673kJ/mol
Kata kunci : nano karbon, dekomposisi katalitik metana, kinetik, regresi non linear, Marquadt
ABSTRACT
Name : Marcho Rizal
Major of Study : Chemical Engineering
Title : Determination of Kinetic Parameter for Catalytic Decomposition of Methane with Ni-Cu-Al Catalyst for Carbon Nano Production
Nano technology is advancing right now. Catalytic Decomposition of Methane is one of many ways to produce Nano Carbon. The problem with this method is the kinetic parameter especially if we include the deactivation of the catalyst used. This research is done to develop a model to determine the parameter kinetic of catalytic decomposition of methane that includes the deactivation of catalyst and will be solved by using a non linear regression, the Marquadt method. This research gives the pre exponensial number ranging from 0.00042 to 34.3, with activation energy ranging from 50,274 kJ/mol to 104,673kJ/mol
Keywords : Nano carbon, catalytic decomposition of methane, kinetic, non linear regression, marquadt
DAFTAR ISI
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... v
ABSTRAK ... vi
DAFTAR ISI ... viii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR SIMBOL ... xi
DAFTAR LAMPIRAN ... xiii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 Ruang Lingkup Masalah ... 3
BAB 2 TINJAUAN PUSTAKA ... 4
2.1 Nano Karbon ... 4
2.2 Cara Memproduksi CNT... 5
2.3 Reaksi Dekomposisi Metana... 6
2.4 Kondisi Operasi ... 10
2.5 Matrix Laboratory (MatLab)... 11
2.6 Regresi Non Linear ... 12
BAB 3 METODE PENELITIAN... 15
3.1 Diagram Alir Penelitian ... 15
3.2 Rincian Kegiatan Penelitian ... 16
BAB 4 HASIL DAN PEMBAHASAN... 21
4.1 Mekanisme Reaksi ... 21
4.2 Model Kinetika dan Fitting Model terhadap Data Eksperimen ... 28
4.3 Penentuan Parameter Kinetik (Nilai Pra Eksponensial Konstanta Laju Reaksi dan Energi Aktivasi)... 32
BAB 5 KESIMPULAN ... 36 DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Tabel 3. 1 Tabel Model Persamaan Laju Reaksi Masing-Masing spesies zat ... 17
Tabel 4. 1 Tabel nilai Konstanta Laju Reaksi untuk nilai k1 hingga k11 ……32
Tabel 4. 2 Tabel nilai K dan Deviasi Standar pada suhu 750oC ... 33
Tabel 4. 3 Tabel nilai K dan Deviasi Standar pada suhu 700oC ... 33
Tabel 4. 4 Tabel nilai K dan Deviasi Standar pada suhu 650oC ... 33
Tabel 4. 5 Tabel nilai K dan Deviasi Standar pada suhu 600oC ... 33
Tabel 4. 6 Tabel nilai K dan Deviasi Standar pada suhu 550oC ... 33
Tabel 4. 7 Tabel nilai K dan Deviasi Standar pada suhu 500oC ... 33
Tabel 4. 8 Tabel Nilai Pra Eksponensial dan Energi Aktivasi dari Masing-Masing k ... 34
DAFTAR GAMBAR
Gambar 2. 1 Logo MatLab ... 12
Gambar 2. 2 Tampilan Antarmuka MatLab ... 12
Gambar 3. 1 Diagram Alir Penelitian………...15
Gambar 3. 2 Algoritma Program Regresi Non Linear... 19
Gambar 4. 1 Ilustrasi Keseluruhan Reaksi ………21
Gambar 4. 2 Skema Mekanisme Detail Dari Reaksi yang Digunakan Dalam Model ... 22
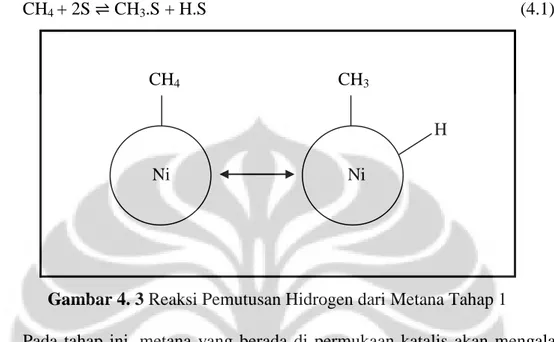
Gambar 4. 3 Reaksi Pemutusan Hidrogen dari Metana Tahap 1... 23
Gambar 4. 4 Reaksi Pemutusan Hidrogen dari Metana Tahap 2... 23
Gambar 4. 5 Reaksi Pemutusan Hidrogen dari Metana Tahap 3... 24
Gambar 4. 6 Reaksi Pemutusan Hidrogen dari Metana Tahap 4... 24
Gambar 4. 7 Pembentukan Gas Hidrogen dari Atom H yang Terikat dengan Inti Aktif ... 25
Gambar 4. 8 Segregasi Karbon yang Terikat pada Katalis ke Bagian Depan Katalis ... 25
Gambar 4. 9 Difusi Karbon Melalui Nikel ... 26
Gambar 4. 10 Pembentukan Nano Karbon ... 27
Gambar 4. 11 Deaktivasi Katalis karena Enkapsulasi Katalis ... 28
Gambar 4. 12 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=750 oC ... 29
Gambar 4. 13 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=700 oC ... 29
Gambar 4. 14 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=650 oC ... 30
Gambar 4. 15 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=600 oC ... 30
Gambar 4. 16 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=550 oC ... 31
Gambar 4. 17 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang
o
DAFTAR SIMBOL
o ANi luas permukaan spesifik partikel nikel [m2/gcat]
o CCNi,F konsentrasi karbon yang terlarut dalam nikel pada bagian depan
partikel [mol C/m3]
o CCNi,R konsentrasi karbon yang terlarut dalam nikel pada bagian belakang
partikel [mol C/m3]
o DNi Diameter partikel nikel [mm]
o DCNi Difusivitas karbon di nikel [m2/h]
o Perubahan energy pada segregasi karbon [J/Mol]
o (g) fasa gas
o k1 konstanta laju reaksi pada tahap (1) [molekul/(site.sec.atm)]
o k2 konstanta laju reaksi balik pada reaksi tahap (1)
[molekul/(site.sec)]
o k3 konstanta laju reaksi pada tahap (2) [molekul/(site.sec.)]
o k4 konstanta laju reaksi balik pada reaksi tahap (2)
[molekul/(site.sec)]
o k5 konstanta laju reaksi pada tahap (3) [molekul/(site.sec.)]
o k6 konstanta laju reaksi balik pada reaksi tahap (3)
[molekul/(site.sec)]
o k7 konstanta laju reaksi pada tahap (4) [molekul/(site.sec.)]
o k8 konstanta laju reaksi balik pada reaksi tahap (4)
[molekul/(site.sec)]
o k9 konstanta laju reaksi pada tahap (5) [molekul/(site.sec.)]
o k10 konstanta laju reaksi balik pada reaksi tahap (5)
[molekul/(site.sec.atm)]
o k11 laju reaksi enkapsulasi pada tahap (9) [molekul/(site.sec)]
o L panjang jalur difusi [m]
o PCH4 tekanan parsial metana [atm]
o PH2 tekanan parsial hydrogen [atm]
o R konstanta gas universal (J/(mol.kelvin)]
o T suhu
o xf konsentrasi karbon pada bagian depan pada partikel nikel [g C/g
Ni]
o xR konsentrasi karbon pada bagian belakang dari partikel nikel [g C/g
Ni]
o θi.s konsentrasi permukaan dari sisi yang diisi oleh spesies i [I = CH3,
CH2, CH, C, H]
o θt total sisi aktif
o θv sisi aktif yang tidak diisi spesies apapun
o ρNi massa jenis nikel
o η jumlah atom di permukaan logam
o Cv jumlah sisiaktif kosong setiap unit massa katalis dibagi dengan
bilangan Avogadro [gmol/gcat]
o Ci.s konsentrasi permukaan yang diisi oleh spesies i [gmol/gcat]
DAFTAR LAMPIRAN
Lampiran A Penurunan persamaan model……….. .39
Lampiran B Data Eksperimen yang Digunakan………...47
Lampiran C Plot ln k Terhadap 1/T ………..55
Lampiran B Program yang digunakan untuk penelitian………61
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Nanoteknologi dan bahasa pemrograman komputer adalah dua hal yang semakin berkembang sekarang ini. Salah satu riset yang menarik tentang nanoteknologi adalah carbon nanotube (CNT) dari divisi nanokarbon. CNT menjadi pusat sorotan media setelah ditemukan oleh Iijima pada tahun 1991. CNT sangat berpotensi untuk digunakan pada berbagai aplikasi seperti nanoteknologi, elektronik, optik, dan lainnya. CNT memiliki kekuatan yang luar biasa dan sifat elektrik yang unik serta merupakan konduktor panas yang efisien. Sifat-sifat tersebut membuat CNT dapat digunakan sebagai penyimpan hidrogen, nanoscale transistor, flat-panel display, superkapasitor, nanoprobes dan sensor (Daenan et al., 2003).
Reaksi dekomposisi katalitik metana merupakan salah satu reaksi yang menjanjikan untuk mengkonversi unsur karbon menjadi material adi karbon nanotube melalui reaksi CH4 C + 2H2 (Chen et al, 2001).
Proses ini juga merupakan salah satu bagian dari chemical vapor deposition
(CVD). Selain cara ini juga ada cara lain untuk memproduksi CNT yaitu arc discharge dan laser ablation. Kelebihan reaksi dekomposisi metana dibandingkan dengan kedua cara diatas adalah biaya yang lebih ekonomis.
Dalam penelitian ini kinetika dari reaksi dekomposisi katalitik metana akan diteliti. Kinetika berhubungan dengan laju dari reaksi kimia dan bagaimana laju reaksi dipengaruhi oleh berbagai faktor seperti konsentrasi dan temperatur. Kinetika memberikan bukti mengenai mekanisme dari proses kimia yang terjadi. Hal ini akan membantu untuk meprediksi hasil dan jumlah dari reaksi kimia yang terjadi. Oleh sebab inilah analisa kinetika mikro digunakan untuk penelitian ini.
Kinetika dari reaksi dekomposisi katalitik metana akan berbeda tergantung dari berbagai macam faktor seperti penggunaan jenis katalis, mekanisme yang ditinjau, dan dasar dari persamaan yang digunakan untuk menurunkan persamaan laju reaksi. Penelitian tentang produksi CNT dengan menggunakan reaksi dekomposisi metana sudah banyak dilakukan sebelumnya. Salah satu contohnya adalah penggunaan katalis berbeda akan menyebabkan perubahan pada kinetika,
seperti yang sudah dibandingkan antara alumina dengan karbon aktif (Zongqing, 2005). Peninjauan mekanisme yang digunakan juga akan mempengaruhi kinetika dan penurunan persamaan laju reaksi.
Dalam tim riset CNT Universitas Indonesia, sejak tahun 2005 telah dilakukan penelitian mengenai reaksi dekomposisi katalitik metana dengan menggunakan katalis terstruktur gauze. Dalam perkembangannya akan dilakukan menggunakan katalis terstruktur pelat sejajar menggunakan katalis Ni-Cu-Al untuk memperoleh luas permukaan yang tinggi dan menghasilkan CNT yang lebih seragam (alligned CNT) . Terkait dengan hal tersebut, maka dilakukan studi kinetika sebagai salah satu dasar perancangan, optimasi dan scale up reaktor. Kinetika reaksi dekomposisi metana yang akan dilakukan berbasis mekanisme reaksi (kinetika intrinsik) yang melibatkan tahap reaksi elementer (Chen et.al., 2001). Internal reaktor menggunakan bentuk granular berukuran 0,125 mm untuk mempermudah limitasi tahanan internal dan eksternal (Wulan, 2011). Parameter-parameter yang tidak diketahui diestimasi melewati prosedur estimasi Parameter-parameter dengan menggunakan data eksperimen dimana set parameter terbaik digunakan untuk meminimalisir hasil dari error jumlah kuadrat antara model dan data dipertimbangkan. Untuk mengestimasi parameter yang digunakan, digunakan metode regresi non linear.
Dalam menyelesaikan masalah pemodelan dengan regresi non linear, terdapat berbagai metode yang dapat digunakan. Salah satunya adalah metode Marquadt. Metode Marquadt ini menggunakan teknik interpolasi antara metode Gauss-Newton dan metode steepest descent. Interpolasi didapat dengan menambahkan matriks diagonal, dimana nilai dari λ dipilih pada setiap iterasi sehingga vektor parameter terkoreksi akan menghasilkan jumlah kuadrat yang lebih rendah pada iterasi. Metode Marquadt sangat efektif dalam penggunaan untuk pengujian dan validasi data, karena ketepatan, dimana jumlah dari kuadrat bilangan residual dapat dicari hingga nilai yang paling kecil.
Penggunaan metode Marquadt pada penelitian ini karena metode Marquadt merupakan salah satu metode regresi non linear yang memiliki tingkat ketepatan yang sangat tinggi.
Pada penelitian ini, fenomena yang terjadi pada kinetika reaksi akan diekspresikan dalam persamaan matematis yang akan diselesaikan untuk mendapatkan informasi mengenai parameter kinetika dari seluruh reaksi sehingga bisa digunakan sebagai basis untuk desain reactor.
1.2 Rumusan Masalah
Bagaimana mendapatkan parameter kinetik dari reaksi dekomposisi katalitik metana untuk produksi CNT dengan menggunakan katalis Ni-Cu-Al.
1.3 Tujuan Penelitian
a. Mengembangkan model kinetika transien dengan mempertimbangkan deaktivasi katalis dari reaksi dekomposisi katalitik metana dengan menggunakan dasar mekanisme milik Reyyan et.al (2009)
b. Mendapatkan parameter kinetika dari reaksi dekomposisi katalitik metana dengan katalis Ni-Cu-Al
1.4 Ruang Lingkup Masalah
a. Kinetika mikro berdasarkan Mekanisme reaksi didasarkan pada mekanisme yang melibatkan tahap reaksi elementer (Reyyan et.al., 2009).
b. Mempertimbangkan deaktivasi katalis
c. Temperatur yang digunakan pada rentang 500 – 750 oC. d. Dilakukan pada tekanan 1 atm.
e. Katalis yang digunakan adalah Ni/Cu/Al dalam bentuk granular. f. Metode regresi non-linear menggunakan metode Marquadt
g. Perangkat lunak yang digunakan untuk penelitian ini adalah MatLab h. Data eksperimen yang digunakan adalah jumlah karbon di setiap
waktu
i. Data eksperimen yang digunakan adalah data eksperimen milik Wulan (2011)
BAB 2
TINJAUAN PUSTAKA
Pada Bab II ini akan dilakukan tinjauan pusataka dari apa yang akan dilakukan dan apa yang ada dari penelitian ini. Yang dibahas dalam tinjauan pustaka ini adalah Carbon Nanotube (CNT), produksi CNT, reaksi dekomposisi metana, perangkat lunak MatLab, dan regresi non linear.
2.1 Nano Karbon
Nano karbon didefinisikan sebagai material karbon yang bukan hanya ukuran partikelnya saja berukuran nanometer akan tetapi struktur dan teksturnya juga berukuran nanometer (Michio, 2004). Carbon Nanotube ditemukan oleh Iijima dengan transmission electron microscopy (TEM) pada tahun 1991 (Iijima, 2002). Sejak saat iu banyak sekali penelitian tentang nanokarbon dilakukan, seperti pada struktur, sifat, dan metode preparasinya. Pada intan, masing-masing atomnya tersusun secara rapat dan secara simetris terkoordinasi memenuhi ruang tiga dimensi. Sedangkan grafit tersusun dari karbon heksagonal yang membentuk lembar atom dua dimensi dimana diantara keduanya tersebut terdapat jarak yang cukup panjang. selain kedua bentuk tersebut, ada beberapa bentuk susunan unsur karbon lainnya yaitu (Petterson,1999):
Fullerenes dan Nanotubes adalah lembaran grafit yang terbungkus baik satu lapis maupun lebih yang membentuk bola yang stabil, disebut fullerenes, atau membentuk tabung molekul, disebut nanotube. Nanopores adalah fiber yang sangat kuat yang tersusun dari ikatan nanotubes
1) Nanofibers adalah susunan dari berlapis-lapis grafit yang membentuk fiber berdiamaeter kurang dari 1 mikrometer.
2) Karbon Aktif biasanya berarti granula atau partikel kecil grafit yang dimurnikan.
3) Carbon Fibers yaitu polimer karbon berantai dengan kandungan karbon tinggi Carbon Nanotubes sendiri bisa
2.1.1 Mekanisme Pertumbuhan Nano karbon
Beberapa model pertumbuhan dari nano karbon sudah di ajukan yang berasal dari pirolisis hidrokarbon pada permukaan logam. Model pertama menyarankan mekanisme 4 tahap. Pada tahap pertama, hidrokarbon terdekomposisi pada permukaan logam, melepas hydrogen dan karbon yang kemudian larut dalam partikel. Tahap kedua meliputi difusi karbon melalui partikel logan dan pengendapan ada bagian belakang atau yang berlawanan dari muka atau permukaan untuk membentuk badan filament. Supply karbon ke bagian muka lebih cepat dibandingkan difusi melalui sebagian besar atau logam, sehingga menyebabkan akumulasi karbon pada bagian muka, dimana hal ini harius dihindari untuk menanggulangi penghalangan dari sisi aktif. Hal ini terjadi pada difusi pada permukaan dan karbon membentuk kulit atau lapisan pada badan utama filamen pada tahap ketiga. Pada tahap keempat, penutupan dan deaktivasi katalis dan terminasi pertumbuhan dari nano karbon terjadi.
Model lain menyatakan bahwa terdapat mekanisme dimana difusi yang terjadi pada sebagian besar karbon tidak terlalu signifikan dan karbon ditransport mengitari pertikel melalui difusi pada permukaan. Model lain mengemukakan sebuah mekanisme dimana karbon membentuk sebuah hemispherical graphene cap pada partikel katalis dan nano karbon tumbuh dari hal tersebut.
2.2 Cara Memproduksi CNT 2.2.1. Arc Discharge
Metode Arc Discharge ini awalnya digunakan untuk memproduksi C60
fullerenes, adalah cara yang paling umum dan mudah untuk memproduksi CNT. Tetapi teknik ini menghasulkan campuran komponen yang kompleks dan membutuhkan purifikasi lebih lanjut, untuk memisahkan CNT dari jelaga dan residu dari katalis logam. Metode ini menghasilkan CNT dari busur penguapan dari dua tongkat karbon yang diletakkan di masing-masing ujung, sejauh 1m dalam sebuah ruang tertutup yang berisikan gas inert pada tekanan rendah. Aliran listrik langsung sebesar 50 sampai 100 A,akan menghasilkan temperatur pelepasan yang tinggi antara kedua elektroda. Pelepasan ini menguapkan
permukaan dari salah satu elektroda karbon dan membentuk tumpukan kecil berbentuk tongkat pada elektroda yang lainnya
2.2.2. Laser Ablation
Metode ini dilakukan dengan menguapkan tongkat grafit dengan campuran katalis kobalt dan nikel pasa temeratur 1200 OC dala argon yang mengalir, dilanjutkan dengan pemanasan dalam vakum pada 1000 OC untuk menyingkirkan C60 dan fullerenes lain. Penguapan awal dengan laser dan diikuti dengan tembakan ke dua, menguapkan target secara seragam. Penggunaan 2 tembakan meminimalisir tumpukan karbon sebagai jelaga. Tembakan laser kedua akan menghancurkan partikel besar yang terbentuk karena tembakan pertama dan memasukkan mereka kedalam struktur nanotube. Material yang dihasilkan dari metode ini berbentuk tambang, berdiameter 10-20 nm, dan memiliki panjang sekitar 100 μm atau lebih. Tiap tambang terdiri dari nanotube berdinding tunggal. Dengan memvariasikan komposisi katalis dan parameter lainnya, diameter dan besar distribusi dapat di variasikan
2.3 Reaksi Dekomposisi Metana
Dekomposisi didefinisikan sebagai salah satu dari reaksi kimia yang menguraikan atau memutuskan ikatan-ikatan suatu senyawa menjadi unsur-unsur atau senyawa yang lebih sederhana. Salah satu contoh adalah dekompsisi metana yang merupakan hidrokarbon yang paling stabil. Sehingga yang terjadi pada reaksi ini adalah pemutusan ikatan H-C dari metana yang menjadi komponen yang lebih sederhana yaitu hydrogen dan karbon. Pemilihan metana sebagai reaktan untuk produksi nanokarbon dan hydrogen karena metana merupakan hidrokarbon dengan perbandingan karbon dengan metana yang paling tinggi. Selain itu metana bisa di dapat langsung dari alam tanpa harus diolah terlebih dahulu, sehingga mengurangi biaya produksi.
Pada reaksi dekomposisi metana atau Methane Decomposition Reaction
(MDR) terjadi reaksi (Chen, 2001) :
CH4C+2H2 ΔH298 = +75KJ/mol (2.1)
Reaksi perngkahan metana dapat dibedakan menjadi 2 jenis yaitu perengkahan langsung (Direct Methane Cracking) dan perengkahan secara tidak langsung (Indirect Methane Cracking). Reaksi dekomposisi metana tergolong reaksi perengkahan langsung dan saat ini sudah diketahui terdapat 2 golongan untuk reaksi perengkahan ini yaitu:
Dekomposisi metana secara thermal (Thermal Cracking) yang akan menghasilkan karbon hitan dan hydrogen,
Dekomosisi katalitik metana yang menggunakan katalis berdasar logam transisi (Fe, Co, dan Ni) yang akan menghasilkan hydrogen dan nanokarbon.
Analisis termodinamika dari reaksi dekomposisi metana menyatakan bahwa nilai untuk energi bebas Gibbs dan energi penguraian metana pada suhu 198 K, masing-masing sebesar 50,8 kJ/mol dan 75 kJ/mol (Song L, 2005). Nilai yang positif ini menunjukkan bahwa reaksi tidak dapat berjalan dengan spontan. Meskipun reaksi dapat berjalan, konversi yang dihasilkan reaksi tersebut tidak akan maksimal. Sedangkan nilai yang positif menandakan reaksi bersifat endotermis. Hal ini akan mempengaruhi konversi yang akan meningkat seiring dengan meningkatnya suhu reaksi sehingga reaksi ini harus dilakukan pada temperatur sangat tinggi.
Temperatur reaksi memegang peranan penting dalam tinjauan ekonomi suatu proses industri. Proses yang dilakukan pada temperatur yang lebih rendah akan lebih menguntungkan jika kita bandingkan dengan proses bertemperatur tinggi. Hal ini disebabkan energi yang dibutuhkan lebih sedikit. Oleh karena itu, untuk menurunkan temperatur reaksi perlu ditambahkan katalis yang dapat menurunkan energi aktivasi.
2.3.1 Katalis Pada Reaksi Dekomposisi Metana
Masalah yang sering timbul pada reaksi dekomposisi katalitik metana adalah deaktovasi katalis yang terjadi akibat pembentukan karbon pada permukaan katalis (Muradov, 2001). Karbon yang dihasilkan dari perengkahan metana akan membentuk deposit karbon yang dapat menutupi inti aktif katalis sehingga terjadi deaktivasi katalis dan menurunnya lifetime katalis. Katalis yang
digunakan saat ini sangat mudah terdeaktivasi pada suhu tinggi. Untuk mengatasi hal ini dan menjaga stabilitas katalis, maka kondisi operasi dijaga pada suhu rendah (<873 K) dengan memperkaya aliran gas metana, dan senantiasa mengeluarkan hydrogen dari hasil produk sehingga konversi metana menjadi lebih tinggi.
Penggunaan katalis berbasis nikel (Ni) pada penelitian dekompsisi metana karena nikel merupakan logam yang paling aktif untuk reaksi dekomposisi katalitik metana disbanding logam-logam lainnya. Tetapi Ni mudah terdeaktivasi dan sintering, sehingga menyebabkan diameter partikel Ni membesar. Hal ini akan mempengaruhi kualitas karbon nanotube. Penambahan promoter baik promoter structural maupun tekstural dapat mencegah terjadinya sintering. Promoter structural yang biasa digunakan adalah Cu (Chen, 2001; Chen, 2004) karena dapat menurunkan titik leleh katalis dan meningkatkan aktivitas katalis. Titik leleh yang rendah diperlukan karena kondisi katalis dalam keadaan liquid adalah syarat terbentuknya karbon nanotube (Chen, 2001). Cu mempunyai afinitas tinggi terhadap struktur grafit dan menghambat pertumbuhan deposit karbon pada permukaan Ni. Sedangkan penambahan promoter tekstural akan memperbaiki tekstur dari katalis sehingga baik untuk digunakan.
Pada penelitian ini digunakan katlis Ni-Cu-Al, dimana Cu digunakan sebagai promotor untuk mencegah sintering dan alumina digunakan sebagai yang menguatkan ikatan antar logam sehingga dapat menjaga diameter Ni tetap kecil.
2.3.2 Kinetika Pada Reaksi Dekomposisi Metana
Di dalam studi kinetika dikenal adanya teknik penentuan kinetika keadaan tunak (steady state kinetik) dan kinetika dalam keadaan dinamik (transient kinetik). Untuk mendapatkan persamaan laju reaksi katalitik dapat dilakukan dengan dua metode, yaitu:
Metode analisa kinetika makro
Metode analisa kinetika mikro
Pada metode analisa kinetika makro, penyusunan persamaan laju reaksi menggunakan prinsip ‘hukum pangkat’ yang kemudian dievaluasi dengan data percobaan. Metode ini etbagi menjadi dia yaitu hukum pangkat sederhana (smiple
power law) dan hukum pangkat kompleks (complex power law). Pengolahan data kinetika dengan metode hukum pangkat atau pendekatan empiris dimaksudkan untuk mendapatkan persamaan laju reaksi atau menentukan harga konstanta laju reaksi dan orde reaksi terhadap konsentrasi reaktan atau tekanan parsial reaktan. Pada reaksi katalitik, orde reaksi biasanya berupa bilangan pecahan dan pesarnya dipengaruhi oleh konsentrasi.
Persamaan yang diperoleh dari metode ini dalam perancangan reactor hanya terbatas pada konsidi pecobnaan penentuan persamaan tersebut karena metode ini berdasarkan persamaan empiris. Oleh karena itu, pada perkembangan selanjutnya sering persamaan laju reaksi katalitik ditentikan berdasarkan mekanisme reaksinya. Persamaan kinetika mekanistik ini diharapkan dapat berlaku pada kondisi yang lebih lebar dibandingkan dengan persamaan kinetika dari metode hukum pangkat (Slamet, 1999).
Sedangkan pada metode analisa kinetika mikro, penyusunan persamaan lajunya bertumpu pada mekanisme reaksi yang terjadi. Analisa kinetika mikro adalah pengujian reaksi-reaksi katalitik berdasarkan pada reaksi-reaksi kimia elementer yang terjadi pada permukaan katalitik dan hubungannya satu sama lain dengan permukaan katalitik selama siklus katalitik terjadi. Strategi yang dipakai pada metode analisa kinetika mikro adalah dengan cara memadukan antara data eksperimen yang ada dengan konsep-konsep teoritis dari system katalitik yang terkait. Salah satu contoh analisa kinetika mikro yang sering digunakan adaah metode isotherm adsopsi, dibutuhkan hubungan kesetimbangan antara konsentrasi/tekanan parsial reaktan dan produk di fasa fluida dengan banyaknya reaktan dan produk yang teradsorpsi di permukaan katalis. Hubungan kesetimbangan pada temperatur konstan ini disebut isotherm adsorpsi.
Di dalam adsorpsi kimiawi, ada beberapa jenis isotherm adsorpsi, diantaranya adalah isotherm Langmuir. Isoterm inibiasa di sebut dengan isotherm Langmuir-Hinshelwood-Hougen-Watson. Isotherm ini diturunkan berdasarkan asumsi bahwa keaktifan inti katalis seragam dan adsorpsi yang terjadi adalah reaksi reversible elementer antara adsorbat dengan inti aktif katalis. Tahap penentu laju reaksinya adalah reaksi permukaan antara reaktan-reaktan yang teradsorpsi yang berlangsung sangat lambat, sehingga mengendalikan laju reaksi.
Mekanisme Langmuir ini sering dipakai karena bentuknya sederhana dan hasil yang memadai (Slamet, 1996).
Jenis isotherm adsorpsi yang lain adalah Eley-Rideal.Mekanisme ini terjadi pada kondisi yang sangat vakum, dengan asumsi bahwa salah satu reaktar teradsorpsi secara kimiawi pada inti aktif katalis, sementara reaktan kedua berada pada fasa gas atau fasa teradsorpsi fisik leman (Hinink, 1995; Slamet 1996).
2.4 Kondisi Operasi
Kondisi operasi yang baik akan mengahasilkan produk akhir dari dekomposisi metana yang sesuai harapan. Untuk dekomposisi metana, terdapat dua kondisi operasi yang sangat mempengaruhi hasil akhir, yaitu temperatur dan tekanan.
2.4.1. Temperatur Operasi
Dekomposisi katalitik matanamembutuhkan temperatur yang cukup tinggi. Semakin tinggi temperatur operasi, maka gas metana akan semakin cepat tedekomposisi. Hal ini akan mempengaruhi reaksi ini baik dari segi kualitas maupun kuantitas. Namun di sisi lain, suhu yang tinggi akan mengakibatkan katalis mudah mengalami sintering dan karbon yang dihasilkan akan semakin banyak sehingga deaktivasi katlis juga semakin cepat terjadi.
Meskipun memiliki dampak negatif, penggunaan temperatur tinggi menyebabkan jumlah karbon yang terbentuk akan gmnejadi lebih banyak. Hasil uji produk membuktikan bahwa CNT hanya akan terbentuk pada temperatur lebih tinggi dari pada temperatur terbentuknya karbon nanofiber pada umumnya. Karbon yang terbentuk pada temperatur tinggi lebih teratur dengan ketebalan seragam (Resketenko, 2003), tetapi penambahan temperatur juga akan menyebabkan diameter dan ketebalan dinding dari nanotube yang telah terbentk semakin mengecil (Sinnots, 1999), sedangkan ng diharapkan adalah nanotube
karbon dengan dinding yang tebal. Semuahal ini membuat tidak ada temperatur tertentu yang mutlak untuk reaksi ini. Temperatur optimal untuk reaksi dekompsisi metana agar terbentuk CNT yang diharapkan berada pada temperatur 650-750oC.
2.4.2. Tekanan Operasi
Pada reaksi dekomposisi metana, tekanan operasinya adalah tekanan rendah atau tekanan atmosferik. Hal ini dikarenakan reaksi dekomposisi metana adalah reaksi endotermis dimana penambahan tekanan malah akan menggeser kesetimbangan reaksi ke arah kiri (menambah reaktan).
2.5 Matrix Laboratory (MatLab)
Matrix Laboratory (MatLab) adalah sebuah bahasa programing generasi keempat yang memberikan pengguna sebuah lingkungan untuk perhitungan numeris. MatLab mengintegrasikan komputasi perhitungan, visualisasi dan programing dalam lingkungan yang mudah untuk digunakan dimana masalah dan penyelesaian diekspresikan dalam notasi matematis. MatLab juga merupakan system interaktif yang data dasarnya tidak membutuhkan dimensi. Hal ini memberikan kesempatan pada pengguna untuk menyelesaikan berbagai perhitungan teknis terutama yang memiliki matriks dan vector.
Sistem dari MatLab terdiri dari bagian-bagian utama yaitu: 1. Desktop Tools and Development Environment
2. Mathematical Function Library 3. The Language
4. Graphics
5. External Interfaces
Walaupun matlab bertujuan utama untuk perhitungan numeris, dengan adanya tambahan dari simulink, maka matlab mampu menambahkan simulasi daerah secara grafis, dan desain berbasis dasar model. MatLab digunakan oleh berbagai jenis pengguna berlatar belakang berbeda-beda seperti insinyur, peneliti, dan ekonom. Penelitian ini menggunakan MatLab sebagai perangkat untuk Validasi data kinetik dan proses curve fitting.
Gambar 2. 1 Logo MatLab (www.Matlab.com)
Gambar 2. 2 Tampilan Antarmuka MatLab (www.Matlab.com)
2.6 Regresi Non Linear
Analisa Regresi atau regresi adalah aplikasi dari metode matematis dan statistik untuk menganalisa data eksperimen dan mem-fit model matematis dari
data dengan mengestimasi parameter-parameter yang tidak diketahui dari model. Serangkaian tes statistik yang biasanya menemani analisa regresi, memberikan identifikasi model, verifikasi model dan efisiensi desain dari program eksperimen. Pada regresi non-linear, dalam sebuah penyelesaian, akan ada lebih dari satu parameter yang tidak diketahui dan haris dihitung dengan mem-fit model dengan data eksperimen. Dalam regresi non linear, mungkin saja dilakukan fitting untuk beberapa variable terikat secara bersamaan dengan menggunakan beberapa persamaan terhadap data. (Constantinides, 2000)
Pada regresi non linear, terdapat beberapa teknik untuk meminimalisir jumlah dari kuadrat residu atau nilai sisa. Beberapa metode yang ada akan membantu kita untuk memfit model yang mengandung beberapa variable, terhadap data eksperimen untuk mendapatkan nilai dari parameter model yang memiliki nilai jumlah dari kuadrat residual keseluruhan yang kecil. Ditambah lagi dengan adanya analisa statistik dari hasil regresi, akan mambantu kita untuk :
Menentukan apakah model memuaskan atau tidak dalam eksperimen
Membedakan model yang bersaing
Menentukan ketepatan dari estimasi parameter dengan membangun daerah terpercaya pada ruang parameter
Mengukur korelasi antara parameter dengan meninjau matrix korelasi koefisien
Melakukan tes untuk memverifikasi data eksperimen yang data dari populasi eksperimen yang sama
Melakukan tes untuk memverifikasi apakah residu antara data dan model terdistribusi secara acak.
2.6.1. Metode Marquadt
Marquadt telah mengembangkan sebuah teknik interpolasi antara metode Gauss-Newton dan metode steepest descent. Interpolasi ini didapat dengan menambahkan matriks diagonal (λI) ke matriks (J’J):
(2.2)
Nilai dari λ dipilih dari setiap iterasi sehingga parameter vektor terkoreksi akan menghasilak nilai jumlah dari kuadrat yang lebih kecil dari iterasi yang
bersangkutan. Dapat mudah dilihat bahwa nilai λ yang kecil dibanding elemen matriks (J’J), metode Marquadt akan mendekati metode Gauss-Newton. Sedangkan ketika nilai λ sangat besar, maka metode ini akan mendekati metode
steepest descent, dengan pengecualian faktor skala yang tidak mempengaruhi arah dari parameter koreksi vektor tetapi member nilai step yang kecil.
Berdasarkan Marquadt, nilai Φ yang kecil diinginkan untuk di daerah sekitar fungsi yang dilinearkan untuk memberikan representasi dari fungsi non linear yang memenuhi syarat. Oleh sebab itu metode untuk menentukan λ harus memberikan nilai λ kecil ketika metode Gauss-Newton akan konvergen secara efisien dan nilai λ ketika metode steepest descent dibutuhkan. Metode Marquadt dapat diaplikasikan pada metode Newton. Dalam kasus ini matriks diagonal λI ditambahkan pada matriks Hessian:
(2.3)
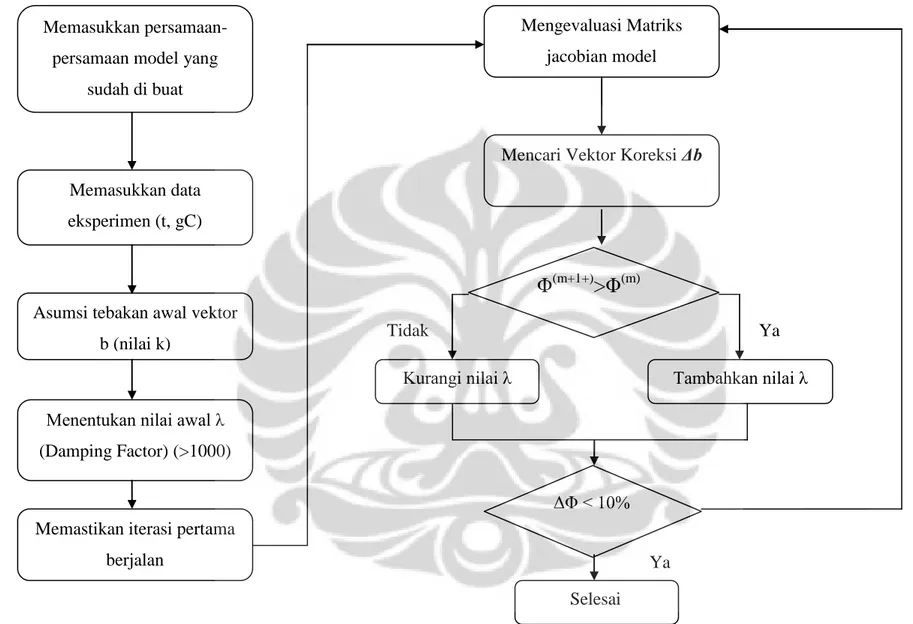
Metode Marquadt memiliki langkah-langkah sebagai berikut: 1. Asumsi tebakan awal parameter vektor b.
2. Menentukan nilai yang besar pada λ, misalkan 1000. Hal ini menunjukkan bahwa iterasi pertama akan didominasi oleh metode steepest descent dan memastukan metode berjalan kenilai jumlah kuadrat residu yang rendah. 3. Mengevaluasi matriks jacobian J dari persamaan model. Juga
mengevaluasi matriks Hessian H jika menggunakan metode Newton. 4. Mencari vektor koreksi Δb.
5. Evaluasi estimasi parameter vektor baru dengan persamaan:
q (2.4)
6. Menghitung nilai baru dari Φ. Jika Φ(m+1) < Φ(m), kurangi nilai λ. Jika Φ(m+1) > Φ(m)
biarkan parameter yang lama [ ] dan tambahkan nilai λ.
7. Ulangi langkah 3 sampai 6 hingga salah satu atau kedua kondisi ini terpenuhi:
a. Φtidak berubah secara signifikan.
b. Δb menjadi sangat kecil (sesuai dengan nilai lriteria konvergensi).
BAB 3
METODE PENELITIAN
3.1 Diagram Alir Penelitian
Gambar 3. 1 Diagram Alir Penelitian Menentukan Mekanisme Reaksi
Membuat Persamaan laju reaksi dari masing-masing spesies yang
terlibat
Regresi non linear dengan metode
Marquadt pada MatLab Data eksperimen
Konstanta laju reaksi (k1-k11)
pada masing-masing suhu yang terdapat pada data percobaan
Plot ln k terhadap 1/T untuk setiap nilai k (k1-k11)
Nilai pra eksponensial energi aktivasi untuk masing-masing
nilai k (k1-k11)
3.2 Rincian Kegiatan Penelitian
a. Menentukan mekanisme reaksi
Tahap ini diawali dengan menentukan reaksi yang terjadi pada percobaan dekomposisi katalitik metana. Pada penelitian ini, terdapat tiga tahap utama dalam reaksinya yaitu Reaksi di permukaan katalis (Surface Reaction), pembentukan nano karbon (Nano Carbon Forming), dan deaktivasi katalis (Catalyst Deactivation). Pada tahap ini, juga di turunkan persamaan laju yang terjadi pada setiap tahap dalam percobaan. Persamaan laju diturunkan dari reaksi-reaksi yang terjadi pada setiap tahapannya.
b. Pemodelan kinetik
Permodelan dari tahap ini dimaksudkan untuk merumuskan beberapa model persamaanlaju reaksi dekomposisi katalitik metana menjadi hydrogen dan nano karbon. Penyusunan persamana kinetika ini dilakukan berdasarkan metode analisa kinetika yang bertumpu pada metode analisa kinetika mikro yang dijbarkan menurut mekanisme reaksi katalitik yang mungkin terjadi:
Reaksi dekomposisi metana secara keseluruhan (Chen et al, 2001) (3.1) Tahapan reaksi dekomposisi katalitik metana berdasarkan
mekanisme (Reyyan, 2009):
I. Reaksi pada permukaan (Surface Reaction)
1. CH4 + 2S CH3.S + H.S
2. CH3.S + S CH2.S + H.S
3. CH2.S + S CH.S + H.S
4. CH.S + S C.S + H.S 5. 2H.S H2 + 2S
II. Pembentukan nano karbon
6. C.S CNi,F + S 7. C C
8. CNi,R Cf
III. Deaktivasi katalis
9. nC.S nCP
Penjabaran dari penurunan model persamaan kinetika reaksi dekomposisi katalitik metana dapat dilihat pada lampiran A. Tabel 3.1 adalah ringkasan model persamaan laju reaksi dekomposisi katalitik metana menjadi hidrogen dan nano karbon berdasarkan mekanisme reaksi:
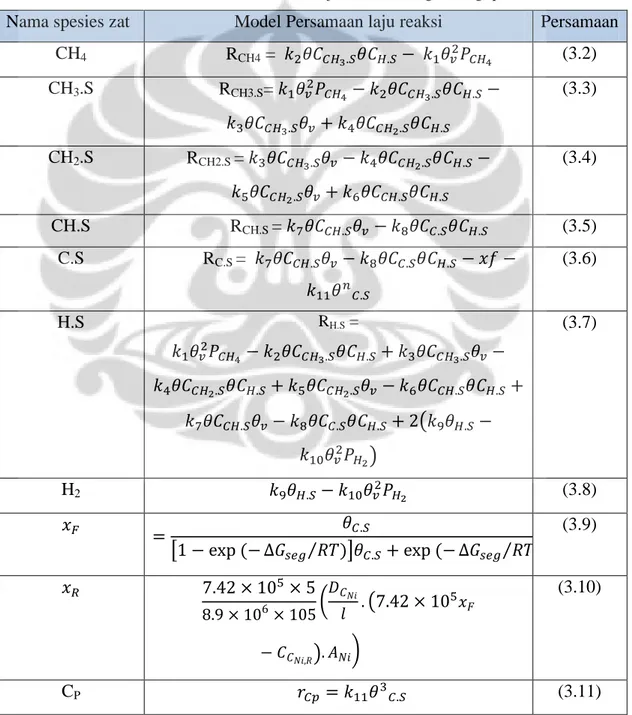
Tabel 3. 1 Tabel Model Persamaan Laju Reaksi Masing-Masing spesies zat
Nama spesies zat Model Persamaan laju reaksi Persamaan
CH4 RCH4 = (3.2) CH3.S RCH3.S= (3.3) CH2.S RCH2.S = (3.4) CH.S RCH.S = (3.5) C.S RC.S = (3.6) H.S RH.S = (3.7) H2 (3.8) (3.9) (3.10) CP (3.11)
Seluruh persamaan yang terdapat pada tabel 3.1, akan dimasukkan kedalam program yang sudah di buat terlebih dahulu di Matlab. Persamaan-persamaan inilah yang akan di cari solusinya setelah parameter-parameter (k1 – k11) di tebak nilai awalnya terlebih dahulu.
c. Regresi non linear dengan menggunakan metode Marquadt
Pada tahap ini, dilakukan regresi untuk menentukan parameter-parameter yang masih belum diketahui. Tahap ini diawali dengan melakukan regresi non linear terhadap data yang sudah di dapat dengan menggunakan metode Marquadt. Kemudian dilakukan trial and error
untuk mendapatkan nilai parameter-parameter kinetik yang paling kecil nilai error nya atau dalam grafik akan menghasilkan bentuk yang paling sesuai dengan persebaran data yang ada. Tahap ini dilakukan pada perangkat lunak Matrix Laboratory. Fitting model dilakukan dengan cara menyelesaikan persamaan-persamaan model secara bersamaan. Kemudian hasil utama dari model yang berupa jumlah karbon yang terbentuk selama rentang waktu tertentu. Hasil simulasi kemudian akan dicocokan dengan data eksperimen yang ada.
Berikut ini adalah algoritma dari regresi yang dilakukan:
19
Asumsi tebakan awal vektor b (nilai k)
Memasukkan data eksperimen (t, gC) Memasukkan
persamaan-persamaan model yang sudah di buat
Menentukan nilai awal λ (Damping Factor) (>1000)
Mengevaluasi Matriks jacobian model
Mencari Vektor Koreksi Δb
Φ
(m+1+)>Φ
(m)Memastikan iterasi pertama berjalan Tambahkan nilai λ ΔΦ < 10% Selesai Ya Tidak Ya Tidak Kurangi nilai λ
Gambar 3. 2 Algoritma Program Regresi Non Linear
20 d. Penentuan nilai parameter kinetik
Pada tahap ini, setelah didapatkan nilai konstanta laju reaksi dari masing-masing suhu, nilai parameter kinetik akan didapatkan dengan memplot nilai ln k (konstanta laju reaksi) yang didapat terhadap 1/T, sehingga nanti akan didapatkan nilai pra eksponensial dan nilai dari energi aktivasi dari masing-masing konstanta laju reaksi.
BAB 4
HASIL DAN PEMBAHASAN
Hasil dari penelitian ini akan ditampilkan, dianalisis dengan jelas. Hasil penelitian ini berupa nilai parameter kinetik dari reaksi dekomposisi katalitik metana yang dilakukan dalam eksperimen. Mekanisme reaksi kimia akan menghasilkan parameter kinetik setelah hasil dari model dibandingkan dengan data eksperimen. Dengan mensimulasikan dengan variasi suhu, akan didapatkan juga nilai pra eksponensial dan energi aktivasi dari reaksi yang dimodelkan pada penelitian ini.
4.1 Mekanisme Reaksi
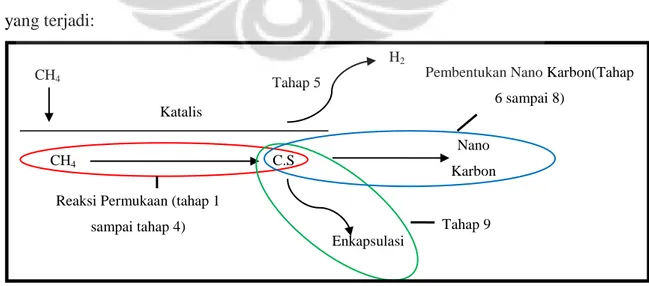
Mekanisme reaksi yang digunakan pada penelitian ini didasarkan pada mekanisme reaksi milik Reyyan (2009), dimana pada model reaksi dekomposisi katalitk metana ini, reaksi dibagi menjadi tiga bagian utama yaitu reaksi di permukaan katalis yaitu reaksi pemutusan – pemutusan atom hidrogen dari metana, pembentukan nano karbon yang terdiri dari larutnya atom karbon dalam katalis, difusi karbon dari bagian depan katalis ke bagian belakang katalis, serta pembentukan nano karbon itu sendiri, dan reaksi yang terakhir adalah enkapsulasi katalis, dimana sebagian atom karbon akan membentuk sebuah lapisan karbon yang akan menutupi katalis. Berikut ini adalah ilustrasi dari keseluruhan reaksi yang terjadi:
Gambar 4. 1 Ilustrasi Keseluruhan Reaksi CH4 CH4 C.S H2 Nano Karbon Enkapsulasi Katalis
Reaksi Permukaan (tahap 1 sampai tahap 4)
Pembentukan Nano Karbon(Tahap 6 sampai 8) Tahap 5 Tahap 9
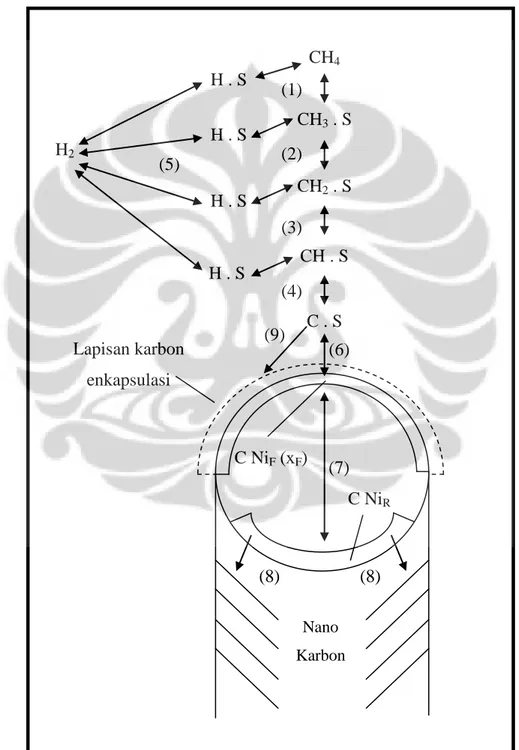
22 Pada reaksi ini, hidrogen yang sudah terlepas dari karbon dapat berikatan kembali dengan karbon pada permukaan katalis sehingga dapat terjadi proses desorpsi dari karbon terhadap katalis. Proses hidrogenasi ini akan terjadi pada setiap intermediate selama di reaksi permukaan katalis.. Gambar 4.2 adalah skema mendetail mekanisme yang digunakan:
Gambar 4. 2 Skema Mekanisme Detail Dari Reaksi yang Digunakan Dalam Model
Nano Karbon (8) (8) (7) C NiF (xF) C NiR (xR) CH4 CH3 . S CH2 . S CH . S C . S (6) (1) (2) (3) (4) H . S H . S H . S H . S (9) (5) H2 Lapisan karbon enkapsulasi
23
4.1.1 Reaksi di permukaan
Pada model, reaksi di permukaan terdiri dari reaksi elementer yang terjadi di permukaan nikel atau katalis seperti yang tersaji pada Gambar 4.3 hingga 4.7 yaitu:
CH4 + 2S CH3.S + H.S (4.1)
Pada tahap ini, metana yang berada di permukaan katalis akan mengalami dehidrogenasi, dimana salah satu atom hidrogen yang berikatan pada karbon akan diputus atom hidrogen tersebut akan menempel pada sisi aktif katalis dan
intermediate CH3 (CH3.S) terbentuk.
CH3.S + S CH2.S + H.S (4.2)
Gambar 4. 4 Reaksi Pemutusan Hidrogen dari Metana Tahap 2 CH3 Ni Ni CH2 H H H
Gambar 4. 3 Reaksi Pemutusan Hidrogen dari Metana Tahap 1 CH4 Ni Ni CH3 H
24 Pada tahap ini, intermediate CH3 (CH3.S) yang berada di permukaan katalis
akan mengalami dehidrogenasi, dan menghasilkan intermediate CH2 ( CH2.S).
CH2.S + S CH.S + H.S (4.3)
Pada tahap ini, intermediate CH2 ( CH2.S) yang berada di permukaan katalis
akan mengalami dehidrogenasi, dan menghasilkan intermediate CH (CH.S).
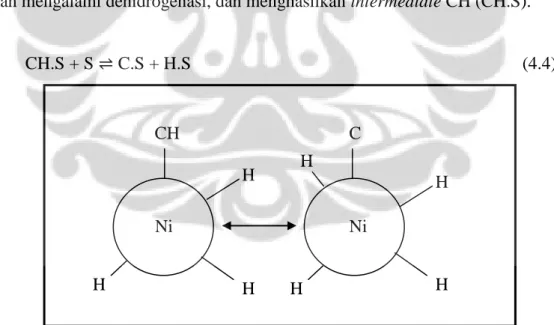
CH.S + S C.S + H.S (4.4)
Pada tahap ini, intermediate CH (CH.S) yang berada di permukaan katalis akan mengalami dehidrogenasi, dan menghasilkan intermediate C (C.S).
2H.S H2 + 2S (4.5)
Gambar 4. 6 Reaksi Pemutusan Hidrogen dari Metana Tahap 4 H CH Ni Ni C H H H H H H
Gambar 4. 5 Reaksi Pemutusan Hidrogen dari Metana Tahap 3 H CH2 Ni Ni CH H H H H
25
Pada tahap ini, seluruh atom hidrogen yang sudah terlepas dari karbon akan berikatan satu sama lain, dan membentuk gas hidrogen
4.1.2 Pembentukan Nano Karbon
Reaksi pada permukaan katalis akan menghasilkan atom karbon yang teradsorb (C.S) dimana spesies ini akan terlarut kedalam partikel nikel pada fasa gas dan akan berdifusi dari bagian depan ke bagian belakang dari partikel nikel, kemudian membentuk nano karbon. Pada model ini, tahapan yang meliputi bagian pembentukan nano karbon adalah sebagai berikut:
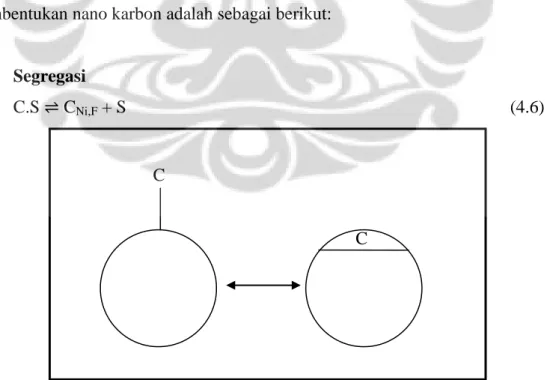
Segregasi
C.S CNi,F + S (4.6)
Gambar 4. 8 Segregasi Karbon yang Terikat pada Katalis ke Bagian Depan Katalis C
C
Gambar 4. 7 Pembentukan Gas Hidrogen dari Atom H yang Terikat dengan Inti Aktif
Ni Ni H2 H H 2 H H H
26 Pada bagian depan nikel, sebuah laspisan dengan konsentrasi karbon yang tinggi akan terbentuk karena sifat segregasi karbon dalam nikel. Permukaan yang kaya akan karbon, dan konsentrasi karbon di permukaan akan berkurang. Konsentrasi dari karbon yang terlarut dapat digambarkan dengan isotherm segregasi. Untuk atom karbon kompleks dengan sisi aktif, “C.S”, dapat digambarkan sebagai atom karbon yang teradsorb. Terdapat persamaan Langmuir untuk segregasi digunakan untuk menentukan nilai konsentrasi karbon pada lapisan segregasi atau konsentrasi karbon pada bagian depan katalis.
(4.7)
(4.8)
Dimana Dimana θC.S adalah fraksi dari katalis yang tertutup karbon dan = -45,217-14.24 T (j/mol) (Snoeck et al, 1997).
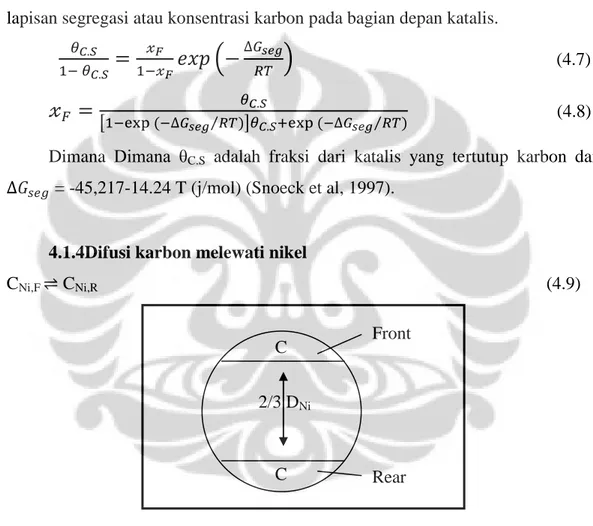
4.1.4Difusi karbon melewati nikel
CNi,F CNi,R (4.9)
Perbedaan dari potensi kimia dari material karbon akan menghasilkan perbedaan dalam tingkat kelarutan pada bagian depan dan belakang katalis (nikel). Hal ini akan menghasilkan gaya dorong utuk difusi karbon melewati nikel. Laju dari difusi dapat ditulis dengan hukum Fick:
(4.10)
Gambar 4. 9 Difusi Karbon Melalui Nikel C C 2/3 DNi Front Rear
27 Dengan jarak rata-rata yang dilewati oleh karbon diasumsikan sebesar 2/3 diameter nikel, = difusivitas karbon dalam nikel, = konsentrasi dari karbon terlarut di nikel pada bagian depan Ni, = konsentrasi dari karbon terlarut di nikel pada bagian belakang Ni dan ANi = Luas Spesifik dari partikel
nikel
4.1.5 Pembentukan nano karbon
CNI,R Cf (4.11)
Reaksi pembentukan nano karbon terjadi terlalu cepat sehingga diasumsikan bahwa seluruh atom karbon yang mencapai bagian belakang dari katalis membentuk nano karbon, Sehingga tahap ini tidak dimasukkan dalam model.
4.1.6 Deaktivasi Katalis
Pada bagian ini, atom karbon yang sudah teradsorb, tidak seluruhnya terlarut dalam katalis. Sebagian dari karbon yang teradsorb akan membentuk sebuah lapisan sehingga mengenkapsulasi permukaan aktif dari katalis. Pada akhirnya, sisi aktif yang tertutup akan meghalangi interaksi antarmuka dari reaktan berfasa gas dalam hal ini metana dan intermediet-intermediet yang ada terhadap sisi aktif
Gambar 4. 10 Pembentukan Nano Karbon Nano Karbon Ni
28 dari nikel atau katalis. Sehingga diasumsikan bahwa perubahan pada penutupan permukaan karena enkapsulasi adalah penyebab utama dari deaktivasi.
Pembentukan karbon yang mengenkapsulasi katalis dapat ditulis sebagai berikut:
nC.S nCp (4.12)
Berdasarkan Chen et al. nilai n yang terbaik adalah tiga (3) dimana nilai ini akan memberikan kecocokan paling tinggi terhadap data yang ada.
4.2 Model Kinetika dan Fitting Model terhadap Data Eksperimen
Model kinetika dari dekomposisi katalitik metana untuk menghasilkan nano karbon terdiri dari tiga bagian besar yaitu reaksi di permukaan katalis, pembentukan nano karbon, dan deaktifasi dari katalis (enkapsulasi). Model kinetika reaksi dekomposisi katalitik metana terdiri dari 7 persamaan diferensial serta 2 persamaan aljabar linear. Dalam model kinetic, persamaan untuk nilai segregasi didapatkan dari data yang diberikan oleh Chen et al (2001). Yaitu:
nilai dari simulasi akan merepresentasikan nilai dari eksperimen (terutama nilai dari jumlah karbon yang terbentuk). Model kinetika ini diselesaikan tanpa menentukan tahap penentu laju reaksi. Model ini juga menggunakan asumsi bahwa seluruh atom karbon yang berdifusi melalui katalis akan membentuk nano karbon hingga katalis terdeaktivasi. (Reyyan, 2009)
Gambar 4. 11 Deaktivasi Katalis karena Enkapsulasi Katalis Cenkapsulasi
29 Model akan disimulasikan dengan menggunakan parameter kinetik yang belum diketahui dan kemudian ditebak dengan menggunakan dasar reaksi maju dan reaksi balik dari dekomposisi metana berdasarkan Snoeck et al (1997) yaitu 8:1 yang merupakan rasio antara reaksi dekomposisi metana dengan reaksi hidrogenasi karbon sehingga menghasilkan metana dengan menggunakan katalis berbasis nikel. Kemudian hasil simulasi akan dibandingkan dengan data. Berikut adalah perbandingan antara model dengan data yang ada:
Gambar 4. 12 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=750 oC
Gambar 4. 13 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=700 oC
-0.05 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0 1000 2000 3000 4000 5000 Ju m lah c ar b o n (gr am ) Waktu (detik) datal model 0 0.05 0.1 0.15 0.2 0.25 0.3 0.00 1000.00 2000.00 3000.00 4000.00 Ju m lah Car b on (g r) Waktu (detik) data model
30
Gambar 4. 14 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=650 oC
Gambar 4. 15 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=600 oC
-0.05 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0 1000 2000 3000 4000 5000 Ju m lah c ar b o n (gr ) Waktu (detik) data model -0.05 0 0.05 0.1 0.15 0.2 0.25 0.3 0 1000 2000 3000 4000 5000 Ju m lah C ar b o n (s) Waktu (detik) data model
31
Gambar 4. 16 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=550 oC
Gambar 4. 17 Fitting Hasil Simulasi Terhadap Data Untuk Karbon yang Terbentuk Terhadap Waktu pada T=500 oC
Simulasi dilakukan dengan menggunakan kriteria konvergensi (Δb) sebesar 10-10 dengan nilai kepercayaan sebesar 95%. Dapat dilihat pada gambar 4.12 hingga 4.17 bahwa secara umum model dan data sudah cukup sesuai dan dapat merepresentasikan apa yang terjadi dalam reaksi tersebut. Asumsi yang
-0.05 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0 1000 2000 3000 4000 Ju m lah c ar b o n (gr ) Waktu (detik) data model 0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18 0 1000 2000 3000 4000 Ju m lah c ar b o n Waktu (detik) data model
32 digunakan untuk membuat model kinetik akan mempengaruhi efisiensi dari model, seperti asumsi bahwa konsentrasi karbon di bagian belakang katalis diasumsikan nol (0) karena atom karbon yang membentuk nano karbon terlalu cepat dalam penggabungannya. Selain itu penyebaran ukuran partikel nikel dan pembentukan nano karbon dianggap seragam (Reyyan, 2009).
4.3 Penentuan Parameter Kinetik (Nilai Pra Eksponensial Konstanta Laju Reaksi dan Energi Aktivasi)
Parameter kinetik dari masing-masing persamaan dalam model didapatkan dengan mencocokan data dengan hasil simulasi dan data eksperimen pada suhu 500oC hingga 750oC. Pada simulasi, akan didapatkan nilai konstanta laju reaksi (k1 hingga k11) untuk suhu yang ada dengan interval 50oC. Berikut ini adalah nilai
dari masing-masing konstanta laju reaksi pada masing-masing suhu:
Tabel 4. 1 Tabel nilai Konstanta Laju Reaksi untuk nilai k1 hingga k11
Suhu (oC) k1 k2 k3 k4 k5
750 8,47E-06 1,05E-06 8,75E-05 1,12E-05 8,43E-04 700 6,12E-06 8,19E-07 6,33E-05 7,17E-06 6,24E-04 650 4,34E-06 5,13E-07 4,12E-05 5,32E-06 4,13E-04 600 3,21E-06 4,17E-07 3,28E-05 4,12E-06 3,21E-04 550 2,00E-06 3,04E-07 2,46E-05 2,65E-06 2,31E-04 500 1,00E-06 1,37E-07 1,09E-05 1,26E-06 1,08E-04
Suhu (oC) k6 k7 k8 k9 k10 k11 750 1,02E-04 8,12E-03 1,00E-03 8,08E-02 1,00E-02 2,00E-02 700 7,55E-05 6,23E-03 7,40E-04 6,19E-02 7,50E-03 9,00E-03 650 5,00E-05 4,42E-03 5,12E-04 4,09E-02 5,00E-03 7,00E-03 600 4,54E-05 3,20E-03 4,08E-04 3,31E-02 4,00E-03 3,00E-03 550 2,66E-05 2,00E-03 2,82E-04 2,12E-02 2,50E-03 8,00E-04 500 1,28E-05 1,20E-03 1,15E-04 1,08E-02 1,25E-03 4,00E-04
Deviasi rata-rata dari keseluruhan nilai K yang didapatkan dari penelitian kurang dari 5%. Berikut ini adalah nilai deviasi dari masing-masing konstanta laju reaksi untuk setiap suhu yang ada:
Tabel 4. 2 Tabel nilai K dan Deviasi Standar pada suhu 750oC
Tabel 4. 3 Tabel nilai K dan Deviasi Standar pada suhu 700oC
Tabel 4. 4 Tabel nilai K dan Deviasi Standar pada suhu 650oC
Tabel 4. 5 Tabel nilai K dan Deviasi Standar pada suhu 600oC
Tabel 4. 6 Tabel nilai K dan Deviasi Standar pada suhu 550oC
Tabel 4. 7 Tabel nilai K dan Deviasi Standar pada suhu 500oC
Nilai k Deviasi k1 8.47E-06 2.54E-07 k2 1.05E-06 5.25E-08 k3 8.75E-05 3.50E-06 k4 1.12E-05 3.58E-07 k5 8.43E-04 4.38E-05 k6 1.02E-04 2.24E-06 k7 8.12E-03 2.92E-04 k8 1.00E-03 4.30E-05 k9 8.08E-02 4.04E-03 k10 1.00E-02 2.70E-04 k11 2.00E-02 0.0006 nilai k deviasi k1 6.12E-06 1.84E-07 k2 8.19E-07 4.10E-08 k3 6.33E-05 2.53E-06 k4 7.17E-06 2.29E-07 k5 6.24E-04 3.24E-05 k6 7.55E-05 1.66E-06 k7 6.23E-03 2.24E-04 k8 7.40E-04 3.18E-05 k9 6.19E-02 3.10E-03 k10 7.50E-03 2.03E-04 k11 9.00E-03 0.00027 nilai k deviasi k1 4.34E-06 1.3E-07 k2 5.13E-07 2.57E-08 k3 4.12E-05 1.65E-06 k4 5.32E-06 1.70E-07 k5 4.13E-04 2.15E-05 k6 5.00E-05 1.10E-06 k7 4.42E-03 1.59E-04 k8 5.12E-04 2.20E-05 k9 4.09E-02 2.05E-03 k10 5.00E-03 1.35E-04 k11 7.00E-03 0.00021 nilai k deviasi k1 3.21E-06 9.63E-08 k2 4.17E-07 2.09E-08 k3 3.28E-05 1.31E-06 k4 4.12E-06 1.32E-07 k5 3.21E-04 1.67E-05 k6 4.54E-05 9.99E-07 k7 3.20E-03 1.15E-04 k8 4.08E-04 1.75E-05 k9 3.31E-02 1.66E-03 k10 4.00E-03 1.08E-04 k11 3.00E-03 0.00009 nilai k deviasi k1 2.00E-06 6E-08 k2 3.04E-07 1.52E-08 k3 2.46E-05 9.84E-07 k4 2.65E-06 8.48E-08 k5 2.31E-04 1.20E-05 k6 2.66E-05 5.85E-07 k7 2.00E-03 7.20E-05 k8 2.82E-04 1.21E-05 k9 2.12E-02 1.06E-03 k10 2.50E-03 6.75E-05 k11 8.00E-04 0.000024 nilai k deviasi k1 1.00E-06 3E-08 k2 1.37E-07 6.85E-09 k3 1.09E-05 4.36E-07 k4 1.26E-06 4.03E-08 k5 1.08E-04 5.62E-06 k6 1.28E-05 2.82E-07 k7 1.20E-03 4.32E-05 k8 1.15E-04 4.95E-06 k9 1.08E-02 5.40E-04 k10 1.25E-03 3.38E-05 k11 4.00E-04 0.000012
Dengan persamaan Arrhenius , dapat diperoleh faktor tumbukan (nilai pra eksponensial), A (molekul/sisi aktif. Detik) dan nilai energi aktivasi, Ea (kJ/mol). Untuk nilai A dan Ea diperoleh dari hasil plot nilai ln (k) dengan (1/T). Hasil pengujian antara ln (k) dengan (1/T) dilakukan pada setiap nilai k agar menghasilkan energi aktivasi untuk masing-masing reaksi pemutusan serta reaksi deaktivasi yang terjadi. Tabel 4.1 menunjukkan hasil pengujian untuk nilai pra eksponensial masing-masing konstanta laju reaksi dan energi aktivasi yang diperoleh:
Tabel 4. 8 Tabel Nilai Pra Eksponensial dan Energi Aktivasi dari Masing-Masing k A (molekul/sisi aktif.detik) Energi Aktivasi (J/mol)
k1 0,005253 54.398,5 k2 0,000426 50.781,91 k3 0,035295 51.047,96 k4 0,006054 53.798,44 k5 0,353101 51.230,87 k6 0,046468 51.746,34 k7 3,092562 50.274,76 k8 0,540101 53.068,26 k9 34,39805 51.180,98 k10 5,139727 52.785.59 k11 0,000219535 104.673,3 .
Untuk hasil plot antara ln k terhadap 1/T untuk setiap nilai k dapat dilihat pada bagian lampiran D.
Dapat dilihat pada tabel 4.1, bahwa nilai pra-eksponensial paling rendah terdapat pada nilai k1 dan k2. Kedua nilai k ini digunakan pada reaksi pemutusan
hidrogen dari gas metana pada tahap satu (1). Reaksi ini merupakan reaksi yang paling lambat diantara seluruh reaksi yang terjadi di permukaan. Sedangkan reaksi paling cepat terjadi pada pemutusan hidrogen yang paling akhir (CH.S C.S).
Nilai Energi aktivasi yang didapat dari hasil simulasi berkisar antara 50.274 j/mol hingga 54.398 J/mol untuk reaksi di permukaan. Nilai ini berbeda dengan nilai energi aktivasi milik Wulan (2011) yang sebesar 67,76 kJ/mol. Perbedaan nilai ini kemungkinan berasal dari model dan asumsi yang digunakan, dimana
35 Selain itu pada model ini tahap pembatas laju tidak ditentukan dan seluruh model di selesaikan secara simultan untuk masing-masing spesies yang telibat dalam reaksi ini.
Nilai energi aktivasi pada penilitian ini menghasilkan nilai yang lebih rendah dibandingkan dengan Zein (2004) yang menyatakan bahwa energi aktivasi reaksi ini adalah 60 kJ/mol. Nilai yang dihasilkan penelitian ini cukup masuk akal jika dibandingkan dengan hasil Zein (2004) karena perbedaan nilai yang didapat tidak besar dan juga karena perbedaan dari katalis yang digunakan. Data eksperimen yang digunakan untuk penelitian ini menggunakan katalis Ni-Cu-Al sedangkan zein menggunakan katalis Ni/TiO2.
BAB 5 KESIMPULAN
Kesimpulan dari Penelitian ini adalah sebagai berikut:
1. Model kinetika reaksi dekomposisi metana dengan katalis Ni-Cu-Al telah berhasil dikembangkan dari mekanisme reaksi elementer milik Reyyan (2009)
2. Model Valid karena memiliki simpangan yang kecil (± 5%)
3. Model kinetika yang dikembangkan adalah model transien yang mempertimbangkan deaktivasi katalis
4. Berikut adalah nilai parameter kinetik yang didapat dari hasil penelitian:
A (molekul/sisi aktif.detik) Energi Aktivasi (J/mol)
k1 0,005253 54.398,5 k2 0,000426 50.781,91 k3 0,035295 51.047,96 k4 0,006054 53.798,44 k5 0,353101 51.230,87 k6 0,046468 51.746,34 k7 3,092562 50.274,76 k8 0,540101 53.068,26 k9 34,39805 51.180,98 k10 5,139727 52.785.59 k11 0,000219535 104.673,3
DAFTAR PUSTAKA
Chen J., Li Y., Qin Y., Chang L. Formation of Bamboo-Shaped Carbon Filaments and Dependence of Their Morphology on Catalys Composition and Reaction Conditions. Carbon 2001;39.1467-1475.
Chen, Jiuling, et al. Production of Cox-free Hydrogen and Nanocarbon by Direct Decomposition of Undiluted Methane on Ni-Cu-Alumina Catalyst. Applied Catalysis: General 2004; 269:178-186.
Constantinides A., Mostoufi N. 2000. Numerical Methods for Chemical Engineers with MATLAB Applications. New Jersey; Prentice Hall
Dai L., 2006. Carbon Nanotechnology. Elsevier B.V.
Hinink, J.P. A Quantitative of Transient Kinetic Experiment: Oxidation of CO by O2/NO on Pt. PhD. Thesis, The Hague, The Netherlands, 1995.
Iijima, S, Carbon Nanotubes : Past, Present, Future. Physica B 2002; 323:1-5. Muradov, N. (2001). Catalysis of Methane Decomposition over Elemental
Carbon. Catalysis Communication, 2, 89 – 94.
Petterson, Joakim, Ove Hjortsberg. Hydrogen storage alternatives: A Technological and Economics Assessment. KFB Reports 1990; Vol 27. Resketenko, T.V., dkk. 2003. Carbon capacious Ni-Cu-Al2O3 catalyst for high
temperature methane decompotition. Applied Catalyst A: General, 247, 51-63.
Reyyan, et al. 2009. Partial Regeneration on Ni-based Catalyst for Hydrogen Production via Methane Cracking Part II: Modelling and Optimization.
Turk J Chem 2009: 33(@ TUBITAK); p. 825-841. S.B. Sinnots, dkk, Chem. Phys. Lett. 315 (1999) 25
Slamet, Studi Kinetika Reaksi Reformasi Metana dengan Karbon DIoksida Menggunakan Katalis Ni/Al2O3. Tesis Magister UI 1996.
Snoeck, et al. 1997. Kinetic Study of the Carbon Filament Formation by Methane Cracking on a Nickel Catalyst. England
Song L. Pengaruh keasaman katalis berbasis Ni-Cu terhadap kinerja reaksi dekomposisi katalitik metana menjadi hydrogen dan nanokarbon. Skripsi. Departemen Teknik Gas dan Petrokimia FTUI; 2005.
38 Wulan, Praswasti PDK, Reaksi Dekomposisi Metana Dengan Katalis Ni-Cu-Al Untuk Produksi Carbon Nanotube : Kinetika Reaksi dan Pemodelan Reaktor. Disertasi. Departemen Teknik Kimia FTUI; 2011
Zein, S. H. S., Mohamed, A. R., and Sai, P. S. T., (2004), Kinetic Studies on Catalytic Decomposition of Methane to Hydrogen and Carbon over Ni/Tio2 Catalyst, Ind. Eng. Chem. Res., 43, pp. 4864-4870
LAMPIRAN A PENURUNAN PERSAMAAN MODEL 1. CH4 + 2S CH3.S + H.S dikalikan
Ctotk’1 = k1 dan Ctotk’2 = k2 r1 = 2. CH3.S + S CH2.S + H.S dikalikan k’ k’
40 r2 = 3. CH2.S + S CH.S + H.S dikalikan
Ctotk’5 = k5 dan Ctotk’6 = k6 r3 = 4. CH.S + S C.S + H.S dikalikan
Ctotk’7 = k7 dan Ctotk’8 = k8