i
LAPORAN AKHIR PENELITIAN
PNBP FAKULTAS MIPA
Determinasi Struktur Molekul Senyawa Antibakteri dari Actinomycetes
Endofit serta Karakterisasi Molekular Gen Penciri Spesies Terseleksi
Ketua/Anggota Tim:
Dr. Alimuddin Ali, S.Si, M.Si (NIDN. 0031126906)
Dr. A. Mu’nisa, S.Si, M.Si (NIDN. 0026057203)
Andi Irma Suryani, S.Pd, M.Si (NIDN. 0001108701)
Dibiayai oleh:
DIPA Universitas Negeri Makassar
Nomor: SP DIPA – 042.01:2.400964/2017, tanggal 7 Desember 2016.
Sesuai Surat Keputusan Rektor Universitas Negeri Makassar
Nomor: 2324/UN36/LT/2017 tanggal 02 Mei 2017
UNIVERSITAS NEGERI MAKASSAR
OKTOBER 2017
iii
RINGKASAN
Karst (limestone) merupakan daerah yang termasuk ekologi langka karena tidak semua negara memiliki ekosistem unik ini. Indonesia, khususnya Sulawesi Selatan dikenal sebagai wilayah yang memiliki ekosistem karst terbesar kedua setelah Cina. Keragaman dan keunikan tanaman yang tumbuh pada daerah ini menjadi sumber menarik untuk melakukan eksplorasi mikrobia khususnya mikrobia Actinomycetes endofit tanaman karst.
Keragaman Actinomycetes endofit yang sangat tinggi menyebabkan kesulitan untuk mengidentifikasi baik pada aras genus maupun spesies. Secara konvensional, identifikasi bakteri termasuk Actinomycetes membutuhkan waktu lama dan biaya mahal. Berbagai pendekatan dilakukan untuk melakukan identifikasi dan skrining mikrobia yang lebih efektif dan efisien. Pendekatan melalui analisis gen untuk identifikasi mikrobia merupakan salah satu teknik identifikasi yang digunakan untuk menemukan mikrobia penghasil senyawa bioaktif yang potensial (Muramatsu, 2008). Penggunaan metode analisis gen tertentu dapat digunakan untuk membedakan kelompok mikrobia, baik pada aras genus, spesies maupun strain. Metode yang telah banyak digunakan adalah sidik jari DNA (DNA fingerprinting).
Untuk mencapai tujuan penelitian tersebut, maka langkah yang dilakukan antara lain mengamplifikasi gen target PKS dan gen 16SrRNA untuk selanjutnya dilakukan sekuensi dan ditentukan homologi dengan gen yang telah diketahui pada data gene bank. Isolat Actinomycetes target digunakan untuk produksi dan purifikasi senyawa antifungi. Selanjutnya dilakukan purifikasi senyawa antifungi untuk proses determinasi dan kecocokan antara homologi gen dengan antifungi yang diperoleh. Purifikasi dilakukan dengan menggunakan metode purifikasi standar dengan pendekatan tingkat kepolaran senyawa target. Hasil penelitian menunjukkan bahwa waktu optimum produksi senyawa antibakteri terbaik sebagai antibakteri dalam menghambat pertumbuhan S.aureus yaitu pada hari ke 11 dengan diameter zona hambatan sebesar 31,57 dan berat biomassa 0,204 gram. Ekstrak hasil preparatif fraksi 10-6 memilki nilai Minimum Inhibitory Concentration (MIC) sebesar 0,0009765625 mg/mL (0,0587 µg/ paper disc) dengan luas zona hambat sebesar 8,2 mm terhadap bakteri S. aureus. Uji fitokimia senyawa antibakteri berbentuk kristal jarum dan berwarna kuning keemasan menunjukkan hasil positif terhadap pereaksi Meyer dan wagner yang tergolong senyawa alkaloid. Dan analisis spektrofotometer FT-IR menunjukkan bahwa senyawa tersebut mengandung gusus –CH alifatik, C≡N, ikatan rangkap C=C aromatik, C-N dan gugus –NH. Keberadaan atom N merupakan salah satu ciri khusus senyawa alkaloid.
iv
PRAKATA
Segala puji dan syukur saya panjatkan ke hadirat Allah, SWT, Tuhan Yang Maha Kuasa atas berkah dan karuniaNya, sehingga Laporan Kemajuan Penelitian ini dapat diselesaikan sesuai dengan rencana yang telah ditetapkan. Penelitian ini merupakan upaya untuk mengeksplorasi kelompok Actinobacteria endofit dari tumbuhan ekosistem karst yang berpotensi menghasilkan senyawa antimikroba. Penulis berharap hasil penelitian ini dapat dimanfaatkan oleh berbagai pihak yang berkepentingan.
Penelitian ini dapat terlaksana dan diselesaikan atas bantuan dari berbagai pihak, oleh karena itu Tim Peneliti mengucapkan banyak terima kasih dan penghargaan yang setinggi-tingginya kepada :
1. Rektor Universitas Negeri Makassar, selaku penanggungjawab institusi untuk pelaksanaan kegiatan penelitian
2. Ketua Lembaga Penelitian (Lemlit) Universitas Negeri Makassar, yang telah memberi bantuan dalam pelaksanaan penelitian.
3. Dekan dan Ketua Jurusan Biologi FMIPA Universitas Negeri Makassar, atas izin dan fasilitasi yang diberikan sehingga penelitian ini dapat terlaksana.
4. Bapak/Ibu Laboran di Laboratorium Mikrobiologi dan Bioteknologi, Jurusan Biologi FMIPA Universitas Negeri Makassar atas bantuan teknis yang diberikan selama kegiatan penelitian ini dilakukan
5. Kepada semua pihak terutama rekan-rekan yang tidak dapat dituliskan satu-per satu atas segala bantuan baik secara langsung maupun tidak.
Akhirnya, semoga penelitian ini dapat memberi manfaat yang sebesar-besarnya bagi semua pihak.
Makassar, 27 Oktober 2017 TIM PENELITI PNBP UNM
v DAFTAR ISI Hal. HALAMAN PENGESAHAN ii RINGKASAN iii PRAKATA iv DAFTAR ISI v DAFTAR TABEL vi
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
BAB I. PENDAHULUAN 1
A.Latar Belakang 1
B. Tujuan Penelitian 1
BAB II. TINJAUAN PUSTAKA 2
A. Karakteristik Actinomycetes 4
B. Actinomycetes sebagai Penghasil Antibakteri. 5
BAB III. TUJUAN DAN MANFAAT PENELITIAN 6
BAB IV. METODE PENELITIAN 7
A. Prosedur Penelitian 7
B. Penentuan waktu produksi antibakteri Actinomycetes sp. 7 C. Fermentasi dan ekstraksi senyawa antibakteri 8
D. Pengujian kromatografi lapis tipis (KLT) 9
E. Fraksinasi dengan Kromatografi Kolom Cair Vakum (KKCV) 9 F. Pengujian Minimum Inhibitory Concentration (MIC) 10 G. Karakterisasi genotipe isolat Actinobacteria terpilih 11
BAB V. HASIL DAN PEMBAHASAN 12
BAB VI. KESIMPULAN DAN SARAN 30
DAFTAR PUSTAKA 31
vi
DAFTAR TABEL
No Tabel Uraian Hal
1 5.1 Pengaruh lama waktu fermentasi dengan aktivitas senyawa antibakteri dan jumlah biomassa yang dihasilkan.
13 2 5.2 Fraksinasi Kromatografi Kolom Cair Vakum (KKCV)
menggunakan eluen dengan perbandingan yang berbeda.
16
3 5.3 Fraksi hasil gabungan dari fraksi KKCV 17
4 5.4 Uji Golongan sampel F10-6 dan fraksi 111 hasil kromatografi flash
18 5 5.5 Nilai Konsentrasi Hambatan Minimum/Minimum
Inhibitory Concentration (MIC) ekstrak KMR-1E terhadap
bakteri uji S. aureus
21
vii
DAFTAR GAMBAR
No Gambar Uraian Hal
1 5.1 Hasil uji antagonis terhadap bakteri uji: (A)
Staphylococcus aureus, (B) Escherichia coli
12 2 5.2 Grafikkorelasi lama fermentasi terhadap luas zona
hambatan dan berat biomassa yang dihasilkan Isolat
Actinomycetes sp. Strain KMR-1E.
13 3 5.3 Hasil uji aktivitas ekstrak etil asetat isolat Actinomycetes
spstrain KMR 1E dengan waktu fermentasi berbeda terhadap bakteri uji: (A) Staphylococcus aureus; (B)
Escherichia coli
14
4 5.4 Ekstrak hasil fermentasi:(A) Ekstrak dari biomassa dengan pelarut metanol; (B) Ekstrak dari medium fermentasi dengan pelarut etil asetat.
14 5 5.5 Kromatogram KLT sebelum kromatografi kolom vacum
cair (KKCV)dengan eluen etil asetat: n-heksan (8:2).
15 6 5.6 Kromatogram fraksi hasil KKCV yang dielusi dengan
eluen etil asetat: n-hexane (8:2, v/v).
16 7 5.7 Fraksi gabungan hasil fraksinasi A) Vial 1, F-10; vial 2,
F-6; B) Vial 1: hasil penguapan F-10; Vial 2: Kristal hasil penguapan F-6.
17 8 5.8 Uji pereaksi meyer dan wagner: A) Sampel F10-6; B)
Sampel fraksi 111 hasil kromatografi flash
18 9 5.9 Hasil KLT-Bioautografi ekstrak kasar etil asetat KMR-1E
terhadap bakteri uji Staphylococcus aureus:Kombinasi eluen yang digunakan: A) Etil asetat: metanol (8:2); B) Etil asetat: metanol (9:1); C) Etil asetat: metanol (6:4).
19
10 5.10 Kromatogram yang telah dielusi dan hasil uji KLT-bioautografi ekstrak hasil flash. A) Kromatogra hasil elusi etil asetat 100%; B) Noda dibawah UV λ 254; C)
Noda dibawah UV λ 366; C) Hasil KLT-Bioautografi hasil
flash.
20
11 5.11 Zona bening yang terbentuk disekeliling paper disc
menggunakan mikroba uji S. aureus. Ekstrak diencerkan hingga 11 kali pengenceran.
21
viii
DAFTAR LAMPIRAN
No Lampiran Uraian Hal
1 Lamp 1 Susunan Organisasi Tim Peneliti/Pelaksana dan Pembagian Tugas
34
2 Lamp 2 Surat Kontrak Penelitian 35
3 Lamp 3 Surat Izin Penelitian 36
1
BAB I. PENDAHULUAN
Penyebaran penyakit infeksi masih menempati peringkat teratas pada negara-negara berkembang seperti Indonesia, sehingga dibutuhkan biaya penanggulangan yang cukup besar terutama untuk pengadaan obat-obat golongan antibiotika. Selama ini antibiotika yang umum digunakan adalah golongan antibakteri dan antifungi. Pengobatan penyakit infeksi dengan pemberian antibiotika tertentu ditemukan beberapa masalah terutama hipersensitif dan kecenderungan resistensi mikrobia penyebab infeksi. Beberapa jenis mikrobia (bakteri dan fungi) telah mengembangkan sistem resistensi terhadap berbagai jenis antibiotika. Mikrobia berusaha dengan berbagai strategi untuk mencegah efek penghambatan terhadap antibiotika serta memiliki perangkat yang sangat efisien untuk menyebarkan sifat resistensi tersebut pada turunanya sehingga menimbulkan terbentuknya patogen resisten (Giamarellou & Antoniadou, 1997). Sistem resistensi tersebut dikembangkan oleh mikrobia melalui beberapa mekanisme misalnya penghambatan pembentukan dinding sel bakteri (Allen dan Nicas, 2003), penghambatan sintesis ribosom bakteri (Krist & Showsh, 2007) perubahan struktur senyawa antibiotika melalui pembentukan -Laktamase (Baquero et al, 1997; Melano et al, 2003), perubahan struktur gen dalam selnya (Witte, 1997; Davelos et al, 2004) serta gangguan pembentukan sterol membran sel fungi (Lemriss et al, 2003).
Penelitian untuk mencari antimikrobia baru yang aman dan memiliki potensi besar merupakan salah satu tantangan bagi industri farmasi saat ini, khususnya yang berkaitan dengan peningkatan infeksi opurtunistik pada inang (Badji et al, 2006). Ketersediaan antibiotik dan senyawa-senyawa kemoterapi lainnya merupakan suatu hal yang menggembirakan baik saat ini maupun yang akan datang, akan tetapi hal tersebut tidaklah mencukupi. Permasalahan utama yaitu harus tersedia bahan-bahan pengobatan baru yang memiliki potensi lebih baik dibanding dengan yang ada saat ini (Allen dan Nicas, 1997). Salah satu upaya yang dapat dilakukan adalah melakukan skrining senyawa bioaktif pada berbagai organisme atau melakukan modifikasi terhadap senyawa yang sudah ada (Breithaupt, 1999).
Actinomycetes merupakan salah satu sumber metabolit bioaktif yang sangat menarik. Meski laju penemuan senyawa baru cenderung menurun akibat kajian secara ekstensif pada kelompok actinomycetes, namun penemuan spesies-spesies
2
baru justru berpotensi besar ditemukan pula metabolit baru (Suzuki et al, 2000; Takahashi dan Omura, 2004). Sejarah penemuan obat-obatan baru menunjukkan adanya fakta bahwa dalam banyak kasus, rangka molekul baru justru ditemukan berasal dari golongan actinomycetes (Badji et al, 2006). Mikami et al, 2000, actinomycetes tidak hanya dihasilkan oleh golongan yang non patogen tetapi juga dihasilkan oleh actinomycetes patogen opurtunistik.
Secara konvensional, upaya identifikasi bakteri termasuk actinomycetes membutuhkan waktu yang sangat lama, biaya dan kerja yang sangat banyak. Upaya yang dilakukan adalah pendekatan berbasis biologi molekuler, misalnya analisis dan determinasi gen kunci yang bertanggung jawab terhadap pembentukan suatu metabolit sekunder. Selain itu pengembangan teknik skrining mikrobia penghasil senyawa bioaktif seperti antimikrobia telah dilakukan melalui pendekatan molekuler untuk menghasilkan metode yang efektif dan efisien (Muramatsu, 2008). Secara umum senyawa bioaktif khususnya antimikrobia merupakan kelompok senyawa poliketida dan non ribosomal peptida (Mc Daniel et al., 2005). Kajian molekuler menunjukkan adanya gen-gen tertentu yang bertanggung jawab terhadap biosintesis senyawa bioaktif pada kelompok actinomycetes. Actinomycetes menghasilkan sebagaian besar senyawa bioaktif yang merupakan senyawa tergolong poliketida dan non ribosomal peptida. Ayuoso dan Genilloud (2005) melaporkan hasil amplifikasi terhadap kedua gen tersebut dan diketahui mikrobia yang memiliki kedua gen tersebut mempunyai keragaman metabolit sekunder dan keragaman genetik yang berbeda.
3
BAB II. TINJAUAN PUSTAKA
Penelitian untuk mencari senyawa baru atau senyawa penuntun (guide
compounds) yang memiliki potensi bioaktif merupakan salah satu tantangan besar
industri farmasi saat ini, khususnya yang berkaitan dengan peningkatan prevalensi penyakit infeksi, degeneratif maupun penyakit metabolisme (Badji et al, 2006). Salah satu upaya yang dapat dilakukan adalah melakukan skrining senyawa bioaktif pada berbagai jenis organisme khususnya kelompok Actinomycetes (Breithaupt, 1999).
Actinomycetes merupakan salah satu sumber metabolit bioaktif yang sangat
menarik. Meski laju penemuan senyawa baru cenderung menurun akibat kajian secara ekstensif pada kelompok Actinomycetes, namun penemuan spesies-spesies baru justru berpotensi besar ditemukan pula metabolit baru (Suzuki et al, 2000; Takahashi dan Omura, 2004). Sejarah penemuan obat-obatan baru menunjukkan fakta bahwa dalam banyak kasus, rangka molekul baru justru ditemukan berasal dari golongan Actinomycetes (Badji et al, 2006). Barrakate et al, 2002 menyatakan bahwa diperkirakan dua pertiga senyawa antibiotika telah diisolasi dari mikrobia ini, sehingga perlu upaya untuk terus dilakukan skrining senyawa bioaktif baru dari kelompok mikrobia ini.
Meskipun sumber mikrobia telah banyak dieksplorasi khususnya di negara non-tropis, akan tetapi sumber mikrobia dari negara tropis justru belum banyak dieksplorasi padahal keragaman mikrobianya sangat tinggi. Menurut Wang et al., 1999 Actinomycetes di negara tropis sangat besar peluang ditemukan metabolit baru karena beragamnya spesies mikrobia, namun diperlukan strategi khusus untuk menemukan Actinomycetes penghasil senyawa bioaktif tersebut. Hal yang menarik adalah mikrobia yang berasosiasi dengan jaringan tumbuhan yang disebut endofit. Mikrobia endofit dinyatakan sebagai mikrobia yang hidup pada jaringan tumbuhan inang dan memiliki kontribusi interaksi antar keduanya dalam bentuk asosiasi yang saling menguntungkan.
Mikrobia endofit memiliki keunikan karena tidak menyebabkan kerugian pada tanaman sehingga interaksi ini menjadi perhatian utama periset untuk menemukan mikrobia penghasil senyawa bioaktif. Keragaman tanaman maupun mikrobia pada wilayah tertentu menjadi dasar pencarian mikrobia penghasil senyawa bioaktif seperti daerah temperate dan tropis. Penelitian endofit tropika dipicu oleh peranan
4
yang cukup penting dari mikrobia ini terhadap prakiraan keragaman mikrobia global dan dinamika komunitas tanaman sebagai sumber senyawa bioaktif baru serta agen pengendalian biologik untuk penggunaan agrohutani tropik (Hawksworth, 2001; Arnold, 2001). Penemuan mikrobia endofit umumnya difokuskan pada tanaman yang berasal dari daerah iklim sedang (temperate), namun sejumlah peneliti mulai memfokuskan pada tanaman daerah tropik (Rodrigues and Petrini, 1997).
Karakteristik Actinomycetes
Actinomycetes merupakan mikrobia yang pada awalnya digolongkan dalam
kelompok fungi karena morfologi dan perkembangannya yang mirip dengan fungi yang dilihat dari miseliumnya, sehingga Actinomycetes juga disebut ray fungi (Kuster, 1958).Actinomycetes memiliki sel berbentukbulat/coccus (Micrococcus) dan rod-coccus cycle (Arthrobacter), bentuk hifa berfragmen (Nocardia, Rothia) danmiselium bercabang yang berbeda-beda (Micromonospora dan Streptomyces). Selain itu, Actinomycetes juga merupakan bakteri Gram-positif, bersifat anaeraob atau fakultatif, tumbuh lambat dan membutuhkan temperatur 25oC-37oC serta memiliki struktur berupa filamen lembut yang sering disebut hyfa atau mycelia, sebagai mana yang terdapat pada fungi memiliki konidia pada hyfa yang menegak, ada yang bersifat saprofit namun ada yang bersifat parasit atau bersimbiosis mutualisme dengan tumbuhan dan hewan (Goodfellow 1983).
Actinomycetes merupakan bakteri yang bereproduksi dengan pembelahan sel,
rentan terhadap penisilin tetapi tahan terhadap zat antifungi (Rollin & Joseph, 2000). Spora Actinomycetes salah satunyaStreptomyces diketahui tahan terhadap pemanasan kering hingga suhu 120°C, biasanya sifat ini dimanfaatkan dalam uji pendahuluan untuk menghindari atau menghilangkan sejumlah bakteri kontaminan (Takashi, 2003). Dalam penelitian Omura (1977), diketahui spora dari Streptomyces
roseofulvus berukuran sekitar 1µ, memiliki pigmen berwarna kuning pucat
keabu-abuan atau coklat keabu-keabu-abuan yang terlihat pada medium yeast extract-malt extract
agar, oatmeal agar dan salt-starch agar.
Actinomycetesbanyak tersebar di alam seperti di tanah, tumbuhan (endofit),
perairan lautdan guakarst (Oskay et al, 2004; Yamac et al., 2011; Manasa et al., 2014). Selain itu, jumlah Actinomycetesdi tanah dapat dipengaruhi olehlokasi geografis, suhu tanah, jenis tanah, pHtanah, kandungan bahan organik, kegiatan
5
pertanian,aerasi, ketersediaan nutrisi, kelembabandan vegetasi tanah (Arifuzzaman et al, 2010). Kebanyakan genus dari Actinomycetes yang hidup ditanah yaitu
Streptomycesmemiliki kemampuan dalam mengeluarkan bau yang khas seperti tanah
yaitu asam asetat, acetaldehida, etanol, isobutanol, dan isobutil asetat yang sekarang ini sudah diidentifikasi sebagai aroma senyawa utama yang dihasilkan oleh
Streptomyces, bahkan hidrogen sulfida dipercaya berperan dalam pembentukan
aroma tanah yang dikeluarkannya (Goodfellow, 1983). Beberapa genus Streptomyces
memiliki pH optimum pada rentang pH 6,5 sampai dengan 7,5 (James dan Edwards 1997).
Actinomycetes sebagai Penghasil Antibakteri.
Hampir 95% dari 2000 antibiotik yang ada dihasilkan oleh kelas
Actinomycetes, salah satu genusnya adalah Streptomyces (Okami dan Hotta, 1988).
Oskay et al. 2004, menemukan 50 strain Actinomycetes yang berbeda pada sampel ladang pertanian yang diambil dari daerah Manisa di Turki. Ternyata 34% dari keseluruhan isolat berpotensi sebagai penghasil antibiotik, dan 7 isolat menghasilkan antibiotik baru. Saat ini Actinomycetes diketahui sebagai penghasil beberapa metabolit bioaktif yang meliputi antibiotik, antiparasitik, antitumor, insektisida, herbisida, alkaloid, inhibitor, peptide imunoaktif, perantara antitrombosit dan masih banyak lagi (Zhang et al., 2000). Menurut Pandey (2004), Streptomyces dan
Micromonospora merupakan genus Actinomycetes yang dikenal sebagai penghasil
antibiotik terbesar. Sifat yang paling menarik dan dimiliki oleh Streptomyces adalah kemampuan dalam menghasilkan metabolit sekunder seperti antifungi, antibakteri, antivirus, antitumor, antihipertensi (Omura, 2001: Patzer, 2010).
Genus Streptomyces juga merupakan mikroba endofitik yang menjanjikan sebagai penghasil antibiotik (Strobel 2003). Akhir-akhir ini, telah ditemukan strain
Streptomyces endofitik sebagai penghasil antibiotik pertama dari jenis munumbicin
yang diisolasi dari tanaman obat snake vine (Kennedia nigricans) yang digunakan oleh suku aborigin Australia sebagaiobat dan membalut luka pendarahan (Castillo et al, 2002).
6
BAB III. TUJUAN DAN MANFAAT PENELITIAN
Penelitian ini bertujuan untuk mengeksplorasi gen penyandi biosintesis metabolit bioaktif pada mikrobia actinomycetes endofit tumbuhan karst sebagai upaya untuk menemukan mikrobia penghasil senyawa bioaktif dengan kategori noveltis (baru).
7
BAB III. METODE PENELITIAN A.Prosedur Penelitian
Actinomycetes terpilih yang menunjukkan antibakteri kategori kuat ditumbuhkan dalam mediumStarch Nitrate Brothdengan komposisi: (soluble starch 20 g, 2 g KNO3, 2 g NaCl, 0,05 g MgSO4.7H2O, 0,01 g FeSO4.7H2O, 2 g K2HPO4,
aquades 1 L, pH 7,0-7,2 sebelum sterilisasi). Semua bahan dihomogenkan dalam 1 liter aquadest. Sterilisasi medium dengan menggunakan autoklaf pada suhu 121oC selama 15 menit dengan tekanan 2 atm.
B.Penentuan waktu optimum produksi antibakteri Actinomycetes sp.terpilih
Penentuan waktu optimum produksi senyawa metabolit sekunder sebagai antibakteri dari isolat Actinomycetes sp. Strain terpilih diawali dengan menginokulasikan isolat terpilih pada Erlenmeyer 250 mL sebanyak 6 buah dengan 2 kali ulangan yang masing-masing berisikan medium Starch Nitrate Broth (SNB) sebanyak 50 mL dan diinkubasi pada suhu kamar dengan laju penggojokan 100 rpm. Waktu fermentasi isolat Actinomycetes sp. Strain terpilih bervariasi yaitu 5, 7, 9, 11, 13 dan 15 hari. Setelah mencapai usia pertumbuhan, masing-masing kultur fermentasi disaring untuk memisahkan biomassa dengan cairan fermentasi. Biomassa yang telah diperoleh masing-masing ditimbang dan untuk cairan fermentasi yang diperoleh masing-masing diekstraksi menggunakan pelarut etilasetat dengan perbandingan (1:1 v/v) dan diuapkan. Hasil dari penguapan masing-masing ditimbang kembali untuk mengetahui berat ekstrak yang diperoleh dari setiap kultur fermentasi.
Ekstrak dilarutkan kembali dengan pelarut etilasetat dengan mengatur konsentrasi hingga 1000 ppm, yang kemudian akan digunakan dalam pengujian aktivitas antibakteri dengan metode biossay. Adapun data penentuan waktu optimum produksi senyawa antibakteri dari isolat Actinomycetes sp. Strain terpilih dinyatakan dalam kurva pertumbuhan yang terdiri atas hari atau lama fermentasi, biomassa (gr) dan aktivitas antibakteri yaitu zona hambatan (mm).
8
C.Fermentasi dan ekstraksi senyawa antibakteri
Fermentasi diawali dengan membuat prekultur Isolat Actinomycetes sp. Strain terpilih diinokulasikan pada medium cair SNB (soluble starch 20 g, 2 g KNO3, 2 g
NaCl, 0,05 g MgSO4.7H2O, 0,01 g FeSO4.7H2O, 2 g K2HPO4, aquades 1 L, pH
7,0-7,2 sebelum sterilisasi) pada Erlenmeyer 1000 ml dengan volume medium 250 ml dan diinkubasi pada suhu kamar selama 3 hari pada laju penggojokan 100 rpm. Prekultur yang telah dibuat selanjutnya dipindahkan ke fermentor yang berisi medium fermentasi sebanyak 4,5 liter. Medium difermentasi selama 14 hari dengan pH 7 dandalam kondisi teragitasi pada laju penggojokan 100rpm.Setelah fermentasi selama 14 hari, media pertumbuhan Actinomycetes sp. Strain terpilih disaring untuk memisahkan biomassa dan cairan fermentasi (supernatan). Supernatan yang diperoleh di ekstraksi dengan pelarut etil asetat (1:1 v/v) dalam corong pisah 250 mL. Hasil ekstraksi yang diperoleh selanjutnya diuapkan kemudian dilarutkan kembali dengan etil asetat, lalu disimpan pada botol vial untuk digunakan pada proses selanjutnya. Selanjutnya untuk biomassa (pelet) yang diperoleh diekstrak dengan teknik maserasi menggunakan metanol selama 3x24 jam. Pelet dan metanol dipisahkan dengan cara penyaringan menggunakan kertas saring dan ekstrak metanol diuapkan sampai diperoleh ekstrak kering kemudian dilarutkan kembali dengan sedikit metanol, lalu disimpan pada botol vial untuk digunakan pada proses selanjutnya.
D.Pengujian kromatografi lapis tipis (KLT)
KLT dilakukan bertujuan untuk mengetahui pola kromatogram yang terbentuk dari pemisahan senyawa organik pada sampel. Menurut Gritter dkk(1991), KLT juga digunakan untuk mencari eluen yang akan digunakan untuk kromatgrafi kolom. Adapun eluen yang digunakan pada pengujian ini merupakan kombinasi dari beberapa pelarut seperti etil asetat, metanol dan n-heksan dengan perbandingan tertentu dan telah dijenuhkan terlebih dahulu didalam chamber. Ekstrak etil asetat yang diperoleh pada tahapan ekstraksi, ditotolkan pada lempeng KLT (Silica gel plat
Merck 60 F254) yang sebelumnya telah ditentukan batas awal dan batas akhir elusi,
kemudian lempeng dielusi di dalam chamber yang sebelumnya telah dikembangkan dengan eluen etil asetat:n-hexane (8:2, v/v). Selanjutnya lempeng divisualisi di
9
bawah lampu UV λ254 nm dan λ366 nm dengan mengamati pola pemisahan senyawa
yang terbentuk dengan penggunaan eluen yang beragam. Pola yang terbentuk pada lempeng KLT kemudian disemprot menggunakan penampak bercak serium sulfat dan dikeringkan. Eluen yang menghasilkan pemisahan terbaik selanjutnya digunakan sebagai eluen pada kromatografi kolom.
E.Fraksinasi dengan Kromatografi Kolom Cair Vakum (KKCV)
Fraksinasi dilakukan bertujuan untuk memisahkan golongan utama kandungan yang satu dari golongan utama yang lain (Harborne, 1987). Fraksinasi menggunakan dua macam pelarut yang tidak saling bercampur, dimana gabungan dari dua macam pelarut tersebut, telah ditentukan pada saat pengujian KLT yang sesuai, sebagai fasa gerak (eluen) dan silica gel sebagai fasa diam (adsorben). Proses kromatografi kolom diawali dengan melarutkan ekstrak etilasetat sebanyak 0,5 gram bersama dengan silica gel dengan sedikit pelarut etilasetat dan dihomogenkan. Ekstrak yang telah homogen diletakkan pada permukaan silica gel kolom yang telah dipadatkan sebelumnya dan dielusi menggunakan beberapa kombinasi pelarut sebanyak 50 mL secara gradient dan eluen yang mampu berikatan dengan senyawa tertentu yang terdapat pada ekstrak etil asetat akan mengalir melalui kolom.Beberapa fraksi yang dihasilkan dari kromatografi kolom, selanjutnya di KLT kembali untuk memperoleh senyawa murni dengan eluen terbaik yang kemudian hasil perolehan senyawa murni akan digunakan dalam pengujian aktivitas antibakteri, uji fitokimia serta penentuan gugus fungsi berdasarkan analisis FT-IR.
F.Pengujian antibakteri dan KLT-Bioautografi
Aktivitas antimikrobia dapat diketahui dengan metode uji hayati (bioassay
method) mengacu pada metode (Ali, 2009). Pengujian aktivitas mikrobia dilakukan
dengan mengunakan fraksi hasil dari Kromatografi Vakumcair (KVC) yang mengandung senyawa murni terhadap bakteri uji. Menurut Ali (2009), sebanyak 15 μL maserat yang telah diketahui konsentrasinya dimasukkan ke dalam kertas cakram (diameter6 mm) hingga jenuh. Selanjutnya setelah semua pelarut menguap, kertas cakram diletakkan pada permukaan media tumbuh yang telah diinokulasikan dengan mikrobia uji yaitu Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 35218, kemudian disimpan didalam lemari es suhu 4oC selama satu jam bertujuan agar senyawa yang terdapat pada kertas cakram dapat berdifusi dengan baik dalam
10
media tumbuh. Kemudian plate diinkubasi pada suhu 37oC selama 48 jam. Mengamati zona hambatan yang terbentuk disekitar kertas cakram. Zona hambatan yang terbentuk menunjukkan adanya aktivitas antibakteri yang kemudian luas zona hambatan diukur menggunakan jangka sorong. Pengujian KLT-Bioautografi yaitu fraksi yang mengandung senyawa murni hasil dari KVC ditotolkan pada lempeng KLT (silica gel plat Merck 60 F254) yang kemudian dielusi menggunakan pelarut campuran tertentu. Selanjutnya pola yang telah terbentuk pada fasa diam ( silica gel ) dideteksi dibawah sinar UV λ254 dan λ365 nm. Lempeng KLT tersebut diletakkan
pada permukaan medium tumbuh yang sebelumnya telah diinokulasikan pada bakteri uji yaitu Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 35218. Diinkubasi didalam ruang pendingin selama1 jam agar senyawa yang terdapat pada setiap pola yang terbentuk dapat berdifusi dengan baik pada medium pertumbuhan dan selanjutnya diinkubassi pada suhu 37o C selama 2 x 24 jam. Zona hambat yang terbentuk disekitar pola menandakan senyawa sersebut aktif sebagai antibakteri pada bakteri uji.
G.Pengujian Minimum Inhibitory Concentration (MIC).
Penentuan nilai MIC dari senyawa antibakteri Actinomycetes sp. Strain terpilih dilakukan dengan metode pengenceran bertingkat yang mengacu pada Ali (2009). Fraksi yang telah dipreparatif dan mengandung senyawa antibakteri diencerkan dengan pelarut etil asetat hingga diperoleh pengenceran tertinggi (11 pengenceran terakhir). Selanjutnya, setiap hasil pengenceran diinjeksikan pada setiap papper disc
(Ø8 mm) dengan volume injek sebanyak 30 µL. Setiap papper disc yang telah dijenuhkan kemudian diletakkan pada permukaan medium yang telah diinokulasikan bakteri uji Staphylococcus aureus ATCC 25923. Selanjutnya plate diinkubasi didalam ruang pendingin selama1 jam, hal ini dimaksudkan agar senyawa yang terdapat pada papper disc mampu berdifusi sempurna pada medium tumbuh. Plate
kemudian diinkubasi pada suhu 37oC selama 24 jam. Zona bening yang terbentuk pada pengenceran terendah dinyatakan sebagai nilai MIC.
H.Karakterisasi genotipe isolat Actinobacteria terpilih
Sekuen gen 16S rRNA diamplifikasi dengan menggunakan metode PCR dengan Taq DNA Polimerase dan primer 27f
(5’AGAGTTTGATCCTGGCTCAG-11
3’), dan 1492r (5’GGTTACCTTGTTACGACTT-3’). Kondisi mesin PCR diatur sebagai berikut: denaturasi DNA target pada suhu 98oC selama 3 menit dilanjutkan dengan 30 siklus pada suhu 94oC selama 1 menit, annealing primer pada suhu 54oC selama 1 menit, dan ekstensi primer pada suhu 72oC selama 5 menit. Pada akhir siklus, reaksi pencampuran diatur pada suhu 72oC selama 5 menit dan selanjutnya didinginkan pada suhu 4oC. Amplifikasi PCR dideteksi dengan gel elektroforesis agaros dan divisualisasi pada UV iluminator setelah diwarnai dengan etidium bromida.
Data sekuen gen 16S rRNA isolat Actinobacteria penghasil senyawa antifungi yang terpilih dilakukan alignment sequence dengan menggunakan program CLUSTAL-X versi 1.6 (Thompson et al., 1997). Pohon filogeni dikonstruksi dengan membandingkan sekuen 16S rDNA yang diperoleh dari genebank DNA database
(http://www.ncbi.nlm.nih.gov/).
Pohon filogeni dikonstruksi dengan menggunakan program Phylip versi 3.5 dengan algoritma neighbour joining (Saitou & Nei, 1987 cit.Kim et al., 2000; Sembiring, 2009). Pohon filogeni divisualisasi dengan program Treeview. Posisi akar pada pohon tanpa akar (unrooted) ditentukan berdasarkan metode neighbour
joining. Selanjutnya matrik similaritas dan perbedaan jumlah nucleotida gen 16S
rRNA antar tipe spesies dari database dianalisis dengan program Phydit (The
12
BAB V. HASIL DAN PEMBAHASAN
1. Uji Antagonis Isolat Actinomycetes sp.Strain KMR-1terhadap Bakteri Uji
Staphylococcus aureus dan Escherichia coli
Isolat yang digunakan dalam penelitian ini berasal dari endofit tanaman
Ficussp. yang merupakan penciri kawasan karst yang diperoleh dari penelitian
sebelumnya. Dari hasil pengujian dengan menggunakan diffution agar block method
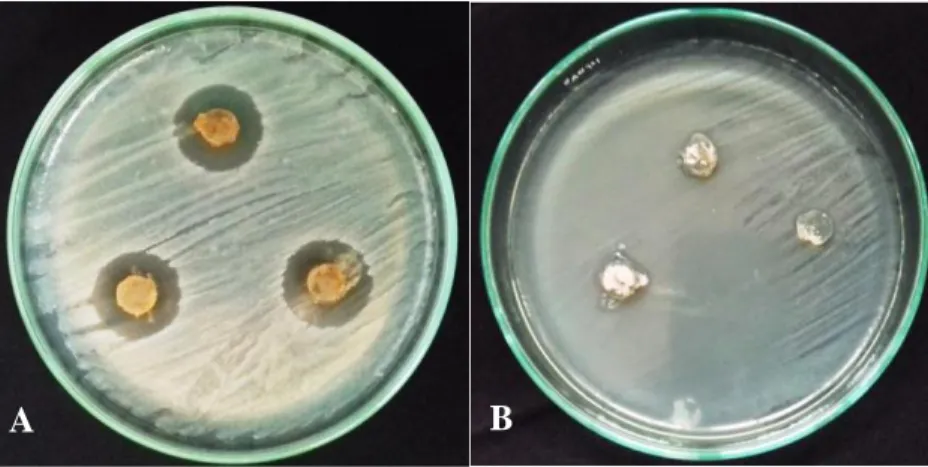
(Ali, 2009) terhadap bakteri uji Staphylococcus aureus dan Escherichia colimenujukkan jika isolat aktif menghambat kedua bakteri ujidengan rata-rata zona hambat yang dihasilkan pada pengujian antagonis terhadap bakteri S. aureus sebesar 23,5 mm dan pada bakteri uji E. coli sebesar 9,8 mm.Profil hasil pengujian antagonis dapat dilihat pada Gambar 5.1.
Gambar 5.1. Hasil uji antagonis terhadap bakteri uji: (A) Staphylococcus aureus,
(B) Escherichia coli
Penentuan Waktu Optimum Produksi Senyawa Antibakteri
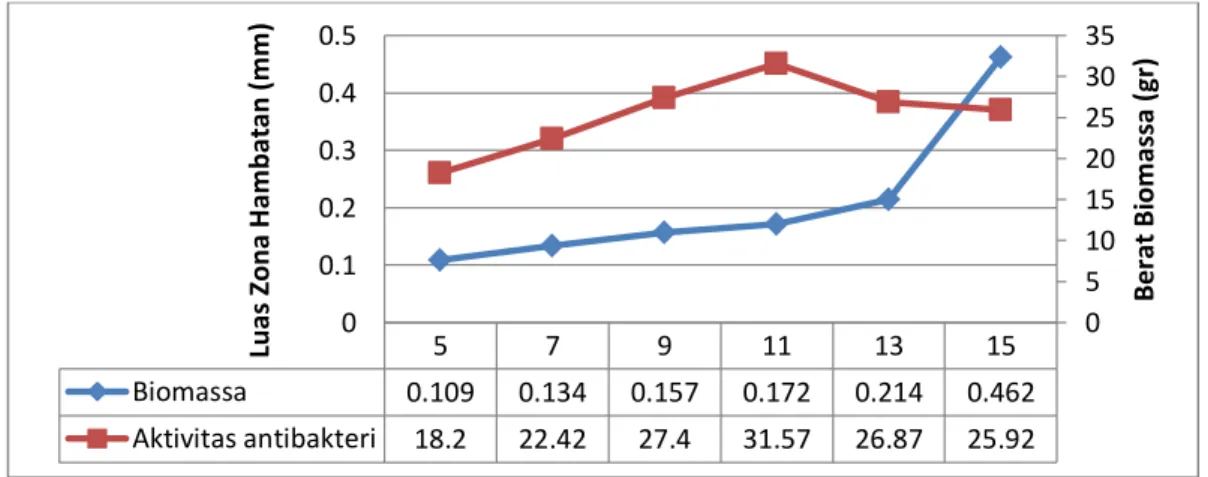
Kultur isolat Actinomycetes sp. strain KMR-1E yang difermentasikan dengan lama fermentasi 5, 7, 9, 11, 13 dan 15 hari, selanjutnya cairan fermentasi diekstraksi menggunakan pelarut etil asetat dengan metode ekstraksi cair-cair (1:1,v/v). Data yang menunjukkan korelasi antara lama waktu fermentasi terhadap aktivitas senyawa antibakteri yang diproduksi serta berat biomassa dapat dilihat pada Tabel 5.1.
13
Tabel 5.1. Pengaruh lama waktu fermentasi dengan aktivitas senyawa antibakteri dan jumlah biomassa yang dihasilkan.
No Hari ke-
Diameter Zona Hambatan (mm)
Biomassa (gr) Escherichia coli Staphylococcus aureus ATCC 35218 ATCC 25923 1 5 - 18.2 0.133 2 7 - 22.42 0.174 3 9 - 27.4 0.180 4 11 - 31.57 0.204 5 13 - 26.87 0.208 6 15 - 25.92 0.258
Keterangan: (-) = tidak ada aktivitas antimikroba
Hasil analisis yang menujukkan korelasi antara waktu optimum pertumbuhan isolat Actinomycetes sp strain KMR-1E pada medium fermentasi dengan produksi senyawa antibakteri dan berat biomassa selanjutnya disajikan dalam bentuk kurva pertumbuhan yang ditampilkan pada Gambar 5.2.
Gambar 5.2 Grafikkorelasi lama fermentasi terhadap luas zona hambatan dan berat biomassa yang dihasilkan Isolat Actinomycetes sp. Strain KMR-1E.
5 7 9 11 13 15 Biomassa 0.109 0.134 0.157 0.172 0.214 0.462 Aktivitas antibakteri 18.2 22.42 27.4 31.57 26.87 25.92 0 5 10 15 20 25 30 35 0 0.1 0.2 0.3 0.4 0.5 Be ra t Bi om assa ( gr ) Lu as Zo n a H am b at an ( m m ) 11
14
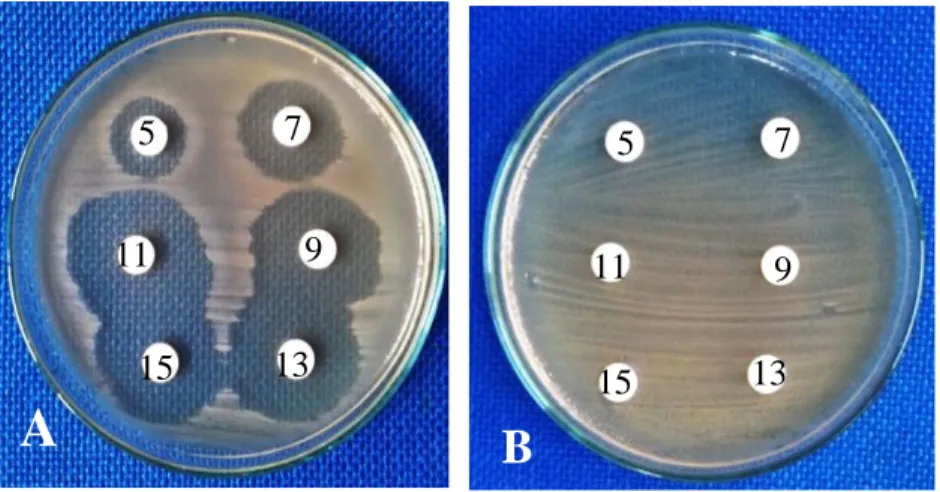
Berdasarkan hasil pengujian yang telah dilakukan, maka tahap lanjutan yang akan dilakukan dalam penelitian ini hanya difokuskan pada ekstrak etil asetat yang memilki aktivitas antibakteri kategori kuat terhadap bakteri uji Staphylococcus
aureus. Profil hasil pengujian ekstrak isolatActinomycetes sp strain KMR-1E
terhadap bakteri uji ditampilkan pada Gambar 5.3.
Gambar 5.3. Hasil uji aktivitas ekstrak etil asetat isolat Actinomycetes spstrain KMR 1E dengan waktu fermentasi berbeda terhadap bakteri uji: (A)
Staphylococcus aureus; (B) Escherichia coli
Hasil Fermentasi dan Ekstraksi
Isolat Actinomycetes spstrain KMR-1E difermentasikan ke dalam medium SNB
(Starch Nitrate Broth) sebanyak 4,5 liter, kemudian diekstraksi menggunakan pelarut
etil asetat (cairan fermentasi) dan pelarut metanol (biomassa) dan dihasilkan berat ekstrak masing-masing 0,231 gr dan 0,235 gr. Ekstrak yang dihasilkan dapat dilihat pada Gambar 5.4.
Gambar 5.4. Ekstrak hasil fermentasi:(A) Ekstrak dari biomassa dengan pelarut metanol; (B) Ekstrak dari medium fermentasi dengan pelarut etil asetat.
A
B
B
A
5 7 9 11 13 15 5 7 11 9 15 1315
Hasil Analisis Kromatografi Lapis Tipis dan kromatografi kolom
Sejumlah senyawa yang terdapat didalam ekstrak kasar isolat KMR-1E akan dipisahkan melalui tahap fraksinasi yang bertujuan untuk memisahkan beberapa senyawa berdasarkan tingkat kepolarannya, dimana senyawa yang bersifat non-polar akan turun terlebih dahulu melalui kolom kromatografi. Sebelum difraksinasi, kedua ekstrak yang diperoleh dari hasil ektraksi cair-cair dan maserasi disatukan menggunakan pelarut etil asetat dan diuji secara kromatografi lapis tipis (KLT), dengan kombinasi pelarut etil asetat: n-heksan dan etil asetat: metanol. Hal ini bertujuan untuk mencari eluen dengan pemisahan terbaik, yang selanjutnya digunakan sebagai eluen dalam proses pemisahan senyawa dengan metode kromatografi kolom. Hasil pemisahan senyawa terbaik melalui kromatografi lapis tipis (KLT) adalah kombinasi eluen etil asetat: n-heksan dengan perbandingan 8:2 (v/v), seperti yang ditunjukkan pada Gambar 5.5.
Gambar 5.5. Kromatogram KLT sebelum kromatografi kolom vacum cair (KKCV)dengan eluen etil asetat: n-heksan (8:2).
Proses fraksinasi pertama menggunakan metode Kromatografi Kolom Cair Vakum (KKCV). Eluen yang diperoleh dari uji KLT digunakan sebagai eluen dengan ulangan sebanyak tiga kalipada metode KKCV yaitu etil asetat: n-heksan (8:2). Metode KKCV menggunakan silika gel G 60 F254 7730 sebanyak 50 gr sebagai
16
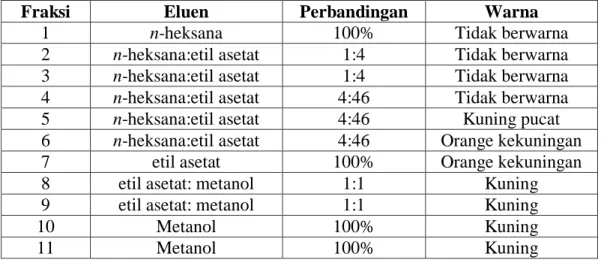
secara bergradien (Step Gradie Polarity). Jumlah fraksi yang diperoleh sebanyak 11 dan diidentifikasi menggunakan metode KLT,dapat dilihat pada Tabel 5.2.
Tabel 5.2. Fraksinasi Kromatografi Kolom Cair Vakum (KKCV) menggunakan eluen dengan perbandingan yang berbeda.
Fraksi Eluen Perbandingan Warna
1 n-heksana 100% Tidak berwarna
2 n-heksana:etil asetat 1:4 Tidak berwarna 3 n-heksana:etil asetat 1:4 Tidak berwarna 4 n-heksana:etil asetat 4:46 Tidak berwarna
5 n-heksana:etil asetat 4:46 Kuning pucat
6 n-heksana:etil asetat 4:46 Orange kekuningan
7 etil asetat 100% Orange kekuningan
8 etil asetat: metanol 1:1 Kuning
9 etil asetat: metanol 1:1 Kuning
10 Metanol 100% Kuning
11 Metanol 100% Kuning
11 fraksi yang dihasilkan pada metode fraksinasi yaitu KKCV, selanjutnya di uji KLT dengan tujuan untuk melihat pemisahan senyawa yang terbentuk berdasarkan fasa diam (silika) dan fasa gerak (pelarut). Kromatogram KLT dengan 11 fraksi dapat dilihat pada Gambar 5.6.
Gambar 5.6.Kromatogram fraksi hasil KKCV yang dielusi dengan eluen etil asetat: n-hexane (8:2, v/v).
Setiap fraksi yang telah di KLT dan menunjukkan profil noda yang sama pada kromatogram hasil KLT, selanjutnya digabungkan sehingga diperoleh 2 fraksiyaitu fraksi F6 dan Fraksi F10. Fraksi F-6 merupakan fraksi hasil gabungan
17
dari fraksi 6, 7 dan 8, sedangkan untuk fraksi F10 merupakan fraksi gabungan dari fraksi 9 dan 10, seperti yang terlihat pada Tabel 5.3.
Tabel 5.3. Fraksi hasil gabungan dari fraksi KKCV
No Fraksi Warna Fraksi gabungan
1 6-8 Orange muda F6
2 9-10 Orange gelap F10
Kedua fraksi yang diperoleh yaitu F6 dan F10 selanjutnya diuapkan. Hasil penguapan pada kedua fraksi tersebut menunjukkan bahwa pada fraksi F6 terlihatadanya kristal kompak berwarna orange kekungingan yang terbentuk disekeliling diding vial. Profil fraksi hasil sebelum dan setelah penguapan dapat dilihat pada Gambar 5.7.
Gambar 5.7. Fraksi gabungan hasil fraksinasi A) Vial 1, F-10; vial 2, F-6; B) Vial 1: hasil penguapan F-10; Vial 2: Kristal hasil penguapan F-6.
Kristal yang terbentuk pada fraksi F6 hasil KKCV selanjutnya difraksinasi kembali dengan metode kromatografi flash dengan bobot fraksi F6 yaitu 16 mg. Fraksi yang diperoleh sebanyak 120 dandiidentifikasi kembali menggunakan metode KLT. Sedangkan untuk fraksi F10 difraksinasi kembali dengan metode KKCV dengan hasil fraksinasi sebanyak 11 fraksi. Fraksi ke 6 atau F10-6 yang merupakan fraksi ke 6 dari fraksinasi F10, terlihat terbentuk kristal yang sama pada F6 yang selanjutnya di preparatif dan diidentifikasi menggunakan metode KLT. Hasil preparatif dari fraksi F10-6 dan fraksi 111 hasil kromatografi flash, selanjutnya diuji golongan dengan penambahan pereaksi tertentu. Dan dari hasil pengujian golongan untuk kedua fraksi menunjukkanbahwa kedua fraksi tersebut termasuk kedalam
A B
18
golongan senyawa alkaloid. Hal ini ditunjukkan dengan adanya reaksi positif pada kedua fraksi setelah ditambahkan pereaksi Wagner yang ditunjukkan dengan adanya endapan berwarna coklat tua dan pereaksi meyer dengan adanya endapan berwarna putih kekuningan dapat dilihat pada Gambar 5.8.
Gambar 5.8. Uji pereaksi meyer dan wagner: A) Sampel F10-6; B) Sampel fraksi 111 hasil kromatografi flash
Penentuan golongan suatu senyawa atau uji fitokimia dapat dilakukan dengan penambahan beberapa pereaksi tertentu seperti FeCl, Liebermann-Burchard, Meyer, dan Wagner dengan tujuan untuk mengetahui golongan senyawa kimia yang terdapat didalam sampel yang diujikan. Hasil pengujian golongan dapat dilihat pada Tabel 5.4.
Tabel 5.4. Uji Golongan sampel F10-6 dan fraksi 111 hasi kromatografi flash .
Sampel
Pereaksi Pengamatan Setelah
Penambahan Keterangan
F10-6
Liebermann-Burchard Merah muda (-) Steroid
FeCl3 Warna kuning (-) Flavonoid
Meyer Endapan putih
kekuningan (+) Alkaloid
Wagner Endapan coklat (+) Alkaloid
111
Liebermann-Burchard Merah muda (-) Steroid
FeCl3 Warna kuning (-) Flavonoid
Meyer Endapan putih
kekuningan (+) Alkaloid
Wagner Endapan coklat (+) Alkaloid
Wagner Meyer Wagner Meyer
A B
32
19
Hasil Uji KLT-Bioautografi Pada Bakteri Uji S. aureus Menggunakan Ekstrak Kasar dan Hasil Kromatografi Flash
Pengujian KLT-Bioautografi dilakukan untuk mengetahui adanya senyawa aktif sebagai antibakteri pada ekstrak kasar etil asetat yang diperoleh. Kromatogram (Plat KLT Silica gel F 256) yang telah dielusi menggunakan 3 kombinasi pelarut yang berbeda yaitu etil asetat: metanol (8:2), etil asetat: metanol (9:1) dan etil asetat: metanol (6:4). divisualisasi di bawah penyinaran lampu UV λ254 nm dan λ366 nm
untuk melihat pemisahan senyawa serta warna yang dipendarkan yang ditunjukkan pada lempeng KLT. Hasil pengujian menunjukkan jika noda aktif merupakan noda berwarna orange kekuningan setelah divisualisasi dibawah lampu UV. Selain itu, dari pengujian ini juga menunjukkan bahwa senyawa berwarna orange kekuningan yang berpontensi sebagai antibakteri didunga merupakan senyawa yang bersifat polar, dilihat dari posisi senyawa lebih diatas dari batas awal elusi setelah dikembangkan dengan kombinasi pelarut etil asetat: metanol dengan perbandingan tertentu. Menurut Pandey (2004), Bercak aktif dapat dideteksi sebagai zona jernih diatas media tumbuh yang yang telah diinokulasikan mikrobia uji. Hasil pengujian KLT-Bioautografi menggunakan ekstrak kasar terhadap bakteri uji S. aureus dapat dilihat pada Gambar 5.9.
Gambar 5.9. Hasil KLT-Bioautografi ekstrak kasar etil asetat KMR-1E terhadap bakteri uji Staphylococcus aureus:Kombinasi eluen yang digunakan: A) Etil asetat: metanol (8:2); B) Etil asetat: metanol (9:1); C) Etil asetat: metanol (6:4).
20
Pemisahan senyawa pada fraksi gabungan 80-85 hasil kromatografi flash
menunjukkan bahwa ekstrak yang telah ditotolkan dan divisualisasi dibawah lampu UV dan diujikan terhadap bakteri S. aureus menunjukkan adanya zona bening yang terbentuk, dapat dilihat pada Gambar 5.10.
Gambar 5.10. Kromatogram yang telah dielusi dan hasil uji KLT-bioautografi ekstrak hasil flash. A) Kromatogra hasil elusi etil asetat 100%; B) Noda dibawah UV λ 254; C) Noda dibawah UV λ 366; C) Hasil
KLT-Bioautografi hasil flash.
Nilai Konsentrasi Hambatan Minimum/ Minumum InhibitoryConcentration
(MIC)
Metabolit sekunder yang berwarna orange kekuningandan aktif menghambat pertumbuhan S. aureus ATCC 25923 diperoleh dengan cara fraksi 10-6 ditotol pada lempeng KLT dan dikembangkan menggunakan pelarut etil asetat 100%. Hasil dari pemisahan beberapa senyawa kemudian dipreparatif dan diujikan kembali untuk mengetahui nilai Konsentrasi Hambatan Minimum/Minimum Inhibitory
Concentration (MIC) menggunakan metode difusi agar. Ekstrak hasil preparatif
dilarutkan dengan pelarut etil asetat dengan konsentrasi awal 1 mg/mL, dan dibuat deret pengencer hingga 11 kali dengan konsentrasi akhir 0,976 µg/mL. Selanjutnya setiap pengenceran diinjeksikan ke papper disc blank (Merck Ø 8 mm) dengan volume 30 μL dan diletakkan pada permukaan media yang telah diinokulasikan bakteri S. aureus ATCC 25923 dan diinkubasi selama 24 jam. Hasil pengujian dapat dilihat pada Tabel 5.5.
A B C D
21
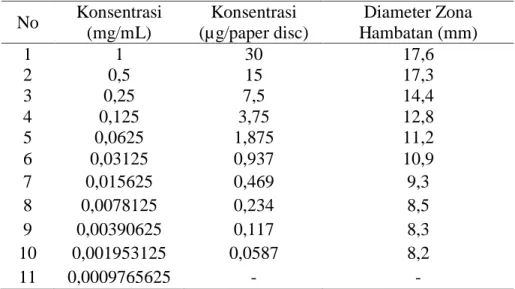
Tabel 5.5. Nilai Konsentrasi Hambatan Minimum/MinimumInhibitory Concentration
(MIC) ekstrak KMR-1E terhadap bakteri uji S. aureus
No Konsentrasi (mg/mL) Konsentrasi (µg/paper disc) Diameter Zona Hambatan (mm) 1 1 30 17,6 2 0,5 15 17,3 3 0,25 7,5 14,4 4 0,125 3,75 12,8 5 0,0625 1,875 11,2 6 0,03125 0,937 10,9 7 0,015625 0,469 9,3 8 0,0078125 0,234 8,5 9 0,00390625 0,117 8,3 10 0,001953125 0,0587 8,2 11 0,0009765625 - -
Keterangan: (-) = tidak ada aktivitas antimikroba
Profil pengujian nilai MIC menggunakan metode difusi agar dapat dilihat pada Gambar 5.11.
Gambar 5.11. Zona bening yang terbentuk disekeliling paper disc menggunakan mikroba uji S. aureus. Ekstrak diencerkan hingga 11 kali pengenceran.
Hasil Spektroskopi IR
Kristal yang telah diuji fitokimia yaitu fraksi ke-111 hasil kromatografi
flashselanjutnya diidentifikasi berdasarkan analisis spektroskopi Infra Red (IR)
menggunakan alat spektrofotometer FT-IR dengan metode pellet KBr. Analisis ini bertujuan untuk menentukan gugus fungsional dari suatu senyawa. Berdasarkan
1 2 3 4 5 6 7 8 9 10 11
22
hasil analisis spektrofotometer FT-IR, interpretasi atau penafsiranspektrum infra
merahdapat ditentukan dengan menganalisa data berupa bilangan gelombang, bentuk
pita, intensitas dan gugus fungsi. Interpretasi Spektrum Infra Merah dapat dilihat pada Tabel 5.6.
Tabel 5.6. Interpretasi Spektrum Infra Merah
Pita serapan FT-IR (cm-1) Bentuk Pita Penempatan Gugus Terkait Intensitas Isolat Pustaka 3444.87; 3421.72 3500
Tajam -NH2 Primer Kuat
2924.09; 3000-2850 Tajam -CH alifatik (CH2) Sedang
1647.21 1600-1475 Tajam C=C aromatic Sedang
2380.16 2260-2240 Tajam C≡N Sedang
1026.13 1350-1000 Melebar C-N Sedang
Profil spektrum Infra Red dapat dilihat pada Gambar 5.12.
Gambar 5.12. Profil spektrum Infra Red (IR)
Antibakteri merupakan senyawa yang dihasilkan oleh suatu mikroorganisme dan dalam konsentrasi kecil mampu menghambat bahkan membunuh proses kehidupan bakteri. Berdasarkan sifat toksisitas selektifnya, antibakteri dapat digolongkan sebagai bakteriostatik, dan bakterisida (Ganiswara dkk, 1995; Blair dkk,
23
2015).Setiap jenis antibakteri memiliki meknisme tersendiri dalam menghambat pertumbuhan bakteri. Agen antimikroba dapat dikategorikan menurut mekanisme kerjanya, yang meliputi gangguan sintesis dinding sel, penghambatan sintesis protein, gangguan sintesis asam nukleat, penghambatan jalur metabolismedan gangguan struktur bakteri membran (Tenover, 2006).
Meski demikian, bakteri dapat mengembangkan kemapuan resistensi secara intrinsik ≥1 kelas agen antimikroba (Pantosti dkk, 2007) atau melalui akuisisi gen resistensi dari organisme lain. Gen resistensi yang diperoleh dapat memungkinkan bakteri untuk menghasilkan enzim yang merusak senyawa antibakteri,senyawa antimikroba mencapai target intraseluler, mengubah target sasaran, atau menghasilkan jalur metabolisme alternatif yang melewati aksi obat (Tanover, 2006).
Saat ini yang menjadi perhatian besar adalah penanganan terhadap infeksi bakteri Gram-positif seperti Pneumococcus, Enterococci, dan Staphylococci
(Guilhelmelli dkk, 2014). Staphylococcusaureus merupakan flora normal tubuh yang umumnya hidup di permukaan kulit dan saluran pernafasan. Mikroba ini umumnya hanya menyebabkan infeksi ringan namun pada kondisi tertentu mikroba ini mampu menyebabkan infeksi yang bersifat sistemik yang berujung kematian.
S. aureus memiliki kemampuan adaptasi yang cepat dibanding keseluruhan
jenis bakteripatogen lain di era antibakteri. Van Sorge dkk (2013), menyatakan bahwa ketika penisislin pertama kali ditemukan pada tahun 1940-an, semua isolat S. aureus menujukkan sifat yang sangat rentan terhadap penicilin, namun pada akhir dekade, 28 % S. aureus yang ditemukan di Boston City Hospital menujukkan sifat resiten terhadap penicilin. Saat ini, hampir seluruh isolat S. aureus yang ditemukan di rumah sakit menujukkan sifat resiten terhadap penicilin. Sejak saat itu, berbagai kelas antibiotik telah digunakan dalam pengobatan terhadap S. aureus namun bakteri ini menunjukkan kemampuan yang unik yang memungkinkannya untuk merespon dengan cepat terhadap semua kelas anibiotik (Pantosi dkk, 2007; Ling dkk 2015).
Ekosistem yang unik memungkinkan untuk menemukan jalur metabolisme yang unik yang telah berevolusi dan memungkinkan mikroorganisme untuk beradaptasi dan bertahan hidup prevalensinya semakin besar. Koleksi mikroba dari ekosistem yang unik tersebut akan menyediakan sumber daya yang kaya untuk penemuan obat-obatan baru (Knight dkk, 2003). Dari penelitian sebelumnya
24
diperoleh isolat Actinomycetes dengan kode KMR-1E (Pasmawati, 2015) yang dianggap potensial karena kemampuannya menghambat bakteri dengan spektrum luas dan daya hambat kategori tinggi.
Uji Antagonis
Kemampuan isolat Actinomycetes sp. strain KMR-1E dalam menghasilkan senyawa antibakteri dapat dilihat pada Gambar 4.1. Pada uji antagonis menggunakan
diffution agar block method (Ali, 2009), hasil positif ditunjukkan pada kedua
mikroba uji yakni S. aureusmewakili bakteri gram positif dan E. colimewakili bakteri gram negatif dengan masing-masing zona hambat sebesar 23,5 mm dan 9,8 mm. Berdasarkan hasil pengujian diketahui bahwa aktivitas penghambatan yang dihasilkan oleh isolat KMR-1E jauh lebih kuat terhadap bakteri S.
aureusdibandingkan dengan bakteri E. Colidan dari potensi ini maka
isolatActinomycetes strain KMR 1E dianggap potensial untuk diuji lebih lanjut melalui tahap fermentasi senyawa menggunakan medium fermentasi Starch Nitrate
Broth(SNB) untuk memproduksi senyawa target dalam jumlah yang memadai.
Waktu optimum pertumbuhan
Produksi senyawa metabolit sekunder dari isolatActinomycetes strain KMR-1E dapat diperoleh dengan cara menumbuhkannya pada media fermentasi (Utami, 2011) Starch Nitrate Broth (SNB), dan diekstraksi menggunakan pelarut etil asetat serta ekstrak yang diperoleh diujikan pada dua jenis bakteri uji yaitu S. aureus
dan E. coli. Selama proses kultur,terjadi perubahan warna kultur yaitu dari tidak berwarna (hari ke-0) hingga kuning dimulai pada hari ke-5, hal ini dikarenakan warna koloni Actinomycetes berbeda-beda serta produksi pigmen terlarut yang berdifusi pada medium kultivasi (Lechevalier, 1980). Menurut Krieg &Holt (1994), salah satu genus Actinomycetes yang dapat menghasilkan pigmen dengan kisaran warna yang beragam, bergantung pada warna miselium vegetatif dan miselium udara adalah Streptomyces sp. Optimasi waktu produksi metabolit sekunder dapat ditentukan dengan membuat grafik hubungan antara waktu inkubasi dan diameter zona hambat (Rante, 2010). Hasil penentuan waktu optimum pertumbuhan dalam produksi senyawa antibakteri dapat dilihat pada Tabel 4.1 yang kemudian dibuat dalam bentuk grafik pada Gambar 4.2 dan uji aktivitas pada Gambar 4.3. Senyawa antibakteri yang diproduksi oleh isolatActinomycetes sp. Strain KMR 1E, hanya aktif
25
menghambat pertumbuhan bakteri S. aureus. Pada pengujian ini, produksi senyawa antibakteri telah dimulai pada hari ke 5 dengan zona hambat 18,2 mm dan terus meningkat hingga hari ke 11 dengan zona hambat 31,57 mm yang merupakan zona hambat optimum dan penurunan aktivitas antibakteri dimulai pada hari ke 13 dan 15 dengan zona hambat 26, 87 mm dan 25,92 mm dan berat biomassa yang terus meningkat. Menurut Sulistyani (2006), strategi Actinomycetes untuk dapat bersaing dengan mikroba lainnya adalah dengan menghasilkan enzim-enzim ekstraseluler dan senyawa antibiotik, dimana senyawa antibiotik berfungsi untuk menghambat pertumbuhan mikroba kompetitor.
Penurunan aktivitas antibakteri dapat disebabkan oleh banyak faktor. Faktor yang paling berperan adalah mekanisme dari biosintesis senyawa metabolit sekunder, senyawa yang dimanfaatkan sebagai antibiotik. Metabolit sekunder dibentuk melalui metabolisme sekunder, yaitu metabolisme yang melibatkan senyawa-senyawa organik spesifik dan terjadi sangat terbatas di alam (Wulandari, 2015).Antibiotik yang merupakan metabolit sekunder banyak dihasilkan pada akhir fase eksponensial dan fase stasioner (Darwis, 1989).Senyawa metabolit sekunder juga dapat mengalami biodegradasi dan dimanfaatkan kembali pada masa germinasi oleh organisme penghasilnya (Wink, 1999). Hal ini juga bisa menjadi faktor yang menyebabkan terjadinya penurunan aktivitas antibakteri. Pada kultur dengan nutrisi yang tetap, setelah melewati fasestationary jumlah sel bakteri akan berkurangakibat menurunya jumlah nutrisi. Nutrisi yang semakin berkurang sementara aktivitas reproduksi sel masih berjalan dan yang tersedia hanya senyawa metabolit sekunder. Kondisi inilah yang memicu terjadinya biodegradasi senyawa metabolit sekunder sehingga bisa digunakan kembali untuk proses germinasi (Wulandari, 2015).
Fermentasi dan Ekstraksi
Metode fermentasi memungkinkan untuk meningkatkan konsentrasi senyawa metabolit sekunder Actinomycetes yang berpotensi sebagaiantibakteri(Wulandari, 2015). Oleh karena itu, metabolit sekunder khususnya senyawa antibakteri yang diproduksi oleh isolatActinomycetes sp. strain KMR-1E dapat diperoleh melalui proses fermentasi dengan menggunakan media cair seperti Starch Nitrate Broth
(SNB) (Utami, 2011). Medium fermentasi yang dibuat sebanyak 4,5 L diinokulasikan dengan prekultur Actinomycetes sp. strain KMR-1E yang telah
26
ditumbuhkan selama 7 hari pada medium SNB, kemudian diinkubasi selama 14 hari dengan mengatur pH:7, suhu: 37oC dan laju penggojokan 100 rpm dengan tujuan agar penyebaran oksigen dan penggunaan nutrien dalam medium lebih efisien.Pemanfaatan metabolit sekunder yang diproduksi oleh Actinomycetes sp. strain KMR-1E baru dapat dimanfaatkan setelah dilakukannya tahap ekstraksi dari medium pertumbuhannya. Ekstraksi dalam hal ini merupakan kegiatan pemisahan senyawa berdasarkan sifat pelarutnya.
Menurut Harborne (1987), salah satu usaha mengefektifkan isolasi senyawa tertentu yaitu dengan pemilihan pelarut organik yang akan digunakan, dimana pelarut polar akan lebih mudah melarutkan senyawa polar dan sebaliknya senyawa nonpolar lebih mudah larut dalam pelarut nonpolar. Ekstraksi metabolit sekunder
Actinomycetes sp. strain KMR-1E dilakukan dengan menyaring medium
pertumbuhan mikroba, untuk memisahkan biomassa dan cairan fermentasi. Cairan fermentasi diekstraksi cair-cair menggunakan pelarut etil asetat (1:1,v/v) didalam corong pisah selama 20 menit, sedangkan biomassa yang diperoleh diektraksi dengan metode maserasi, yaitu biomassa direndam menggunakan pelarut metanol 3x24 jam dan setiap ekstrak yang diperoleh kemudian diuapkan. Profil perolehan metabolit sekunder dapat dilihat pada Gambar 4.4 yang nampak berwarna kuning.
Analisis Kromatografi Lapis Tipis (KLT) dan Fraksinasi dengan kromatografi kolom
Ekstrak kasar yang mengandung senyawa aktif antibakteri selanjutnya dipurifikasi. Prosespemisahan dan pemurnian senyawa dilakukan denganmetode kromatografi kolom cair vakum (KKCV), kromatografi flash dan preparatif. Sebelum dilakukannya pemisahan dan pemurnian berdasarkan kromatografi kolom, terlebih dahulu dilakukan analisis kromatografi lapis tipis (KLT), yang bertujuan dalam penentuan eluen terbaik terhadap pemisahan suatu senyawa.Berdasarkan hasil dari analisis KLT menunjukkan bahwa eluen terbaik adalah etil asetat: n-heksan dengan perbandingan 8:2 yang kemudian digunakan pada proses KKCV sebanyak 3 kali ulangan, dimana komposisi eluen yang digunakan dimulai dari eluen yang bersifat non polar hingga polar. Hasil dari KKCV diperoleh 11 fraksi yang kemudian diidentifikasi kembali dengan uji KLT. Fraksi yang menujukkan pola pemisahan senyawa yang sama, selanjutnya digabung menjadi 2 fraksi yaitu F6 dan F10 seperti
27
yang ditunjukkan pada Tabel 4.3. Hasil penguapan kedua fraksi menunjukkan bahwa pada fraksi F6 terbentuk kristal berwarna orange dengan susunan yang kompak di sekeliling diding vial, sedangkan untuk F10 tidak menunjukkan terbentuknya kristal (Gambar 4.7). Selanjutnya F6 dengan bobot 16 mg kembali difraksinasi dengan metode kromatografi flash dan menghasilkan 120 fraksi, dimana fraksi ke 111 yang membentuk kristal berwarna kuning yang selanjutnya diuji golongan dan dianalisis berdasarkan spektroskopi IR. Sedangkan untuk F10 difraksinasi kembali dengan metode KKCV dan menghasilkan 11 fraksi, pada fraksi ke 6 atau F10-6 hasil fraksinasi F10 terlihat adanya kristal yang terbentuk dengan kristal yang sama pada F6 hasil KKCV pertama.
Kedua jenis fraksi yaitu Fraksi F10-6 yang telah dipreparatif dan fraksi 111 hasil kromatografi flash yang membentuk kristal serupa berwarna orange kekuning selanjutnya diuji golongan yang menunjukkan hasil bahwa kedua jenis fraksi tersebut termasuk kedalam senyawa alkaloid, dikarenakan pada saat ekstrak dilarutkan dengan pelarut etil asetat dan ditambahkan dengan pereaksi Wagner, terlihat adanya endapan yang terbentuk berwarna coklat tua dan pada penambahan pereaksi Meyer juga terbentuk endapan berwarna putih kekuningan (Marliana, 2005).
Uji KLT-Bioautografi Pada Bakteri Uji S. aureus Menggunakan Ekstrak Kasar dan Hasil Kromatografi Flash
Bioautografi merupakan suatu metode yang spesifik untuk mendeteksi bercak kromatogram hasil kromatografi lapis tipis (KLT) yang mempunyai aktivitas antibakteri.Bercak aktif dapat dideteksi sebagai zona jernih diatas media tumbuh yangtelah diinokulasikan mikrobia uji (Pandey, 2004). Pada pengujian ini, ekstrak yang digunakan merupakan ekstrak kasar dan ekstrak hasil kromatografi flash gabungan fraksi 80-85. Pada awalnya ekstrak kasar diuji untuk mengetahui adanya senyawa yang aktif sebagai antibakteri secara KLT-Bioautografi dan hasilnya dapat dilihat pada Gambar 4.9. Ada tiga lempeng KLT yang digunakan pada pengujian KLT-Bioautografi estrak kasar,yang dielusi dengan kombinasi pelarut yang sama dengan perbandingan berbeda yaitu etil asetat: metanol perbandingan 8:2, 9:1 dan 6:4 (v/v). Hasil pengujian menunjukkan bahwa senyawa yang aktif adalah senyawa yang berwarna orange kekuningan. Pengujian KLT-Bioautografi ekstrak hasil kromatografi flash gabungan fraksi 80-85, ditotolkan pada lempeng KLT dan dielusi
28
dengan pelarut etil asetat 100%. Hasilnya menunjukkan bahwa dari titik awal senyawa dielusi hingga letak pola senyawa orange kuningan pada saat lempeng divisualisasi di bawah lampu UV terlihat adanya zona bening yang terbentuk (Gambar 4.10). Pengujian ini pun dapat digunakan sebagai data pendukung bahwa senyawa berwarna orange kekuningan merupakan senyawa yang berpotensi dalam menekan pertumbuhan bakteri S. aureus dengan membentuk zona hambatan.
Nilai Konsentrasi Hambatan Minimum/ Minumum Inhibitory Concentration
(MIC)
Penentuan kosentrasi hambatan minimum atau Minimum inhibitory
concentration merupakan salah satu metode untuk mengetahui kemampuan
konsentrasi terendah suatu senyawa tertentu dalam menghambat aktivitas pertumbuhan mikroba uji. Pada pengujian ini digunakan metode difusi agar. Ekstrak yang berwarna orange kuningan yang aktif sebagai antibakteri diperoleh dengan cara preparatif fraksi F10-6 dan diencerkan dengan pelarut etil asetat hingga pengenceran 11. Konsentrasi awal adalah 1 mg/mL dengan konsentrasi akhir 0,0009765625 mg/mL. Setiap paper disc diinjeksikan dengan senyawa yang telah diatur konsentrasinya dengan volume 30 µL. Tingginya kemampuan suatu senyawa setelah berdifusi pada media pertumbuhan, yaitu mampu menekan pertumbuhan suatu mikroba uji yang ditentukan dengan besarnya zona hambat yang terbentuk, sehingga menunjukkan bahwa mikroba uji sensitif terhadap senyawa antibakteri yang diujikan. Hasil pengujian yang telah dilakukan menunjukkan bahwa nilai MIC senyawa antibakteri dari isolatActinomycetes sp. strain KMR-1E termasuk kategori senyawa antimikrobia potensial mengingat kisaran penghambatannya yang mencapai 10 kali pengenceran dengan konsentrasi 0,0009765625 mg/mL (0,0587 µg/ papper disc) dengan luas zona hambat sebesar 8,2 mm (Tabel 4.5).Kegiatan eksplorasi kandidat obat baru, semakin rendah nilai MIC suatu senyawa aktif, menunjukkan senyawa tersebut semakin potensial sebagai bahan obat. Walaupun demikian, senyawa aktif harus memiliki toksisitas rendah terhadap sel normal tubuh, jika pemanfaatnnya sebagai obat pada manusia atau hewan (Nurkanto, 2012). Berdasarkan hasil pengujian nilai MIC, dapat diasumsikan jika senyawa antibakteri yang dihasilkan oleh isolat Actinomycetes sp strain KMR 1E termasuk senyawa baru agen
29
antimkrobia potensial namun hasil ini harus diperkuat dengan data analisis senyawa lebih lanjut.
1. Uji Spektroskopi IR
Analisis spektroskopi inframerah berdasarkan Tabel 4.6 dan Gambar 4.12, menunjukkan bahwa senyawa yang diperoleh mengandung gugus NH, khususnya gugus NH primer karena terdapat runcingan ganda pada ujung pita yang ditunjukkan pada serapan didaerah (v) 3444.87 dan 3421. 72 cm-1, dengan Vibrasi ulur yang diduga dari N-H (3310-3500 cm-1) (bukan gugus –OH).
Serapan tajam dengan intensitas sedang tampak pada daerah 2924.09 cm-1, dan 2854.65 cm-1 yang merupakan vibrasi ulur C–H alifatik (gugus –CH2 atau
metilen). Sifat khas C-H alifatik ini ditandai dengan melihat adanya serapan pada daerah v < 3000-2850 dan untuk serapan dekat dengan v 2853 dan 2926 cm-1 menunjukkan senyawa mengandung gugus metilen yang kemudian dibedakan dengan sifat simetri dan asimetri. Intensitas sedang dan bentuk pita tajam yang terletak dekat dengan daerah serapan 2250 cm-1 menunjukkan adanya gugus nitril atau C≡N dengan serapan 2380. 16 cm-1
Selanjutnya untuk gugus C=C aromatik terlihat pada interpetasi spektrum yaitu pada daerah serapan 1647.21 cm-1 dan daerah serapan gugus fungsi aromatik dapat ditentukan dekat dengan 1650 cm-1. Hal ini dibuktikan dengan adanya CH alifatik yang terletak disebelah kanan daerah serapan 3000 cm-1. Dan pada daerahserapan v 1350 hingga 1000 cm-1dengan intensitas sedangdapat menunjukkkan adanya gugus C-N dengan daerah serapan 1026.13 cm-1.
Berdasarkan data hasil analisis spektrofotometer infra merah menunjukkan bahwa senyawa yang berbentuk kristal tersebut mengandung gusus –CH alifatik, C≡N, ikatan rangkap C=C aromatik, C-N dan gugus –NH. Keberadaan atom N atau nitrogen merupakan salah satu ciri khusus dari gologan senyawa alkaloid, dimana atom N ditemukan sebagai gugus Amina atau Amida. Dugaan ini diperkuat pada uji golongan menggunakan pereaksi Meyer dan Wegner yang menunjukkan hasil positif merupakan senyawa alkaloid.
47
30
BAB VI. KESIMPULAN DAN SARAN
Berdasarkan penelitian yang telah dilakukan maka dapat disimpulkan bahwa: 1. Waktu optimum produksi senyawa antibakteri terbaik sebagai antibakteri dalam
menghambat pertumbuhan bakteri S. aureus yaitu pada hari ke 11 dengan diameter zona hambatan sebesar 31,57 dan berat biomassa 0,204 gram.
2. Hasil KLT-Bioautografi menunjukkan bahwa metabolit yang aktif sebagai antibakteri memiliki sifat polar dan berwarna orange kekuningan dalam menghambat petumbuhan bakteriS. aureus.
3. Ekstrak hasil preparatif fraksi 10-6 memiliki nilai Minimum Inhibitory
Concentration (MIC) sebesar 0,0009765625 mg/mL (0,0587µg/paperdisc)
dengan luas zona hambat sebesar 8,2 mm terhadap bakteri
S. aureus.
4. Uji fitokimia senyawa antibakteri berbentuk kristal jarum dan berwarna kuning keemasan menunjukkan hasil positif terhadap pereaksi Meyer dan wagner yang tergolong senyawa alkaloid. Dan analisis spektrofotometer FT-IR menunjukkan bahwa senyawa tersebut mengandung gusus –CH alifatik, C≡N, ikatan rangkap C=C aromatik, C-N dan gugus –NH. Keberadaan atom N merupakan salah satu ciri khusus senyawa alkaloid.
31
DAFTAR PUSTAKA
Ali, A. 2009. Skrining dan karakterisasi parsial senyawa antifungi dari Actinomycetes
asal limbah padat sagu terdekomposisi. Berk. Penel. Hayati: 14 (219–225). Allen, N.E, and Nicas, T.I. 2003. Mechanism of action of oritavancin and related
glycopeptide antibiotics. 2003. FEMS Microbiol Rev, 26: 511-532.
Arifuzzaman, M., Khatun, M.R., Rahman, H. 2010. Isolation and screening of
actinomycetes from Sundarbans soil for antibacterial activity. Afr. J.
Biotechnol., 9: 4615-4619.
Ayuoso, A., Clark, D., Gonzales, I., Salazar, O., Anderson, A, and Genilloud, O. 2005. A novel Actinomycetes strain de-replication approach based on the diversity of polyketide synthase and nonribosomal peptide synthetase biosynthetics pathways. Appl Gen and Mol Biotec, 67: 795-806.
Badji, B., Zitouni,A., Mathieu,F., Lebrihi, A and Sabaou, N .2006. Antimicrobial compounds produced by Actinomadura sp AC104 isolated from an Algerian Sahara soil. Can J Microbiol, 55 (4): 373-382
Barakate, M., Ouhdouch, Y., Oufdou, K.H, and Beaulieu, C. 2002. Characterization of rhizosperic soil Streptomyces from Moroccan habitats and their antimicrobial activities. World J Microb Biot, 18: 49-54.
Breitaupt, H. 1999. The new antibiotic: can novel antibacterial treatments combat the rising tide of drug-resistant infectious? Nat Biotechnol, 17.
Castillo, Y., G.A. Strobel, and E.J. Ford. 2002. Munumbicins wide spectrum antibiotics produced by Streptomyces munumbi, endophytic on Kennedia nigriscans. Microbiology 148:2675-2685.
Chun, J. 1999. PHYDIT (The Phylogenetic Editor) Version 3.0. User’ Manual
Davelos, A.L.,Xiao, K., Flor, J.M, and Kinkel, L.L. 2004. Genetic and phenotypic traits of streptomycetes used to characterized antibiotic activities of field-collected microbes. Can J Microbiol, 50(2): 79-89.
Giamarellou, H., Antoniadou, A. 1997.The effect of monitoring of antibiotic use on
decreasing antibiotic resistant in the hospital. (Ciba Foundation Symposium
207). Antibiotic resistance: origins, evolution, selection and spread. John Willey & Sons: 76-92.
Goodfellow. M. 1983. Ecology of Actinomycetes.Ann.Rev. Microbiol. 1983. 37:189-216.
James PDA dan Edwards C. 1997.The effects of temperature on growth and production of the antibiotic granaticin by a thermotolerantStreptomycete. J Gen
Microbiol135: 1997-2003.
Kim, B.S., Moon, S.S, and Hwang, B.K. 2000. Structure elucidation and antifungal activity of an antracycline antibiotic, daunomycin, isolated from Actinomadura
rosela. J Agr Food Chem, 48: 1875-1881.
Kuster E. 1958. TheActinomycetes.didalam: Burger A, Raw F. 1967. Soil Biology. London: Acad Press.
Lemriss, S., Laurent, F., Couble, A., Casoli, E., Lancelin, J.M., Bonaccio, D.S., Rifai, S., Fassaouane, A, and Boiron, P. 2003. Screening of nonpolyenic antifungal metabolites produced by clinical isolates of Actinomycetes. Can J