BAB II
TINJAUAN PUSTAKA
2.1 PENDAHULUAN
Pada bab ini akan menjelaskan teori tentang analisis elektrokimia, sel elektrokimia, larutan elektrolit, jenis – jenis elektroda, potensiometri, voltammetri, potentiostatic dan SEM (Scaning Electron Microscopy).
2.2 ANALISIS ELEKTROKIMIA
Analisis elektrokimia merupakan metode analisis kuantitatif atau kualitatif yang didasarkan pada sifat-sifat kelistrikan suatu larutan zat yang dianalisis (cuplikan) di dalam suatu sel elektrokimia. Di dalam sel elektrokimia dapat dipelajari hubungan-hubungan antara konsentrasi dengan potensial (potensiometri), konsentrasi dengan daya hantar listrik (konduktometri), konsentrasi dengan jumlah muatan listrik (koulometri), konsentrasi dengan potensial dan arus listrik (polarografi dan voltammetri) (Hendayana, dkk., 1994).
Reaksi oksidasi dan reduksi merupakan konsep dasar reaksi yang terjadi dalam elektrokimia. Adanya elektron yang berpindah dari satu spesi atom ke spesi atom yang lain atau pelepasan elektron (oksidasi) dan penangkapan elektron (reduksi) berarti ada elektron yang mengalir (Khopkar, 1990). Aliran elektron merupakan indikasi terjadinya arus listrik. Serah terima elektron mengakibatkan terjadinya perubahan muatan atom-atom yang berikatan atau spesi kimia yang terlibat. Perubahan muatan tersebut yang selanjutnya disebut peristiwa oksidasi dan reduksi atau dikenal sebagai reaksi redoks yang dapat memberikan informasi mengenai konsentrasi, kinetika,
mekanisme reaksi, dan aktifitas dari spesi dalam larutan. Reaksi oksidasi dan reduksi (redoks) dapat dituliskan dalam bentuk ½ reaksi sebagai berikut:
O + ne- R (2.1)
Dimana O adalah spesi yang dioksidasi dan R adalah spesi yang tereduksi. Setiap proses reduksi dan oksidasi terjadi pada permukaan elektroda dari sel elektrokimia. Dalam sistem yang dikontrol secara termodinamik, potensial elektroda dapat diukur dengan menentukan konsentrasi spesi elektroaktif pada permukaan elektroda berdasarkan persamaan Nernst:
[ ]
[ ] (2.2)
Dimana E adalah potensial standar dari reaksi redoks, R konstanta gas (8.314 J/K mol), T temperatur (K), n bilangan yang menyatakan transfer elektron dalam reaksi, F adalah konstanta Faraday (96.487 coulombs) (Wang, 1994). Elektrokimia mempelajari hubungan antara energi listrik dengan terjadinya reaksi kimia. Hubungan tersebut dapat dipahami melalui proses yang terjadi dalam sel elektrokimia.
Dalam penelitian ini, reaksi yang terjadi pada elektroda Ag/AgCl dapat dinyatakan dalam persamaan Nernst:
( ) [
] (2.3)
Aktivitas spesies ionik sama dengan konsentrasi produknya dan koefisien aktivitasnya. Memperhatikan aktivitas itu koefisien untuk spesies kimia dalam fase padat didefinisikan sebagai satu keasatuan dan pada konsentrasi ion klorida rendah sampai sedang koefisien aktivitas ion klorida juga kira-kira satu kesatuan Persamaan (2.3) dapat dinyatakan dalam bentuk konsentrasi bukan aktivitas, menjadi:
( ) *
| |
| | | |+ (2.4)
Karena perak klorida adalah garam yang mudah larut, konsentrasinya Idealnya harus tetap konstan di media berair. Demikian juga dengan Konsentrasi perak juga harus tetap konstan karena dalam fase padat sehingga, rasio konsentrasi klorida perak ke perak, (k) harus tetap konstan dan persamaan (2.4) menjadi:
Dengan membalik dan memisahkan istilah logaritmik lalu mengkonversi untuk mendasarkan 10 hasil:
(
) [ [ ] ( )] (2.6) Dengan mensubstitusikan berbagai konstanta pada suhu 25 ◦C, menjadi:
| | ( ) (2.7) Oleh karena itu, dalam kondisi ideal dan pada suhu operasi Dari 25 ◦C, potensial elektroda terukur (E) secara teoritis berkurang sekitar 59 mV untuk setiap dekade perubahan klorida konsentrasi ion. Persamaan (2.7) juga menjelaskan untuk apapun dengan konsentrasi klorida, potensi terukur bisa berubah jika rasio (k) perak klorida terhadap perubahan perak (Cranny, et al,. 2011).
2.2.1 Sel Elektrokimia
Sel elektrokimia merupakan seperangkat komponen peralatan dan bahan elektrolit yang dapat menghantarkan arus listrik. Secara umum sel elektrokimia terdiri dari dua elektroda dan penghantar luar. Awal tahun 1950an sebagian besar percobaan elektrokimia menggunakan tiga elektroda dan instrumennya dilengkapi dengan potensiostat (Reiger, 1994). Elektrolit dalam sel elektrokimia dapat berupa leburan atau larutan. Elektroda dicelupkan dalam larutan elektrolit yang sesuai sehingga terjadi kontak antar muka elektroda dengan elektrolit. Kontak antar muka tersebut menimbulkan potensial sel yang menentukan berlangsungnya reaksi oksidasi dan reduksi (redoks). Setiap proses reduksi dan oksidasi terjadi pada permukaan elektroda dari sel elektrokimia. Kesatuan elektrolit dan elektroda dinamakan setengah sel. Setiap sel elektrokimia terdiri dari dua buah setengah sel. Elektroda yang merupakan tempat terjadinya proses oksidasi disebut anoda. Elektroda yang merupakan tempat terjadinya proses reduksi disebut katoda. Anoda dan katoda dalam sel elektrokimia dihubungkan dengan penghantar untuk mengalirkan elektron sehingga menghasilkan arus listrik.
Sel elektrokimia diklasifikasikan sebagai sel galvani dan sel elektrolisis, keduanya berguna dalam analisis elektrokimia. Sel galvani merupakan sel elektrokimia yang dapat menghasilkan listrik karena terjadinya reaksi kimia yang spontan, sedangkan sel elektrolisis adalah sel elektrokimia yang menggunakan listrik sebagai sumber energi untuk terjadinya reaksi kimia. Sel elektrokimia juga dapat bersifat reversibel dan irreversibel. Reversibel jika arah reaksi elektrokimia dapat
berbalik ketika arah dari aliran elektron diubah. Irreversibel jika pengubahan arus menyebabkan perbedaan ½ reaksi yang terjadi pada salah satu atau kedua elektroda (Skoog, et al., 1992). Elektroanalisis sendiri mempelajari fenomena yang terjadi pada interfase antara permukaan elektroda dan lapisan tipis di sekitar elektroda. Bahan yang digunakan untuk pembuatan sel elektrokimia harus dapat dipakai padam range temperatur yang lebar, bentuk stabil, tahan terhadap larutan, pelarut organic dan reagen, tahan lama, dan yang terpenting adalah terbuat dari bahan yang transparan, sehingga larutan dan elektrodanya dapat diamati (Sawyer, et al., 1995). Bahan penyusun dari sel yang umum digunakan adalah glas, teflon, dan quart.
2.2.2 Larutan Elektrolit
Analisis secara elektrokimia, tidak ada pelarut tunggal yang ideal. Pemilihan pelarut biasanya berdasarkan beberapa faktor diantaranya didasarkan pada konduktivitas, kemampuan melarutkan elektrolit dan elektroaktif analit, aktifitas redoks, dan reaktifitas dengan materi yang diteliti. Pelarut tidak boleh menimbulkan efek adsorbsi dari elektroaktif analit pada elektroda. Pelarut juga harus tidak bereaksi dengan analit atau dengan produk dan harus tidak mengalami reaksi elektrokimia pada range potensial berlebih (Gosser, 1993; Reiger, 1994).
Larutan elektrolit merupakan kombinasi dari pelarut dan elektrolit pendukung. Pemilihan larutan elektrolit bergantung pada aplikasinya. Larutan elektrolit digunakan untuk mengurangi hambatan dari larutan, menambah konduktifitas dan mengontrol potensial selama penelitian untuk mengurangi efek migrasi elektron yang mempengaruhi arus yang terukur tidak hanya terukur dari analit yang berdifusi melainkan juga dari migrasi (Skoog, et al., 1963), serta mempertahankan agar kekuatan ion konstan (Wang, 1994). Larutan elektrolit yang digunakan pada penelitian ini adalah larutan KCl. Penggunanaan larutan berair KCl karena potential junction dapat dieliminasi (Reiger, 1994).
2.3 POTENSIOMETRI
Potensiometri adalah salah satu teknik analisis yang telah lama dikenal, perkembangan metode potensiometri termasuk sangat pesat, hal ini disebabkan oleh kesesuaian dengan kebutuhan analisis relatif cepat, murah serta hasil analisis yang akurat. Potensiometri merupakan metode analitik yang didasarkan pada pengukuran potensial larutan analit sebagai penentu konsentrasi analit. Persamaan sel dapat dituliskan sebagai persamaan 2.8 (Harvey, 2000).
Esel = Ekatoda – Eanoda (2.8)
Potensial suatu elektroda tidak dapat diukur tersendiri tetapi dengan mengabungkan elektroda pembanding yang memiliki nilai tetap selama pengukuran. Perangkat yang digunakan pada pengukuran potensiometri secara langsung antara lain elektroda selektif ion (ESI), elektroda pembanding, dan alat pengukur potensial berupa sebuah pH / milivolt meter yang dapat mendeteksi 0,2 mV atau lebih (Wang, 2006).
Pada potensiometri katoda berfungsi sebagai elektroda indikator (Eind), reaksi yang terjadi adalah reaksi oksidasi sedangkan anoda berfungsi sebagai elektroda pembanding (Eref) rekasi yang terjadi adalah oksidasi. Adanya perbedaan konsentrasi dan mobilitas ion-ion dalam larutan sel elektrokimia menimbulkan adanya potensial liquid junction (Elj) pada batas antamuka larutan, sehingga persamaan potensial sel menjadi persamaan 2.9 (Harvey,2000).
Esel = Eind - Eref + Elj (2.9)
Elektroda yang digunakan dalam teknik elektrokimia terdiri dari tiga elektroda, yaitu elektroda kerja (WE), elektroda pembanding (RE), dan elektroda kounter (CE) (Siswoyo, et al., 2000).
2.3.1 Elektroda Kerja (WE)
Elektroda kerja merupakan elektroda tempat reaksi yang diinginkan terjadi (Underwood, 1999). Karakteristik yang ideal dari elektroda kerja adalah memilki daerah potensial yang lebar, hambatan kecil, dan permukaan yang reprodusibel. Daerah potensial dari masing-masing elektroda tergantung pada bahan elektroda dan komposisi dari elektrolit. Daerah potensial dapat disesuaikan dengan elektroda dan larutan elektrolit yang digunakan (Fifield and Haines, 1995). Elektroda kerja
digunakan untuk menunjukkan secara tidak langsung jika elektroda ini merespon beberapa ½ reaksi spesifik (Reiger, 1994). Elektroda kerja yang digunakan adalah elektroda Ag/AgCl.
2.3.2 Elektroda Pembanding (RE)
Elektroda pembanding merupakan elektroda yang mempunyai potensial elektrokimia konstan sepanjang tidak ada arus yang mengalir dan sama sekali tidak peka terhadap komposisi larutan yang akan diselidiki. Elektroda pembanding digunakan untuk mengukur potensial pada elekroda kerja. Pasangan elektroda pembanding adalah elektroda kerja. Potensial yang akan diukur bergantung pada konsentrasi zat yang akan diselidiki (Hendayana, dkk, 1994). Pemilihan elektroda pembanding harus memperhatikan beberapa faktor yaitu:
1. elektroda pembanding harus reversibel dan sesuai dengan persamaan Nernst, 2. tegangannya harus konstan setiap waktu,
3. potensialnya harus kembali ke nilai dasar setelah arus kecil dilewatkan melalui elektroda (Sawyer, et al., 1995).
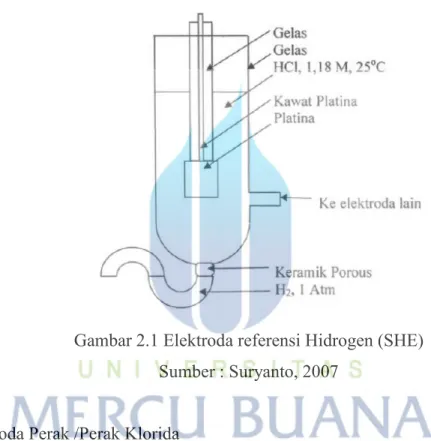
Beberapa contoh elektroda pembanding: a. Elektroda Hidrogen Standar (SHE)
Ini merupakan elektroda referensi dengan sistem logam mulia / gas hidrogen. Reaksi yang terjadi dapat ditulis sebagai berikut:
H+ + e- = ⁄ H2 (2.10)
Elektrolit yang digunakan dalam elektroda ini adalah asam klorida. Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Pt (s) | H2 (g) | H+ (aq) (2.11)
Garis tegak menyatakan batas fasa. Potensial elektrodanya dapat dinyatakan sebagai berikut:
EH+/H2 = E0
H+/H2 + (RT/F) ln ([H+]/[H2]1/2) (2.12) Dimana [H+] adalah konsentrasi ion hidrogen di dalam larutan, [H2] adalah tekanan parsial gas hidrogen. Untuk kondisi standar, bahan murni pada temperatur 25°C, tekanan hidrogen parsial pada 1 atm, aktifitas ion hidrogen 1 unit (equivalent dengan 1,18 M asam klorida), maka suku ke dua dari persamaan menjadi nol, sehingga:
EH+/H2 = E0
Potensial elektroda sekarang menjadi potensial elektroda hidrogen standar (SHE) yang nilainya nol pada semua temperatur. Berdasarkan konvensi SHE merupakan elektroda referensi standar utama. Elektroda ini sangat tidak praktis, karena elektroda ini memerlukan suplai gas hidrogen. Waktu yang diperIukan untuk menstabilkan elektroda hidrogen standar yang baru dibuat cukup lama. Hal ini disebabkan lambatnya elektroda hidrogen mencapai kesetimbangan. Karena kesulitan-kesulitan ini, maka elektroda ini jarang digunakan.
Gambar 2.1 Elektroda referensi Hidrogen (SHE) Sumber : Suryanto, 2007
b. Elektroda Perak /Perak Klorida
Ini merupakan elektroda referensi dengan sistem logam / garam. Elektroda ini banyak digunakan karena mudah dan handal. Elektroda ini dapat dioperasikan pada temperatur lebih dari 100°C. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
AgCI + e- = Ag + Cl- (2.14)
Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Ag (s) | AgCI (s) | Cl- (aq) (2.15)
Potensial elektrodanya dapat dinyatakan sebagai berikut:
EAg/AgCl = E0Ag/AgCl – (RT/F) ln ([AgCl]/[Ag][Cl-]) (2.16) Dimana E0Ag/AgCl = 0,2223 V vs SHE pada 25oC dengan koefisien temperatur 0,23
mV/oC. karena perak dan perak klorida berada dalam bentuk padat maka [AgCI]=[Ag]=l. Dengan ini maka persamaan 2.16 berubah menjadi:
EAg/AgCl = E0Ag/AgCl – (RT/F) ln ([Cl-]) (2.17) Persamaan 2.13 memperlihatkan bahwa potensial elektroda ini tergantung pada aktifitas ion klorida didalam elektroda. Untuk itu penting sekali untuk mengetahui komposisi elektrolit yang menjadi larutan pengisi serta konsentrasinya. Untuk larutan pengisi yang mengandung 3,5 M kalium klorida, maka potensial elektrodanya mencapai 0.199 V vs SHE pada temperature 25oC. Kelemahan dari elektroda ini adalah sensitif terhadap cahaya. Cahaya menyebabkan AgCl berubah menjadi Ag. Selain itu elektroda ini tidak cocok untuk larutan yang mengandung ion komplek seperti ion ammonium dan ion sianida.
Gambar 2.2 Elektroda referensi Ag/AgCl Sumber : Suryanto, 2007
c. Elektroda Merkuri/Merkuro Klorida (Calomel) SCE
Ini merupakan elektroda referensi dengan sistem logam / garam tak larut. Elektroda ini digemari karena kemudahan dan kehandalannya. Elektroda ini lebih dikenal dengan sebutan kalomel. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
HgCl + e0 = Hg + Cl- (2.18)
Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Hg (l) | HgCl (s) | Cl (aq) (2.19)
Potensial elektrodanya dapat dinyatakan sebagai berikut:
Dimana E0Hg/HgCl = 0,268 V vs SHE pada 25°C dengan koefisien temperatur 0,29 mV/0C. karena merkuri dalam bentuk cair dan merkuro klorida dalam bentuk padat maka [HgCI]=[Hg]=1. Dengan ini maka persamaan 2.20 berubah menjadi:
EHg/HgCl = E0Hg/HgCl (RT/F) In ([Cl-]) (2.21) Persamaan ini menunjukkan bahwa potensial elektroda tergantung pada aktifitas ion klorida didalam larutan pengisi. Konsentrasi ion klorida dapat divariasi. Untuk 0.1 M, 1.0 M dan 3.8 M Jenuh), potensial elektroda pada temperatur 25°C adalah 0.336 V, 0.283 V dan 0.245 V vs SHE. Umumnya elektroda ini mempunyai larutan pengisi yang mengandung garam kalium klorida jenuh. Konsentrasi kalium klorida yang jenuh dapat dilihat pada bagian bawah elektroda yang umumnya didapatkan kalium klorida padat (tidak larut). Elektroda ini mempunyai 2 kendala, pertama, temperatur maksimum dimana elektroda ini bekerja stabil adalah 70°C, kedua, pembuatan elektroda ini lebih sulit dibandingkan dengan elektroda Ag/AgCl. Selain elektroda kalomel, ada 2 elektroda referensi lain yang menggunakan merkuri.
Gambar 2.3 Elektroda referensi Calomel (SCE) Sumber : Suryanto, 2007
Elektroda Merkuri / Merkuro Sulfat
Ini merupakan elektroda referensi dengan sistem logam / garam tak larut. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
⁄ Hg2SO4 + e- = Hg + ⁄SO42- (2.22) Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Hg (l) | Hg2SO4 (s) | SO42- (aq) (2.23) Potensial elektrodanya dapat dinyatakan sebagai berikut:
EHg2SO4 = E0Hg2SO4 – (RT/F) ln [SO42-] (2.24) Persamaan ini menunjukkan bahwa potensial elektroda tergantung pada aktifitas ion sulfat didalam larutan pengisi. Jika elektroda diisi dengan kalium sulfat jenuh, maka potensialnya sebesar 0,644 V vs SHE pada temperatur 27°C. Elektroda ini juga dapat diisi dengan natrium sulfat dengan karakteristik yang hampir sarna.
Elektroda Merkuri / Merkuro Oksida
Ini merupakan elektroda referensi dengan sistem logam / garam tak larut. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
HgO + H2O + 2e- = Hg + 2OH- (2.25) Fasa- fasa yang ada dapat dinyatakan sebagai berikut:
Hg (l) | HgO (s) | OH- (aq) (2.26) Potensial elektrodanya dapat dinyatakan sebagai berikut:
EHg/HgO = E0Hg/HgO - (RT/2F) In [OH-] (2.27) Jika elektroda ini diisi dengan natrium hidroksida 0.1 M, maka potensialnya menjadi 0,926 V vs SHE pada temperature 25°C.
2.3.3 Elektroda kounter (Counter Electrode)
Counter elektrode adalah konduktor yang melengkapi sel. Counter elektode biasanya digunakan konduktor yang bersifat inert seperti platina dan grafit, tapi dapat digunakan logam yang sama dengan elektroda kerjanya. Arus yang mengalir menuju larutan melalui elektroda kerja selanjutnya akan meninggalkan larutan melalui elektroda kounter. Elektroda kounter dapat sekaligus digunakan sebagai elektroda kerja pada saat arus yang mengalir dalam sel adalah kecil. Elektroda pembantu yang digunakan adalah platina (Pt). Elektroda padat Pt ini memiliki kelebihan yaitu dapat digunakan pada daerah potensial yang lebih luas. Pt dapat digunakan pada +1,2 V – (-0,2) V (vs EKJ) dalam suasana asam dan +0,7 V – 0,1 V dalam suasana basa.
2.4 VOLTAMETRI
Voltammetri merupakan salah satu metode elektroanalisis skala mikro yang mengkaji informasi tentang analit berdasar pengukuran arus (I) sebagai fungsi potensial (V) pada kondisi dimana elektroda indikator atau elektroda kerja mengalami polarisasi. Arus yang diukur adalah arus difusi yaitu arus yang timbul karena adanya proses oksidasi atau reduksi analit elektroaktif pada permukaan elektroda (Skoog, 1992). Voltammetri dikembangkan berdasarkan prinsip polarografi yang dikenal menggunakan tetesan air raksa (Dropping Mercury Electrode, DME) sebagai elektroda kerja, mikro elektroda lebih banyak digunakan dalam teknik voltammetri sebagai elektroda kerja. Elektroda yang terpolarisasi adalah elektroda kerja (WE) pasangannya adalah elektroda pembanding (RE) yang bisa berupa kalomel (Saturated Calomel Electrode, SCE) atau Ag/AgCl. Elektroda kounter (CE) juga digunakan untuk ikut mendukung proses-proses pertukaran elektron atau aliran arus dalam sel terutama untuk sistem yang menghasilkan arus yang cukup besar.
Teknik voltammetri merupakan teknik elektrokimia dinamik (tidak pada arus nol). Proses oksidasi dan reduksi yang terjadi pada permukaan elektroda pada dasarnya merupakan transfer elektron atau transfer muatan. Arus yang diukur dalam ampere atau coulomb/detik dari kecepatan alir muatan. Reaksi elektrokimia pada permukaan elektroda dikendalikan dengan mengaplikasikan potensial pada elektroda. Potensial yang diaplikasikan disebut sinyal eksitasi dan arus yang diukur disebut sinyal hasil (Fifield and Haines, 1995). Respon dari sel elektrokimia sebagai arus direkam dan ditunjukkan dalam kurva arus-potensial disebut voltamogram. Sumbu horizontal sebagai potensial dalam volt sedangkan sumbu vertikal sebagai arus dalam μA. arus konstan yang diperoleh setelah peningkatan arus secara tajam adalah arus batas (limiting current) sedangkan arus konstan yang diperoleh sebelum peningkatan arus secara tajam (pengukuran larutan blanko sebelum analit ditambahkan) disebut arus residu (residual current).
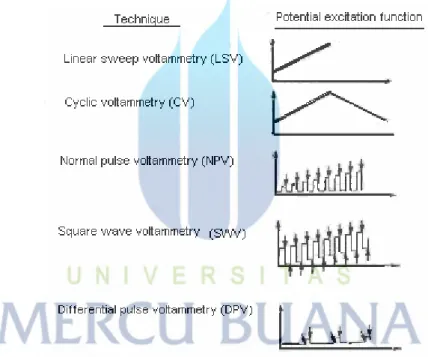
Beberapa teknik yang umum di gunakan untuk polarisasi potensial elektroda dalam voltammetri yaitu: Linear Sweep Voltammetry (LSV), Voltammetri siklik (CV), Normal Pulse Voltammetry (NPV), Square Wave Voltammetry (SWV), Differential
Pulse Voltammetry (DPV) dapat dilihat pada gambar 2.4. Linear Sweep Voltametry menunjukkan sinyal eksitasi voltammetri klasik, dimana potensial DC yang diaplikasikan ke dalam sel bertambah secara linier (biasanya dengan range 2-3 V) sebagai fungsi waktu. Arus yang dihasilkan selanjutnya dicatat sebagai fungsi waktu dan juga sebagai fungsi potensial yang digunakan. Differential pulse voltammetry dan square wave voltammetry sinyal eksitasi ditunjukkan dengan tipe pulsa. Arus diukur pada variasi waktu selama life time dari pulsa. Voltammetri siklik ditunjukkan dalam bentuk gelombang triangular. Potensial disikluskan antara dua nilai, pertama penambahan secara linier hingga maksimum kemudian berkurang secara linier dengan slope urutan angka yang sama. Proses ini dapat dilakukan dengan banyak pengulangan siklik dengan arus akan direkam sebagai fungsi waktu.
Gambar 2.4 Variasi metode eksitasi potensial pada teknik voltammetri (Skoog, et al., 1992).
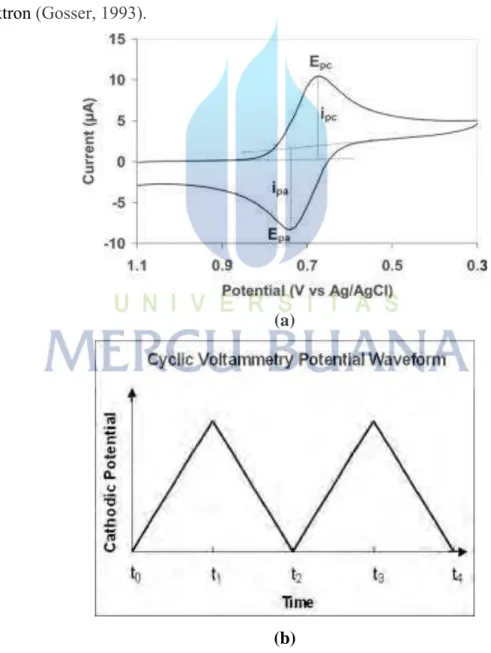
2.4.1 Voltammetri Siklik (CV)
Voltammetri Siklik merupakan metode yang umum digunakan dalam teknik elektroanalisis dan merupakan metode yang bagus, dapat memungkinkan melakukan karakterisasi pada sistem elektrokimia, digunakan untuk mempelajari proses reduksi dan oksidasi (redoks), dan untuk memahami intermidiet reaksi dan untuk mendapatkan stabilitas dari produk reaksi. Voltammetri siklik didasarkan pada variasi potensial yang digunakan pada elektroda kerja (Wang, 1994). Pengukuran
menggunakan voltammetri siklik, potensiostat mengontrol potensial yang melewati elektroda kerja untuk mengubah potensial secara perlahan kembali ke potensial awal. Potensial awal bergerak ke arah negatif menuju ke potensial akhir yang dicapai dan terbentuk ½ siklus yang menyatakan sebagai O direduksi menjadi R. Arus yang dihasilkan pada proses ini disebut arus katodik, kemudian scan akan kembali berbalik ke arah positif dan R akan dioksidasi kembali menjadi O. Arus yang dihasilkan disebut arus anodik (Reiger, 1994). Aliran potensial yang dialirkan menuju elektroda, selanjutnya respon arus dapat diamati. Analisis dari respon arus dapat memberikan informasi mengenai termodinamika dan kinetika dari transfer elektron pada permukaan elektroda-larutan, kinetika dan mekanisme reaksi dari berbagai transfer elektron (Gosser, 1993).
(a)
(b)
Gambar 2.5. Voltamogram siklik
Bentuk dari gelombang ini adalah triangular yang menyatakan potensial sebagai fungsi waktu. Larutan yang digunakan tidak perlu dilakukan pengadukan, sehingga transport massa yang dikontrol adalah proses secara difusi (Fifield and Haines, 1995). Parameter yang penting dalam voltammetri siklik adalah arus puncak dan potensial puncak yaitu keduanya berasal dari puncak katoda dan anoda. Reaksi dapat dikatakan reversibel, jika proses transfer elektron lebih cepat dibandingkan dengan proses lainnya misalnya difusi, sehingga selisih antara potensial puncak dituliskan :
△Ep = Ep anoda – Ep katoda (2.28)
= 2.303 = V pada 25o (2.29) dengan n jumlah elektron. Jika reaksi irreversible maka △Ep > V
potensial reduksi formal (E) untuk pasangan reversibel :
(2.30)
Arus puncak dapat dihitung dengan persamaan Rancles-Sevcik:
ip = 2,686x105n3/2ACD1/2v1/2 (2.31) dimana ip adalah arus puncak (A), A luas elektroda (cm2), D koefisien difusi (cm2/s), C konsentrasi (mol/cm3), v kecepatan scan (v/s) (Wang, 2006).
2.5 POTENSIOSTAT
Teknik elektrokimia untuk keperluan analisis kuantitatif instrumental membutuhkan pengetahuan dan alat-alat tambahan untuk pengolahan data . Hal ini berkenaan dengan kenyataan bahwa pembangkit sinyal analitik yang dihasilkan dalam komponen instrumen memerlukan pengolahan agar dapat memberikan data yang mudah dibaca dan diolah untuk bahan informasi.
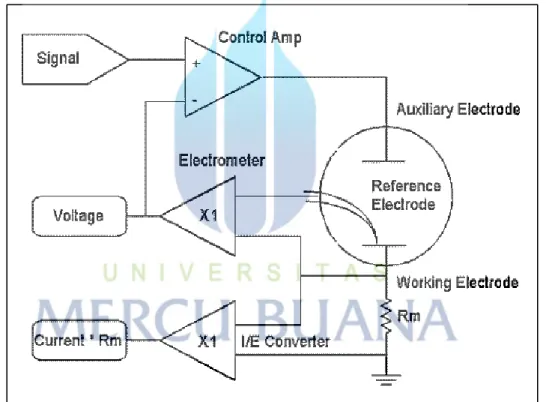
Potensiostat merupakan instrumen yang dapat digunakan untuk mengukur arus yang melewati pasangan elektroda kerja dan elektroda kounter dan selalu menjaga keseimbangan beda potensial antara elektroda kerja dan elektroda pembanding (Bard and Faulker, 1980). Potensiostat mengukur arus yang mengalir antara elektroda kerja dan elektroda pembanding. Variabel yang dikontrol oleh potensiostat adalah potensial
dilihat pada gambar 2.6 yang terdiri dari lima komponen yaitu: sinyal generator, power amplifier, elektrometer, I/E converter dan perekam.
a. Signal Generator (Pembangkit Sinyal)
Pembangkit sinyal ini menghasilkan perbedaan potensial antara elektroda kerja dengan elektroda pembanding. Perbedaan potensial dibentuk dari potensial tunggal atau potensial yang dikontrol oleh komputer. Output digital ke analog (D/A) mengubah bilangan yang dihasilkan komputer kedalam potensial. Pemilihan yang tepat dari urutan bilangan memungkinkan computer menghasilkan potensial yang konstan, potensial yang linier dan gelombang sinusdatar (sinusoidal). Bilangan dari eksitasi potensial menghasilkan variasi yang berbeda dari voltammetri.
Gambar 2.6 Susunan dasar dari potensiostat Sumber : Andriani, 2007
b. Elektrometer
Rangkaian elektrometer mengukur beda potensial antara elektroda kerja dengan elektroda pembanding. Outputnya memiliki dua fungsi yaitu feedback signal pada rangkaian potensiostat dan sinyal diukur sewaktu-waktu potensial sel dibutuhkan. Elektrometer yang ideal memiliki arus input nol dan memiliki impedansi input yang tidak terbatas.
c. The I/E conventer (pengubah arus ke potensial)
Pengubah arus ke potensial merupakan rangkaian pengikut arus untuk mengukur arus sel dan menampilkan sebagai potensil. Potensial output, Eout diperoleh dari arus sel X resistor feedback.
d. The Power Amplifier (Daya Amplifier)
Daya amplifier atau pengontrol amplifier dari potensiostat berfungsi mengatur potensial pada elektroda kounter–elektroda kerja untuk mencapai selisih yang tepat pada elektroda pembanding-elektroda kerja. Pengontrol amplifier membandingkan potensial sel yang diukur dengan potensial yang diharapkan dan mengendalikan arus yang masuk kedalam sel untuk memaksa potensialnya menjadi sama. Potensial yang diukur adalah input yang masuk ke dalam input negatif dari pengontrol amplifier.
e. Perekam Data/ The Recorder
Merupakan peralatan sederhana untuk menampilkan dan merekam output potensiostat dalam bentuk chart recorder atau voltmeter digital (Siswoyo, et al., 2000).
2.6 SEM (Scanning Electron Microscopy)
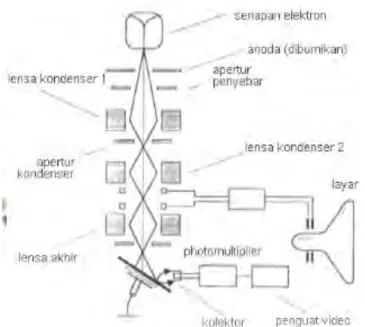
SEM terdiri dari sebuah senapan elektron yang memproduksi berkas elektron pada tegangan dipercepat sebesar 2 – 30 kV. Berkas elektron tersebut dilewatkan pada beberapa lensa elektromagnetik untuk menghasilkan image berukuran <~10nm pada sampel yang ditampilkan dalam bentuk film fotografi atau ke dalam tabung layar. Diagram skematik dan cara kerja SEM digambarkan sebagai berikut:
Gambar 2.7 Diagram skematik fungsi dasar dan cara kerja SEM (Sumber: Anggraini, 2008)
SEM sangat cocok digunakan dalam situasi yang membutuhkan pengamatan permukaan kasar dengan pembesaran berkisar antara 20 kali sampai 500.000 kali. Sebelum melalui lensa elektromagnetik terakhir scanning raster mendeflesikan berkas elektron untuk men-scan permukaan sampel. Hasil scan ini tersinkronisasi dengan tabung sinar katoda dan gambar sampel akan tampak pada area yang di-scan.
Tingkat kontras yang tampak pada tabung sinar katoda timbul karena hasil refleksi yang berbeda-beda dari sampel. Sewaktu berkas elektron menumbuk permukaan sampel sejumlah elektron direfleksikan sebagai backscattered electron (BSE) dan yang lain membebaskan energi rendah secondary electron (SE). Emisi radiasi elektromagnetik dari sampel timbul pada panjang gelombang yang bervariasi tapi pada dasarnya panjang gelombang yang lebih menarik untuk digunakan adalah daerah panjang gelombang cahaya tampak (cathodoluminescence) dan sinar-X.
Elektron-elektron BSE dan SE yang direfleksikan dan dipancarkan sampel dikumpulkan oleh sebuah scintillator yang memancarkan sebuah pulsa cahaya pada elektron yang datang. Cahaya yang dipancarkan kemudian diubah menjadi sinyal listrik dan diperbesar oleh photomultiplier. Setelah melalui proses pembesaran sinyal tersebut dikirim ke bagian grid tabung sinar katoda. Scintillator biasanya memiliki
potensial positif sebesar 5 – 10 kV untuk mempercepat energi rendah yang dipancarkan elektron agar cukup untuk mengemisikan cahaya tampak ketika menumbuk scintillator. Scintillator harus dilindungi agar tidak terkena defleksi berkas elektron utama yang memiliki potensial tinggi. Pelindung metal yang mengandung metal gauze terbuka yang menghadap sampel memungkinkan hampir seluruh elektron melalui permukaan scintillato (Anggraini, 2008).